Zusammenfassung
- Definition:Maligne Erkrankung des hämatopoetischen Systems, ausgehend von Lymphoblasten, mit einem Anteil von über 25 % im Knochenmark.
- Häufigkeit:Bei Kindern macht die akute lymphoblastische Leukämie (ALL) 85 % aller Leukämien aus und etwa 1/3 aller Malignomfälle. Die höchste Inzidenz tritt zwischen dem 2. und 5. Lebensjahr auf. Danach nimmt die Häufigkeit ab, steigt aber nach dem 50. Lebensjahr wieder an.
- Symptome:Erstes Auftreten in der Regel subakut mit Anämie, Granulozytopenie und Thrombozytopenie, Abgeschlagenheit und Müdigkeit, Infektions- und Blutungsneigung.
- Befunde:Anämie, Schleimhaut- und Hautblutungen, anhaltende Infektionen, Lymphknotenschwellung, vergrößerte Leber/Milz, druckschmerzhafte Knochen
- Diagnostik:Das Differenzialblutbild zeigt gleichartige Lymphoblasten im peripheren Blut sowie Zytopenie der anderen Zelllinien. Die Diagnosesicherung erfolgt in der Knochenmarksbiopsie.
- Therapie:85 % der Kinder und 50 % der Erwachsenen können mithilfe einer adäquaten Chemotherapie geheilt werden; auch eine Strahlenbehandlung kann indiziert sein. Im Rezidivfall ist zur kurativen Behandlung in der Regel eine Hochdosisbehandlung mit allogener Stammzelltransplantation notwendig.
Allgemeine Informationen
Definition1
- Die akute lymphoblastische Leukämie (ALL), auch akute lymphatische Leukämie, ist eine maligne Erkrankung des hämatopoetischen Systems, die von schnell wachsenden unreifen lymphatischen Zellen (Lymphoblasten) ausgeht.
- Abgrenzung vom lymphoblastischen Lymphom
- akute lymphoblastische Leukämie (ALL): > 25 % Lymphoblasten im Knochenmark
- lymphoblastisches Lymphom, auch Prolymphozyten-Leukämie: < 25 % Lymphoblasten im Knochenmark und fehlende leukämische Ausschwemmung
- Die reifzellige B-ALL wird der Gruppe der Burkitt-Leukämien/-Lymphome zugeordnet. Diese sind oft schnell progredient und brauchen eine besondere Behandlung.
Klassifikation
Nach WHO (2016)2
- B-lymphatische Leukämie/B-lymphatisches Lymphom
- B-lymphatische Leukämie/B-lymphatisches Lymphom, nicht näher bezeichnet
- B-lymphatische Leukämie/B-lymphatisches Lymphom mit wiederkehrenden genetischen Anomalien
- B-lymphoblastische Leukämie/Lymphom mit t(9;22)(q34.1;q11.2);BCR-ABL1
- B-lymphoblastische Leukämie/Lymphom mit t(v;11q23.3);KMT2A rearrangiert
- B-lymphoblastische Leukämie/Lymphom mit t(12;21)(p13.2;q22.1); ETV6-RUNX1
- B-lymphoblastische Leukämie/Lymphom mit Hyperdiploidie
- B-lymphoblastische Leukämie/Lymphom mit Hyperdiploidie
- B-lymphoblastische Leukämie/Lymphom mit t(5;14)(q31.1;q32.3) IL3-IGH
- B-lymphoblastische Leukämie/Lymphom mit t(1;19)(q23;p13.3);TCF3-PBX1
- Provisorische Entität: B-lymphoblastische Leukämie/Lymphom, BCR-ABL1–like
- Provisorische Entität: B-lymphoblastische Leukämie/Lymphom mit iAMP21
- T-lymphatische Leukämie/T-lymphatisches Lymphom
- Provisorische Entität: Early T-cell precursor lymphoblastische Leukämie
Häufigkeit
Gesamtinzidenz
- Jährliche Inzidenz Gesamtbevölkerung: 1,1/100.000
Im Kindesalter3
- Häufigste maligne Erkrankung im Kindesalter
- 85 % aller kindlichen Leukämien
- etwa 1/3 aller malignen Erkrankungen
- Bei Kindern unter 5 Jahren: 5,3/100.000, Häufigkeitsgipfel zwischen dem 2. und 5. Lebensjahr
- Bei Kindern unter 15 Jahren: 3,3/100.000
Im Erwachsenenalter
- Mit zunehmendem Alter weiterer Rückgang, ab 50 wieder Zunahme der Häufigkeit
- Bei über 80-Jährigen: 2,3/100.000
Geschlechterverteilung
- Männliches Geschlecht etwas häufiger betroffen (1,4:1,0)
Ätiologie und Pathogenese
Pathogenese
- Genetische Veränderungen tragen zur leukämischen Transformation von hämatopoetischen Stammzellen bei, mit der Folge einer Zellfunktionsänderung.
- Die malignen Zellen verlieren die Fähigkeit zur Reifung und Differenzierung.
- Die unkontrollierte Proliferation führt dazu, dass die normalen Zellen im Knochenmark verdrängt werden und sich eine Zytopenie in einer oder mehreren Zelllinien entwickelt.
Prädisponierende Faktoren
- Chromosomenschäden, entweder kongenital (z. B. Trisomie 21) oder erworben (z. B. myelotoxische Chemikalien, Radioaktivität), erhöhen das Risiko für Leukämien.
- Einige wenige Betroffene haben früher Zytostatika oder Strahlenbehandlung bekommen.
ICD-10
- C91 Lymphatische Leukämie
- C91.0 Akute lymphatische Leukämie [ALL]
- C91.7 Sonstige lymphatische Leukämie
- C91.8 Reifzellige B-ALL vom Burkitt-Typ
- C91.9 Lymphatische Leukämie, nicht näher bezeichnet
- C83.5 Lymphoblastisches Lymphom
- B-Zell-Vorläufer-Lymphom
- Lymphoblastisches B-Zell-Lymphom
- Lymphoblastisches Lymphom o.n.A.
- Lymphoblastisches T-Zell-Lymphom
- T-Zell-Vorläufer-Lymphom
Diagnostik
Diagnostische Kriterien
- Typisches Erkrankungsbild mit aplastischer Anämie, Blutungsneigung und Infektanfälligkeit
- Zytopenie oder Panzytopenie, Blasten im peripheren Blut und stark vermehrt im Knochenmark
Differenzialdiagnosen
- Mononukleose
- Akute myeloische Leukämie
- Chronische lymphatische Leukämie
- Hodgkin-Lymphom
- Non-Hodgkin-Lymphom
Anamnese
- Meist subakuter Beginn mit:
- Abgeschlagenheit und Müdigkeit – Anämie
- häufige Infektionen – Granulozytopenie
- Blutungstendenz in Haut und Schleimhäuten – Thrombozytopenie.
- Einige Patient*innen haben:
- Kopfschmerzen
- Übelkeit und Erbrechen (meningeale Affektion)
- unscharfes Sehen
- Doppelbilder
- Ekzeme
- leukämische Meningitis
- Knochen- und Gelenkschmerzen
- Hodenschwellung
- Hautinfiltrate.
Klinische Untersuchung
- Oft reduzierter Allgemeinzustand
- Blässe, sonstige Anämiezeichen
- Hautblutungen: Petechien, Ekchymosen, Hämatome
- Langwierige Infektionen
- Lymphknotenschwellungen, lokalisierter oder fortgeschrittener Tumor
- Moderate Hepatosplenomegalie
- Schmerzempfindlichkeit bei der Palpation von Knochen, insbesondere Sternum und Tibia
Ergänzende Untersuchungen in der Hausarztpraxis
- Differenzialblutbild
- typischer Befund: Lymphoblasten im peripheren Blut und Zytopenie in den sonstigen Zelllinien
- Dominanz von gleichartigen unreifen Lymphoblasten
- selten aleukämische Form der ALL: Leukopenie
- Harnsäure erhöht
Diagnostik bei Spezialist*innen
- Röntgen-Thorax in zwei Ebenen
- Mediastinaler Tumor?
- Sonografie – Zielregionen
- Abdomen
- Mediastinum
- Lymphknoten
- Hoden
- Fragestellung
- Organomegalie?
- Niereninfiltrate?
- Darminfiltrate?
- Thymusbefall?
- Pleurabefall?
- Perikarderguss?
Untersuchungen im Krankenhaus
- Knochenmarkaspirat und Knochenmarkbiopsie
- Evtl. Lymphknotenbiopsie
- CT, ggf. MRT oder PET von Thorax/Abdomen/Becken
- Liquordiagnostik
Indikationen zur Überweisung
- Bei Verdacht auf ALL unverzügliche diagnostische Abklärung und Therapie an einem hämatoonkologischen Zentrum
- Ein schneller Behandlungsstart innerhalb von 1–2 Tagen kann von entscheidender Bedeutung für die Prognose sein, insbesondere bei hoher Malignomlast.
Therapie
Therapieziele
- Ggf. vor Therapiebeginn
- Erhalt der Reproduktionsfähigkeit durch Kryokonservierung von Keimzellen
- Induktionstherapie
- komplette Remission durch Eradikation der Leukämiezellen mit Normalisierung von Blutbild und Knochenmark
- Rückgang der klinischen Symptome
- Konsolidierungs- und Erhaltungstherapie
- Remission erhalten.
- ZNS-Befall verhindern.
- Palliation
- Symptome lindern.
- Lebensqualität verbessern.
Allgemeines zur Therapie
- Individuelle Behandlung nach:
- Phänotyp
- Genotyp
- Progressionsrisiko
- Lebensalter
- Induktionsphase mit Hochdosis-Zytostatika
- Anschließend zytostatische Konsolidierungsbehandlung zum Erhalt der Remission (Postremissionstherapie)
- Evtl. Strahlentherapie
- Evtl. allogene Stammzelltransplantation
- Bei Rezidiv ggf. neuere immuntherapeutische Ansätze
Risikobewertung
- Die Bewertung des individuellen Risikos der erkrankten Person ist von entscheidender Bedeutung für die Wahl der Therapie.
- Zum Diagnosezeitpunkt werden Erwachsene in zwei Risikogruppen (Rückfallrisiko) eingeteilt:
- Standardrisikogruppe
- Hochrisikogruppe.
- Kinder werden meistens in die Gruppen Standardrisiko, hohes Risiko und sehr hohes Risiko eingeteilt.
- Grundlagen der Risikobewertung sind u. a.:
- Alter
- klinische Behandlung
- Befunde, z. B. Knochenmarkuntersuchungen.
Hochspezialisierte Behandlung
- Die intensive zytostatische Behandlung einer akuten Leukämie ist sehr belastend, hat erhebliche Nebenwirkungen und kann schwere Komplikationen mit sich bringen. Die Behandlung ist von erfahrenen Hämatolog*innen in einer Spezialabteilung einzusetzen und zu leiten.
- Wenn bei einem jüngeren Erwachsenen das Rezidiv einer akuten Leukämie eintritt, ist eine Hochdosis-Chemotherapie in Kombination mit einer allogenen hämatopoetischen Stammzelltransplantation in der Regel die einzige Behandlung mit kurativer Perspektive.
- Bei bestimmten Untergruppen der ALL und eindeutig erhöhtem Rezidivrisiko kann die Stammzelltransplantation auch in der ersten Remission indiziert sein.
- Tumorlyse-Syndrom
- massenhafter Tumorzell-Zerfall mit Freisetzung toxischer Konzentrationen von Harnsäure und Kalium
- Gefahr des Nierenversagens
- beim Burkitt-Lymphom/-Leukämie besonders hohes Risiko
- vorbeugend reichliche Flüssigkeitszufuhr (ca. 3.000 ml/m2/d)
- vor der Induktionstherapie: Vorphase-Therapie mit Dexamethason/Cyclophosphamid
- ggf. Allopurinol oder Rasburicase
Medikamentöse Therapie
- 85 % der Kinder und 50 % der Erwachsenen können mithilfe einer adäquaten Chemotherapie geheilt werden.
- Die zytostatische Induktionsbehandlung ist weniger myelosuppressiv als bei myeloischer Leukämie und führt nicht immer zu Knochenmarkaplasie.
- Während der Induktionsbehandlung: ZNS-Prophylaxe durchführen.
- Methotrexat intrathekal
- ggf. Kombination mit Cytarabin und einem Kortikosteroid
- ggf. Schädelbestrahlung
Rezidivierende und Refraktäre Erkrankung
- Ggf. weitere Induktionstherapie
- Immuntherapie
- Mit dem Anti-CD20-Antikörper Rituximab konnten die Behandlungsergebnisse beim Burkitt-Lymphom/-Leukämie und der B-Zell-Vorläufer ALL deutlich verbessert werden.4
- Der Anti-CD19-Antikörper Blinatumomab und das CD22-Antikörper-Wirkstoff-Konjugat Inotuzumab konnten bei Frührezidiven und refraktären Rezidiven der B-Vorläufer-ALL bessere Ergebnisse erzielt werden als mit der Standardchemotherapie.5-6
- Chimeric-Antigen-Receptor-T-Zellen (CAR-T): Herstellung ex vivo aus T-Zellen der an ALL erkrankten Person. Die Zellen werden mit einem einem Antigen-Rezeptor gegen Oberflächenmarker von Leukämiezellen sowie verschiedenen Signaltransduktions-Elementen versehen. Mit Tisagenlecleucel wurde 2018 das erste CAR-T-Therapeutikum zugelassen.7
Palliativbehandlung
- Schmerzen
- Übelkeit und Erbrechen
- Verstopfung
- Maligne Obstruktion
- Mundtrockenheit
- Mangelernährung und Dehydrierung
- Atembeschwerden
- Depression
- Angst
- Delir
Prävention
- ZNS-Prophylaxe unter der Induktionstherapie
- Prophylaxe des Tumorlyse-Syndroms
Verlauf, Komplikationen und Prognose
Verlauf
- Oft subakutes oder akutes Erstauftreten
- Oft stürmischer, zuweilen aber auch schleppender Verlauf
- Die meisten Betroffenen erreichen eine primäre Remission.
- Bei Rezidiven ist eine Heilung nur durch eine Knochenmarktransplantation zu erreichen.
Komplikationen
- Lebensbedrohliche Infektionen oder Blutungen
- Psychosoziale Nachwirkungen
- Der Erkrankungs- und Behandlungsprozess kann Schmerzen und Unwohlsein mit sich bringen, außerdem psychische Belastungen, die wiederum Angst, Depressivität, Trauer und Wut erzeugen können.
- Körperliche Veränderungen wie Gewichtsverlust oder -zunahme, Mondgesicht und Haarausfall führen zuweilen zu einem herabgesetzten Selbstwertgefühl und zu sozialer Isolation.
- Besondere Risikofaktoren mit negativen Spätfolgen (z. B. Lernschwierigkeiten in der Schule) sind eine Strahlenbehandlung und eine Behandlungszeit länger als 3 Jahre.
- Eine intrathekale Chemotherapie kann u. U. leichte kognitive Defizite nach sich ziehen.
Prognose
- Primäre Remission
- bei 90 % aller Erwachsenen und 95 % aller Kinder
- Postremissionstherapie
- Ist kurativ bei 30–50 % aller Erwachsenen und bei 60–80 % aller Kinder.
- Sekundäre Malignome
- Die Personen, die in ihrer Kindheit eine akute lymphatische Leukämie überlebten, haben – verglichen mit der Gesamtbevölkerung – ein etwa 14-mal so hohes Risiko für die Entwicklung einer sekundären Malignomerkrankung.
Prognostische Faktoren
- Sensitivität gegenüber Chemotherapie
- Variiert mit den genetischen Subtypen der ALL.
- Alter
- prognostisch hoch relevant
- Die Philadelphia-Chromosom-positive-ALL zeigt z. B. eine günstige Prognose bei Kindern von 1–9 Jahren, eine schlechtere Prognose bei Jugendlichen und eine sehr schlechte Prognose bei Erwachsenen.
- Über 60-Jährige haben meist eine schlechte Prognose; bei ihnen treten mehr behandlungsbedingte Komplikationen und Todesfälle auf.
Verlaufskontrolle
- Zu Beginn der ersten 3 Erhaltungszyklen (im 1. Jahr ungefähr alle 3 Monate) wird eine konventionelle Remissionsbewertung anhand des Blutausstrichs und Knochenmarkaspirats durchgeführt.
- Monatliche Kontrollen im 1. Jahr mit routinemäßigen hämatologischen Blutproben
- In den 2 nachfolgenden Jahren eine Kontrolle alle 3 Monate
Remissionskriterien
- Komplette Remission bei:
- Hb > 10 g/dl (> 6,2 mmol/l), Granulozyten > 1,5 x 109/l und Thrombozyten > 100 x 109/l
- keine Blasten im peripheren Blut, im Liquor oder in früher betroffenen extramedullären Lokalisationen
- im Knochenmark: normale trilineare Hämatopoese und Blasten < 5 %.
Rezidivkriterien
- > 5 % Blasten im Knochenmark
- Evtl. Blasten im Liquor oder in anderen extramedullären Lokalisationen
Nach Abschluss der Krankenhausbehandlung
- Nach allogener Stammzelltransplantation
- Rezidiverkennung
- Erkennung einer chronischen Transplantat-gegen-Wirt-Reaktion (Graft-versus-Host-Disease)
- Diagnostik von Spätschäden
- Impfungen sind indiziert nach individueller Absprache mit der behandelnden Abteilung.
- Nach einer allogenen Stammzelltransplantation und hochdosierter Behandlung mit autologem Stammzellsupport (HMAS) kann eine vollständige Revakzination indiziert sein.
- Pneumokokken-Impfung nach 1 Jahr, danach alle 5 Jahre Antikörpertiter-Kontrolle und ggf. Auffrischung
- Vermeiden Sie Lebendvakzine und perorale Vakzine in den ersten 2 Jahren nach HMAS.
- Fatigue, chronische Müdigkeit
- subjektives Gefühl von Ermüdbarkeit und eingeschränkter Funktionskapazität; selbst nach Ruhe und Schlaf keine Besserung
- besonders häufig nach Strahlentherapie oder Zytostatikabehandlung
- Wird von vielen Betroffenen als die größte von allen behandlungsbedingten Belastungen erlebt.
- Behandlung
- Aufklärung über den Hintergrund der Beschwerden
- leichtes, individuelles Trainingsprogramm
- Spätfolgendiagnostik
- kardiologisch (Anthrazyklinkardiomyopathie)
- endokrinologisch (nach Alkylanzien und Strahlentherapie)
- hepatisch (nach Cytarabin oder Hepatitis)
- zerebral (nach Schädelbestrahlung)
Patienteninformationen
Patienteninformationen in Deximed
Lindernde Behandlung bei fortgeschrittener Krebserkrankung
- Was ist Palliativmedizin?
- Angstbehandlung in der Palliativmedizin
- Übelkeit und Erbrechen, Palliativmedizin
- Verstopfung, Palliativmedizin
- Mundbeschwerden in der Palliativmedizin
- Gewichtsverlust bei Krebs
- Depression in der Palliativmedizin
- Delir in der Palliativmedizin
Illustrationen
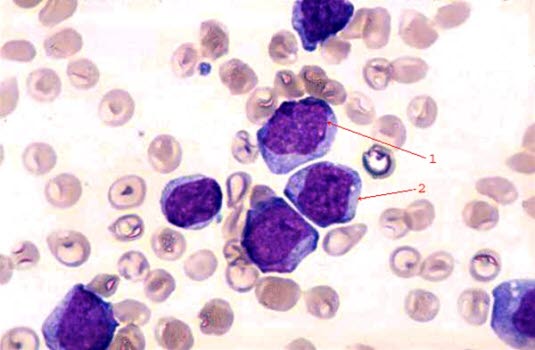
Leukämische Blasten: 1 großer Zellkern; 2 Zytoplasma
Quellen
Literatur
- Cortelazzo S, Ponzoni M, Ferreri AJM, Hoelzer D. Lymphoblastic lymphoma. Crit Rev Oncol Hematol 2011; 79: 330-43. PubMed
- Arber DA, Orazi A, Hasserjian R et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127:2391-2405. PMID: 27069254 PubMed
- Kaatsch P, Spix C, German Childhood Cancer Registry - Annual Report 2015 (1980-2014). Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz, 2015. www.kinderkrebsregister.de
- Maury S, Chevret 1, Thomas X et al. Rituximab in B-Lineage Adult Acute Lymphoblastic Leukemia. N Engl J Med 2016 Sep 15; 375(11): 1044-53. pmid:27626518 PubMed
- Kantarjian HM, DeAngelo DJ, Stelljes M, et al. Inotuzumab Ozogamicin versus Standard Therapy for Acute Lymphoblastic Leukemia. N Engl J Med 2016; 375: 740-53. PMID: 27292104 PubMed
- Kantarjian HM, Stein AS, Bargou RC, et al. Blinatumomab treatment of older adults with relapsed/refractory B-precursor acute lymphoblastic leukemia: Results from 2 phase 2 studies. Cancer 2016; 122:2178-85. PMID: 27143254 PubMed
- European Medicines Agency. Kymriah. Human medicine European public assessment report (EPAR). last updated 29.10.2021 www.ema.europa.eu
Autor*innen
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg