Zusammenfassung
- Definition:Die periphere arterielle Verschlusskrankheit (PAVK) bezeichnet eine Einschränkung der Durchblutung der die Extremitäten versorgenden Arterien. Dies kann graduell (durch eine Stenose) oder komplett (Okklusion) sein.
- Häufigkeit:Prävalenz 3–10 %, 15–20 % bei über 70-Jährigen. Unterdiagnostiziert, Verhältnis von asymptomatischen zu symptomatischen Patienten ca. 4:1.
- Symptome:Typisch sind Schmerzen bei Belastung mit eingeschränkter Gehstrecke und Besserung in Ruhe (Claudicatio intermittens). Je nach Lokalisation der Gefäßläsion können die Beschwerden in Gesäß, Oberschenkel, Wade oder Fuß auftreten.
- Befunde:Abgeschwächte periphere Pulse, Stenosegeräusch in der Leiste, trophische Störungen der Haut; positiver Ratschow-Test.
- Diagnostik:Sicherung der Diagnose durch Bestimmung eines Knöchel-Arm-Index (ABI) < 0,9. Ergänzend Farbduplexsonografie zur Lokalisationsdiagnostik.
- Therapie:Behandlung der Risikofaktoren und Thrombozytenaggregationshemmung. Gehtraining zur Besserung der schmerzfreien und maximalen Gehstrecke. Bei hohem Leidensdruck oder kritischer Extremitätenischämie Revaskularisation durch Katheterintervention oder OP.
Allgemeine Informationen
Definition
- Die periphere arterielle Verschlusskrankheit (PAVK) bezeichnet eine Einschränkung der Durchblutung der die Extremitäten versorgenden Arterien bzw. seltener der Aorta.
- Dies kann graduell (durch eine Stenose) oder komplett (Okklusion) sein.
Problemstellung für den hausärztlichen Bereich
- Relativ hohe Prävalenz der PAVK in der Grundversorgung1
- Häufigkeit und Bedeutung der PAVK werden z. T. von Ärzten und Patienten unterschätzt.2
- Unterschätzung der Prävalenz, da nur ca. jeder 4. Patient typische Beschwerden aufweist.
- Teilweise Vorliegen einer „maskierten" PAVK, da die Gehstrecke bereits wegen Komorbiditäten wie Arthrose, Herzinsuffizienz oder Lungenerkrankung eingeschränkt ist.
- Patienten mit PAVK sind hinsichtlich der Risikofaktoren und Begleiterkrankungen unterbehandelt.
- Auch asymptomatische Patienten weisen eine erhöhte kardiovaskuläre Mortalität auf und profitieren von Präventionsmaßnahmen.3
Stadieneinteilung
- Für eine einfache klinische Einteilung können drei Gruppen unterschieden werden:
- asymptomatische PAVK
- Claudicatio intermittens
- kritische Extremitätenischämie
- Für eine differenziertere klinische Einteilung wird überwiegend die Stadieneinteilung nach Fontaine verwendet, im angelsächsischen Raum und international wissenschaftlich ist die Einteilung nach Rutherford gebräuchlicher.
Stadieneinteilung nach Fontaine
- Grad I: asymptomatisch
- Grad II: Claudicatio intermittens
- a) schmerzfreie Gehstrecke > 200 m
- b) schmerzfreie Gehstrecke < 200 m
- Grad III: Ruheschmerzen
- Grad IV: Ulzerationen/Gangrän
Häufigkeit
- Gesamtprävalenz der PAVK 3–10 % (basierend auf der Bestimmung des ABI)4-5
- Die prognostische Bedeutung einer nur auf ABI basierenden Diagnose ist aber nicht ganz klar.
- Ansteigende Prävalenz mit dem Alter
- Das Verhältnis Frauen zu Männern ist altersabhängig.
- In jüngeren Altersgruppen sind Männer häufiger betroffen.
- in älteren Altersgruppen etwa gleichverteilt
- Verhältnis von asymptomatischen zu symptomatischen Patienten altersunabhängig ca. 4:16
- Ca. 3 % der Hospitalisierungen wegen PAVK7
Ätiologie und Pathogenese
Ätiologie
- Atherosklerose bei > 95 % der Patienten Auslöser einer PAVK
- Seltenere Ursachen stenosierender/okklusiver Läsionen
- Vaskulitis
- kongenitale oder erworbene Gefäßmissbildungen
- fibromuskuläre Dysplasie
- periphere Embolie
- zystische Adventitiadegeneration
- Kompressionssyndrome
- Gefäßtumor
- Pseudoxanthoma elasticum
- Trauma oder Strahlenschäden
Pathogenese
- Zunächst Ausbildung atherosklerotischer Veränderungen mit noch ausreichender Perfusion in Ruhe und unter Belastung
- Mit zunehmender Stenosierung Entwicklung einer Belastungsischämie
- Klinisch manifestiert sich die Belastungsischämie als Claudicatio intermittens („Schaufensterkrankheit, unterbrochenes Hinken")
- Der Claudicatio-Schmerz ist ein somatischer Tiefenschmerz mit folgenden Hypothesen zur Pathogenese:
- Versorgungsstörung (Mangel an Sauerstoff und Substrat)
- Entsorgungsstörung (mangelnde Ausspülung algetischer Stoffwechselprodukte)
- Muskelmechanische Schmerzgenese (verlängerte Relaxationsphase)
- Druckerhöhung in der Faszienloge
- Walking-through-Phänomen: ca. 1–2 Minuten nach Belastungsbeginn verbesserte Ausspülung von Schmerzmediatoren durch Rekrutierung in Ruhe nicht perfundierter Kapillaren
- Bei Progredienz der PAVK Überforderung der Kompensationsmechnismen und Entstehung einer chronisch-kritischen Extremitätenischämie mit Ruheschmerz und schließlich Nekrose/Gangrän
- Neben der Atherosklerose tragen thrombotische Verschlüsse der Peripherie zur Entstehung der kritischen Extremitätenischämie bei.8
Prädisponierende Faktoren
- Die wichtigsten prädisponierenden Faktoren sind die klassischen Risikofaktoren für die Entstehung einer Atherosklerose (Rauchen, Diabetes mellitus, Hyperlipidämie und arterielle Hypertonie)
- Jeder dieser Faktoren ist signifikant und unabhängig von den anderen mit einem erhöhten PAVK-Risiko verbunden.9
- Rauchen
- Rauchen ist der wichtigste Risikofaktor der PAVK.
- verantwortlich für die Hälfte der Fälle einer klinisch manifesten PAVK
- Das Risiko steigt mit der Intensität des Konsums.3
- relatives Risiko 5,6 (Konsum ≥ 35 Jahre) für das Auftreten einer hospitalisationsbedürftigen PAVK
- Diabetes mellitus
- nach dem Rauchen zweitwichtigster Risikofaktor
- relatives Risiko um den Faktor 2–4 erhöht
- HbA1c-Anstieg um 1 % erhöht das Risiko um ca. 28 %.
- Leider konnte für eine medikamentöse HbA1c-Senkung keine entsprechende Risikoreduktion nachgewiesen werden.
- verminderte Gehleistung und Mobilität sowie 5-fach erhöhtes Amputationsrisiko bei PAVK-Patienten mit Diabetes mellitus im Vergleich zu Patienten ohne Diabetes mellitus3
- Hyperlipidämie
- Gesamt-Cholesterin und LDL-Cholesterin sind unabhängige Risikofaktoren für eine PAVK.
- Weitere Risikofaktoren sind:
- erniedrigtes HDL
- Triglyzeride
- Lipoprotein A.
- Arterielle Hypertonie
- relatives Risiko um den Faktor 2 erhöht
- Ein Anstieg des systolischen Blutdrucks um 20 mmHg ist mit einem Anstieg des Risikos um 63 % verbunden.3
- Sonstige prädisponierende Faktoren
- Alter
- chronische Nierenkrankheit mit Niereninsuffizienz
- chronisch erhöhte Entzündungsparameter
- positive Familienanamnese für PAVK
- bekannte kardiovaskuläre Erkrankung
ICD-10
- I70 Arteriosklerose
- I70.2 Arteriosklerose einer Arterie in einer Extremität
Diagnostik
Diagnostische Kriterien
- Verdachtsdiagnose auf der Basis von Anamnese und klinischer Untersuchung10
- Bestätigung durch Bestimmung des Knöchel-Arm-Index (ABI)
- Die nichtinvasive Messung des Dopplerverschlussdrucks ist ein geeigneter Test zum Nachweis der PAVK (Empfehlungsgrad A, Evidenzklasse 1).
- ABI-Wert von < 0,9 gilt als beweisend für das Vorliegen einer relevanten PAVK (Empfehlungsgrad A, Evidenzklasse 1).
Differenzialdiagnosen
- Nicht-vaskuläre Ursachen
- Claudicatio spinalis bei degenerativen Veränderungen wie Spinalkanalstenose
- Coxarthrose oder Gonarthrose
- diabetische Neuropathie oder andere periphere Neuropathie
- Meralgia paraesthetica (Kompression N. cutaneus femoris lateralis)
- Kompression des N. peronaeus
- Tendinitis, Bursitis
- hämatologische Erkrankungen (Thrombozytose, Kryoglobulinämie, Kälteagglutinine)
Anamnese
Symptome
- Claudicatio-Schmerz
- typische Charakteristik
- Muskelschmerz
- belastungsabhängig
- in Ruhe Besserung nach wenigen Minuten
- Beeinträchtigung des Gehvermögens mit verminderter schmerzfreier und maximaler Gehstrecke
- Lokalisation (abhängig von der Gefäßläsion)
- Glutäalregion
- Oberschenkel
- Wade
- Fuß
- typische Charakteristik
- Ruheschmerzen
- Lokalisation (häufig beginnend im Vorfuß)
- evtl. Besserung bei herabhängenden Beinen
- Hautläsionen/Wunden
- schlecht oder nicht heilend
Risikofaktoren
- Rauchen
- Diabetes mellitus
- Hyperlipidämie
- Arterielle Hypertonie
- Übergewicht/Bewegungsmangel
Komorbiditäten (oder V. a. Komorbidität bei entsprechender Symptomatik)
Familienanamnese
- Für PAVK und/oder sonstige kardiovaskuläre Erkrankung
Medikamente
- Thrombozytenaggregationshemmer
- Antihypertensiva
- Antidiabetika
- Statine
Klinische Untersuchung
- Die klinische Untersuchung gehört zur Basisdiagnostik, ermöglicht allein ohne ABI-Bestimmung aber häufig noch keine sichere Diagnose.11
- Alleiniges Tasten der Pulse zur Diagnose der PAVK ist unzureichend (Sensitivität 20 %).
- Andererseits wird bei nicht tastbaren Fußpulsen die Diagnose PAVK zu häufig gestellt (geringe Spezifität).
Inspektion (seitenvergleichend)
- Haut
- Farbe
- Integrität der Haut
- Ulzerationen (häufig im Bereich des Außenknöchels)
- Behaarung (Haarverlust)
- Schweißbildung
- trophische Störungen der Nägel
- Muskulatur
- Atrophie
Palpation (seitenvergleichend)
- Pulse
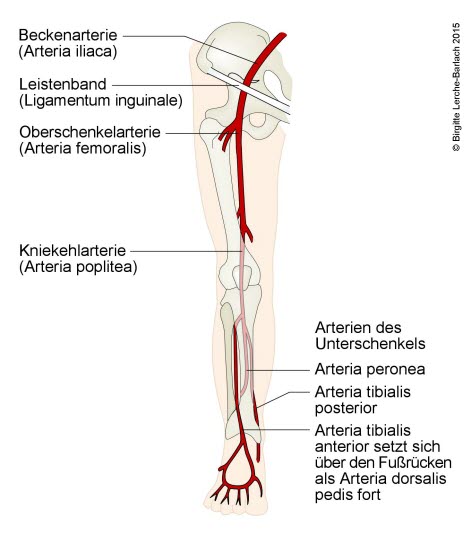
- A. femoralis, A. poplieta, A. tibialis posterior, A. dorsalis pedis
- Temperatur der Beine und Füße
Auskultation
- Bauchaorta
- A. femoralis
Ratschow-Test
- Durchführung und Interpretation
- Patient/in liegt auf dem Rücken mit angehobenen Beinen, Beuge- und Streckbewegungen der Füße über mehrere Minuten.
- Verdacht auf Perfusionsstörung bei:
- raschem Abblassen der Fußsohlenhaut unter Belastung
- verzögerter Wiederauffüllung im Sitzen.
- Wenig Evidenz, die klinische Erfahrung zeigt aber die Nützlichkeit der Untersuchung.
 siehe Tabelle: Abgrenzung der PAVK von der Neuropathie (klinische Untersuchung)
siehe Tabelle: Abgrenzung der PAVK von der Neuropathie (klinische Untersuchung)
Ergänzende Untersuchungen in der Hausarztpraxis
Bestimmung des Knöchel-Arm-Index (ABI)
- In der Hausarztpraxis kann eine Basisdiagnostik mit gezielter Anamnese, klinischer Untersuchung und ABI-Messung durchgeführt werden.
- Die Bestimmung des ABI kann durch Ärztin/Arzt oder Assistenzpersonal erfolgen.
- Ein Vergleich zwischen Hausärzten, Angiologen und Assistenzpersonal zeigte keinen Unterschied.
- Durchführung
- 10 min in ruhender Position (zuvor keine große körperliche Anstrengung)
- Messungen der systolischen Blutdruckwerte an beiden Armen
- Mittelwert der Messungen an beiden Armen wird verwendet (bei Differenz ≥ 10 mmHg wird der höhere Druck verwendet).
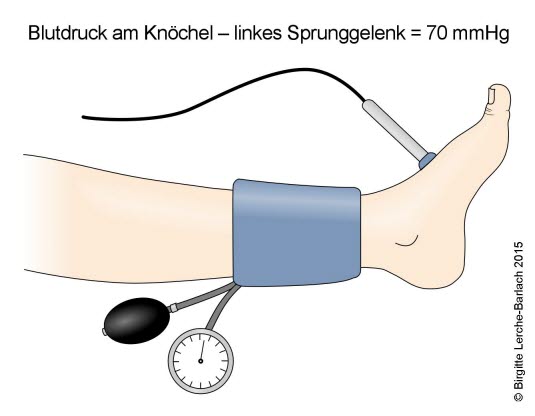
- Anbringen und Aufblasen der Blutdruckmanschette (10–12 cm breit) über dem Knöchel
- Messung der systolischen Blutdruckwerte an A. tibialis posterior und A. tibilais anterior mit Doppler-Sonde (8–10 MHz)
- Berechnung des ABI für jedes Bein: niedrigster Knöchelarteriendruck geteilt durch mittleren Armarteriendruck
- Sensitivität > 90 %, Spezifität fast 100 %
- Bei normalem ABI, aber klinischen Hinweisen auf PAVK kann die Sensitivität durch Messung 1 min nach repetitivem Zehenstand erhöht werden (Abfall des Knöchelarteriendrucks um > 30 mmHg oder eine Reduktion des ABI um 20 % gilt dann als beweisend für PAVK).
- Bei V. a. Mediasklerose (ABI > 1,3 – insbesondere bei Diabetes mellitus) kann alternativ eine Großzehendruckmessung mit Bestimmung des TBI (Toe-Ankle-Index) durchgeführt werden (TBI < 0,7 pathologisch).
 siehe Tabelle: ABI-Kategorien zur Abschätzung des PAVK-Schweregrades
siehe Tabelle: ABI-Kategorien zur Abschätzung des PAVK-Schweregrades
Gehtest/Laufbandergometrie
- Objektivierung einer Claudicatio
- Quantifizierung der Gehstrecke bis zum Beschwerdebeginn
Labor
- Blut
- Urin
- Teststreifen, ggf. Morgenurin oder Spontanurin auf Proteinurie/Albuminurie
Diagnostik beim Spezialisten
Farbduplex-Sonografie
- Methode der 1. Wahl in der Gefäßdiagnostik der Becken- und Beinarterien
- Eine Diagnostik mittels CT oder MRT soll nicht primär durchgeführt werden (Choosing Wisely).
- Beurteilung von Morphologie und Hämodynamik, Quantifizierung des Stenosegrades
- Bei Männern > 65 Jahre sollte gleichzeitig ein Screening auf Bauchaortenaneurysma erfolgen.
- Untersucherabhängig
- Bei nicht eindeutigen Befunden können zusätzliche bildgebende Methoden (MRA, CTA, DSA) eingesetzt werden.
CT-Angiografie (CTA)
- Sensitivität 95 %, Spezifität 96 %12
- Vorteile: hohe Bildauflösung, kurze Untersuchungszeit
- Nachteile: nephrotoxische Kontrastmittel, Strahlenexposition
MR-Angiografie (MRA)
- Sensitivität und Spezifität 95 % in der Diagnostik klinisch relevanter Stenosen13
- Vorteile: keine Strahlenexposition, keine nephrotoxischen Kontrastmittel
- Nachteile: Überschätzung des Stenosegrades bei Verkalkungen, Kontraindikationen für MRT (Metallimplantate, z. T. Herzschrittmacher)
Digitale Subtraktionsangiografie (DSA)
- Goldstandard in der Gefäßdarstellung
- Für die reine Diagnostik aber heutzutage meist nicht notwendig, gleichzeitige Durchführung von Interventionen
Pneumatische segmentale Oszillografie
- Unabhängig von Mediasklerose
- Zur Etagenlokalisation
Transkutane Sauerstoffdruckmessung
- Abschätzung des Amputationsrisikos bei kritischer Ischämie
Screening
- International unterschiedliche Empfehlungen zum Screening auf PAVK, auch aufgrund unsicherer Datenlage
- Ein generelles Screening asymptomatischer Patienten wird derzeit nicht empfohlen.
- Bei Patienten im Disease-Management-Programm Diabetes mellitus ist eine mindestens jährliche Kontrolle des Fußstatus u. a. mit Palpation der Fußpulse vorgesehen, im Zweifelsfall Bestimmung des Knöchel-Arm-Indexes (ABI).
Indikationen zur Überweisung/Klinikeinweisung
- Symptomatische PAVK zur Lokalisationsdiagnostik und evtl. – nur bei hohem individuellem Leidensdruck und geeigneter Gefäßmorphologie – Planung einer operativen/interventionellen Therapie
- Kritische Extremitätenischämie zur raschen Abklärung und Behandlung durch Katheterintervention/OP
Checkliste zur Überweisung
PAVK, Claudicatio intermittens
- Zweck der Überweisung
- Diagnostik? Therapie? Sonstiges?
- Anamnese
- Symptome
- Claudicatio intermittens (Gehstrecke?), Ruheschmerzen
- Risikofaktoren
- Vorerkrankungen
- Medikation
- Symptome
- Klinische Untersuchung
- Hautzustand, Wunden
- Pulse: Palpation und Auskultation
- Ratschow-Test, Bestimmung des Knöchel-Arm-Index
- Ergänzende Untersuchungen
Therapie
Therapieziele
- Hemmung der Progression der PAVK
- Risikoreduktion peripherer vaskulärer Ereignisse
- Reduktion kardiovaskulärer und zerebrovaskulärer Ereignisse
- Reduktion von Schmerzen
- Verbesserung von Belastbarkeit, Gehleistung und Lebensqualität
Allgemeines zur Therapie
- Schwerpunkte der Behandlung abhängig vom klinischen Stadium
- Stadium I nach Fontaine:
- Risikoreduktion kardiovaskulärer Ereignisse
- Stadium II nach Fontaine:
- Besserung der schmerzfreien und maximalen Gehstrecke
- Erhalt der Mobilität und damit verbesserte Lebensqualität
- Stadium III und IV nach Fontaine: Gliedmaßenerhalt
- Stadium I nach Fontaine:
- Bestandteile der Therapie sind:
- Behandlung der Risikofaktoren
- strukturiertes Gehtraining
- Thrombozytenaggregationshemmung
- vasoaktive Substanzen
- interventionelle/operative Revaskularisation
- Wundbehandlung
- Eine Basisbehandlung besteht aus Management der Risikofaktoren, Gehtraining und Thrombozytenaggregationshemmung.
- Revaskularisation ist eine symptomatische Therapie ohne Einfluss auf die progrediente Atherosklerose; eine Indikation sollte daher vor dem Hintergrund von Nutzen-Risiko, Leidensdruck und Behandlungswunsch der Patienten erfolgen.
Behandlung der Risikofaktoren
- Weitere Informationen zu präventiven Maßnahmen siehe auch Primärprävention von Herz- und Gefäßerkrankungen
Ernährung/körperliche Aktivität
- Die Ernährung sollte abwechslungsreich sein und sich an den Empfehlungen der mediterranen Kost orientieren.
- Bei Übergewicht gehört eine Gewichtsabnahme zur Basisbehandlung.
- Körperliche Aktivität wird bei PAVK empfohlen.3 Es ist möglich, Gehtraining auf Muster 56 zulasten der gesetzlichen Krankenversicherung zu verordnen.
Rauchen
- Rauchen ist der wichtigste Risikofaktor und eine Nikotinkarenz beeinflusst nachweislich die Progredienz der PAVK.
- Basis einer Raucherentwöhnung ist die entsprechende ärztliche Betreuung.14
Diabetes mellitus
- Zielkorridor für HbA1c 7,0–8,0 % zur Prävention von Folgekomplikationen
- Bei älteren Patienten sollte das HbA1c, um Symptomfreiheit zu erzielen, nicht über 8,5 % ansteigen.
- Als orales Antidiabetikum der 1. Wahl gilt Metformin.
- Zu Details der Behandlung siehe auch die Artikel Typ-2-Diabetes und Typ-1-Diabetes
Hyperlipidämie
- Günstige Wirkung von Statinen hinsichtlich Sekundärprävention kardiovaskulärer Ereignisse und Gehstrecke bei Patienten mit PAVK15-17
- Inwieweit die LDL-Werte bei PAVK-Patienten gesenkt werden müssen, ist mangels entsprechender prospektiv-randomisierter Studien noch offen.
- Die „Fixdosistherapie" soll in einer Standarddosierung erfolgen (insbesondere Simvastatin oder Pravastatin 20–40 mg/d).
- Vor allem die zuverlässige Einnahme von Statinen sollte sichergestellt sein aufgrund des beträchtlichen Adhärenz-Problems in der täglichen Praxis.
- Zur Therapie siehe auch den Artikel Hyperlipidämie
Arterielle Hypertonie
- Blutdruckbehandlung senkt die Mortalitäts- und Amputationsrate.
- Für die initiale Behandlung werden vor allem ACE-Hemmer und Ca-Antagonisten empfohlen.18-19
- Betablocker verschlechtern eine Claudicatio-Symptomatik nicht und können bei bestehender Indikation (Herzinsuffizienz, KHK, Vorhofflimmern) weiter verabreicht werden.18
- Darüberhinaus verringern Betablocker die Mortalität bei gefäßchirurgischen Eingriffen.
- Zur Therapie siehe auch den Artikel Arterielle Hypertonie.
Strukturiertes Gehtraining
- Entscheidender Bestandteil der konservativen Therapie zusätzlich zur Behandlung der Risikofaktoren20
- Bei PAVK-Stadium II nach Fontaine soll, wenn immer möglich, ein strukturiertes Gehtraining durchgeführt werden.
- Bei Beckengefäßläsionen, Femoralisgabelläsion und Stenosen oder Verschlüssen der A. profunda femoris sollte das Gehtraining allerdings erst nach Rekanalisation erfolgen, da es sonst nicht wirksam ist.
- Kriterien eines strukturierten Gehtrainings21-22
- Leitung durch einen professionellen Gefäßsporttrainer
- Durchführung mehrmals wöchentlich
- Gesamtdauer mehrere Monate
- Allerdings sind Gefäßsportgruppen seltener verfügbar als z. B. Koronarsportgruppen.
- Durch strukturiertes Gehtraining wird eine signifikante Erhöhung der schmerzfreien und maximalen Gehstrecke erzielt.23
Thrombozytenaggregationshemmung/orale Antikoagulation
- Der Nutzen der Thrombozytenaggregationshemmung zur Vermeidung peripher-vaskulärer Ereignisse ist nicht gut belegt, sie wird nicht zuletzt aber auch zur Risikoreduktion koronarer und zerebrovaskulärer Ereignisse verabreicht.24-26
- Formal besteht keine Zulassung für ASS zur Prävention bei PAVK, während Clopidogrel auf der Datenbasis der CAPRIE-Studie eine Zulassung zur präventiven Behandlung der PAVK hat.27
- Dennoch ist ASS im Allgemeinen die Medikation der 1. Wahl, Clopidogrel sollte gegeben werden bei ASS-Unverträglichkeit/Kontraindikationen oder bei Hochriskopatienten.
- Asymptomatische PAVK-Patienten ohne sonstige Manifestation einer Atherosklerose sollten keinen Thrombozytenaggregationshemmer erhalten.
- Bei Patienten mit oraler Antikoagulation aus anderer Indikation soll wegen der PAVK keine zusätzliche Thrombozytenfunktionshemmung erfolgen (Choosing Wisely).
- In einer neueren Studie führte die Kombination aus ASS und niedrigdosiertem Rivaroxaban im Vergleich zur ASS-Monotherapie zu einer signifikanten Abnahme kardiovaskulärer Ereignisse bei allerdings Zunahme an Blutungskomplikationen.28
Orale vasoaktive Substanzen
- Ziel der Anwendung vasoaktiver Substanzen ist die Verbesserung der Gehstrecke bei Claudicatio, zur Verfügung stehen vorwiegend zwei Substanzen:29-30
- Cilostazol (Phosphodiesterase-III-Inhibitor)
- Naftidrofuryl (5-HT2-Rezeptor-Antagonist)
- Pentoxifyllin wurde früher häufig eingesetzt, wird aber nicht mehr empfohlen.31
- Nebenwirkungen und Kontraindikationen schränken die Anwendungsmöglichkeiten ein, vasoaktive Substanzen gelten daher nicht als First-Line-Therapie.
- Cilostazol oder Naftidrofuryl sollten im Stadium der Claudicatio nur dann gezielt eingesetzt werden, wenn die Lebensqualität der Patienten erheblich eingeschränkt ist, die Gehstrecke unter 200 m liegt und ein Gehtraining nicht oder nur eingeschränkt durchgeführt werden kann.
Revaskularisation
- Revaskularisationen können durch Katheterintervention oder chirurgischen Eingriff erfolgen, im Einzelfall auch durch Hybrideingriffe.32-34
- Katheterinterventionen und Operationen sind symptomatische Maßnahmen ohne Einfluss auf die Progression der Grunderkrankung.
- Bei asymptomatischer PAVK soll daher eine prophylaktische Gefäßrekonstruktion nicht erfolgen.
- Die Patienten sollten unter Berücksichtigung von Leidensdruck, Nutzen-Risiko, Aufwand und persönlicher Präferenz in den Entscheidungsprozss eingebunden sein.
- Bei der Indikationsstellung sind zu berücksichtigen:
- Stadium der PAVK nach Fontaine oder Rutherford
- Lokalisation, Morphologie und Komplexität der Gefäßläsionen
- Begleiterkrankungen
- individueller Therapiewunsch der Patientin/des Patienten
Interventionelle Therapie
- In den vergangenen Jahren hat sich das Spektrum möglicher Katheterinterventionen durch neue Techniken und Materialien auch auf komplexe Läsionen erweitert.
- Grundsätzlich stehen folgende Techniken für die PTA (perkutane transluminale Angioplastie) zur Verfügung:
- reine Ballondilatation mit unbeschichtetem Ballon
- Implantation von unbeschichteten Metall-Stents
- Dilatation mit medikamentenbeschichteten (Paclitaxel) Ballons
- Implantation medikamentenbeschichteter (Paclitaxel, Sirolimus) Stents
Operation
- Operationen werden heutzutage vor allem bei langstreckigen, komplexen Läsionen durchgeführt.
- Für die Bypassanlage werden vor allem prothetische Materialien oder V.-saphena-Grafts verwendet.
- Nur wenige Studien sind für einen direkten Vergleich zwischen OP und Katheterintervention verfügbar.
- Für den aortoiliakalen Bereich wurde keine Vergleichsstudien publiziert, infrainguinal sind die Ergebnisse für die offene Chirurgie und für die interventionelle Therapie vergleichbar.
Kritische Extremitätenischämie
- Bei kompletter Ischämie muss umgehend eine interventionelle oder operative Behandlung erfolgen.
- Patienten mit kritischer Extremitätenischämie sollen daher schnellstmöglich in eine Klinik mit ausreichender Expertise eingewiesen werden.
Verlauf, Komplikationen und Prognose
Komplikationen
- Wundheilungsstörung
- Infektion, Gangrän
- Kritische Extremitätenischämie
- Amputation
- Herzinfarkt
- Schlaganfall
Verlauf und Prognose
- Verlauf der Symptomatik bei Claudicatio
- Besserung bei ca. 1/4 der Patienten
- wenig Veränderung bei ca. 1/3 bis der Hälfte der Patienten
- Verschlechterung bei ca. 1/4 der Patienten
- Je ausgeprägter die Claudicatio desto schneller die Progression
- Das Risiko einer kritischen Extremitätenischämie ist bei Claudicatio im Vergleich zum Herzinfarkt- und Schlaganfallsrisiko gering, das 10-Jahres-Risiko für eine Amputation beträgt 2 %.
- Es besteht eine direkte Korrelation zwischen Erniedrigung des ABI und Zunahme der kardiovaskulären Morbidität und Mortalität.
- Ein ABI < 0,90 ist verbunden mit einer Verdopplung der 10-Jahres-Raten an koronaren Ereignissen, kardiovaskulärer Mortalität und Gesamtmortalität.3
- Auch bei einer asymptomatischen PAVK besteht ein deutlich erhöhtes Risiko für kardiovaskuläre Ereignisse und Tod.35
- 10-Jahres-Mortalität beträgt bei:
- asymptomatischer PAVK 23 %
- Claudicatio 30 %
- kritischer Extremitätenischämie 40 %
Verlaufskontrolle
- Verlaufskontrollen werden durch Hausarzt und Gefäßmediziner durchgeführt.
- Ein strukturiertes Nachsorgeprogramm umfasst die folgenden Elemente:
- Beratung und Management der Risikofaktoren
- klinische Kontrolluntersuchungen
- Erfassung weiterer Behandlungsoptionen
- Nachsorge von invasiven Behandlungsverfahren (operativ und endovaskulär).
- Patienten sollen zu regelmäßigem Gehtraining angeleitet und idealerweise in Gefäßsportgruppen eingebunden werden.
Patienteninformationen
Patienteninformationen in Deximed
- Periphere arterielle Verschlusskrankheit
- Ernährungsempfehlungen bei erhöhten Blutfettwerten
- Vollwertige Ernährung, Empfehlungen der Deutschen Gesellschaft für Ernährung
- Fettarme Lebensmittel
- Ballaststoffe in der Nahrung
- Ernährung und Bewegung – für ein gesundes Herz
- Übergewicht und Gewichtsabnahme
- Gute Fußpflege
- Warum sollten Sie das Rauchen aufgeben, und wie gelingt es?
- Alkohol und Herz- und Gefäßerkrankungen
Illustrationen
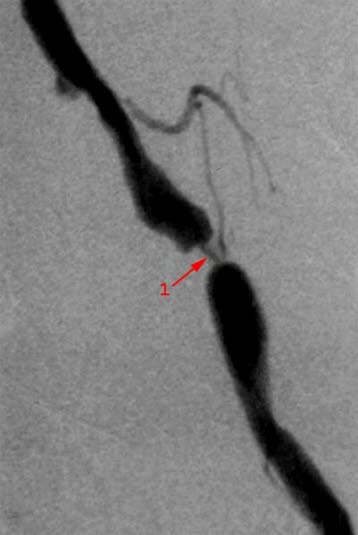
Stenose in der Iliaca, Röntgenbild
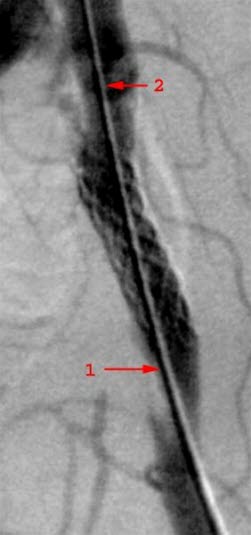
Stentbehandelte Stenose der Iliaca, Röntgenbild
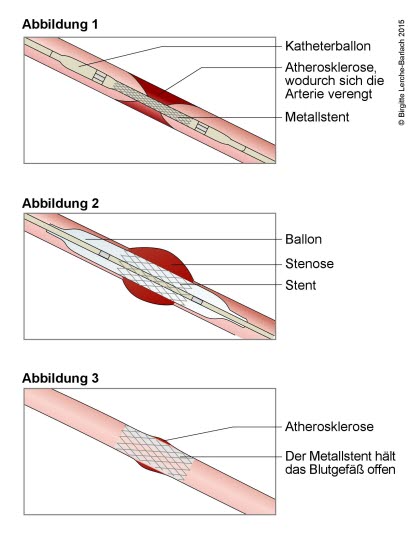
Stentbehandlung eines engen Blutgefäßes
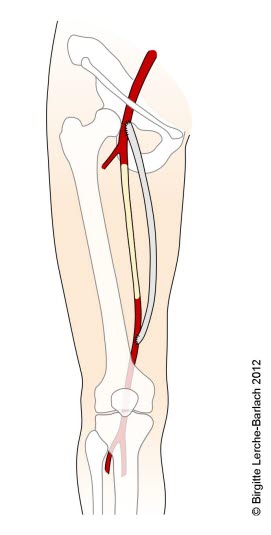
Bypass einer peripheren Okklusion
Knöchelblutdruck
Arterien der unteren Extremitäten
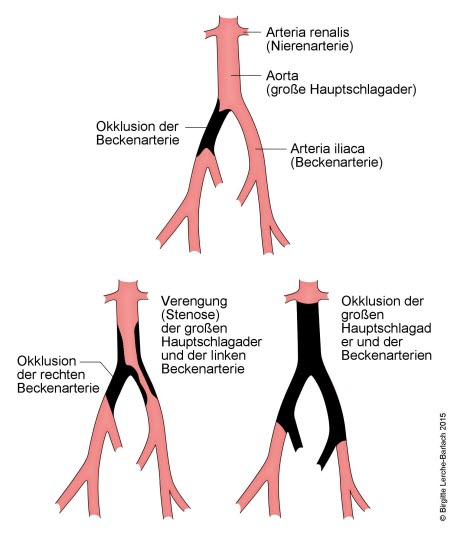
Thrombotische Erkrankungen der Iliaca-Arterien
Quellen
Leitlinien
- European Society of Cardiology. Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Stand 2017. www.escardio.org
Literatur
- Hirsch AT, Criqui MH, Treat-Jacobsen D, et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA 2001; 286: 1317-24. www.ncbi.nlm.nih.gov
- Belch JJ, Topol EJ, Agnelli G, et al, Prevention of Atherothrombotic Disease Network. Critical issues in peripheral arterial disease detection and management: a call to action. Arch Intern Med 2003; 163: 884-92. PubMed
- Aboyans V, Ricco J, Bartelink M, et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Eur Heart J 2018; 39: 763-821. doi:10.1093/eurheartj/ehx095 DOI
- Kroger K, Stang A, Kondratieva J, et al. Prevalence of peripheral arterial disease - results of the Heinz Nixdorf recall study. Eur J Epidemiol. 2006; 21(4): 279-285. www.ncbi.nlm.nih.gov
- Diehm C, Schuster A, Allenberg H, et al. High prevalence of peripheral arterial disease and comorbidity in 6,880 primary care patients: cross sectional study. Atherosclerosis. 2004;172:95-105.) www.ncbi.nlm.nih.gov
- Fowkes F, Housley E, Cawood E. Edinburgh Artery Study: prevalence of asymptomatic and symptomatic peripheral arterial disease in the general population. Int J Epidemiol 1991; 20: 384-392. pmid:1917239 PubMed
- Malyar N, Furstenberg T, Wellmann J, et al. Recent trends in morbidity and inhospital outcomes of in-patients with peripheral arterial disease: a nationwide population-based analysis. Eur Heart J 2013; 34: 2706-2714. eurheartj.oxfordjournals.org
- Narula N, Dannenberg A, Olin J, et al. Pathology of Peripheral Artery Disease in Patients With Critical Limb Ischemia. J Am Coll Cardiol 2018; 72: 2152-2163. doi:10.1016/j.jacc.2018.08.002 DOI
- Joosten MM, Pai JK, Bertoia ML, et al. Associations between conventional cardiovascular risk factors and risk of peripheral artery disease in men. JAMA 2012; 308: 1660-7. www.ncbi.nlm.nih.gov
- Firnhaber J, Powell C. Lower Extremity Peripheral Artery Disease: Diagnosis and Treatment. Am Fam Physician 2019; 99: 362-369. www.aafp.org
- Khan NA, Rahim SA, Anand SS, Simel DL, Panju A. Does the clinical examination predict lower extremity peripheral arterial disease? JAMA 2006; 295: 536-46. PubMed
- Met R, Bipat S, Legemate DA, Reckers JA, Koelemay MJW. Diagnostic performance of computed tomography angiography in peripheral arterial disease. A systematic review and meta-analysis. JAMA 2009; 301: 415-24. www.ncbi.nlm.nih.gov
- Menke J, Larsen J. Meta-analysis: Accuracy of contrast-enhanced magnetic resonance angiography for assessing steno-occlusions in peripheral arterial disease. Ann Intern Med 2010; 153: 325-34. www.ncbi.nlm.nih.gov
- Stead LF, Buitrago D, Preciado N, Sanchez G, Hartmann-Boyce J, Lancaster T. Physician advice for smoking cessation. Cochrane Database of Systematic Reviews 2013, Issue 5. Art. No.: CD000165. DOI: 10.1002/14651858.CD000165.pub4. DOI
- Paraskevas KI, Wierzbicki AS, Mikhailidis DP. Statins and noncardiac vascular disease. Curr Opin Cardiol. 2012;27(4):392–397. www.ncbi.nlm.nih.gov
- Pedersen TR, Kjekshus J, Pyörälä K, et al. Effect of simvastatin on ischemic signs and symptoms in the Scandinavian Simvastatin Survival Study (4S). Am J Cardiol 1998; 81: 333-5. PubMed
- Aronow WS, Nayak D, Woodworth S, Ahn C. Effect of simvastatin versus placebo on treadmill exercise time until the onset of intermittent claudication in older patients with peripheral arterial disease at six months and at one year after treatment. Am J Cardiol 2003; 92: 711-2. PubMed
- Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J 2018; 39: 3021–3104. doi:10.1093/eurheartj/ehy339 DOI
- Ahimastos AA, Walaker PJ, Askew C, et al. Effect of ramipril on walking times and quality of life among patients with peripheral artery disease and intermittent claudication: a randomized controlled trial. JAMA 2013 Feb 6;309(5):453-60. PubMed
- Stewart KJ, Hiatt WR, Regensteiner JG, Hirsch AT. Exercise training for claudication. N Engl J Med 2002;347:1941-51. New England Journal of Medicine
- Lane R, Ellis B, Watson L, Leng GC. Exercise for intermittent claudication. Cochrane Database of Systematic Reviews 2014, Issue 7. Art. No.: CD000990. DOI: 10.1002/14651858.CD000990.pub3. DOI
- Fokkenrood HJP, Bendermacher BLW, Lauret GJ, Willigendael EM, Prins MH, Teijink JAW. Supervised exercise therapy versus non-supervised exercise therapy for intermittent claudication. Cochrane Database of Systematic Reviews 2013, Issue 8. Art. No.: CD005263. DOI: 10.1002/14651858.CD005263.pub3. DOI
- Lane R, Ellis B, Watson L, et al. Exercise for intermittent claudication. Cochrane Database Syst Rev. 2014 ;7:CD000990. pubmed.ncbi.nlm.nih.gov
- Berger JS, Krantz MJ, Kittelson JM, Hiatt WR. Aspirin for the prevention of cardiovascular events in patients with peripheral artery disease. A meta-analysis of randomized trials. JAMA 2009; 301: 1909-19. www.ncbi.nlm.nih.gov
- Wong PF, Chong LY, Mikhailidis DP, Robless P, Stansby G. Antiplatelet agents for intermittent claudication. Cochrane Database of Systematic Reviews 2011; 11: CD001272. Cochrane (DOI)
- Fowkes FG, Price JF, Stewart MC, et al. Aspirin for prevention of cardiovascular events in a generel population screened for a low ankle brachial index: a randomized controlled trial. JAMA 2010; 303: 841-8. www.ncbi.nlm.nih.gov
- A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996;348:1329–1339. www.ncbi.nlm.nih.gov
- Anand S, Bosch J, Eikelboom J, et al. Rivaroxaban with or without aspirin in patients with stable peripheral or carotid artery disease: an international, randomised, double-blind, placebo-controlled trial. Lancet 2018; 391: 219-229. doi:10.1016/S0140-6736(17)32409-1 DOI
- Stevens JW, Simpson E, Harnan S, et al. Systematic review of the efficacy of cilostazol, naftidrofuryl oxalate and pentoxifylline for the treatment of intermittent claudication. Br J Surg 2012; 99: 1630-8. pmid:23034699 PubMed
- Bedenis R, Stewart M, Cleanthis M, et al. Cilostazol for intermittent claudication. Cochrane Database Syst Rev 2014; 10: CD003748. doi:10.1002/14651858.CD003748.pub4. DOI
- Salhiyyah K, Forster R, Senanayake E, et al. Pentoxifylline for intermittent claudication. Cochrane Database Syst Rev 2015; 9: CD005262. doi:10.1002/14651858.CD005262.pub3 DOI
- Malgor RD, Alalahdab F, Elraiyah TA, et al. A systematic review of treatment of intermittent claudication in the lower extremities. Vasc Surg. 2015;61:54S-73S. doi: 10.1016/j.jvs.2014.12.007 DOI
- Fowkes F, Leng GC. Bypass surgery for chronic lower limb ischaemia. Cochrane Database of Systematic Reviews 2008; 2: CD002000. www.cochranelibrary.com
- Bradbury AW, Adam DJ, Bell J, et al. Bypass versus angioplasty in severe ischaemia if the leg (BASIL) trial: an intention-to-treat analysis of amputation-free and overall survival in patients randomized to a bypass surgery-first or a balloon angioplasty-first revascularization strategy. J Vasc Surg 2010; 51: 5-17. www.ncbi.nlm.nih.gov
- Diehm C, Allenberg JR, Pittrow D et al. Mortality and vascular morbidity in older adults with asymptomatic versus symptomatic peripheral artery disease. Circulation 2009; 120:2053–2061. doi.org
Autoren
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.
- Günther Egidi, Dr. med., Arzt für Allgemeinmedizin, Bremen (Review)