Zusammenfassung
- Definition:Leukämien sind maligne Erkrankungen des blutbildenden Systems mit unkontrollierter Vermehrung von reifen oder unreifen Leukozyten im Knochenmark. Die Ursachen sind unbekannt, es besteht eine Assoziation mit genetischen Veränderungen.
- Häufigkeit:Leukämien machen insgesamt 30 % aller Krebserkrankungen < 18 Jahre aus. Am häufigsten tritt die akute lymphatische Leukämie (ALL) mit > 80 % auf. Die Prävalenz ist z. B. beim Down-Syndrom, bei genetischen Syndromen, bei Immundefekten oder nach einer früheren Radio-/Chemotherapie erhöht.
- Symptome:Unspezifische frühe Symptome: Reduzierter Allgemeinzustand, Folgen von Anämie, Neutropenie und Thrombozytopenie, Knochenschmerzen.
- Befunde:Blässe, Fieber, vergrößerte Lymphknoten, Hämatome, Hepatosplenomegalie, Hautinfiltrationen, Gingivahyperplasie, Mediastinalverbreiterung.
- Diagnostik:Differenzialblutbild: hohe oder niedrige Leukozytenwerte, Reduktion anderer Zellreihen, Nachweis von Blasten. Knochenmarkpunktion: Blastennachweis. Klinische Chemie: LDH und Harnsäure erhöht.
- Therapie:Risikoadaptierte Polychemotherapie gemäß standardisierter Therapieprotokolle, ggf. Bestrahlung und hämatopoetische Stammzelltransplantation für bestimmte Risikogruppen.
Allgemeine Informationen
Definition
- Leukämien sind maligne Erkrankungen des blutbildenden Systems
- unkontrollierte Vermehrung von funktionsuntüchtigen Leukozyten oder deren Vorstufen im Knochenmark
- Verdrängung der normalen Blutbildung im Knochenmark und Ausschwemmung von Leukämiezellen in die Blutbahn
- Infiltration von Organen und Geweben möglich
- Im Kindesalter treten fast ausschließlich akute Verlaufsformen auf. Der Anteil an allen malignen Erkrankungen < 18 Jahre beträgt:
- 22 % für akute lymphatische Leukämien (ALL)
- 4 % für akute myeloische Leukämien (AML)
- 2,5 % für myelodysplastische Syndrome (MDS)
- 0,6 % für chronisch myeloproliferative Erkrankungen
Häufigkeit
- Leukämien machen etwa 30 % der Krebserkrankungen im Kindesalter aus.
- Jährliche Inzidenz bei Kindern < 18 Jahren
- Am häufigsten tritt die ALL bei Kindern zwischen 1–4 Jahren auf. Jungen sind im Vergleich zu Mädchen im Verhältnis 1,3:1 häufiger betroffen.
Ätiologie und Pathogenese
- Weitgehend unbekannt
Disponierende Faktoren
- Genetische Faktoren
- spontane somatische Mutationen oder vorbestehende Keimbahnmutationen
- Down-Syndrom: 14- bis 20-fach erhöhtes Risiko für die Entwicklung einer akuten Leukämie1
- genetische Syndrome (z. B. Fanconie-Anämie, Neurofibromatose Typ I, Bloom-Syndrom, Immundefekte)
- Umweltfaktoren
- frühere Radio- oder Chemotherapie
- chemische Noxen
ICD-10
- C91 Lymphatische Leukämie
- C91.0 Akute lymphatische Leukämie [ALL]
- C92 Myeloische Leukämie
- C92.0 Akute myeloblastische Leukämie [AML]
Diagnostik
Diagnostische Kriterien
- Klinisches Bild, Blut- und Knochenmarkausstrich sind diagnoseweisend. Zur Stadieneinteilung und Therapiefestlegung sind weiterführende diagnostische Maßnahmen notwendig.
Differenzialdiagnosen
- Idiopathische thrombozytopenische Purpura (ITP)
- Ist die häufigste Ursache für akut auftretende Petechien und Purpura bei Kindern.
- Geht nicht mit Anämie einher; die Untersuchung des Knochenmarks zeigt eine normale Hämatopoese.
- in der Regel guter Allgemeinzustand
- Infektiöse Mononukleose
- Lymphozytose mit atypischen Lymphozyten, generalisierte Lymphadenopathie und Splenomegalie
- Nachweis von EBV-Antikörpern mittels Schnelltest oder anderer immunologischer Verfahren
- Leukämoide Reaktionen z. B. bei bakterieller Sepsis, akuter Hämolyse, Infektion mit Bordetella pertussis
- Nachweis einer Leukozytose und unreifer myeloider Zellen im peripheren Blut
- Maligne Lymphome
- Lymphadenopathie
- Diagnosestellung u. a. durch Lymphknotenbiopsie
- Juvenile rheumatoide Arthritis
- Schmerzen in den Gelenken und Extremitäten, evtl. hinkender Gang
- in einigen Fällen Leukozytose, Anämie und Splenomegalie
- Osteomyelitis
- Bildgebung und Keimnachweis zur Diagnosesicherung
- Aplastische Anämie
- selten Lymphadenopathie und Splenomegalie
- hypozelluläres Knochenmark
- Panzytopenie
- Myelodysplastisches Syndrom
- Thrombozytopenie, Anämie und Neutropenie sind möglich.
- im Verlauf oft Progress zur sekundären AML
- Neuroblastom mit Metastasen
- evtl. Lymphoblasten-ähnliche Neuroblasten im Knochenmark
- erhöhte Ausscheidung von Katecholaminen im Urin
Anamnese
- Häufig kurze Anamnese mit unspezifischen Allgemeinsymptomen, selten auch längerer Verlauf
- Typische Symptome
- Müdigkeit
- Abgeschlagenheit, Krankheitsgefühl
- Knochen- und Gelenkschmerzen, bei Kleinkindern Gehverweigerung
- Symptome aufgrund der Verdrängung der normalen Blutbildung im Knochenmark
- Blässe
- Infektneigung
- Blutungsneigung
- Symptome bei Organinfiltration
- Bauchschmerzen und aufgeblähter Bauch bei Infiltration von Leber und Milz
- Schmerzen und Schwellungen in Knochen und Gelenken2
- Dyspnoe bei Infiltration von Lunge, Perikard oder Pleura
- Kopfschmerzen, Nackensteife, Erbrechen und neurologische Ausfallerscheinungen bei ZNS-Befall
Klinische Untersuchung
- Blässe bei Anämie
- Petechien oder Hämatome bei Thrombozytopenie
- Fieber und lokale Infektionsbefunde, primär in Rachen und Atemwegen aufgrund funktionsuntüchtiger Leukozyten und Leukopenie
- Lymphadenopathie bei etwa der Hälfte aller Patient*innen, häufig asymmetrisch
- Hepatosplenomegalie
- Geschwollene Gelenke
- Schmerzlose, harte Hodenschwellung (meist einseitig)
- Hautinfiltrate
- Gingivahyperplasie und Hautinfiltrate bei bestimmten AML-Subtypen
Ergänzende Untersuchungen in der Hausarztpraxis
- Laboruntersuchungen
- variable Leukozytenzahl; sowohl niedrig als auch sehr hoch
- meist Anämie und Thrombozytopenie, in 3 % der Fälle jedoch normales Blutbild
- erhöhte Laktatdehydrogenase- und Harnsäurewerte
- Sonografie
- häufig Hepatosplenomegalie, vergrößerte Lymphknoten, seltener Mediastinaltumor, Pleura- oder Perikarderguss
Diagnostik bei Spezialist*innen – im Krankenhaus
Spezielle Leukämiediagnostik
- Zytologie
- Blut- und Knochenmarkausstrich mit Nachweis von Blasten
- Anteil der Blasten im Knochenmark ≥ 25 %
- Histologie
- Knochenmarkbiopsie
- Zytochemie
- Immunphänotypisierung
- Unterscheidung von AML und ALL, Identifizierung des Subtyps durch Antigennachweis auf oder in den Leukämiezellen
- Zytogenetik und spezifische Molekulargenetik
- Identifizierung pathologischer Veränderungen/Mutationen auf chromosomaler und molekularer Ebene
- notwendig und zunehmend wichtiger für Risikostratifizierung und Therapieplanung1
- Untersuchung der Zerebrospinalflüssigkeit
- Beurteilung einer möglichen Streuung der Leukämiezellen ins ZNS
- Zellzahl, Bestimmung des Eiweißgehalts
- morphologische Untersuchung evtl. vorhandener leukämischer Blasten
- zytogenetische Untersuchung
Labordiagnostik
- Blutbild
- Differenzialblutbild mit Erythrozytenindizes und Retikulozyten
- Klinische Chemie
- Ferritin (meist erhöht)
- CRP, Blutsenkung
- Na, K, Ca, P, Mg, AP, Harnstoff, Kreatinin, Harnsäure, GOT, GPT, Gamma-GT, LDH, CHE, Bilirubin, Blutzucker, Gesamteiweiß, Immunglobuline
- Gerinnung
- Serologie
- EBV, CMV, Varizella-Zoster, Herpes simplex, evtl. Toxoplasmose, HBV, HCV, HIV, Aspergillus-Antigen
- Sonstiges
- Blutgruppe: AK-Suchtest
- Tuberkulin-Hauttest anlegen.
Apparative Diagnostik
- Röntgenthorax in zwei Ebenen
- Ultraschall Abdomen, Mediastinum, Lymphknotenstationen, Hoden
- Ggf. kranielles MRT (oder CCT, wenn MRT nicht verfügbar), MRT Thorax, Abdomen, bzw. des knöchernen Skelettes
- EKG/Herzecho
- EEG
- Ggf. Tonaudiogramm
Indikationen zur Überweisung
- Sofortige Einweisung bei Verdacht auf Leukämie
- Achtung: lebensbedrohliche Notfälle!
- Atemwegsverlegung bei Mediastinalverbreiterung durch Lymphom/T-ALL
- Hyperleukozytose (> 100.000 Leukozyten/µl)
- Tumorlyse-Syndrom (massiver Zellzerfall, Nephropathie)
- disseminierte intravasale Gerinnung/Blutung
Therapie
Therapieziele
- Erreichung einer schnellen und anhaltenden Remission
- Risikoadaptierte Therapie mit dem Ziel einer Vermeidung bzw. Minimierung von therapiebedingten Langzeitschäden
Allgemeines zur Therapie
- Therapie in spezialisierten Zentren im Rahmen aktueller national/international anerkannter Therapieprotokolle
- Leukämie bei Kindern ist eine maligne Erkrankung mit guter Prognose. Die Behandlung ist intensiv und langwierig; vielfach ist aber eine dauerhafte Heilung möglich.
- Zur optimalen Behandlung ist eine genaue Klassifizierung/Risikostratifizierung der Leukämie notwendig.
Empfehlungen für Patient*innen
- Unbedingte Vermeidung von Infektionsrisiken während der Intensivtherapie
- keine Krippe, Kita, Schule, größere Familienfeiern, Menschenansammlungen, öffentliche Verkehrsmittel
- kein Besuch von/bei Infektiösen
- Vermeidung von Baustellen (Achtung auch bei Renovierung im eigenen Haus) und feuchten Wohnungen, keine Topfpflanzen im Schlafzimmer, keine Gartenarbeit, kein enger Tierkontakt, kein Zoobesuch, keine Feldspaziergänge
- Lebensmittelhygiene
- Vermeidung von Aktivitäten mit Verletzungs-/Blutungsrisiko
- Pflege des zentralvenösen Zugangs (Port oder ZVK) gemäß Anweisung
- Sofortige Kontaktaufnahme mit Klinik bei Fieber
- Sofortige Kontaktaufnahme mit Klinik nach Kontakt mit Varizellen, Herpes oder anderen Infektionskrankheiten
Medikamentöse Therapie
AML
- Polychemotherapie anhand etablierter Therapieprotokolle
- Behandlung in drei Phasen:
- Induktion
- Konsolidierung
- Reintensivierung
- In den meisten Fällen schließt sich eine Erhaltungstherapie an, wobei Dauer und Notwendigkeit nicht abschließend geklärt sind.
- Schädelbestrahlung nur bei initialem ZNS-Befall
- Prophylaktische intrathekale Therapie bei Kindern ohne ZNS-Befall
- Allogene hämatopoetische Stammzelltransplantation nur bei ungünstiger Zytogenetik oder schlechtem Therapieansprechen3
ALL
- Polychemotherapie anhand etablierter Therapieprotokolle
- Behandlung in vier Phasen:
- Induktionstherapie und Induktionskonsolidierung
- Extrakompartmenttherapie
- Reinduktionstherapie
- Erhaltungstherapie
- Allogene hämatopoetische Stammzelltransplantation nur in sehr seltenen Fällen (sehr ungünstige Zytogenetik, Nichtansprechen auf Induktionstherapie)
- ZNS-Bestrahlung bei manifestem initialem Befall nach jeweiligem Studienprotokoll
- Intrathekale Therapie bei allen Patient*innen zur Vorbeugung eines ZNS-Rezidivs
- Immuntherapie mit Antikörpern in Studien4
- Therapie mit Tyrosinkinaseinhibitoren bei bestimmten Unterformen (BCR-ABL1 positiv)5-6
Supportive Therapie
- Erythroyzten- und Thrombozytensubstitution
- Infektionsprophylaxe
- Adäquate und schnelle Infektions-/Sepsistherapie
- Antiemese
- Schmerztherapie
- Aufrechterhaltung eines guten Ernährungszustands
Fertilitätserhaltende Maßnahmen
- Individuell abgestimmte, ausführliche Aufklärung von Patient*innen und Eltern
- vor Therapiebeginn
- während der Nachsorge
Psychosoziale Unterstützung
- Professionelle Unterstützung der gesamten Familie
- Extremsituation für betroffene Kinder, Eltern und Geschwister
- ausgeprägte seelische, körperliche und soziale Belastungen durch Erkrankung, Therapie und therapiebedingte Isolation
- Hilfe bei der Krankheitsbewältigung und Förderung der Therapie-Compliance
- Vorbeugung und Behandlung von krankheits-/therapiebedingten Verhaltensauffälligkeiten
- Sozialrechtliche Unterstützung
Therapie im Rezidiv
AML
- Empfehlung einer allogenen Stammzelltransplantation
- Zunehmender Einsatz zielgerichteter Substanzen z.B. Antikörper wie Gemtuzumab-Ozogamicin7-8 oder Tyrosinkinaseinhibitoren
- Erneute Risikostratifizierung9
- Hochrisiko: Empfehlung einer allogenen Stammzelltransplantation
- Niedrigrisiko: erneute medikamentöse Therapie
- Antikörpertherapie im Rahmen von Studien10
Palliativtherapie
- Palliative Schmerztherapie
- Übelkeit und Erbrechen
- Obstipation
- Maligne gastrointestinale Obstruktionen
- Mundtrockenheit
- Mangelernährung und Dehydratation
- Atembeschwerden
- Depression
- Angst
- Delirium
Verlauf, Komplikationen und Prognose
Verlauf
- Die Krankheit tritt akut nach einer kurzen Anamnese auf. Besonders im Frühstadium können die Symptome unspezifisch und vielfältig sein.
- An die intensive mehrmonatige Akuttherapie schließen sich eine zweijährige Erhaltungstherapie und eine langfristige Nachsorge an.
Komplikationen
Akute Komplikationen
- Disseminierte intravasale Gerinnung
- Tumorlyse-Syndrom mit Hyperkaliämie und Hyperurikämie infolge des Zellzerfalls
- Insbesondere zu Beginn der Chemotherapie bei hoher Anzahl von Leukämiezellen; kann Nierenschäden und Herzrhythmusstörungen verursachen.
- Hyperleukozytose, Leukostase mit Thromben
- Atemwegsverlegung bei Mediastinalverbreiterung durch Lymphom/T-ALL
- Steroiddiabetes
- Folgen der Panzytopenie
Langzeitkomplikationen
- Auftreten sekundärer Malignome, insbesondere nach ZNS-Bestrahlung
- Langzeitschäden durch die Erkrankung oder ihre Therapie in allen Organsysteme möglich
- Einschränkung der Herzfunktion nach Anthrazyklintherapie
- Hörstörungen nach Therapie mit Platinderivaten
- Akute oder chronische Nierenfunktionsstörungen
- Osteopenie, Osteoporose und Knochennekrosen nach Kortison-Therapie
- Schädigung von Lunge und Gastrointestinaltrakt
- Neuropsychologische Störungen und Entwicklungsverzögerung insbesondere nach ZNS-Bestrahlung
- Funktionsstörungen des endokrinen Systems
- Wachstumsstörungen, Fertilitätsstörungen, Entwicklungsstörungen
- Psychosoziale Beeinträchtigungen
Prognose
- 5-Jahres-Überlebensrate für Kinder < 18 Jahre zum Zeitpunkt der Diagnose:
Verlaufskontrolle
- Eine an die Erkrankung und Therapie angepasste Nachsorge ist notwendig, um ein Rezidiv oder Spätfolgen zu erkennen und zu therapieren.
- Die onkologische Nachsorge wird von der behandelnden Klinik in einer Spezialsprechstunde koordiniert und findet in enger Zusammenarbeit mit den niedergelassenen Haus-/Kinderärzt*innen statt.
- Neben den medizinischen Kontrolluntersuchungen erfolgt im Rahmen der Nachsorge eine Beratung zu Impfungen, Risikofaktoren und Familienplanung
- Ein besonderes Augenmerk während der Nachsorge sollte auf:
- dem frühzeitigen Erkennen eines möglichen Rezidivs liegen.
- Knochenmarksrezidiv (Anämie, Infektionsneigung, Blutungen)
- ZNS-Rezidiv
- Hodenrezidiv (schmerzlose, harte Hodenschwellung)
- dem frühzeitigen Erkennen organspezifischer Spätfolgen liegen (siehe auch Abschnitt Langzeitkomplikationen).
- dem frühzeitigen Erkennen eines möglichen Rezidivs liegen.
Patienteninformationen
Patienteninformationen in Deximed
- Leukämie bei Kindern
- Zytostatika (Chemotherapie gegen Krebs)
- Schmerzen und Schmerztherapie
- Essen bei Appetitlosigkeit – Ernährungstipps
Weitere Informationen
- Baker, Lynn S.: You and Leukemia: A Day at a Time. Philadelphia, London: Saunders, 2002
Illustrationen
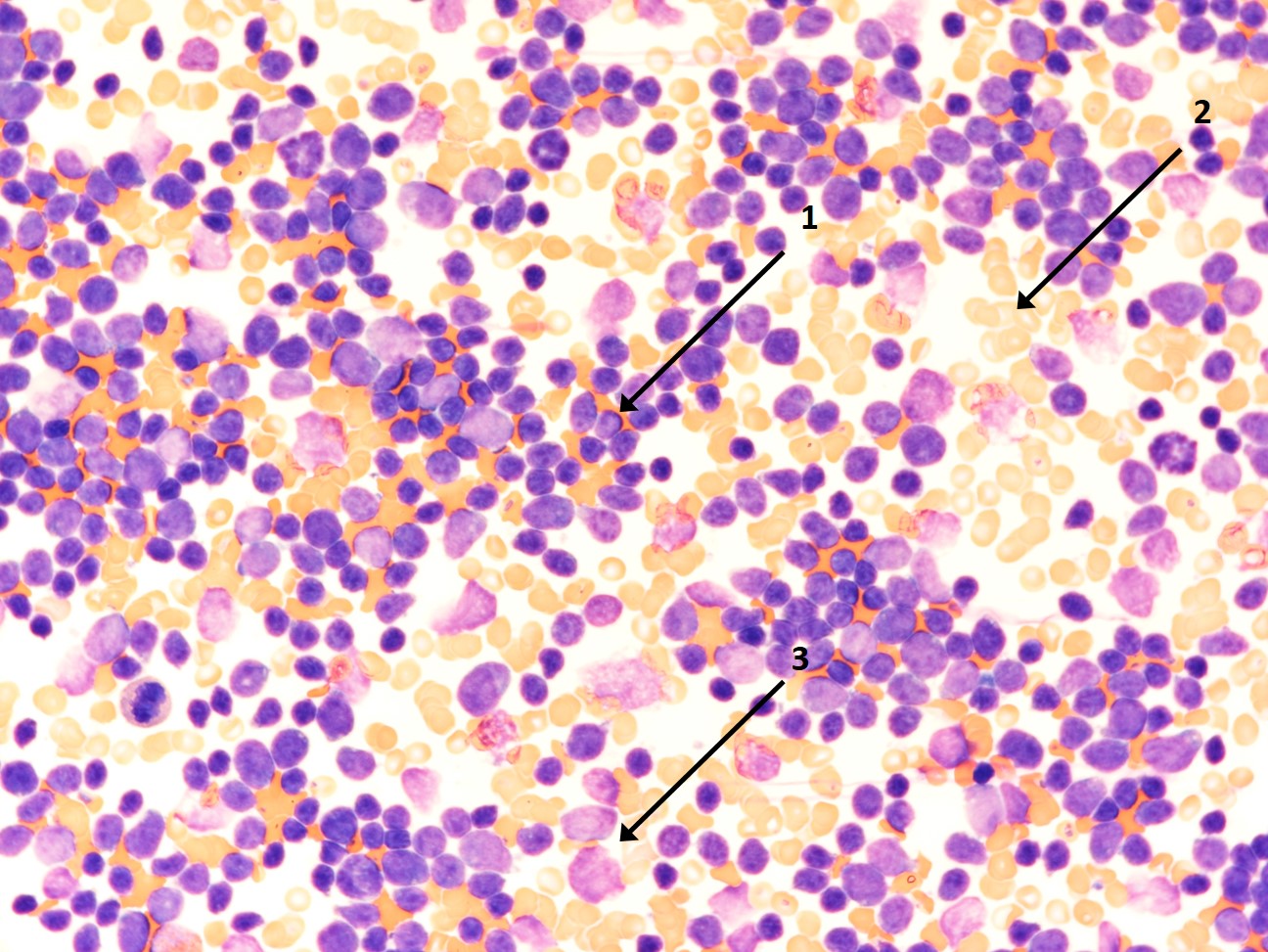
Knochenmarkausstrich mit vielen lymphatischen Blasten (1), Erythrozyten (2) und einigen Zelltrümmern (3)
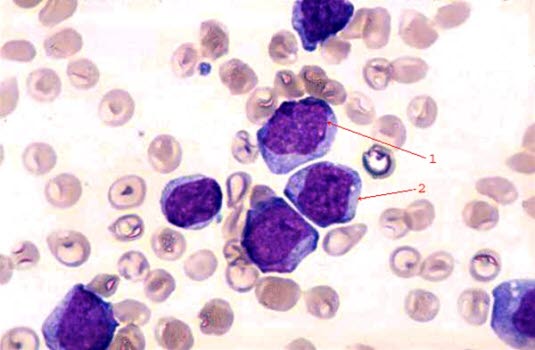
Peripherer Blutausstrich mit myeloischen Blasten (1 und 2), typisch mit großem unreifen Kern mit aufgelockerter Chromatinstruktur und sichtbaren Nukleoli
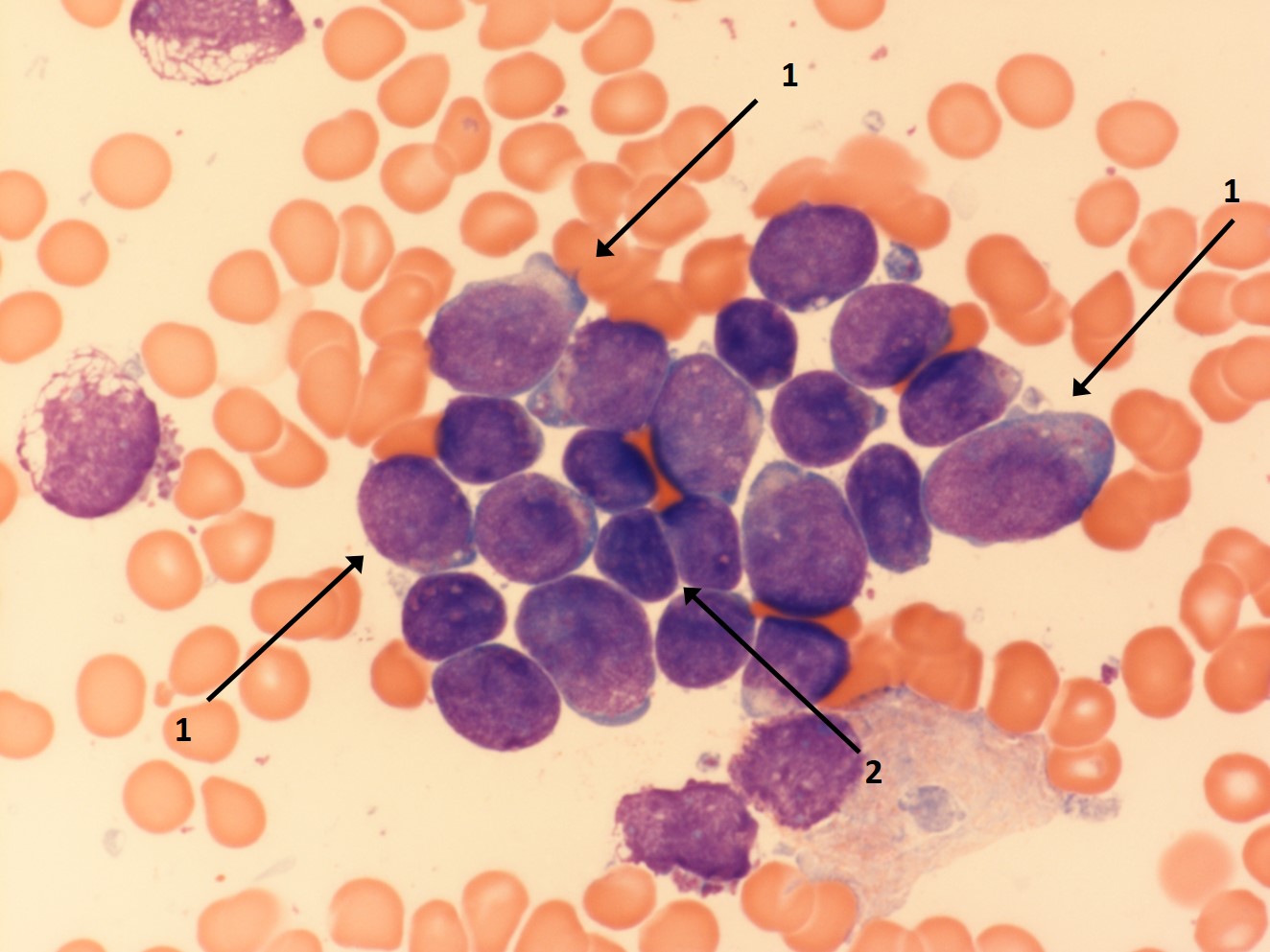
Lymphatische Blasten im Knochenmark (1), dazwischen einige morphologisch unauffällige Lymphozyten (2)
Quellen
Literatur
- Creutzig U, van den Heuvel-Eibrink M, Gibson B, et al. on behalf of the AML Committee of the International BFM Study Group . Diagnosis and management of acute myeloid leukemia in children and adolescents: recommendations from an international expert panel . Blood 2012; 120: 3187-3205. doi.org
- Sinigaglia R, Gigante C, Bisinella G, et al. Musculoskeletal manifestations in pediatric acute leukemia. J Pediatr Orthop 2008; 28:20. PubMed
- Niewerth D, Creutzig U, Bierings MB, Kaspers GJ. A review on allogeneic stem cell transplantation for newly diagnosed pediatric acute myeloid leukemia. Blood. 2010 Sep 30;116(13):2205-14. pubmed.ncbi.nlm.nih.gov
- Queudeville M, Ebinger M. Blinatumomab in Pediatric Acute Lymphoblastic Leukemia-From Salvage to First Line Therapy (A Systematic Review). J Clin Med. 2021 Jun 8;10(12):2544. www.ncbi.nlm.nih.gov
- Cario G, Leoni V, Conter V, Baruchel A, Schrappe M, Biondi A. BCR-ABL1-like acute lymphoblastic leukemia in childhood and targeted therapy. Haematologica. 2020 Sep 1;105(9):2200-2204. www.ncbi.nlm.nih.gov
- Biondi A, Schrappe M, De Lorenzo P et al. Imatinib after induction for treatment of children and adolescents with Philadelphia-chromosome-positive acute lymphoblastic leukaemia (EsPhALL): a randomised, open-label, intergroup study. Lancet Oncol. 2012 Sep;13(9):936-45. pubmed.ncbi.nlm.nih.gov
- Niktoreh N, Lerius B, Zimmermann M et al. Gemtuzumab ozogamicin in children with relapsed or refractory acute myeloid leukemia: a report by Berlin-Frankfurt-Münster study group. Haematologica. 2019 Jan;104(1):120-127. pubmed.ncbi.nlm.nih.gov
- Zwaan CM, Reinhardt D, Zimmerman M et al; International BFM Study Group on Paediatric AML. Salvage treatment for children with refractory first or second relapse of acute myeloid leukaemia with gemtuzumab ozogamicin: results of a phase II study. Br J Haematol. 2010 Mar;148(5):768-76. pubmed.ncbi.nlm.nih.gov
- Tallen G, Ratei R, Mann G et al. Long-term outcome in children with relapsed acute lymphoblastic leukemia after time-point and site-of-relapse stratification and intensified short-course multidrug chemotherapy: results of trial ALL-REZ BFM 90. J Clin Oncol. 2010 May 10;28(14):2339-47. pubmed.ncbi.nlm.nih.gov
- Locatelli F, Zugmaier G, Rizzari C et al. Effect of Blinatumomab vs Chemotherapy on Event-Free Survival Among Children With High-risk First-Relapse B-Cell Acute Lymphoblastic Leukemia: A Randomized Clinical Trial. JAMA. 2021 Mar 2;325(9):843-854. pubmed.ncbi.nlm.nih.gov
Autor*innen
- Kristin Haavisto, Dr. med., Fachärztin für Innere Medizin und Hämato-/Onkologie, Münster
- Anne Strauß, Ärztin in Weiterbildung Pädiatrie, Zentrum für Kinder- und Jugendmedizin, Universitätsklinikum Freiburg