Zusammenfassung
- Definition:Eine rezidivierende akute Arthritis primär peripherer Gelenke, die durch eine Einlagerung von Harnsäurekristallen in Gelenken, gelenknahen Geweben oder Weichteilen hervorgerufen wird.
- Häufigkeit:Prävalenz geschlechtsübergreifend etwa 1–5 %. Sie steigt mit dem Alter an. Männer sind deutlich häufiger betroffen als Frauen.
- Symptome:Zu den Symptomen zählen akute, rezidivierende Anfälle, vor allem im Großzehengrundgelenk, evtl. auch im Knöchel-, Knie-, Ellenbogen- oder Handgelenk.
- Befunde:Die betroffenen Gelenke sind gerötet und geschwollen. Möglich sind auch Ablagerungen von Harnsäurekristallen in den Weichteilen (sog. Tophi), z. B. an den Fingern, Ohren oder Sehnen.
- Diagnostik:Klinische Diagnose. Bei diagnostischer Unsicherheit Gelenkpunktat und Untersuchung der Synovialflüssigkeit auf Uratkristalle.
- Therapie:Anfälle werden mit NSAR, Kortison oder Kolchizin behandelt. Therapie der Wahl bei symptomatischer Hyperurikämie mit mind. 2 Anfällen pro Jahr ist Allopurinol.
Allgemeine Informationen
Definition
- Synonym: Arthritis urica
- Die Gicht ist eine rezidivierende akute Arthritis insbesondere peripherer Gelenke, die durch eine Einlagerung von Harnsäurekristallen hervorgerufen wird.
- Podagra bezeichnet den klassischen Befall des Großzehengrundgelenks.
- Die Gicht verläuft regelhaft in Schüben, sie kann sich jedoch auch zu einer chronischen Gicht entwickeln.
Stadieneinteilungen
- International verschiedene Stadieneinteilungen
- Eine mögliche Stadieneinteilung versucht der Charakterisierung der Gichterkrankung als Kontinuum gerecht werden:1
- Stadium A: Hyperurikämie
- Stadium B: mikroskopischer oder bildgebender Nachweis von Uratkristallansammlungen ohne klinische Symptomatik
- Stadium C: Uratkristallansammlungen mit Symptomen akuter Gichtanfälle
- Stadium D: fortgeschrittene Gicht
Häufigkeit
- Lebenszeitprävalenz
- ca. 1–5 %
- Inzidenz
- in den letzten Jahren deutlich ansteigend, u. a. durch die demografische Entwicklung
- Alter und Geschlecht
- Die Prävalenz der Gicht steigt mit dem Alter an.2
- Männer sind etwa 3-mal so häufig betroffen wie Frauen.
- bei Männern mit dem Alter linear zunehmend, bei Frauen exponentielle Zunahme nach der Menopause
- Diesbezüglich wird postuliert, dass Östrogen eine Rolle im Purinstoffwechsel spielt, da eine hormonelle Ersatztherapie in der Postmenopause das Risiko, eine Gicht zu entwickeln, minimiert.
Ätiologie und Pathogenese
- Die Gicht ist mit einer Hyperurikämie assoziiert, die als eine Erhöhung der Serumharnsäure von ≥ 416 μmol/l (7 mg/dl) definiert ist.
- abhängig von der Quelle unterschiedliche Grenzwerte
Purinstoffwechsel
- Harnsäure ist das Endprodukt des Purinstoffwechsels.
- Etwa 75 % werden über die Nieren, 25 % über den Darm ausgeschieden.
Ursachen des erhöhten Harnsäurespiegels
- Eine Hyperurikämie resultiert meist aus einer genetisch bedingt verminderten renalen Harnsäure-Ausscheidung in Kombination mit einer erhöhten Zufuhr über die Nahrung.
- Auch andere Ursachen für eine Hyperurikämie sind möglich, z. B. durch:7
- Zerfall von Tumorzellen im Rahmen einer Chemotherapie
- medikamentös induzierte erhöhte Reabsorbtion von Harnsäure in der Niere
- u. a. durch Pyrazinamid, Low-Dose-Aspirin, Ciclosporin, Testosteron, Diuretika
- medikamentös induzierte reduzierte Uratausscheidung
- u. a. durch Tacrolimus
Bildung von Kristallen
- Kristalle werden gebildet, wenn die Harnsäurekonzentration das Löslichkeitsprodukt von 416 μmol/l (7 mg/dl) übersteigt.
- Das Ausfällen von Harnsäurekristallen findet bei niedrigeren Temperaturen schneller statt.
- Häufung der Anfälle am Großzehengrundgelenk, das eine besonders kühle Stelle des Körpers ist.
- Das Ausmaß der Ausfällung steigt bei zunehmender Azidose an, sodass alle Krankheitsbilder, die zu einer Azidose führen, auch eine verstärkte Ausfällung von Kristallen mit sich bringen.
- Das Ausfällen von Harnsäurekristallen findet bei niedrigeren Temperaturen schneller statt.
- Die Harnsäurekonzentration im Serum ist der wichtigste Risikofaktor für das erstmalige Auftreten eines Gichtanfalls.
- Bei Harnsäurespiegel < 7 mg/dl Inzidenz von 0,1 %, bei Harnsäurespiegel > 9 mg/dl Inzidenz von 4,9 %
- Außer der Harnsäure spielen jedoch auch weitere Faktoren eine entscheidende Rolle, z. B. die genetische Disposition und freie Fettsäuren.
- Es gibt Patient*innen mit sehr hohen Harnsäurewerten im Serum, die Zeit ihres Lebens keinen Gichtanfall bekommen, und Patient*innen mit sehr niedrigen Harnsäurewerten, die trotzdem einen Gichtanfall erleiden.
Prädisponierende Faktoren
- Die Angaben basieren auf dieser Referenz.
- Übergewicht, Adipositas
- Arterielle Hypertonie
- Alkoholkonsum
- Ernährungsgewohnheiten: viel Fleisch, Meeresfrüchte, Nahrungsmittel/Getränke mit hohem Fruktosegehalt
- Niereninsuffizienz
- Diuretikagebrauch
- Männliches Geschlecht
- Fortgeschrittenes Alter
- Erhöhte Harnsäurekonzentrationen im Serum
- Niedrige Temperaturen
ICD-10
- M10 Gicht
- M10.0 Idiopathische Gicht
- M10.1 Bleigicht
- M10.2 Arzneimittelinduzierte Gicht
- M10.3 Gicht durch Nierenfunktionsstörung
- M10.4 Sonstige sekundäre Gicht
- M10.9 Gicht, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
- Die klinische Diagnose des Gichtanfalles ist zu stellen, wenn:
- sich eine schmerzhafte Monoarthritis innerhalb ca. eines Tages ohne Prodromi entwickelt hat – und –
- ein peripheres kleines Gelenk oder das Kniegelenk befallen ist – und –
- weder Trauma (z. B. OP) noch intraartikuläre Injektion noch ein akut eingetretener schlechter Allgemeinzustand vorliegt.
- Eine weitere Diagnostik ist nur bei untypischen Fällen indiziert.
- Von einer diagnostischen Punktion im hausärztlichen Bereich zum Nachweis von Uratkristallen wird abgeraten.
- Die Serumharnsäure ist bei 1/3 der Patient*innen im akuten Anfall nicht erhöht.
- Eine Röntgenuntersuchung des betroffenen Gelenks wird bei klinischem Verdacht auf einen Gichtanfall nicht empfohlen.
ACP-Leitlinie
- Das American College of Physicians (ACP) empfiehlt eine Gelenkpunktion mit Analyse der Gelenkflüssigkeit auf Uratkristalle, wenn die klinische Beurteilung es zur differenzialdiagnostischen Beurteilung notwendig erscheinen lässt, auch wenn es in der primärmedizinischen Versorgung schwierig ist.8
- Nicht notwendig ist die Gelenkpunktion z. B. bei Patient*innen mit Podagra, Vorliegen von Risikofaktoren (wie Alter) und keinem Hinweis auf eine Hautverletzung.
- Cave: (relative) Kontraindikationen für Gelenkpunktion beachten, wie z. B. Antikoagulation, die bei älteren Patient*innen oft vorliegen
Differenzialdiagnosen
- Reaktive Arthritis
- Akute septische Arthritis
- Weichteilinfektion
- Trauma/Fraktur
- Phlegmone
- Rheumatoide Arthritis
- Bursitis, Tendinitis, Tendovaginitis
- Chondrokalzinose
Anamnese
- Akuter Gichtanfall
- Erstmalig treten Gichtanfälle normalerweise in nur einem Gelenk auf.
- Sie sind hyperakut und können die Betroffenen aus dem Schlaf reißen.
- Eine Belastung des Gelenks ist dann nahezu unmöglich, und bereits kleinste Berührungen sind unangenehm.
- Oft fand vor dem Anfall exzessiver Alkohol- und/oder Fleischgenuss statt (Feier).
- Zu 85 % ist das Großzehengrundgelenk betroffen.
- Zwischen den Anfällen durchlaufen die Patient*innen lange, beschwerdefreie Phasen.
- Chronische Phase
- Durch Uratablagerungen (Tophi) können chronische Beschwerden entstehen.
Klinische Untersuchung
- Rote, geschwollene, heiße, druckempfindliche und nur eingeschränkt bewegliche Gelenke
 Akuter Gichtanfall am Großzehengrundgelenk
Akuter Gichtanfall am Großzehengrundgelenk- Mitunter ähnelt das klinische Bild in den angrenzenden Gelenken oder dem Weichteilgewebe dem einer Arthritis.
- Welche Gelenke sind betroffen?
- Am häufigsten ist das Großzehengrundgelenk betroffen.
- Dann folgen in abnehmender Häufigkeit der Fuß, der Knöchel, das Knie und die Finger.
- Prinzipiell können sämtliche Gelenke betroffen sein.
- Weitere mögliche Manifestationen der Gicht sind eine Bursitis praepatellaris und eine Bursitis olecrani.
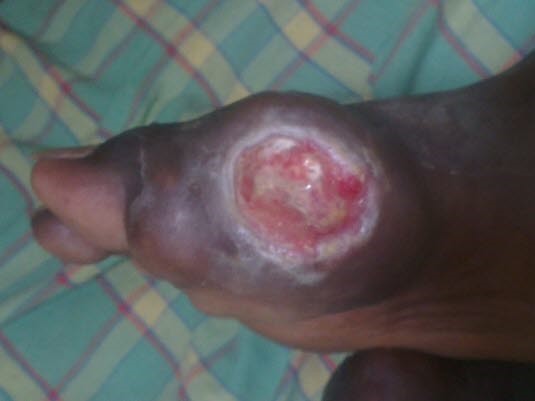 Chronische Gicht am Großzehengrundgelenk
Chronische Gicht am Großzehengrundgelenk - Prädilektionsstellen für Tophi (Uratablagerungen bei chronischem Verlauf): Zehen, Finger, Hand, Fuß, Ellenbogen und Ohren
Ergänzende Untersuchungen in der Hausarztpraxis
- Die Diagnose wird in der Regel klinisch gestellt, die nachfolgenden Laborwerte sind nicht zwingend zu untersuchen.
- Harnsäure im Serum
- nur bei 2/3 der Patient*innen im Anfall erhöht
Diagnostik bei Spezialist*innen (nur bei untypischen/unklaren Fällen)
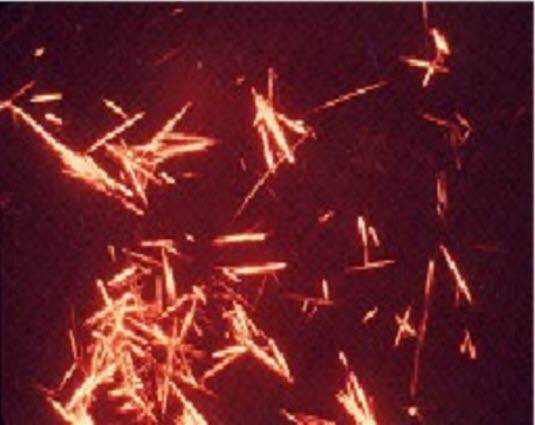
Nadelförmige Harnsäurekristalle unter dem Polarisationsmikroskop
- Gelenkpunktion bei unklarer Diagnose8
- zum definitiven Nachweis von Uratkristallen (beweisend für die Diagnose)
- Sonografie
- In der Arthrosonografie lassen sich das sog. Doppelkontur-Zeichen am Gelenkknorpel, Ablagerungen von Tophi, knöcherne Erosionen und Zeichen der Synovitis darstellen.
- Die Sensitivität der Sonografie liegt bei 76,9 % und die Spezifität bei 84,3 %, wobei die Sensitivität bei einer Krankheitsdauer von mehr als 2 Jahren höher ist.9
- Ggf. Dual-Energy-CT
- Die Dual-Energy-CT (DECT) bietet bei rezidivierenden Anfällen eine hohe Testgenauigkeit im Hinblick auf den Nachweis von Harnsäurekristallen.
- Die Sensitivität der DECT für die Diagnose Gichtarthritis ist im direkten Vergleich zur Sonografie etwas höher, während die Spezifität etwa gleich ist (bei der ersten Krankheitsepisode weniger genau, da nur Uratdepots > 1 mm3 zuverlässig erkannt werden).10
- Ggf. Röntgen der betroffenen Gelenke zum Ausschluss anderer Differenzialdiagnosen
- Skelettveränderungen treten erst nach vielen Jahren der Krankheit auf, wenn keine umfassende Behandlung erfolgt ist.
- Typische Veränderungen sind subkortikale Zysten ohne Erosionen.11
Indikationen zur Überweisung
- Die Behandlung der Erkrankung erfolgt in der Regel in der Hausarztpraxis.
- Bei Unsicherheit bezüglich der Diagnose Überweisung an Orthopäd*in zur Gelenkpunktion
Therapie
Therapieziele
- Akute Anfälle verkürzen
- Schmerzen lindern
- Fortschreiten der Gicht und neue Gichtanfälle vermeiden, evtl. Uratablagerungen abbauen und die Tophusbildung rückgängig machen
Allgemeines zur Therapie
- Akuter Gichtanfall
- Indikation zur frühzeitigen medikamentösen Therapie
- Chronische Hyperurikämie
- keine zwingende Indikation zur medikamentösen Therapie
- Zur Indikation für eine harnsäuresenkende Therapie siehe Abschnitt Häufige Gichtanfälle und chronische Gicht.
Akuter Gichtanfall
- Bis zum Abklingen der Symptome medikamentös therapieren (i. d. R. < 14 Tage)
- Frühzeitige medikamentöse Therapie (am besten innerhalb 12–24 h nach Schmerzbeginn)
- Gelenk ruhigstellen und kühlen
- Patient*innen über die Erkrankung und ihre Risikofaktoren (Ernährungsempfehlungen) aufklären (siehe Empfehlungen für Patient*innen)
- Eine harnsäuresenkende Therapie im akuten Anfall nicht beginnen oder verändern
- Beginn einer harnsäuresenkenden Therapie frühestens 2 Wochen nach Beginn des akuten Gichtanfalls
- Eine bereits bestehende harnsäuresenkende Therapie kann im akuten Gichtanfall fortgeführt werden.
Medikamentöse Therapie bei Anfällen
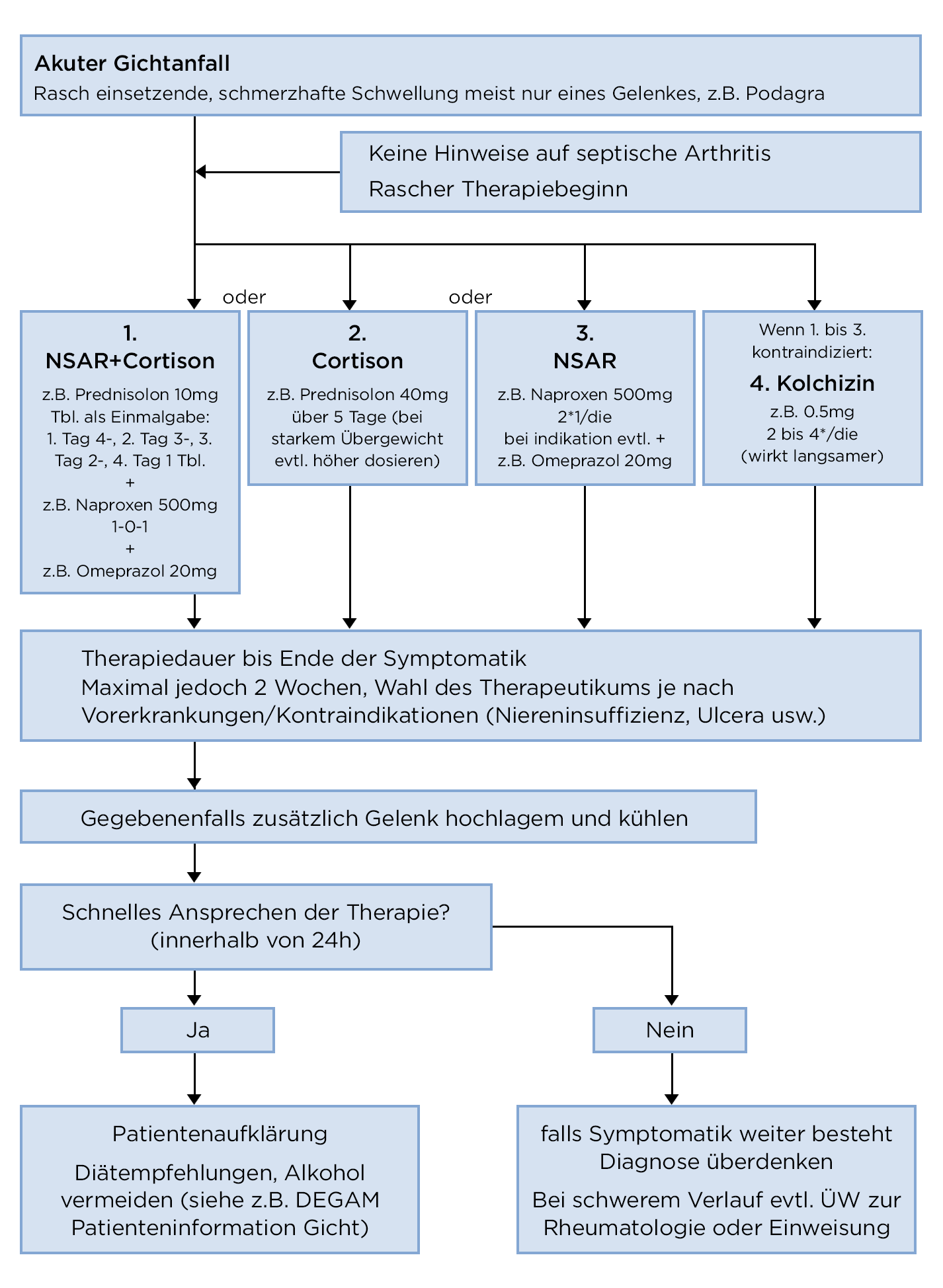
Algorithmus akute Gicht
- Patient*innen, die unter wiederkehrenden Anfällen leiden, können eine solche Therapie selbst durchführen.
- NSAR, COX-2-Hemmer, Kolchizin und Prednisolon haben eine vergleichbare Wirkung, wobei die Dokumentation unzureichend ist.12-13
- Prednisolon und NSAR gegenüber Kolchizin bevorzugen.
- NSAR13
- Durch eine frühzeitige Behandlung kann ein vollständiger Ausbruch abgewendet werden.
- Die Wahl des NSAR ist nicht entscheidend, wichtig ist der frühe Therapiebeginn.12
- COX-2-Hemmer wirken vergleichbar wie nichtselektive NSAR, werden aber besser vertragen als Diclofenac.14
- COX-2-Hemmer sollten nicht bei Patient*innen mit kardiovaskulären Erkrankungen angewendet werden.
- Die Therapie erfolgt in der Regel über eine Dauer von 2–5 Tagen mit einer hohen Dosis bzw. so lange, bis die Symptome verschwinden.
- Kolchizin
- Sind NSAR kontraindiziert, ist Kolchizin eine Alternative.15
- seit 2018 reduzierte Dosierungsempfehlung aufgrund der geringen therapeutischen Breite
- Todesfälle sind bereits nach Einnahme von nur 7 mg Kolchizin innerhalb von 4 Tagen beschrieben.
- Dosisempfehlung: eine Tagesdosis am 1. Tag von 2 mg, am 2. und 3. Tag 2–3 x 0,5 mg und am 4. Tag ggf. 2 x 0,5 mg bis zum Erreichen der Höchstdosis von 6 mg pro Gichtanfall
- seit 2018 reduzierte Dosierungsempfehlung aufgrund der geringen therapeutischen Breite
- Die Therapie muss innerhalb von 24 Stunden eingeleitet werden, um wirksam zu sein.
- Sind NSAR kontraindiziert, ist Kolchizin eine Alternative.15
- Prednisolon p. o.
- Die Wirkung von Prednisolon ist laut einer systematischen Übersichtsarbeit mit der von NSAR gleichwertig. Das Risiko für gastrointestinale Blutungen ist vergleichbar, jedoch treten weniger Dyspepsie, Übelkeit oder Erbrechen auf.16
- 40 mg/d über 5 Tage sind bzgl. Wirksamkeit sowie Nebenwirkungsprofil mit 2 x 500 mg Naproxen vergleichbar.17
Häufige Gichtanfälle und chronische Gicht
Harnsäuresenkende Pharmakotherapie: Indikation
- Erwogen werden sollte eine medikamentöse Senkung der Harnsäure:
- bei Patient*innen mit mindestens 2 Gichtanfällen/Jahr
- bei Patient*innen mit Uratablagerungen (Tophi, Uratnephrolithiasis) und/oder chronischer Gicht.
- Beginn
- erst nach vollständigem Abklingen der Symptome
- frühestens 14 Tage nach einem Gichtanfall
Durchführung
- Mittel der Wahl Allopurinol
- Anfangsdosis 100–300 mg/d
- Steigerung auf bis zu 800 mg/d möglich (Cave: Leber- und Niereninsuffizienz, Interaktionen!)
- bei Vorliegen einer Nieren- oder Leberinsuffizienz sollte die Dosierung von Allopurinol entsprechend der Fachinformation reduziert werden.
- Reservemittel, evtl. in Kombination mit Allopurinol, sind Probenecid und Benzbromaron.
- Vitamin C 500 mg/d p. o.
- Ob dadurch weniger Gichtanfälle auftreten, und wenn ja, ab wann dieser Effekt eintritt, ist unklar.
- Da diese Vitamin-C-Dosis als sicher gilt, kann in Einzelfällen eine orale Vitamin-C-Einnahme erwogen werden.
- Cave Febuxostat! Nur Reservemedikament für seltene, schwere, anders nicht behandelbare Uratablagerungen.
- erhöhte kardiovaskuläre und Gesamtsterblichkeit im Vergleich mit Allopurinol
Anfallsprophylaxe
- Wenn am Beginn einer harnsäuresenkenden Therapie z. B. wegen hoher Gichtlast eine Anfallsprophylaxe empfehlenswert erscheint
- NSAR (z. B. Naproxen 1 x 500 mg oder 2 x 250 mg/d, bei Risikopatient*innen Magenschutz erwägen) oder Kolchizin (0,5–1,2 mg/d)
- Für 2 bis maximal 6 Monate
- Eine Therapie mit Allopurinol sollte in den ersten 6 Monaten nicht ohne Kolchizin 2 x 0,5 mg/d erfolgen soll. Niedrigdosierte NSAR werden nur als Alternative bei Unverträglichkeit und Kontraindikationen gegen Kolchizin empfohlen.
Kontrolle des Harnsäureserumspiegels
- Indikationen
- wenn der Therapieerfolg durch die klinische Einschätzung der Gicht nicht ausreichend beurteilt werden kann
- um die Patientenmotivation zu erhöhen
- um die Therapieadhärenz zu überprüfen
- Zielwert
- Derzeit lässt sich aus den vorliegenden Studien kein bestimmter Grenzwert des Surrogatparameters für die Serumharnsäure allgemeingültig festlegen.
Beendigung
- Es kann erwogen werden, eine harnsäuresenkende Therapie nach 5 Jahren effektiver Therapie zu beenden.
Medikamentöse Therapie
- Allopurinol ist die 1. Wahl.
- Hemmt die Oxidation von Xanthin zu Harnsäure, wodurch wiederum die Harnsäureproduktion gehemmt wird. 18
- Es werden 1 x tgl. 100–300 mg verabreicht.
- Einige Patient*innen benötigen höhere Dosen (400–600 mg).
- In seltenen Fällen sind bis zu 800 mg täglich erforderlich.
- Überempfindlichkeit ist ein mögliches Problem. Bei Dosen von 300 mg und mehr besteht ein erhöhtes Risiko.19
- Es ist ratsam, die Dosis langsam, evtl. monatlich, zu steigern, um die Entwicklung einer Hypersensitivität zu vermeiden.19
- Probenecid
- Urikosurikum: Hemmung der renalen Reabsorption von Harnsäure
- Cave: Initial besteht ein erhöhtes Risiko einer Konkrementbildung in den Nieren (auf Trinkmenge achten!).
- Dosierung
- Anfangsdosis (1. Behandlungswoche): halbe Tablette (entsprechend 250 mg) 2 x/d
- dann 1 Tablette (entsprechend 500 mg) 2 x/d
- Die Wirkung von Probenecid hängt stark von der Nierenfunktion ab.
- Benzbromaron
- Urikosurium: Hemmung der renalen Reabsorption von Harnsäure
- Dosierung
- Einschleichend dosieren.
- Initialdosis: 20 mg Benzbromaron 1 x/d
- Erhaltungsdosis: 1 Tablette (100 mg Benzbromaron) 1 x/d
- Kontraindikationen: u. a. Leber- und Niereninsuffizienz
- Febuxostat
- Febuxostat ist ein Xanthinoxidase-Hemmer, gehört also derselben Stoffgruppe an wie Allopurinol, ist jedoch kein Purin-Derivat.20-21
- Die übliche Dosis beträgt 1 x tgl. 40–80 mg oral.
- Laut einer großen Studie mit über 6.000 Patient*innen erhöht Febuxostat bei Menschen mit Herz-Kreislauf-Erkrankungen die Mortalität signifikant im Vergleich zu Allopurinol.22
- Laut arznei-telegramm ist Febuxostat deshalb als striktes Reservemedikament anzusehen.
- Lesinurad
- Urikosurikum
- keine Monotherapie wegen nephrotoxischer Wirkung
- in Deutschland nicht zugelassen
- in Kombination mit Allopurinol effektive Senkung des Harnsäurespiegels, in manchen Ländern (USA, Österreich) zugelassen für therapierefraktäre Patient*innen23
Empfehlungen für Patient*innen
- Vermeidung von:
- Alkohol
- Bier und „Hochprozentiges“ geht dosisabhängig mit einem erhöhten Risiko von Gicht einher.
- Für Männer scheint 1/4 l und für Frauen 1/8 l Wein am Tag nicht mit vermehrtem Auftreten von Gicht einherzugehen.
- mit Zucker gesüßten Getränken
- sehr fettem Essen
- Alkohol
- Sämtliche Diätempfehlungen sind bisher nicht auf ihre Effektivität bezüglich patientenrelevanter Endpunkte hin untersucht.
- Empfohlen wird eine Ernährung mit einem hohen Anteil von Gemüse und einem geringen Fettgehalt (wie beim metabolischen Syndrom).13
- Hinweise dazu finden Sie auch in der Patienteninformation Puringehalt von Lebensmitteln.
- Es sollten gesundheitsfördernde Maßnahmen ergriffen werden, die der Entwicklung von Begleiterkrankungen wie Adipositas, metabolisches Syndrom, Hypertonie, Hyperlipidämie, Diabetes und chronische Nierenerkrankungen entgegenwirken.24-25
- Regelmäßige körperliche Aktivität13
- Aus einer Kohortenstudie mit männlichen Läufern/Joggern geht hervor, dass bei Männern, die körperlich aktiv sind, die ein ideales Körpergewicht halten und die eine obst- und gemüsereiche und fleisch- und alkoholarme Ernährung aufweisen, ein geringeres Gichtrisiko besteht.3
Prävention
- Prophylaktische Behandlung mit Allopurinol zur Vermeidung einer akuten Niereninsuffizienz bei Patient*innen, die eine Chemo- oder Strahlentherapie erhalten.
- Medikamente, die die Harnsäureausscheidung beeinträchtigen, vermeiden (Thiaziddiuretika und Salicylate).
- Thiazide erhöhen den Harnsäurespiegel und sollten bei Patient*innen mit Gicht durch ein anderes Medikament ersetzt werden, z. B. Kalziumantagonisten oder Losartan (Angiotensin-II-Antagonist).13
- Vitamin C
- Aus einer prospektiven Studie mit einer Beobachtungsdauer von 20 Jahren geht hervor, dass eine erhöhte Vitamin-C-Zufuhr mit einem geringeren Gichtrisiko assoziiert ist. Vitamin C wirkt urikosurisch und erhöht die Ausscheidung von Harnsäure.26
Verlauf, Komplikationen und Prognose
Verlauf
- Typisch für die Gicht sind akute Anfälle und lange Phasen der Remission.
- Nach der ersten akuten Episode können die Patient*innen über Monate oder Jahre beschwerdefrei sein, bei einigen treten jedoch auch häufige Anfälle auf. In Ausnahmefällen entwickeln sich eine chronische, tophische Gicht, dauerhafte Gelenkschädigungen oder beides.
- Ohne medikamentöse Therapie dauert der schmerzhafte Gichtanfall ca. 1–2 Wochen an.
- Verlauf bei fehlender Behandlung
- Nach 20 Jahren unbehandelter Gicht entwickeln 75 % der Patient*innen eine chronisch-tophöse Form.
- U. a. deswegen können Patient*innen mit Gicht erhebliche Einschränkungen ihrer körperlichen Funktionsfähigkeit – verbunden mit einer reduzierten Lebensqualität – entwickeln.
Komplikationen
- Polyarthritis
- Nierensteine
- Harnsäuresteine machen etwa 10 % aller Nierensteine aus.
- Chronische Niereninsuffizienz
- Problematisch ist, dass die Hyperurikämie zwar selbst nephrotoxisch wirkt und somit eine harnsäuresenkende Therapie potenziell indiziert ist, auf der anderen Seite jedoch die notwendige harnsäuresenkende Therapie bei chronischer Niereninsuffizienz nur deutlich dosisreduziert eingesetzt werden darf oder sogar kontraindiziert ist.
- Tophi
- Allopurinol-Hypersensitivitätssyndrom (AHS)
- Bei 2 % der Behandelten treten Hautausschläge auf, die unvermittelt und nicht vorhersehbar beginnen, bei 0,4 % davon in ein AHS mit Fieber, Eosinophilie und akutem Leber- und Nierenversagen übergehen, das wiederum bei 14–30 % tödlich verläuft.
- Septische Arthritis
- Die Gicht ist mit einem erhöhten Risiko einer bakteriellen Arthritis assoziiert.27
Kardiovaskuläre Erkrankungen bei Hyperurikämie
- Gicht zählt grundsätzlich als kardiovaskulärer Risikofaktor.
- Der Zusammenhang zwischen erhöhtem kardiovaskulärem Risiko und Gicht liegt nach aktuellem Forschungsstand an einer endothelialen Dysfunktion, die zum einen durch die Hyperurikämie und zum anderen durch einen durch Harnsäurekristalle induzierten Entzündungsprozess in den Gefäßen ausgelöst wird.
- 80 % der Patient*innen mit Gicht in Deutschland leiden auch unter einer arteriellen Hypertonie.28
- Kohortenstudien zufolge besteht bei Patient*innen mit Hyperurikämie ein erhöhtes relatives Risiko eines kardiovaskulär bedingten Todes und eines Herztodes (RR 1,4 bzw. 1,6).29-30
- In einer Auswahl von 1.189 Patient*innen aus Taiwan war bei Gicht-Patient*innen, die eine langfristige Hyperurikämie-Therapie erhielten, die Lebenserwartung insgesamt besser und das kardiovaskuläre Risiko geringer als bei den Patient*innen, die keine Langzeitbehandlung erhielten.31
- Eine Analyse von zwei prospektiven Kohortenstudien aus Dänemark ergab keinen kausalen Zusammenhang zwischen einer erhöhten Harnsäurekonzentration und koronaren Herzkrankheiten oder Hypertonie.32
- Die Studie identifizierte einen erhöhten BMI als wahrscheinlichen Confounder für die in der Vergangenheit nachgewiesene Assoziation.
Prognose
- Dank der heutigen Therapiemöglichkeiten können die meisten Patient*innen ein normales Leben führen, sofern die Diagnose früh genug gestellt wird.
- Bei Patient*innen mit fortgeschrittener Erkrankung kann die Behandlung zu einer gewissen Besserung der Beschwerden führen: Tophi können aufgelöst, die Gelenkfunktion verbessert und ein Nierenversagen verlangsamt werden.
- U-förmige Abhängigkeit zwischen dem Serumharnsäurespiegel und der Sterblichkeit33
- höchste Kategorie (Serumharnsäure ≥ 9,5 mg/dl für Männer und ≥ 8,5 mg/dl für Frauen) relatives Risiko für Versterben, insbesondere durch kardiovaskuläre Ereignisse, 2,39 (Männer) bzw. 3,77 (Frauen)
- niedrigste Kategorie (Serumharnsäure < 3,5 mg/dl für Männer und < 2,5 mg/dl für Frauen) relatives Risiko für Versterben 1,58 (Männer) bzw. 1,8 (Frauen)
- Vermutlich auf einen zusätzlich bestehenden Diabetes mellitus zurückzuführen.
- Ein schlecht eingestellter Diabetes mellitus hat durch die Hyperglykämie einen zusätzlichen urikosurischen Effekt, was niedrige Harnsäurewerte erklären könnte.
Verlaufskontrolle
- Die Patient*innen sollten bzgl. Komorbiditäten und kardiovaskulärer Risikofaktoren systematisch untersucht werden:13
- Nierenfunktion
- kardiovaskuläre Erkrankungen
- Hyperlipidämie
- Diabetes
- Rauchen
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Über Selbsttherapie in Form einer Ernährungsumstellung und einer Gewichtsreduzierung
Patienteninformationen in Deximed
Illustrationen

Akuter Gichtanfall am Großzehengrundgelenk
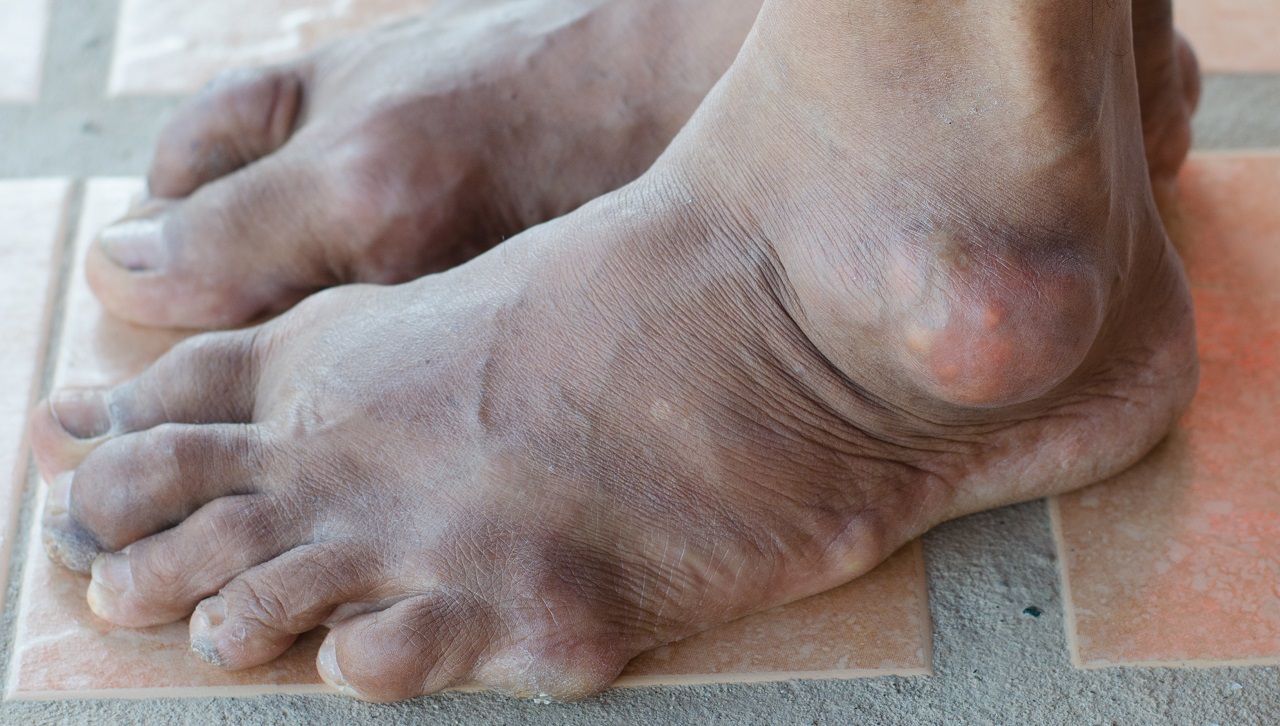
Ausgeprägter Befund mit Gichttophi
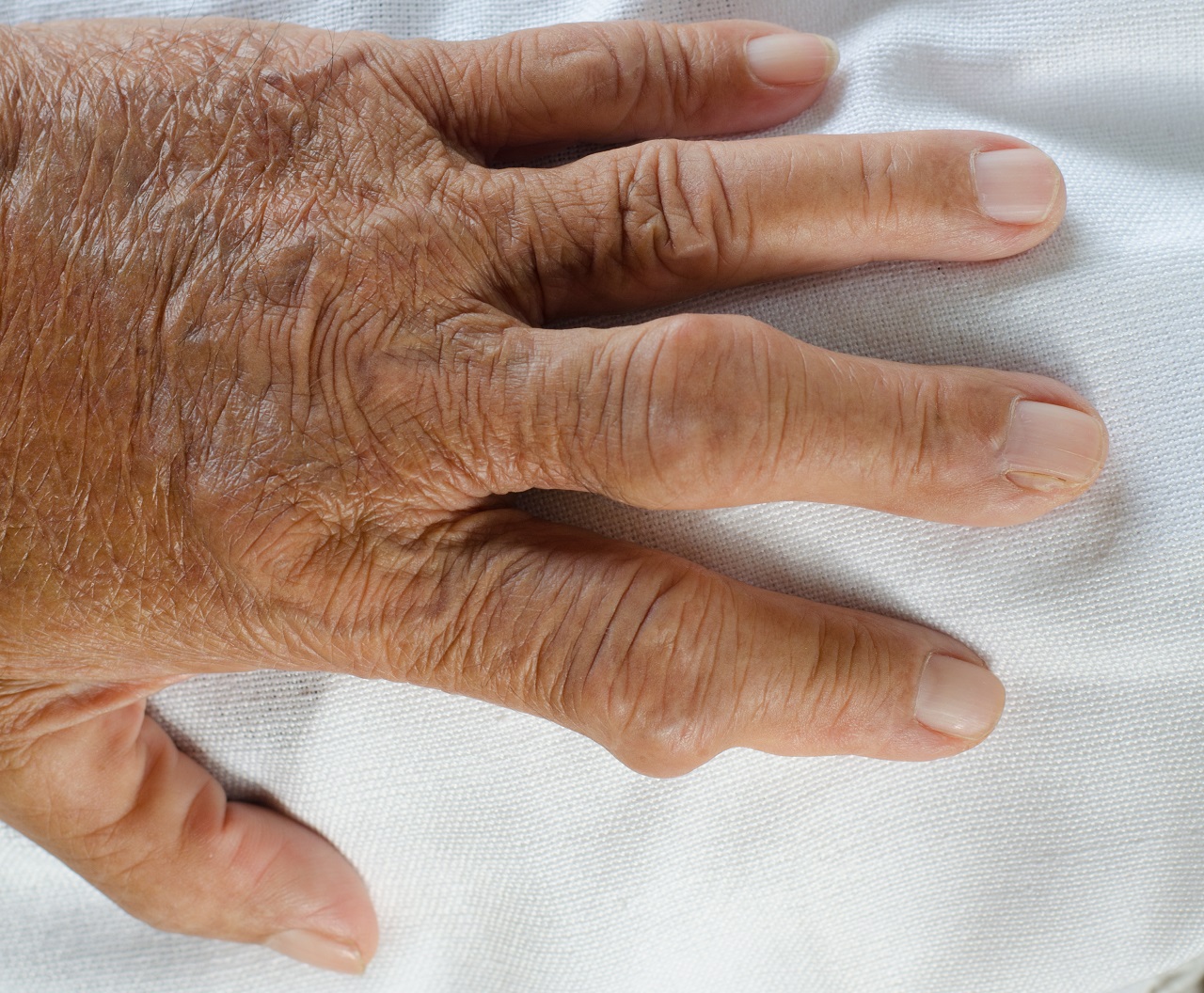
Gichttophi

Chronische Gicht am Großzehengrundgelenk

Bei Vorliegen einer Gicht sind unter dem Polarisationsmikroskop in der Gelenkflüssigkeit polymorphnukleäre Zellen sowie intra- und extrazelluläre nadelförmige Harnsäurekristalle erkennbar. Dies ist pathognomonisch.
Quellen
Literatur
- Dalbeth N, Stamp L. Hyperuricaemia and gout: time for a new staging system? Ann Rheum Dis, 2014. 73(9): p. 1598-600. www.ncbi.nlm.nih.gov
- Mikuls TR, Farrar JT, Bilker WB, et al. Gout epidemiology: results from the UK general practice research database, 1990-1999. Ann Rheum Dis 2005;64: 267-272. PubMed
- Williams PT. Effects of diet, physical activity and performance, and body weight on incident gout in ostensible healthy, vigorously active men. Am J Clin Nutr 2008; 87: 1480-7. PubMed
- Choi HK, Atkinson K, Karlson EW, Willett W, Curhan G. Purine-rich foods, dairy and protein intake, and the risk of gout in men. N Engl J Med 2004; 350: 1093-1103. PubMed
- Choi HK, Curhan G. Soft drinks, fructose consumption, and the risk of gout in men: prospective cohort study. BMJ 2008; 336: 309-12. pubmed.ncbi.nlm.nih.gov
- Choi HK, Willett W, Curhan G. Fructose-rich beverages and risk of gout in women. JAMA 2010; 304: 2270-8. pubmed.ncbi.nlm.nih.gov
- Emorinken A, Ugheoke AJ. Pyrazinamide-induced acute gouty arthritis: a case report. Int J Res Med Sci 2022; 10(2): 526-9. msjonline.org
- Qaseem A, McLean RM, Starkey M, et al. Diagnosis of Acute Gout: A Clinical Practice Guideline From the American College of Physicians. Annals of Internal Medicine 2017. www.acpjournals.org
- Ogdie A, Taylor WJ, Neogi T, et al. Performance of Ultrasound in the Diagnosis of Gout in a Multicenter Study: Comparison With Monosodium Urate Monohydrate Crystal Analysis as the Gold Standard. Arthritis Rheumatol 2017 Feb; 69(2): 429-438. pmid:27748084 PubMed
- Bongartz T, Glazebrook KN, Kavros SJ, et al. Dual-energy CT for the diagnosis of gout: an accuracy and diagnostic yield study. Ann Rheum Dis 2014. doi:10.1136/annrheumdis-2013-205095 DOI
- Underwood M. Diagnosis and management of gout. BMJ 2006; 332: 1315-9. PubMed
- van Durme CM, Wechalekar MD, Buchbinder R, et al. Non-steroidal anti-inflammatory drugs for acute gout. Cochrane Database Syst Rev 2014; 9: CD010120. pmid:25225849 PubMed
- Richette P, Doherty M, Pascual E, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis 2017 Jan; 76(1): 29-42. pmid:27457514 PubMed
- Zhang S, Zhang Y, Liu P, et al. Efficacy and safety of etoricoxib compared with NSAIDs in acute gout: a systematic review and a meta-analysis. Clin Rheumatol 2016 Jan; 35(1): 151-8. pmid:26099603 PubMed
- Sivera F, Andres M, Carmona L, et al. Multinational evidence-based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3e initiative. Ann Rheum Dis 2013. doi:10.1136/annrheumdis-2013-203325 DOI
- Billy CA, Lim RT, Ruospo M, Palmer SC, Strippoli GFM. Corticosteroid or Nonsteroidal Antiinflammatory Drugs for the Treatment of Acute Gout: A Systematic Review of Randomized Controlled Trials. J Rheumatol 2017 Aug ; pii: jrheum.170137: (Review) . pmid:28765243 PubMed
- Janssens HJEM, Janssen M, van de Lisdonk EH, et al. Use of oral prednisolone or naproxen for the treatment of gout arthritis: a double-blind, randomised equivalence trial. Lancet 2008; 371: 1854-60. PubMed
- Seth R, Kydd AS, Buchbinder R, et al. Allopurinol for chronic gout. Cochrane Database Syst Rev. 2014 Oct 14;10:CD006077. Cochrane (DOI)
- Stamp LK, Taylor WJ, Jones PB, et al. Starting dose is a risk factor for allopurinol hypersensitivity syndrome: A proposed safe starting dose of allopurinol. Arthritis Rheum 2012; 64: 2529-36. PubMed
- Becker MA, Schumacher HR Jr, Wortmann RL, et al. Febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase: a twenty-eight-day, multicenter, phase II, randomized, double-blind, placebo-controlled, dose-response clinical trial examining safety and efficacy in patients with gout. Arthritis Rheum 2005; 52: 916-23. PubMed
- Takano Y, Hase-Aoki K, Horiuchi H, et al. Selectivity of febuxostat, a novel non-purine inhibitor of xanthine oxidase/xanthine dehydrogenase. Life Sci 2005; 76: 1835-47. PubMed
- White WB, Saag KG, Becker MA, Borer JS, Gorelick PB, Whelton A, Hunt B, Castillo M, Gunawardhana L; CARES Investigators. Cardiovascular Safety of Febuxostat or Allopurinol in Patients with Gout. N Engl J Med. 2018 Mar 29;378(13):1200-1210. 29527974 www.ncbi.nlm.nih.gov
- Saag KG, Fitz-Patrick D, Kopicko J, et al. Lesinurad combined with allopurinol: randomized, double-blind, placebo-controlled study in gout subjects with inadequate response to standard of care allopurinol (a US-based study). Arthritis Rheumatol 2017; 69: 203–12. www.ncbi.nlm.nih.gov
- Khanna D, Fitzgerald JD, Khanna PP, et al; American College of Rheumatology. 2012 American College of Rheumatology guidelines for management of gout. Part 1: Systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care Res (Hoboken) 2012;64:1431-1446. PubMed
- Jordan KM, Cameron JS, Snaith M, et al. British Society for Rheumatology and British Health Professionals in Rheumatology Standards, Guidelines and Audit Working Group (SGAWG). British Society for Rheumatology and British Health Professionals in Rheumatology guideline for the management of gout. Rheumatology (Oxford) 2007;46:1372-1374. PubMed
- Choi KH, Gao X, Curhan G. Vitamin C intake and the risk of gout in men. Arch Intern Med 2009; 169: 502-7. PubMed
- Lim SY, Lu N, Choi HK. Septic arthritis in gout patients: a population-based cohort study. Rheumatology (Oxford) 2015; 54: 2095-9. PMID: 26170377 PubMed
- Kiltz U, Perez-Ruiz F, Uhlig T, et al. The Prevalence and Incidence of Gout, Its Associated Comorbidities and Treatment Pattern: An Epidemiological Study from Germany. ACR/ARHP Annual Meeting 2018. acrabstracts.org
- Choi HK, Curhan G. Independent impact of gout on mortality and risk for coronary heart disease. Circulation 2007; 116: 894-900. PubMed
- Krishnan E, Svendsen K, Neaton JD, Grandits G, Kuller LH; for the MRFIT Research Group. Long-term cardiovascular mortality among middle-aged men with gout. Arch Intern Med 2008; 168: 1104-10. PubMed
- Chen J-H, Lan J-L, Cheng C-F, et al. Effect of Urate-lowering Therapy on the Risk of Cardiovascular Disease and All-cause Mortality in Patients with Gout: A Case-matched Cohort Study. J Rheumatol 2015; 42: 1694-1701. doi:10.3899/jrheum.141542 DOI
- Palmer TM, Nordestgaard BG, Benn M, et al. Association of plasma uric acid with ischaemic heart disease and blood pressure: mendelian randomisation analysis of two large cohorts. BMJ 2013; 347: f4262. BMJ (DOI)
- Cho SK, Chang Y, Kim I, et al. U-Shaped Association Between Serum Uric Acid Level and Risk of Mortality: A Cohort Study. Arthritis Rheumatol 2018; 70(7): 1122-32. pubmed.ncbi.nlm.nih.gov
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung, Innere Medizin, Frankfurt