Czym są wrodzone wady serca?
Około 0,8% wszystkich noworodków rodzi się z wrodzoną wadą serca. Mogą to być wrodzone malformacje mięśnia sercowego, lub dużych naczyń krwionośnych wokół serca. Niektóre wady serca nie powodują żadnych objawów lub stają się zauważalne dopiero w trakcie rozwoju. Łagodne wrodzone wady serca zwykle nie mają wpływu na długość i jakość życia, natomiast ciężkie wady serca wymagają terapii i ewentualnie operacji. Wrodzone wady serca powstają w fazie rozwoju serca w łonie matki, np. z powodu szkodliwych wpływów zewnętrznych, takich jak zakażenia, alkoholizm, zaburzenia metaboliczne lub przyjmowanie niektórych leków. Za rozwój wad serca mogą odpowiadać również czynniki genetyczne, a także nieprawidłowości chromosomalne (np. zespół Downa). Może się zdarzyć, że nie zostanie znaleziona żadna przyczyna rozwoju wady serca.
Istnieją różne rodzaje wrodzonych wad serca, które mogą również występować łącznie. Zakres lub nasilenie obrazu klinicznego może być różne. Wady serca należą do najczęstszych wad wrodzonych.
Struktura i funkcja serca w stanie prawidłowym
Serce to rodzaj pompy, która zapewnia zaopatrzenie organizmu w krew. Składa się z dwóch przedsionków i dwóch komór. Drogę krwi można opisać w następujący sposób: odtlenowana krew dostaje się do prawego przedsionka przez żyłę główną dolną i górną. Następnie przepływa do prawej komory serca i wypełnia ją. Prawa komora aktywnie pompuje krew przez tętnice płucne do krążenia płucnego. Tutaj krew przesyłana jest przez maleńkie naczynia, które poprzez cienką błonę mają kontakt z wdychanym powietrzem. Krew jest teraz natlenowana i jednocześnie uwalnia dwutlenek węgla, który wydychamy. Krew z krążenia płucnego gromadzi się teraz w większych naczyniach i jest kierowana do lewego przedsionka przez żyły płucne. Stąd jest ona z kolei transportowana do lewej komory serca. Lewa komora pompuje teraz natlenowaną krew przez dużą tętnicę główną (aortę) do dużego strumienia krwi (krążenie systemowe). Tlen jest zużywany w obwodach ciała, a odtlenowana krew wraca do serca. Cykl zaczyna się od nowa.
Ukrwienie w łonie matki i po urodzeniu
Nienarodzone dziecko jest zaopatrywane w bogatą w natlenowaną przez łożysko za pośrednictwem pępowiny. W układzie krążenia dziecka istnieją połączenia skrótowe, tzw. shunty. Dzięki nim natlenowana krew może płynąć szybciej i lepiej docierać do organizmu dziecka. Tętnica płucna z kolei ma połączenie skrótowe z aortą, zwane przewodem tętniczym albo przewodem Botalla. W łonie matki drogę krwi można opisać w następujący sposób: natlenowaną krew, doprowadzoną do prawego serca przez pępowinę, pompuje prawa komora do tętnicy płucnej. Stąd krew kierowana jest przez przewód tętniczy do aorty i w ten sposób trafia do krążenia ogólnego. Krew jest więc celowo prowadzona tak, aby omijała płuca, ponieważ w łonie matki dziecko nie może ich jeszcze wykorzystywać. Ciało korzysta z bezpośredniego dopływu natlenowanej krwi bez konieczności dokonywania „objazdów” przez płuca.
Po urodzeniu te połączenia skrótowe są stopniowo zamykane. Dziecko może teraz samodzielnie dotleniać krew poprzez oddychanie i nie potrzebuje połączeń skrótowych.
Przetrwały przewód tętniczy (PDA)
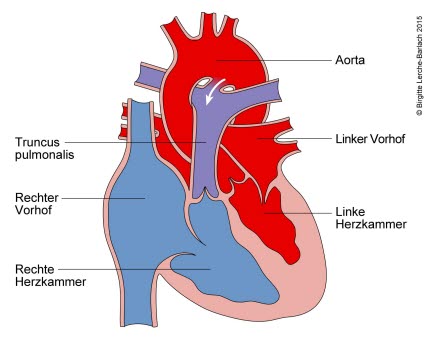
Prawidłowo przewód tętniczy pozostaje otwarty do około 3 dni po urodzeniu. Jeśli przewód tętniczy nie zamyka się po tym czasie, połączenie to nazywane jest przetrwałym przewodem tętniczym. Ponieważ płuca są teraz wykorzystywane, opór w krążeniu płucnym zmniejsza się i ciśnienie tętnicze spada. W krążeniu ogólnym jest teraz wyższe ciśnienie tętnicze. Ponieważ krew zawsze przepływa z obszarów o wyższym ciśnieniu do obszarów o niższym ciśnieniu, przepływ w przewodzie tętniczym jest teraz odwrócony (patrz ilustracja). Krew pokonuje następującą trasę: Utlenowana krew z lewego serca jest pompowana do aorty i do organizmu, ale przez połączenie skrótowe dociera również do tętnicy płucnej, przez co w naczyniach płucnych powstaje dodatkowe obciążenie objętościowe i ciśnieniowe. Z naczyń płucnych więcej krwi dociera teraz także do lewego przedsionka, który z kolei w większym stopniu wypełnia lewą komorę. Lewa komora reaguje zwiększeniem grubości ściany (przerost). Dodatkowo w czasie napełniania serca (rozkurcz) dochodzi do zmniejszenia ukrwienia w obszarze krążenia ogólnego. W przypadku niewielkiej objętości, która jest tracona przez PDA (objętość shuntu), objawia się to zmniejszonym przepływem krwi do rąk i stóp. Duża objętość shuntu może prowadzić do zmniejszenia przepływu krwi do narządów.
W miarę postępu choroby krążenie płucne reaguje na podwyższone ciśnienie skurczem naczyń i przebudową tkanek, tak że rozwija się nie dające się odwrócić nadciśnienie płucne. Ciśnienie w prawej komorze staje się teraz tak duże, że przepływ krwi odwraca się i przepływa ona z tętnicy płucnej do aorty (zespół Eisenmengera). Do aorty wpływa krew uboga w tlen, co może uwidocznić się na skórze jako niebieskie zabarwienie (sinica),
Przetrwały przewód tętniczy jest trzecią do czwartej najczęstszą wadą serca i występuje u około 1 na 2000 urodzeń. Występuje szczególnie często u wcześniaków.
Przyczyna
Dokładny mechanizm rozwoju PDA nie został jeszcze wyjaśniony. Szczególnie u wcześniaków PDA jest spowodowane brakiem dojrzewania. U dojrzałych noworodków istnieją częściowo genetyczne przyczyny rozwoju PDA. Nieprawidłowości chromosomalne, np. zespół Downa, często powodują wady serca. Jeśli rodzice lub rodzeństwo mają lub mieli wrodzone wady serca, zwiększa się ryzyko, że u kolejnych dzieci również wystąpi wada serca.
Istnieją również czynniki zewnętrzne, które mogą powodować wady serca, np. zakażenia lub przyjmowanie niektórych leków w czasie ciąży. Jednym z przykładów jest zakażenie różyczką. Ponadto spożywanie alkoholu przez matkę prawdopodobnie zwiększa ryzyko wystąpienia wad serca u dziecka.
Przyczyną wrodzonych wad serca mogą być również przewlekłe choroby matki, np. cukrzyca. Ryzyko może być zmniejszone dla tej choroby, jeśli poziom glukozy we krwi jest dobrze ustawiony przed i w czasie ciąży.
Diagnostyka
PDA jest zwykle wykrywane na podstawie wyglądu klinicznego lub badań. W badaniu fizykalnym szmery serca lub silne pulsowanie na rękach lub nogach mogą wskazywać na PDA. Niewydolność serca (niewydolność serca) może objawiać się np. dusznością, przyspiszonym rytmem serca i nieprzybieraniem na wadze.
PDA można uwidocznić za pomocą badania USG serca (echokardiografii). Pozwala ona ocenić, ile krwi przepływa przez PDA w czasie oraz funkcję i strukturę lewej komory serca. Dodatkowo, echokardiografia może być wykorzystana do kontroli przebiegu, aby zobaczyć, czy terapia przyniosła efekt, czy też PDA zamknął się samoistnie. Z reguły pobiera się również krew. Także EKG może wykazać nieprawidłowości w przypadku PDA. Rzadko wykonuje się kolejne badania specjalistyczne, np. cewnikowanie serca.
Terapia
Celem terapeutycznym jest rozpoznanie i leczenie choroby tak, aby można było uniknąć powikłań takich jak niewydolność serca. Wcześniaki są zwykle leczone lekami (indometacyna lub ibuprofen), które mają spowodować zamknięcie PDA. W pozostałych przypadkach terapia zależy od wieku dziecka i rozległości objętości shuntu. W przypadku niewielkiego PDA, który nie powoduje szmerów w sercu, zwykle nie jest konieczna żadna terapia. Czasami można spróbować poczekać, aż PDA zamknie się sam. W innych przypadkach najrozsądniejsze jest zamknięcie zabiegowe. Można to zrobić chirurgicznie lub przez cewnik sercowy, np. także wtedy, gdy farmakoterapia nie przyniosła rezultatów.
Po operacji i wszczepieniu sztucznego materiału istnieje zwiększone ryzyko wystąpienia zapalenia wewnętrznych ścian serca (zapalenie wsierdzia), dlatego przez 6 miesięcy podaje się antybiotyki (profilaktyka zapalenia wsierdzia).
Rokowanie
Po wczesnym zamknięciu PDA bez istotnych chorób wtórnych rokowanie jest znakomite. U wcześniaków o rokowaniu decydują głównie choroby wtórne.
Dodatkowe informacje
- Wrodzone wady serca
- Szmery serca u dzieci
- Cewnikowanie serca u dzieci
- Zapalenie wsierdzia
- Przetrwały przewód tętniczy — informacje dla personelu medycznego
- Wrodzone wady serca — informacje dla personelu medycznego
Inne wrodzone wady serca
- Tetralogia Fallota
- Ubytki w przegrodach u dzieci: ubytek w przegrodzie międzyprzedsionkowej (ASD) i ubytek w przegrodzie międzykomorowej (VSD)
- Zespół niedorozwoju lewego serca
- Przełożenie wielkich naczyń
Autorzy
- Marleen Mayer, lekarka, Mannheim
Link lists
Authors
Previous authors
Updates
Gallery
Snomed
References
Based on professional document Wrodzone wady serca. References are shown below.
- European Society of Cardiology. Management of adult congenital heart disease. Stand 2020. www.escardio.org
- Saenz RB, Beebe DK, Triplett LC. Caring for infants with congential heart disease and their families. Am Fam Phys 1999. pubmed.ncbi.nlm.nih.gov
- Gelb B, Chung W. Complex Genetics and the Etiology of Human Congenital Heart Disease. Cold Spring Harb Perspect Med 2014; 4: a013953. www.ncbi.nlm.nih.gov
- Sifrim A, Hitz M, Wilsdon A, et al. Distinct genetic architectures for syndromic and nonsyndromic congenital heart defects identified by exome sequencing. Nat Genet 2016; 48: 1060–1065. doi:10.1038/ng.3627 DOI
- Narchi H, Kulaylat N. Heart disease in infants of diabetic mothers. Images Paediatr Cardiol 2000; 2: 17–23. pmid:22368579 PubMed
- Levy H, Guldberg P, Güttler F, et al. Congenital heart disease in maternal phenylketonuria: report from the Maternal PKU Collaborative Study. Pediatr Res 2001;49:436-442. doi:11328945 www.ncbi.nlm.nih.gov
- Yang J, Qiu H, Qu P, et al. Prenatal Alcohol Exposure and Congenital Heart Defects: A Meta-Analysis. PLoS One 2015; 10: e0130681. doi:10.1371/journal.pone.0130681 DOI
- Ionescu-Ittu R, Marelli AJ, Mackie AS, Pilote L. Prevalence of severe congenital heart disease after folic acid fortification of grain products: time trend analysis in Quebec, Canada. BMJ 2009; 338: b1673. BMJ (DOI)
- Lynch T, Abel D. Teratogens and Congenital Heart Disease. J Diagn Med Sonogr 2015;31:310-305. doi:10.1177/8756479315598524 DOI
- Wiesel A, Stolz G, Queisser-Wahrendorf A. Evidence for a teratogenic risk in the offspring of health personnel exposed to ionizing radiation?! Birth Defects Res A Clin Mol Teratol 2016; 106: 475-479. doi:10.1002/bdra.23532 www.ncbi.nlm.nih.gov
- Dolk H, McCullough N, Callaghan S, et al. Risk factors for congenital heart disease: The Baby Hearts Study, a population-based case- control study. PLoS ONE 2020; 15: e0227908. doi:10.1371/journal.pone.0227908 DOI
- De-Wahl Granelli A, Wennergren M, Sandberg K, et al. Impact of puls oximetry screening on the detection of duct dependent congenital heart disease: a Swedish prospective screening study in 39821 newborns. BMJ 2009; 338: a3037. BMJ (DOI)
- Ho VB. Radiologic Evaluation of suspected congenital heart disease in adults. Am Fam Physician 2009; 80: 597-602. American Family Physician
- Punnoose A, Burke A, Golub R. Innocent (Harmless) Heart Murmurs in Children. JAMA 2012; 308: 305. doi:10.1001/jama.2012.6223 DOI
- Giuffre RM, Walker I, Vaillancourt S, et al. Opening Pandoras's box: parental anxiety and the assessment of childhood murmurs. Can J Cardiol 2002; 18: 406-14. www.ncbi.nlm.nih.gov
- Diller GP, Breithardt G, Baumgartner H. Congenital heart defects in adulthood. Dtsch Arztebl Int 2011; 108: 452-459. doi:10.3238/arztebl.2011.0452 DOI
- Hernandez A, Paul T, Abrams D, et al. Arrhythmias in congenital heart disease: a position paper of the European Heart Rhythm Association (EHRA), Association for European Paediatric and Congenital Cardiology (AEPC), and the European Society of Cardiology (ESC) Working Group on Grown-up Congenital Heart Disease, endorsed by HRS, PACES, APHRS, and SOLAECE. Europace 2018; 20: 1719-1720. doi:10.1093/europace/eux380 DOI
- Vigl M, Kaemmerer M, Seiffert-Klaus V, et al. Contraception in women with congenital heart disease. Am J Cardiol 2010; 106: 1317-1321. doi:10.1016/j.amjcard.2010.06.060 DOI

