Streszczenie
- Definicja: Choroba refluksowa przełyku (Gastro Esophageal Reflux Disease – GERD) występuje wtedy, gdy refluks treści żołądkowej powoduje uciążliwe objawy i/lub powikłania.
- Epidemiologia: GERD występuje u 10–25% dorosłej populacji.
- Objawy: Typowe objawy to zgaga, odbijanie kwaśną treścią i cofanie się treści żołądkowej do przełyku (regurgitacja).
- Diagnostyka: Objawy kliniczne, rozpoznanie potwierdzone endoskopowo, ewentualnie uzupełnione 24–godzinną pH–metrią z impedancją i manometrią.
- Leczenie: Zmiana stylu życia, farmakoterapia najczęściej inhibitorami pompy protonowej, ewentualnie lekami zobojętniającymi. Czas trwania i intensywność farmakoterapii w zależności od nasilenia objawów choroby i jej powikłań. Rzadko występują wskazania do leczenia chirurgicznego (fundoplikacja laparoskopowa).
Informacje ogólne
Definicja
- Choroba refluksowa przełyku (Gastro Esophageal Reflux Disease – GERD) występuje wtedy, gdy patologiczny refluks treści żołądkowej do przełyku powoduje uciążliwe objawy i/lub powikłania.
Epidemiologia
- GERD
- Najczęstsza choroba przełyku.
- Najczęstsza choroba przewodu pokarmowego (obok próchnicy i zakażenia Helicobacter pylori).
- Ogólna chorobowość
- Częstość występowania w Europie wynosi 8,8–25,9%.1
- Wzrost chorobowości w ostatnich dekadach.
- Płeć
- Zbliżona chorobowość u mężczyzn i kobiet.2
- U mężczyzn jest zwiększone ryzyko wystąpienia nadżerkowego zapalenia przełyku (2–krotnie), przełyku Barretta (10–krotnie) i raka przełyku (8–krotnie).2
- Zbliżona chorobowość u mężczyzn i kobiet.2
- Wiek
- Nie potwierdzono zależności pomiędzy częstością występowania a wiekiem.
- Wraz z wiekiem:
- zmniejsza się nasilenie typowych objawów refluksu
- wzrasta nasilenie zapalenia przełyku i objawów nietypowych (np. dysfagii).
- Może wystąpić również u dzieci (zobacz artykuł choroba refluksowa przełyku u dzieci).
Perspektywa w praktyce lekarza rodzinnego
- GERD jest złożoną chorobą, w której nie ma „złotego” standardu diagnostycznego i istnieją nierozstrzygnięte problemy terapeutyczne.
- Należy unikać trywializacji, obejmującej np. następujące przekonania:
- GERD = zgaga
- endoskopia rzadko wymagana
- leczenie: IPP dla wszystkich i długookresowo.
Etiologia i patogeneza
- GERD jest złożonym schorzeniem o niejednorodnych objawach i wielopostaciowym podłożu patogenetycznym.3
- W aktualnej koncepcji patofizjologicznej podkreśla się rolę przejściowej relaksacji dolnego zwieracza przełyku z cofaniem się treści żołądkowej do dystalnego odcinka przełyku, powodujących objawy i/lub zmiany w błonie śluzowej.
- Zmiany anatomiczne (np. przepuklina wślizgowa rozworu przełykowego) mogą nasilać dolegliwości, ale nie muszą występować.
- Cofająca się treść żołądkowa powoduje:
- Poszerzenie szczelin w przestrzeniach międzykomórkowych i przenikanie treści żołądkowej do nabłonka.
- Pobudzenie zakończeń nerwowych z wyzwoleniem objawów
- O nasileniu objawów decyduje również indywidualny miejscowy próg pobudzenia oraz mechanizmy OUN.
- Ewentualnie uszkodzenie nabłonka w postaci nadżerek i owrzodzeń
- U niektórych pacjentów rozwija się przełyk Barretta (metaplazja komórek walcowatych jako zmiana przednowotworowa).
- GERD jest obecnie rozumiany jako termin ogólny, obejmujący różne fenotypy o złożonej patofizjologii.4
- Nasilenie objawów zależy od wielu czynników, takich jak:5
- liczba epizodów refluksu
- proksymalny zasięg refluksu
- kwasowość cofającej się treści
- nadwrażliwość przełyku
- nadmierne wyczulenie na objawy (cognitive hypervigilance).
- Przekłada się to na dużą różnorodność obrazu klinicznego.
- Brak ścisłego związku między objawami a zmianami chorobowymi.
- Objawy i zmiany chorobowe mogą występować niezależnie od siebie lub łącznie.
- Znaczenie zakażenia Helicobacter pylori
- Ujemny związek między zakażeniem Helicobacter pylori a chorobą refluksową.
- Przełyk Barretta oraz gruczolakorak przełyku również występują rzadziej przy zakażeniu Helicobacter pylori.
Objawy fenotypowe
- Nienadżerkowa choroba refluksowa (non–erosive reflux disease – NERD)
- Dolegliwości refluksowe z pogorszeniem jakości życia, ale bez zmian wykrywalnych endoskopowo.
- U połowy pacjentów z NERD nie występuje patologiczne zarzucanie treści żołądkowej i można ich dalej podzielić na 2 podgrupy:
- nadwrażliwy przełyk: związek objawów z fizjologicznymi epizodami refluksu
- zgaga czynnościowa: zgaga bez związku z refluksem.
- Nadżerkowe refluksowe zapalenie przełyku (erosive esophageal reflux disease – ERD) o różnym stopniu ciężkości
- zmiany wykrywalne endoskopowo (nadżerki, zwężenie przełyku).
- Powikłania GERD:
- przełykowe: zwężenia, przełyk Barretta
- pozaprzełykowe: zapalenie krtani, przewlekły kaszel, astma, nadżerki szkliwa zębów.
Klasyfikacja montrealska6
- Zespoły przełykowe
- Zespoły objawowe:
- Typowy zespół refluksowy:
- zgaga
- odbijanie kwaśną treścią
- cofanie się treści żołądkowej do przełyku (regurgitacja).
- Refluksowy zespół bólowy klatki piersiowej
- ból za mostkiem lub w klatce piersiowej (patrz także artykuł niesercowy ból w klatce piersiowej)
- często klinicznie trudny do odróżnienia od bólu dławicowego.
- Typowy zespół refluksowy:
- Zespoły ze zmianami w przełyku:
- refluksowe zapalenie przełyku
- zwężenie przełyku
- przełyk Barretta
- rak przełyku.
- Zespoły objawowe:
- Zespoły pozaprzełykowe
- Udowodniony związek z refluksem:
- refluksowy zespół kaszlowy
- refluksowy zespół krtaniowy
- refluksowy zespół astmatyczny
- refluksowy zespół nadżerek zębowych.
- Możliwy związek z refluksem:
- zapalenie zatok przynosowych
- zapalenie gardła
- nawracające zapalenie ucha środkowego
- idiopatyczne zwłóknienie płuc.
- Udowodniony związek z refluksem:
Czynniki predysponujące
- Czynniki genetyczne (dodatni wywiad rodzinny).
- Nadwaga, otyłość.7
- Nawyki żywieniowe (posiłki o dużej objętości, wysokotłuszczowe/niskobłonnikowe, szybkie spożywanie posiłków).
- Nikotynizm.
- Alkohol.
- Choroby psychiczne, np. zaburzenia lękowe, depresja.
- Ciąża.
- Przepuklina rozworu przełykowego.
- Leki, m.in.:
- substancje o działaniu rozluźniającym na dolny zwieracz przełyku (antagoniści kanału wapniowego, leki antycholinergiczne, teofilina, azotany)
- leki powodujące gastroparezę (opiaty, glikokortykosteroidy).
- Helicobacter pylori nie jest czynnikiem ryzyka choroby refluksowej przełyku.2
ICD–10
- K21 Choroba refluksowa żołądkowo–przełykowa.
- K21.0 Refluks żołądkowo–przełykowy z zapaleniem przełyku.
- K21.9 Zarzucanie żołądkowo–przełykowe bez zapalenia przełyku.
Diagnostyka
Kryteria diagnostyczne
- Brak złotego standardu diagnostycznego.
- W postępowaniu diagnostycznym przyjmuje się, że objawy lub zmiany chorobowe są spowodowane zarzucaniem treści żołądkowej.
- W praktyce rozpoznanie stawiane jest często na podstawie obecności dokuczliwej zgagi i/lub regurgitacji.
- Należy zatem rozróżnić między:
- potwierdzonym GERD (wymaga diagnostyki instrumentalnej)
- dolegliwościami refluksowymi (ocena kliniczna, ale diagnostycznie tylko umiarkowanie wiarygodna).
- Należy zatem rozróżnić między:
Potwierdzenie rozpoznania GERD według klasyfikacji Lyon3
Potwierdzona GERD
- Endoskopia
- ciężkie refluksowe zapalenie przełyku (stopnia C lub D według klasyfikacji Los Angeles)
- pozapalne zwężenie przełyku
- potwierdzona histologicznie metaplazja >1 cm w przypadku przełyku Barretta.
- 24-godzinna ph–metria z impedancją
- całkowity czas ekspozycji na działanie kwasu >6%.
Graniczna GERD
- Endoskopia
- łagodne refluksowe zapalenie przełyku (stopnia A lub B według klasyfikacji Los Angeles).
- 24–godzinna ph–metria z impedancją
- czas ekspozycji na działanie kwasu 4–6%
- liczba epizodów refluksu: 40–80.
Wykluczenie GERD
- Endoskopia
- brak zmian.
- 24–godzinna ph–metria z impedancją
- czas ekspozycji na działanie kwasu <4%
- liczba epizodów refluksu: <40.
Kliniczne podejrzenie rozpoznania GERD (dolegliwości refluksowe)
- Podejrzenie rozpoznania na podstawie występujących objawów.
- Należy zwrócić uwagę na typowe objawy refluksu (zgaga, odbijanie kwaśną treścią, regurgitacja).
- Występują często.
- Niska czułość i swoistość.
- GERD uznaje się za prawdopodobną, gdy:
- Typowe objawy refluksu występują co najmniej 1–2 x w tygodniu oraz
- Towarzyszy im pogorszenie jakości życia.
- Jeśli zgaga jest wiodącym objawem klinicznym, prawdopodobieństwo GERD jest stosunkowo wysokie.
- Odpowiedź na IPP (inhibitory pompy protonowej) nie jest wiarygodnym kryterium diagnostycznym.
- Jeśli objawy są niejasne, nie należy prowadzić empirycznej terapii IPP w celu diagnostycznym, lecz przeprowadzić dalsze badania.
- Niezależnie od tego, empiryczna terapia IPP jest często stosowana w przypadku typowych dolegliwości refluksowych.
Diagnostyka różnicowa
- Inne choroby przebiegające z bólem w klatce piersiowej, niesercowym bólem w klatce piersiowej.
- Choroba wrzodowa.
- Dyspepsja czynnościowa.
- Zespół jelita drażliwego.
- Rak przełyku.
- Eozynofilowe zapalenie przełyku.
- Achalazja.
- Uchyłki przełyku.
- Twardzina układowa.
- Kamica żółciowa.
- Zespół Zollingera–Ellisona.
- Choroby psychosomatyczne.
Wywiad
Objawy
- Typowe objawy:
- zgaga
- odbijanie kwaśną treścią
- cofanie się treści żołądkowej do przełyku (regurgitacja).
- Inne możliwe objawy związane z refluksem:
- bóle nadbrzusza
- ból w klatce piersiowej (również zamostkowy)
- uczucie pieczenia w gardle
- uporczywy kaszel
- poranne odchrząkiwanie
- zachrypnięty głos
- chrypka
- napady astmy.
- Objawy ostrzegawcze:
- dysfagia/odynofagia
- utrata masy ciała
- ból brzucha budzący ze snu
- krwawe/fusowate wymioty
- smoliste stolce
- niedokrwistość.
- Inne czynnościowe dolegliwości przewodu pokarmowego:
- objawy dyspepsji (niestrawności)
- objawy jelita drażliwego.
- Czynniki predysponujące:
- wywiad rodzinny
- nadwaga, otyłość
- nawyki żywieniowe (posiłki o dużej objętości, wysokotłuszczowe)
- nikotynizm
- spożywanie alkoholu.
- Leki (mogą wywołać GERD poprzez rozluźnienie dolnego zwieracza przełyku lub nasilić objawy choroby):
- antagoniści kanału wapniowego
- preparaty zawierające nitroglicerynę
- teofilina
- leki przeciwcholinergiczne
- agoniści receptorów beta–adrenergicznych
- benzodiazepiny i inne leki nasenne
- preparaty estrogenowe w hormonalnej terapii zastępczej po menopauzie.
Badanie fizykalne
- Masa ciała, wzrost (BMI)
- Otyłość jest czynnikiem predysponującym, niezamierzona utrata masy ciała jest objawem alarmowym.
- Bladość
- Niedokrwistość jest objawem alarmowym.
- Powiększone węzły chłonne szyjne
- U 10–28% pacjentów z rakiem przełyku.
- Nadżerki na zębach.
Badania uzupełniające w praktyce lekarza rodzinnego
Badania laboratoryjne
- Morfologia krwi (niedokrwistość)
- żelazo, ferrytyna.
- Badanie na obecność krwi w stolcu (kał na krew utajoną).
- Diagnostyka w kierunku zakażenia Helicobacter pylori
- Choroba refluksowa przełyku nie jest wskazaniem do badania na obecność H. pylori.
- Wytyczne gastroenterologiczne zalecają obecnie wykonanie badań w kierunku H. pylori u pacjentów z planowaną lub długotrwałą terapią IPP.
- Wynika to z faktu, że długotrwała terapia IPP u pacjentów zakażonych H. pylori wiąże się ze zwiększonym ryzykiem wystąpienia zanikowego zapalenia żołądka. Dyskusyjne jest, czy dotyczy to również dalszej progresji do nowotworu żołądka, zatem realizacja tego zalecenia nie wydaje się obecnie obowiązkowa.
Diagnostyka gastroenterologiczna
Endoskopia (EGD = ezofagogastroduodenoskopia)
- Standardowa procedura diagnostyczna refluksowego zapalenia przełyku, przełyku Barretta, zwężenia przełyku.
- Rozpoznanie nadżerkowego refluksowego zapalenia przełyku, jeżeli występują typowe objawy makroskopowe: plamiste, pasmowate lub nakładające się nadżerki w dystalnym odcinku przełyku.
- Dalsza diagnostyka nie jest konieczna ze względu na wysoką swoistość tych zmian.
- Podział refluksowego zapalenia przełyku według klasyfikacji Los Angeles:8
- stopień A: ubytki błony śluzowej nie dłuższe niż 5 mm i nie łączące się ze sobą
- stopień B: ubytki błony śluzowej dłuższe niż 5 mm i nie łączące się ze sobą
- stopień C: ubytki błony śluzowej łączą się ze sobą pomiędzy fałdami, obejmując mniej niż 75% obwodu przełyku
- stopień D: ubytki błony śluzowej łączą się ze sobą pomiędzy fałdami, obejmując ponad 75% obwodu przełyku.
- Ewentualnie potwierdzenie przepukliny rozworu przełykowego.
Biopsja
- W typowym refluksowym zapaleniu przełyku nie ma potrzeby pobierania biopsji z przełyku.
- Biopsję należy wykonywać przy podejrzeniu:
24–godzinna pH–metria z impedancją
- Złoty standard diagnostyki i określania charakterystyki epizodów refluksowych
- odstawienie IPP co najmniej 7 dni, a najlepiej 14 dni przed badaniem.
- 24–godzinny pomiar za pomocą sondy w przełyku:
- wartości pH
- liczby i czasu trwania epizodów refluksu.
- Najważniejszym parametrem jest czas ekspozycji na kwas (AET)/24 godziny.
- Wartości odcięcia w diagnostyce czynnościowej:
- Potwierdzenie patologicznego refluksu żołądkowo–przełykowego
- AET >6%
- >80 epizodów refluksu/24 godziny.
- Wykluczenie patologicznego refluksu żołądkowo–przełykowego
- AET <4%
- >40 epizodów refluksu/24 godziny.
- Potwierdzenie patologicznego refluksu żołądkowo–przełykowego
- Udokumentowanie zależności między objawami a epizodami refluksu.
- Umożliwia ocenę refluksu niekwaśnego.
Manometria
- Konieczna tylko w niektórych przypadkach, np. diagnostyka różnicowa u pacjentów opornych na IPP lub ocena przed leczeniem zabiegowym.
- Ocena dolnego zwieracza przełyku (położenie, długość, nacisk spoczynkowy, wiotczenie przy odruchu połykania) i perystaltyki w przełyku.
- Potwierdzenie lub wykluczenie przepukliny rozworu przełykowego.
Wskazania do skierowania do specjalisty
Wskazania do EGD
- Na życzenie pacjenta można w pierwszej kolejności wykonać dalsze badania (np. endoskopowe) zamiast zastosowania terapii empirycznej.
- Dalsze wskazania do EGD:
- Natychmiast w przypadku wystąpienia objawów alarmowych.
- Czynniki ryzyka przełyku Barretta:
- dodatni wywiad rodzinny
- wiek >50 lat
- długoletnie, zwłaszcza nocne objawy refluksu
- palenie tytoniu
- otyłość brzuszna.
- U pacjentów bez odpowiedzi na prawidłowo stosowaną terapię IPP.
- W przypadku wysokiego dobowego zapotrzebowania na IPP w terapii empirycznej.
Wskazania do wykonania pH–metrii z impedancją
- Objawy refluksu i brak odpowiedzi na empiryczną terapię IPP (np. w diagnostyce nadwrażliwego przełyku lub zgagi czynnościowej).
- Kliniczne podejrzenie choroby refluksowej bez typowych objawów i/lub z podejrzeniem objawów pozaprzełykowych.
Leczenie
Cele leczenia
- Celami terapii GERD są:
- ustąpienie objawów choroby
- wygojenie się zmian w przełyku
- dopuszczalne jest utrzymywanie się nieznacznych zmian (stopnia A/B według klasyfikacji Los Angeles)
- zapobieganie powikłaniom.
Ogólne informacje o leczeniu
- Leczenie może obejmować:
- zalecenia ogólne
- farmakoterapię
- leczenie chirurgiczne
- terapię interwencyjną.
Zalecenia ogólne
- Korzyści i ograniczenia wynikające ze stosowania zaleceń ogólnych należy omówić z pacjentem:
- Zmniejszenie masy ciała u pacjentów z nadwagą lub otyłością.
- Dieta
- unikanie indywidualnie nietolerowanych pokarmów i napojów
- unikanie spożywania posiłków w późnych porach (mniej niż 3 godziny przed snem)
- błonnik pokarmowy (owoce, warzywa)
- ograniczenie kawy, herbaty, słodzonych napojów gazowanych (korzystny wpływ).
- Sen
- w pozycji z uniesionym tułowiem (co najmniej 10–12 cm, optymalnie 28 cm)
- odpowiedni wypoczynek nocny.
- Zaprzestanie palenia papierosów, ograniczenie spożycia alkoholu (efekt niepotwierdzony, ale ogólny korzystny wpływ na zdrowie).
- Unikanie leków sprzyjających refluksowi.
Farmakoterapia
Inhibitory pompy protonowej (IPP)
- Wyższa skuteczność IPP w porównaniu z placebo, lekami zobojętniającymi i antagonistami H2.
- Obecnie IPP zaliczane są do leków o bardzo dobrym profilu bezpieczeństwa.
Sposób przyjmowania
- Przyjmować około 30 minut przed posiłkiem.
- Lepsza skuteczność rano niż wieczorem.
- Stosowanie 2 x na dobę może poprawić ich skuteczność w porównaniu ze zwiększeniem pojedynczej dawki (np. 2 x 20 mg skuteczniejsze niż 1 x 40 mg).
Standardowe dawkowanie
- Standardowe dawki różnych IPP (w zależności od wskazania stosuje się również połowę dawki lub podwójne dawki standardowe):
- esomeprazol: 40 mg
- omeprazol: 20 mg
- lanzoprazol: 30 mg
- pantoprazol: 40 mg
- rabeprazol: 20 mg
- dekslanzoprazol: 30 mg.
Alginiany
- Uzupełniająco w przypadku niewystarczającej kontroli objawów lub jako alternatywa w przypadku łagodnych objawów lub dobrej kontroli objawów.
- Sposób działania alginianów:
- Ulegają żelifikacji w kontakcie z kwasem żołądkowym.
- Neutralizują tzw. kieszonkę kwasową (acid pocket) tworzącą się pod wpustem żołądka po przyjęciu pokarmu, mechaniczna ochrona przełyku skierowana do góry.
- Dodatkowa ochrona poprzez tworzenie warstwy ochronnej na błonie śluzowej przełyku.
- Korzystne klinicznie właściwości alginianów:
- szybki początek działania (w ciągu 5 minut)
- w łagodnej lub umiarkowanej GERD skuteczność porównywalna do 20 mg omeprazolu
- można je stosować jako środki na zgagę w okresie ciąży.
Inne leki
Blokery receptora H2
- Skuteczniejsze niż placebo i leki zobojętniające, ale mniej skuteczne niż IPP.
- Skuteczność zmniejsza się stopniowo przy regularnym przyjmowaniu leku (tachyfilaksja).
Leki zobojętniające
- Często stosowane w samoleczeniu, ale brak jednoznacznych dowodów potwierdzających skuteczność.9
- Efekt po 5 minutach od zażycia, utrzymuje się do 1 godziny.
- Mogą być stosowane doraźnie jako terapia uzupełniająca w przypadku dolegliwości refluksowych lub NERD.
- Preparaty dostępne w Polsce:
- glin
- glin+olejek miętowy
- glin+magnez
- wapń+magnez
- glin+wodorowęglan sodu+kwas alginowy
- glin+magnez+symetikon.
Leki działające miejscowo
-
- Siarczan chondroityny: wiązanie i neutralizacja pepsyny, udział w procesach naprawy uszkodzeń komórek.
- Kwas hialuronowy: udział w gojeniu i regeneracji.
- Poloxamer 407: adhezja do błony śluzowej przełyku, tworzenie warstwy ochronnej, przyspiesza gojenie nadżerek.
- Sukralfat: działanie protekcyjne na błonę śluzową przewodu pokarmowego - tworzy warstwę ochronną, ułatwia gojenie.
Prokinetyki
- Itopiryd: antagonista receptorów dopaminowych D2, prowadzi do istotnego zmniejszenia objawów po 4 tygodniach, brak wpływu na gojenie się nadżerek.
- Może być pomocny u pacjentów z towarzyszącą depresją.
Neuromodulatory
- Opcja w zgadze czynnościowej, nadwrażliwym przełyku:
- trójpierścieniowe leki przeciwdepresyjne
- trazodon
- selektywne inhibitory wychwytu zwrotnego serotoniny
- inhibitory wychwytu zwrotnego serotoniny i noradrenaliny.
Agoniści receptora GABA–B
- Baklofen hamuje przejściową relaksację dolnego zwieracza przełyku.
- Opcjonalnie (użycie pozarejestracyjne, off label) jako terapia uzupełniająca w przypadku opornych na IPP objawów poposiłkowych, nadwrażliwego przełyku.
- Ciężkie działania niepożądane, często zawroty głowy, osłabienie, zmęczenie.
Schematy leczenia w różnych wskazaniach
- W niektórych wskazaniach IPP można stosować przez krótki okres, w innych przypadkach wymagana jest długotrwała terapia.
- W leczeniu stanów ostrych i terapii długoterminowej zaleca się stosowanie poniższych schematów.
Dolegliwości refluksowe (bez wykonanej endoskopii)
Leczenie w stanach ostrych
- IPP ± alginiany/leki zobojętniające.
- Standardowa dawka IPP, w razie potrzeby alginian/leki zobojętniające.
- Alginiany mogą być również stosowane jako alternatywa dla IPP w przypadku łagodnych objawów.
- Czas trwania: 4 tygodnie.
Leczenie długoterminowe
- IPP lub alginian/leki zobojętniające w razie potrzeby w przypadku nawracającego dyskomfortu.
- Dawka standardowa stosownie do potrzeb.
- Zalecana endoskopia, ponowna ocena po 6 miesiącach.
NERD (prawidłowe wyniki endoskopii)
Leczenie w stanach ostrych
- IPP ± alginian/leki zobojętniające.
- Połowa standardowej dawki IPP, w razie potrzeby alginian/leki zobojętniające.
- Czas trwania: 4 tygodnie.
Leczenie długoterminowe
- IPP lub alginian/leki zobojętniające w razie potrzeby.
- Dawka standardowa IPP w razie potrzeby lub minimalna dawka skuteczna.
- Bez ograniczeń czasowych.
Łagodne refluksowe zapalenie przełyku (stopnia A i B według klasyfikacji Los Angeles)
Leczenie w stanach ostrych
- IPP.
- Dawka standardowa.
- Czas trwania: 4 tygodnie.
Leczenie długoterminowe
- IPP.
- Dawka standardowa w razie potrzeby lub minimalna dawka skuteczna.
- Stosowanie ciągłe lub przerywane w zależności od potrzeb.
Ciężkie refluksowe zapalenie przełyku (stopnia C i D według klasyfikacji Los Angeles)
Leczenie w stanach ostrych i długoterminowe
- IPP.
- Dawka standardowa (ewentualnie podwójna dawka standardowa w schemacie 1–0–1).
- Czas trwania: 8 tygodni/na stałe.
Refluksowe zwężenie przełyku
Leczenie w stanach ostrych i długoterminowe
- IPP.
- Podwójna dawka standardowa.
- Bez ograniczeń czasowych.
Przełyk Barretta
Leczenie w stanach ostrych i długoterminowe
- IPP tylko w przypadku występowania objawów refluksu i/lub zapalenia przełyku.
Refluksowy zespół bólowy klatki piersiowej
Leczenie w stanach ostrych
- IPP.
- Podwójna dawka standardowa.
- Czas trwania: 8 tygodni.
Leczenie długoterminowe
- IPP.
- Zwiększanie/zmniejszanie dawki w zależności od potrzeb klinicznych.
- Czas trwania: ustalany indywidualnie.
Podejrzenie objawów pozaprzełykowych
Leczenie w stanach ostrych
- IPP ± alginian.
- Podwójna dawka standardowa (1–0–1), w razie potrzeby alginian.
- Czas trwania: 12 tygodni.
Leczenie długoterminowe
- IPP ± alginian.
- Zwiększanie/zmniejszanie dawki w zależności od potrzeb klinicznych.
- Czas trwania: ustalany indywidualnie.
Farmakoterapia w okresie ciąży
- GERD występuje u 30–50% kobiet w ciąży, a refluksowe zapalenie przełyku u 1–2% ciężarnych.
- Możliwości leczenia:
- przy łagodnych objawach należy zastosować leki zobojętniające (sukralfat) lub antagonistę receptora H2 (ranitydyna)
- alginiany
- pantoprazol lub omeprazol z grupy IPP.
Postępowanie w przypadku dolegliwości opornych na IPP
- U nawet 50% pacjentów z objawami refluksu nie uzyskuje się wystarczającej kontroli objawów nawet po długotrwałym przyjmowaniu IPP.
- Po 8 tygodniach stosowania IPP w standardowej dawce, zaleca się następujące postępowanie diagnostyczno–terapeutyczne:
- Po wykluczeniu objawów alarmowych i innych chorób (np. serca, pęcherzyka żółciowego, trzustki): IPP 2 x na dobę, zmiana na inny IPP, zapewnienie prawidłowego przyjmowania 30–60 minut przed posiłkiem.
- Czas trwania 4–8 tygodni, w przypadku uporczywych dolegliwości.
- Odstawienie IPP na 3–4 tygodnie.
- EGD z biopsją z możliwym rozpoznaniem ciężkiego refluksowego zapalenia przełyku (stopnia C/D według klasyfikacji Los Angeles), przełyku Barretta, eozynofilowego zapalenia przełyku.
- Niestwierdzenie ciężkiego zapalenia przełyku oznacza wykluczenie eozynofilowego zapalenia przełyku.
- Manometria przełyku
- Jeżeli nie występują zaburzenia motoryki.
- 24–godzinna pH–metria z impedancją
- Przy patologicznym odbijaniu kwasem: optymalizacja hamowania wydzielania kwasu, leczenie skojarzone (np. + alginian), leczenie operacyjne.
- Bez patologicznego odbijania kwasem: rozpoznanie i dalsze leczenie zależą od tego, czy objawy i epizody refluksu korelują ze sobą, czy nie.
- Objawy prawdopodobnie związane z refluksem: rozpoznanie przełyku nadwrażliwego, możliwości terapeutyczne: modyfikacja stylu życia, alginiany, neuromodulatory, leczenie zabiegowe.
- Objawy prawdopodobnie niezwiązane z refluksem: rozpoznanie zgagi czynnościowej, możliwości terapeutyczne: leki przeciwdepresyjne, terapia behawioralna.
- Po wykluczeniu objawów alarmowych i innych chorób (np. serca, pęcherzyka żółciowego, trzustki): IPP 2 x na dobę, zmiana na inny IPP, zapewnienie prawidłowego przyjmowania 30–60 minut przed posiłkiem.
Postępowanie chirurgiczne
- Zabiegi chirurgiczne (i endoskopowe) są rozważane jedynie u pacjentów, u których leczenie zachowawcze nie przynosi zadowalających efektów, nie jest tolerowane lub pożądane.
Fundoplikacja
- Standardowa procedura operacyjna.10
- Laparoskopowa fundoplikacja powinna być preferowana w stosunku do operacji otwartej.
- Zabiegi chirurgiczne powinny być wykonywane w specjalistycznych ośrodkach, posiadających odpowiednie doświadczenie w zastosowaniu procedury.
- Pacjentów należy poinformować o ryzyku związanym z fundoplikacją laparoskopową: chorobowość <10%, wskaźnik powikłań około 5%, śmiertelność około 0,2%.
Opaska magnetyczna
- Implantacja pierścienia magnetycznego w celu wzmocnienia dolnego zwieracza przełyku.
- Aktualnie brak danych porównawczych do ustalonej operacji standardowej.
Neuromodulacja
- Elektryczna stymulacja dolnego zwieracza przełyku poprzez laparoskopowo wszczepione elektrody (bateria w bocznej ścianie brzucha).
Procedury endoskopowe
- Opcja dla pacjentów, którzy nie chcą poddać się uznanej standardowej metodzie leczenia operacyjnego i bez istotnej przepukliny.
Fundoplikacja przezustna
- Zwężenie połączenia żołądkowo–przełykowego z dostępu endoluminalnego.
- Jak dotąd nie potwierdzono korzyści w porównaniu z uznaną metodą fundoplikacji laparoskopowej.
Resekcja błony śluzowej
- Działanie antyrefluksowe poprzez rozległą resekcję błony śluzowej w okolicy wpustu z bliznowatym obkurczeniem.
Przebieg, powikłania i rokowanie
Powikłania
- Ciężkie zapalenie przełyku.
- Pozapalne zwężenie przełyku.
- Przełyk Barretta.
- Rak przełyku.
Przebieg i rokowanie
- Najczęściej przebieg przewlekły, ale zdarzają się spontaniczne wyleczenia.
- Często dobra kontrola w ramach terapii empirycznej, ale także znaczny odsetek pacjentów z nieadekwatną kontrolą objawów i w związku z tym potrzebą dalszej diagnostyki/leczenia.
- U około 25% pacjentów obserwuje się tendencję do progresji w badaniach endoskopowych.
- W przypadku przełyku Barretta istnieje ryzyko rozwoju gruczolakoraka, ale ryzyko to jest niższe niż wcześniej sądzono.
- Długość życia pacjentów z GERD nie ulega skróceniu.
Dalsze postępowanie
- Kontrola endoskopowa jest wymagana w przypadku przełyku Barretta oraz u pacjentów z powikłaniami.11
- W przypadku wystąpienia objawów alarmowych, takich jak dysfagia lub utrata masy ciała, należy wykonać niezwłocznie kontrolną endoskopię.
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Ilustracje
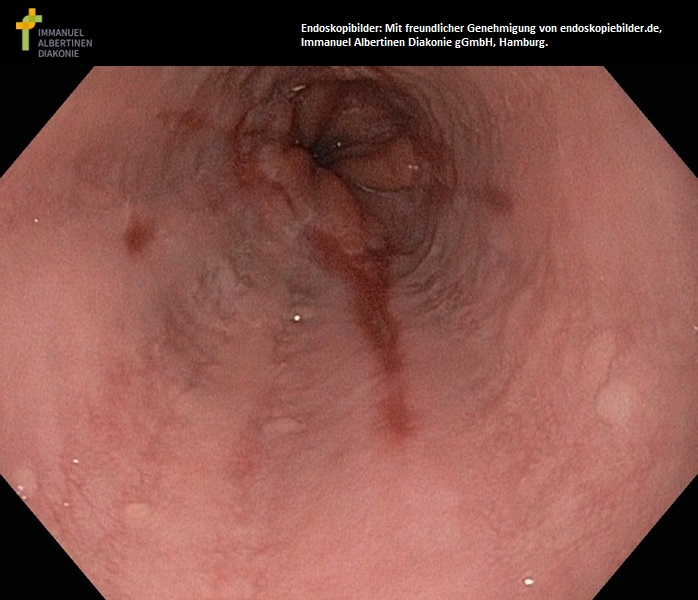
Rak płaskonabłonkowy przełyku (dzięki uprzejmości endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)

Zwężający gruczolakorak przełyku (dzięki uprzejmości endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)

Przełyk Barretta (metaplazja do 3 cm długości) (dzięki uprzejmości endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
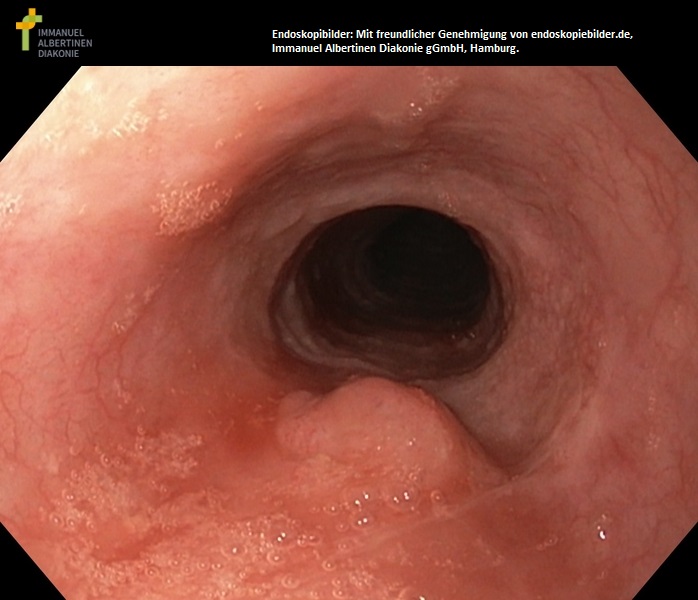
Refluksowe zapalenie przełyku stopnia III (dzięki uprzejmości endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
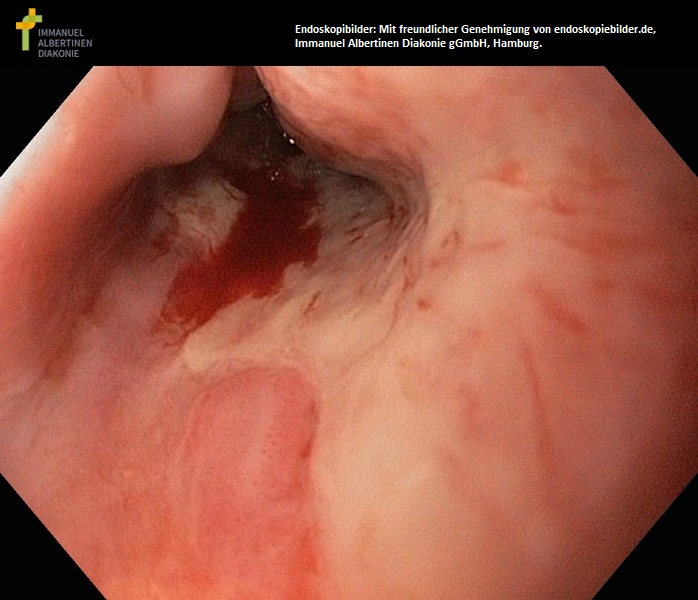
Refluksowe zapalenie przełyku stopnia II (dzięki uprzejmości endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
Źródła
Wytyczne
- Świdnicka-Siergiejko A., Marek T., Waśko-Czopnik D. et al. Postępowanie diagnostyczno-terapeutyczne w chorobie refluksowej przełyku, Konsensus Polskiego Towarzystwa Gastroenterologii 2022, Med. Prakt. 2022, 6: 38-74, ptg-e.org.pl
Piśmiennictwo
- El-Serag H., Sweet S., Winchester C., et al. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review, Gut 2014, 63: 871-80, doi:10.1136/gutjnl-2012-304269, DOI
- Richter J.E., Rubenstein J.H. Presentation and Epidemiology of Gastroesophageal Reflux Disease, Gastroenterology, 2018, 154(2): 267‐76, PMID: 28780072, www.ncbi.nlm.nih.gov
- Ghisa M., Barberio B., Savarino V., et a. The Lyon Consensus: Does It Differ From the Previous Ones? J Neurogastroenterol Motil 2020, 26: 311-21, doi:10.5056/jnm20046, DOI
- Katzka D., Pandolfino J., Kahrilas P. Phenotypes of Gastroesophageal Reflux Disease: Where Rome, Lyon, and Montreal Meet, Clin Gastroenterol Hepatol 2020, 18: 767-76, doi:10.1016/j.cgh.2019.07.015, DOI
- Gyawali C., Kahrilas P., Savarino E., et al. Modern diagnosis of GERD: the Lyon Consensus. Gut 2018, 67: 1351-62, doi:10.1136/gutjnl-2017-314722, DOI
- Vakil N., van Zanten S.V., Kahrilas P., Dent J., Jones R.; Global Consensus Group. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence-based consensus, Am J Gastroenterol. 2006, 101(8): 1900‐43, PMID: 16928254, insights.ovid.com
- Patti M. Gastroesophageal Reflux Disease. Medscape, aktualizacja: 20.11.2021, dostęp: 12.06.2022, emedicine.medscape.com
- Lundell L., Dent J., Bennett J. Endoscopic assessment of oesophagitis: clinical and functional correlates and further validation of the Los Angeles classification, Gut 1999, 45: 172-80, doi:10.1136/gut.45.2.172, DOI
- Clarrett D.M., Hachem C. Gastroesophageal Reflux Disease (GERD), Mo Med. 2018, 115(3): 214‐8, PMID: 30228725, www.ncbi.nlm.nih.gov
- Frazzoni M., Piccoli M., Conigliaro R., Frazzoni L., Melotti G. Laparoscopic fundoplication for gastroesophageal reflux disease, World J Gastroenterol. 2014, 20(39): 14272-9, PMID: 25339814, www.ncbi.nlm.nih.gov
- Lübbers H., Mahlke R., Lankisch P.G., Stolte M. Follow-up endoscopy in gastroenterology: when is it helpful? Dtsch Arztebl Int. 2010, 107(3): 30-9, PMID: 20140171, www.ncbi.nlm.nih.gov
- Moayyedi P., Eikelboom J.W., Bosch J., et al. Safety of Proton Pump Inhibitors Based on a Large, Multi-Year, Randomized Trial of Patients Receiving Rivaroxaban or Aspirin, Gastroenterology, 2019, 157(3): 682-91, e2, PMID: 31152740, pubmed.ncbi.nlm.nih.gov
- Eusebi L.H., Rabitti S., Artesiani M.L., et al. Proton pump inhibitors: Risks of long-term use, J Gastroenterol Hepatol. 2017, 32(7): 1295-302, PMID: 28092694, onlinelibrary.wiley.com
Opracowanie
- Grzegorz Margas (recenzent)
- Adam Windak (redaktor)
- Michael Handke (recenzent/redaktor)
- Anneke Damberg (recenzent/redaktor)
