Zusammenfassung
- Definition:Indolentes B-Zell-Non-Hodgkin-Lymphom, das durch einen leukämischen Verlauf charakterisiert ist. Im peripheren Blut kann eine monoklonale B-Zell-Population von definitionsgemäß > 5 × 109 Zellen/l mit CLL-Phänotyp nachgewiesen werden.
- Häufigkeit:Häufigste Leukämieform, jährliche Inzidenz 3–5/100.000. Mittleres Erkrankungsalter bei Männern 72, bei Frauen 75 Jahre.
- Symptome:Viele Patient*innen sind zum Diagnosezeitpunkt asymptomatisch. Ansonsten Lymphknotenschwellungen, abdominelles Druckgefühl, Abgeschlagenheit, evtl. B-Symptomatik.
- Befunde:Schmerzlose Lymphknotenschwellungen zervikal, axillär und inguinal, Hepatosplenomegalie. Anämie, Blutungszeichen (Thrombozytopenie) bei fortgeschrittener Erkrankung.
- Diagnostik:Zur Diagnosestellung genügt im Allgemeinen periphere Blutentnahme mit Differenzialblutbild, Blutausstrich und Immunphänotypisierung.
- Therapie:Stadieneinteilung nach Binet vor Therapieentscheidung. Bei asymptomatischen Patient*innen im Binet-Stadium A oder B „Watch and Wait“. Ansonsten bei Behandlungsindikation individualisierte Therapie abhängig von Fitness, Alter und genetischen Risikofaktoren. Zur Verfügung stehen Chemotherapeutika, CD-20-Antikörper und sog. zielgerichtete Substanzen wie Ibrutinib. Allogene Stammzelltransplantation nur noch selten indiziert.
Allgemeine Informationen
Definition
- Indolentes B-Zell-Non-Hodgkin-Lymphom, das durch einen leukämischen Verlauf charakterisiert ist.
- im peripheren Blut auftretende monoklonale B-Zell-Population von definitionsgemäß > 5 × 109 Zellen/l mit CLL-Phänotyp
- Vor dem Übergang in die chronisch-lymphatische Leukämie (CLL) besteht eine Phase mit monoklonaler B-Lymphozytose (MBL).
- Bei MBL besteht definitionsgemäß eine klonale B-Zell-Population ≤ 5 × 109 Zellen/l im Blut ohne sonstigen Anhalt für lymphoproliferative Erkrankung.
- MBL ist fakultative Präneoplasie für eine CLL und findet sich relativ häufig in der Allgemeinbevölkerung (0,5–5 %), steigende Prävalenz mit dem Alter.
- Risiko der Progression in CLL im Mittel ca. 1 %/Jahr, abhängig von der Zellzahl
Häufigkeit
- Häufigste Leukämie in den westlichen Industriestaaten
- Inzidenz
- jährliche Inzidenz 3–5/100.000
- Geschlechterverhältnis
- Verhältnis Männer zu Frauen ca. 2:1
- Altersverteilung
- im Allgemeinen Erkrankung des höheren Alters
- mittleres Erkrankungsalter bei Männern 72 Jahre
- mittleres Erkrankungsalter bei Frauen 75 Jahre
- Ca. 10 % der Patient*innen sind < 55 Jahre.1
- in den vergangenen Jahren häufiger auch bei jüngeren Patient*innen diagnostiziert wegen zunehmender Anzahl von Routinelaboruntersuchungen
- im Allgemeinen Erkrankung des höheren Alters
- Anteil an Krebserkrankungen
- Anteil von ca. 1 % an allen invasiven Krebsneuerkrankungen
- Anteil von 30 % an allen Leukämien
- Anteil von 10 % an allen Non-Hodgkin-Lymphomen
Ätiologie und Pathogenese
Ätiologie
- Ätiologie bislang nicht geklärt
- Genetische Faktoren scheinen eine Rolle zu spielen.
- Kinder von CLL-Patient*innen haben ein erhöhtes Risiko für Non-Hodgkin-Lymphome.
- selten in Asien
Pathogenese
- CLL charakterisiert durch Proliferation und Akkumulation von reifen B-Zellen
- Zentrale Elemente der Pathogenese sind:
- Inhibition von Apoptose
- Dysregulation der Proliferation.
- Im Lauf der Erkrankung kommt es zu schrittweisen, akkumulierenden genetischen Veränderungen mit Mutationen und Chromosomenanomalien, die die Proliferation begünstigen bzw. die Apoptose verhindern.,
- Mutationen und Chromosomenalterationen machen die CLL im Verlauf aggressiver und führen zu Therapieresistenz.2
Prädisponierende Faktoren
- Erworben
- organische Lösungsmittel, z. B. Benzol nach deutscher Berufskrankheiten-Verordnung (Nr. 1318)
- vermehrter Kontakt zu Herbiziden/Pestiziden
- Hepatitis C
- Neigung zu allergischen Erkrankungen
- Vielzahl von Atemwegsinfekten in der Anamnese
- Hereditär
- 8,5-fach erhöhtes Risiko bei Verwandten 1. Grades von CLL-Patient*innen
ICD-10
- C91.1 Chronische lymphatische Leukämie vom B-Zell-Typ [CLL]
Diagnostik
- Zur Diagnosestellung genügt in der Regel eine periphere Blutentnahme (Differenzialblutbild, Blutausstrich, Immunphänotypisierung)
- Patient*innen bei Diagnose häufig beschwerdefrei, Diagnosestellung im Rahmen von Blutuntersuchungen aus anderer Indikation
- Bei einer ätiologisch nicht anderweitig erklärbaren persistierenden Lymphozytose (> 50 % der Leukozyten oder > 5 G/l entsprechend 5.000/μl) und/oder einer Lymphadenopathie und/oder Splenomegalie und/oder Autoimmunzytopenie soll eine CLL-Diagnostik durchgeführt werden.
- Folgende Untersuchungsverfahren sollen bei der Initialdiagnostik der CLL zur Anwendung kommen:
- Anamnese
- körperliche Untersuchung mit vollständiger Erhebung des
peripheren Lymphknotenstatus und Leber- und Milzgrößenabschätzung - maschinelles Blutbild (mindestens Hämoglobin, Leukozytenzahl, Thrombozytenzahl)
- mikroskopisches Differenzialblutbild
- Immunphänotypisierung des peripheren Blutes
Diagnostische Kriterien
- Diagnose einer CLL, wenn folgende Kriterien erfüllt sind:
- Zellzahl: > 5 × 109 klonale B-Lymphozyten/l (> 5.000 Zellen/μl) im peripheren Blut über mindestens 3 Monate
- Blutausstrich: Vorherrschen kleiner, morphologisch reif wirkender Lymphozyten
- Immunphänotypisierung: Koexpression der B-Zell-Antigene CD19, CD20, und CD23 mit dem T-Zell-Antigen CD5
- Nachweis der Monoklonalität der Lymphozyten durch Erfassung der Leichtkettenrestriktion (nur Kappa- oder Lambda-Leichtketten werden exprimiert)
Differenzialdiagnosen
- Die häufigsten Differenzialdiagnosen sind:
- monoklonale B-Lymphozytose
- reaktive Lymphozytose (virale Infekte, Kollagenosen)
- andere, leukämisch verlaufende Lymphome (follikuläres Lymphom, lymphoplasmozytisches Lymphom, Marginalzonenlymphom, Mantelzell-Lymphom, B-Prolymphozyten-Leukämie (B-PLL)
- Haarzell-Leukämie
Anamnese
- Ca. 25–50 % der Patient*innen sind asymptomatisch zum Zeitpunkt der Diagnose!3
- Symptome
- Allgemeinsymptome
- Abgeschlagenheit
- Leistungsschwäche
- Müdigkeit
- B-Symptomatik (ca. 20 %): Fieber, Nachtschweiß, Gewichtsverlust > 10 % in den letzten 6 Monaten
- Lymphknotenschwellungen vor allem
- zervikal
- axillär
- inguinal
- Reizhusten, Dyspnoe (bei thorakalen Lymphknoten)
- Druckgefühl im Bereich von Milz und/oder Leber (50 %)
- erhöhte Infektanfälligkeit
- Allgemeinsymptome
- Familienangehörige mit CLL?
- Zurückliegende Malignome und deren Therapie?
- Exposition gegenüber Chemikalien (z. B. Benzol) oder radioaktiver Strahlung?
Klinische Untersuchung
- Lymphknotenschwellungen bei ca. 80 % der symptomatischen Patient*innen3
- Lymphknoten zumeist
- schmerzlos
- einige Zentimeter groß
- mittelhart
- verschieblich
- Lymphknoten zumeist
- Hepatosplenomegalie (ca. 50 %)
- Evtl. Blässe (Anämie)
- Evtl. Blutungszeichen (Thrombozytopenie)
- ca. 10 % der Patient*innen initial mit Anämie und/oder Thrombozytopenie
Ergänzende Untersuchungen in der Hausarztpraxis
Blutuntersuchung
- Differenzialblutbild
- Leukozyten: Lymphozytose
- Zusätzlich zur maschinellen Leukozytendifferenzierung (manchmal ungenau) soll eine mikroskopische Zelldifferenzierung mit Blutausstrich durchgeführt werden.
- Hb: zu Beginn meist noch normal
- Thrombozyten: zu Beginn meist noch normal
- Leukozyten: Lymphozytose
- Klinische Chemie
- LDH
- Bilirubin, Gamma-GT, GOT, GPT
- Kreatinin, Harnstoff, Harnsäure
- Haptoglobin (bei V. a. Hämolyse)
- Serum-Eiweißelektrophorese
- Hypogammaglobulinämie bei fortgeschrittener Erkrankung
- direkter Coombstest (bei V. a. Autoimmunhämolyse)
Screening
- Ein routinemäßiges Screening auf CLL wird weder für die Allgemeinbevölkerung noch für Verwandte von CLL-Patient*innen empfohlen.1
Sonografie Abdomen
- im Rahmen der Initialdiagnostik nicht unbedingt erforderlich
- Hepatosplenomegalie, Lymphknotenvergrößerung
- Lymphknoten > 1 cm werden als vergrößert gewertet.
- Milz wird bis 12 cm als nicht pathologisch vergrößert bewertet.
Diagnostik bei Spezialist*innen
Labor: Immunphänotypisierung
- Für den Nachweise einer CLL soll eine Immunphänotypisierung durchgeführt werden.
- Expression von CD19 und CD23
- Koexpression von CD5
- schwache oder fehlende Expression von CD20, CD79b, FMC7
- Monoklonalität von Igκ oder Igλ
- Aus der absoluten Lymphozytenzahl im Blutbild und dem relativen Anteil monoklonaler B-Zellen in der Immunphänotypisierung ergibt sich die absolute Zahl monoklonaler B-Zellen.
- CLL liegt vor bei > 5 × 109 monoklonaler B-Zellen/l (entspricht 5.000/μl).
Laboruntersuchungen vor Therapieeinleitung
- Genetische Analysen (mit entscheidend für Therapieauswahl)
- Chromosomen-Deletion 17p13
- TP53-Mutation
- IGHV-Mutation
- Weitere Laboruntersuchungen, z. B. quantitative Bestimmung der Immunglobuline bei Verdacht auf Immundefizienz, Beta-2-Mikroglobulin (prognostischer Parameter)
Knochenmarkaspirat und/oder Biopsie
- In der Regel zur Diagnosestellung nicht erforderlich
- Option bei nicht eindeutiger Immunphänotypisierung
- Evtl. im Krankheitsverlauf zur Beurteilung unklarer Zytopenien bzw. der Remissionsqualität
Lymphknotenbiopsie
- Im Allgemeinen für die Diagnose nicht erforderlich
- Option bei nicht eindeutiger Immunphänotypisierung
- Indiziert bei:
- fehlender leukämischer Ausschwemmung
- V. a. Transformation in aggressives Lymphom (Richter-Syndrom).
Bildgebung
- Eine Schnittbildgebung ist in der Initialdiagnostik normalerweise nicht erforderlich.
- Die Stadieneinteilung erfolgt ohne Bildgebung.
- Sonografie Abdomen
- vor Therapieeinleitung empfohlen: Milz, Leber, Lymphknoten
- Lymphknoten > 1 cm werden als vergrößert gewertet (während und nach Behandlung gelten nur Lymphknoten > 1,5 cm als vergrößert)
- Computertomografie (CT)
- nur bei speziellen Fragestellungen (z. B. mediastinaler Befall, abdomineller Lymphknotenbulk) oder im Rahmen klinischer Studien
Stadieneinteilung
- Stadieneinteilung nach Binet oder Rai ist bei CLL wichtig zur:
- Prognoseabschätzung
- Evaluierung der Behandlungsindikation
- Sowohl Einteilung nach Binet als auch nach Rai einfach durchzuführen (keine Bildgebung nötig).
- körperliche Untersuchung
- Blutbild
- In Europa vorwiegend Einteilung nach Binet
Stadieneinteilung nach Binet
- Bestimmung von Hb und Thrombozyten
- Beurteilung von 5 Lymphregionen
- Lymphknoten uni- oder bilateral zervikal
- Lymphknoten uni- oder bilateral axillär
- Lymphknoten uni- oder bilateral inguinal
- Milz
- Leber
- Siehe Tabelle CLL-Stadieneinteilung nach Binet.
- Bei Erstdiagnose befinden sich:
- 60 % im Stadium A
- 30 % im Stadium B
- 10 % im Stadium C
Indikationen zur Überweisung
- Zur Abklärung und ggf. Therapieentscheidung bei Verdacht auf CLL
Therapie
Therapieziele
- CLL ist in den meisten Fällen nicht heilbar, daher sind die Therapieziele im Allgemeinen:1
- Verlängerung der Lebenszeit
- Verbesserung der Lebensqualität
- Eine allogene Stammzelltransplantation ist die potenziell kurative Therapie für einige wenige Patient*innen.
Allgemeines zur Therapie
Allgemeine Prinzipien
- Eine frühzeitige Therapie bei asymptomatischen Patient*innen verlängert das Überleben nicht.
- Eine Therapie soll daher erst begonnen werden beim Auftreten von:2
- ausgeprägten Zeichen der Knochenmarkverdrängung oder
- krankheitsbedingten Symptomen wie B-Symptomatik oder Fatigue
Asymptomatische vs. symptomatische Patient*innen
- Bei asymptomatischen Hochrisikopatient*innen sollte mit der Watch-&-Wait-Strategie fortgefahren werden.
- Bei nur mäßiggradiger Thrombopenie oder Anämie kann trotz Vorliegen eines Stadiums Binet C noch weiter abgewartet werden, wenn sich die Werte hierbei in den kurzfristigeren Kontrolluntersuchungen stabil halten.
- Während die Hepatomegalie allein in der Regel keine Therapieindikation darstellt, kann eine ausgeprägte Splenomegalie mit einer Milzvergrößerung > 6 cm unter dem Rippenbogen eine Therapieindikation darstellen.
- Sofern allein B-Symptome als Indikation für den Therapiebeginn vorhanden sind, soll eine differenzialdiagnostische Abwägung, insbesondere von Infektionen bzw. gastrointestinalen, endokrinologischen und metabolischen Erkrankungen, erfolgen.
- Eine Therapie sollte begonnen werden, wenn Nachtschweiß länger als 1 Monat besteht und für die Patient*innen Leidensdruck verursacht.
Behandlungsindikationen
- CLL Binet A und B, keine aktive Erkrankung: „Watch and Wait“, bis die Erkrankung symptomatisch wird.
- CLL Binet A und B, aktive Erkrankung: Therapie
- CLL Binet C: Therapie
- Kriterien für eine aktive Erkrankung
- Auftreten/Verschlechterung einer Knochenmarksinsuffizienz
- ausgeprägte (> 10 cm) oder progrediente Lymphknotenschwellungen
- ausgeprägte (> 6 cm) oder progrediente Splenomegalie
- progrediente Lymphozytose (bei Patient*innen mit > 30.000 Lymphozyten/µl)
- > 50 % Zunahme innerhalb von 2 Monaten
- Verdoppelungszeit der Lymphozyten < 6 Monate
- Allgemeinsymptome
- Gewichtsabnahme (> 10 %) innerhalb der letzten 6 Monate
- Fieber > 38 °C über mehr als 2 Wochen
- Nachtschweiß
- ausgeprägte Fatigue
- autoimmune Anämie oder Thrombozytopenie, resistent gegen Steroidbehandlung
Evaluierung des Behandlungserfolgs
- Siehe Tabelle Chronisch lymphatische Leukämie, Remissionskriterien.
Behandlungsstrategie
- Behandlung sollte möglichst im Rahmen klinischer Studien erfolgen.
- Für Behandlungsindikation und Wahl der spezifischen Therapie stehen im Vordergrund.
- Binet-Stadium und klinische Symptome
- körperliche Fitness und Komorbidität – Einteilung anhand Cumulative Illness Rating Scale CIRS (14 Organkategorien, Punktwert 0–44):
- fitte Patient*innen („Go go“), CIRS ≤6
- unfitte Patient*innen („Slow go“), CIRS >6
- gebrechliche Patient*innen („No go“).
- zytogenetische und molekulargenetische Risikofaktoren (v. a. del(17p), TP53-Mutation)
- Das Alter spielt mit einem Cut-off von 65 Jahren für bestimmte Therapieschemata auch eine Rolle, tritt als Kriterium per se aber heutzutage eher in den Hintergrund.
- Die Therapiewahl soll sich an der Komorbidität und weniger am kalendarischen Alter orientieren.
- Im Vergleich zu früher gibt es heutzutage andere Strategien der Behandlungsintensität.
- früher: allmähliche medikamentöse Eskalation passend zum chronisch-rezidivierenden Verlauf
- heute: von Anfang an möglichst effektive Therapie
Eingesetzte Substanzen
- Etablierte Wirkstoffe in der Behandlung der CLL sind:
Chemotherapeutika
- Chlorambucil: Alkylans
- Bendamustin: Alkylans
- Fludarabin: Purinanalogon
- Cyclophosphamid: Alkylans
Antikörper
- Rituximab: CD-20-Antikörper
- Obinutuzumab: CD-20-Antikörper
- Alemtuzumab: CD-52-Antikörper
Zielgerichtete Substanzen
- Ibrutinib: Tyrosinkinase-Inhibitor
- Idelalisib: PI3K-Inhibitor
- Venetoclax: Bcl-2-Inhibitor
Erstlinienbehandlung2
Fitte Patient*innen („Go go“)
- Ohne del(17p)/TP53-Mutation
- Mit del(17p)/TP53-Mutation
Unfitte Patient*innen („Slow go“)
- Ohne del(17p)/TP53-Mutation
- Chlorambucil + Obinutuzumab oder
- Ibrutinib
- Mit del(17p)/TP53-Mutation
- Ibrutinib
- bei Kontraindikationen bezüglich Ibrutinib: Venetoclax, Idelalisib + Rituximab
Gebrechliche Patient*innen („No go“)
- Supportive Therapie
- Im Einzelfall auch antineoplastische Medikation mit Steroiden, Chlorambucil, Bendamustin, Ibrutinib, Venetoclax oder Anti-CD20 Antikörpern
Zweitlinienbehandlung
- Auftreten eines Rezidivs definiert durch:
- Wiederauftreten von vergrößerten Lymphknoten und/oder
- Anstieg der Lymphozyten > 5 × 109/l (>5000/μl)
- Evtl. auch knochenmarkinfiltrationsbedingte Anämie, Thrombozytopenie oder Neutropenie als Hinweis auf Rezidiv
- Auch Zweitlinientherapie möglichst im Rahmen klinischer Studien
- Vor Einleitung einer Rezidivtherapie erneute Diagnostik hinsichtlich genetischer Risikofaktoren
- Bei Spätrezidiven > 3 Jahre nach der Erstlinienbehandlung ist eine Wiederholung der Erstlinientherapie möglich (sofern keine neue TP53-Aberration).
- Bei Frührezidiven < 3 Jahren nach Erstlinienbehandlung Wechsel auf andere Behandlungsoptionen
- Ibrutinib
- Idelalisib9 + Rituximab
- Venetoclax + Rituximab
- u. a.
Allogene Stammzelltransplantation
- Aufgrund der neuen Therapiemöglichkeiten nur noch selten allogene Stammzelltransplantation2
- Option in Hochrisikosituationen, z. B. bei Resistenz gegen Chemoimmuntherapien
Palliativbehandlung
- Schmerzen
- Übelkeit und Erbrechen
- Verstopfung
- Maligne gastrointestinale Obstruktion
- Mundtrockenheit
- Mangelernährung und Dehydratation
- Atembeschwerden
- Depression
- Angst
- Delir
Verlauf, Komplikationen und Prognose
Komplikationen
- Infektionen
- im Verlauf häufig Infektionskomplikationen (Abnahme der Immunglobulin-Konzentrationen, weitere Mechanismen eines erworbenen Immundefizits)
- Unter bestimmten Bedingungen (schwere, rezidivierende Infekte, ineffektive antimikrobielle Therapie) kann eine prophylaktische Immunglobulingabe erwogen werden.
- Autoimmunzytopenie
- Beinhaltet autoimmunhämolytische Anämie (7–10 %), Autoimmunthrombozytopenie (1–5 %), Pure Red Cell Anemia (< 1 %) und Autoimmunneutropenie (< 1 %).
- Behandlungsmöglichkeiten
- vor allem Kortikosteroide, Immunglobulin
- Rituximab, Immunsuppressiva
- Splenektomie
- Übergang in hochmalignes Lymphom mit ungünstiger Prognose (Richter-Transformation)
- Sekundärmalignome
- Risiko 2- bis 7-fach erhöht
Verlauf und Prognose
- Am wichtigsten für die Prognoseabschätzung ist die klassische Stadieneinteilung mit folgenden Werten für das mediane Überleben:
- Binet A: > 11,5 Jahre
- Binet B: > 8,6 Jahre
- Binet C: 7 Jahre
- Durch Prognosescores kann der Verlauf ergänzend eingeschätzt werden, da es auch innerhalb eines klinischen Stadiums zu unterschiedlichen Verläufen kommen kann.
- Der internationale Prognoseindex CLL-IPI berücksichtigt verschiedene klinische und molekularbiologische Variablen:
- TP53 deletiert oder mutiert: 4 Punkte
- IGHV unmutiert: 2 Punkte
- Serum-Beta-2-Mikroglobulin > 3,5 mg/l: 2 Punkte
- klinisches Stadium Binet B–C: 1 Punkt
- Alter > 65 Jahre: 1 Punkt
- Auf Basis des CLL-IPI ergibt sich folgendes Gesamtüberleben nach 5 Jahren:
- niedriges Risiko (0–1 Punkte) 93 %
- mittleres Risiko (2–3 Punkte) 79 %
- hohes Risiko (4–6 Punkte) 63 %
- sehr hohes Risiko (7 – 10 Punkte) 23,3 %
Verlaufskontrolle
- Hausärztliche und fachhämatologische Verlaufskontrollen in Absprache mit dem hämatologischen Zentrum
- Verlaufskontrollen sollten im Abstand von 3–6 Monaten durchgeführt werden:
- Blutbilduntersuchung, CRP, LDH
- klinische Untersuchung von Lymphknoten, Leber und Milz
- Radiologische Untersuchungen mit CT/MRT bei Patient*innen in Remission sind in der Regel nicht erforderlich.
- Besonders geachtet werden sollte auf:
- Infektionen
- Auftreten von Autoimmunzytopenien
- schnelle Lymphknotenvergrößerungen
- B-Symptome und/oder eine Erhöhung der LDH (evtl. Hinweis für Rezidiv, Transformation in hochmalignes Lymphom = Richter-Syndrom)
- Impfungen
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Trotz der Diagnose „Leukämie“ können Betroffene viele Jahre lang ein normales Leben leben.
Patienteninformationen in Deximed
- Chronische lymphatische Leukämie
- Krebstherapien, Medikamenten
- Essen bei Appetitlosigkeit – Ernährungstipps
Lindernde Behandlung bei fortgeschrittener Krebserkrankung
- Palliativmedizin
- Angst
- Übelkeit und Erbrechen
- Verstopfung
- Mundbeschwerden
- Atembeschwerden
- Gewichtsverlust bei Krebs
- Depression
- Delir
Illustrationen
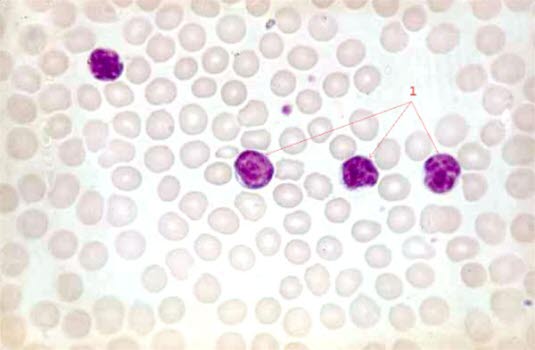
Blutausstrich von Patient*innen mit chronischer lymphatischer Leukämie (40-fache Vergrößerung)
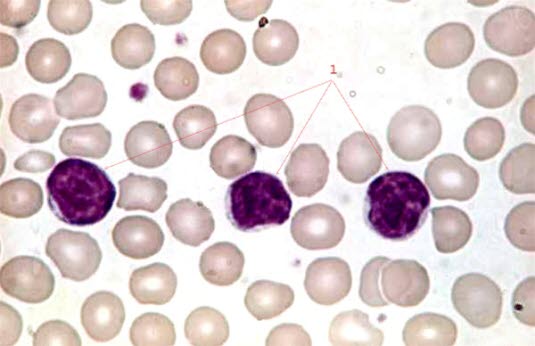
Blutausstrich von Patient*innen mit chronischer lymphatischer Leukämie (100-fache Vergrößerung)
Quellen
Leitlinien
- European Society for Medical Oncology. Chronic Lymphocytic Leukaemia: Clinical Practice Guidelines for diagnosis, treatment and follow-up. Stand 2020. www.esmo.org
Literatur
- Eichhorst B, Robak T, Montserrat E, et al. Chronic Lymphocytic Leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2021; 32: 23-33. doi:10.1016/j.annonc.2020.09.019 DOI
- von Tresckow J, Eichhorst B, Bahlo J, et al. The treatment of chronic lymphatic leukemia. Dtsch Arztebl Int 2019; 116: 41-46. doi:10.3238/arztebl.2019.0041 DOI
- Chisti M. Chronic Lymphocytic Leukemia (CLL). Medscape, updated Oct 02, 2020. Zugriff 20.02.21. emedicine.medscape.com
- Hallek M, Fischer K, Fingerle-Rowson G, et al.. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet 2010; 376: 1164-74. pubmed.ncbi.nlm.nih.gov
- Vidal L, Gafter-Gvili A, Gurion R, et al. Bendamustine for patients with indolent B cell lymphoid malignancies including chronic lymphocytic leukaemia. Cochrane Database of Systematic Reviews 2012, Issue 9. Art. No.: CD009045. pubmed.ncbi.nlm.nih.gov
- Eichhorst B, Fink AM, Bahlo J et al. First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial. Lancet Oncol 2016 Jul; 17(7): 928-942. pmid:27216274 PubMed
- Byrd JC, Brown JR, O`Brien S, et al. Ibrutinib versus Ofatumumab in Previously Treated Chronic Lymphoid Leukemia. N Engl J Med 2014 May 31. www.nejm.org
- Jain N, Keating M, Thompson P et al. Ibrutinib and Venetoclax for First-Line Treatment of CLL. N Engl J Med 2019; 380: 2095-2103. pmid:31141631. www.ncbi.nlm.nih.gov
- Furman R, M.D., Sharman J, Coutre S, et al. Idelalisib and Rituximab in Relapsed Chronic Lymphocytic Leukemia. N Engl J Med 2014; 370: 997-1007. doi:10.1056/NEJMoa1315226 DOI
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.