Allgemeine Informationen
Definition
- Riech- und Schmeckstörungen gelten als Ursachen für u. a. einseitige Ernährung und verminderte Lebensqualität.
- Nomenklatur
- Dysosmie: Riechstörung
- Anosmie: keine Riechleistung vorhanden
- Hyposmie: verminderte Riechwahrnehmung
- Funktionelle Anosmie: Verlust der Riechwahrnehmung mit evtl. Restfunktion, die im Alltag aber keinen Nutzen bringt
- Parosmien: Gerüche werden anders wahrgenommen.
- Phantosmien: fälschliches Wahrnehmen von Gerüchen, wo keine sind
- Analog dazu Nomenklatur von Schmeckstörungen (Ageusie, Hypogeusie etc.)
Häufigkeit
- Prävalenz nach einer deutschen Studie1
- 18 % Hyposmie und 3,6 % funktionelle Anosmie
- 20 % Hypoeugesie
- Ab einem Alter von 50 Jahren hat 1/4 der Bevölkerung ein verschlechtertes Riechvermögen (Presbyosmie).
Ätiologie
- Riech- und Schmeckstörungen können diverse Ursachen haben und sich auf unterschiedliche Art und Weise äußern.
- Die drei häufigsten Ursachen von Riechstörungen:
- chronische Sinusitiden mit/ohne Polyposis nasi
- in 72 % der Fälle ursächlich für Riechstörungen
- akute Infekte der oberen Atemwege
- Schädel-Hirn-Trauma
- chronische Sinusitiden mit/ohne Polyposis nasi
- Weitere Ursachen von Riechstörungen
- neurodegenerative Erkrankungen
- Ein veränderter Neurotransmitter-Metabolismus stört wahrscheinlich die Übertragung der Riechinformationen.2
- Medikamentennebenwirkungen oder chemische Noxen
- kongenital
- Kallmann-Syndrom, aplastischer Bulbus olfactorius
- neurodegenerative Erkrankungen
- Schmeckstörungen
Anatomie und Physiologie
Geruchssinn4
- Gerüche dringen in die Nase ein und lösen sich im Nasensekret auf.
- Stimulation der Geruchsrezeptoren in Riechschleimhaut im Bereich der oberen Nasenmuscheln
- Weiterleitung der Riechinformation über Nervenfasern (Fila olfactoria) durch die Löcher der Lamina cribrosa des Os ethmoidale in den Bulbus olfactorius
- Im Bulbus beginnt die zentralnervöse Verarbeitung und Weiterleitung an Cortex cerebri.
- Riechstörungen können an allen o. g. Strukturen auftreten.
- Geruchsrezeptoren verfügen über ein lebenslanges Regenerationsvermögen.
- Zusätzliche zum Geruch werden Informationen wie Temperatur, Reizstärke und Schärfe über die nasalen und maxillaren Äste des N. trigeminus übermittelt.
Geschmackssinn4
- Geschmacksknospen auf der Zunge sowie im weichen Gaumen, Pharynx, Larynx, Epiglottis und oberen Drittel des Ösophagus dienen als Rezeptorzellen.
- Fünf Geschmacksqualitäten
- süß
- salzig
- sauer
- bitter
- umami (Aminosären Glutamin sowie Asparaginsäure)
- Innervation
- vordere 2/3 der Zunge durch Chorda tympani des N. facialis
- hinteres Drittel der Zunge durch N. glossopharyngeus
- Gaumen durch N. petrosus major
- Pharynx und Larynx durch N. vagus
- Der Verlust des Geschmackssinns ist deutlich seltener als der Verlust des Geruchssinns, da die Weiterleitung über viele verschiedene Nerven erfolgt.
- N. trigeminus vermittelt Zusatzinformationen wie Temperatur und Schmerz.
- Auch die Geschmacksrezeptoren verfügen über ein lebenslanges Regenerationsvermögen und erneuern sich ungefähr alle 10 Tage.
Risikofaktoren
- Starke Raucher mit > 20 Zigaretten/Tag mit deutlich erhöhtem Risiko für Geruchs- und Geschmacksstörungen1
- M. Parkinson
- in einer Studie unter 400 Patienten 96,7 % mit Riecheinschränkungen5
- Das Risiko für reduziertes Riechvermögen steigt mit zunehmendem BMI.6
- Erhöhtes Risiko für Riechstörungen bei Diabetes mellitus, insbesondere bei Bedarf einer hochdosierten Therapie (orale Antidiabetika und/oder Insulin)7
ICD-10
- R43 Störungen des Geruchs- und Geschmackssinnes
- R43.0 Anosmie
- R43.1 Parosmie
- R43.2 Parageusie
- R43.8 Sonstige und nicht näher bezeichnete Störungen des Geruchs- und Geschmackssinnes
Differenzialdiagnostische Auslöser
- Akuter respiratorischer Infekt
- Allergische Rhinitis
- Chronische Rhinosinusitis
- Nasenpolypen
- Kopfverletzung
- insbesondere Verletzung der Lamina cribriforme
- Neurodegenerative Erkrankungen
- Medikamentöse Nebenwirkungen
- Chemotherapeutika, ACE-Hemmer, Angiotensin-Rezeptor-Blocker, Kalziumblocker, Diuretika, Antibiotika, Antiarrhythmika, antithyreoidale Substanzen, Antidepressiva, Antiepileptika, Statine
- Toxische Substanzen
- Alkohol, Kokain, diverse Giftstoffe
- Chronische Erkrankungen
- z. B. Typ-2-Diabetes
- Postoperative Zustände
- Z. n. Nasenoperation, totaler Laryngektomie, Pharyngektomie, Tonsillektomie
- Intrakranielle Tumoren
- Schlaganfall
- Kongenital
- Kallmann-Syndrom, aplastischer Bulbus olfactorius
- Larvierte Depression
Anamnese
- Subjektiv häufig schwierige Beurteilung und qualitative Beschreibung der Riech- und Schmeckstörung8
- Empfehlung für Basis-Anamnese
- Seit wann bemerken Sie eine Einschränkung?
- Plötzlicher Beginn?
- Trauma? Infektion?
- Leiden Sie an einer Nasenatmungsbehinderung? Ein- oder beidseitig?
- Epistaxis? Allergien? Nasale Sekretion?
- Sind Erkrankungen im HNO-Bereich bekannt, insbesondere im Bereich der Nase/Zunge?
- Chronische Sinusitis? Voroperationen?
- Wann war die letzte HNO-ärztliche Untersuchung und Bildgebung?
- In welchen Situationen merken Sie die Einschränkung am meisten?
- Kochen? Gefahrenquellen, z. B. Rauch?
- Ist der grobe Geschmack (salzig, süß, sauer etc.) eingeschränkt?
- Gastrointestinale Erkrankungen? Reflux?
- Ist der Feingeschmack (Wein, Gewürze etc.) eingeschränkt?
- Appetit? Gewichtsverlust?
Klinische Untersuchung
Allgemeines
- Untersuchung der Nase
- U. a. Spiegel unter Nase halten und Beschlag durch Ausatemluft bei geschlossenem Mund überprüfen: symmetrisch?
- Inspektion der Mundhöhle
- Anzeichen für verminderte Speichelproduktion?
- Anzeichen einer Infektion, Entzündung oder anderen Pathologie der Mundschleimhaut, Zunge, Zähne, Zahnfleisch, Gaumen?
Geruchstest beim HNO-Arzt oder Neurologen
- Screeningtest zur qualitativen Differenzierung von Geruchsstörungen mittels Sniffin-Sticks9
- 16 verschiedene Duftstifte und je 4 Antwortmöglichkeiten pro Stift
- Schmeckpulver zur Testung des retronasalen Riechvermögens
- Duftende Pulver (z. B. Vanillezucker, Kaffeepulver, gemahlener Zimt etc.) oder süßliche Bonbons werden in den Mund genommen, die beim Lutschen bzw. Kauen Düfte freisetzen.
- Retronasale Riechempfindungen sollen dann anhand von Listen mit verbalen Deskriptoren benannt werden.
- Zum raschen Nachweis einer Hyposmie ist der Alkohol-Sniff-Test praktikabel.10
- In Alkohol getränkter Tupfer wird von kaudal Richtung Nase geführt.
- Wird der stechende Alkoholgeruch erst auf Höhe des Kinns oder später wahrgenommen, liegt wahrscheinlich Hyposmie vor.
Geschmackstest11
- Geschmackstest immer in Kombination mit Geruchstest, da der Feingeschmack extrem vom Geruchssinn beeinflusst wird.
- Screening mittels überschwelliger Schmecklösungen
- Patient/in streckt Zunge leicht heraus.
- Hochkonzentrierte Schmecklösungen werden lokal auf die Zunge aufgetragen.
- auf Tafel anzeigen, welche Schmeckwahrnehmung vorliegt
- 3-Tropfen-Test
- Bestimmung der Schmeckschwelle
- drei verschiedene Konzentrationen eines Geschmacksstoffs werden auf die Zunge appliziert, beginnend mit geringster Konzentration.
- Die Schwelle ist definiert als Konzentration, die die Patienten 3x hintereinander korrekt erkennen.11
- Taste-Strips (Geschmacksstreifen) für die fünf Geschmacksqualitäten sind eine geeignete Screeningmaßnahme.12
Indikationen zur Überweisung
- HNO-ärztliche Vorstellung zur Nasenendoskopie und Ausschluss sinugener Ursachen bei Riech- und Schmeckstörungen empfohlen
Ergänzende Untersuchungen beim Spezialisten
Bildgebung
- Sofern die endoskopische Untersuchung keine Hinweise liefert, ist eine Kopfbildgebung indiziert, vorzugsweise per MRT.
- Zur Beurteilung einer Sinusitis oder Polyposis nasi Nasennebenhöhlen-CT
Therapie
Therapie einer Riechstörung
- Die Therapie ist abhängig von der Ursache der Geruchs- bzw. Geschmacksstörung.
- Bei akuter Rhinitis/Rhinosinusitis
- Eine temporäre Riechstörung im Rahmen eines akuten Infektes der oberen Atemwege (akute virale oder bakterielle Rhinitis/Rhinosinusitis) bedarf keiner gesonderten Therapie.
- Bei chronischer Rhinosinusitis mit/ohne Nasenpolypen
- Die aktuelle Literaturlage stützt bei sinunasalen Riechstörungen im Rahmen einer chronischen Rhinosinusitis den Einsatz von topischen Kortikosteroiden
bzw. bei einer Polyposis nasi von topischen und oralen Kortikosteroiden.
- Die aktuelle Literaturlage stützt bei sinunasalen Riechstörungen im Rahmen einer chronischen Rhinosinusitis den Einsatz von topischen Kortikosteroiden
- Bei allergischer Rhinitis
- Sollte ein Therapieversuch einer Dysosmie im Rahmen einer allergischen Rhinitis unternommen werden, sind topische Steroide möglicherweise die aussichtsreichste Therapieoption.
- Bei nichtallergischer/idiopathischer Rhinitis
- Für die nichtallergische/idiopathische Rhinitis lässt sich in Bezug auf Riechstörungen basierend auf der heutigen Literaturlage und der weitgehend ungeklärten Pathophysiologie nur die Empfehlung ableiten, einen individuellen Therapieversuch zur Verbesserung der Grunderkrankung durchzuführen. Dies gilt analog auch für andere Rhinitisformen mit ungeklärter Pathophysiologie. Bei Riechstörungen bei einer toxisch-irritativen Rhinitis stehen Karenzmaßnahmen im Vordergrund.
- Bei postinfektiöser Dysosmie
- Bei postinfektiösen Riechstörungen sollte ein strukturiertes Riechtraining empfohlen werden. Das Riechtraining sollte möglichst innerhalb des ersten Jahres nach dem Eintreten der Dysosmie begonnen werden. Darüber hinaus kann ein (zusätzlicher) medikamentöser Therapieversuch unternommen werden, wobei höhergradige Evidenznachweise heute ausstehen.
- Bei posttraumatischer Dysosmie
- Bei posttraumatischen Riechstörungen kann eine absteigende Therapie mit Zinkglukonat mit oder ohne eine systemische Gabe von Kortikosteroiden eingesetzt werden. Alternativ oder ergänzend kann auch ein strukturiertes Riechtraining empfohlen werden. Die Therapie sollte möglichst zeitnah nach dem Trauma begonnen werden.
- Bei nichtsinunasaler Grunderkrankung
- Bei Riechstörungen mit Bezug zu einer Grunderkrankung außerhalb des HNO-Bereiches sollte ein interdisziplinäres Vorgehen eingeschlagen werden, das durch die maßgeblich beteiligte Disziplin koordiniert wird.
- Riechtraining bei postinfektiöser, posttraumatischer und M.-Parkinson-assoziierten Geruchsstörungen mit guten Erfolgen
- Für 6–12 Monate morgens und abends an verschiedenen Düften „schnüffeln“ und dadurch bewusst Riechzellen und zentralnervöse Verarbeitung aktivieren.
- Kostengünstige Therapie, die z. B. mit ätherischen Ölen durchgeführt werden kann.13
- Chronische Sinusitis mit Polyposis nasi
- Endoskopische Entfernung der Polypen aus der Nasennebenhöhle kann zur Verbesserung des Geruchsempfindens führen.14
- 8-wöchige Behandlung mit topischen Steroiden kann zu einer Verbesserung des Geruchssinns und der sinunasalen Erkrankung führen.15
- Systemische Steroide können als diagnostischer Test dienen, wenn die Behandlung zeitnah zu einer kurzzeitigen Symptomlinderung führt.16-17
- Schädel-Hirn-Trauma
- Frühzeitige systemischen Einnahme von Zink sowie hochdosiert Prednisolon führt zu signifikant besserer Prognose bei traumatischer Anosmie im Vergleich zu Prednisolon allein oder keiner Therapie.18
- Erfolgsrate bei Zink + Prednisolon 28 % für Rückkehr des Riechvermögens, ohne Therapie nur 2,7 %
- Neurodegenerative Erkrankungen
Therapie einer Schmeckstörung
- Eine sachkundige Beratung der betroffenen Person sollte elementarer Bestandteil der Therapie sein (ggf. auch mit einer Ernährungsberatung).
- Der Vielseitigkeit der zur Behandlung von Schmeckstörungen vorgeschlagenen Therapiemaßnahmen steht aus der Literatur ein nur geringes Evidenzniveau gegenüber.
- Der am besten evaluierte Therapieansatz ist die Zinkgabe bei idiopathischer Schmeckstörung. Aus klinischer Sicht kann bei idiopathischen Schmeckstörungen oder im Rahmen eines Zinkmangels ein Therapieversuch mit Zink durchgeführt werden.
- Bei Verdacht auf Medikamentennebenwirkungen sollten Karenz- oder Umstellungsmaßnahmen erfolgen.
- Schmeckstörungen im Rahmen von dermatologischen, internistischen und neurologischen Grunderkrankungen erfordern regelmäßig ein interdisziplinäres Vorgehen, Therapiemaßnahmen oder -versuche sollten durch das maßgeblich beteiligte Fach koordiniert werden.
Illustrationen
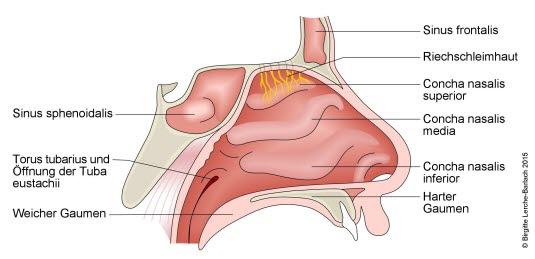
Nase mit Conchae und Nebenhöhlen
Quellen
Literatur
- Vennemann MM, Hummel T, Berger K, et al. The association between smoking and smell and taste impairment in the general population. J Neurol 2008; 255(8): 1121-6. www.ncbi.nlm.nih.gov
- Doty RL. Olfactory dysfunction in neurodegenerative diseases: is there a common pathological substrate?. Lancet Neurol 2017; 16(6): 478-88. www.ncbi.nlm.nih.gov
- Deems DA, Doty RL, Settle RG, et al. Smell and Taste Disorders, A Study of 750 Patients From the University of Pennsylvania Smell and Taste Center. Arch Otolaryngol Head Neck Surg 1991; 117(5): 519-28. www.ncbi.nlm.nih.gov
- Malaty J, Malaty IAC. Smell and taste disorders in primary care. Am Fam Physician 2013; 88: 852-9. www.ncbi.nlm.nih.gov
- Haehner A, Boesveldt S, Berendse HW, et al. Prevalence of smell loss in Parkinson‘s disease – A multi- center study. Parkinsonism Relat Disord 2009; 15(7): 490-4. www.ncbi.nlm.nih.gov
- Richardson BE, Vander Woude EA, Sudan R, et al. Altered olfactory acuity in the morbidly obese. Obes Surg 2004; 14(7): 967-9. www.ncbi.nlm.nih.gov
- Chan JYK, García-Esquinas E, Ko OH, et al. The association between diabetes and olfactory function in adults. Chem Senses 2017; 43(1): 59-64. www.ncbi.nlm.nih.gov
- Steinbach S, Hummel T, Böhner C, et al. Qualitative and quantitative assessment of taste and smell changes in patients undergoing chemotherapy for breast cancer or gynecologic malignancies. J Clin Oncol. 2009;27(11):1899–1905. www.ncbi.nlm.nih.gov
- Mueller CA, Grassinger E, Naka A, et al. A self-administered odor identification test procedure using the "Sniffin' Sticks". Chem Senses 2006; 31(6): 595-8. www.ncbi.nlm.nih.gov
- Davidson TM, Murphy C. Rapid clinical evaluation of anosmia. The alcohol sniff test. Arch Otolaryngol Head Neck Surg 1997; 123(6): 591-4. www.ncbi.nlm.nih.gov
- Gudziol H, Hummel T. Normative values for the assessment of gustatory function using liquid tastants. Acta Otolaryngol 2007; 127(6): 658-61. www.ncbi.nlm.nih.gov
- Wolf A, Varga L, Wittibschlager L, et al. A self-administered test of taste function using „Taste Strips“. Int Forum Allergy Rhinol 2016; 6(4): 362-6. www.ncbi.nlm.nih.gov
- Patel ZM, Wise SK, DelGaudio JM. . Randomized Controlled Trial Demons- trating Cost-Effective Method of Olfactory Training in Clinical Practice: Essential Oils at Uncontrolled Concentration. Laryngoscope Investig Otolaryngol 2017; 2(2): 53-56. www.ncbi.nlm.nih.gov
- Rudmik L, Smith TL. Olfactory Improvement after Endoscopic Sinus Surgery. Curr Opin Otolaryngol Head Neck Surg 2013; 20(1): 29-32. www.ncbi.nlm.nih.gov
- Mott AE, Cain WS, Lafreniere, Leonard G, Gent JF, Frank ME. Topical corticosteroid treatment of anosmia associated with nasal and sinus disease. Arch Otolaryngol Head Neck Surg. 1997;123(4):367–372. www.ncbi.nlm.nih.gov
- Seiden AM, Duncan HJ. The diagnosis of a conductive olfactory loss. Laryngoscope. 2001;111(1):9–14. www.ncbi.nlm.nih.gov
- Martinez-Devesa P, Patiar S. Oral steroids for nasal polyps. Cochrane Database Syst Rev. 2011(7):CD005232. Cochrane (DOI)
- Jiang RS, Twu CW, Liang KL. Medical Treatment of Traumatic Anosmia. Otolaryngol Head Neck Surg 2015; 152(5): 964-8. www.ncbi.nlm.nih.gov
- Haehner A, Tosch C, Wolz M, et al. Olfactory training in patients with Parkinson's disease. PLoS One. 2013;8(4):e61680. journals.plos.org
Autoren
- Lino Witte, Dr. med., Arzt in Weiterbildung, Innere Medizin, Frankfurt