Zusammenfassung
- Definition:Zusammenfassender Begriff für alle Folgezustände nach tiefer Bein- oder Beckenvenenthrombose. Durch persistierende Obstruktion und/oder Venenklappeninsuffizienz entsteht eine venöse Hypertonie.
- Häufigkeit:20–50 % der Patient*innen mit TVT entwickeln ein postthrombotisches Syndrom. Jährliche Inzidenz 1–3/1.000 Einw.
- Symptome:Typische Symptome sind Schmerzen, Krämpfe, Schwere- und Spannungsgefühl, Parästhesien, Juckreiz.
- Befunde:Typische Befunde sind Ödeme, Hautinduration, Hyperpigmentierung, Rötung, Wadenkompressionsschmerz, Ulzeration.
- Diagnostik:Klinische Diagnose, evtl. ergänzende Bildgebung (Duplexsonografie).
- Therapie:Überwiegend konservative Behandlung mit Allgemeinmaßnahmen, physikalischer Therapie und Kompressionsbehandlung. Im Einzelfall sind bei schwerem PTS chirurgische oder endovaskuläre Therapien eine Option.
Allgemeine Informationen
Definition
- Das postthrombotische Syndrom bezeichnet die Symptome und klinischen Zeichen, die durch verbliebene Obstruktion und/oder Reflux als Ausdruck einer Klappeninsuffizienz nach tiefer Venenthrombose (TVT) entstehen.
- Durch die Hypertension kommt es u. a. zu:1-2
- Schwellung
- Spannungsgefühl
- Schmerzen
- Hautveränderungen bis hin zu Ulzerationen
- Auftreten typischerweise innerhalb von 2 Jahren nach TVT3
- bei der Mehrzahl der Patient*innen im 1. Jahr3
Häufigkeit
- Häufigste Komplikation der TVT4
- 20–50 % der Patient*innen mit TVT entwickeln ein postthrombotisches Syndrom.4
- Ca. 5–10 % entwickeln ein schweres PTS.
- Die Wahrscheinlichkeit für Ulzeration 10 Jahre nach TVT liegt bei fast 5 %.5
- Zunahme der Inzidenz mit dem Alter6
- über 1/3 der Patient*innen > 60 Jahre6
- Bezogen auf die Gesamtbevölkerung jährliche Inzidenz 1–3/1.000 Einw.7
Ätiologie und Pathogenese
Ätiologie
- Ursächlich für das Entstehen eines PTS ist eine TVT der Bein- und/oder Beckenvenen.
Pathogenese
- Die venöse Hypertension ist von entscheidender pathophysiologischer Bedeutung.
- Zwei Hauptmechanismen, die zur Druckerhöhung führen können:
- Obstruktion des venösen Abflusses
- nach TVT häufig nur unvollständige Rekanalisation der verschlossenen Venen
- Insuffizienz der Venenklappen mit Reflux
- Obstruktion des venösen Abflusses
- Die Literaturangaben sind widersprüchlich, ob einer der beiden Mechanismen dominant ist.7
- Zusätzlich erfolgt vermutlich eine Schädigung der Venenwand durch akute und chronische Entzündungsprozesse mit Fibrosierung und dadurch Begünstigung des Refluxes.6
- Eine venöse Hypertension verursacht:8
- Dilatation der Kapillaren und erhöhte endotheliale Permeabilität für Plasma, Proteine und Erythrozyten
- Zunahme der Klappeninsuffizienz durch Erweiterung der tiefen Venen
- Fortleitung über Perforansvenen auf das oberflächliche Venensystem
- Anhaltende venöse Hypertension und Entzündung führen zu strukturellen und biochemischen Veränderungen mit Schädigung von Haut und subkutanem Gewebe.7
Prädisponierende Faktoren
- Wichtige Prädiktoren
- Weitere prädisponierende Faktoren
- vorbestehende chronisch-venöse Insuffizienz4
- residuelle Venenobstruktion4
- Adipositas
- unzureichende Antikoagulation
- höheres Alter4
- persistierende D-Dimer-Erhöhung
ICD-10
- I87.0 Postthrombotisches Syndrom
Diagnostik
Diagnostische Kriterien
- Es gibt keinen „Goldstandard“ für die Diagnose eines PTS.7
- Primär klinische Diagnose aufgrund klinischer Symptome und Befunde8
- Ohne klinische Symptome/Befunde sollte die Diagnose nicht gestellt werden (z. B. nur auf der Basis einer Duplexsonografie): Patient*innen mit PTS haben meist eine Klappeninsuffizienz, aber viele Menschen mit Klappeninsuffizienz haben kein PTS.
- Hilfreich bei Diagnosestellung und Einschätzung des Schweregrades sind klinische Scores (z. B. Villalta-, Ginsberg- und Brandjes-Score).8
Klassifizierung mit dem Villalta-Score
- Mit dem Villalta-Score erfolgt eine Klassifizierung mithilfe von 5 Symptomen und 6 klinischen Befunden sowie dem Vorhandensein bzw. Fehlen von Ulzerationen.10
- Für jedes Symptom und jedes klinische Zeichen werden je nach Ausprägung 0–4 Punkte vergeben, Ulzerationen werden in „vorhanden/nicht vorhanden“ eingeteilt.
- Symptome
- Schmerz
- Krämpfe
- Schweregefühl
- Parästhesien
- Juckreiz
- klinische Zeichen
- prätibiale Ödeme
- Hautinduration
- Hyperpigmentierung
- Rötung
- Venenektasie
- Wadenkompressionsschmerz
- Ulcus cruris venosum vorhanden/nicht vorhanden
- Symptome
- Siehe Tabelle Villalta-PTS-Skala.
- Diagnostisch für PTS: Score ≥ 5 Punkte
- Schweregradeinteilung
- Score 5–9: leichtes PTS
- Score 10–14: mäßiges PTS
- Score ≥ 15 oder Ulcus cruris venosum: schweres PTS
Differenzialdiagnosen
- Neu aufgetretene TVT (evtl. Rezidiv)
- Venöse Insuffizienz anderer Ätiologie
- Beinödeme und/oder Ekzem aus anderen Ursachen
Anamnese
- Anamnestisch TVT
- Mögliche Symptome7
- Schmerz
- Schwellungsgefühl
- Krämpfe
- Schweregefühl
- Gefühl des „müden“ Beins
- Parästhesien
- Claudicatio
- Fragen zum Auftreten der Symptome7
- Persistierend oder intermittierend?
- Zunahme am Ende des Tages?
- Verschlechterung bei langem Stehen oder Gehen?
- Verbesserung bei Hochlagerung des Beines?
Klinische Untersuchung
- Mögliche klinische Zeichen7
- Ödem
- Teleangiektasien
- Venenektasie
- Varizen
- Rötung
- Zyanose
- Hyperpigmentierung
- Ekzem
- Wadenkompressionsschmerz
- Lipodermatosklerose
- Atrophie blanche
- offenes oder abgeheiltes Ulcus cruris venosum
- 80 % der venösen Ulzerationen treten im Innenknöchelbereich auf.
- Ätiologie von Beingeschwüren
- 70 % venös
- 10 % arteriell
- 10 % gemischt venös-arteriell
- 10 % andere Ursachen (z. B. Vaskulitiden, Neuropathie, exogene Ursachen u. a.).
Ergänzende Untersuchungen in der Hausarztpraxis
- Ergänzende Beurteilung der arteriellen Durchblutung
Diagnostik bei Spezialist*innen
- Bei TVT in der Vorgeschichte und klinischer Diagnose eines PTS ist eine routinemäßige Bildgebung/Testung zur Diagnosestellung nicht erforderlich.11
Duplexsonografie
- Indiziert vor allem bei Patient*innen ohne eindeutige TVT in der Anamnese7
- Residuelle Thromben
- Reflux bei Venenklappeninsuffizienz
CT-/MR-Phlebografie
- Vor allem bei V. a. iliakale/kavale Obstruktionen8
Invasive Phlebografie
- Selten indiziert
Funktionsdiagnostik
- Phlebologische Funktionsdiagnostik kann im Einzelfall behandlungsrelevante zusätzliche Informationen liefern, Bedeutung vor allem in der Verlaufskotrolle und Begutachtung
- venöse Verschluss-Plethysmografie (VVP)
- Lichtreflex-Rheografie (LRR)
- Phlebodynamometrie (PDM)
Indikationen zur Überweisung
- Klinische Diagnose/V. a. PTS ohne Anamnese einer TVT
- Weitere Abklärung vor evtl. katheterinterventioneller/chirurgischer Therapie
Therapie
Therapieziele
- Beschwerden lindern.
- Progression vermeiden/verlangsamen, insbesondere die Entstehung eines Ulcus cruris venosum.
Allgemeines
- PTS ist nicht heilbar.8
- Zur Prävention und Behandlung eines PTS können verschiedene Therapieoptionen genutzt bzw. erwogen werden:
- Allgemeinmaßnahmen
- physikalische Therapie
- medikamentöse Therapie
- Kompressionstherapie
- chirurgische Therapie
- endovaskuläre Therapie
- Das Wichtigste zur Vermeidung eines PTS ist die Vermeidung einer TVT.6
- Siehe auch die Artikel:
Allgemeinmaßnahmen
- Patient*innen mit PTS sollten ihr Verhalten im Alltag anpassen:
- Langes Stehen vermeiden.
- Beine regelmäßig hochlagern.
- Beine bewegen zur Aktivierung der Muskelpumpe.
- Einschneidende Kleidungsstücke vermeiden.
- Überwärmung vermeiden.
- Die Haut pflegen.
Physikalische Therapie
- Möglichkeiten der physikalischen Therapie
- Entstauungsgymnastik (Aktivierung der Venenpumpe)
- Bewegungssportarten (vor allem Schwimmen)
- Kneipp-Kaltwasseranwendungen
- manuelle Lymphdrainage
- intermittierende pneumatische Kompression
Kompressionsbehandlung
- Die Kompressionstherapie bewirkt:8
- Reduzierung des Venenquerschnitts und dadurch Verbesserung der Venenklappenfunktion
- Verbesserung des venösen Rückstroms
- Abnahme der Beinödeme
- Die Daten und Empfehlungen zum Nutzen der Kompressionstherapie sind international allerdings uneinheitlich.7,12-18
- Empfehlungen zur Kompressionstherapie:
- frühzeitiger Beginn einer Kompressionstherapie zur Reduktion von Häufigkeit und Schwere des postthrombotischen Syndroms
- nach TVT Kompressionstherapie für mindestens 6 Monate
- Die Entscheidung über Fortsetzung und Dauer ist abhängig von den Symptomen und Zeichen des postthrombotischen Syndroms (z. B. Schmerzen, Schweregefühl, Ödem, Hautveränderungen).
- Verlaufskontrollen in 6- bis 12-monatigen Intervallen
- bei Fortbestehen eines venösen Funktionsdefizits die Kompressionstherapie weiterführen
- Andere Daten weisen darauf hin, dass Stützstrümpfe nach TVT mindestens 2 Jahre getragen werden sollten.3
- Verwendung von individuell angepassten Strümpfen zur Kompression
- Nach der Intensität des Andrucks werden 4 Kompressionsklassen (KKL) unterschieden:
- KKL I (leichte Kompression): 18–21 mmHg
- KKL II (mittlere Kompression): 23–32 mmHg
- KKL III (kräftige Kompression): 34–46 mmHg
- KKL IV (sehr kräftige Kompression): ≥ 49 mmHg
- Beim beginnenden postthrombotischen Syndrom ist die KKL II meist ausreichend.
- Es soll immer die niedrigste wirksame KKL gewählt werden, da dies zu einer besseren Adhärenz führt.
- In schwereren Stadien können Stümpfe der KKL III (oder IV) erforderlich sein.
- Wadenstrümpfe sind vergleichbar effektiv wie Schenkelstrümpfe bei besserer Tolerierbarkeit.17
- Kompressionsstrümpfe sollten zur Entfernung von Schweiß und Schmutz täglich gewaschen werden, im Rahmen der Erstversorgung sollte daher immer eine Zweitverordnung erfolgen.
- Nach der Intensität des Andrucks werden 4 Kompressionsklassen (KKL) unterschieden:
- Im Einzelfall – bei schweren Ödemen oder Ulzerationen – kann auch eine intermittierende pneumatische Kompression eingesetzt werden.7
- Kontraindikationen für eine Kompressionstherapie
- fortgeschrittene PAVK
- Herzinsuffizienz NYHA III–IV
- septische Phlebitis
- Phlegmasia coerulea dolens
- Anwendung unter Abwägung von Nutzen und Risiko
- ausgeprägte nässende Dermatosen
- Unverträglichkeit auf Kompressionsmaterial
- schwere Sensibilitätsstörungen der Extremität
- fortgeschrittene periphere Neuropathie (z. B. bei Diabetes mellitus)
- primär chronische Polyarthritis
- Diuretika sollten im Allgemeinen nicht Bestandteil der Behandlung des PTS sein.7
- allenfalls kurzfristiger Einsatz im Rahmen einer Entstauungstherapie
Behandlung des Ulcus cruris
- Bei der Behandlung des Ulcus cruris wird die Kompressionstherapie klar empfohlen.
- Näheres zur Behandlung des Ulcus cruris siehe Artikel Ulcus cruris venosum und die entsprechenden Leitlinien.
Medikamentöse Therapie
Orale Antikoagulation
- Zur Medikamentenauswahl und Dauer der Antikoagulation nach TVT siehe die Artikel:
- Es ist derzeit nicht bekannt, ob es einen Unterschied zwischen Vit-K-Antagonisten und DOAK hinsichtlich der Verhinderung eines PTS gibt.6
Venenaktive Substanzen
- Wegen fehlender Evidenz und möglicher Langzeitnebenwirkungen gibt es keine Empfehlung für venenaktive Medikamente (z. B. Rutoside).8
Chirurgische und endovaskuläre Therapie
- Ein invasives Verfahren sollte erst bei Versagen der konservativen Therapie erwogen werden.8
- Durchführung in einem Gefäßzentrum mit entsprechender Expertise
Chirurgische Therapie
- Keine randomisierten Studien zur chirurgischen Therapie des PTS vorliegend8
- Optionen sind:8
- Cross-over-Bypass bei einseitigem Beckenvenenverschluss
- femorokavale oder iliokavale Prothesen bei beidseitigem Beckenvenenverschluss oder infrarenalem Cavaverschluss
Endovaskuläre Therapie
- Stentangioplastie der iliakalen Strombahn ist eine Option bei Patient*innen mit schwerem PTS.8,19
- bislang allerdings keine eindeutige Evidenz zum Nutzen
- Die pharmakomechanische Thrombolyse (lokale Lyse plus Entfernung des Thrombus ohne oder mit Stent) bei Patient*innen mit akuter TVT hat in einer kürzlichen Studie nicht zu einer Reduktion des PTS geführt.20
Hybridverfahren
- Operative Desobliteration (Entfernung postthrombotischer Trabekel) in Kombination mit Stentangioplastie8
Verlauf, Komplikationen und Prognose
Komplikationen
- Rezidivthrombose
- Lungenembolie
- Progress des PTS mit Ulzerationen
- Infektionen
- Blutungskomplikationen unter Antikoagulation
Verlauf und Prognose
- Häufig schlechte Prognose mit andauernder Einschränkung21
- Patient*innen mit PTS haben eine signifikant schlechtere Lebensqualität.22
- Die Lebensqualität ist häufig stärker eingeschränkt als bei Patient*innen mit anderen chronischen Erkrankungen wie z. B. Arthrose oder COPD.7
- durchschnittlich 2 Monate pro Jahr arbeitsunfähig, Berentung durchschnittlich 8 Jahre früher
- In den vergangenen Jahren gab es günstigere Berichte: Unter regelmäßiger Kontrolle ist ein stabiler Verlauf bei bis zu 50 % der Betroffenen möglich.21
Verlaufskontrollen
- Regelmäßige hausärztliche Kontrolle
- Evaluation des klinischen Verlaufs
- Motivation der Patient*innen zur Umsetzung der Kompressionstherapie
- Phlebologische Kontrolluntersuchungen in 6- bis 12-monatigen Intervallen
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen
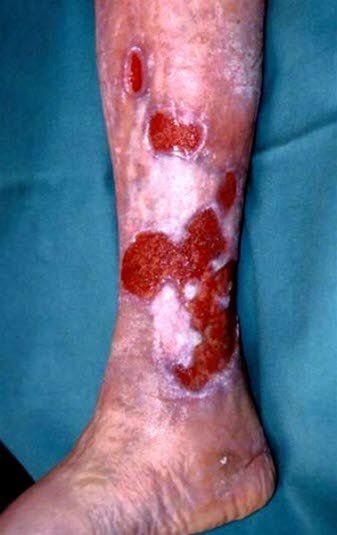
Ulcus cruris venosum, multiple
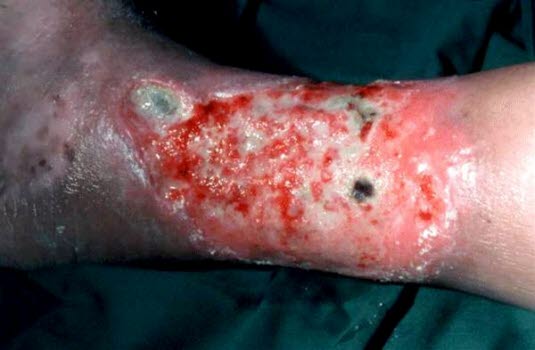
Ulcus cruris venosum, nässendes
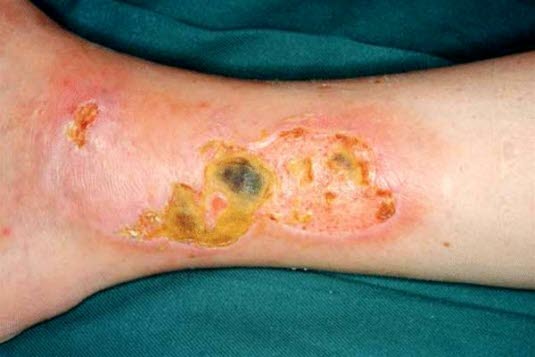
Ulcus cruris venosum, trockenes
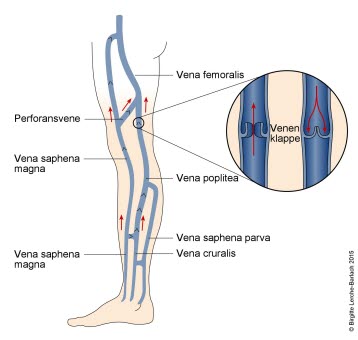
Venen in den unteren Extremitäten
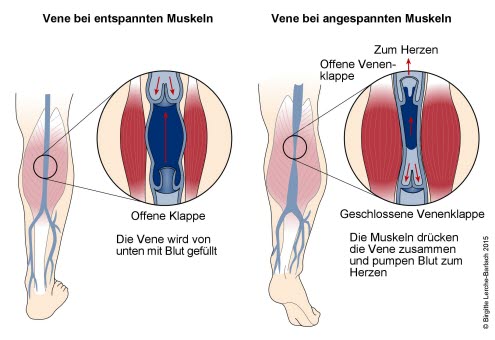
Venen und Venenpumpe
Quellen
Literatur
- Kahn S, Ginsberg J. Relationship between deep venous thrombosis and the postthrombotic syndrome. Arch Intern Med. 2004;164: 17-26. PubMed
- Kahn S, Partsch H, Vedantham S, Prandoni P, Kearon C. Definition of post-thrombotic syndrome of the leg for use in clinical investigations: a recommendation for standardization. J Thromb Haemost 2009;7:879–83. www.ncbi.nlm.nih.gov
- Mol G, van de Ree M, Klok F. One versus two years of elastic compression stockings for prevention of post-thrombotic syndrome (OCTAVIA study): randomised controlled trial. BMJ 2016; 353: i2691. doi:10.1136/bmj.i2691 DOI
- Galanaud J, Monreal M, Kahn S. Epidemiology of the post-thrombotic syndrome. Thromb Res 2018; 164: 100-109. pmid:28844444 PubMed
- Schulman S, Lindmarker P, Holmstrom M, et al. Post-thrombotic syndrome, recurrence, and death 10 years after the first episode of venous thromboembolism treated with warfarin for 6 weeks or 6 months. J Thromb Haemost 2006; 4: 734-742. doi:10.1111/j.1538-7836.2006.01795.x DOI
- Kahn S, Galanaud J, Vedantham S, et al. Guidance for the prevention and treatment of the post-thrombotic syndrome. J Thromb Thrombolysis 2016; 41: 144-153. doi:10.1007/s11239-015-1312-5 DOI
- Kahn S, Comerota A, Cushman M, et al. The postthrombotic syndrome: evidence-based prevention, diagnosis, and treatment strategies: a scientific statement from the American Heart Association. Circulation 2014; 130: 1636-1661. doi:10.1161/CIR.0000000000000130 DOI
- Schleimer K, Barbati ME, Gombert A, et al. The treatment of post-thrombotic syndrome—the role of endovascular recanalization in chronic iliac vein obstruction. Dtsch Arztebl Int 2016; 113: 863-870. doi:10.3238/arztebl.2016.0863 DOI
- Prandoni P, Frulla M, Sartor D, Concolato A, Girolami A. Vein abnormalities and the post-thrombotic syndrome. J Thromb Haemost 2005;3:401–2. www.ncbi.nlm.nih.gov
- Kahn S. Measurement properties of the Villalta scale to define and classify the severity of the post-thrombotic syndrome. J Thromb Haemost 2009;7:884–8. www.ncbi.nlm.nih.gov
- Kahn S. How I treat postthrombotic syndrome. Blood 2009; 114: 4624-4631. doi:10.1182/blood-2009-07-199174 DOI
- Kolbach DN, Sandbrink MWC, Prins MH, Neumann MHAM. Compression therapy for treating stage I and II (Widmer) post-thrombotic syndrome. Cochrane Database of Systematic Reviews 2003, Issue 4. Art. No.: CD004177. DOI: 10.1002/14651858.CD004177. DOI
- Kearon C, Akl EA, Ornelas J. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest 2016 Feb; 149(2): 315-352. pmid:26867832 PubMed
- Kahn SR, Shapiro S, Wells PS, et al. Compression stockings to prevent post-thrombotic syndrome: a randomised placebo-controlled trial. The Lancet 2014; 383: 880-8. pmid:24315521 PubMed
- Jain A, Cifu A. Prevention, Diagnosis, and Treatment of Postthrombotic Syndrome. JAMA 2016; 315: 1048-1049. doi:10.1001/jama.2016.0225 DOI
- Musani MH, Matta F, Yaekoub AY, et al. Venous compression for prevention of postthrombotic syndrome: a meta-analysis. Am J Med. 2010;123:735-740. PubMed
- Prandoni P, Noventa F, Quintavalla R, et al. Thigh-length versus below-knee compression elastic stockings for prevention of the postthrombotic syndrome in patients with proximal-venous thrombosis: a randomized trial. Blood. 2012;119:1561-1565. PubMed
- Berntsen CF, Kristiansen A, Akl EA, et al. Compression Stockings for Preventing the Postthrombotic Syndrome in Patients with Deep Vein Thrombosis. Am J Med 2015; S0002-9343: 30030-9. doi:10.1016/j.amjmed.2015.11.031 DOI
- Nayak L, Vedantham S. Multifaceted Management of the Postthrombotic Syndrome. Semin Intervent Radiol 2012; 29: 16-22. doi:10.1055/s-0032-1302447 DOI
- Vedantham S, Goldhaber S, Julian J, et al. Pharmacomechanical Catheter-Directed Thrombolysis for Deep-Vein Thrombosis. N Engl J Med 2017; 377: 2240-2252. doi:10.1056/NEJMoa1615066 DOI
- Prandoni P, Kahn S. Post-thrombotic syndrome: prevalence, prognosticationand need for progress. Br J Haematol 2009; 145: 286–295 . doi:10.1111/j.1365-2141.2009.07601.x DOI
- Kachroo S, Boyd D, Bookhart B, et al. Quality of life and economic costs associated with postthrombotic syndrome. Am J Health Syst Pharm 2012; Am J Health Syst Pharm: 567-572. doi:10.2146/ajhp110241 DOI
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.