Zusammenfassung
- Definition:Partielle oder vollständige Verlegung der Leit- und/oder Muskelvenen durch Blutgerinnsel, häufig appositionelles Wachstum mit Gefahr der Lungenembolie.
- Häufigkeit:Jährliche Inzidenz symptomatischer TVT ca. 90–130/100.000 Einwohner. Zunahme der Inzidenz mit dem Alter.
- Symptome:Schwellung, Schmerz, Spannungsgefühl, Überwärmung, verstärkte Venenzeichnung.
- Befunde:Klassische klinische Zeichen wie Wadenkompressionsschmerz wenig spezifisch.
- Diagnostik:Dreistufiger Algorithmus mit 1. Bestimmung der klinischen Wahrscheinlichkeit (Wells Score), 2. Bestimmung der D-Dimere, 3. Kompressionsultraschall zur definitiven Diagnosestellung.
- Therapie:Antikoagulation mit niedermolekularem Heparin, Vit-K-Antagonist oder DOAK. Kompressionstherapie zur Vermeidung eines postthrombotischen Syndroms.
Allgemeine Informationen
Definition
- Eine akute tiefe Bein- und Beckenvenenthrombose (TVT) ist definiert als partielle oder vollständige Verlegung der Leit- und/oder Muskelvenen durch Blutgerinnsel.
- häufig appositionelles Wachstum mit Gefahr der Lungenembolie
- Terminologie: Der Begriff Thrombose ist vom griechischen „thrombos“ (Pfropf, Klumpen) abgeleitet.
Klassifikation nach Verlaufstyp
- Aszendierende Thrombose (häufigste Form)
- Ursprung meist in den Unterschenkelvenen, häufig appositionelles Wachstum nach proximal
- Transfasziale Thrombose (deutlich seltener)
- Beginn in oberflächlicher Vene (Vena saphena magna, Vena saphena parva, seltener in Perforansvenen am Unterschenkel) mit Wachstum in das tiefe Venensystem hinein (hohes Embolierisiko)
- Deszendierende Thrombose (Sonderform)
- Beginn in der Vena iliaca (meist in der V. iliaca communis links), Wachstum meist appositionell nach distal, aber auch Ausbreitung nach proximal in die V. cava möglich
Klinische Problemstellung
- Jeder klinische Verdacht auf Venenthrombose soll umgehend soweit abgeklärt werden, dass eine therapeutische Entscheidung erfolgen kann.
- Anamnese und körperliche Untersuchung allein sind hierzu nicht ausreichend.
Häufigkeit
- Inzidenz
- In der Allgemeinbevölkerung liegt die jährliche Inzidenz symptomatischer TVT bei 90–130 pro 100.000 Einw.1
- Alter
- altersabhängiger Anstieg der Inzidenz von 1:100.000 im Kindesalter auf 1:100 im Senium
- 70 % der Thrombosen nach dem 70. Lebensjahr
- Inzidenz bei Bewohner*innen von Pflegeeinrichtungen im Vergleich zur Gesamtbevölkerung mehrfach erhöht2
- Geschlecht
- Männer und Frauen sind etwa gleich häufig betroffen.
- Rezidive
- Männer mit höherem Rezidivrisiko3
Ätiologie und Pathogenese
- Die Virchow-Trias beschreibt die wichtigsten pathogenetischen Faktoren für die Entstehung einer Thrombose.
- Verlangsamung des Blutflusses
- geänderte Blutzusammensetzung
- pathologische Veränderungen der Gefäßwand
- Disposition
- Eine Vielzahl von prädisponierenden Faktoren/Erkrankungen erhöhen das individuelle Risiko, dass die pathogenetischen Mechanismen der Virchow-Trias zur Thrombusbildung führen.
- Lediglich in ca. 10 % der Fälle können keine Risikofaktoren identifiziert werden.
Prädisponierende Faktoren
Transiente Faktoren
- Größere Operation in den vergangenen 3 Monaten
- Trauma (vor allem der unteren Extremitäten)
- Immobilisierung > 3 Tage
- Langstreckenflug in den vergangenen 4 Wochen
- Infektionen
- Dehydration
- Schwangerschaft und postpartale Phase
- Orale Kontrazeptiva (v. a. 3. und 4. Generation), vor allem in Kombination mit Rauchen
Chronische Faktoren
- Höheres Alter
- Gebrechlichkeit
- St. n. TVT/LE, postthrombotisches Syndrom
- Adipositas
- Thrombophilie, heparininduzierte Thrombopenie II
- Chronische Erkrankungen
- Malignome
- chronisch venöse Insuffizienz
- Herzinsuffizienz
- COPD
- nephrotisches Syndrom
- St. n. Schlaganfall
- Autoimmunerkrankungen (z. B. SLE/Antiphospholipid-Syndrom, Vaskulitiden)
- chronisch-entzündliche Darmerkrankungen
- hämatologische Erkrankungen (z. B. myeloproliferative Erkrankungen)
- Medikamente (z. B. Kortikosteroide, postmenopausale Hormonbehandlung, Tamoxifen, Testosteronsubstitution)
ICD-10
- I80 Thrombose, Phlebitis und Thrombophlebitis
- I80.2 Thrombose, Phlebitis und Thrombophlebitis sonstiger tiefer Gefäße der unteren Extremitäten
- O22 Venenkrankheiten und Hämorrhoiden als Komplikationen in der Schwangerschaft
- O22.3 Tiefe Venenthrombose in der Schwangerschaft
- O87 Venenkrankheiten und Hämorrhoiden als Komplikationen im Wochenbett
- O87.1 Tiefe Venenthrombose im Wochenbett
Diagnostik
Diagnostische Kriterien
- Verdachtsdiagnose durch Anamnese, Klinik und evtl. laborchemische Bestimmung der D-Dimere
- Die definitive Diagnose erfolgt durch Bildgebung (meist Kompressionsultraschall).
Diagnostischer Algorithmus
- Der primäre klinische V. a. eine TVT ergibt sich üblicherweise aus Symptomen wie Schwellung, Schmerz, Spannungsgefühl, Berührungsempfindlichkeit, Überwärmung, verstärkte Venenzeichnung.
- Die weitere Abklärung sollte entlang eines klar definierten Untersuchungsalgorithmus auf tiefe Venenthrombose (bzw. Lungenembolie) erfolgen, dieser besteht aus der Abfolge von:
- Abschätzung der klinischen Wahrscheinlichkeit einer TVT
- D-Dimer-Test (Durchführung abhängig von der klinischen Wahrscheinlichkeit)
- Bildgebung zur definitiven Diagnosestellung, überwiegend durch Kompressionsultraschall.
Abschätzung der klinischen Wahrscheinlichkeit
- Durch die Anwendung von Scores kann eine standardisierte Abschätzung der klinischen Wahrscheinlichkeit für das Vorliegen einer TVT vorgenommen werden.4
- Alternativ kann gemäß der Leitlinien auch eine nicht-formalisierte, empirische Beurteilung durch erfahrene Untersucher*innen herangezogen werden.
- Der gebräuchlichste und empfohlene Score ist der Wells Score.
- Der Wells-Score ergibt sich aus anamnestischen und klinischen Kriterien und ist somit einfach und schnell zu erheben:
- jeweils + 1 Punkt für:
- aktive Tumorerkrankung
- Lähmung oder kürzliche Immobilisation der Beine
- Bettruhe (> 3 Tage); große Chirurgie (< 12 Wochen)
- Schmerz/Verhärtung entlang der tiefen Venen
- Schwellung ganzes Bein
- Unterschenkelschwellung > 3 cm gegenüber Gegenseite
- eindrückbares Ödem am symptomatischen Bein
- Kollateralvenen
- frühere, dokumentierte TVT
- – 2 Punkte für:
- alternative Diagnose mindestens ebenso wahrscheinlich wie Venenthrombose
- jeweils + 1 Punkt für:
- Gesamt-Score, dichotomische Beurteilung
- ≤ 1 Punkt: Wahrscheinlichkeit für TVT nicht hoch
- ≥ 2 Punkte: Wahrscheinlichkeit für TVT hoch
Weiteres diagnostisches Vorgehen abhängig von der Beurteilung der klinischen Wahrscheinlichkeit
- Je nach der klinischen Wahrscheinlichkeit erfolgt das weitere diagnostische Vorgehen:
- Wells-Score ≤ 1 (Wahrscheinlichkeit nicht hoch): D-Dimere bestimmen.
- Wells-Score ≥ 2 (Wahrscheinlichkeit hoch): direkt Bildgebung (keine Bestimmung der D-Dimere!)
- Bei hoher klinischer Wahrscheinlichkeit kann nach ärztlicher Einschätzung eine Antikoagulationsbehandlung bereits vor der Bildgebung begonnen werden.
Bestimmung der D-Dimere
- D-Dimere sind als Fibrinspaltprodukt bei Patient*innen mit TVT erhöht.
- Der Test ist allerdings unspezifisch, eine Erhöhung ist auch bei zahlreichen anderen Ursachen (z. B. Malignom, Trauma, Blutung, Infektion, Entzündung, Schwangerschaft) möglich.
- D-Dimer-Test nur nach vorheriger Einschätzung der klinischen Wahrscheinlichkeit!
- Hoher negativer prädiktiver Wert der D-Dimere bei Patient*innen ohne hohe klinische Wahrscheinlichkeit, d. h. negative D-Dimere schließen bei diesen Patient*innen eine Thrombose weitgehend aus.
- Bei Patient*innen mit hoher klinischer Wahrscheinlichkeit ist der negativ prädiktive Wert weniger genau, daher bei diesen Patient*innen keine Bestimmung der D-Dimere, sondern direkte Bildgebung.
- Beurteilung des D-Dimer-Wertes
- Der angegebene Grenzwert liegt für die meisten D-Dimer-Tests bei 500 μg/l.
- Zu berücksichtigen ist allerdings, dass ältere Patient*innen physiologisch höhere D-Dimer-Werte aufweisen.
- Durch Verwendung eines altersabhängigen Grenzwerts ab 50 Jahren (Lebensalter × 10 µg/l) kann die Spezifität des Tests ohne Einbußen bei der Sensitivität erhöht werden.
Weiteres diagnostisches Vorgehen abhängig vom Ergebnis des D-Dimer-Tests
- Klinische Wahrscheinlichkeit nicht hoch (Wells-Score ≤ 1), D-Dimere normal:
- TVT ausgeschlossen, keine weitere Diagnostik
- Klinische Wahrscheinlichkeit nicht hoch (Wells-Score ≤ 1), D-Dimere erhöht:
- Bildgebung (Ultraschall)
Kompressionsultraschall/Farbduplexsonografie
- Methode der Wahl zum Nachweis oder Ausschluss einer TVT
- hohe Sensitivität und Spezifität
- im Einzelfall Einschränkung der Untersuchungsbedingungen durch Ödem, Hämatom, Wunde, Narbe oder Adipositas
- Darstellung der gesamten venösen Strombahn von Leistenband bis Knöchel
- genaue Untersuchung auch von Unterschenkel- und Muskelvenen
- Bei Hinweisen durch das Flussprofil auf Thrombose der Beckenstrombahn ergänzende farbduplexsonografische Darstellung der Venae iliacae externae und communes
- Bei negativem komplettem Beinvenenultraschall kann eine TVT in der Regel primär (ohne Wiederholungsuntersuchung) ausgeschlossen werden.
Weiteres Vorgehen nach Ultraschalluntersuchung
- Thrombusnachweis: sofortiger Beginn einer Antikoagulation
- Thrombusausschluss: keine Therapie
Diagnostisches Vorgehen bei speziellen Gruppen
Schwangerschaft
- Detaillierte Ausführungen zum Vorgehen in der Schwangerschaft siehe Artikel Venöse Thromboembolie in der Schwangerschaft.
Malignome
- Bei Patient*innen mit Malignom ist
- die klinische Wahrscheinlichkeit für eine TVT von vornherein erhöht.
- der D-Dimer-Wert üblicherweise ohnehin erhöht und daher zur Differenzierung nicht geeignet.
- Die Diagnostik sollte bei klinischem Verdacht daher primär mit dem Ultraschall erfolgen.
Oberflächliche Venenthrombosen
- Bei V. a. eine oberflächliche Venenthrombose der Vena saphena magna oder parva bzw. deren akzessorischen Venen sollte eine sonografische Abklärung erfolgen, da in bis zu 30 % der Fälle eine asymptomatische TVT vorliegt.
Differenzialdiagnosen
- Oberflächliche Thrombophlebitis
- Postthrombotisches Syndrom
- Chronisch venöse Insuffizienz
- Venöses Kompressionssyndrom
- Erysipel
- Phlegmone
- Traumatisches Ödem
- Muskelriss
- Baker-Zyste (rupturiert)
- Begleitödem bei Arthritis/aktivierter Arthrose
- Lymphödem
- Acrodermatitis atrophicans
- Akute arterielle Durchblutungsstörung
- Herzinsuffizienz
- Hypoalbuminämisches Ödem
- Nephrotisches Syndrom
- Arzneimittelinduzierte Ödeme (z. B. Ca-Antagonisten)
Anamnese
- Mögliche Symptome
- Schwellung
- Schmerz
- Spannungsgefühl
- Berührungsempfindlichkeit
- Überwärmung
- verstärkte Venenzeichnung
- Zyanose
- Vorgeschichte
- Wichtig ist die systematische Abfrage nach prädisponierenden Faktoren (s. o.).
- Medikamente
- thrombogene Medikation (z. B. Östrogene, Kortikosteroide)
- bestehende Antikoagulanzientherapie
Klinische Untersuchung
- Klassische klinische Untersuchungszeichen sind wenig zuverlässig und erlauben alleine keine Diagnose.5
- Meyer: Wadenkompressionsschmerz
- Löwenberg: Wadenschmerz bei Kompression mit Blutdruckmanschette
- Homans: Wadenschmerz bei Dorsalextension des Fußes
- Payr: Schmerz bei Druck auf die Fußsohle medial
- Bisgaard: Druckschmerz retromalleolär
Ergänzende Untersuchungen in der Hausarztpraxis
Labor
- D-Dimer-Test
- Zu empfehlen ist eine quantitative Bestimmung im Labor.
- Grenzwert üblicherweise bei 500 μg/l
- ab dem 50. LJ sollte ein höherer Grenzwert verwendet werden (Lebensalter × 10 µg/l), hierdurch bessere Spezifität ohne Einbuße bei der Sensitivität.
- Daneben stehen auch Point-of-Care-Tests zur Verfügung.
- Zu empfehlen ist eine quantitative Bestimmung im Labor.
Diagnostik bei Spezialist*innen
Labor: Thrombophilie-Screening
- Screening auf Thrombophilie ist keine Routinemaßnahme.
- Keine Bedeutung für Diagnostik auf TVT oder initiale Therapie
- Langfristige therapeutische Konsequenzen eher selten
- Dies gilt insbesondere für milde thrombophile Störungen wie die heterozygote Faktor-V-Mutation.
- Gründe für ein Screening können sein:,
- junges Alter
- positive Familienanamnese
- V. a. Antiphospholipid-Syndrom
- ungewöhnliche Lokalisation/fulminantes Ausmaß
- Bei Indikation zum Thrombophiliescreening sollte dieses durchgeführt werden.
- gleich im Rahmen der Initialdiagnostik oder
- am Ende eines zunächst geplanten Antikoagulationszeitraums
- Bei unmittelbaren Konsequenzen für die Behandlungsdauer kurze Unterbrechung der Antikoagulation, um eine Interaktion auszuschließen.
- bei OAK mit Vit-K-Antagonist evtl. Bridging mit niedermolekularem Heparin, hierdurch keine Beeinflussung der Thrombophiliediagnostik
Kompressionsultraschall/Farbduplexsonografie
- Verwendete Techniken
- Kompressionsultraschall: Thrombosenachweis durch Nicht-Komprimierbarkeit der Vene und Binnenechos
- Farbduplexsonografie: Beurteilung der Abflusssituation der Beckenvenen
- Standardisierte Untersuchung von:
- kleinem Becken
- Oberschenkelvenen
- Unterschenkelvenen einschließlich Muskelvenen.
- Der Verschluss sollte genau beschrieben werden, die Diagnose einer Ein-, Zwei-, Drei-, oder Vier-Etagen-TVT ist nicht ausreichend.
- Verlauf der TVT sowie der „Endzustand“ der geschädigten Vene sollten genau dokumentiert werden: wichtig zur Abgrenzung von Rezidivthrombosen gegen postthrombotische Veränderungen.
Weitere Bildgebungsverfahren
- MRT- und CT-Phlebografie
- Schnittbildverfahren können bei Beckenvenen-/Vena-cava-Thrombose zur Feststellung der genauen Ausdehnung verwendet werden.
- Invasive Phlebografie
- Spielt heutzutage im klinischen Alltag keine wesentliche Rolle mehr.
Untersuchung auf zugrunde liegende Malignome
- Bei ca. 5–15 % der Patient*innen besteht eine noch nicht bekannte maligne Grunderkrankung.6
- Bei ungeklärter Ätiologie sollte eine Abklärung im Hinblick auf ein Malignom erfolgen.
- Die durchgeführte Diagnostik richtet sich dabei nach der:
- Anamnese
- alters- und geschlechtsspezifischen Risikokonstellation
Indikationen zur Krankenhauseinweisung
- Bei Möglichkeit zur raschen Durchführung der Diagnostik einschließlich ggf. Kompressionsultraschall kann diese ambulant durchgeführt werden.
- ansonsten Einweisung ins Krankenhaus
- Bei Verdacht auf Lungenembolie stationäre Einweisung
Therapie
Therapieziele
- Vermeidung einer Lungenembolie
- Erhalt der venösen Drainage, Vermeidung eines postthrombotischen Syndroms (PTS)
Allgemeines zur Therapie
Elemente der Behandlung
- Elemente der Behandlung sind:
- Antikoagulation
- Kompressionstherapie
- im Einzelfall rekanalisierende Maßnahmen
Ort der Behandlung
- In der Regel ambulante Durchführung der Behandlung
- Hospitalisierung meist nur bei schweren Begleiterkrankungen erforderlich
- Auch die akute Therapie kann von erfahrenen niedergelassenen Ärzt*innen durchgeführt werden, wesentlich sind dabei:
- zweifelsfreie Sicherung der Diagnose
- Gewährleistung der Applikation einer Antikoagulation in der richtigen Dosis
- ärztliche Erreichbarkeit, ggf. in Zusammenarbeit mit Krankenhaus
- evtl. Unterstützung durch Sozialdienst (Injektionen, Kompressionstherapie)
Phasen der Antikoagulation und dabei verwendete Substanzen
Initialtherapie
- Die Initialtherapie dauert einige bis max. 21 Tage in Abhängigkeit von den verwendeten Substanzen
- niedermolekulare Heparine (NMH)
- unfraktioniertes Heparin
- heutzutage nur selten indiziert, z. B. bei schwerer Niereninsuffizienz
- weniger effektiv als NMH7
- Fondaparinux
- direkte orale Antikoagulanzien (DOAK)
Erhaltungstherapie
- Dauer 3–6 Monate
- Vit-K-Antagonist (Phenprocoumon)
- DOAK
- NMH bei Malignomen
Verlängerte Erhaltungstherapie
- Dauer > 3–6 Monate in Abhängigkeit von der Beurteilung des Rezidivrisikos
- Vit-K-Antagonist (Phenprocoumon)
- DOAK
- NMH (Malignome)
- ASS
Initialtherapie
- Zu Details der verwendeten Substanzen (Wirkmechanismen, Dosierungen, Nebenwirkungen, Kontraindikationen, notwendige Laborkontrollen, Antidote) siehe Artikel Antikoagulation
- Die therapeutische Antikoagulation soll sofort nach Diagnosestellung begonnen werden.
- Bei hoher klinischer Wahrscheinlichkeit kann eine Behandlung nach ärztlicher Einschätzung auch schon vor der Bildgebung eingeleitet werden.
- Bei Beginn mit einem NMH wird dieses üblicherweise mindestens 5 Tage verabreicht bis zu einer Dauer von meist max. 7–10 Tage.
- Ist eine Erhaltungstherapie mit Vit-K-Antagonist geplant, wird diese überlappend begonnen (Ziel-INR 2,0–3,0).
- Bei der geplanten Anwendung von DOAK sind zwei Gruppen zu unterscheiden:
- Bei Verwendung von Dabigatran oder Edoxaban wird zunächst 5 Tage mit NMH anbehandelt, dann erfolgt die weitere Therapie mit dem DOAK.
- Bei Verwendung von Rivaroxaban oder Apixaban kann die Behandlung sofort mit dem DOAK begonnen werden (zu Beginn in erhöhter Dosierung).
Medikamente
Niedermolekulare Heparine (NMH)8
- Dalteparin: 100 IE/kg 2 x tgl. oder 200 IE/kg 1 x tgl.
- Enoxaparin: 1,0 mg/kg 2 x tgl.
- Tinzaparin: 175 IE/kg 1 x tgl.
- Certoparin: 8.000 IE 2 x tgl.
- Nadroparin 0,1 ml/10 kg 1–2 x tgl.
Fondaparinux
- 7,5 mg 1 x tgl. bzw. bei < 50 kg KG 5 mg 1 x tgl., bei > 100 kg KG 10 mg 1 x tgl.
Vit-K-Antagonist (Phenprocoumon)
- Aufsättigung (normalgewichtig, lebergesund)
- 1. Tag: 9 mg
- 2. und 3. Tag: 6 mg
- ab 4. Tag tgl. INR, bis zur Erreichung des Zielwertes
- Bei älteren Patient*innen, Menschen mit beeinträchtigter Nahrungsaufnahme oder Lebererkrankungen sowie bei Personen mit erhöhtem Blutungsrisiko: nicht mehr als 3–6 mg tgl. und INR-Bestimmung am 3. Tag
- Bei Erreichen des INR-Ziels: individuelle Erhaltungsdosis, in der Regel 1,5–4,5 mg/d
Direkte orale Antikoagulanzien (DOAK)
- Rivaroxaban
- 2 x 15 mg/d über 21 Tage, dann 1 x 20 mg/d
- Apixaban
- 2 x 10 mg/d über 7 Tage, dann 2 x 5 mg/d
- Edoxaban
- 5 Tage NMH, dann 1 x 60 mg/d
- Dabigatran
- 5 Tage NMH, dann 2 x 150 mg/d (2 x 110 mg/d empfohlen bei Patient*innen ≥ 80 Jahre und bei gleichzeitiger Verapamil-Einnahme)
Erhaltungstherapie
- An die Initialphase soll sich eine Erhaltungstherapie von 3–6 Monaten anschließen.
- Diese kann mit Vit-K-Antagonist oder DOAK durchgeführt werden, wobei die Entscheidung über die verwendete Substanz üblicherweise bereits initial getroffen wird.
- Bei Tumorpatient*innen werden NMH in der Erhaltungstherapie verwendet.
- Die Vor- und Nachteile der DOAK gegenüber VKA werden kontrovers diskutiert.
- Nicht eingesetzt werden sollten DOAK statt VKA bei Patient*innen
- die mit VKA gut einzustellen sind bzw. deren INR unter bereits bestehender Therapie mit VKA stabil im therapeutischen Bereich liegt (INR > 70 % der Zeit im therapeutischen Bereich)
- mit unsicherer Adhärenz
- mit einem hohen Risiko für gastrointestinale Blutungen (z. B. bei Ulcus ventriculi oder duodeni, Ösophagusvarizen, chronisch entzündliche Darmerkrankungen, Divertikulitis)
- mit schwerer Nierenfunktionseinschränkung (CrCl < 30 ml/min)
- im Fall von Edoxaban mit einer hoch normalen Nierenfunktion (laut der US-amerikanischen Food and Drug Administration [FDA] CrCl > 95 ml/min Kontraindikation)
- die Arzneimittel einnehmen, für die als Inhibitoren oder Induktoren von Cytochrom-P450-3A4(CYP3A4)- und P-Glykoprotein(P-gp)-Wechselwirkungen beschrieben sind, sodass eine gleichzeitige Behandlung kontraindiziert ist oder vermieden werden sollte (darunter Amiodaron, Dronedaron, Azol-Antimykotika, Carbamazepin, Ciclosporin, Clarithromycin, johanniskrauthaltige Präparate, HIV-Proteaseinhibitoren, Verapamil)
- mit mechanischen Herzklappen einschließlich perkutanem Aortenklappenersatz
- Nur nach eingehender Prüfung sollten DOAK statt VKA angewendet werden
- bei mäßiger Nierenfunktionseinschränkung (CrCl 30–50 ml/min: Dosisreduktion erforderlich bei Dabigatran, Edoxaban, Rivaroxaban, nicht bei Apixaban).
- bei Multimedikation (mehr als 5 systemisch wirksame Arzneimittel): Klinisch relevante Wechselwirkungen zwischen anderen Arzneimitteln und DOAK sind bisher nur unzureichend bekannt und können wegen der fehlenden Möglichkeit von Laborkontrollen nicht erfasst werden
- DOAK können eine Option statt VKA sein für Patient*innen
- die wegen einer VTE sehr wahrscheinlich nur kurzfristig (z. B. bis 3 Monate) eine orale Antikoagulation benötigen
- mit einem hohen Risiko für intrazerebrale Blutungen, wenn der Nutzen einer Antikoagulation als grundsätzlich größer eingeschätzt wird als das Risiko durch eine intrazerebrale Blutung
- mit einem erhöhten Risiko für spezifische Arzneimittel- oder Nahrungsmittelinteraktionen unter VKA
- mit stark schwankenden INR-Werten trotz regelmäßiger Einnahme von VKA, für die eine regelmäßige Kontrolle des INR-Wertes schwierig ist
Verlängerte Erhaltungstherapie
- Nach 3–6 Monaten soll eine Entscheidung über Beendigung oder Weiterführen der Antikoagulation getroffen werden.
- Die Frage nach einer Verlängerung der Erhaltungstherapie ist allerdings komplex und letztlich eine Abwägungsfrage zwischen:
- geschätztem Rezidivrisiko und
- Blutungsrisiko unter Antikoagulation
Risikoeinschätzung
- Patient*innen mit einem eindeutigen passageren Risikofaktor für eine TVT werden im Allgemeinen nicht dauerhaft antikoaguliert, hierzu zählen z. B. Trauma, Operation, akute internistische Erkrankung, Schwangerschaft.
- Grundsätzlich gilt:
- Je spontaner die Thrombose aufgetreten ist, desto höher das Rezidivrisiko.
- Je stärker mit einem transienten Risikofaktor assoziiert die Thrombose aufgetreten ist, desto niedriger das Rezidivrisiko.
- Kriterien für eine verlängerte Erhaltungstherapie sind:
- Risikofaktor: fortbestehend
- Genese: unklar
- Rezidiv: ja
- Blutungsrisiko: gering
- bisherige Antikoagulationsqualität: gut
- D-Dimere (nach Therapieende): erhöht
- Residualthrombus: vorhanden
- Geschlecht: männlich
- Thrombus-Ausdehnung: langstreckig
- Thrombus-Lokalisation: proximal
- schwere Thrombophilie: ja (z. B. Antiphospholipid-Syndrom)
- Patientenpräferenz: dafür
- Insgesamt besteht für die Entscheidung für oder gegen eine verlängerte Erhaltungstherapie ein recht breiter Ermessensspielraum, die Präferenz der Patient*innen nach Nutzen-Risiko-Aufklärung sollte auf jeden Fall in den Entscheidungsprozess einbezogen werden.
Medikation für verlängerte Erhaltungstherapie
Vitamin-K-Antagonist
- Traditionelle verlängerte Erhaltungstherapie mit Vitamin-K-Antagonist (INR 2,0–3,0)
DOAK
- 2 DOAK sind für die verlängerte Erhaltungstherapie in reduzierter Dosierung zugelassen:
- Rivaroxaban 1 x 10 mg/d
- Apixaban 2 x 2,5 mg/d.
ASS
- Bei Patient*innen, die eine verlängerte Antikoagulation nicht wünschen oder nicht tolerieren, kann eine Behandlung mit ASS erwogen werden.9
- In mehreren Studien konnte gezeigt werden, dass ASS 100 mg/d das Rezidivrisiko senkt, wenn auch weniger stark als Antikoagulanzien.10-12
Besondere Patientengruppen
Schwangerschaft und Stillzeit
- Siehe Artikel Venöse Thrombembolie in der Schwangerschaft.
Malignome
- Tumorpatient*innen sollten initial für 3–6 Monate mit niedermolekularem Heparin behandelt werden, Art und Dauer der nachfolgenden Antikoagulation richtet sich nach der Aktivität des Tumors und dem Blutungsrisiko.
- Nach Möglichkeit sollte die Antikoagulation für die gesamte Dauer der aktiven Tumorerkrankung erfolgen.
- DOAK scheinen eine wirksame und sichere Therapiealternative zu NMH zu sein, die Erfahrungen sind aber noch begrenzt.
- Die Antikoagulationsform sollte daher individuell mit den Patient*innen besprochen werden.
Isolierte distale Thrombose
- Geringeres Schadenspotenzial (weniger Rezidive, seltener postthrombotisches Syndrom),
- Die isolierte distale Venenthrombose sollte nicht länger als 3 Monate antikoaguliert werden, auch wenn sie als Rezidiv oder idiopathisch auftritt.
Oberflächliche Venenthrombose
- Die Indikation zu einer Antikoagulation soll geprüft werden.
- Bei transfaszialem Thrombuswachstum soll wie bei einer tiefen Venenthrombose vorgegangen werden.
Thrombose von Arm- und Schultervenen
- Bei einer Thrombose von Arm- und Schultervenen sollte eine Antikoagulation über 3 Monate erfolgen.
Katheterassoziierte Thrombose
- Eine katheterassoziierte Thrombose sollte 6–12 Wochen antikoaguliert werden.
Kompressionstherapie
- Zur Vermeidung eines postthrombotischen Syndroms sollte frühzeitig eine Kompressionstherapie begonnen werden.
- allerdings nur geringe wissenschaftliche Evidenz13
- Kompression nur am von der TVT betroffenen Bein erforderlich
- In der Regel genügen Wadenkompressionsstrümpfe der Kompressionsklasse II
- Notwendigkeit einer Behandlung > 3 Monate abhängig von Venenstatus und Schwellneigung
Rekanalisierende Maßnahmen/V.-cava-Filter
- Rekanalisierende Maßnahmen können im Einzelfall bei iliofemoraler Thrombose indiziert sein.
- Wenn indiziert, Durchführung so früh wie möglich in spezialisiertem Zentrum
- venöse Thrombektomie
- Kombination von Thrombolyse und Thrombektomie
- kathetergestützte pharmakomechanische Thrombektomie
- Der Nutzen eines V.-cava-Filters zur Vermeidung von Lungenembolien ist fraglich und bleibt Einzelfällen vorbehalten.
Spezielle Situationen
Bridging
- Siehe Artikel Antikoagulation
Antikoagulierte Patient*innen in zahnärztlicher Behandlung
- Siehe Artikel Antikoagulation
Verlauf, Komplikationen und Prognose
Komplikationen
- Lungenembolie
- Phlegmasia coerulea dolens
- Postthrombotisches Syndrom
- Blutungen unter Antikoagulation
- unter verlängerter Erhaltungstherapie Blutungsrisiko 1–3 % pro Jahr
Verlauf und Prognose
- In der Mehrzahl der Fälle komplikationslose Auflösung der Thrombose14
- Bei proximaler Beinvenenthrombose Lungenembolie in 50 % der Fälle (häufig asymptomatisch)
- Während der ersten 6 Monate der Antikoagulation nach venöser Thrombembolie beträgt die Rate tödlicher Rezidive 0,5 % und die Rate tödlicher Blutungen 0,2 %.15
- Das Langzeitüberleben ist bei Patient*innen ohne Tumor nach der Phase der Erhaltungstherapie nicht wesentlich reduziert.16
- Bei spontaner Thrombose beträgt das Rezidivrisiko ohne Antikoagulation (nach mindestens 3 Monate Erhaltungstherapie):17
- 10 % im 1. Jahr
- 16 % nach 2 Jahren
- 25 % nach 4 Jahren
- 36 % nach 10 Jahren
- Männer haben ein 60 % höheres Rezidivrisiko als Frauen.
- Bei ca. 25 % der Fälle mit proximaler TVT Entwicklung eines postthrombotischen Syndroms14
- meistens in den ersten 2 Jahren
Verlaufskontrolle
- Klinische Untersuchung in den ersten Wochen nach Therapieeinleitung zur Überprüfung der Therapie
- Begutachtung des Lokalbefundes
- Überprüfung der Verträglichkeit der Medikation
- Optimierung der Kompressionstherapie
- Angiologische Kontrolle nach 3 Monaten und/oder bei Abschluss der Antikoagulation
- Erfassung und Dokumentation des Ausmaßes evtl. Residualthromben
Weitere Informationen
- Perioperative Thromboseprophylaxe
- Thromboseprophylaxe bei internistischen Patient*innen
- Thromboseprophylaxe bei Flugreisen
- Kontrazeption, Methodenwahl
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen
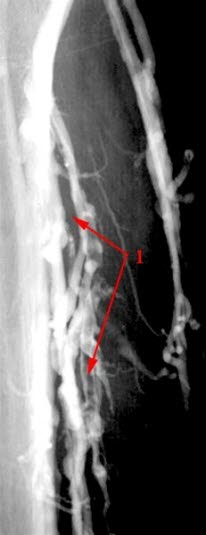
Tiefe Venenthrombose, Venografie
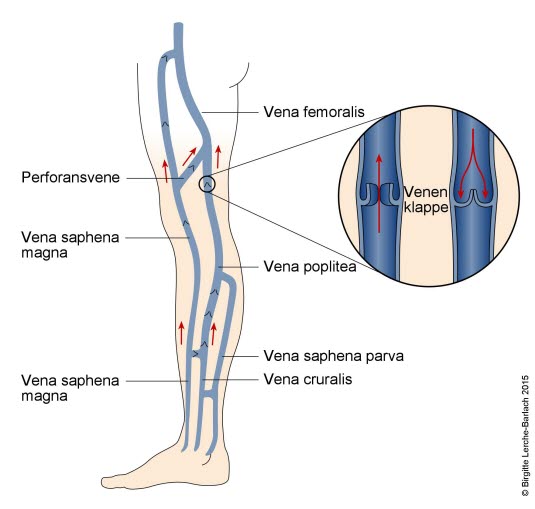
Venen in den unteren Extremitäten
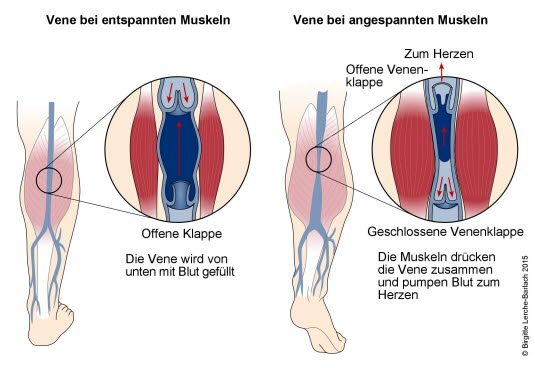
Venen und Muskelpumpe
Quellen
Leitlinien
- European Society of Cardiology. Guidelines for the diagnosis and management of acute pulmonary embolism. Stand 2019. www.escardio.org
Literatur
- Heit JA, Silverstein MD, Mohr DN, et al. The epidemiology of venous thromboembolism in the community. Thromb Haemost 2001; 86: 452-63. PMID: 11487036 PubMed
- Apenteng PN, Hobbs FR, Roalfe A, et al. Incidence of venous thromboembolism in care homes: a prospective cohort study. Br J Gen Pract 2017 Feb; 67 (655): e130-e137. pmid:28093420 PubMed
- Douketis J, Tosetto A, Marucci M, et al. Risk of recurrence after venous thromboembolism in men and women: patient level meta-analysis. BMJ 2011; 342: d813. www.ncbi.nlm.nih.gov
- van der Velde E, Toll D, Ten Cate-Hoek A et al. Comparing the diagnostic performance of 2 clinical decision rules to rule out deep vein thrombosis in primary care patients. Ann Fam Med 2011; 9: 31-6. PubMed
- Goodacre S, Sutton AJ, Sampson FC. Meta-analysis: The value of clinical assessment in the diagnosis of deep vein thrombosis. Ann Intern Med 2005; 143: 129-39. PubMed
- Khan F, Vaillancourt C, Carrier M: Should we screen extensively for cancer after provoked venous thrombosis. BMJ 2017, Mar 22; 356:j1081. www.ncbi.nlm.nih.gov
- Castellucci LA, Cameron C, Le Gal G, et al. Clinical and safety outcomes associated with treatment of acute venous thromboembolism. A systematic review and meta-analysis. JAMA 2014; 312: 1122-35. doi:10.1001/jama.2014.10538. DOI
- Testroote M, Stigter WA, Janssen L, et al. Low molecular weight heparin for prevention of venous thromboembolism in patients with lower-leg immobilization. Cochrane Database Syst Rev. 2014 Apr 25;4:CD006681 Cochrane (DOI)
- European Society of Cardiology. Guidelines for the diagnosis and management of acute pulmonary embolism. Stand 2019. www.escardio.org
- Simes J, Becattini C, Agnelli G, et al. Aspirin for the Prevention of Recurrent Venous Thromboembolism: The INSPIRE Collaboration. Circulation. 2014 Sep 23;130(13):1062-71 PubMed
- Beccatini C, Agnelli G, Schenone A, et al. Aspirin for preventing the recurrence of venous thromboembolism. N Engl J Med 2012; 366: 1959-67. New England Journal of Medicine
- Brighton TA, Eikelbooom JW, Mann K, et al. Low-dose aspirin for preventing recurrent venous thromboembolism. N Engl J Med 2012. doi:10.1056/NEJMoa1210384 DOI
- Appelen D, van Loo E, Prins MH, Neumann MHAM, Kolbach DN. Compression therapy for prevention of post-thrombotic syndrome. Cochrane Database of Systematic Reviews 2017, Issue 9. www.cochrane.org
- Patel K. Deep Venous Thrombosis (DVT). Medscape, updated June 05, 2019. Zugriff 27.11.21. emedicine.medscape.com
- Carrier M, Le Gal G, Wells PS et al. Systematic review: case-fatality rates of recurrent Venous Thromboembolism and major Bleeding Events Among Patients treated for venous Thromboembolism. Ann Intern Med 2010; 152: 578-589. www.ncbi.nlm.nih.gov
- Reitter SE, Waldhoer T, Mayerhofer M et al. Long-term survival of patients with a history of venous thromboembolism. Ann Hematol Feb 2011. www.researchgate.net
- Khan F, Rahman A, Carrier M, et al. Long term risk of symptomatic recurrent venous thromboembolism after discontinuation of anticoagulant treatment for first unprovoked venous thromboembolism event: systematic review and meta-analysis. BMJ 2019; 366: l4363. pmid:31340984. www.ncbi.nlm.nih.gov
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.
- Marlies Karsch-Völk, Dr. med, Fachärztin für Allgemeinmedizin, München
- Guido Schmiemann, Dr. med., Facharzt für Allgemeinmedizin, Bremen (Review)