Allgemeine Informationen
Definition
- Die H.-pylori-Infektion ist eine bakterielle Erkrankung des Magens, unabhängig von Symptomen bzw. klinischem Erscheinungsbild.
Häufigkeit
- Prävalenz und Inzidenz
- global eine der häufigsten Infektionen des Menschen
- Daten aus den 2000er Jahren zeigen eine weltweite Prävalenz von bis zu 50 % mit großer regionaler Variabilität.1
- Inzidenz rückläufig, auch wegen erfolgreicher Eradikationsstrategien.
- Alter
- Prävalenz in einer deutschen Studie aus den 1990er Jahren zwischen 3 % bei Kindern und 48 % bei Erwachsenen1
- < 30-Jährige 19–25 %
- > 30-Jährige 35–55 %
- > 65-Jährige 69–90 %
- Prävalenz in einer deutschen Studie aus den 1990er Jahren zwischen 3 % bei Kindern und 48 % bei Erwachsenen1
- Geschlecht
- ähnliche Häufigkeit bei Frauen und Männern
Ätiologie und Pathogenese
- Helicobacter pylori ist ein gramnegatives, begeißeltes Bakterium.
- Die Übertragung von H. pylori erfolgt von Mensch zu Mensch.
- Der genaue Übertragungsweg ist nicht geklärt, wahrscheinlich überwiegend oral-oral, gastral-oral und fäkal-oral.2
- Enger Kontakt von Kindern mit H.-pylori-infizierten Familienangehörigen ist der wichtigste Übertragungsweg, Übertragung zwischen erwachsenen Lebenspartner*innen ist dagegen selten.
- H. pylori verfügt über Säureresistenzmechanismen: insbesondere Hydrolyse von Harnstoff durch Urease, der gebildete Ammoniak puffert die Magensäure ab.
- Die Infektion kann zu einer chronisch-aktiven B-Gastritis führen.
- Dennoch ist die Mehrzahl der Infizierten asymptomatisch, geschätzt 10–20 % entwickeln eine manifeste Erkrankung.
- Voraussetzung ist vermutlich das Zusammenspiel von Virulenzfaktoren des Bakteriums mit wirtsspezifischen und Umweltfaktoren.
- Folgeerkrankungen sind:
- Dyspepsie
- H.-pylori-assoziierte Dyspepsie ist eine eigene Entität, funktionelle Dyspepsie sollte erst nach Ausschluss einer H.-pylori-Infektion diagnostiziert werden.3
- Ulkuskrankheit
- 90 % der Ulcera duodeni und 70 % der Ulcera ventriculi sind mit H. pylori assoziiert.
- MALT-Lymphom
- 6-fach erhöhtes Risiko durch H. pylori
- Magenkarzinom
- H. pylori ist der wesentliche Risikofaktor für das Magenkarzinom (2- bis 3-fach erhöhtes Risiko)4
- extragastrale Erkrankungen
- Dyspepsie
Krankheitsbilder ohne Assoziation mit H. pylori-Infektionen
- Es besteht eine inverse Assoziation einer H. pylori Infektion mit der:
Prädisponierende Faktoren
- Prädisponierende Faktoren sind:
- Migrationshintergrund aus Ländern Süd- und Osteuropas, Zentralasiens, Asiens, Afrikas sowie Mittel- und Südamerikas
- niedriger sozioökonomischer Status
- schlechte hygienische Bedingungen.
Diagnostik
Diagnostische Kriterien
- Nachweis einer aktuellen Infektion mit H. pylori kann erfolgen durch:
- invasive Methoden (Biopsieentnahmen im Rahmen einer Gastroskopie)
- Histologie
- Urease-Schnelltest
- bei speziellen Fragestellungen
- Kultur
- PCR
- nichtinvasive Methoden
- Stuhl-Antigentest ELISA
- 13CHarnstoff-Atemtest.
- invasive Methoden (Biopsieentnahmen im Rahmen einer Gastroskopie)
- Der serologische Nachweis von IgG-AK unterscheidet nicht zwischen einer aktuellen und früheren, inzwischen aber eradizierten Infektion.
- Siehe auch Tabelle Ulkuskrankheit, Sensitivität und Spezifität der verschiedenen Nachweismethoden von H. pylori.
Anamnese
- Ca. 80 % der Infektionen mit H. pylori verlaufen asymptomatisch.
- Symptome einer Dyspepsie6
- Symptome einer Ulkuskrankheit (rein klinisch im Allgemeinen von Dyspepsie nicht sicher abzugrenzen)
- Symptome eines fortgeschrittenen Magenkarzinoms
- Familienanamnese
- Migrationshintergrund aus Ländern Süd- und Osteuropas, Zentralasiens, Asiens, Afrikas sowie Mittel- und Südamerikas (erhöhte Prävalenz von H. pylori)
- Medikamente
- NSAR
- ASS7
Klinische Untersuchung
- Häufig keine Befunde zu erheben.
- Druckschmerz bei epigastrischer Palpation
- Bei länger bestehender Ulkuserkrankung oder bedingt durch die Eisenmangelanämie: Blässe bei Anämie
Ergänzende Untersuchungen in der Hausarztpraxis
Allgemeines Labor
- Blutbild (Anämie?)
- Evtl. Eisenstatus
- Evtl. Stuhltest auf okkultes Blut
Nichtinvasiver Nachweis einer Helicobacter-Infektion
- Generell gilt, dass die Untersuchung auf H. pylori nur bei möglicher therapeutischer Konsequenz vorgenommen werden sollte.
- Die Entscheidung für eine mögliche Eradikationsbehandlung sollte demnach bereits vor der Diagnostik getroffen werden.
- Im Rahmen der hausärztlichen Diagnostik können nichtinvasive Tests auf H. pylori eingesetzt werden.
- Für die die Entscheidung zwischen nichtinvasiven und invasiven Tests sollten Risiken, Kosten und Zeitaufwand berücksichtigt werden.
- Für eine zuverlässige H.-pylori-Diagnostik (dies gilt für nichtinvasive und invasive Tests) sollten folgende Zeiträume eingehalten werden:
- mindestens 2 Wochen nach Ende einer Behandlung mit Protonenpumpen-Inhibitoren (PPI)
- mindestens 4 Wochen nach Eradikation oder sonstiger antibiotischer Therapie (insbesondere Makrolide).
- Erhöhte Wahrscheinlichkeit für falsch-positive Befunde bei Urease-abhängigen Tests bei bakterieller Überwucherung (z. B. bei verzögerter Darmmotilität, Hypochlorhydrie)
- Erhöhte Wahrscheinlichkeit für falsch-negative Befunde durch:
- Vorbehandlung mit Protonenpumpen-Inhibitoren (PPI)
- kürzlich durchgeführte Antibiotikatherapie
- obere gastrointestinale Blutung
- vorangegangene Magenteilresektion
- Mukosaatrophie und intestinale Metaplasie
- Magenkarzinom und MALT-Lymphom.
- Harnstoff-Atemtest
- Voraussetzungen: nüchtern ab 2 Stunden vor Test, 2 Wochen zuvor keine PPI, 4 Wochen zuvor keine Antibiotika/Bismut, keine Blutung
- Durchführung (in 15–30 min möglich): orale Einnahme von 13C-isotopenmarkiertem Harnstoff, H. pylori hydrolisiert Harnstoff, entstehendes markiertes CO2 wird in der Atemluft erfasst.
- teurer als der Antigen-Stuhltest
- Sensitivität 85–95 %, Spezifität 85–95 %
- Antigen-Stuhltest
- Antigentest auf Basis monoklonaler Antikörper3
- Voraussetzungen: 2 Wochen zuvor keine PPI, 4 Wochen zuvor keine Antibiotika/Bismut, keine Blutung
- Sensitivität 85–95 %, Spezifität 85–95 %
Diagnostik bei Spezialist*innen
Gastroskopie, invasiver Nachweis einer H.-pylori-Infektion
- Die Gastroskopie ermöglicht neben dem Nachweis von H. pylori auch die Erfassung einer Gastritis, von Ulzera und von Tumoren.
- Alle invasiven Verfahren zum Nachweis von H. pylori basieren auf der Untersuchung von Gewebebiopsien.
- Urease-Schnelltest
- schneller, unkomplizierter und kostengünstigster Bedside-Test
- Sensitivität 90–95 %, Spezifität 90–95 %
- PCR
- molekulargenetische Diagnostik mittels Polymerase-Chain-Reaction (PCR)
- Sensitivität 90–95 %, Spezifität 90–95 %
- Histologie
- Kultur
- in der Praxis nur im Zusammenhang mit Resistenzbestimmung von Bedeutung
- Sensitivität 70–90 %, Spezifität 100 %
Differenzialdiagnosen
Empfehlungen zu Indikationen zur Diagnostik auf H. pylori
- Screening
- Bei einer erhöhten Wahrscheinlichkeit für Magenkrebs (Familienanamnese oder Migration aus Ländern mit erhöhter Inzidenz kann eine Testung auf H. pylori asymptomatischen Patient*innen angeboten werden.
- Bei einer erhöhten Wahrscheinlichkeit für Magenkrebs (Familienanamnese oder Migration aus Ländern mit erhöhter Inzidenz kann eine Testung auf H. pylori asymptomatischen Patient*innen angeboten werden.
- Dyspepsie
- Im Rahmen der Abklärung dyspeptischer Beschwerden sollte eine H.-pylori-Testung erfolgen.
- Im Rahmen der Abklärung dyspeptischer Beschwerden sollte eine H.-pylori-Testung erfolgen.
- PPI-Dauertherapie
- Bei Patient*innen mit geplanter oder laufender PPI-Dauertherapie sollte eine Testung auf H. pylori erfolgen.
- Hintergrund ist, dass eine Dauertherapie mit PPI bei H.-pylori-positiven Patient*innen mit einem erhöhten Risiko für eine atrophische Gastritis assoziiert ist. Ob dies auch für die weitere Progression zum Magenkarzinom gilt, ist umstritten, sodass die Umsetzung dieser Empfehlung aktuell nicht zwingend erscheint.
- Ulcus ventriculi/duodeni
- Bei peptischem Ulcus ventriculi oder duodeni soll auf H. pylori getestet werden.
- Eisenmangelanämie
- Bei nach adäquater Diagnostik ungeklärter oder refraktärer Eisenmangelanämie sollte auf H. pylori getestet werden.
- Bei nach adäquater Diagnostik ungeklärter oder refraktärer Eisenmangelanämie sollte auf H. pylori getestet werden.
Vor Therapie mit NSAR, Thrombozytenaggregationshemmern oder Antikoagulanzien
- Vor einer geplanten Dauermedikation mit nichtsteroidalen Antirheumatika (NSAR) sollten Patient*innen mit erhöhtem Risiko für eine Ulkuskrankheit bzw. Ulkuskomplikation auf eine H.-pylori-Infektion untersucht und bei Keimnachweis einer Eradikationstherapie zugeführt werden.
- Vor einer geplanten Dauermedikation mit niedrig dosiertem ASS sollten Patient*innen mit erhöhtem Risiko für eine Ulkuskrankheit bzw. Ulkuskomplikation auf eine H.-pylori-Infektion untersucht und bei Keimnachweis einer Eradikationstherapie zugeführt werden.
- Vor geplanter Antikoagulation sollte bei Risikokonstellation eine Testung auf H. pylori erfolgen.
- Patient*innen, die unter ASS, P2Y12-Inhibitoren oder Antikoagulanzien oder NSAR eine gastroduodenale Blutung entwickeln, sollen auf eine H.-pylori-Infektion untersucht und bei Keimnachweis einer Eradikationstherapie zugeführt werden.
- ITP
- Patient*innen mit idiopathischer thrombozytopenischer Purpura (ITP) können nach Rücksprache mit den Spezialist*innen auf eine H.-pylori-Infektion untersucht und bei Keimnachweis einer Eradikationstherapie zugeführt werden, da dadurch ein Thrombozytenanstieg erfolgen kann.8
- Patient*innen mit idiopathischer thrombozytopenischer Purpura (ITP) können nach Rücksprache mit den Spezialist*innen auf eine H.-pylori-Infektion untersucht und bei Keimnachweis einer Eradikationstherapie zugeführt werden, da dadurch ein Thrombozytenanstieg erfolgen kann.8
- IgA-Vaskulitis
- Eine H.-pylori-Infektion gilt als möglicher Trigger einer IgA-Vaskulitis. Daher kann bei einer IgA-Vaskulitis nach Rücksprache mit den Spezialist*innen eine Testung auf H. pylori erfolgen.
- Eine H.-pylori-Infektion gilt als möglicher Trigger einer IgA-Vaskulitis. Daher kann bei einer IgA-Vaskulitis nach Rücksprache mit den Spezialist*innen eine Testung auf H. pylori erfolgen.
- Magenfrühkarzinom
- Nach Resektion eines Magenfrühkarzinoms oder Adenoms soll bei Nachweis von H. pylori eine Eradikation erfolgen.
- Nach Resektion eines Magenfrühkarzinoms oder Adenoms soll bei Nachweis von H. pylori eine Eradikation erfolgen.
- MALT-Lymphome
- Bei allen gastralen MALT-Lymphomen soll, unabhängig vom H.-pylori-Status und -Stadium, initial eine H.-pylori-Eradikationstherapie durchgeführt werden.
- GERD (keine Indikation)
- Eine gastroösophageale Refluxerkrankung stellt per se keine Indikation für eine H.-pylori-Testung dar.
Therapie
Allgemeines zur Therapie
- Die H.-pylori-Eradikation trägt neben der Magenkarzinom-Prävention zur Prävention weiterer gastro-duodenaler Erkrankungen bei.
- Die Therapie erfolgt p. o., eine intravenöse H.-pylori-Eradikationstherapie soll nicht durchgeführt werden.
Indikationen zur Eradikation
- Indikationen zur Eradikation von H. pylori sind:
- Ulcus ventriculi, Ulcus duodeni
- MALT-Lymphom
- Bei allen gastralen MALT-Lymphomen soll, unabhängig vom H.-pylori-Status und -Stadium, initial eine H.-pylori-Eradikationstherapie durchgeführt werden.
- Dyspepsie
- bei bis zu 10 % anhaltende Symptombesserung
- individuelle Entscheidung (Patientenwunsch, Leidensdruck, Aspekt der Karzinomprävention, mögliche Nebenwirkungen der Therapie)
- Asymptomatische Patient*innen nach positiver Testung
- Geplante Dauertherapie mit NSAR, Thrombozytenaggregationshemmern bei erhöhtem Ulkusrisiko
- Geplante Dauertherapie mit Antikoagulanzien, wenn eine positive Testung erfolgte.
- OGI-Blutung unter NSAR, Thrombozytenaggregationshemmern, Antikoagulanzien
- Eisenmangelanämie nach Ausschluss anderer Ursachen
- Nach Rücksprache mit Spezialist*innen
- idiopathische thrombozytopenische Purpura (ITP)
- Sjögren-Syndrom
- IgA-Vaskulitis
- lymphozytäre Gastritis
- diffuses großzelliges B-Zell-Lymphom (DGBZL)
- St. n. nach Resektion Magenfrühkarzinom oder Adenom
Allgemeines zur Eradikation
- Bis vor Kurzem war die clarithromycinbasierte Tripel-Therapie weltweit Standard, durch Resistenzen inzwischen verminderte Wirksamkeit.3
- Risikofaktoren für eine primäre Clarithromycinresistenz
- Herkunft aus Süd- oder Osteuropa
- frühere Behandlung mit Antibiotika (insbesondere Makrolidantibiotika)
- Die prätherapeutische Resistenzlage ist von großer Relevanz, die Wahl des Therapieschemas sollte die Wahrscheinlichkeit einer möglichen Antibiotikaresistenz berücksichtigen.
Therapeutischer Algorithmus
Erstlinientherapie
- Inzwischen soll die bismuthaltige Quadrupel-Therapie bevorzugt als Erstlinientherapie für mindestens 10 Tage eingesetzt werden.
- Allerdings führt diese Therapie wegen der hohen Medikamentenmenge („Pill Burden“) von 120 Tabletten in 10 Tagen und den verstärkt auftretenden Nebenwirkungen (insbesondere metallischer Geschmack und Bauchschmerzen) zu einer höheren Abbruchquote als die „alten“ Triple-Therapien.
- Es gibt auch eine „Single Capsule Quadruple Therapy“ mit niedrigerer „Pill Burden“.
Zweitlinientherapie
- Die Zweitlinientherapie soll unter Berücksichtigung der Resistenztestung über mindestens 10 Tage erfolgen mit:3
- Standard-Tripel-Therapie – oder –
- Fluorochinolon-haltigen Tripel-Therapie.
Drittlinientherapie
- Nach Versagen einer Zweitlinientherapie sollen weitere Therapieversuche nur mit Spezialist*innen abgesprochen werden.
- abnehmende antibiotische Therapieoptionen nach fehlgeschlagener resistenzadaptierter Zweitlinien-Therapie
Begleitmaßnahmen
- Der Erfolg einer medikamentösen Eradikation kann unterstützt werden durch:
- sorgfältige Aufklärung
- Motivation zur Therapietreue
- Einnahme der Medikamente vor den Mahlzeiten
- Milderung von Antibiotika-Nebenwirkungen durch Probiotika9
- Rauchstopp.
Medikamentöse Protokolle
- Bei allen Protokollen sollen PPI mit verabreicht werden.
- Z. B. Omeprazol oder Pantoprazol in Standardosierung
Bismut-Quadrupel-Therapie – 10 Tage
- PPI 1–0–1
- Bismut-Kalium-Salz 140 mg 3–3–3–3
- Tetracyclin 125 mg 3–3–3–3
- Metronidazol 125 mg 3–3–3–3
Standard-Tripel-Therapie (französisch) 10 – 14 Tage3
- PPI 1–0–1
- Clarithromycin 500 mg 1–0–1
- Amoxicillin 1.000 mg 1–0–1
Standard-Tripel-Therapie (italienisch) 10 – 14 Tage3
- PPI 1–0–1
- Clarithromycin 250–500 mg 1–0–1
- Metronidazol 400–500 mg 1–0–1
Fluorchinolon-Tripel-Therapie – 10 Tage
- PPI 1–0–1
- Levofloxacin 500 mg oder Moxifloxacin 400 mg 1–0–0
- Amoxicillin 1.000 mg 1–0–1
Kontrolle des Eradikationserfolgs
- Eine Erfolgskontrolle sollte immer durchgeführt werden (unabhängig von der Indikation zur Eradikation).
- Durchführung frühestens 4 Wochen nach einer Eradikationsbehandlung bzw. 2 Wochen nach Absetzen einer PPI-Therapie
- Die Kontrolle kann im Allgemeinen nichtinvasiv durchgeführt werden mittels:
- 13CHarnstoff-Atemtest – oder –
- Antigen-Stuhltest.
- Eine Endoskopie ist nur bei spezieller Indikation erforderlich (Ulcus ventriculi, St. n. blutendem Ulcus duodeni, MALT-Lymphom, fortgeschrittene präneoplastische Veränderungen der Magenschleimhaut).
- Routinemäßige Verlaufskontrollen zum Ausschluss einer Reinfektion nach erfolgreicher Eradikation sollten nicht erfolgen.
Prävention
- Eine wirksame Impfung steht zurzeit nicht zur Verfügung.
Verlauf, Komplikationen und Prognose
Komplikationen
- Mögliche Komplikationen und Folgekrankheiten sind:
- Ulkuskrankheit
- Adenokarzinom des Magens
- MALT-Lymphom.
Verlauf und Prognose
- Insgesamt sehr gute Prognose10
- Bei frühzeitiger Eradikation ist eine Restitutio ad integrum der Magenschleimhaut möglich.
- Eine Helicobacter-Eradikationstherapie senkt die Inzidenz und Mortalität an Magenkrebs signifikant. Deswegen kann die Eradikation insbesondere bei hoher Prätestwahrscheinlichkeit ein wichtiger Baustein der Prävention sein.11
- Ein MALT-Lymphom kann häufig durch alleinige Eradikationstherapie geheilt werden.
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen
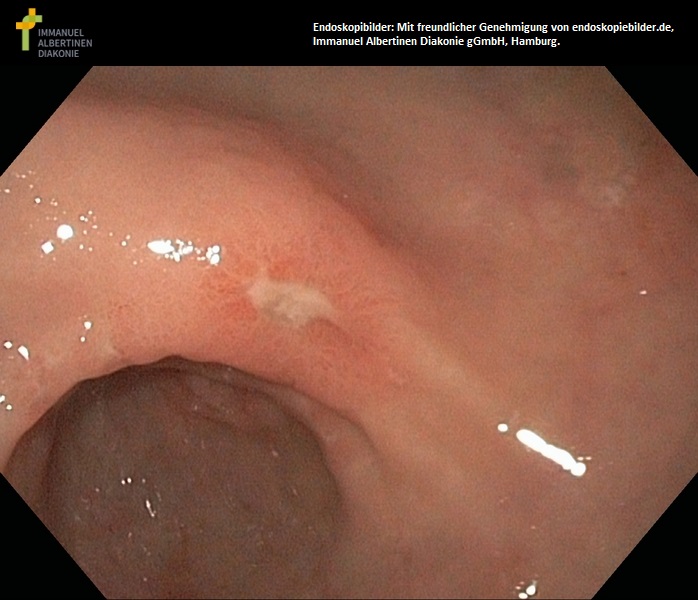
Antrum-Ulkus (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
Quellen
Literatur
- Hooi JKY, Lai WY, Ng WK, Suen MMY, et al. Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology. 2017 Aug;153(2):420-429. doi: 10.1053/j.gastro.2017.04.022. Epub 2017 Apr 27. PMID: 28456631. pubmed.ncbi.nlm.nih.gov
- Sharndama H, Mba I. Helicobacter pylori: an up‐to‐date overview on the virulence and pathogenesis mechanisms. Braz J Microbiol 2022; 53: 33-50. doi:10.1007/s42770-021-00675-0 DOI
- Fischbach W, Malfertheiner P. Helicobacter pylori infection—when to eradicate, how to diagnose and treat. Dtsch Arztebl Int 2018; 115: 429–36. www.aerzteblatt.de
- Park JY, Forman D, Waskito LA, Yamaoka Y, Crabtree JE. Epidemiology of Helicobacter pylori and CagA-Positive Infections and Global Variations in Gastric Cancer. Toxins (Basel). 2018 Apr 19;10(4):163. doi: 10.3390/toxins10040163. PMID: 29671784; PMCID: PMC5923329. pubmed.ncbi.nlm.nih.gov
- Scida S, Russo M, Miraglia C, Leandro G, Franzoni L, Meschi T, De' Angelis GL, Di Mario F. Relationship between Helicobacter pylori infection and GERD. Acta Biomed. 2018 Dec 17;89(8-S):40-43. doi: 10.23750/abm.v89i8-S.7918. PMID: 30561416; PMCID: PMC6502218. www.ncbi.nlm.nih.gov
- Madisch A, Andresen V, Enck P, et al. The diagnosis and treatment of functional dyspepsia. Dtsch Arztebl Int 2018; 115: 222–32. DOI: 10.3238/arztebl.2018.0222 www.aerzteblatt.de
- Sarri GL, Grigg SE, Yeomans ND. Helicobacter pylori and low-dose aspirin ulcer risk: A meta-analysis. J Gastroenterol Hepatol. 2019 Mar;34(3):517-525. doi: 10.1111/jgh.14539. Epub 2018 Dec 17. PMID: 30408229. pubmed.ncbi.nlm.nih.gov
- Kim BJ, Kim HS, Jang HJ, Kim JH. Helicobacter pylori Eradication in Idiopathic Thrombocytopenic Purpura: A Meta-Analysis of Randomized Trials. Gastroenterol Res Pract. 2018 Oct 9;2018:6090878. doi: 10.1155/2018/6090878. PMID: 30402091; PMCID: PMC6198559. www.ncbi.nlm.nih.gov
- McFarland L, Huang Y, Wang L, et al. Systematic review and meta-analysis: Multi-strain probiotics as adjunct therapy for Helicobacter pylori eradication and prevention of adverse events. United European Gastroenterol J 2016; 4: 546-561. www.ncbi.nlm.nih.gov
- Santacroce L. Helicobacter Pylori Infection. Medscape Jul 21, 2021. Zugriff 11.05.22. emedicine.medscape.com
- Ford A, Yuan Y, Moayyedi P. Helicobacter pylori eradication therapy to prevent gastric cancer: systematic review and meta-analysis. Gut 2020; 69: 2113–21. gut.bmj.com
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.
- Thomas Maibaum, Dr. med., Facharzt für Allgemeinmedizin, Rostock (Review)
- Marlies Karsch-Völk, Dr. med., Fachärztin für Allgemeinmedizin, München