Zusammenfassung
- Definition:Die idiopathische Lungenfibrose (IPF) ist eine spezifische, chronisch-progrediente, nicht reversible Form der Lungenfibrose unklarer Ursache. Die Erkrankung tritt überwiegend bei älteren Menschen auf und ist auf die Lunge begrenzt. Radiologisch zeigt sie das Bild einer sog. UIP (Usual Interstitial Pneumonia).
- Häufigkeit:Prävalenz 30–60 Fälle/100.000 Einw. Manifestation überwiegend jenseits des 50. Lebensjahres. Verteilung Männer zu Frauen > 2:1.
- Symptome:Belastungsdyspnoe und Husten mit progredientem Verlauf, Abgeschlagenheit.
- Befunde:Trommelschlägelfinger, Uhrglasnägel, inspiratorisches Knisterrasseln. In fortgeschrittenen Stadien evtl. Zyanose, Zeichen der Rechtsherzinsuffizienz.
- Diagnostik:HRCT (hochaufösendes CT) des Thorax mit Nachweis des Musters einer UIP (Usual Interstitial Pneumonia). Ausschluss anderer Ursachen einer interstitiellen Lungenerkrankung.
- Therapie:Die Behandlung besteht aus nichtmedikamentösen Maßnahmen und einer antifibrotischen medikamentösen Therapie. Lungentransplantation ist die einzige kurative Behandlungsoption.
Allgemeine Informationen
Definition
- Die Definition der idiopathischen Lungenfibrose (übliche Abkürzung IPF = Idiopathic Pulmonary Fibrosis) umfasst folgende Kriterien:1
- spezifische Form einer chronischen, progredienten, nicht reversiblen, fibrosierenden interstitiellen Pneumonie unbekannter Ursache
- tritt überwiegend bei älteren Patient*innen auf
- Begrenzung auf die Lungen
- radiologisches und/oder histologisches Muster einer UIP (Usual Interstitial Pneumonia)
- Andere Formen einer interstitiellen Pneumonie müssen ausgeschlossen sein.
Häufigkeit
- Seltene Erkrankung
- aber häufigste Form der idiopathischen interstitiellen Pneumonien
- In Europa jährliche Inzidenz 3–9/100.000 mit zunehmender Tendenz
- Prävalenz zwischen 30 und 60/100.000
- Manifestation überwiegend jenseits des 50. Lebensjahrs
- Verteilung Männer zu Frauen > 2:1
- Mehrzahl der Patient*innen mit Raucheranamnese
Ätiologie und Pathogenese
Ätiologie
- Die Ätiologie der IPF ist definitionsgemäß unbekannt.
- Familiäre Häufung bei bis zu 11 % der Krankheitsfälle
- Die familiäre Lungenfibrose ist definiert als Auftreten einer interstitiellen Lungenerkrankung bei 2 oder mehr Mitgliedern derselben Familie.
- Erbgang vermutlich autosomal-dominant mit reduzierter Penetranz4
- Manifestation der familiären IPF in jüngerem Alter als die sporadische Form
Pathogenese
- Das Verständnis der Pathogenese der IPF hat sich in den vergangenen Jahren geändert: Statt von einer chronisch-inflammatorischen geht man nun eher von einer chronisch-fibrosierenden Erkrankung mit komplexen Mechanismen aus.
- Aktuell werden folgende pathogenetische Mechanismen angenommen:
- Ausgangspunkt ist ein vermehrter Untergang von Alveolarepithelzellen.
- anschließend fehlgeleitete Wundheilung mit überschießender, anhaltender Proliferation von Bindegewebe und Narbenbildung
- Als finaler Schritt des fehlgeleiteten Wundheilungsprozesses entstehen mit Bronchialepithel ausgekleidete Honigwabenzysten.
- Die Veränderungen führen zu progredienter Atemnot und Verschlechterung der Lungenfunktion.5
- Dabei können 4 Verlaufsformen unterschieden werden:
- rasch progredient
- mit akuten Exazerbationen
- mäßig progredient
- langsam progredient
- Krankheitsmanifestation und Verlauf werden wahrscheinlich auch bei sporadischen Fällen erheblich durch die genetische Veranlagung beeinflusst.
Prädisponierende Faktoren
- Rauchen ist der einzige zweifelsfrei nachgewiesene exogene Risikofaktor.
- Weitere mögliche Risikofaktoren sind:
- chronische virale Infektionen (z. B. Hepatitis, EBV)
- Exposition gegenüber Metallstäuben
- gastroösophagealer Reflux
- Genetische Polymorphismen und Mutationen werden mit IPF in Zusammenhang gebracht.
ICD-10
- J84.1 Idiopathische Lungenfibrose
Diagnostik
- Bis zur Diagnosestellung einer Lungenfibrose vergehen nach den ersten Symptomen im Mittel etwa 2 Jahre.
Diagnostische Kriterien
- Zur Diagnosestellung werden die Kriterien 1 und 2 oder 1 und 3 vorausgesetzt:
- Ausschluss einer interstitiellen Lungenerkrankung bekannter Ursache (z. B. durch Kollagenosen/andere Systemerkrankungen, Exposition gegenüber inhalativen Noxen, Medikamenten, etc.)
- Vorhandensein eines UIP-Musters (UIP = Usual Interstitial Pneumonia) im HRCT (High Resolution CT)
- spezifische Kombinationen von HRCT und Histologie
- Die Diagnosestellung der IPF sollte im Rahmen einer multidisziplinären Diskussion (MDD) erfolgen unter Beteiligung von Pneumolog*in, Radiolog*in sowie evtl. Patholog*in und Rheumatolog*in.
Differenzialdiagnosen
- Die IPF sollte auch wegen der Unterschiede in Therapie und Prognose gegen Differenzialdiagnosen abgegrenzt werden.
- Krankheiten mit histologischem und/oder radiologischem UIP-Muster
- kollagenoseassoziierte Lungenfibrose (inkl. rheumatoide Arthritis)
- Pneumokoniosen, vor allem asbestinduzierte Lungenfibrose
- medikamenten- oder strahleninduzierte Lungenfibrose
- chronische Verlaufsform (Grad III) der exogen-allergischen Alveolitis
- seltene Ursachen
- Lungenfibrose bei Dyskeratosis congenita
- Lungenfibrose bei Hermansky-Pudlak-Syndrom
- Krankheiten mit histologischem und/oder radiologischem UIP-Muster
Anamnese
- Symptome
- Atemnot
- Bei Belastung/in Ruhe?
- Seit wann?
- Schleichender Beginn?
- Langsame/rasche Progredienz?
- trockener Reizhusten
- Verstärkung unter Belastung?
- Häufige Atemwegsinfekte?
- Allgemeinsymptome: Abgeschlagenheit, Müdigkeit, Gewichtsverlust?
- Ein- und Durchschlafstörungen, Tagesmüdigkeit?
- Schlafstörungen und schlafbezogene Atmungsstörungen sind sehr häufig bei IPF-Patient*innen.
- Atemnot
- Medikamente (zu medikamentösen Auslösern von respiratorischen Erkrankungen siehe auch pneumotox.com)
- Rauchen?
- 60–70 % der betroffenen Patient*innen mit Raucheranamnese
- Manifestation der Erkrankung häufig auch längere Zeit nach Beendigung eines Zigarettenkonsums
- Sonstige häusliche oder berufliche Exposition gegenüber inhalativen Noxen?
- Kollagenose/sonstige Autoimmunerkrankung?
- Allergien?
- Familienanamnese positiv für IPF?
Klinische Untersuchung
- Inspektion2,6
- Trommelschlegelfinger (ca. 20 %)
- Uhrglasnägel (ca. 50–70 %)
- in fortgeschrittenen Fällen: Ruhedyspnoe, Zyanose, Zeichen der Rechtsherzbelastung
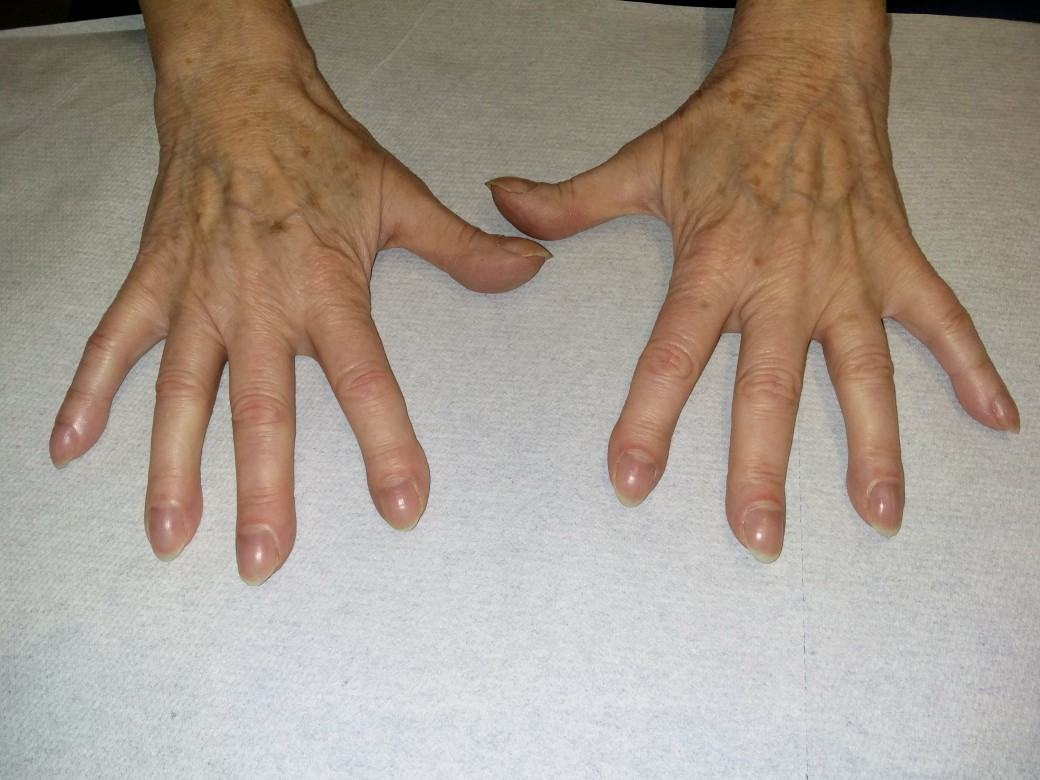 Trommelschlegelfinger
Trommelschlegelfinger
- Auskultation
- inspiratorisches Knisterrasseln = Sklerosiphonie vor allem basal und basolateral (≥ 90 %)2
- bereits früh im Verlauf der Erkrankung auskultierbar
Ergänzende Untersuchungen in der Hausarztpraxis
Labor
- Keine spezifische Labordiagnostik
- Zum Ausschluss/Nachweis einer Kollagenose kann ein Screening durchgeführt werden:1
- BSG, CRP, ANA, Rheumafaktor, Anti-CCP, ANCA
- (ANA und Rheumafaktor können bei IPF schwach positiv sein.)
- BSG, CRP, ANA, Rheumafaktor, Anti-CCP, ANCA
- Evtl. NT-proBNP bei V. a. pulmonale Hypertonie/Rechtsherzinsuffizienz
Röntgen-Thorax
- Interstitielle Zeichnungsvermehrung
- differenzierte Beurteilung durch Rö-Thorax aber nicht möglich
- Rö-Thorax kann insbesondere in den Anfangsstadien unauffällig sein.
Erfassung von Komorbiditäten
- Komorbiditäten sollten bei IPF-Patient*innen erfasst werden wegen Auswirkungen auf:,
- Symptomatik
- Lebensqualität
- Verlauf
- Prognose
- Zu den häufigsten bzw. relevantesten Komorbiditäten gehören:
- pulmonale Hypertonie
- COPD/Lungenemphysem
- Bronchialkarzinom
- gastrointestinale Refluxkrankheit (GERD)
- KHK
- Weitere häufige Komorbiditäten sind:
- Diabetes
- (obstruktive) Schlafapnoe
- arterielle Hypertonie und andere kardiovaskuläre Erkrankungen
- Depressionen
- Die Überlebenszeit ist um über die Hälfte reduziert bei mehr als vier Komorbiditäten.
Diagnostik bei Spezialist*innen
Hochauflösendes Thorax-CT (HRCT)
- HRCT ist das entscheidende Bildgebungsverfahren.
- Bei allen Patient*innen mit Verdacht auf IPF soll ein volumetrisches CT in High-Resolution-Technik ohne Röntgenkontrastmittel durchgeführt werden.
- Nachweis des Befundmusters einer UIP (Usual Interstitial Pneumonia) ist ein diagnostisches Kriterium für eine IPF.
- Ein UIP-Muster kann aber auch bei anderen interstitiellen Erkrankungen vorliegen und ist somit nicht pathognomonisch für IPF.
- Kriterien des UIP-Musters2
- retikuläre Verdichtungen vor allem subpleural und basal
- Traktionsbronchiektasien
- Honigwabenmuster
- zystisch erscheinende, luftgefüllte Areale, typischer Durchmesser 3–10 mm (bis zu 25 mm)
- Die Kriterien des UIP-Musters können in unterschiedlichem Ausmaß erfüllt sein, die radiologische Befundung soll unter Verwendung der HRCT-Diagnosekategorien erfolgen:,
- definitive UIP
- wahrscheinliche UIP
- unbestimmt
- alternative Diagnose.
- Bei sicherem UIP-Muster in der HRCT sollte zur Vermeidung von Komplikationen auf eine Lungenbiopsie verzichtet werden.1
Lungenbiopsie
- Bei Patient*innen ohne sicheres UIP-Muster im HRCT kann ergänzend eine Lungenbiopsie durchgeführt werden.
- Die transbronchiale Kryobiopsie hat mittlerweile die chirurgische Lungenbiopsie weitgehend abgelöst.
- Die Risiken der Biopsie können den Nutzen insbesondere bei schweren Lungenfunktionsstörungen oder Komorbiditäten überwiegen.
Bronchoalveoläre Lavage (BAL)
- Bei Patient*innen ohne eindeutiges UIP-Muster im HRCT wird eine bronchoalveoläre Lavage (BAL) empfohlen.1
- Die BAL hilft u. a. in der Abgrenzung gegen eine exogen-allergische Alveolitis mit Lymphozytose in der BAL.2
Lungenfunktionsprüfung
- Nachweis und Quantifizierung einer restriktiven Ventilationsstörung und Gasaustauschstörung durch Spirometrie, Bodyplethysmografie und Bestimmung der Diffusionskapazität
- Eine normale oder nur gering veränderte Lungenfunktionsprüfung schließt eine IPF im Frühstadium aber nicht aus.2
6-Minuten-Gehtest
- Beurteilung der Leistungsfähigkeit
- Prognostische Bedeutung
- Ggf. Indikationsstellung zur O2-Therapie
Echokardiografie
- Bei V. a. pulmonale Hypertonie/Rechtsherzinsuffizienz
Polysomnografie
- Schlafstörungen und schlafbezogene Atmungsstörungen treten sehr häufig bei IPF-Patient*innen auf. Eine Schlafdiagnostik kann daher in das diagnostische Management einbezogen werden.
Labor
- Serologisches Screening bei allen Patient*innen mit neu identifizierter interstitieller Lungenerkrankung, auch wenn keine anderen Zeichen oder Symptome einer Kollagenose/Systemerkrankung vorliegen:
- BSG/CRP
- Rheumafaktor
- ACCP (Antikörper gegen zyklisch-zitrullinierte Peptide)
- ANA
- ANCA
- Weitere serologische Diagnostik von Fall zu Fall (z. B. hinsichtlich Myositis, Sjögren-Syndrom, Sklerodermie)
Genetische Untersuchung
- Gentests im Rahmen der normalen klinischen Diagnostik sind derzeit nicht empfohlen.
Indikationen zur Überweisung
- Bei Verdacht auf die Erkrankung Überweisung an eine pneumologische Praxis
Therapie
Therapieziele
- Krankheitsaktivität dämpfen
- Überleben verlängern
Allgemeines zur Therapie
- Bestandteile der Therapie sind:
- nichtmedikamentöse Maßnahmen,
- Rauchstopp
- Gewichtskontrolle
- körperliche Aktivität
- Infektionsprävention (Impfung gegen Influenza und Pneumokokken)
- O2-Langzeittherapie bei einem paO2 < 55 mm Hg (paO2 < 60 mmHg bei pulmonaler Hypertonie oder Cor pulmonale)
- nichtinvasive Beatmung
- pneumologische Rehabilitation
- medikamentöse antifibrotische Therapie
- Pirfenidon und Nintedanib verlangsamen die Fibrosierung und verlängern das mittlere Überleben.
- Die Indikation zur antifibrotischen Therapie sollte idealerweise durch ein multidisziplinäres Team (ILD-Board) gestellt werden.
- Lungentransplantation als einzige kurative Behandlungsoption4
- nichtmedikamentöse Maßnahmen,
Medikamentöse Therapie
- Vor der Zulassung der Antifibrotika wurden unterschiedliche Therapieansätze verfolgt (u. a. Immunsuppressiva, Endothelinantagonisten, Phosphodiesterasehemmer, Acetylcystein).7-11
- Diese werden mittlerweile nicht mehr empfohlen.
- Die medikamentöse Therapie beruht zurzeit auf zwei antifibrotisch wirksamen Substanzen, Pirfenidon und Nintedanib.
- Pirfenidon
- Wirkung durch Regulation profibrotischer und proinflammatorischer Zytokinkaskaden
- Verlangsamung des Krankheitsprozesses in klinischen Studien12-13
- Eine gepoolte Analyse von drei Studien zeigte eine signifikante Reduktion der Gesamtmortalität in der Pirfenidon-Gruppe versus Placebo.14
- Nebenwirkungen meist gut kontrollierbar und reversibel
- gastrointestinal: Übelkeit und Erbrechen, Diarrhö, Dyspepsie, Gewichtsverlust, Leberwertanstieg, selten schwere Leberschäden
- dermatologisch: Ausschlag, Phototoxizität
- Vor Behandlungsbeginn müssen Transaminasen und Bilirubinspiegel gemessen und in den ersten 6 Monaten einmal monatlich korrigiert werden. Dosisanpassung bei erheblichem Transaminasenanstieg oder Absetzen der Behandlung.
- Nintedanib
- intrazellulärer Tyrosinkinaseinhibitor
- Wirkung durch Hemmung der Signaltransduktion verschiedener Wachstumsfaktoren (Vascular Endothelial Growth Factor [VEGF], Fibroblast Growth Factor [FGF], Platelet Derived Growth Factor [PDGF])
- Verlangsamt im Vergleich zu Placebo den Erkrankungsprozess und verlängert den Zeitraum bis zur ersten Exazerbation.15-16
- Nebenwirkungen meist mild bis moderat und gut kontrollierbar: Diarrhö, Übelkeit, Erbrechen, Appetitlosigkeit, Gewichtsverlust, Anstieg der Leberwerte
- Vorsicht bei Patient*innen mit erhöhtem kardiovaskulärem Risiko!
- Bei symptomatischen Patient*innen wird eine antifibrotische Behandlung ab dem Zeitpunkt der Diagnose empfohlen.
- Bei guter Verträglichkeit sollte die antifibrotische Therapie zeitlich unbegrenzt, ggf. bis zur Lungentransplantation verabreicht werden.
- Ein Wechsel zwischen den beiden antifibrotischen Medikamenten ist bei nichtkontrollierbaren Nebenwirkungen und/oder fehlender Wirksamkeit möglich.
- Eine kombinierte Nintedanib-Pirfenidon-Therapie wird gegenwärtig nicht empfohlen.
- Folgende Medikamente werden nicht zur Behandlung der IPF empfohlen:
- „Triple Therapie“ (Prednisolon, Azathioprin, Acetylcystein)
- Acetylcystein-Monotherapie
- Antikoagulation mit Vitamin-K-Antagonisten
- Imatinib
- Ambrisentan
- duale Endothelinrezeptor-Antagonisten-1 (Bosentan, Macitentan)
- Phosphodiesterase-5-Inhibitor Sildenafil
- antazide Therapie als IPF-Therapie ohne Hinweis auf Reflux
Verlauf, Komplikationen und Prognose
Komplikationen
- Akute Exazerbationen der IPF
- definiert als akute, signifikante respiratorische Verschlechterung typischerweise innerhalb eines Monats
- kaum Therapiemöglichkeiten, sehr ungünstige Prognose (Letalität > 50 %)
- Lungenemphysem
- Pneumothorax
- kumulative Inzidenz von 8,5 %, 12,5 % bzw. 17,7 % nach 1, 2 und 3 Jahren
- Pulmonale Hypertonie
- bei bis zu 1/3 der Patient*innen schwere pulmonale Hypertonie
- Lungenkarzinom
- Inzidenz 5–48 %, Risiko für Lungenkarzinom steigt nach Diagnose mit zunehmender Krankheitsdauer an.
- Pneumonie
- Komplikationen im Rahmen einer Lungenbiopsie (u. a. Blutung, Pneumothorax)
Verlauf und Prognose
- Der klinische Verlauf ist variabel und nicht sicher vorhersagbar.
- Mehrere mögliche Spontanverläufe:
- stabiler Verlauf
- langsame, gleichmäßige Progression (Mehrheit der Patient*innen)
- rasche Progression
- unvorhersehbare akute Verschlechterung durch Komplikation wie Pneumonie oder aus unbekanntem Grund.
- Unterschiedliche Verläufe möglicherweise bedingt durch komplexes Zusammenspiel von Geschlecht, Alter, genetischen und Umweltfaktoren
- Progression kann durch Bestimmung des Lungenvolumens (FVC, forcierte exspiratorische Vitalkapazität) eingeschätzt werden.2
- stabile Patient*innen mit Schwankungen < 5 %
- Abfall der FVC um 5–10 % in 6–12 Monaten deutet auf prognostisch relevante Progression hin.
- Abfall der FVC > 10 % in 6 Monaten ist mit stark erhöhter Mortalität verbunden.
- Pneumologische Rehabilitation verbessert körperliche Belastbarkeit, Lebensqualität und Symptome.17
- Insgesamt schlechte Prognose, mittleres Überleben nach Diagnosestellung: 3–5 Jahre4,18
- 5-Jahre-Überlebensrate: 20–40 %
- Die IPF ist die Lungenfibrose mit der schlechtesten Prognose.
- Häufigkeit von Exazerbationen ca. 5–15 % pro Jahr mit hoher Mortalität2
- mittlere Lebenserwartung 3–4 Monate nach akuter Exazerbation
- Komorbiditäten mit ungünstigem Einfluss auf die Prognose, die Anzahl der Komorbiditäten korreliert mit der Prognose.
- Konsequente Behandlung von Komorbiditäten führt möglicherweise zu einer Verbesserung der Prognose.
- Familiäre Formen der IPF weisen häufig eine langsamere Progredienz auf.
Verlaufskontrolle
- Regelmäßige Verlaufskontrollen üblicherweise in 3- bis 4-monatigen Intervallen
- Wichtige Parameter für die Verlaufsbeurteilung sind:
- Lebensqualität
- Belastbarkeit (6-Minuten-Gehtest)
- Lungenfunktion (Spirometrie/Bodyplathysmografie)
- Diffusionskapazität
- Bildgebung (HRCT)
- Eine periodische Vorstellung bei niedergelassenen Pneumolog*innen sowie einem Zentrum für interstitielle Lungenerkrankungen ist sinnvoll.
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen

Trommelschlegelfinger (mit freundlicher Genehmigung von Dr. med. Erich Ramstöck)
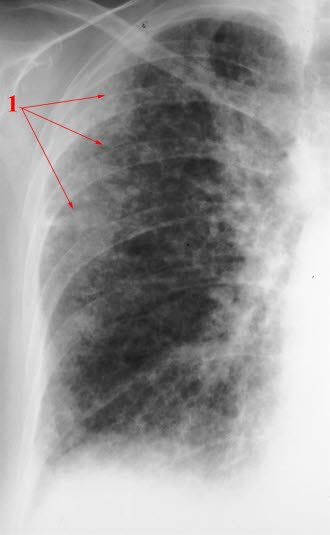
Lungenfibrose, Röntgen
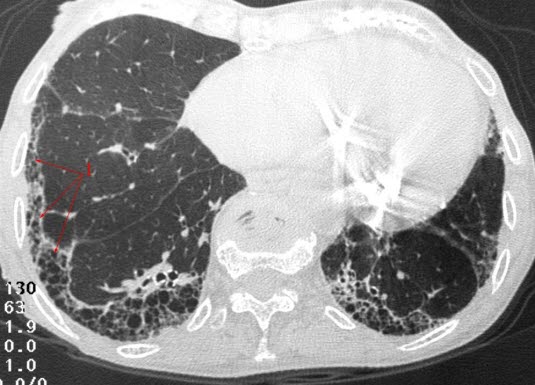
Lungenfibrose, CT
Quellen
Leitlinien
- American Thoracic Society, European Respiratory Society, Japanese Respiratory Society, Latin American Thoracic Society. Diagnosis of Idiopathic Pulmonary Fibrosis. Stand 2018. www.atsjournals.org
Literatur
- Raghu G, Remy-Jardin M, Myers J, et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2018; 198: e44-e68. doi:https10.1164/rccm.201807-1255ST www.ncbi.nlm.nih.gov
- Behr J. The diagnosis and treatment of idiopathic pulmonary fibrosis. Dtsch Arztebl Int 2015; 110: 875-881. doi:10.3238/arztebl.2013.0875 www.aerzteblatt.de
- Raghu G, Weycker D, Edelsberg J, et al. Incidence and prevalence of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2006; 174: 810-6. PubMed
- King Jr TE, Pardo A, Selman M. Idiopathic pulmonary fibrosis. Seminar. Lancet 2011; 378: 1949-61. PubMed
- Gross TJ, Hunninghake GW. Idiopathic pulmonary fibrosis. N Engl J Med 2001; 345: 517-25. PubMed
- Raghu G, Mageto YN, Lockhart D, Schmidt RA, Wood DE, Godwin JD. The accuracy of the clinical diagnosis of new-onset idiopathic pulmonary fibrosis and other interstitial lung disease: a prospective study. Chest 1999; 116: 1168-74. PubMed
- Hunninghake GW. Antioxidant therapy for idiopathic pulmonary fibrosis. N Engl J Med 2005; 353: 2285-7. PubMed
- Bajwa EK, Ayas NT, Schulzer M, Mak E, Ryu JH, Malhotra A. Interferon-gamma1b therapy in idiopathic pulmonary fibrosis: a meta-analysis. Chest 2005; 128: 203-06. www.ncbi.nlm.nih.gov
- Zisman DA, Schwartz M, Anstrom KJ, et al. A controlled trial of sildenafil in advanced idiopathic pulmonary fibrosis. N Engl J Med 2010; 363: 620-8. PubMed
- Horton MR, Santopietro V, Mathew L, et al. Thalidomide for the treatment of cough in idiopathic pulmonary fibrosis: a randomized trial. Ann Intern Med 2012; 157: 398-406. www.ncbi.nlm.nih.gov
- Raghu G, Anstrom KJ, King TE, et al. Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis. N Engl J Med 2012; 366: 1968-77. New England Journal of Medicine
- Noble PW, Albera C, Bradford WZ, et al. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials. Lancet 2011; 377: 1760-9. PubMed
- King TE, Bradford WZ, Castro-Bernardini S, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med 2014. doi:10.1056/NEJMoa1402582 DOI
- Nathan S, Albera C, Bradford W et al. Effect of pirfenidone on mortality: pooled analyses and meta-analyses of clinical trials in idiopathic pulmonary fibrosis. Lancet Respir Med 2017; 5: 33-41. doi:10.1016/S2213-2600(16)30326-5 DOI
- Richeldi L, Costabel U, Selman M, et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med 2011; 365: 1079-87. New England Journal of Medicine
- Richeldi L, du Bois RM, Raghu G, et al. Efficacy and safety of nintedanib in idiopathic pulmonar fibrosis. N Engl J Med 2014. doi:10.1056/NEJMoa1402584 DOI
- Cheng L, Tan B, Yin Y, et al. Short- and long-term effects of pulmonary rehabilitation for idiopathic pulmonary fibrosis: a systematic review and meta-analysis. Clin Rehabil. 2018. PMID: 29843523 www.ncbi.nlm.nih.gov
- Ley B, Collard HR, King TE Jr. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2011; 183: 431-40. PubMed
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.