Informacje ogólne
Definicja
- Definicja idiopatycznego włóknienia płuc (idiopathic pulmonary fibrosis – IPF) obejmuje następujące kryteria:1
- Szczególna forma przewlekłego, postępującego, nieodwracalnego, zwłókniającego śródmiąższowego zapalenia płuc o nieznanej przyczynie.
- Występuje zazwyczaj u pacjentów w starszym wieku.
- Ograniczenie do płuc.
- Radiologiczny lub histopatologiczny wzorzec zwykłego śródmiąższowego zapalenia płuc (usual interstitial pneumonia – UIP).
- UIP jest określeniem zmian stwierdzanych w badaniu mikroskopowym wycinka płuca pobranego od chorych z klinicznym obrazem IPF.
- Należy wykluczyć inne formy śródmiąższowego zapalenia płuc.
Epidemiologia
- Choroba rzadka, ale najczęstsza postać idiopatycznych śródmiąższowych zapaleń płuc.
- W Europie roczna zapadalność wynosi 3–9 na 100 000 z tendencją wzrostową.
- Szacuje się, że w Polsce roczna zapadalność na IFP wynosi 4,2–4,7 na 100 000.
- Chorobowość pomiędzy 30 a 60 na 100 000:
- W większości przypadków objawy występują po 50. roku życia.
- Stosunek liczby mężczyzn do liczby kobiet >2:1.
- U większość pacjentów palenie tytoniu w wywiadzie.
Etiologia i patogeneza
Etiologia
- Zgodnie z definicją etiologia IPF jest nieznana (idiopatyczna).
- Podłoże genetyczne stwierdza się nawet w 11% przypadków:
- rodzinne włóknienie płuc definiuje się jako występowanie śródmiąższowej choroby płuc u dwojga lub więcej członków tej samej rodziny
- dziedziczenie prawdopodobnie autosomalne dominujące ze zmniejszoną penetracją4
- objawy rodzinnego IPF występują w młodszym wieku niż postać sporadyczna.
Patogeneza
- Rozumienie patogenezy IPF w ostatnich latach uległo zmianie: obecnie przyjmuje się, że zamiast przewlekłej choroby zapalnej jest to przewlekła choroba zwłóknieniowa o złożonych mechanizmach.
- Zakłada się następujące mechanizmy patogenetyczne:
- Punktem wyjścia jest zwiększony rozpad komórek nabłonka pęcherzyków płucnych.
- Następnie występuje nieprawidłowo ukierunkowany proces gojenia z nadmierną, uporczywą proliferacją tkanki łącznej i bliznowaceniem.
- Ostatnim etapem nieprawidłowo przebiegającego procesu gojenia jest rozwój torbieli o strukturze plastra miodu, wyściełanych komórkami nabłonka oskrzeli.
- Zmiany prowadzą do postępującej duszności i pogorszenia czynności płuc.5
- W zależności od przebiegu, można rozróżnić cztery postaci:
- szybko postępującą
- z ostrym zaostrzeniem
- pośrednio postępującą
- wolno postępującą.
- Na objawy i przebieg choroby w sporadycznych przypadkach prawdopodobnie znaczący wpływ mają także predyspozycje genetyczne.
Czynniki predysponujące
- Palenie tytoniu jest jedynym udowodnionym egzogennym czynnikiem ryzyka.
- Inne możliwe czynniki ryzyka to:
- przewlekłe infekcje wirusowe (np. zapalenie wątroby, EBV)
- narażenie na pyły metali
- choroba refluksowa przełyku.
- Polimorfizmy i mutacje genetyczne są związane z IPF.
ICD-10
- J84.1 Inne choroby tkanki śródmiąższowej płuc ze zwłóknieniem.
Diagnostyka
- Rozpoznanie włóknienia płuc następuje średnio po około 2 latach od wystąpienia pierwszych objawów.
Kryteria diagnostyczne
- Do postawienia rozpoznania konieczne jest spełnienie kryteriów 1 i 2 lub 1 i 3:
- wykluczenie śródmiąższowej choroby płuc o znanej przyczynie (np. spowodowanej przez choroby tkanki łącznej/inne choroby ogólnoustrojowe, narażenia na wziewne substancje szkodliwe, leki, itp.)
- obecność wzorca UIP w HRCT
- określone kombinacje wyników HRCT i badań histopatologicznych.
- Rozpoznanie IPF należy ustalić poprzez postępowanie interdyscyplinarne z udziałem pulmonologa, radiologa oraz ewentualnie histopatologa i reumatologa.
Diagnostyka różnicowa
- IPF należy odróżnić od innych chorób ze względu na odmienne leczenie i rokowanie.
- Choroby z histopatologicznym lub radiologicznym wzorcem z UIP
- włóknienie płuc związane z chorobami tkanki łącznej (w tym zapalenie stawów)
- pylica płuc, zwłaszcza włóknienie płuc wywołane azbestem
- włóknienie płuc wywołane przez leki lub napromieniowanie
- przewlekła postać (stopień III) egzogennego alergicznego zapalenia pęcherzyków płucnych (AZPP).
- Rzadkie przyczyny
- włóknienie płuc w dyskeratozie wrodzonej (dyskeratosis congenita)
- włóknienie płuc w zespole Hermanskiego–Pudlaka.
- Choroby z histopatologicznym lub radiologicznym wzorcem z UIP
Wywiad
- Objawy:
- Duszność
- wysiłkowa/w spoczynku?
- od kiedy?
- stopniowy początek?
- wolne/szybkie postępowanie objawów?
- Suchy kaszel w wyniku podrażnienia
- nasilenie przy wysiłku?
- Częste infekcje dróg oddechowych?
- Ogólne objawy: zmęczenie, znużenie, utrata masy ciała?
- Trudności z zasypianiem i przesypianiem nocy, zmęczenie w ciągu dnia?
- Zaburzenia snu i zaburzenia oddychania związane ze snem są u pacjentów z IPF bardzo częste.
- Duszność
- Leki (informacje na temat farmakologicznych czynników wyzwalających choroby układu oddechowego można znaleźć również na stronie pneumotox.com).
- Palenie tytoniu
- 60–70% pacjentów z IPF ma w wywiadzie palenie papierosów.
- Objawy choroby często utrzymują się również przez długi czas po zaprzestaniu palenia papierosów.
- Inne domowe lub zawodowe narażenia na wziewne substancje szkodliwe.
- Choroby tkanki łącznej/inne choroby autoimmunologiczne.
- Alergie.
- Dodatni wywiad rodzinny w kierunku idiopatycznego włóknienia płuc.
Badanie fizykalne
- Ocena:2,6
- palce pałeczkowate (ok. 20%)
- paznokcie zegarkowe (50–70%)
- w przypadkach zaawansowanych: duszność spoczynkowa, sinica, objawy prawokomorowej niewydolności serca.
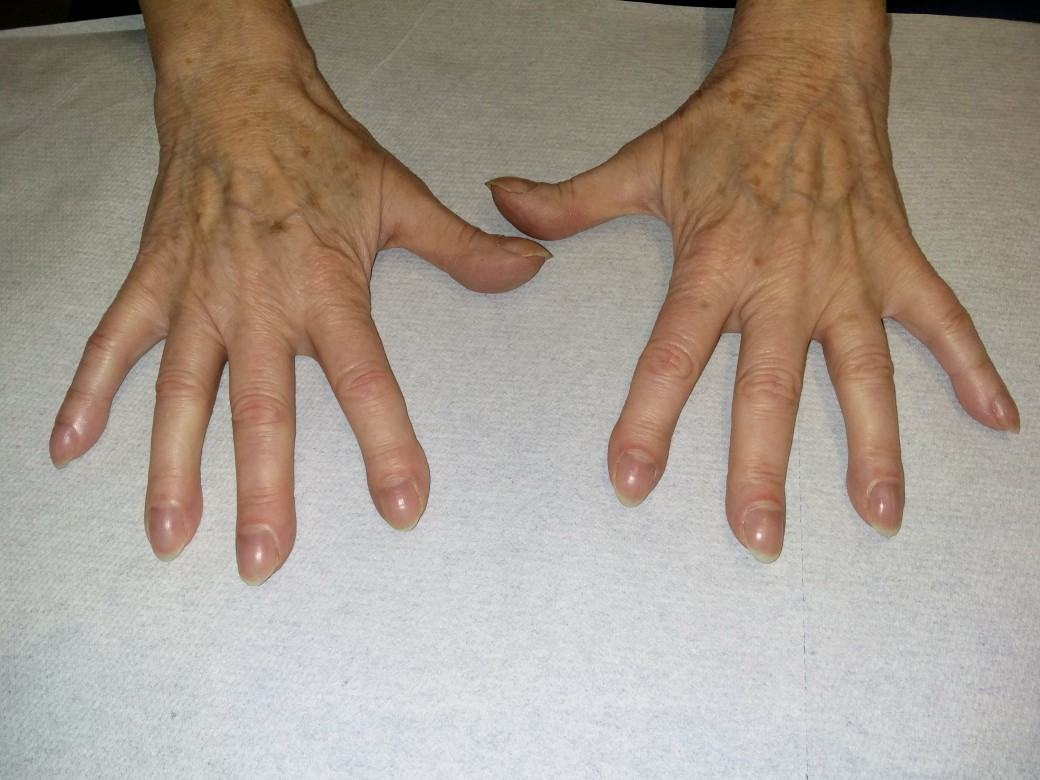 Palce pałeczkowate
Palce pałeczkowate
- Osłuchiwanie:
Badania uzupełniające
Badania laboratoryjne
- Brak swoistych wyników badań laboratoryjnych.
- W celu wykluczenia/wykrycia chorób tkanki łącznej można przeprowadzić badania przesiewowe:1
- OB, CRP, czynnik reumatoidalny (RF), anty–CCP
- Wynik badania przeciwciał przeciwjądrowych i czynnika reumatoidalnego w IPF może być nieznacznie dodatni.
- OB, CRP, czynnik reumatoidalny (RF), anty–CCP
RTG klatki piersiowej
- Zagęszczenia śródmiąższowe
- Ocena różnicowa za pomocą RTG klatki piersiowej nie jest jednak możliwa.
- Badanie rentgenowskie klatki piersiowej, zwłaszcza we wczesnych stadiach, może nie wykazywać zmian.
- Typowy obraz w RTG:7
- Wyższe ustawienie obu kopuł przepony oraz zmniejszona wielkość pól płucnych.
- Zacienienia o typie siateczki widoczne w okolicach nadprzeponowych.
- W bardziej zaawansowanym stadium zacienienia sięgają coraz wyżej, ale zawsze są najbardziej nasilone w obwodowych częściach płuc, czyli pod opłucną.
Wykrycie chorób współistniejących
- W przypadku pacjentów z IPF należy ocenić choroby współistniejące ze względu na ich wpływ na:
- objawy
- jakość życia
- przebieg
- rokowanie.
- Do najczęstszych lub najbardziej istotnych chorób współistniejących należą:
- nadciśnienie płucne
- POChP/rozedma płuc
- rak płuca
- refluks żołądkowo–jelitowy (choroba refluksowa przełyku, GERD)
- choroba wieńcowa.
- Innymi częstymi chorobami współistniejącymi są:
- cukrzyca
- obturacyjny bezdech senny
- nadciśnienie tętnicze i inne choroby sercowo-naczyniowe
- depresja.
- W przypadku więcej niż czterech chorób współistniejących przeżywalność zmniejsza się o ponad połowę.
Diagnostyka specjalistyczna
Badania laboratoryjne
- W celu wykluczenia/wykrycia chorób tkanki łącznej można przeprowadzić badania przesiewowe:1
- Przeciwciała przeciwjądrowe (antinuclear antibodies – ANA), przeciwciała przeciwko cytoplazmie neutrofilów (anti-neutrophil cytoplasmic antibodies –ANCA).
- Wynik badania przeciwciał przeciwjądrowych – ANA w IPF może być nieznacznie dodatni.
- Przeciwciała przeciwjądrowe (antinuclear antibodies – ANA), przeciwciała przeciwko cytoplazmie neutrofilów (anti-neutrophil cytoplasmic antibodies –ANCA).
- Ewentualnie NT–proBNP (N-Terminal pro B–type Natriuretic Peptide), w przypadku podejrzenia nadciśnienia płucnego/prawokomorowej niewydolności serca.
TK klatki piersiowej wysokiej rozdzielczości (HRCT)
- HRCT jest rozstrzygającym badaniem obrazowym.
- Bardzo charakterystyczne zmiany:7
- zacienienia o wyglądzie siateczki oraz plastra miodu
- najbardziej nasilone w dolnych częściach płuc
- jest ich więcej z tyłu niż z przodu.
- U wszystkich pacjentów z podejrzeniem IPF należy wykonać tomografię komputerową w technice wysokiej rozdzielczości bez podania kontrastu.
- Stwierdzenie cech UIP (zwykłego śródmiąższowego zapalenia płuc) jest kryterium diagnostycznym IPF.
- Wzorzec zwykłego śródmiąższowego zapalenia płuc może jednak występować również w innych chorobach śródmiąższowych i w związku z tym nie jest patognomoniczny dla IPF.
- Kryteria wzorca zwykłego śródmiąższowego zapalenia płuc (UIP)2
- zagęszczenia siateczkowate, zwłaszcza podopłucnowe i podstawne
- rozstrzenie oskrzeli z pociąganiem
- wzorzec plastra miodu
- torbielowate, wypełnione powietrzem obszary, typowo o średnicy 3–10 mm (do 25 mm).
- Kryteria wzorca UIP mogą zostać spełnione w różnym stopniu, a ustalenia radiologiczne należy dokonywać przy użyciu kategorii diagnostycznych HRCT:
- definitywne zwykłe śródmiąższowe zapalenie płuc
- prawdopodobne zwykłe śródmiąższowe zapalenie płuc
- nieokreślone
- inne rozpoznanie.
- Jeżeli tomografia HRCT potwierdzi wzorzec UIP, w celu uniknięcia powikłań należy zrezygnować z biopsji płuca.1
Biopsja płuca
- U pacjentów bez potwierdzonego w HRCT wzorca UIP, można uzupełniająco wykonać biopsję płuca.
- Kriobiopsja przezoskrzelowa w dużej mierze zastąpiła chirurgiczną biopsję płuc.
- Ryzyko związane z biopsją może przewyższać korzyści, szczególnie w przypadku poważnych zaburzeń czynności płuc lub chorób współistniejących.
- Typowe cechy w badaniu mikroskopowym:7
- Mozaikowatość zmian, czyli występowanie obszarów prawidłowego miąższu płuc na przemian z obszarami zmienionymi zapalnie, zaburzenie prawidłowej architektury płuca przez blizny i obszary plastra miodu oraz różnoczasowość zmian (obok siebie obszarów „starych" zmian w postaci dokonanego włóknienia i „świeżych" w postaci skąpych nacieków zapalnych).
Płukanie oskrzelowo–pęcherzykowe (brochoalveolar lavage – BAL)
- U pacjentów bez jednoznacznego wzorca UIP w HRCT, zaleca się płukanie oskrzelowo-pęcherzykowe (BAL).1
- BAL jest pomocne między innymi w różnicowaniu z egzogennym alergicznym zapaleniem pęcherzyków płucnych z limfocytozą w BAL.
Kontrola czynności płuc
- Potwierdzenie i ilościowa ocena mechanicznego ograniczenia wentylacji oraz zaburzeń wymiany gazowej poprzez spirometrię, pletyzmografię oraz określenie pojemności dyfuzyjnej płuc.
- Jednak prawidłowy lub tylko nieznacznie zmieniony wynik badań czynnościowych płuc (szczególnie spirometria) nie wyklucza IPF we wczesnych stadiach.2
- W późniejszych stadiach typowe są:7
- Cechy restrykcji, czyli obniżenie pojemności życiowej – VC (vital capacity) i całkowitej pojemności płuc – TLC (total lung capacity).
- Obniżona pojemność życiowa (VC) i dobrze zachowana drożność oskrzeli, duża w stosunku do objętości płuc, powodują, że w badaniu spirometrycznym stwierdza się często stosunek objętości wydechowej pierwszosekundowej (FEV1) do pojemności życiowej (VC), czyli wskaźnik FEV1/VC wyższy od spodziewanego.
- Pomiar zdolności dyfuzyjnej dla tlenku węgla (DLCO) jest czułym wskaźnikiem zaburzeń czynnościowych w IPF, który jest nieprawidłowy wcześniej niż obserwowane zmiany w badaniu spirometrycznym.
Test 6–minutowego marszu
- Ocena wydolności.
- Znaczenie prognostyczne.
- Ewentualnie wskazanie do tlenoterapii.
Echokardiografia
- W przypadku podejrzenia nadciśnienia płucnego/prawokomorowej niewydolności serca.
Polisomnografia
- Zaburzenia snu i zaburzenia oddychania związane ze snem są u pacjentów z IPF bardzo częste.
- W związku z tym diagnostyka zaburzeń snu może zostać włączona do postępowania diagnostycznego.
Badania laboratoryjne
- Serologiczne badania przesiewowe wszystkich pacjentów z nowo rozpoznanym śródmiąższowym zapaleniem płuc, nawet jeśli nie występują inne objawy choroby tkanki łącznej/choroby ogólnoustrojowej:
- OB/CRP
- czynnik reumatoidalny (rheumatoid factor - RF)
- anty–CCP (anti–cyclic citrullinated peptides antibodies, przeciwciała przeciwko cyklicznemu cytrulinowanemu peptydowi)
- przeciwciała przeciwjądrowe (ANA) - w AOS
- ANCA – w AOS.
- Dalsza diagnostyka serologiczna w poszczególnych przypadkach (np. w kierunku zapalenia mięśni [myositis], zespołu Sjögrena, twardziny układowej).
Badanie genetyczne
- Testy genetyczne jako część standardowej diagnostyki klinicznej nie są obecnie zalecane.
Wskazania do skierowania do specjalisty
- W przypadku podejrzenia IPF pacjenta należy skierować do pulmonologa.
Leczenie
Cele leczenia
- Ograniczenie aktywności choroby.
- Wydłużenie czasu przeżycia.
Ogólne informacje o leczeniu
- Elementami terapii są:
- Środki niefarmakologiczne:
- zaprzestanie palenia
- kontrola masy ciała
- aktywność fizyczna
- zapobieganie infekcjom (szczepienie przeciw grypie oraz pneumokokom)
- długoterminowa tlenoterapia
- wentylacja nieinwazyjna
- rehabilitacja pulmonologiczna.
- Farmakoterapia przeciwwłóknieniowa:
- Pirfenidon i nintedanib spowalniają włóknienie i wydłużają średni czas przeżycia.
- Wskazania do terapie przeciwwłóknieniowej powinny być podejmowane przez zespół interdyscyplinarny.
- Przeszczep płuc jako jedyna metoda prowadząca do wyleczenia.4
- Środki niefarmakologiczne:
Farmakoterapia
- Przed zatwierdzeniem leków przeciwwłóknieniowych stosowano różne podejścia lecznicze, np. leki immunosupresyjne, antagonistów receptora endoteliny, inhibitory fosfodiesterazy, acetylocysteinę.8-12
- Nie są one już zalecane.
- Farmakoterapia opiera się obecnie na dwóch substancjach przeciwwłóknieniowych, pirfenidonie i nintedanibie (w Polsce dostępne wyłącznie w ramach programów lekowych).
- Pirfenidon:
- Działanie w drodze regulacji kaskad cytokin o działaniu profibrotycznym i prozapalnym.
- Spowolnienie procesu chorobowego w badaniach klinicznych.13-14
- Meta–analiza wyników trzech badań wykazała znaczące obniżenie śmiertelności z dowolnego powodu w grupie przyjmującej pirfenidon w porównaniu z grupą przyjmującą placebo.15
- Działania niepożądane są zazwyczaj łatwe do opanowania i odwracalne.
- Objawy ze strony przewodu pokarmowego: nudności i wymioty, biegunka, niestrawność, utrata masy ciała, podwyższone próby wątrobowe, rzadko ciężkie uszkodzenie wątroby.
- Objawy dermatologiczne: wysypka, reakcje fototoksyczne.
- Przed rozpoczęciem leczenia należy oznaczyć stężenie transaminaz i bilirubiny oraz kontrolować raz w miesiącu przez pierwsze 6 miesięcy.
- W przypadku znacznego wzrostu stężenia aminotransferaz dostosowanie dawki lub przerwanie leczenia.
- Nintedanib
- Wewnątrzkomórkowy inhibitor kinazy tyrozynowej.
- Działanie poprzez hamowanie transdukcji sygnału różnych czynników wzrostu (czynnik wzrostu śródbłonka naczyniowego [vascular endothelial growth factor –VEGF], czynnik wzrostu fibroblastów [fibroblast growth factor – FGF], płytkopochodny czynnik wzrostu [platelet derived growth factor – PDGF]).
- W porównaniu z placebo spowalnia proces chorobowy i wydłuża czas do pierwszego zaostrzenia.16-17
- Działania niepożądane zazwyczaj łagodne do umiarkowanych i łatwe do opanowania: biegunka, nudności, wymioty, utrata apetytu, utrata masy ciała, podwyższone próby wątrobowe.
- Należy zachować ostrożność w przypadku pacjentów ze zwiększonym ryzykiem sercowo–naczyniowym.
- U pacjentów objawowych zaleca się wdrożenie leczenia przeciwwłóknieniowego w momencie ustalenia rozpoznania.
- Jeśli jest dobrze tolerowane, leczenie przeciwwłóknieniowe należy stosować przez czas nieokreślony, w razie potrzeby do czasu przeszczepu płuc.
- Zamiana dwóch leków przeciwwłóknieniowych jest możliwa w przypadku wystąpienia niedających się kontrolować działań niepożądanych lub braku skuteczności.
- Leczenie skojarzone nintedanibem i pirfenidonem obecnie nie jest zalecane.
- Następujące leki nie są zalecane do leczenia idiopatycznego włóknienia płuc:
- „terapia potrójna” (prednizon, azatiopryna, acetylocysteina)
- acetylocysteina w monoterapii
- antykoagulacja antagonistami witaminy K
- imatynib
- ambrisentan
- podwójny antagonista receptora endoteliny–1 (bosentan, macitentan)
- inhibitor fosfodiesterazy typu 5 (sildenafil)
- leczenie zobojętniające kwas jako leczenie idiopatycznego włóknienia płuc bez dowodów choroby refluksowej.
Przebieg, powikłania i rokowanie
Powikłania
- Ostre zaostrzenia IPF
- Definiowane jako ostre, znaczne pogorszenie czynności układu oddechowego, zwykle w ciągu jednego miesiąca.
- Brak skutecznego leczenia, bardzo niekorzystne rokowanie (śmiertelność >50%).
- Rozedma płuc.
- Odma opłucnowa
- Skumulowana zapadalność 8,5%, 12,5% lub 17,7% po 1, 2 i 3 latach.
- Nadciśnienie płucne
- Do 1/3 pacjentów ma ciężkie nadciśnienie płucne.
- Rak płuca
- Zapadalność 5–48%, ryzyko raka płuc wzrasta po rozpoznaniu wraz z wydłużaniem się czasu trwania choroby.
- Zapalenie płuc.
- Powikłania po biopsji płuca (m.in. krwotok, odma opłucnowa).
Przebieg i rokowanie
- Przebieg jest różny i nie można go pewnie przewidzieć.
- Możliwych jest wiele przebiegów choroby:
- przebieg stabilny
- powolny, równomierny postęp choroby (u większości pacjentów)
- szybka progresja
- nagłe ostre pogorszenie na skutek powikłań, takich jak zapalenie płuc lub z nieznanych przyczyn.
- Różne przebiegi mogą być uwarunkowane złożoną interakcją płci pacjenta, jego wieku, czynników genetycznych i środowiskowych.
- Progresję można ocenić poprzez określenie natężonej pojemności życiowej płuc (forced expiratory vital capacity – FVC):2
- pacjenci w stanie stabilnym z wahaniami <5%
- obniżenie FVC o 5–10% w ciągu 6–12 miesięcy wskazuje na istotną prognostycznie progresję
- obniżenie FVC >10% w ciągu 6 miesięcy jest związane ze znacznie podwyższoną śmiertelnością.
- Rehabilitacja pulmonologiczna poprawia wydolność fizyczną, jakość życia i łagodzi objawy.18
- Ogólne złe rokowanie, średni okres przeżycia po ustaleniu rozpoznania: 3–5 lat.4,19
- Wskaźnik przeżycia 5-letniego: 20–40%.
- IPF jest zwłóknieniem płuc o najgorszym rokowaniu.
- Częstość zaostrzeń ok. 5–15% rocznie, z wysoką śmiertelnością.2
- Średni okres przeżywalności po ostrym zaostrzeniu: 3–4 miesiące.
- Choroby współistniejące o niekorzystnym wpływie na rokowanie, liczba chorób współistniejących koreluje z rokowaniem.
- Konsekwentne leczenie chorób współistniejących może prowadzić do poprawy rokowania.
- Rodzinne formy IPF często charakteryzują się wolniejszym postępem.
Dalsze postępowanie
- Regularne kontrole zazwyczaj co 3–4 miesiące.
- Do istotnych parametrów oceny przebiegu należą:
- jakość życia
- wydolność (test 6–minutowego marszu)
- czynność płuc (spirometria/pletyzmografia)
- pojemność dyfuzyjna płuc
- diagnostyka obrazowa (HRCT).
- Wskazana jest okresowa kontrola w poradni pulmonologicznej i/lub ośrodku referencyjnym leczenia chorób śródmiąższowych płuc.
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Ilustracje

Palce pałeczkowate (dzięki uprzejmości dr n. med. Ericha Ramstöcka)
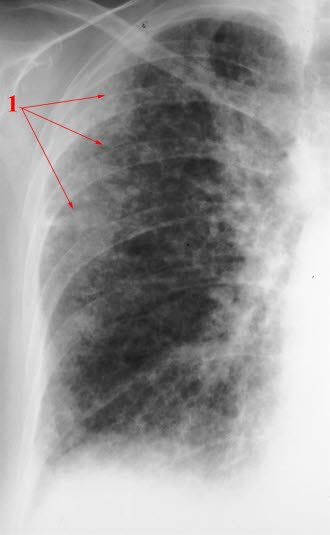
Włóknienie płuc, Rtg przeglądowy płuc: pole płucne jest małe, przepona ustawiona wysoko. Widoczne rozsiane zmiany typu siateczki, najbardziej nasilone pod opłucną (zaznaczone 1) oraz w dolnych polach płuc
Źródła
Wytyczne
- American Thoracic Society, European Respiratory Society, Japanese Respiratory Society, Latin American Thoracic Society. Diagnosis of Idiopathic Pulmonary Fibrosis. Stan na 2018 r., www.atsjournals.org.
- Piotrowski W.J. Diagnostyka i leczenie idiopatycznego włóknienia płuc i postępującego
włóknienia płuc. Omówienie wytycznych American Thoracic Society i European Respiratory
Society 2022. Med Prakt 2022; 10: 22–31, www.mp.pl. - Piotrowski W,. Bestry I., Białas A., et al. Wytyczne Polskiego Towarzystwa Chorób Płuc dotyczące diagnostyki i leczenia idiopatycznego włóknienia płuc. Pneum Pol 2020, 1(1): 9-67, journals.viamedica.pl.
Piśmiennictwo
- Raghu G., Remy-Jardin M., Myers J., et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2018; 198: e44-e68. doi:https10.1164/rccm.201807-1255ST, www.ncbi.nlm.nih.gov.
- Behr J. The diagnosis and treatment of idiopathic pulmonary fibrosis. Dtsch Arztebl Int 2015; 110: 875-81. doi:10.3238/arztebl.2013.0875, www.aerzteblatt.de.
- Raghu G., Weycker D., Edelsberg J., et al. Incidence and prevalence of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2006; 174: 810-6, PubMed.
- King Jr T.E., Pardo A., Selman M. Idiopathic pulmonary fibrosis. Seminar. Lancet 2011, 378: 1949-61, PubMed.
- Gross T.J., Hunninghake G.W. Idiopathic pulmonary fibrosis. N Engl J Med 2001, 345: 517-25, PubMed.
- Raghu G., Mageto Y.N., Lockhart D., Schmidt R.A., Wood D.E., Godwin J.D. The accuracy of the clinical diagnosis of new-onset idiopathic pulmonary fibrosis and other interstitial lung disease: a prospective study. Chest 1999, 116: 1168-74, PubMed.
- Kuś J. Zwykłe śródmiąższowe zapalenie płuc, czyli samoistne włóknienie płuc. Postępy Nauk Medycznych 2011, 4: 260-6, www.czytelniamedyczna.pl.
- Hunninghake G.W. Antioxidant therapy for idiopathic pulmonary fibrosis. N Engl J Med 2005, 353: 2285-7. PubMed.
- Bajwa E.K., Ayas N.T., Schulzer M., Mak E., Ryu J.H., Malhotra A. Interferon-gamma1b therapy in idiopathic pulmonary fibrosis: a meta-analysis. Chest 2005, 128: 203-6, www.ncbi.nlm.nih.gov.
- Zisman D.A., Schwartz M., Anstrom K.J., et al. A controlled trial of sildenafil in advanced idiopathic pulmonary fibrosis. N Engl J Med 2010, 363: 620-8, PubMed.
- Horton M.R., Santopietro V., Mathew L., et al. Thalidomide for the treatment of cough in idiopathic pulmonary fibrosis: a randomized trial. Ann Intern Med 2012, 157: 398-406, www.ncbi.nlm.nih.gov.
- Raghu G., Anstrom K.J., King T.E., et al. Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis. N Engl J Med 2012, 366: 1968-77, New England Journal of Medicine.
- Noble P.W., Albera C., Bradford W.Z., et al. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials. Lancet 2011, 377: 1760-9, PubMed.
- King TE, Bradford WZ, Castro-Bernardini S, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med 2014. doi:10.1056/NEJMoa1402582 DOI
- Nathan S., Albera C., Bradford W. et al. Effect of pirfenidone on mortality: pooled analyses and meta-analyses of clinical trials in idiopathic pulmonary fibrosis. Lancet Respir Med 2017, 5: 33-41. doi:10.1016/S2213-2600(16)30326-5, DOI.
- Richeldi L., Costabel U., Selman M., et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med 2011, 365: 1079-87, New England Journal of Medicine.
- Richeldi L., du Bois R.M., Raghu G., et al. Efficacy and safety of nintedanib in idiopathic pulmonar fibrosis. N Engl J Med 2014. doi:10.1056/NEJMoa1402584, DOI.
- Cheng L., Tan B., Yin Y., et al. Short- and long-term effects of pulmonary rehabilitation for idiopathic pulmonary fibrosis: a systematic review and meta-analysis. Clin Rehabil. 2018, PMID: 29843523, www.ncbi.nlm.nih.gov.
- Ley B., Collard H.R., King T.E. Jr. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2011, 183: 431-40, PubMed.
Opracowanie
- Tomasz Tomasik (recenzent)
- Adam Windak (redaktor)
- Małgorzata Marczewska (recenzent/redaktor)
- Michael Handke (recenzent/redaktor)