Zusammenfassung
- Definition:Multisystemerkrankung mit granulomatösen Entzündungen; betroffen sind vor allem Lunge und lymphatisches System, eine Manifestation ist aber in jedem Organ möglich.
- Häufigkeit:Jährliche Inzidenz ca. 12/100.000. Auftreten in jedem Alter möglich, Erkrankungsgipfel zwischen 20. und 40. Lebensjahr. Tritt bei Frauen häufiger auf.
- Symptome:Teilweise asymptomatisch mit zufälliger Diagnose im Röntgen-Thorax. Bei chronischem Verlauf häufig Abgeschlagenheit, Husten und Belastungsdyspnoe, weitere Symptome abhängig vom Organbefall. Bei akutem Verlauf stehen Fieber, Gelenkbeschwerden (Sprunggelenke) und Erythema nodosum im Vordergrund.
- Befunde:Röntgen-Thorax mit bihilärer Lymphadenopathie und/oder Lungenparenchymveränderungen. Granulomnachweis durch Biopsie. Weitere Befunde abhängig vom Organbefall. Laborchemisch häufig Erhöhung des Angiotensin-Converting-Enzyms (ACE).
- Diagnostik:Kein für Sarkoidose spezifischer Test verfügbar, daher epikritische Diagnosestellung: 1. typische oder vereinbare klinische und radiologische Veränderungen, 2. histologisch epitheloidzellige Granulome in mindestens einem Organ, 3. Ausschluss relevanter Differenzialdiagnosen.
- Therapie:Häufig selbstlimitierend, vor allem bei akuter Erkrankung. Medikamentöse Therapie vor allem mit Kortikosteroiden. Bei unzureichendem Ansprechen Immunsuppressiva, TNF-Alpha-Blocker.
Allgemeine Informationen
Definition
- Multisystemerkrankung unklarer Ätiologie mit granulomatösen Entzündungen
- Betroffen sind vor allem Lunge und lymphatisches System.
- Manifestation in jedem Organ möglich
- Synonyme sind M. Boeck oder M. Besnier-Boeck-Schaumann.
- Erstbeschreibung 1899 durch den norwegischen Hautarzt Caesar Boeck1
Häufigkeit
- Nur ungefähre Angaben zu Häufigkeit und Verbreitung, da die Erkrankung häufig nicht oder erst spät erkannt wird.
- Prävalenz
- ca. 46/100.000
- Inzidenz
- jährliche Inzidenz in Mitteleuropa ca. 12/100.000 Einw.
- Alter
- Geschlecht
- Frauen zu Männern ca. 2:14
- Regionale Verteilung in Europa
- in Skandinavien häufiger als in Südeuropa5
- Ethnizität
Ätiologie und Pathogenese
Ätiologie
- Die Ätiologie ist unbekannt.
- Wahrscheinlich Triggerung der Erkrankung durch eine Vielzahl von Faktoren5
- Genetische Faktoren scheinen eine Rolle zu spielen.2
- Fälle mit familiärer Häufung sind beschrieben.7
- Eine infektiöse Ursache konnte bisher nicht identifiziert werden.8
Pathogenese
- Entstehung von Granulomen auf dem Boden einer T-Zell-vermittelten Immunreaktion9
- Aktivierung von Makrophagen durch Zytokinsekretion (TNF-α, IL-2, IL-12, IL-17, INF-γ) mit Einleitung der Granulombildung
- Die Granulome bestehen aus einer zentralen kompakten Ansammlung von Makrophagen und Epitheloidzellen, umgeben von Lymphozyten.
- vermehrte Hydroxylierung von 25-Hydroxy-Vit D zu 1,25-Dihydroxy-Vit D in den Makrophagen der Granulome mit Folge einer Hyperkalzämie bei ca. 10 % der Patient*innen
- Insgesamt immunologische Charakteristika einer Reaktion gegen ein – bisher allerdings nicht identifiziertes – nominelles Antigen, denkbar wären sowohl belebte als auch unbelebte Auslöser.
Organbefall
- Die folgenden Angaben zur Häufigkeit sind als grobe Werte zu verstehen, da die Zahlen in der Literatur stark variieren.4-5
- Lunge, hiläre Lymphknoten (> 90 %)
- bihiläre Lymphadenopathie (50 %)
- bihiläre Lymphadenopathie und Parenchyminfiltrate (25 %)
- Parenchyminfiltrate (15 %)
- Lungenfibrose (5–10 %)
- Auge (20–50 %)
- Uveitis am häufigsten (v. a. anterior, auch posterior oder intermedia)
- Keratokonjunktivitis
- Nahezu jede Struktur am Auge kann betroffen sein.
- Haut (15–30 %)
- Erythema nodosum
- Lupus pernio
- Papeln, Noduli, Plaques
- Leber, Milz (20–30 %)
- Hepatomegalie, Splenomegalie
- Transaminasenerhöhung
- Gallengangsbefall
- Zirrhose, portale Hypertonie
- Muskuloskeletales System (20–30 %)
- Arthralgie, Arthritis
- Myopathie
- Periphere Lymphadenopathie (30 %)
- meist diskret palpable Lymphknoten (zervikal, axillär, inguinal)
- ZNS (5–10 %)
- zerebrale Herde
- Hirnnervenbeteiligung (häufig)
- aseptische Meningitis
- Hydrozephalus
- Krampfanfälle
- Kopfschmerzen
- Periphere Nerven (5 %)
- Mononeuritis multiplex
- Polyradikulitis
- Polyneuropathie
- Herz (5 %)
- Reizleitungsstörungen (AV-Block, Schenkelblock)
- ventrikuläre Tachykardien, supraventrikuläre Tachykardien
- Kardiomyopathie, Herzinsuffizienz
- plötzlicher Herztod
- Niere (5 %)
- Hyperkalzurie mit Nierensteinen
- interstitielle Nephritis
- Knochen (1 %)
- noduläre Läsionen
- zystische Läsionen
- Knochenmarksbefall
Verlaufsformen
Akuter Verlauf
- Bei einem akuten Verlauf stehen im Vordergrund:,
- allgemeines Krankheitsgefühl, Abgeschlagenheit, Gewichtsabnahme
- Fieber
- Gelenkbeschwerden
- Erythema nodosum (insbesondere an den Unterschenkeln)
- Oft zusätzlich trockener Husten und Belastungsdyspnoe
- Der Übergang einer akuten in eine chronische Verlaufsform ist selten, aber möglich.
- Bestimmte Formen der akuten Sarkoidose treten syndromal auf, d. h. mit einem typischen Muster des Organbefalls: Löfgren-Syndrom, Heerfordt-Syndrom.
Löfgren-Syndrom
- Trias des Löfgren-Syndroms
- Sprunggelenksarthritis
- Erythema nodosum
- bihiläre Lymphadenopathie
- Überwiegend Frauen, Auftreten meist zwischen 20. und 30. Lebensjahr
Heerfordt-Syndrom
- Trias des Heerfordt-Syndroms
- Parotitis
- Uveitis anterior
- Fazialisparese
Chronischer Verlauf
- Häufig verzögerte Diagnose bei oligosymptomatischem oder asymptomatischem Verlauf
- Nicht selten Zufallsbefund im Röntgen-Thorax
- Bei meistens dominierendem thorakalem Befall über mehrere Monate zunehmender (Reiz-)Husten, Abgeschlagenheit und Belastungsdyspnoe
- Häufig uncharakteristische Beschwerden ohne Bezug zu einem Manifestationsorgan, insbesondere ein Fatigue-Syndrom kann bei chronischer Sarkoidose dominierend sein.
- Im Übrigen ist die klinische Manifestation abhängig vom weiteren Organbefall.
Disponierende Faktoren
- In 5 % der Fälle familiär gehäuftes Vorkommen
- Umweltfaktoren wurden diskutiert (z. B. Insektizide, mikrobielle Aerosole)10
ICD-10
- D86 Sarkoidose
- D86.0 Sarkoidose der Lunge
- D86.1 Sarkoidose der Lymphknoten
- D86.2 Sarkoidose der Lunge mit Sarkoidose der Lymphknoten
- D86.3 Sarkoidose der Haut
- D86.8 Sarkoidose an sonstigen und kombinierten Lokalisationen
- D86.9 Sarkoidose, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
- Epikritische Diagnosestellung mit idealerweise folgenden Kriterien:
- typische oder vereinbare klinische und radiologische Veränderungen
- histologisch epitheloidzellige Granulome in mindestens einem Organ
- meistens nichtnekrotisierend, nekrotisierende Granulome aber vorkommend
- Ausschluss relevanter Differenzialdiagnosen
- Es gibt keinen spezifischen diagnostischen Test für Sarkoidose.4
- häufig späte Diagnosestellung, vor allem bei pulmonalem Befall11
Differenzialdiagnosen
- Differenzialdiagnose bei Systemerkrankung mit Nachweis epitheloidzellhaltiger Granulome5
- Tuberkulose (Infektion mit M. tuberculosis)
- atypische Mykobakteriosen
- Pilzinfektionen, Histoplasmose, Kokzidiose
- Infektion mit Bartonellen, Toxoplasmose, Brucellen
- Sarkoidose-ähnliche Läsionen bei Krebserkrankungen
- Sarkoidose-ähnliche Läsionen bei Immundefekten
- Sarkoidose-ähnliche Läsionen, die mit Medikamenten assoziiert sind.
- Hartmetall-assoziierte Granulomatose
- chronische Berylliose
- systemische Vaskulitiden
- rein pulmonal: exogen allergische Alveolitis, Silikose
Anamnese
- Ein Teil der Patient*innen ist symptomfrei und die Verdachtsdiagnose ergibt sich aus einem Zufallsbefund im Röntgen-Thorax.
- Weites Spektrum an nicht selten wenig richtungsweisenden klinischen Manifestationen
- Lunge und Lymphknoten sind am häufigsten befallen, aber fast alle Organe können betroffen sein.
- An eine Sarkoidose sollte u. a. gedacht werden bei jungen-mittelalten Patient*innen mit:4
- unerklärtem Husten
- Kurzatmigkeit
- Allgemeinsymptomen wie (sub-)febrilen Temperaturen, Gewichtsverlust, Fatigue.
- Ca. 50 % der Patient*innen stellen sich mit respiratorischen Symptomen vor.4
- Ca. 30 % der Patient*innen mit Allgemeinsymptomen (Fieber, Gewichtsverlust, Fatigue)4
- Weitere Symptome abhängig von sonstigem Organbefall
Klinische Untersuchung
- Bei V. a. Sarkoidose breite klinische Untersuchung, da alle Organsysteme betroffen sein können.
- Haut
- Erythema nodosum
- Lupus pernio
- spezifischste kutane Läsion12
- livid-rote bis bräunliche, bis mehrere Zentimeter große Knoten
- Lokalisation meist zentrofazial
- Bezeichnung aufgrund der Ähnlichkeit mit Frostbeulen (Perniones)
- Papeln, Noduli, Plaques
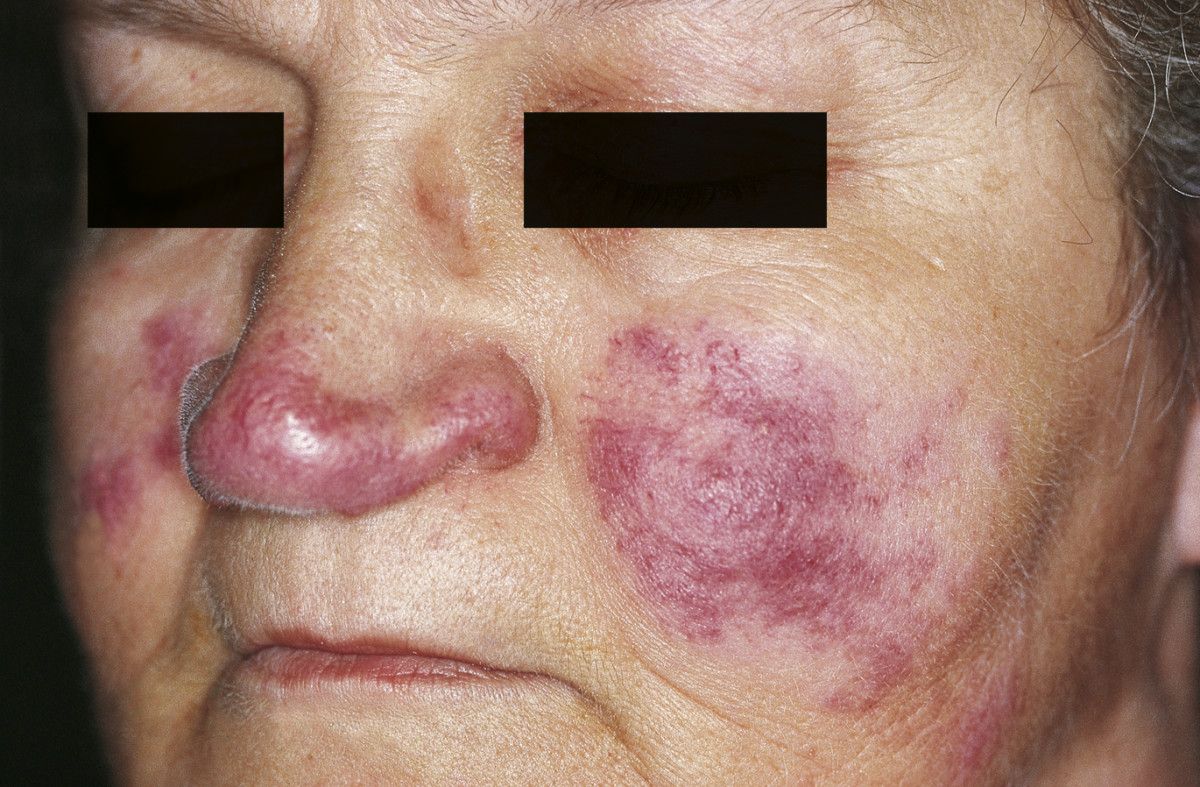 Lupus pernio
Lupus pernio
- Lymphknoten
- Auch extrathorakale Lymphknoten können vergrößert sein (zervikal, axiallär, inguinal).
- Gelenke
- Bei beidseitiger Sprunggelenksarthritis einer jungen Frau sollte bis zum Beweis des Gegenteils an ein Löfgren-Syndrom gedacht werden.
- Augen
- Rötung (Uveitis)
- Lungen
- meistens unauffälliger Auskultationsbefund, evtl. Rasselgeräusche8
- Herz
- Rhythmusstörungen
- Leber und Milz
- Hepatomegalie, Splenomegalie
- Neurologie
- zentrale Störungen (z. B. Hirnnervenausfälle)
- Befunde peripherer Neuropathien
Ergänzende Untersuchungen in der Hausarztpraxis
Rö-Thorax
- Pathologische Befunde im Röntgen-Thorax im Verlauf bei > 90 % der Patient*innen mit Sarkoidose
- Radiologische Einteilung nach Scadding
- Typ 0: Normalbefund
- Typ I: bihiläre Lymphadenopathie
- Typ II: bihiliäre Lymphadenopathie und Veränderungen des Lungenparenchyms
- Typ III: Lungenparenchymveränderungen ohne Lymphadenopathie
- Typ IV: Lungenfibose
- Nur im CT erkennbare Manifestationen werden in dieser Stadieneinteilung nicht berücksichtigt.
Labor
- Blut
- Blutbild, Differenzialblutbild
- evtl. Leukopenie
- Entzündungswerte
- Leberenzyme
- Kreatinin, eGFR
- Kalzium
- Hyperkalzämie bei ca. 10 % der Patient*innen8
- Serumeiweißelektrophorese, Immunelektrophorese
- Immunglobuline oft erhöht, vor allem IgG
- Biomarker
- Blutbild, Differenzialblutbild
- Urin
- Kalzium (Hyperkalzurie)
Spirometrie
- Typischerweise zeigt die Spirometrie mit Zunahme des Lungenbefalls eine restriktive Ventilationsstörung.
- Bei ca. 15–20 % der Patient*innen auch Obstruktion nachweisbar8
EKG
- In Studien wurden bei kardialer Sarkoidose nachgewiesen:
- AV-Block: 26–62 %
- Schenkelblock: 12–61 %.
24-h-EKG
- Nachweis und Quantifizierung von Herzrhythmusstörungen bei kardialer Sarkoidose
- supraventrikuläre Tachykardie 0–15 %
- ventrikuläre Tachykardie 2–42 %
Sonografie Abdomen
- Hinweise für Leber- oder Milzbeteiligung
Diagnostik bei Spezialist*innen
Bildgebende Verfahren
- CT
- Ausschluss von Differenzialdiagnosen15
- bei atypischen Verläufen und zur Diagnose pulmonaler Komplikationen
- strenge Indikationsstellung aufgrund der Strahlenbelastung vor allem bei jüngeren Patient*innen mit unkompliziertem Verlauf
- MRT
- Nachweis entzündlicher Herde bei:
- Neurosarkoidose
- kardialer Sarkoidose
- muskuloskelettaler Sarkoidose
- Nachweis entzündlicher Herde bei:
- FDG-PET/CT
- Echokardiografie
- Befunde wie abnorme Septumdicke, systolische/diastolische Dysfunktion oder Wandbewegungsstörungen möglich, allerdings keine für Sarkoidose spezifischen oder gar pathognomonischen Befunde
Bodyplethysmografie
- Bestimmung der Diffusionskapazität (DLCO)
- Kann auch schon bei nur geringen radiologischen Veränderungen eine Diffusionsstörung anzeigen.
- Geeignet auch als Verlaufsparameter
Bronchoalveoläre Lavage
- Abschätzung der Inflammation
- Bei Sarkoidose Erhöhung des CD4/CD8-Quotienten (nicht spezifisch)
- Verbessert die prognostische Einschätzung
- Erhöhung der Neutrophilen > 3 % ohne Keimnachweis häufig mit progredientem Verlauf verbunden
- Fester Bestandteil zum Ausschluss von Differenzialdiagnosen
Biopsie
- Bei Erstdiagnose sollte im Allgemeinen eine bioptische Sicherung angestrebt werden.5
- Ausnahme sind das Löfgren- und das Heerfordt-Syndrom, aufgrund ihrer typischen klinischen Präsentation ist hier keine histologische Bestätigung notwendig.4
- Die Biopsie sollte an dem Organ mit der besten Zugänglichkeit und Sicherheit durchgeführt werden.4
- Neben Lunge/intrathorakalen Lymphknoten können z. B. periphere Lymphknoten, Haut beim Lupus pernio oder Konjunktiven bei nodulären Veränderungen gut geeignet sein.
- Das Erythema nodosum oder periartikuläre Schwellungen eignen sich nicht für Biopsien.
- Aufgrund des häufigen Lungenbefalls und des einfachen bronchoskopischen Zugangs bioptische Sicherung meist in der Lunge5
- Die transbronchiale Lungenbiopsie kann um einen endobronchialen Ultraschall mit transbronchialer Feinnadelaspiration (EBUS/TBNA) ergänzt werden mit Erhöhung der Sensitivität.17-18
Liquorpunktion
- Bei V. a. Neurosarkoidose Liquoranalyse inklusive Bakteriologie/Zytologie zum Ausschluss infektiöser oder paraneoplastischer Differenzialdiagnosen
Indikationen zur Überweisung
- Bei V. a. die Erkrankung Überweisung zur Pneumologie
- In Abhängigkeit vom vermuteten Organbefall ggf. multidisziplinärer Ansatz
Therapie
Therapieziele
- Ausheilung
- Organfunktionen erhalten.
- Symptome kontrollieren.
- Komplikationen vermeiden.
Allgemeines zur Therapie
- Bei der Therapieentscheidung sind zu berücksichtigen:5
- die hohe Rate an Spontanheilungen
- häufiges Auftreten asymptomatischer Organbeteiligungen
- die erheblichen Nebenwirkungen der Kortikosteroidtherapie
- Der Nachweis eines Organbefalls im Rahmen einer Sarkoidose ist insofern noch nicht gleichzusetzen mit einer Behandlungsindikation.
- Sofern keine signifikanten Organbeeinträchtigungen vorliegen, kann als Alternative zur Steroidtherapie zunächst ein abwartendes und symptomorientiertes Vorgehen mit den Patient*innen besprochen werden.
- Wichtig sind:
- die Definition eines klaren Therapiezieles
- ggf. eine Anpassung des Therapieziels im Verlauf
- idealerweise Beendigung der Therapie nach Erreichen des Ziels.
- Allgemein besteht eine Behandlungsindikation bei einer progredienten, durch die Entzündung ausgelösten Schädigung eines Organs (mit oder ohne Symptomlast).
- Im Einzelnen sind obligate Therapieindikationen:,
- progrediente lungenfunktionelle Einschränkungen, progrediente belastungsinduzierte Oxygenierungsstörung
- kardiale Sarkoidose
- Neurosarkoidose
- Augenbeteiligung
- Hyperkalzämie
- wegen der Hyperkalzämie-Neigung keine Osteoporose-Prophylaxe durch Kalzium- und Vitamin-D-Substitution5
- Nephrokalzinose
- Splenomegalie mit Rupturgefahr und/oder Thrombopenie
- Lupus pernio
- symptomatische Knochenbeteiligung
- Muskelbeteiligung
- starke Erhöhung der Transaminasen oder Leberinsuffizienz.
- Das akute Löfgren-Syndrom kann symptomatisch mit NSAR behandelt werden, da es häufig zur Spontanremission kommt.,
Medikamentöse Therapie
- Für die Behandlung stehen folgende Therapeutika zur Verfügung (keine strenge Evidenz für bestimmte Therapieregime).
Erstlinienentherapie
- Prednison
- Prednisolon
Zweitlinientherapie
- 1. Wahl
- Methotrexat
- Azathioprin
- Einzelfallentscheidung
- Leflunomid
- Mycophenolat-Mofetil
- Hydroxychloroquin
- Cyclophosphamid
Drittlinientherapie
- 1. Wahl (TNF-Alpha-Blocker)
- Infliximab
- Adalimumab
- Einzelfallentscheidung
- Rituximab
- Tofacitinib
Kortikosteroide
- Kortikosteroide sind meistens die Medikamente der 1. Wahl.19-22
- Die Studienlage ist eigentlich noch unzureichend, die Durchführung placebokontrollierter Studien wird jedoch als ethisch nicht vertretbar betrachtet.5
- Bei Initialtherapie beträgt die übliche Dosis Prednison 0,5 mg/kg Körpergewicht.5
- Dosis und Dauer können der klinischen Situation angepasst werden.
- Bei Neurosarkoidose sind höhere Dosen zur Überwindung der Blut-Hirn-Schranke notwendig.5
- Therapiedauer 6 Monate mit anschließendem Ausschleichen über weitere 6 Monate5
- Kommt es während des Ausschleichens oberhalb einer Erhaltungsdosis von 7,5 mg/d zur Reaktivierung, ist der Einsatz von Methotrexat oder Azathioprin zu erwägen.5
Weitere Substanzen
- Methotrexat und Azathioprin werden primär zur Zweitlinientherapie eingesetzt auch mit dem Ziel der Kortikoideinsparung.5
- Bei unzureichendem Ansprechen stehen zur Drittlinientherapie vor allem TNF-alpha-Antikörper (Infliximab, Adalimumab) zur Verfügung.5,23
- positiver Einfluss auf die funktionelle Vitalkapazität der Lunge und insbesondere auch auf extrapulmonale Manifestationen
Chirurgie/Intervention
- Bei schwerem therapierefraktärem Verlauf sollte eine Lungentransplantation erwogen werden.
- Bei kardialer Sarkoidose kann die Implantation eines Aggregats (Schrittmacher, ICD, CRT) erforderlich werden.
- Bei Hydrozephalus im Rahmen einer Neurosarkoidose ist die Shuntdrainage angezeigt.
Verlauf, Komplikationen und Prognose
Komplikationen
- Auch unter Therapie kann es bei einigen Patient*innen zum Auftreten schwerer, vor allem pulmonaler, kardiovaskulärer und neurologischer Komplikationen kommen, z. B.:4
- respiratorische Insuffizienz
- pulmonale Hypertonie, Cor pulmonale
- maligne Herzrhythmusstörungen, plötzlicher Herztod
- Schlaganfall24
- venöse Thrombembolien25
- Hydrozephalus
- epileptische Anfälle
- Komplikationen durch Kortikosteroidtherapie bzw. weitere Therapeutika5
Verlauf und Prognose
- Insgesamt gute Prognose mit oftmals vollständiger Ausheilung
- insbesondere akute Verlaufsform mit guter Prognose, in 95 % der Fälle innerhalb von Monaten spontane Rückbildung
- Etwa 2/3 der Patient*innen mit vollständiger Remission oder nur geringen Funktionsminderungen, bei der Hälfte dieser Fälle innerhalb der ersten 3 Jahre
- Bei 1/3 der Patient*innen chronischer oder progressiver Verlauf
- Faktoren, die mit einer schlechteren Prognose verbunden sind:
- Alter > 40 Jahre
- kardiale Beteiligung
- Neurosarkoidose
- Lungenfibrose
- Hyperkalzämie
- Nephrokalzinose
- chronische Uveitis
- Lupus pernio
- zystische Knochenläsionen
- dunkle Hautfarbe
- Mortalität nur gering erhöht, auch wenn fatale Verläufe bei pulmonaler, kardialer und neurologischer Sarkoidose möglich sind.
- Eine schwedische Kohortenstudie ergab folgende Überlebensraten für alle Formen der Sarkoidose:26
- 1-Jahres-Überlebensrate: 98,9 %
- 5-Jahres-Überlebensrate: 95,4 %
- 10-Jahres-Überlebensrate: 89,4 %
- Eine schwedische Kohortenstudie ergab folgende Überlebensraten für alle Formen der Sarkoidose:26
- Medizinische Notfälle mit unmittelbarem Interventionsbedarf können sich vor allem bei Beteiligung von Herz, ZNS und Auge oder bei Hyperkalzämie entwickeln.
Verlaufskontrolle
- Verlaufskontrolle werden empfohlen:
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen

Lupus pernio (Quelle: Sand M, Sand D, Thrandorf C. Cutaneos lesions of the nose. Head Face Med 2010, zur Verfügung gestellt von Sand et al.)
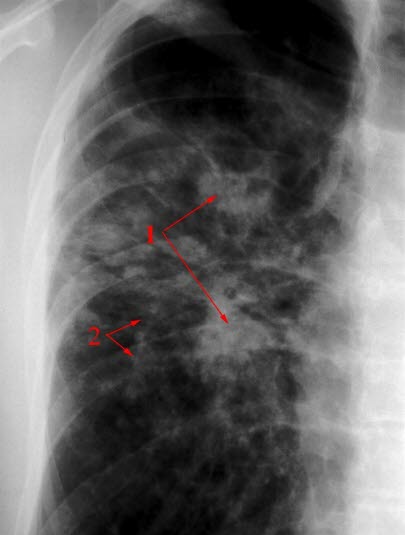
Sarkoidose, Röntgenbild
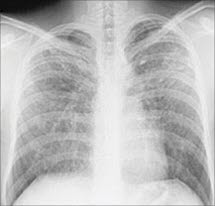
Sarkoidose, Röntgenbild
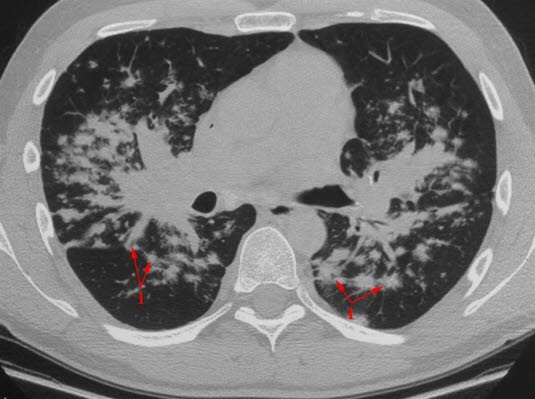
Sarkoidose, CT
Lungen und Bronchien
Quellen
Literatur
- Boeck C. Multiple benign sarcoid of the skin. J Cutan Genitourin Dis 1899; 17: 543-50. pubmed.ncbi.nlm.nih.gov
- Iannuzzi M, Rybicki B, Teirstein A. Sarcoidosis. N Engl J Med 2007; 357: 2153-2165. doi:10.1056/NEJMra071714 DOI
- Hoffmann AL, Milman N, Byg KE. Childhood sarcoidosis in Denmark 1979-1994: incidence, clinical features and laboratory results at presentation in 48 children. Acta Paediatr 2004; 93: 30-6. PubMed
- Soto-Gomez N, Peters J, Nambiar A. Diagnosis and management of sarcoidosis. Am Fam Physician 2016;93:840-850. www.aafp.org
- Prasse A. The diagnosis, differential diagnosis, and treatment of sarcoidosis. Dtsch Arztebl Int 2016; 113: 565-574. doi:10.3238/arztebl.2016.0565 DOI
- Rybicki BA, Major M, Popovich J Jr et al. Racial differences in sarcoidosis incidence: a 5-year study in a health maintenance organization. Am J Epidemiol 1997; 145: 234. pmid:9012596 PubMed
- Rybicki BA, Iannuzzi MC, Frederick MM et al. Familial aggregation of sarcoidosis. A case-control etiologic study of sarcoidosis (ACCESS). Am J Respir Crit Care Med 2001; 164: 2085. pmid:11739139 PubMed
- Kamangar N. Sarcoidosis. Medscape, updated Sep 15. 2020. Zugriff 07.07.21. emedicine.medscape.com
- Broos CE, Hendriks RW, Kool M. T-cell immunology in sarcoidosis: Disruption of a delicate balance between helper and regulatory T-cells. Curr Opin Pulm Med 2016; 22: 476. pmid:27379969 PubMed
- Newman LS, Rose CS, Bresnitz EA et al. A case control etiologic study of sarcoidosis: environmental and occupational risk factors. Am J Respir Crit Care Med 2004; 170: 1324-30. pmid:15347561 PubMed
- Judson MA, Thompson BW, Rabin DL, Steimel J, Knattereud GL, Lackland DT, et al. The diagnostic pathway to sarcoidosis. Chest 2003; 123: 406-12. PubMed
- Yanardag H, Pamuk ON, Pamuk GE. Lupus pernio in sarcoidosis: clinical features and treatment outcomes of 14 patients. J Clin Rheumatol 2003; 9: 72-6. PubMed
- Zulauf N, Passek K, Wanke E. Angiotensin Converting Enzyme (ACE) – ein Marker in der Diagnostik der Sarkoidose. Zbl Arbeitsmed 2020; 70: 278-280. doi:10.1007/s40664-020-00388-5 DOI
- Gungor S, Ozseker F, Yalcinsoy M et al. Conventional markers in determination of activity of sarcoidosis. Int Immunopharmacol 2015; 25: 174-9. doi:https://doi.org/10.1016/j.intimp.2015.01.015 pubmed.ncbi.nlm.nih.gov
- Nunes H, Brillet PY, Valeyre D, Brauner MW, Wells AU. Imaging in sarcoidosis. Semin Respir Crit Care Med 2007; 28: 102-20. PubMed
- Sobic-Saranovic D, Artiko V, Obradovic V. FDG PET imaging in sarcoidosis. Semin Nucl Med 2013; 43(6): 404–411. pmid: 24094707 PubMed
- Annema JT, Veseliç M, Rabe KF. Endoscopic ultrasound-guided fine-needle aspiration for the diagnosis of sarcoidosis. Eur Respir J 2005; 25: 405-9. PubMed
- von Bartheld MB, Dekkers OM, Szlubowski A, et al. Endosonography vs conventional bronchoscopy for the diagnosis of sarcoidosis: the GRANULOMA randomized clinical trial. JAMA 2013; 309(23): 2457–2464. pmid:23780458 PubMed
- Paramothayan NS, Lasserson TJ, Jones P. Corticosteroids for pulmonary sarcoidosis. Cochrane Database of Systematic Reviews 2005, Issue 2. Art. No.: CD001114. pubmed.ncbi.nlm.nih.gov
- Pietinalho A, Tukiainen P, Haahtela T, Persson T, Selroos O; Finnish Pulmonary Sarcoidosis Study Group. Early treatment of stage II sarcoidosis improves 5-year pulmonary function. Chest 2002; 121: 24-31. PubMed
- Baughman RP, Lower EE. Treatment of Sarcoidosis. Clin Rev Allergy Immunol 2015; 49(1): 79-92. pmid:25989728 PubMed
- Birnie DH, Sauer WH, Bogun F, et al. HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart Rhythm 2014; 11(7): 1305–1323. pmid:24819193 PubMed
- Hoitsma E, Faber CG, van Santen-Hoeufft M et al. Improvement of small fiber neuropathy in a sarcoidosis patient after treatment with infliximab. Sarcoidosis Vasc Diffuse Lung Dis 2006; 23: 73-77. pmid:16933474 PubMed
- Ungprasert P, Crowson CS, Matteson EL. Risk of cardiovascular disease among patients with sarcoidosis: a population-based retrospective cohort study, 1976-2013. Eur Respir J 2017; 49(2): pii: 1601290. pmid:28182567 PubMed
- Yakoob ZJ et al. Sarcoidosis and Risk of TVE: Validation with Big Data. Chest 2017; 151: 1398. pmid:28599933 PubMed
- Rossides M, Kullberg S et al. Sarcoidosis mortality in Sweden: a population-based cohort study. Eur Respir J. 2018;51(2). erj.ersjournals.com
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i.Br.