Informacje ogólne
Definicja
- Wielonarządowa choroba o niejasnej etiologii przebiegająca z zapaleniem ziarniniakowym
- Najczęściej zajmuje płuca i układ limfatyczny (węzły chłonne wnęk).
- Może zajmować też inne narządy.
- Inna nazwa to choroba Besniera–Boecka–Schaumanna.
- Po raz pierwszy opisana w 1899 roku przez norweskiego dermatologa Caesara Boecka.1
Epidemiologia
- Tylko przybliżone dane na temat częstotliwości i rozpowszechnienia, ponieważ choroba ta często nie jest rozpoznawana lub jest rozpoznawana późno.
- Chorobowość
- Około 46 przypadki na 100 000 osób; istotne różnice geograficzne i rasowe (od 4,7 do 64/100 000).2
- Zapadalność
- Roczna zapadalność w Europie Środkowej: około 12 przypadków na 100 000 osób, a w Polsce 10 przypadków na 100 000 osób.3
- Wiek
- Płeć
- Stosunek liczby kobiet do mężczyzn: około 2:1.6
- Rozłożenie geograficzne w Europie
- Częściej w Skandynawii niż w Europie Południowej.7
- Pochodzenie etniczne
Etiologia i patogeneza
Etiologia
- Etiologia nie jest znana.
- Prawdopodobnie wieloczynnikowa.7
- Czynniki genetyczne wydają się odgrywać istotną rolę:4
- Do tej pory nie udało się ustalić przyczyny zakaźnej.10
Patogeneza
- Rozwój ziarniniaków na podłożu reakcji immunologicznej wywołanej przez limfocyty T.11
- Aktywacja makrofagów poprzez wydzielanie cytokin (TNF–alfa, IL–2, IL–12, IL–17, INF–gamma) z tworzeniem ziarniniaków.
- Ziarniniaki składają się z makrofagów oraz komórek nabłonkowatych otoczonych limfocytami i fibroblastami.
- Zwiększona hydroksylacja 25–hydroksy–witaminy D do 1,25–dihydroksy
-–witaminy D w makrofagach ziarniniaków prowadzi do hiperkalcemii u około 10% pacjentów.
- Zwiększona hydroksylacja 25–hydroksy–witaminy D do 1,25–dihydroksy
- Proces przypomina reakcję immunologiczną przeciwko antygenowi, którego, jak dotąd, nie udało się zidentyfikować.
Potencjalnie zajęte narządy
- Poniższe informacje dotyczące częstotliwości zajęcia poszczególnych narządów należy postrzegać jako wartości przybliżone, ponieważ dane w literaturze są bardzo zróżnicowane.
- Płuca, węzły chłonne wnęk płucnych (>90%)
- obustronna limfadenopatia wnękowa (50%)
- obustronna limfadenopatia wnękowa i zmiany w miąższu płuca (25%)
- nacieki płucne (15%)
- włóknienie płuc (5–10%).
- Oko (20–50%)
- najczęściej zapalenie błony naczyniowej oka (uveitis)
- Dotyczy przede wszystkim przedniego odcinka oka, lecz może również obejmować odcinek tylny lub część pośrednią.
- zapalenie spojówki i rogówki
- niemal każda struktura oka może być zajęta.
- co 5. pacjent ma przebieg bezobjawowy.12
- najczęściej zapalenie błony naczyniowej oka (uveitis)
- Skóra (15–30%)
- rumień guzowaty (erythema nodosum)
- toczeń odmrozinowy (lupus pernio)
- wykwity grudkowe, plamisto–grudkowe, guzki podskórne, zmiany typu rybiej łuski.
- Wątroba, śledziona (20–30%)
- hepatomegalia, splenomegalia
- podwyższone transaminazy
- choroby dróg żółciowych
- marskość wątroby, nadciśnienie wrotne.
- Układ mięśniowo–szkieletowy (20–30%)
- bóle stawów, zapalenie stawów
- bóle mięśniowe.
- Limfadenopatia obwodowa (30%)
- zazwyczaj w badaniu palpacyjnym dyskretnie wyczuwalne węzły chłonne (szyjne, pachowe, pachwinowe).
- OUN (5–10%)
- ognisko w mózgu
- uszkodzenie nerwów czaszkowych (częste)
- aseptyczne zapalenie opon mózgowo–rdzeniowych
- wodogłowie
- napady drgawkowe
- ból głowy.
- Nerwy obwodowe (5%)
- zapalenie kilku pojedynczych nerwów (mononeuritis multiplex)
- zapalenie wielokorzeniowe
- polineuropatia.
- Serce (5%)
- zaburzenia przewodzenia (blok AV, blok odnogi pęczka Hisa)
- częstoskurcz komorowy, częstoskurcz nadkomorowy
- kardiomiopatia, niewydolność serca
- nagły zgon sercowy.
- Nerki (5%)
- hiperkalciuria z kamicą nerkową
- śródmiąższowe zapalenie nerek.
- Kości (1%)
- zmiany guzkowe
- zmiany torbielowate
- choroby szpiku kostnego.
Przebieg
Ostry przebieg
- W ostrym przebiegu głównymi objawami są:
- ogólne złe samopoczucie, zmęczenie, zmniejszenie masy ciała
- gorączka
- dolegliwości bólowe stawów
- rumień guzowaty (erythema nodosum), zwłaszcza na podudziach.
- Często dodatkowo suchy kaszel i duszność wysiłkowa.
- Przejście postaci ostrej w przewlekłą zdarza się rzadko, ale jest możliwe.
- Niektóre rodzaje ostrej sarkoidozy cechują się charakterystycznym zespołem objawów
- np. zespół Löfgrena, zespół Heerfordta.
Zespół Löfgrena
- Triada zespołu Löfgrena
- zapalenie stawu skokowego
- rumień guzowaty (erythema nodosum)
- obustronna limfadenopatia wnękowa.
- Często również występuje gorączka.
- Pojawia się najczęściej między 20 a 30 rokiem życia, z przewagą u kobiet.
Zespół Heerfordta
- Triada zespołu Heerfordta
- zapalenie ślinianek przyusznych (parotitis)
- zapalenie przedniej części błony naczyniowej oka (uveitis anterior)
- porażenie nerwu twarzowego.
- Często również występuje gorączka.
Przebieg przewlekły
- Często opóźnione rozpoznanie w przebiegu skąpo– lub bezobjawowym.
- Nierzadko przypadkowe stwierdzenie w rutynowym badaniu RTG klatki piersiowej, wykonanym z innych wskazań.
- Przewlekły kaszel (kilka miesięcy), zmęczenie i duszność wysiłkowa.
- W sarkoidozie o przewlekłym przebiegu często występują niecharakterystyczne dolegliwości bez związku z zajętym narządem, w szczególności zespół zmęczenia.
- Poza tym objawy kliniczne zależą od zajętych narządów.
Czynniki predysponujące
- Wywiad rodzinny dodatni w 5% przypadków.
- Stwierdzono wpływ czynników środowiskowych (np. insektycydy, aerozole mikrobiologiczne).13
ICD–10
- D86 Sarkoidoza.
- D86.0 Sarkoidoza płucna.
- D86.1 Sarkoidoza węzłów chłonnych.
- D86.2 Sarkoidoza płucna współistniejąca z sarkoidozą węzłów chłonnych.
- D86.3 Sarkoidoza skórna.
- D86.8 Sarkoidoza innych narządów oraz wielonarządowa.
- D86.9 Sarkoidoza, nieokreślona.
Diagnostyka
Kryteria diagnostyczne
- Rozpoznanie stawia się na podstawie:
- typowego obrazu klinicznego oraz charakterystycznych zmian radiologicznych
- potwierdzenia w badaniu histopatologicznym obecności ziarniniaków w co najmniej jednym narządzie (przeważnie ziarninaki niemartwicze)
- wykluczenie innych prawdopodobnych rozpoznań różnicowych.
- Nie istnieje określony test diagnostyczny do potwierdzenia sarkoidozy6
- Często rozpoznawana późno, zwłaszcza w przypadku zajęcia płuc.14
Diagnostyka różnicowa
- Choroby ogólnoustrojowe z obecnością ziarniniaków zawierających komórki epitelioidalne:7
- gruźlica (zakażenie M. tuberculosis)
- atypowe mykobakteriozy
- zakażenia grzybicze (aspergiloza, histoplazmoza)
- zakażenia pierwotniakowe (kokcydioza, toksoplazmoza)
- zakażenia wywołane przez bakterie Bartonella, Brucella
- reakcja sarkoidalna w węzłach chłonnych w przebiegu nowotworu złośliwego
- zmiany podobne do sarkoidozy przy niedoborach odporności
- ziarniniakowo–limfocytowa choroba śródmiąższowa płuc (granulomatous lymphocytic interstitial lung disease – GLILD) u chorych z pospolitym zmiennym niedoborem odporności (common variable immunodeficiency – CVID)
- reakcje polekowe
- choroby ziarniniakowe wywoływane przez pyły metali
- przewlekła beryloza, krzemica
- układowe zapalenia naczyń (vasculitis)
- alergiczne zapalenie pęcherzyków płucnych.
- Powiększenie węzłów chłonnych wnęk w przebiegu nowotworów pierwotnych (układu chłonnego) oraz wtórnych (przerzuty raka piersi, płuca, nerki).
- Inne choroby śródmiąższowe płuc.
Wywiad lekarski
- U części pacjentów przebieg choroby jest bezobjawowy, a podejrzenie sarkoidozy wysuwa się na podstawie przypadkowo stwierdzonych zmian w badaniu RTG klatki piersiowej wykonanym z innych przyczyn.
- Szerokie spektrum objawów klinicznych, często niespecyficznych.
- Najczęściej zajęte są płuca i węzły chłonne, ale niemal każdy narząd może być dotknięty.
- Diagnostykę w kierunku sarkoidozy należy rozważyć m.in. u pacjentów w młodym i średnim wieku z poniższymi objawami:6
- niewyjaśniony kaszel
- duszność
- objawy ogólne, takie jak podwyższona temperatura, utrata masy ciała, zmęczenie.
- U około 50% pacjentów występują objawy ze strony układu oddechowego.6
- Około 30% pacjentów ma objawy ogólne (gorączka, utrata wagi, zmęczenie).6
- Pozostałe objawy zależą od zajętego narządu.
Badanie fizykalne
- W przypadku podejrzenia sarkoidozy konieczne jest dokładne, szczegółowe badanie przedmiotowe, ze względu na ogólnoustrojowy charakter choroby.
- Skóra
- rumień guzowaty (erythema nodosum)
- toczeń odmrozinowy (lupus pernio)
- najbardziej specyficzna dla sarkoidozy zmiana skórna15
- czerwone lub brązowawe nacieki o wielkości do kilku centymetrów
- umiejscowienie głównie w części środkowej twarzy
- nazwa ze względu na podobieństwo do odmrożeń (odmroziny)
- wykwity grudkowe, plamisto–grudkowe, guzki podskórne, zmiany typu rybiej łuski.
- Węzły chłonne
- oprócz węzłów chłonnych wnęk, powiększone mogą być również węzły chłonne obwodowe (szyjne, pachowe, pachwinowe).
- Stawy
- obustronne zapalenie stawów skokowych u młodej kobiety nasuwa podejrzenie zespółu Löfgrena, dopóki nie zostanie postawione inne rozpoznanie.
- Oczy
- ból, zaczerwienienie – zapalenie błony naczyniowej (uveitis).
- Płuca
- Serce
- zaburzenia rytmu
- nagły zgon sercowy.
- Wątroba i śledziona
- hepatomegalia, splenomegalia.
- Układ neurologiczny
- zaburzenia ośrodkowego układu nerwowego (np. porażenie nerwów czaszkowych)
- cechy neuropatii obwodowej
- rzadziej aseptyczne zapalenie opon mózgowo–rdzeniowych.
Badania uzupełniające w praktyce lekarza rodzinnego
RTG klatki piersiowej
- Nieprawidłowy wynik RTG klatki piersiowej stwierdza się u ponad 90% pacjentów z sarkoidozą.
- Klasyfikacja radiologiczna według Scaddinga:16
- Typ 0: prawidłowy obraz.
- Typ I: obustronna limfadenopatia wnękowa.
- Typ II: obustronna limfadenopatia wnękowa i zmiany w miąższu płuc.
- Typ III: zmiany w miąższu płuc bez limfadenopatii.
- Typ IV: włóknienie płuc.
- Cechy widoczne tylko w tomografii komputerowej nie są brane pod uwagę w tej klasyfikacji.
Badania laboratoryjne
- Krew
- morfologia krwi z rozmazem
- możliwa leukopenia
- markery stanu zapalnego
- enzymy wątrobowe.
- morfologia krwi z rozmazem
- Kreatynina, eGFR.
- Wapń
- hiperkalcemia u około 10% pacjentów.10
- Elektroforeza białek surowicy, immunoelektroforeza
- immunoglobuliny często podwyższone, zwłaszcza IgG (niedostępne w POZ).
Spirometria
- Najczęściej w spirometrii stwierdza się zaburzenia wentylacji o typie restrykcji, szczególnie w zaawansowanych stadiach choroby.
- U 15–20% pacjentów można również stwierdzić obturację.10
EKG
- Wykonywane u każdego chorego jako badanie przesiewowe
- W przypadku zajęcia serca, najczęstsze zaburzenia to:
- blok AV: 26–62%
- blok odnogi pęczka Hisa: 12–61%.
Badanie Holter EKG (24-–godzinne)
- Dostępne w POZ tylko w ramach opieki koordynowanej.
- Wykrywanie zaburzeń rytmu serca lub przewodzenia:
- częstoskurcz nadkomorowy 0–15%
- częstoskurcz komorowy 2–42%.
USG jamy brzusznej
- Wskazane przy podejrzeniu zajęcia wątroby lub śledziony (hepato– i/lub splenomegalia, podwyższona aktywność transaminaz).
Diagnostyka specjalistyczna
Badania laboratoryjne
- Krew
- Biomarkery
- ACE (angiotensin converting enzyme, konwertaza angiotensyny)
- wskaźnik masy ziarniniaków
- aktywność w surowicy podwyższona nawet u 75% pacjentów z sarkoidozą6
- palenie prowadzi do wzrostu ACE proporcjonalnego do konsumpcji.
- sIL2R (rozpuszczalny receptor dla interleukiny–2)17
- odzwierciedla aktywację komórek T
- marker odpowiedni do kontroli przebiegu choroby.7
- Neopteryna
- odzwierciedla aktywację monocytów
- marker odpowiedni do kontroli przebiegu choroby.7
- ACE (angiotensin converting enzyme, konwertaza angiotensyny)
- Biomarkery
- Mocz
- Wapń w dobowej zbiórce moczu (hiperkalciuria) – badanie zwykle wykonywane w warunkach szpitalnych.
Badania obrazowe
- TK
- Wykluczenie rozpoznań różnicowych.18
- Wskazana przy nietypowym przebiegu choroby i w diagnostyce powikłań płucnych.
- Zalecane wykonywanie tylko w ściśle określonych wskazaniach ze względu na ekspozycję na promieniowanie jonizujące, zwłaszcza u młodszych pacjentów z przebiegiem choroby bez powikłań.
- MR
- Wykrywanie ognisk zapalnych przy:
- neurosarkoidozie
- sarkoidozie serca
- sarkoidozie mięśniowo–szkieletowej.
- Wykrywanie ognisk zapalnych przy:
- FDG PET/TK
- Echokardiografia
- Brak zmian specyficznych czy patognomicznych dla sarkoidozy
- Możliwe jest stwierdzenie nieprawidłowej grubości przegrody, dysfunkcji skurczowej/rozkurczowej lub zaburzeń kurczliwości.
- W przypadku podejrzenia nadciśnienia płucnego złotym standardem pozostaje cewnikowanie prawego serca.
- Brak zmian specyficznych czy patognomicznych dla sarkoidozy
Pletyzmografia
- Określenie zdolności dyfuzyjnej płuc (DLCO).
- Może wskazywać na zaburzenia dyfuzji nawet przy niewielkich zmianach radiologicznych.
- Wskazana w monitorowaniu przebiegu choroby.
Bronchoskopia z pobraniem popłuczyn oskrzelowo–pęcherzykowych (BAL)
- Ocena stanu zapalnego.
- Zwiększony stosunek liczby limfocytów CD4/CD8 (wskaźnik niespecyficzny).
- Ma znaczenie prognostyczne
- Zwiększenie liczby neutrofilów >3% bez dowodów na obecność drobnoustrojów często związany jest z postępującym przebiegiem choroby.
- Badanie podstawowe w diagnostyce różnicowej.
Biopsja
- Należy zasadniczo dążyć do potwierdzenia rozpoznania na podstawie badania histopatologicznego materiału z biopsji.7
- Wyjątkiem są zespół Löfgrena i zespół Heerfordta – ze względu na typowy dla nich obraz kliniczny, potwierdzenie histopatologiczne nie jest konieczne.6
- Biopsja najbardziej dostępnego narządu, z uwzględnieniem bezpieczeństwa procedury6
- Oprócz węzłów chłonnych płuc/śródpiersia odpowiednie mogą być węzły chłonne obwodowe, skóra w przypadku tocznia odmrozinowego (lupus pernio) lub spojówki w przypadku zmian guzkowych.
- Rumień guzowaty (erythema nodosum) lub obrzęki okołostawowe nie nadają się do biopsji.
- Ze względu na częste zajęcie płuc i łatwy dostęp bronchoskopowy, należy wykonać przezoskrzelową biopsję tkanki płucnej. 7
- Biopsja przezoskrzelowa płuca powinna być uzupełniona przezoskrzelową aspiracyjną biopsją igłową węzłów chłonnych pod kontrolą ultrasonografii wewnątrzoskrzelowej (EBUS-TBNA) – wzrasta wówczas czułość badania.
- Jeśli u chorego występują zarówno cechy limfadenopatii, jak i zmiany w miąższu płuca,
wgwedług zaleceń BTS badaniem z wyboru jest EBUS–TBNA.
Badanie płynu mózgowo–rdzeniowego
- W przypadku podejrzenia neurosarkoidozy konieczne jest badanie płynu mózgowo–rdzeniowego, w tym badanie bakteriologiczne/cytologiczne, w celu wykluczenia rozpoznań różnicowych o charakterze infekcyjnym lub paraneoplastycznym.
Badanie okulistyczne w lampie szczelinowej
- Wyjściowe badanie należy wykonać u każdego chorego.
- Zajęcie narządu wzroku występuje aż u około 1/4 chorych, a co 5. ma przebieg bezobjawowy.12
- Ponowna ocena okulistyczna zalecana jedynie w przypadku pojawienia się zaburzeń widzenia, bólu gałki ocznej, światłowstrętu lub innych objawów.12
Wskazania do skierowania do specjalisty
- W przypadku podejrzenia sarkoidozy skierowanie do pulmonologa lub na Oddział Chorób Płuc.
- Ze względu na możliwość zajęcia wielu różnych narządów, wskazane jest podejście wielodyscyplinarne.
Leczenie
Cele leczenia
- Wyleczenie.
- Zachowanie funkcji narządów.
- Kontrola objawów.
- Uniknięcie powikłań.
Ogólne informacje o leczeniu
- Przy podejmowaniu decyzji o wyborze terapii należy wziąć pod uwagę:7
- duży odsetek samoistnych wyleczeń
- częste występowanie bezobjawowego zajęcia narządów
- znaczne skutki uboczne terapii systemowej glikokortykosteroidami (GKS).
- Wykrycie zajęcia narządu w przebiegu sarkoidozy nie jest równoznaczne ze wskazaniem do rozpoczęcia leczenia.
- Jeśli nie ma istotnych zaburzeń narządowych, można omówić z pacjentem podejście oparte na obserwacji i monitorowaniu objawów, jako alternatywę dla GKS.
- Ważne są:
- jasne określenie celu leczenia
- w razie potrzeby korekta celu terapii podczas leczenia
- optymalne zakończenie leczenia po osiągnięciu celu.
- Wskazanie do leczenia istnieje w przypadku postępującego uszkodzenia narządu (również bez towarzyszących objawów) wywołanego przez stan zapalny.
- Leczenie jest konieczne w następujących przypadkach:20
- postępujące zaburzenia czynności płuc, postępująca niewydolność oddechowa
- sarkoidoza serca
- neurosarkoidoza
- zajęcie oczu
- hiperkalcemia
- Ze względu na tendencję do hiperkalcemii, w sarkoidozie nie stosuje się profilaktyki osteoporozy poprzez suplementację wapnia i witaminy D.7
- Leczenie należy rozważyć w następujących przypadkach:
- splenomegalia z ryzykiem pęknięcia śledziony i/lub małopłytkowością
- wapnica nerek
- toczeń odmrozinowy (lupus pernio)
- objawowe zajęcie kości
- zajęcie mięśni
- duży wzrost aktywności transaminaz lub niewydolność wątroby.
- Zespół Löfgrena z ostrym przebiegiem można leczyć objawowo za pomocą niesteroidowych leków przeciwzapalnych (NLPZ), gdyż często dochodzi do spontanicznej remisji.
Farmakoterapia
- W leczeniu dostępne są poniższe opcje terapeutyczne (brak ścisłych dowodów pozwalających na dobór konkretnych schematów terapii).
Leczenie pierwszego rzutu
Leczenie drugiego rzutu
- Pierwszy wybór:
- Decyzja o włączeniu w poszczególnych przypadkach:
Leczenie trzeciego rzutu
- Pierwszy wybór (bloker TNF–alfa)
- Decyzja o włączeniu w poszczególnych przypadkach
Glikokortykosteroidy (GKS)
- Glikokortykosteroidy są zwykle lekami pierwszego wyboru.21-24
- W terapii początkowej zwykle stosowana dawka prednizonu wynosi 0,5 mg/kg masy ciała lub 20–40 mg na dobę.7
- Dawkę i czas trwania należy dostosować do sytuacji klinicznej.
- W neurosarkoidozie konieczne są większe dawki pozwalające na przełamanie bariery krew–mózg.7
- Czas trwania leczenia to 6 miesięcy z późniejszym stopniowym odstawieniem w ciągu kolejnych 6 miesięcy.7
- Leczenie krótsze niż 12 miesięcy wiąże się ze zwiększonym ryzykiem nawrotu choroby.25
- Jeśli reaktywacja wystąpi podczas odstawiania leku powyżej dawki podtrzymującej 7,5 mg na dobę, należy rozważyć zastosowanie metotreksatu lub azatiopryny.7
Inne substancje
- Metotreksat i azatiopryna są stosowane przede wszystkim w terapii drugiego rzutu, również w celu zredukowania dawki GKS.7
- Porównywalne działanie immunosupresyjne metotreksatu i azatiopryny.7
- W przypadku nietolerancji lub przeciwwskazań do tych substancji, można alternatywnie zastosować leflunomid lub mykofenolan mofetylu.7
- W razie niewystarczającej odpowiedzi klinicznej, terapią trzeciego rzutu są przeciwciała anty TNF–alfa (infliksymab, adalimumab).7,26
- Pozytywny wpływ na czynnościową pojemność życiową płuc oraz na objawy pozapłucne.
Chirurgia/leczenie interwencyjne
- W ciężkim, przewlekłym, postępującym, opornym na leczenie przebiegu, należy rozważyć wskazania do przeszczepienia płuca.
- W przypadku sarkoidozy serca konieczne może być wszczepienie urządzenia (stymulator serca, ICD, CRT).
- W przypadku wodogłowia związanego z neurosarkoidozą, wskazany jest drenaż za pomocą systemów zastawkowych.
Przebieg, powikłania i rokowanie
Powikłania
- Nawet przy prawidłowym leczeniu u części pacjentów mogą wystąpić ciężkie powikłania, zwłaszcza płucne, sercowo-naczyniowe i neurologiczne, np.:6
- niewydolność oddechowa
- nadciśnienie płucne, serce płucne (cor pulmonale)
- ciężkie zaburzenia rytmu serca, nagły zgon sercowy
- udar27
- żylna choroba zakrzepowo–zatorowa28
- wodogłowie
- napady padaczkowe
- powikłania związane z terapią glikokortykosteroidami lub innymi lekami.7
Przebieg i rokowanie
- Ogólnie dobre rokowanie, często z całkowitym wyleczeniem
- Ostry przebieg ma szczególnie dobre rokowanie – w 95% przypadków spontaniczna regresja w ciągu kilku miesięcy.
- U około 2/3 chorych uzyskuje się remisję całkowitą lub z jedynie niewielkim upośledzeniem funkcji narządów; w połowie przypadków w ciągu pierwszych 3 lat.
- Przewlekły lub postępujący przebieg u około 1/3 chorych.
- Czynniki związane z gorszym rokowaniem:
- wiek >40 lat
- zajęcie serca
- zajęcie ośrodkowego układu nerwowego (neurosarkoidoza)
- włóknienie płuc
- hiperkalcemia
- wapnica nerek, kamica nerkowa, niewydolność nerek
- przewlekłe zapalenie błony naczyniowej oka (uveitis)
- toczeń odmrozinowy (lupus pernio)
- torbielowate zmiany kostne
- ciemny kolor skóry (pochodzenie z Afryki).
- Śmiertelność jest niewielka i wynosi 1–5%; najczęstszymi przyczynami zgonu są niewydolność oddechowa, zajęcie serca oraz neurosarkoidoza.3
- Wskaźniki przeżycia dla wszystkich postaci sarkoidozy:29
- wskaźnik przeżycia 1 rok: 98,9%
- wskaźnik przeżycia 5 lat: 95,4%
- wskaźnik przeżycia 10 lat: 89,4%.
- Wskaźniki przeżycia dla wszystkich postaci sarkoidozy:29
- Nagłe zdarzenia medyczne wymagające interwencji lekarskiej zdarzają się najczęściej w przypadku zajęcia serca, ośrodkowego układu nerwowego i oka oraz w przypadku hiperkalcemii.
Dalsze postępowanie
- Zalecana jest kontrola choroby:
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Ilustracje
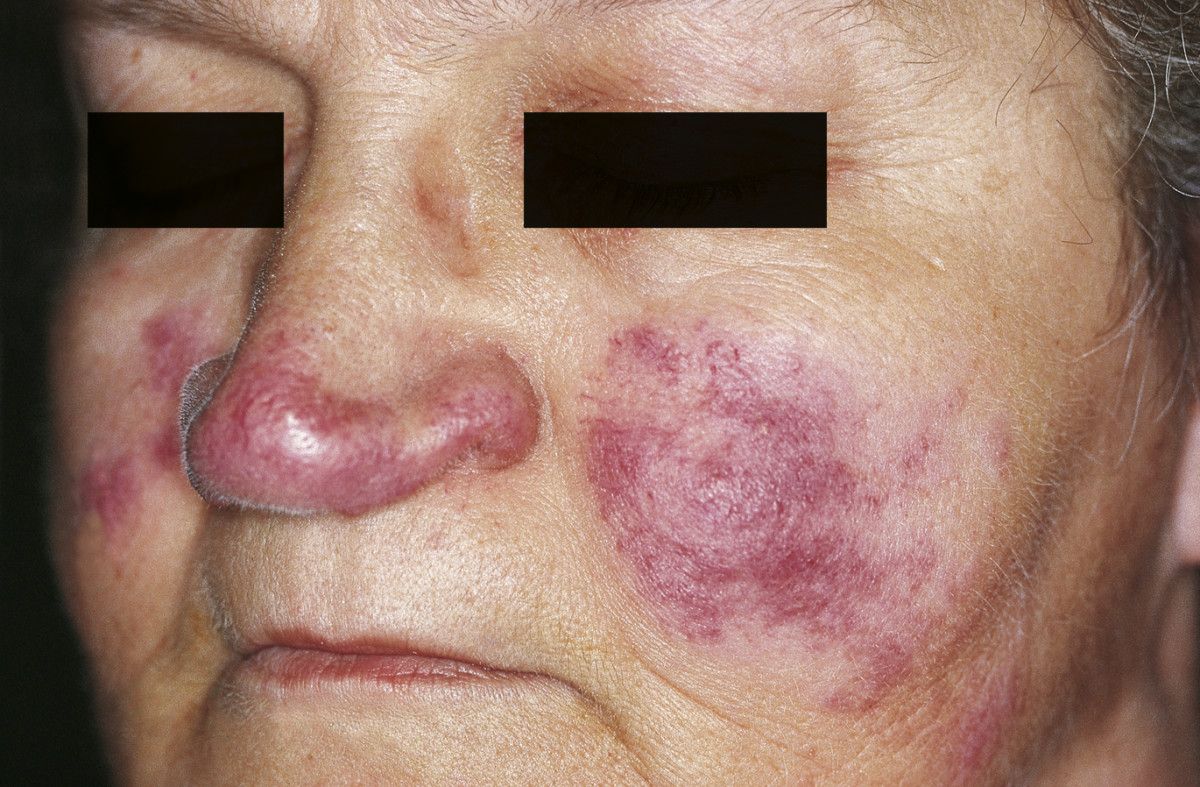
Toczeń odmrozinowy – lupus pernio (źródło: Sand M, Sand D, Thrandorf C. Cutaneos lesions of the nose. Head Face Med 2010, udostępnione przez Sand et al.)
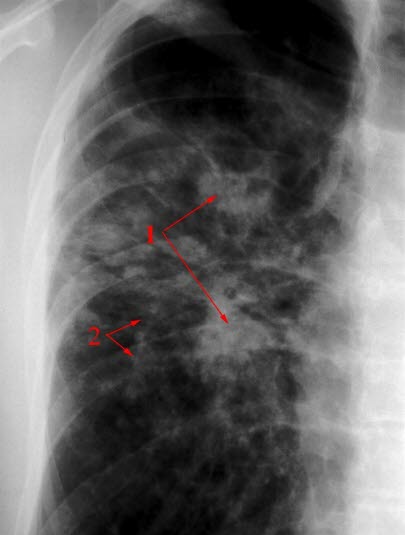
Sarkoidoza w RTG klatki piersiowej
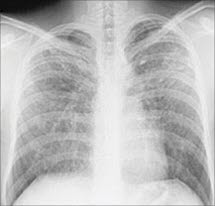
Sarkoidoza, RTG klatki piersiowej
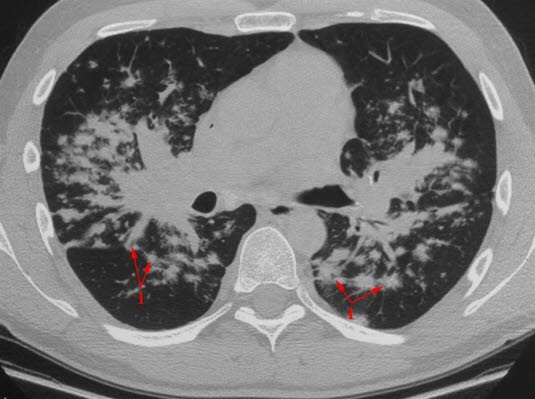
Sarkoidoza, tomografia komputerowa
Źródła
Wytyczne
- Thillai M, Atkins CP, Crawshaw A. et al. BTS Clinical Statement on pulmonary sarcoidosis. Thorax. 2021 Jan;76(1):4-20. DOI
- Piotrowski W. Sarkoidoza układu oddechowego. Omówienie stanowiska British Thoracic Society 2021. Med. Prakt., 2021; 12: 50–59. mp.pl
- Crouser ED, Maier LA, Wilson KC, et al. Diagnosis and Detection of Sarcoidosis. An Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med. 2020;201(8):e26-e51. DOI
- Piotrowski WJ, Bączek K, Majewski S. Zasady leczenia sarkoidozy na podstawie wytycznych European Respiratory Society (ERS) i stanowiska British Thoracic Society (BTS). Pneumonologia Polska. 2022;3:24–32. journals.viamedica.pl
Piśmiennictwo
- Boeck C. Multiple benign sarcoid of the skin, J Cutan Genitourin Dis 1899, 17: 543-50, pubmed.ncbi.nlm.nih.gov
- Zulauf N., Passek K., Wanke E. Angiotensin Converting Enzyme (ACE) – ein Marker in der Diagnostik der Sarkoidose, Zbl Arbeitsmed 2020, 70: 278-80, doi:10.1007/s40664-020-00388-5, DOI
- Szczeklik A., Gajewski P. Interna Szczeklika 2022, Medycyna Praktyczna, 2022, www.mp.pl
- Iannuzzi M., Rybicki B., Teirstein A. Sarcoidosis, N Engl J Med 2007, 357: 2153-65, doi:10.1056/NEJMra071714, DOI
- Hoffmann A.L., Milman N., Byg K.E. Childhood sarcoidosis in Denmark 1979-1994: incidence, clinical features and laboratory results at presentation in 48 children, Acta Paediatr 2004, 93: 30-6, PubMed
- Soto-Gomez N., Peters J., Nambiar A. Diagnosis and management of sarcoidosis, Am Fam Physician 2016, 93: 840-50, www.aafp.org
- Prasse A. The diagnosis, differential diagnosis, and treatment of sarcoidosis, Dtsch Arztebl Int 2016, 113: 565-74, doi:10.3238/arztebl.2016.0565, DOI
- Rybicki B.A., Major M., Popovich J. Jr et al. Racial differences in sarcoidosis incidence: a 5-year study in a health maintenance organization, Am J Epidemiol 1997, 145: 234, pmid:9012596, PubMed
- Rybicki B.A., Iannuzzi M.C., Frederick M.M. et al. Familial aggregation of sarcoidosis. A case-control etiologic study of sarcoidosis (ACCESS), Am J Respir Crit Care Med 2001, 164: 2085, pmid:11739139, PubMed
- Kamangar N. Sarcoidosis. Medscape, aktualizacja: 15.09.2020, dostęp: 07.07.2021, emedicine.medscape.com
- Broos C.E., Hendriks R.W., Kool M. T-cell immunology in sarcoidosis: Disruption of a delicate balance between helper and regulatory T-cells, Curr Opin Pulm Med 2016, 22: 476, pmid:27379969, PubMed
- Crouser E.D., Maier L.A., Wilson K.C., et al. Diagnosis and Detection of Sarcoidosis. An Official American Thoracic Society Clinical Practice Guideline, Am J Respir Crit Care Med. 2020, 201(8): 26-51, doi:10.1164/rccm.202002-0251ST, pubmed.ncbi.nlm.nih.gov
- Newman L.S., Rose C.S., Bresnitz E.A. et al. A case control etiologic study of sarcoidosis: environmental and occupational risk factors, Am J Respir Crit Care Med 2004, 170: 1324-30, pmid:15347561, PubMed
- Judson M.A., Thompson B.W., Rabin D.L., Steimel J., Knattereud G.L., Lackland D.T., et al. The diagnostic pathway to sarcoidosis, Chest 2003, 123: 406-12, PubMed
- Yanardag H., Pamuk O.N., Pamuk G.E. Lupus pernio in sarcoidosis: clinical features and treatment outcomes of 14 patients, J Clin Rheumatol 2003, 9: 72-6, PubMed
- Piotrowski W.J.: Diagnostyka sarkoidozy. Omówienie wytycznych American Thoracic Society 2020, Med. Prakt., 2020, 9: 27-38, www.mp.pl
- Gungor S., Ozseker F., Yalcinsoy M. et al. Conventional markers in determination of activity of sarcoidosis, Int Immunopharmacol 2015, 25: 174-9, doi:https://doi.org/10.1016/j.intimp.2015.01.015, pubmed.ncbi.nlm.nih.gov
- Nunes H., Brillet P.Y., Valeyre D., Brauner M.W., Wells A.U. Imaging in sarcoidosis, Semin Respir Crit Care Med 2007, 28: 102-20, PubMed
- Sobic-Saranovic D., Artiko V., Obradovic V. FDG PET imaging in sarcoidosis, Semin Nucl Med 2013, 43(6): 404-11, pmid: 24094707, PubMed
- Piotrowski W.J., Bączek K., Majewski S. Zasady leczenia sarkoidozy na podstawie wytycznych European Respiratory Society (ERS) i stanowiska British Thoracic Society (BTS), Pneumonologia Polska, 2022;3: 24-32, journals.viamedica.pl
- Paramothayan N.S., Lasserson T.J., Jones P. Corticosteroids for pulmonary sarcoidosis, Cochrane Database of Systematic Reviews 2005, Issue 2. Art. No.: CD001114, pubmed.ncbi.nlm.nih.gov
- Pietinalho A., Tukiainen P., Haahtela T., Persson T., Selroos O; Finnish Pulmonary Sarcoidosis Study Group, Early treatment of stage II sarcoidosis improves 5-year pulmonary function, Chest 2002, 121: 24-31, PubMed
- Baughman R.P., Lower E.E. Treatment of Sarcoidosis, Clin Rev Allergy Immunol 2015, 49(1): 79-92, pmid:25989728, PubMed
- Birnie D.H., Sauer W.H., Bogun F., et al. HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis, Heart Rhythm 2014, 11(7): 1305-23, pmid:24819193, PubMed
- Piotrowski W.J.: Sarkoidoza układu oddechowego. Omówienie stanowiska British Thoracic Society 2021, Med. Prakt., 2021, 12: 50-9, www.mp.pl
- Hoitsma E., Faber C.G., van Santen-Hoeufft M. et al. Improvement of small fiber neuropathy in a sarcoidosis patient after treatment with infliximab, Sarcoidosis Vasc Diffuse Lung Dis 2006, 23: 73-7, pmid:16933474, PubMed
- Ungprasert P., Crowson C.S., Matteson E.L. Risk of cardiovascular disease among patients with sarcoidosis: a population-based retrospective cohort study, 1976-2013, Eur Respir J 2017, 49(2): pii: 1601290, pmid:28182567, PubMed
- Yakoob Z.J. et al. Sarcoidosis and Risk of TVE: Validation with Big Data, Chest 2017, 151: 1398, pmid:28599933, PubMed
- Rossides M., Kullberg S. et al. Sarcoidosis mortality in Sweden: a population-based cohort study, Eur Respir J. 2018, 51(2), erj.ersjournals.com
- Annema J.T., Veseliç M., Rabe K.F. Endoscopic ultrasound-guided fine-needle aspiration for the diagnosis of sarcoidosis, Eur Respir J 2005, 25: 405-9, PubMed
- von Bartheld M.B., Dekkers O.M., Szlubowski A., et al. Endosonography vs conventional bronchoscopy for the diagnosis of sarcoidosis: the GRANULOMA randomized clinical trial, JAMA 2013, 309(23): 2457-64, pmid:23780458, PubMed
- Thillai M., Atkins C.P., Crawshaw A., Hart S.P., Ho L.P., Kouranos V., Patterson K., Screaton N.J., Whight J., Wells A.U. BTS Clinical Statement on pulmonary sarcoidosis. Thorax, 2021 Jan, 76(1): 4-20, doi: 10.1136/thoraxjnl-2019-214348, Epub 02.12.2020, Erratum in: Thorax. 2021 Jul, 76(7):e4, PMID: 33268456, pubmed.ncbi.nlm.nih.gov
Opracowanie
- Magdalena Karpiuk (recenzent)
- Sławomir Chlabicz (redaktor)
- Michael Handke (recenzent/redaktor)