Streszczenie
- Definicja: Udary mózgu to schorzenia naczyniowe mózgu, których wspólną cechą jest nagłe uszkodzenie tkanki mózgowej w wyniku okluzji naczynia krwionośnego lub krwotoku mózgowego; prowadzi do wystąpienia ogniskowych lub uogólnionych zaburzeń. Przemijający atak niedokrwienny (transient ischaemic attack – TIA) to określone zaburzenie czynności neurologicznej całkowicie odwracalne w ciągu 24 godzin.
- Epidemiologia: Na 100 000 osób przypada ok. 330 udarów rocznie.
- Objawy i badanie fizykalne: Wstępna ocena według algorytmu neurologicznego FAST: nietypowy wygląd twarzy (ang. Face - twarz), zmniejszenie siły ramienia (ang. Arm - ramię), trudności w mówieniu i rozumieniu mowy (ang. Speech - mowa). Jeśli występują powyższe objawy, należy natychmiast skierować pacjenta do szpitala (ang. Time - czas).
- Diagnostyka: Na oddziale udarowym wstępna tomografia komputerowa (TK) lub rezonans magnetyczny (RM) w celu wykluczenia lub wykrycia krwotoku i oceny obszaru niedokrwienia. W trakcie dalszej diagnostyki należy przeprowadzić badania wyjaśniające etiologię (EKG, echokardiografię, obrazowanie tętnic zaopatrujących mózg).
- Leczenie: W przypadku udaru niedokrwiennego tromboliza dożylna (możliwie w ciągu 4,5 godziny od wystąpienia objawów) i trombektomia mechaniczna (możliwie w ciągu 6 godzin). W zależności od wyników badań obrazowych metody te mogą być również skuteczne, gdy upłynie więcej czasu. Profilaktyka wtórna za pomocą leków, rehabilitacja.
Informacje ogólne
Definicja
- Udar mózgu: schorzenia naczyniowe mózgu, których wspólną cechą jest nagłe uszkodzenie tkanki mózgowej w wyniku okluzji naczynia krwionośnego lub krwotoku mózgowego, skutkujące wystąpieniem ogniskowych lub uogólnionych zaburzeń.
- Przemijający atak niedokrwienny (transient ischaemic attack – TIA) — określone zaburzenie czynności neurologicznej całkowicie odwracalne w ciągu 24 godzin.
- Definicja opiera się wyłącznie na wynikach badania przedmiotowego.
Epidemiologia
-
- Jedną z najczęstszych przyczyn zgonu, a w Polsce trzecią (po chorobach serca i nowotworach).
- Główną przyczyną niepełnosprawności.
- Istotnym kosztem w systemach opieki zdrowotnej.
- Zapadalność na świecie:
- Na 100 000 osób przypada około 330 udarów rocznie
- z czego około 240 to pierwszy epizod schorzenia
- około 90 to ponowny epizod.
- W ciągu ostatnich 15 lat częstość występowania udarów utrzymuje się na mniej więcej tym samym poziomie.
- Śmiertelność z powodu udaru w ciągu ostatnich 15 lat znacznie spadła – z 500 wśród kobiet i 600 wśród mężczyzn do 300 na 100 000 osób.
- Na 100 000 osób przypada około 330 udarów rocznie
- Zapadalność na udar w Polsce wynosi około 175 na 100 000 mężczyzn i 125 na 100 000 kobiet, na TIA 120 na 100 000 mężczyzn i 71 na 100 000 kobiet.1
- Z powodu udaru hospitalizowanych jest około 40 proc. pacjentów oddziałów neurologicznych.
- 50-60% pacjentów dociera do oddziału szpitalnego w pierwszych kilku godzinach od początku udaru.
- Według danych NFZ, w latach 2013–2018 wystąpił spadek liczby pacjentów hospitalizowanych z powodu udaru niedokrwiennego, co stoi w pewnej sprzeczności z danymi międzynarodowymi (możliwy skutek działań profilaktycznych).2
- Wiek
- Zapadalność rośnie z wiekiem, a od 65. roku życia schorzenie występuje częściej niż incydenty wieńcowe.
- Płeć
- Częstość występowania udaru w ciągu całego życia jest nieco wyższa u mężczyzn niż u kobiet.
- Status społeczno–ekonomiczny
- Zapadalność jest najwyższa w przypadku niskiego statusu społecznego i najniższa w przypadku wysokiego statusu społecznego.
- U kobiet odnotowuje się wyraźniejszy gradient społeczny.
- Zapadalność jest najwyższa w przypadku niskiego statusu społecznego i najniższa w przypadku wysokiego statusu społecznego.
- Koszty
Etiologia i patogeneza
Etiologia udaru niedokrwiennego (ok. 85%)
- Najczęstsze jest niedokrwienie spowodowane ograniczeniem dopływu krwi do mózgu przez tętnice – na podstawie kryteriów TOAST (Trial of ORG10172 in Acute Stroke Treatment) można dokonać następującej klasyfikacji etiologii5-6:
- Makroangiopatia (około 10%).
- Tętnica zewnątrzczaszkowa lub wewnątrzczaszkowa z niedrożnością ≥50% (np. zwężenie tętnicy szyjnej, zmiany miażdzycowe).
- Mikroangiopatia (około 25%).
- Zawały lakunarne/zatokowe w obrazowaniu mózgu (najczęściej następstwo nadciśnienia tętniczego).
- Zatorowość sercowa (około 25%).
- Migotanie lub trzepotanie przedsionków, skrzeplina wewnątrzsercowa, proteza zastawki serca, śluzak przedsionka.
- Inne przyczyny (około 10%).
- Np. rozwarstwienie, zapalenie naczyń, koagulopatie, skurcze naczyń.
- Nieznana etiologia („udar kryptogenny”) (około 30%).
- ESUS (Embolic Stroke of Undetermined Source – udar zatorowy o nieznanym źródle, około 15%), jest rozwinięciem koncepcji udaru kryptogennego.5
- Koncepcja ta opiera się na fakcie, że większość udarów kryptogennych prawdopodobnie spowodowana jest zatorami o nieznanym źródle i wymaga ujednoliconej, poszerzonej diagnostyki.5
- Makroangiopatia (około 10%).
- Niedokrwienie żylne jest znacznie rzadsze i spowodowane jest zakrzepicą żył lub zatok żylnych w mózgu.
Etiologia udaru krwotocznego (ok. 15%)
- Krwotok wewnątrzmózgowy.
- Krwotok podpajęczynówkowy.
Patogeneza
Udar
- Główną przyczyną udaru jest obniżenie przepływu krwi poniżej progu potrzebnego do utrzymania integralności funkcjonalnej komórek mózgu.7
- Niedostateczne ukrwienie uruchamia złożoną kaskadę szkodliwych mechanizmów biochemicznych, między innymi7-9:
- stan zapalny
- niedostateczną podaż energii
- kwasicę
- ekscytotoksyczność (uszkadzanie neuronów przez glutaminian i podobne związki)
- toksyczność wywołaną wolnymi rodnikami i cytokinami
- aktywację dopełniacza
- pogorszenie działania bariery krew–mózg
- infiltrację leukocytów.
- Ostatecznie mechanizmy te prowadzą do śmierci komórkowej.
TIA
- Rozumienie TIA w kontekście patogenetycznym (odwracalny deficyt neurologiczny z całkowitą regresją w ciągu 24 godzin) zmieniło się dzięki nowoczesnym badaniom obrazowym (RM).10
- Termin ten powinien być ograniczony do pacjentów, u których nie występują zmiany w RM.
- Przemijające objawy z widocznymi zmianami wiążą się ze zwiększonym ryzykiem wystąpienia udaru prowadzącego do trwałej niepełnosprawności.
- Problem z przemijającymi objawami neurologicznymi bez uwidocznionych zmian w obrazowaniu mózgu polega na tym, że może być wiele innych przyczyn schorzenia, które niekoniecznie muszą prowadzić do stosowania leków przez całe życie. Obraz odpowiadający udarowi może towarzyszyć na przykład migrenie (patrz także diagnostyka różnicowa). Sprawę komplikuje fakt, że sama migrena, a zwłaszcza leczenie jej tryptanami, może zwiększać ryzyko wystąpienia udarów.11
Czynniki predysponujące
- Istnieją niemodyfikowalne i modyfikowalne czynniki ryzyka udaru niedokrwiennego i krwotocznego.
Niemodyfikowalne czynniki ryzyka12
- Wiek
- Ryzyko wzrasta wraz z wiekiem.
- Płeć
- U młodych kobiet ryzyko jest nieco wyższe niż u mężczyzn, a u osób starszych ryzyko to jest nieco wyższe u mężczyzn niż u kobiet.
- Pochodzenie
- Zwiększone ryzyko, a jednocześnie mniejsze działanie ochronne beta–blokerów i inhibitorów konwertazy angiotensyny (angiotensin–converting enzyme inhibitors – ACEI), występuje u osób pochodzenia afrykańskiego.
- Czynniki genetyczne
- Ryzyko jest wyższe w przypadku dodatniego wywiadu rodzinnego.
Modyfikowalne czynniki ryzyka udaru niedokrwiennego
- W badaniu Interstroke zidentyfikowano 10 modyfikowalnych czynników ryzyka12-13:
- nadciśnienie tętnicze
- palenie tytoniu
- otyłość brzuszna – zwiększony stosunek obwodu talii do obwodu bioder
- niezdrowa dieta
- brak aktywności fizycznej
- cukrzyca
- zwiększone spożywanie alkoholu
- stres psychospołeczny i depresja
- przyczyny kardiologiczne
- stosunek apolipoproteiny B do apolipoproteiny A1, czyli LDL/HDL.
- Inhibitory owulacji zawierające estrogeny zwiększają ryzyko wystąpienia udaru.
Modyfikowalne czynniki ryzyka udaru krwotocznego
- Nadciśnienie tętnicze.
- Palenie tytoniu.
- Otyłość brzuszna: zwiększony stosunek obwodu talii do obwodu bioder.
- Zwiększone spożywanie alkoholu.
- Niezdrowa dieta.
ICD–10
- I61 Krwotok śródczaszkowy.
- I61.0 Krwotok mózgowy do półkul, podkorowy.
- I61.1 Krwotok mózgowy do półkul, korowy.
- I61.2 Krwotok mózgowy do półkul, nieokreślony.
- I61.3 Krwotok mózgowy do pnia mózgu.
- I61.4 Krwotok mózgowy do móżdżku.
- I61.5 Krwotok mózgowy wewnątrzkomorowy.
- I61.6 Krwotok mózgowy o mnogim umiejscowieniu.
- I61.8 Inne krwotoki mózgowe.
- I61.9 Krwotok mózgowy, nieokreślony.
- I63 Zawał mózgu.
- I63.0 Zawał mózgu spowodowany przez zakrzep tętnic przedmózgowych.
- I63.1 Zawał mózgu spowodowany przez zator tętnic przedmózgowych.
- I63.2 Zawał mózgu spowodowany przez nieokreśloną niedrożność lub zwężenie tętnic przedmózgowych.
- I63.3 Zawał mózgu spowodowany przez zakrzep tętnic mózgowych.
- I63.4 Zawał mózgu spowodowany przez zator tętnic mózgowych.
- I63.5 Zawał mózgu spowodowany przez nieokreśloną niedrożność lub zwężenie tętnic mózgowych.
- I63.6 Zawał mózgu spowodowany przez zakrzep żył mózgowych, nieropny.
- I63.8 Inny zawał mózgu.
- I63.9 Zawał mózgu, nieokreślony.
- I64 Udar mózgu, nieokreślony jako krwotoczny lub zawałowy.
- I69 Następstwa chorób naczyniowych mózgu.
- I69.0 Następstwa krwotoku podpajęczynówkowego.
- I69.1 Następstwa krwotoku śródmózgowego.
- I69.2 Następstwa innych nieurazowych krwotoków wewnątrzczaszkowych.
- I69.3 Następstwa zawału mózgu.
- I69.4 Następstwa udaru mózgu, nieokreślonego jako krwotoczny lub zawałowy.
- I69.8 Następstwa innych i nieokreślonych chorób naczyń mózgowych.
- G45 Przemijające napady niedokrwienia mózgu i zespoły pokrewne.
- G45.9 Przemijające napady niedokrwienia mózgu, nieokreślone.
- G46.3 Zespół udarowy pnia mózgu.
- G46.4 Zespół udarowy móżdżku.
Kryteria diagnostyczne
- Ostre objawy neurologiczne.
- Widoczne niedokrwienie/krwotok w obrazowaniu mózgu.
Diagnostyka różnicowa (naśladowanie udaru)
- Nawet w wysokospecjalistycznym ośrodku początkowe błędne rozpoznanie wynosi około 10%, a w ramach medycyny ratunkowej należy zakładać wyższe wskaźniki.14
- Istotne elementy schorzeń „naśladujących udar” to:
- Przyczyny mózgowe (trzy najczęstsze)
- atak padaczkowy (zwłaszcza zespół Todda = tymczasowe porażenie po napadzie padaczkowym)
- migrena z aurą
- zaburzenia czynnościowe/dysocjacyjne.
- Przyczyny mózgowe (inne)
- guzy mózgu i zmiany wewnątrzczaszkowe powodujące uciśnięcie i przemieszczenie (np. krwiak podtwardówkowy, ropień mózgu)
- stan zapalny
- omdlenia.
- Izolowane uszkodzenia nerwów czaszkowych
- obwodowe porażenia nerwu twarzowego
- westybulopatie.
- Przyczyny metaboliczne
- hipoglikemia, hiperglikemia
- zaburzenia elektrolitowe (np. hiponatremia).
- Pogorszenie ogólnego stanu fizycznego (zwłaszcza u osób starszych)
- niewystarczające spożycie płynów
- zakażenie, sepsa.
- Pseudoporażenia
- ortopedyczne ograniczenia ruchu (np. złamanie szyjki kości udowej, uszkodzenie stożka rotatorów).
- Encefalopatie
- nadciśnieniowa
- wątrobowa.
- Przyczyny mózgowe (trzy najczęstsze)
Diagnostyka i opieka przedkliniczna
- Udar/TIA to nagłe przypadki medyczne
- W razie jakichkolwiek podejrzeń należy niezwłocznie wezwać zespół ratownictwa medycznego.
- Każda inna próba zorganizowania pomocy medycznej prowadzi do opóźnień w leczeniu potencjalnie zagrażających zdrowiu i życiu.
Badanie wstępne
- Wstępne badanie przedmiotowe powinno być wykonane według schematu ABCDE:
- Airway (drożność dróg oddechowych)
- Breathing (ocena oddechu)
- Circulation (ocena krążenia i krwawień zewnętrznych)
- Disability (ocena stanu przytomności i prosta ocena neurologiczna)
- Exposure (badanie przedmiotowe po ekspozycji/odsłonięciu pacjenta).
- W razie potrzeby należy przeprowadzić działania ratujące życie zgodnie ze schematem ABC (patrz również podstawowe zabiegi resuscytacyjne, zaawansowane zabiegi resuscytacyjne).
- Dotyczy to jednak tylko nielicznych pacjentów z udarem.
- W innym przypadku kolejnym krokiem jest ocena stanu neurologicznego.
- W tym celu należy zastosować standaryzowany algorytm badania neurologicznego (np. FAST), który z dużą dozą pewności wykrywa deficyty neurologiczne i umożliwia przyjęcie do szpitala na odpowiedni oddział.
- Ocena FAST może być wykonywana przez pracowników ochrony zdrowia bez specjalizacji neurologicznej, jak również przez osoby niezwiązane zawodowo z medycyną.
FAST
- Face (ang. twarz)
- Poproś, by badana osoba się uśmiechnęła. Czy jeden kącik ust opada? Może to świadczyć o porażeniu mięśni twarzy/hemiparezie.
- Arm (ang. ramię)
- Poproś badaną osobę o wyciągnięcie ramion do przodu i jednoczesne odwrócenie dłoni ku górze.
- W przypadku porażenia nie można podnieść obu ramion – jedno ramię opada lub skręca się.
- Speech (ang. mowa)
- Poproś badaną osobę o powtórzenie prostego zdania.
- Jeśli nie jest w stanie tego zrobić lub jej głos brzmi niewyraźnie, prawdopodobnie mamy do czynienia z zaburzeniem mowy.
- Time (ang. czas)
- Jeżeli wystąpi co najmniej jeden z wyżej wymienionych objawów, należy niezwłocznie zadzwonić pod numer 112 („Czas to mózg”)!
- Osoby posiadające doświadczenie neurologiczne mogą wykorzystać skalę NIHSS (National Institutes of Health Stroke Scale) do bardziej wszechstronnej oceny klinicznej ciężkości udaru, choć zwykle stosuje się ją tylko w szpitalu.
- Za każde kryterium NIHSS przyznaje się od 0 do 4 punktów (łączny wynik 0–42 punktów) – im wyższy wynik, tym cięższy udar (kalkulator NIHSS).
- Uwaga: udarów niedokrwiennych i krwotocznych nie można różnicować na podstawie badania przedmiotowego.
- W trakcie kontaktu telefonicznego w przypadku podejrzenia udaru, pracownicy ochrony zdrowia powinni przeprowadzić ocenę według kryteriów FAST i w razie potrzeby natychmiast powiadomić personel ratunkowy.
Początkowa opieka
- Jeśli czas na to pozwala, należy (na wszelki wypadek) założyć wenflon/kaniulę dożylną. Zalety takiego postępowania:
- w razie potrzeby możliwość dożylnego podania leków
- możliwość pomiaru stężenia glukozy we krwi
- podawanie płynów w przypadku odwodnienia
- pobranie krwi do badań laboratoryjnych (w zależności od kroków podjętych przez personel ratunkowy).
- Hipoglikemia jest typowym przykładem stanu „naśladującego udar” i dlatego należy ją wykluczyć.
- Należy dokonać pomiaru glukozy we krwi, aby wykluczyć hipoglikemię.
- Przy niskim stężeniu cukru we krwi (poniżej 60 mg/dl; 3,3 mmol/l) należy podać dożylnie 20% roztwór glukozy (dawka początkowa - bolus 0,2–0,5g/kg m.c.) lub domięśniowo/podskórnie 1 mg glukagonu.
- Należy ostrożnie postępować w przypadku początkowo podwyższonego ciśnienia tętniczego, co ma miejsce często – zbyt szybkie jego obniżenie może nasilić niedokrwienie, a zbyt wysokie ciśnienie jest niekorzystne w przypadku krwawienia (rozróżnienie etiologii w badaniu przedmiotowym jest jednak niemożliwe).
- Nie udowodniono korzyści z rutynowego podawania tlenu. Tlen należy podać tylko wtedy, gdy saturacja wynosi poniżej 95%.
- Nie należy podawać leków przeciwzakrzepowych (heparyna) lub hamujących agregację płytek krwi (kwas acetylosalicylowy) przed przeprowadzeniem badań obrazowych w szpitalu, ponieważ w warunkach przedklinicznych nigdy nie można wykluczyć krwawienia.
- Należy udokumentować dane zebrane w wywiadzie, w tym początek objawów i ewentualne przeciwwskazania do leczenia trombolitycznego, a także udzieloną już pomoc. Trzeba również przygotować plan leczenia.
- Czas oczekiwania na karetkę powinien być wykorzystany na przekazanie podstawowych informacji pacjentom i opiekunom (np. pacjent nie powinien wstawać bez asysty, należy wstrzymać się od jedzenia i przyjmowania płynów) oraz, w razie potrzeby, na uspokojenie osób kontaktujących się z pracownikiem ochrony zdrowia.
Wskazania do skierowania do hospitalizacji lub ambulatoryjnych badań diagnostycznych
Ostry udar lub TIA w ciągu ostatnich 48 godzin16
- Pacjentów należy natychmiast leczyć na (pod)oddziale udarowym lub w ośrodku interwencyjnego leczenia udaru.
TIA >48 godzin i <14 dni
- Pacjenci wysokiego ryzyka powinni zostać przyjęci na oddział udarowy w następujących przypadkach:
- migotanie przedsionków w wywiadzie
- zwężenie tętnic doprowadzających krew do mózgu w wywiadzie
- inne wcześniejsze choroby układu krążenia
- wysoka punktacja w skali ABCD2 (≥4) – punktacja uwzględnia wiek, ciśnienie tętnicze, rodzaj objawów, czas trwania objawów oraz obecność cukrzycy.
Objawy >14 dni temu
- Z reguły wystarczają ambulatoryjne badania diagnostyczne, które należy przeprowadzić jak najszybciej w ciągu miesiąca od wystąpienia objawów.
- U pacjentów ambulatoryjnych, diagnostyka i profilaktyka wtórna nie różnią się od działań podjętych u pacjentów, którzy przebyli udar.
Przeciwwskazania do hospitalizacji
- Lekarze rodzinni mogą decydować się na terapię paliatywną, a nie hospitalizację, biorąc pod uwagę stosunek korzyści do ryzyka oraz życzenia pacjentów lub ich opiekunów.
- W takim przypadku następuje rezygnacja z usług służb ratunkowych i rozpoczęcie działań wspierających.
Diagnostyka i leczenie na oddziale udarowym
Koncepcja oddziału udarowego
- Oddziały udarowe to specjalistyczne placówki o integracyjnej koncepcji leczenia pacjentów z udarem w ostrej fazie.
- Koncepcja ta obejmuje wczesne rozpoznanie, przedszpitalne postępowanie w nagłych wypadkach, szybkie kierowanie do ośrodków posiadających takie oddziały, przyjęcie w trybie nagłym, natychmiastową diagnostykę neuroradiologiczną i za pomocą innych urządzeń, objęcie opieką na oddziale intensywnej terapii i wreszcie dalsze przeniesienie do oddziałów ogólnych, placówek rehabilitacyjnych lub opieki domowej.
- Leczenie zapewnia odpowiednio przygotowany, wielospecjalistyczny zespół pracowników medycznych (zespół
udarowy); niezbędny jest całodobowy i nieograniczony dostępu do badań neuroobrazowych (przynajmniej CT)
i diagnostyki laboratoryjnej. - W regionach wiejskich powinna mieć miejsce telekonsultacja – połączenie z izbą przyjęć szpitali regionalnych z oddziałami udarowymi (telestroke units).
Diagnostyka
Wstępne obrazowanie
- Na oddziale udarowym wykonuje się szybkie badania obrazowe metodą TK lub RM w celu odróżnienia niedokrwienia od krwotoku.
- Tomografia komputerowa (TK):
- Standard diagnostyczny – szeroko dostępne badanie o uniwersalnym zastosowaniu.
- Angiografia TK ze środkiem kontrastowym pozwala z dużą pewnością wykryć pozaczaszkowe i śródczaszkowe patologie naczyniowe.
- Informacje na temat perfuzji tkanek i rozróżnienie pomiędzy tkanką martwą (zawał), a otaczającą tkanką o niedostatecznej perfuzji (penumbra).
- Obrazowanie metodą rezonansu magnetycznego (RM):
- W porównaniu z TK większa czułość, umożliwiająca wiarygodne wykrywanie tkanki mózgowej objętej zawałem we wczesnej fazie udaru, możliwość oszacowania czasu dokonania zawału.
- Wady to większy wysiłek logistyczny, dłuższy czas badania i mniejsza dostępność.
Monitorowanie
- Pacjenci z ostrym udarem (TIA i zawał mózgu) powinni być monitorowani za pomocą odpowiedniej aparatury przynajmniej przez pierwsze 2–3 dni.
- Monitorowanie powinno obejmować co najmniej: ciśnienie krwi, częstość akcji serca, EKG, oddech, nasycenie krwi tlenem i temperaturę ciała.
Dodatkowa diagnostyka
- Monitorowanie EKG
- Powinno być prowadzone przez kilka dni (telemetria, ewentualnie EKG metodą Holtera w dalszym przebiegu), jeśli wykrycie migotania przedsionków lub innych arytmii ma konsekwencje dla dalszego leczenia.
- Wizualizacja pozaczaszkowych i śródczaszkowych naczyń zaopatrujących mózg w krew:
- Jak najwcześniej (w ciągu 24–48 godzin) należy przeprowadzić nieinwazyjną diagnostykę naczyń pozaczaszkowych i śródczaszkowych.
- W zależności od dostępności i wiedzy fachowej, można rozważyć następujące metody:
- Ultrasonografia dopplerowska.
- Angiografia TK.
- Angiografia RM.
- Echokardiografia (przezklatkowa, przezprzełykowa)
- Należy wykonać przezklatkowe badanie echokardiograficzne (transthoracic echocardiography – TTE) w celu ustalenia etiologii, jeśli nie udało się jej wyjaśnić na podstawie wstępnej diagnostyki (np. migotanie przedsionków lub zwężenie tętnicy szyjnej dużego stopnia).
- Jeśli po rutynowej diagnostyce (obrazowanie mózgu, wizualizacja naczyń pozaczaszkowych i śródczaszkowych, EKG, EKG metodą Holtera i TTE) etiologia jest niejasna, należy wykonać echokardiografię przezprzełykową (transesophageal echocardiography – TEE) w ramach dodatkowego postępowania.
Leczenie ostrego udaru niedokrwiennego
- Celem interwencji terapeutycznej przy niedokrwiennym udarze mózgu jest przywrócenie odpowiedniej perfuzji i uratowanie tkanki penumbry (strefy półcienia – obszaru pomiędzy już martwą a otaczającą ją, wciąż żywą tkanką mózgową).
- Zakres penumbry można w przybliżeniu oszacować za pomocą TK lub RM („niedopasowanie” pomiędzy obszarem zaburzeń dyfuzji a perfuzji – DWI/PWI mismatch; obszar mózgu zagrożony progresją udaru, możliwe korzyści z przywrócenia krążenia).
Rekanalizacja – tromboliza
- Tromboliza dożylna jest standardem leczenia udaru niedokrwiennego w oknie czasowym do 4,5 godziny.
- Jeśli leczenie można rozpocząć w ciągu 3 godzin, prawdopodobieństwo dobrych efektów dodatkowo wzrasta.
- Wraz z wydłużaniem się okna czasowego, stosunek korzyści do ryzyka krwawienia maleje.
- Ryzyko krwawienia wywołanego trombolizą wynosi 3–7%.
- Niemniej jednak tromboliza może być przydatna również później, jeśli badania obrazowe wskazują na obecność dużego obszaru penumbry:
- w oknie czasowym 4,5–9 godzin
- przy nieznanym początku objawów (udar typu wake–up).
- Wskazania do trombolizy zależą od stopnia zaawansowania klinicznego:
- Trombolizę należy wykonać, jeśli występują objawy udaru grożące niepełnosprawnością.
- Jeśli objawy są łagodne i nie grożą niepełnosprawnością, tromboliza może nie być konieczna.
- Nie stosuje się leczenia trombolitycznego jeśli objawy całkowicie ustąpiły (TIA).
- U pacjentów z udarem niedokrwiennym, u których można zastosować leczenie w ciągu 4,5 godziny od wystąpienia objawów i u których nie ma przeciwwskazań, należy przeprowadzić dożylną trombolizę z zastosowaniem alteplazy.
- Trombolizę dożylną w 4,5-godzinnym oknie czasowym u dorosłych pacjentów należy wykonać niezależnie od wieku.
- U pacjentów z udarem niedokrwiennym w oknie czasowym od 4,5 do 9 godzin (o znanym początku lub od połowy snu przy nieznanym czasie trwania objawów) i niezgodnością pomiędzy rdzeniem zawału a penumbrą w TK lub RM, należy zastosować dożylną trombolizę z zastosowaniem alteplazy.
- Główne przeciwwskazania do leczenia trombolitycznego: krwawienie wewnątrzczaszkowe w wywiadzie, objawy krwotoku podpajęczynówkowego, stwierdzone inne aktywne krwawienie, nie poddające sie leczeniu ciśnienie skurczowe ≥185 mmHg lub rozkurczowe ≥110 mmHg, ostre zaburzenia krzepnięcia (np. podanie heparyny w ciągu ostatnich 48 godz., liczba płytek ≤100 000/µl, leczenie przeciwkrzepliwe z INR ≥1,7), leczenie NOAC z przyjęciem ostatniej dawki <48h i brakiem leku neutralizującego, glikemia ≤50 mg/dl (2,7 mmol/l), rozległy (>1/3 półkuli mózgu) zawał w obrazie TK.
Rekanalizacja – leczenie wewnątrznaczyniowe
- Wewnątrznaczyniowe leczenie udaru za pomocą mechanicznej trombektomii jest metodą znaną od dawna. Z biegiem czasu zeszła ona na dalszy plan, ale obecnie jest integralną częścią leczenia ze względu na korzystne wyniki badań.17-20
- Trombektomia jest wykonywana jako uzupełnienie rozpoczętej wcześniej trombolizy dożylnej.
- Często w przypadku okluzji dużych naczyń (dystalna tętnica szyjna i główny pień tętnicy środkowej mózgu) spowodowanych dużymi skrzeplinami, występuje brak wystarczającej odpowiedzi na trombolizę dożylną.
- Skrzepliny przebija się za pomocą cewnika (stent retriever, stent mózgowy), a następnie zostają one uwięzione za pomocą rozprężającej się siateczki.
- Pacjenci z udarem niedokrwiennym, klinicznie istotnym deficytem neurologicznym i okluzją głównej tętnicy w krążeniu przednim, powinni być poddani mechanicznej trombektomii, możliwie w ciągu 6 godzin, w celu poprawy wyników czynnościowych.
- Poza 6–godzinnym oknem czasowym, należy wykonać trombektomię mechaniczną odpowiednich okluzji w krążeniu przednim, jeśli zaawansowane badania obrazowe (np. wizualizacja małego rdzenia zawału, „niedopasowanie”) w kontekście objawów klinicznych sugerują, że uratowanie tkanki z wysokim ryzykiem martwicy jest możliwe.
- Pacjenci, którzy kwalifikują się do leczenia wewnątrznaczyniowego udaru i nie mają przeciwwskazań do trombolizy dożylnej, powinni również jak najwcześniej otrzymać alteplazę, przy czym żadna z metod leczenia nie może opóźniać drugiej.
- Główne przeciwwskazania do tromebektomii: brak niedrożności/krytycznego zwężenia dużego pnia tętniczego (brak wskazań), występowanie/duże ryzyko krwawienia wewnątrzczaszkowego lub systemowego, koagulopatie, INR >3,0, małopłytkowość <40 000/ul, nie poddające się leczeniu ciśnienie tętnicze skurczowe >185 mmHg i/lub rozkurczowe >110 mmHg, nieznany czas wystąpienia objawów.
Leczenie ostrego udaru krwotocznego
Krwotok wewnątrzczaszkowy
- Zasadniczo obniżenie ciśnienia skurczowego krwi do wartości około 140 mmHg, a nawet niższych, zmniejsza rozległość krwawienia i częstość krwawień wtórnych.
- Ponieważ w warunkach przedklinicznych nie można odróżnić niedokrwienia od krwotoku, tolerowana wartość wynosi około 160 mmHg.
- W zależności od przebiegu choroby, w ramach hospitalizacji mogą być wymagane:
- Założenie zewnętrznego systemu drenażu płynu mózgowo–rdzeniowego.
- Mikrochirurgiczne usunięcie krwiaka.
- Intensywna terapia mająca na celu ochronę neurologiczną i obniżenie ciśnienia w mózgu.
Krwotok podpajęczynówkowy (subarachnoid hemorrhage – SAH)
- SAH w 85% przypadków jest spowodowany pęknięciem tętniaka i eliminuje się go za pomocą wprowadzenia cewnika (embolizacja) lub metodą operacyjną (zaklipsowanie).
- Dalsze działania w ramach intensywnej terapii to leczenie ograniczające skurcz naczyń lub obniżające ciśnienie śródczaszkowe, a także założenie drenażu płynu mózgowo–rdzeniowego.
Dalsze kroki w ostrej fazie
Fizjoterapia
- Wszyscy pacjenci po udarze powinni rozpocząć mobilizację (aktywność poza łóżkiem) w ciągu 48 godzin od wystąpienia udaru:
- Czas trwania 30–60 min dziennie, przez 5–7 dni w tygodniu.
Ergoterapia
- Poprzez wczesną, ukierunkowaną ergoterapię (terapia przez pracę, wykonywanie czynności), należy jak najwcześniej korygować między innymi np. deficyty pracy kończyn górnych, w tym drobne zaburzenia motoryki ręki.
Logopedia
- Zalecana jest wczesna ocena logopedyczna w celu wykrycia i leczenia zaburzeń mowy.
- Nie ma dowodów na poprawę w zakresie afazji lub dyzartrii.
Profilaktyka wtórna
Leczenie przeciwzakrzepowe
Leki hamujące agregację płytek krwi
- Wczesna profilaktyka wtórna rozpoczyna się już w ostrej fazie w postaci hamowania agregacji płytek krwi.
- Podstawą jest stosowanie kwasu acetylosalicylowego 100 mg na dobę lub klopidogrelu 75 mg na dobę w monoterapii.
- Podwójną terapię przeciwpłytkową (dual antiplatelet therapy – DAPT) łączącą kwas acetylosalicylowy i klopidogrel, należy proponować do 3 tygodni po udarze niedokrwiennym.21
- 3–tygodniową terapię DAPT należy rozumieć jako przedłużone leczenie stanu ostrego, u pacjentów z dużym ryzykiem wczesnego nawrotu udaru (zmiany miażdżycowe w dużych naczyniach)– w przypadku ogólnego zalecenia podwójnej terapii istnieją dowody wskazujące na to, że ryzyko wynikające z krwawienia wyraźnie przewyższa korzyści.
- U pacjentów ze zwiększonym ryzykiem krwawienia pozaczaszkowego lub śródczaszkowego, nie należy stosować DAPT w ramach wczesnej profilaktyki wtórnej udaru.
- Lekarze pierwszego kontaktu odgrywają ważną rolę w zakończeniu stosowania podwójnej terapii i przejściu na monoterapię.
- Pacjentom należy zaproponować kwas acetylosalicylowy 75-150 mg na dobę (klopidogrel 75 mg na dobę tylko w przypadku rzeczywistej nietolerancji), a decyzja o przyjmowaniu leków zależy od indywidualnej sytuacji klinicznej i tolerancji; .
- Nie ma też ogólnych zaleceń dotyczących przedłużenia leczenia lub zmiany terapii przeciwzakrzepowej w przypadkach powtórnego udaru podczas leczenia.
- Ocena skuteczności leków hamujących agregację płytek krwi za pomocą badania czynności płytek krwi nie jest zalecana.
- Należy unikać jednoczesnego stosowania IPP u pacjentów bez problemów ze strony układu pokarmowego.
- Aby uniknąć ewentualnych działań niepożądanych wynikających z ciągłego stosowania IPP, można zamiast nich zastosować famotydynę – bloker H2.
- W przypadku jednoczesnego stosowania leków z grupy NLPZ i ASA, należy wziąć pod uwagę, że skuteczność kwasu acetylosalicylowego może być wówczas zmniejszona: przyjmowanie leków z grupy NLPZ należy rozłożyć w czasie, z reguły podając je co najmniej 30 min po przyjęciu kwasu acetylosalicylowego.
- Czas rozpoczęcia przyjmowania leków hamujących agregację płytek krwi
- Nie należy rozpoczynać leczenia, dopóki nie zostanie wykluczony krwotok wewnątrzczaszkowy.
- Jak najwcześniej po udarze niedokrwiennym lub TIA, nawet jeśli przyczyna niedokrwienia nie została jeszcze ustalona.
Doustne leki przeciwzakrzepowe
- W przypadku udaru kardiogennego, należy omówić z pacjentem stosowanie doustnych leków przeciwzakrzepowych zamiast terapii hamującej agregację płytek krwi – może to zapobiec 2/3 nawrotów choroby.
- Szczegóły dotyczące terapii z zastosowaniem antagonistów witaminy K (vitamin K antagonists – VKA) lub doustnych leków przeciwkrzepliwych niebędących antagonistami witaminy K (non–vitamin K antagonist oral anticoagulants – NOAC), znajdują się w artykule Leki przeciwzakrzepowe.
- Pacjentom powyżej 18. roku życia z udarem niedokrwiennym lub TIA i stałym, przetrwałym lub napadowym migotaniem przedsionków, należy, o ile nie występują przeciwwskazania (w tym stwierdzony w TK rozległy obrzęk oraz wtórne ukrwotocznienie), zaproponować stałe przyjmowanie leków przeciwzakrzepowych w postaci VKA (acenokumarol, warfaryna) lub NOAC. Terapię rozpocząć niezwłocznie w TIA, w udarze po kilku dniach od jego wystąpienia (udar lekki – po 3–5 dniach, udar umiarkowany – po 5–7 dniach, udar ciężki – po 14 dniach). Decyzja o wyborze grupy substancji podejmowana jest wspólnie z pacjentem po ocenie chorób współistniejących, stosowanych leków i jego preferencji.
- Starszy wiek nie jest przeciwwskazaniem do stosowania doustnych leków przeciwzakrzepowych u pacjentów z migotaniem przedsionków po udarze niedokrwiennym lub TIA. Osłabienie i ryzyko upadku również nie są przeciwwskazaniem.
- Stosowanie doustnych leków przeciwzakrzepowych u pacjentów z migotaniem przedsionków i zaburzeniami poznawczymi lub otępieniem jest uzasadnione, o ile będą one przyjmowane regularnie, a stan pacjenta będzie monitorowany.
VKA a NOAC
- Terapia VKA może być korzystna szczególnie w przypadku pacjentów w bardzo podeszłym wieku, z wieloma chorobami współistniejącymi, niewydolnością nerek i stosujących wiele innych leków (nie wykazano takiej skuteczności w badaniach rejestracyjnych dotyczących NOAC).
- W przypadku terapii przeciwzakrzepowej w postaci VKA należy dążyć do docelowej wartości INR mieszczącej się w przedziale 2,0–3,0.
- Dawkowanie NOAC powinno ściśle odpowiadać zaleceniom producenta, aby uniknąć przyjmowania zaniżonych dawek, co ma często miejsce.
- Co najmniej raz w roku powinna być przeprowadzana kontrola czynności nerek, a w sytuacjach zaburzeń ich funkcji – częściej.
- Badania prowadzone w warunkach rzeczywistej praktyki klinicznej (Real World Evidence – RWE) nie wykazały przewagi NOAC nad VKA, a w zapobieganiu zdarzeniom zatorowym przewagę ma raczej terapia VKA. W przypadku NOAC nieco rzadziej występowały krwotoki mózgowe.
- NOAC nie należy stosować, jeśli:
- U pacjentów dobrze funkcjonuje leczenie przeciwzakrzepowe za pomocą VKA (odsetek czasu leczenia, TTR >70%).
- Występuje niepewność co do przestrzegania zaleceń – znacznie krótszy okres półtrwania NOAC oznacza mniejszą tolerancję błędu w przyjmowaniu leku niż w przypadku długo działającej warfaryny.
- Występuje wysokie ryzyko krwawienia z przewodu pokarmowego.
- Występują ciężkie zaburzenia czynności nerek (eGFR poniżej 30 ml/min).
- Pacjent jest po wymianie zastawki serca lub występuje u niego istotne zwężenie zastawki mitralnej.
- W ciąży, karmieniu piersi i u młodszych dzieci.
- Wskazaniem do stosowania NOAC mogą być:
- Szczególne interakcje VKA z lekami i żywnością.
- Szczególne przeciwwskazanie do stosowania VKA (np. ciężka niewydolność wątroby).
- Duże wahanie wartości INR przy przyjmowaniu VKA, pomimo prawidłowego przestrzegania schematu leczenia.
- Wysokie ryzyko krwotoku śródmózgowego.
- Świeżo rozpoznane migotanie przedsionków wymagające kontroli rytmu lub ablacji.
Dalsza farmakoterapia
Lipidy
- Prowadzonego przed udarem leczenia statynami nie powinno się przerywać w ostrej fazie choroby; jeśli poziom lipidów był dobrze kontrolowany nie należy zmieniać terapii.
- Pacjentom po udarze należy zlecić profilaktykę wtórną z zastosowaniem statyn. Należy ich poinformować o efekcie ochronnym statyn – w największym badaniu w tym zakresie bezwzględna redukcja ponownego udaru w ciągu 4,9 roku wyniosła 2,2%, bez istotnego wpływu na śmiertelność.22
- Sposób prowadzenia leczenia statynami jest od pewnego czasu przedmiotem kontrowersi oraz dyskusji, niemniej polskie wytyczne jednoznacznie wskazują na korzyści i konieczność ich stosowania.23
Nadciśnienie tętnicze
- Pacjenci z nadciśnieniem tętniczym po udarze, powinni przyjmować na stałe leki obniżające ciśnienie tętnicze krwi.
- Ciśnienie krwi należy obniżyć do wartości poniżej 140/90 mmHg, a następnie powoli poniżej 130/80 mmHg, pod warunkiem dobrej tolerancji; u starszych pacjentów mniej intensywnie.15
- Dalsze obniżanie ciśnienia krwi nie przynosi zwykle żadnych korzyści – należy unikać wartości poniżej 120/70 mmHg.
- Jeśli to możliwe, leczenie powinno polegać na stosowaniu tiazydopodobnego leku moczopędnego – chlortalidonu24 lub indapamidu lub blokera receptora AT1 angiotensyny II (sartan) lub inhibitora konwertazy angiotensyny (angiotensin converting enzyme inhibitor – ACEI).
- Szczególnie u pacjentów w podeszłym wieku z wielochorobowością, dobór leków obniżających ciśnienie musi przebiegać z uwzględnieniem tych chorób oraz możliwych interakcji przyjmowanych leków.
- Do podstawowych połączeń dwulekowych należą15:
- ACEI + dihydropirydynowy antagonista wapnia
- ACEI + diuretyk tiazydopodobny/tiazydowy
- sartan + diuretyk tiazydopodobny/tiazydowy
- sartan + dihydropirydynowy antagonista wapnia.
- Czas rozpoczęcia leczenia
- Przyjmowanie leków obniżających ciśnienie można rozpocząć w pierwszych dniach po wystąpieniu objawów udaru.
Cukrzyca
- Pacjentom z cukrzycą i po udarze należy udzielić odpowiednich wskazówek, zgodnie z obowiązującymi wytycznymi.
- U pacjentów w zaawansowanym wieku, z czasem przeżycia krótszym niż 10 lat oraz po przebytym udarze mózgu - mniej restrykcyjne kryteria wyrównania glikemii, tj. HbA1c 8,0–8,5%.
Terapia hormonalna
- Po udarze należy przerwać trwającą terapię hormonalną.
- Kobietom w okresie postmenopauzy, które chcą rozpocząć zastępczą terapię hormonalną lub kontynuować ją w celu złagodzenia objawów menopauzy, należy przedstawić stosunek ryzyka do korzyści, biorąc pod uwagę ich życzenia i preferencje.
Diagnostyka i leczenie zespołu obturacyjnego bezdechu sennego (obstructive sleep apnea syndrome – OSAS)
- Po udarze lub TIA, przy podejrzeniu OSAS, pacjenta należy skierować do specjalisty w celu dalszej diagnostyki i zaproponowania możliwości leczenia.
- Przy OSAS należy unikać spożywania alkoholu wieczorem oraz stosowania leków nasennych i uspokajających, a w razie potrzeby należy podjąć próbę redukcji masy ciała.
- Metoda wspomagania oddychania w leczeniu bezdechu sennego (continuous positive airway pressure – CPAP) i aparat wysuwający żuchwę są metodami pierwszego wyboru.
Środki interwencyjne/chirurgiczne
Zwężenia tętnic pozaczaszkowe i śródczaszkowe
- Diagnostyka i leczenie zwężeń pozaczaszkowych znajduje się w artykule zwężenie tętnicy szyjnej.
- Pacjenci ze zwężeniami śródczaszkowymi na ogół przyjmują leki hamujące agregację płytek krwi, a w przypadku nawracających objawów lub nawrotowych udarów mózgu w indywidualnych przypadkach można rozważyć implantację stentu.
Przetrwały otwór owalny (patent foramen ovale – PFO)
- Pacjentom poniżej 60. roku życia z PFO i brakiem możliwości wyjaśnienia alternatywnej etiologii niedokrwienia mózgu mimo przeprowadzonej wielokierunkowej diagnostyki, należy zaproponować interwencyjne zamknięcie otworu, jeśli występuje co najmniej umiarkowany przeciek i prawdopodobieństwo przemieszczenia materiału zatorowego lub tętniak przegrody międzyprzedsionkowej.
Zmiana stylu życia
- Mimo, że istnieje niewiele dowodów na skuteczność zmian stylu życia w profilaktyce wtórnej w porównaniu do profilaktyki pierwotnej, można przyjąć, że są one równie ważne.
Dieta i używki
- Dieta powinna być zróżnicowana i zgodna z zaleceniami dla diety śródziemnomorskiej
- dużej ilości owoców, warzyw, oliwy z oliwek, produktów pełnoziarnistych, ryb
- ograniczenie spożycia czerwonego mięsa i słodyczy.
- W razie potrzeby, lekarze rodzinni i inni lekarze POZ powinni zalecać częstsze poradnictwo dietetyczne w postaci udziału w odpowiednich zajęciach (jeśli dostępne).
- Sól:
- należy ograniczyć spożycie soli, zwłaszcza w przypadku nadciśnienia tętniczego.
- Alkohol:
- należy ograniczyć spożywanie alkoholu.
- Palenie:
- należy zaprzestać palenia papierosów.
Suplementy żywieniowe
- Zasadniczo nie powinno się zalecać suplementacji preparatami witaminowymi lub zawierającymi przeciwutleniacze.
Aktywność fizyczna
- Pacjentów należy zachęcać do regularnej aktywności fizycznej w oparciu o indywidualne możliwości i preferencje.
- Pacjenci, którzy mają ograniczoną zdolność do aktywności fizycznej, powinni wykonywać ćwiczenia z bezpieczną dla nich intensywnością i minimalizować czas spędzony w pozycji siedzącej.
Nadwaga/otyłość
- Lekarze rodzinni powinni wspierać pacjentów w redukcji masy ciała poprzez rozmowy na ten temat.
- Poradnictwo należy zindywidualizować, powinno ono być praktyczne i zorientowane na cel oraz wyraźnie uwzględniać czynniki psychospołeczne.
Rehabilitacja w ramach opieki lekarza rodzinnego
- Ogólne zasady rehabilitacji w szpitalu i poza nim – patrz także udar, rehabilitacja.
- Po leczeniu stanu ostrego (faza A) następuje wczesna rehabilitacja (faza B) i dalsza rehabilitacja neurologiczna (faza C), które odbywają się w warunkach szpitalnych, ale leczenie uzupełniające może odbywać się zarówno w ramach hospitalizacji, jak i w warunkach ambulatoryjnych.
- W ciągu 3 miesięcy po zabiegach rehabilitacyjnych można rozważyć dalsze skierowanie pacjenta do Poradni Rehabilitacyjnej.
- Lekarze rodzinni/POZ opiekują się pacjentami we wszystkich fazach po udarze, ponieważ nie każdy pacjent podlega hospitalizacji, a tylko część z nich korzysta z rehabilitacji.
Cele i planowanie
- Sukces zależy również od tego, w jakim stopniu pacjenci współdecydują o celu rehabilitacji. Cele powinny być zatem opracowane wspólnie z pacjentem, z uwzględnieniem składowych takich jak zaangażowanie i aktywność pacjenta oraz możliwości jego organizmu.
- Pacjentów należy wspierać w określaniu ich osobistych celów terapii.
- Cele te powinny być wyrażone w taki sposób, by można je było ocenić i określić w czasie. Należy je także zapisać.
- Pacjenci, ich środowisko społeczne i zespół rehabilitacyjny, powinni mieć bieżącą wiedzę na temat wyznaczonych celów rehabilitacyjnych.
- Cele powinny być regularnie weryfikowane i w razie potrzeby korygowane.
- Decyzja o wyborze i zaleceniu oraz przeprowadzeniu rehabilitacji powinna być podjęta na podstawie ustandaryzowanych procedur oceny.
- W przypadku opieki ambulatoryjnej, podmioty prowadzące rehabilitację powinny przeprowadzać standardowe oceny i udostępniać ich wyniki lekarzom rodzinnym w formie raportu.
- Lekarze rodzinni mogą przeprowadzić powszechną i nieskomplikowaną ocenę w skali Barthel, która jednak tylko w niewielkim stopniu rejestruje czynności złożone.
Obszary opieki
- W ramach opieki ambulatoryjnej koordynację leczenia przejmuje zwykle lekarz rodzinny/POZ, a w planowanie i realizację powinny być zaangażowane różne grupy zawodowe.
Elementy terapii
- Elementy terapii obejmują ergoterapię, terapię fizykalną (fizjoterapię) oraz terapię głosową, języka i mowy (logopedię).
Zapewnienie pomocy
- Ma na celu przywrócenie zaangażowania w życie codzienne i aktywności pacjenta na możliwie wysokim poziomie.
Opieka pielęgniarska
- Istnieją różne świadczenia ubezpieczeniowe w zakresie opieki zdrowotnej i pielęgniarskiej, które pozwalają uniknąć luk w opiece nad pacjentami z udarem wymagającymi wsparcia oraz które stanowią pomoc dla opiekunów.
- Jeśli to możliwe, przed powrotem pacjenta do środowiska domowego, należy wyjaśnić, czy potrzebuje on pomocy w postaci specjalnego sprzętu, zmian w przestrzeni lub innego wsparcia.
Neuropsychologia
- W przypadku konieczności diagnostyki i wsparcia psychologicznego, pacjenta należy skierować do poradni specjalistycznej.
Terapia zaburzeń rezydualnych po udarze
Układ mięśniowo–szkieletowy
- Pacjentom z niedowładem po udarze należy zaproponować:
- Środki poprawiające siłę mięśni oraz aktywność kończyn.
- Dodatkowo rozważyć ze specjalistą rehabilitacji możliwość przeprowadzenia zabiegów elektrycznej stymulacji mięśni.
- Trening chodu należy zaproponować w przypadku zaburzeń poruszania się i chodzenia.
- Nie należy rutynowo zakładać ortezy ręki i nadgarstka w przypadku niedowładu kończyny górnej (brak reakcji na ból, ograniczenie funkcji kończyny i zakres ruchu).
- W przypadku zaburzenia czynności układu orofacjalnego (ustno–twarzowego) należy rozważyć działania mające na celu poprawę funkcji motorycznej mięśni mimicznych.
- W przypadku spastyczności należy zaproponować fizjoterapię i trening siłowy. Dodatkowo można uzupełnić je: doustnymi lekami przeciwspastycznymi, takimi jak baklofen, tyzanidyna lub diazepam (spastyczność uogólniona) oraz realizowanymi przez specjalistów: stymulacją elektryczną, miejscowym domięśniowym wstrzyknięciem toksyny botulinowej (spastyczność ogniskowa), domięśniowym podaniem baklofenu (spastyczność wieloogniskowa).
- W przypadku zaburzeń kontroli postawy lub zaburzeń równowagi, należy zaproponować środki poprawiające równowagę, wytrzymałość i siłę mięśni.
- Jeśli ryzyko upadków jest wysokie, należy przeprowadzić ocenę ryzyka upadków w środowisku domowym i doradzić, jak wyeliminować źródła zagrożenia.
Wrażenie bliskiego omdlenia
- Główne zalecenia to fizjoterapia (tzw. trening kompensacji zawrotów głowy) oraz fizjoterapia z wykorzystaniem urządzeń (szczególnie trening na bieżni).
Zaburzenia mowy i języka, dysfagia
- Przy afazji i dysartrii należy zaproponować terapię mowy – logopeda.
- W przypadku dysfagii należy zaproponować terapię zaburzeń przełykania.
Zaburzenia percepcji
- Można zalecić określony trening praktyczny w celu poprawy percepcji przestrzennej z włączeniem codziennych aktywności.
- W przypadku deficytów pola widzenia można zaproponować trening kompensacyjny.
- Należy zbadać pacjenta pod kątem zespołu zaniedbywania połowiczego (niemożność przetwarzania lub reagowania na bodźce pojawiające się w określonej połowie pola widzenia) i zaproponować specjalistyczne postępowanie fizjoterapeutyczne oraz trening funkcjonalny.
- Należy zaproponować środki poprawiające wrażliwość (np. stymulację sensoryczną, trening sensomotoryczny, itp.).
Bóle
- Należy zaproponować działania fizjoterapeutyczne w celu zmniejszenia bólu.
- W przypadku bólu przewlekłego należy zaproponować leczenie interdyscyplinarne (wsparcie lekarskie, fizjoterapia, ergoterapia, psychoterapia, wsparcie pielęgniarskie) i rozważyć skierowanie do Poradni Leczenia Bólu.
- W przypadkach łagodnego lub umiarkowanego osłabienia ramienia lub ręki, można zastosować terapię lustrzaną jako uzupełnienie w celu poprawy czynności kończyny.
- Pacjentom po udarze z bólem neuropatycznym należy początkowo zaproponować amitryptylinę, duloksetynę, gabapentynę lub pregabalinę.
- W przypadku niewystarczającego złagodzenia bólu należy sięgnąć po inny lek przeciwbólowy z zaleceń podstawowych.
- Pacjenci powinni być instruowani w zakresie ruchu, zmiany postawy oraz optymalnych pozycji ruchowych i ułożenia ciała w spoczynku.
- Opcje w przypadku bólu barku po udarze lub w zespołach bólu regionalnego:
- Stosowanie szyn, ortez lub taśm, terapia ułożeniowa, stymulacja elektryczna, wstrzykiwanie toksyny botulinowej lub środka znieczulającego miejscowo, doustne NLPZ lub glikokortykosteroidy.
- Nadwrażliwość na ból (CPSP – Central Post–Stroke Pain, ang. ośrodkowy ból po udarze):
- Można podjąć próbę leczenia z zastosowaniem amitryptyliny i lamotryginy.
- Pregabalinę, gabapentynę, karbamazepinę lub fenytoinę można rozważyć jako terapie drugiego wyboru.
Funkcje poznawcze
- W przypadku zaburzeń uwagi należy, z uwzględnieniem istniejących możliwości, zaproponować trening funkcjonalny na podstawie diagnostyki neuropsychologicznej, ewentualnie uzupełniony o inne działania, takie jak terapia poznawczo-behawioralna, trening ruchowy, zajęcia rekreacyjne.
- W przypadku zaburzeń pamięci, na podstawie diagnostyki neuropsychologicznej należy zaproponować trening funkcjonalny oparty na ćwiczeniach; w przypadku ciężkich zaburzeń pamięci należy zaproponować stymulację wielozmysłową lub trening fizyczny.
- Aby poprawić umiejętności rozwiązywania problemów i pamięć roboczą, należy zaproponować trening praktyczny.
- Procedury ćwiczeń poznawczych powinny być połączone z metodami zarządzania zachowaniami.
Zaburzenia lękowe/depresyjne/afektywne
- Po udarze należy zaproponować regularną ocenę dotyczącą stanów lękowych i depresji.
- Pacjenci po udarze z objawami emocjonalnymi (lęk, depresja) mogą odnieść korzyści z leczenia lekami przeciwdepresyjnymi, ale nie należy ich rutynowo proponować.
- W przypadku depresji lub zaburzeń lękowych można zaproponować i skierować na psychoterapię.
Nietrzymanie moczu i kału
- U wszystkich pacjentów należy określić, czy występuje u nich nietrzymanie moczu i kału. W tym celu należy zaoferować następujące postępowanie diagnostyczne i w razie potrzeby terapeutyczne:
- Strukturalną ocenę nietrzymania moczu (np. International Consultation on Incontinence Questionnaire - ICIQ), badanie ultrasonograficzne dróg moczowych z oznaczeniem zalegającego moczu, ogólne badanie moczu.
- W celu zmniejszenia epizodów nietrzymania moczu należy zalecić trening fizyczny i w razie potrzeby redukcję masy ciała.
- Opcje postępowania w przypadku nietrzymania moczu: ćwiczenia pęcherza i dna miednicy, ewentualnie leki przeciwcholinergiczne (po wykluczeniu zalegania moczu).
- Opcje postępowania w przypadku wysiłkowego nietrzymania moczu: ćwiczenia dna miednicy, duloksetyna, zastosowanie pessarium (krążek wkładany do pochwy).
- Leczenie farmakologiczne nietrzymania kału może obejmować stosowanie loperamidu (lub fosforanu kodeiny w przypadku nietolerancji).
Seksualność
- W przypadku występowania dysfunkcji seksualnych, lekarze rodzinni powinni zaproponować specjalistyczne poradnictwo i wyjaśnić możliwe przyczyny.
Ograniczona samowystarczalność
- Pacjentom będącym w środowisku domowym, z ograniczeniami w wykonywaniu osobistych czynności życia codziennego i upośledzeniem zręczności, należy zaproponować, z uwzględnieniem istniejących możliwości, trening i terapię zajęciową w zakresie codziennego funkcjonowania.
Udział w życiu społecznym
- Pacjenci i ich krewni powinni być informowani o: wsparciu finansowym i państwowych świadczeniach opiekuńczych, usługach poradnictwa psychospołecznego i społeczno-prawnego, a także o grupach samopomocowych; należy wesprzeć pacjentów wystawiając odpowiednie skierowania oraz udzielić wsparcia przy składaniu wniosków.
Przebieg, powikłania i rokowanie
Powikłania
- Informacje o powikłaniach i ich leczeniu można znaleźć w artykule rehabilitacja po udarze.
Przebieg i rokowanie
- Ryzyko zgonu z powodu udaru spadło w krajach rozwiniętych prawie o połowę, a wskaźniki przeżycia wynoszą:
- 93% po 30 dniach
- 75–93% po 1 roku
- 55% po 5 latach.
- Rokowanie w przypadku udarów krwotocznych jest gorsze niż w przypadku udarów niedokrwiennych.
- Wśród udarów niedokrwiennych najgorsze rokowanie mają udary sercowo–zatorowe.
- 35% osób dotkniętych tym schorzeniem jest w pierwszych miesiącach uzależnionych od opieki pielęgniarskiej.
- U 40–50% pacjentów występuje przewlekła, umiarkowana (np. mogą chodzić, ale potrzebują pomocy w codziennym życiu) lub ciężka niepełnosprawność.
- Czynniki predykcyjne dobrego wyniku leczenia to:
- przyjęcie do oddziału udarowego
- krótki czas między wystąpieniem objawów a rozpoczęciem leczenia
- młody wiek
- mały obszar udaru
- dobry stan we wczesnym okresie po udarze (sprawność mowy, siła w rękach, zdolność chodzenia)
- przestrzeganie schematu leczenia
- samodzielność przed udarem
- aktywność zawodowa
- pomoc ze strony członków rodziny.
- Nie należy lekceważyć znaczenia motywacji: im bardziej aktywny udział pacjenta w leczeniu i im większy wysiłek, tym większe postępy.
Dalsze postępowanie
- Elementy składowe opieki:
- ocena przebiegu neurologicznego, neuropsychologicznego i psychologicznego
- kontrola czynników ryzyka
- dostosowanie terapii nielekowej (styl życia) i lekowej, ocena przestrzegania schematu leczenia
- rejestrowanie zapotrzebowania na środki pomocnicze, rehabilitację, opiekę, a w razie potrzeby odpowiednie wsparcie.
Zdolność do prowadzenia pojazdów
- Zaleca się sprawdzenie zdolności do prowadzenia pojazdów już w placówce rehabilitacyjnej, w ramach szczegółowej oceny neuropsychologicznej z udokumentowaniem w karcie informacyjnej.
- W przypadkach wątpliwych wskazane jest badanie zdolności do prowadzenia pojazdów przez neuropsychologa (ocena kontroli emocjonalnej, zdolności rozeznania w otoczeniu i zmian osobowościowych spowodowanych chorobą).
- Ograniczenia lub utrata czynności kończyn z powodu zaburzeń ośrodkowego lub obwodowego układu nerwowego wymagają oceny neurologicznej lub badania potwierdzającego zdolność do prowadzenia pojazdów.
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Ilustracje
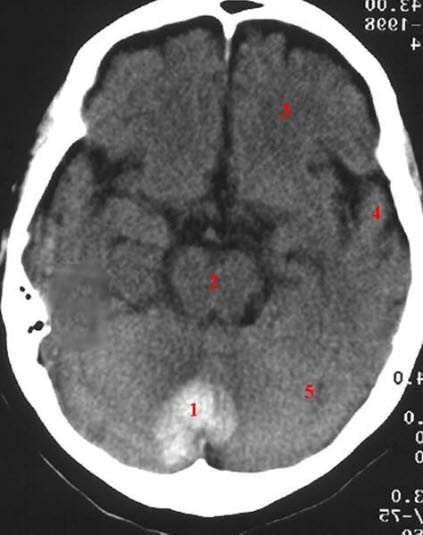
Krwiak w móżdżku, TK
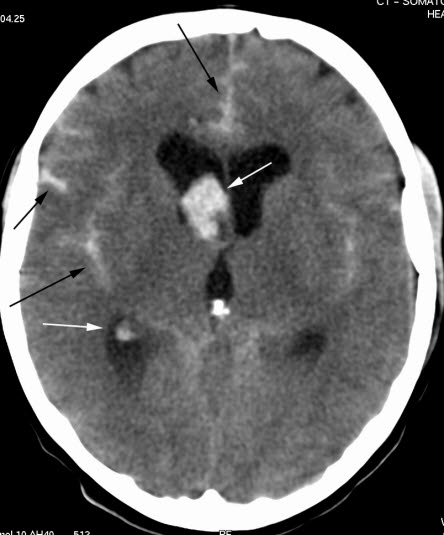
Krwotok podpajęczynówkowy (TK)
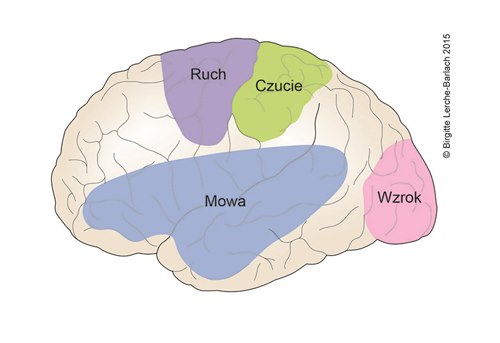
Anatomia mózgu - czynnościowa
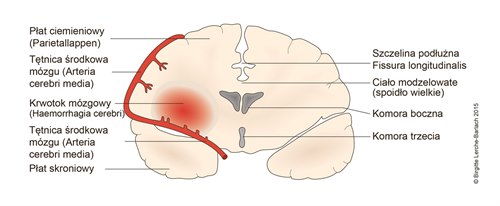
Krwotok mózgowy
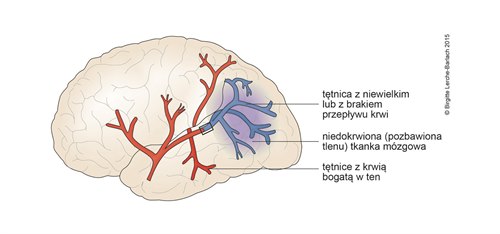
Udar
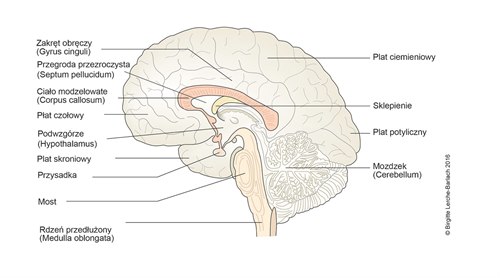
Anatomia mózgu - przekrój podłużny przyśrodkowy
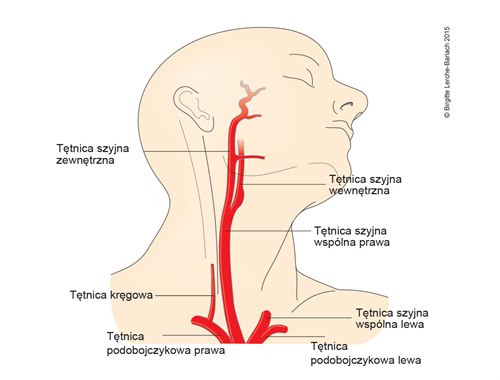
Tętnica szyjna i kręgowa
Źródła
Wytyczne
- Fonseca A.C., Merwick A., Dennis M., et al. Wytyczne European Stroke Organisation dotyczące postępowania w przypadkach przemijającego napadu niedokrwienia mózgu. Tłumaczenie wybranych fragmentów artykułu: European Stroke Organisation (ESO) guidelines on management of transient ischaemic attack. https://www.mp.pl/neurologia/wytyczne/287255,wytyczne-european-stroke-organisation-dotyczace-postepowania-w-przypadkach-przemijajacego-napadu-niedokrwienia-mozgu (dostęp 30.12.2024)
- Błażejewska-Hyżorek B., Czernuszenko A., Członkowska A., et al. Wytyczne postępowania w udarze mózgu. Polski Przeglad Neurologiczny 2019, Suplement A (15): A1-A155.
Piśmiennictwo
- Litwin T., Członkowska A. Udary mózgu – wprowadzenie, podyplomie.pl, dostęp 12.12.2023.
- Centrala Narodowego Funduszu Zdrowia. NFZ o zdrowiu. Udar niedokrwienny mózgu, ezdrowie.gov.pl, dostęp 12.12.2023.
- Kolominsky-Rabas P.L., Heuschmann P.U., Marschall D. et al. Lifetime cost of ischemic stroke in Germany: results and national projections from a population-based stroke registry: the Erlangen Stroke Project. Stroke 2006, 37: 1179-83, www.ncbi.nlm.nih.gov
- Luengo-Fernandez R., Violato M., Candio P., et al. Economic burden of stroke across Europe: A population–based cost analysis. Eur Stroke J 2020, 5: 17-25. doi:10.1177/2396987319883160, DOI
- Diener H.C., Grond M. Embolic Stroke of Undetermined Source. Cardiovasc 2018, 18: 38-40, doi:10.1007/s15027-018-1405-0, DOI
- Adams H. Jr, Bendixen B., Kappelle L., et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke 1993, 24: 35-41, pubmed.ncbi.nlm.nih.gov
- Hossmann K. Pathophysiological basis of translational stroke research. Folia Neuropathol 2009, 47: 213-27. www.termedia.pl
- Heiss W. The Pathophysiology of Ischemic Stroke Studied by Radionuclide Imaging. J Neurol Neuromedicine 2016,; 1: 22-8, www.jneurology.com
- Kuriakose D., Xiao Z.. Pathophysiology and Treatment of Stroke: Present Status and Future Perspectives. Int J Mol Sci 2020, 21: 7609. doi:10.3390/ijms21207609, DOI
- Easton J., Albers G., Caplan L, et al. Discussion: Reconsideration of TIA terminology and definitions. Neurology. 2004, 62: 29-34, pubmed.ncbi.nlm.nih.gov
- Gudmundsson L., Scher A., Aspelund T et al. Migraine with aura and risk of cardiovascular and all cause mortality in men and women: prospective cohort study, BMJ 2010, 341:c3966, www.bmj.com
- Boehme A., Esenwa C., Elkind M. Stroke Risk Factors, Genetics, and Prevention. Circ Res 2017, 120: 472-95, doi:10.1161/CIRCRESAHA.116.308398, DOI
- O'Donnell M.J., Xavier D., Liu L., et al. Risk factors for ischaemic and intracerebral haemorrhagic stroke in 22 countries (the INTERSTROKE study): a case control study. Lancet 2010, 376: 112-23, pubmed.ncbi.nlm.nih.gov.
- Lakatos L., Christ M., Müller M., et al. „Stroke mimics“ – Differenzialdiagnose des Schlaganfalls in der Notfallmedizin, Notfall Rettungsmed 2021, 24: 990-6, doi:10.1007/s10049-021-00877-x, DOI
- Tykarski A., Filipiak K.J., Januszewicz A et al. Zasady postępowania w nadciśnieniu tętniczym – 2019 rok. Wytyczne Polskiego Towarzystwa Nadciśnienia Tętniczego. Nadciśnienie Tętnicze w Praktyce 2019, 1(5): 1-86.
- Stroke Unit Trialists' Collaboration. Organised inpatient (stroke unit) care for stroke. Cochrane Database Syst Rev., wrzesień 2013, 11;9:CD000197, pubmed.ncbi.nlm.nih.gov
- Berkhemer O.A., Fransen P.S.S., van den Berg L.A., et al. A randomized trial of intraarterial treatment for acute ischemic stroke, N Engl J Med 2014, doi:10.1056/NEJMoa1411587, DOI
- Goyal M., Demchuk A.M., Menon B.K., et al for the ESCAPE Trial Investigators. Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med 2015, doi:10.1056/NEJMoa1414905, DOI
- Campbell B.C.V., Mitchell P.J., Kleinig T.J., et al for the EXTEND-IA Investigators. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl J Med 2015, doi:10.1056/NEJMoa1414792, DOI
- Jovin T.G., Chamorro A., Cobo E., et al. Thrombectomy within 8 Hours after Symptom Onset in Ischemic Stroke. N Engl J Med 2015, doi:DOI: 10.1056/NEJMoa1503780, DOI
- Ge F., Lin H., Liu Y. et al. Dual antiplatelet therapy after stroke or transient ischaemic attack – how long to treat? The duration of aspirin plus clopidogrel in stroke or transient ischaemic attack: a systematic review and meta-analysis Eur J Neurol. 2016, 23: 1051-7, pubmed.ncbi.nlm.nih.gov
- Amarenco P., Bogousslawsky J., Callahan A., et al. The Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) Investigators. N Engl J Med 2006, 549:59, www.nejm.org
- Banach M., Burchardt P., Chlebus K., et al. Wytyczne TpL/KLRWP/PTK/PTDL/PTD/PTNT diagnostyki i leczenia zaburzeń lipidowych w Polsce 2021, Nadciśnienie Tętnicze w Praktyce 2021, 7: 113-222, www.nadcisnienietetnicze.pl
- Furberg C., Wright J., Davis B. et al for the ALLHAT officers. Major outcomes in high-risk hypertensive patients randomized to angiotensin–converting enzyme inhibitor or calcium channel blocker vs diuretic. JAMA 2002, 288: 2981-97, pubmed.ncbi.nlm.nih.gov
Opracowanie
- Tomasz Tomasik (redaktor)
- Adam Windak (redaktor)
- Michael Handke (recenzent/redaktor)
