Streszczenie
- Definicja: 3 lub więcej następujących po sobie pobudzeń dodatkowych, powstających poniżej rozwidlenia pęczka Hisa, o częstości akcji komór ≥100/min. Częstoskurcz komorowy (ventricular tachycardia – VT) trwający ≥30 s określa się jako utrwalony VT. Jeśli zespoły QRS są zawsze tak samo ukształtowane, jest to monomorficzny VT (jednokształtny); jeśli kształt zespołu QRS się zmienia, jest to polimorficzny VT (wielokształtny).
- Epidemiologia: Zwiększenie częstości występowania VT wyzwalanego niedokrwieniem wraz z wiekiem, jest równoległy do zwiększenia częstości występowania choroby wieńcowej. Idiopatyczny VT może wystąpić w każdym wieku.
- Objawy: Kołatanie serca, zawroty głowy, omdlenia, duszność i ból w klatce piersiowej.
- Badanie fizykalne: Tachykardia, ewentualnie niedociśnienie/wstrząs.
- Diagnostyka: Rozpoznanie przy użyciu 12–odprowadzeniowego EKG.
- Leczenie: W przypadku istotnego hemodynamicznie VT – natychmiastowa kardiowersja elektryczna (KWE); w przypadku tolerowanego hemodynamicznie VT – również przerwanie farmakologiczne. Leczenie choroby podstawowej. W przypadku zwiększonego ryzyka nagłego zgonu sercowego (NZS) implantacja wszczepialnego kardiowertera–defibrylatora (implantable cardioverter–defibrillator – ICD) ma znaczenie dla rokowania. Terapia farmakologiczna i ablacja cewnikowa są skuteczne objawowo poprzez zmniejszenie częstości występowania VT.
Informacje ogólne
Definicja
- Arytmia serca z 3 lub więcej następującymi po sobie pobudzeniami o częstotliwości ≥100/min., wywodzącymi się z komór, niezależnymi od przewodzenia w przedsionku i łączu przedsionkowo–komorowym.
- Zakres częstości często od 100–220/min.
- Podział na podstawie czasu trwania VT
- Nieutrwalony (non–sustained) VT: czas trwania do 30 sekund
- Krótki VT (do około 10 pobudzeń) jest często określany również jako „salwa pobudzeń komorowych”.
- Utrwalony (sustained) VT: czas trwania ≥30 sekund.
- Nieutrwalony (non–sustained) VT: czas trwania do 30 sekund
- Podział na podstawie morfologii zespołów QRS
- monomorficzny VT (jednokształtny): taki sam kształt zespołów QRS w trakcie trwania częstoskurczu
- polimorficzny VT (wielokształtny): zmienny kształt zespołów QRS.
Epidemiologia
- Dane dotyczące częstości występowania częstoskurczu komorowego są nieliczne.
- Zwiększenie częstości występowania VT wyzwalanego niedokrwieniem wraz z wiekiem pokrywa się ze zwiększeniem częstości występowania choroby wieńcowej.
- Idiopatyczny VT może wystąpić w każdym wieku.
- Występuje częściej u mężczyzn niż u kobiet, ze względu na większą częstość występowania choroby wieńcowej.
- Utrwalony VT jest najczęstszą przyczyną nagłego zgonu sercowego (około 80% przypadków).1
- Zgon sercowy z powodu przekształcenia VT do migotania komór i zatrzymania krążenia.
- U 5–10% pacjentów z ostrym zawałem mięśnia sercowego trwały VT/migotanie komór występują przedszpitalnie, u kolejnych 5% – w ciągu 48 godzin po przyjęciu do szpitala.2
- Nagły zgon sercowy stanowi około 25% zgonów z powodu chorób sercowo–naczyniowych.3
- Nieutrwalny częstoskurcz komorowy jest stosunkowo częstym zjawiskiem zarówno w prawidłowym sercu, jak i sercu zmienionym strukturalnie.4
Etiologia i patogeneza
- Choroba niedokrwienna serca (najczęstsza przyczyna).
- Inne strukturalne choroby serca (zobacz także kardiomiopatie)
- kardiomiopatia rozstrzeniowa
- kardiomiopatia przerostowa
- arytmogenna kardiomiopatia prawej komory
- naciekowe choroby serca, takie jak sarkoidoza
- wrodzona wada serca
- po operacji wrodzonej wady serca VT może rozwinąć się w okresie pooperacyjnym.
- Kanałopatie wrodzone
- Idiopatyczny częstoskurcz komorowy przy strukturalnie prawidłowym sercu
- Częstoskurcz z drogi odpływu: częściej z drogi odpływu prawej komory (right ventricular outflow tract – RVOT), rzadziej z drogi odpływu lewej komory (left ventricular outflow tract – LVOT).
- Częstoskurcz wiązkowy.
- Leki
- Np. leki przeciwarytmiczne klasy III, leki psychotropowe, zatrucie naparstnicą i wiele innych (internetowy katalog leków potencjalnie wydłużających QT).
- Zaburzenia elektrolitowe
- Np. hipokaliemia.
- Środki psychoaktywne
- Np. kokaina.
Czynniki predysponujące
- Zawał serca lub niedokrwienie mięśnia sercowego.
- Kardiomiopatie, niewydolność serca.
- Zaburzenia elektrolitowe.
ICD–10
- I47.2 Częstoskurcz komorowy.
Diagnostyka
Kryteria diagnostyczne
- Rozpoznanie ustala się za pomocą 12–odprowadzeniowego EKG (patrz także EKG, lista kontrolna, EKG, podstawy):
- częstość akcji komór >100/min.
- ≥3 kolejne pobudzenia
- poszerzone zespoły QRS o pochodzeniu komorowym.
- Sam poszerzony zespół QRS nie jest dowodem na komorowe pochodzenie pobudzenia; w diagnostyce różnicowej należy uwzględnić inne częstoskurcze o szerokim zespole (zobacz niżej).
- Różnicowanie częstoskurczów o szerokim zespole jest często trudne.
Wyniki EKG sugerujące częstoskurcz komorowy1
- Rozkojarzenie AV (pobudzenia komór i przedsionków są niezależne od siebie)
- Jednak załamki P są często trudne lub niemożliwe do wykrycia.
- Pobudzenia zsumowane (fusion beats) i pobudzenia przechwycone (capture beats)
- Pobudzenie zsumowane (fusion beat)
- połączenie wąskiego, powstałego z pobudzenia w węźle zatokowym zespołu QRS z szerokim, wyzwalanym w komorze zespołem QRS
- występowanie zwłaszcza przy wolnym VT.
- Pobudzenie przechwycone (capture beat)
- przewiedzione pobudzenie zatokowe z wąskim zespołem QRS podczas VT
- występowanie zwłaszcza przy wolnym VT.
- Pobudzenie zsumowane (fusion beat)
- Znacznie poszerzone zespoły QRS
- Czas trwania w typie bloku lewej odnogi pęczka Hisa: >160 ms.
- Czas trwania w typie bloku prawej odnogi pęczka Hisa: >140 ms.
- Początkowy załamek R w odprowadzeniu aVR („oś północno–zachodnia”).
- Zgodność wychylenia
- Zgodność wychylenia zespołu QRS we wszystkich odprowadzeniach przedsercowych.
- Morfologia zespołu QRS bloku lewej odnogi pęczka Hisa z odchyleniem osi w prawo.
- Brak zespołu QRS we wszystkich odprowadzeniach przedsercowych, występuje jednakowy kierunek jednofazowych (typu QS lub R) zespołów QRS.
- Pomocna w rozpoznaniu VT może być systematyczna analiza z zastosowaniem algorytmów diagnostycznych (kryteria Brugadów8, algorytm aVR9).
Diagnostyka różnicowa częstoskurczu z szerokimi zespołami QRS
- Częstoskurcze z szerokimi zespołami QRS można podzielić na 3 grupy:10
- I. Częstoskurcz komorowy
- II. Częstoskurcz nadkomorowy (supraventricular tachycardia – SVT) z poszerzeniem zespołu QRS z powodu nieprawidłowego przewodzenia lub bloku odnogi
- Bloki prawej lub lewej odnogi pęczka Hisa występują mniej więcej tak samo często1(zobacz również blok prawej i lewej odnogi pęczka Hisa).
- Częstoskurcz nadkomorowy z poszerzeniem zespołu QRS spowodowanym przewodzeniem przez dodatkowy pęczek (zobacz również zespół WPW).
Wywiad lekarski
- Oprócz EKG najważniejszym sposobem odróżnienia SVT od VT jest wywiad lekarski!
- U pacjentów po zawale mięśnia sercowego lub z niewydolnością serca prawdopodobieństwo wystąpienia VT wynosi 95%.
- Aktualny wywiad lekarski
- kołatanie serca (nagły początek, nagły koniec)
- dławica piersiowa
- duszność
- obniżona tolerancja wysiłku
- zawroty głowy, omdlenia (zwłaszcza podczas wysiłku fizycznego).
- Wcześniejsze występowanie w wywiadzie
- choroba wieńcowa, stan po zawale mięśnia sercowego
- kardiomiopatia
- niewydolność serca
- znany zespół WPW w EKG/zespół WPW
- choroby predysponujące do wystąpienia zaburzeń elektrolitowych
- nadużywanie alkoholu
- przyjmowanie narkotyków
- leki (np. diuretyki, leki przeciwarytmiczne, naparstnica, itp.)
- nagły zgon sercowy w wywiadzie rodzinnym.
Badanie fizykalne
- Tętno: tachykardia.
- Ciśnienie tętnicze: ewentualnie niedociśnienie
- Ocena hemodynamiczna nie jest wiarygodnym kryterium odróżnienia VT od SVT; w poszczególnych przypadkach VT może być tolerowany dobrze, a SVT źle.
- Ewentualnie tachypnoe, osłuchowo objawy obrzęku płuc.
- Ewentualnie objawy zmniejszonej perfuzji: bladość, zimne poty, sinica.
- Objawy rozkojarzenia AV
- zmiana głośności pierwszego tonu serca
- przerywana, wyraźna pulsacja tętna żyły szyjnej („wystrzały armatnie”) spowodowana skurczem przedsionków przy zamkniętej zastawce trójdzielnej.
Badania uzupełniające w praktyce lekarza rodzinnego
EKG
- U wszystkich pacjentów w celu rozpoznania komorowych zaburzeń rytmu jest zalecane spoczynkowe 12–odprowadzeniowe EKG.3
- Jeśli to możliwe, należy również ocenić EKG w rytmie zatokowym.
- Blizna po zawale.
- Inne oznaki uszkodzeń strukturalnych (poszerzenie zespołu QRS, zmiany końcowego odcinka ST–T, cechy przerostu, oznaki kardiomiopatii (np. arytmogenna kardiomiopatia prawej komory (arrhythmogenic right ventricular cardiomyopathy – ARVC), kardiomiopatia przerostowa).
- Istniejący wcześniej blok odnogi pęczka Hisa.
- Zespół długiego QT.
- Częstoskurcz komorowy
- Częstotliwość (częstotliwość komór 100–220/min.).
- Monomorficzny/polimorficzny.
- Nieutrwalony (30 s).
- W typie bloku prawej odnogi pęczka Hisa (pochodzący z lewej komory serca) lub typie bloku lewej odnogi pęczka Hisa (pochodzący z prawej komory serca).
- Czy kryteria EKG przemawiają za VT (zobacz sekcja kryteria diagnostyczne)?
- Trzepotanie komór
- Monomorficzne zespoły QRS w kształcie spinki do włosów.
- Częstotliwość 200–300/min.
- Torsade de pointes
- Zespoły QRS zmieniają kierunek wychylenia największych załamków wobec linii izoelektrycznej.
- Częstotliwość w większości przypadków >200/min.
- Migotanie komór
- Poszczególne zespoły QRS są słabo zarysowane, jedynie nieznacznie odbiegają od linii izoelektrycznej.
- Częstotliwość 250–400/min.
Diagnostyka specjalistyczna
Próba wysiłkowa EKG
- Objawy niedokrwienia.
- Wyzwolenie VT zależnego od obciążenia.
- Próba wysiłkowa jest zalecana u pacjentów z co najmniej umiarkowanym ryzykiem choroby wieńcowej powodującym niedokrwienie lub komorowe zaburzenia rytmu.3
- Próba wysiłkowa jest zalecana u pacjentów z podejrzeniem arytmii komorowej (w tym polimorficznym katocholaminergicznym częstoskurczem komorowym).
EKG metodą Holtera (Holter EKG)
- Do wykrywania i rozpoznawania arytmii jest zalecane ambulatoryjne monitorowanie EKG.3
- W przypadku epizodów występujących codziennie lub kilka razy w tygodniu przydatne jest EKG 24– lub 72–godzinne.
Badania krwi
- Szybkie oznaczenie troponiny przy podejrzeniu ostrego zespołu wieńcowego.
- D–dimery przy podejrzeniu zatorowości płucnej.
- BNP/NT–proBNP przy podejrzeniu niewydolności serca.
- Stężenie leku (np. digoksyny).
Monitorowanie ambulatoryjne
- W przypadku rzadszych epizodów przydatna jest rejestracja za pomocą zewnętrznych lub implantowanych rejestratorów zdarzeń.3,11
Echokardiografia
- Echokardiografia jest zalecana w celu określenia funkcji lewej komory i wykrycia strukturalnej choroby serca u wszystkich pacjentów ze znaną lub podejrzewaną arytmią komorową.3
- Wymiary serca:
- ocena globalnej i miejscowej funkcji lewej i prawej komory
- oznaki kardiomiopatii (kardiomiopatia rozstrzeniowa, kardiomiopatia przerostowa, ARVC)
- czynność zastawek.
- Echokardiografia wysiłkowa (lub scyntygrafia mięśnia sercowego) jest zalecana do wykrywania niemego niedokrwienia u pacjentów z pośrednim ryzykiem choroby wieńcowej i mniej jednoznaczną próbą wysiłkową EKG (przerost lewej komory, obniżenie odcinka ST w spoczynku, blok lewej odnogi pęczka Hisa).
Obrazowanie metodą rezonansu magnetycznego serca (RM)
- Należy rozważyć RM lub TK, jeśli echokardiografia nie daje wystarczających informacji.3
- Badanie służy jako uzupełnienie echokardiografii.
- Dostarcza informacji o strukturze mięśnia sercowego (blizny? nacieki tłuszczowe przy ARVC?).
TK serca
- Opcja, gdy echokardiografia jest niewystarczająca, a RM nie jest dostępny.
Koronarografia
- Koronarografia powinna być rozważona u pacjentów z zagrażającym życiu VT lub przeżytym, nagłym zatrzymaniem krążenia z co najmniej średnim ryzykiem choroby wieńcowej.3
- Potwierdzenie lub wykluczenie istotnej choroby wieńcowej jako przyczyny ciężkich arytmii komorowych.
Badanie elektrofizjologiczne
- Badanie elektrofizjologiczne jest zalecane u pacjentów z chorobą wieńcową, którzy niedawno przebyli zawał mięśnia sercowego i mają objawy sugerujące tachyarytmię, w tym kołatanie serca, stany przedomdleniowe oraz omdlenia:3
- w celu udokumentowania możliwości wywołania częstoskurczu komorowego
- w celu stratyfikacji ryzyka VT
- na potrzeby diagnostyki omdleń
- w celu określenia wskazań do terapii ICD.
- Wartość diagnostyczna jest najwyższa u pacjentów ze strukturalną chorobą serca (np. choroba wieńcowa z dysfunkcją lewej komory).3
- U pacjentów bez strukturalnej choroby serca i bez nieprawidłowego EKG dodatkowe korzyści diagnostyczne są niewielkie.3
Wskazania do skierowania do specjalisty
- Pacjenci z potwierdzonym lub klinicznym podejrzeniem częstoskurczu komorowego.
Leczenie
Cele leczenia
- Poprawa rokowania.
- Złagodzenie objawów.
Ogólne informacje o leczeniu
- Podstawą każdej terapii jest optymalne leczenie choroby podstawowej.3
- W miarę możliwości należy unikać ostrego pogorszenia i postępu choroby podstawowej.3
- Terapia podstawowa jest uzupełniana indywidualnie o:
- środki farmakologiczne
- zastosowanie urządzeń (ICD lub ICD–CRT)
- działania interwencyjne.
Doraźne leczenie utrwalonego częstoskurczu komorowego
- Leczenie zależy od stabilności hemodynamicznej i co do zasady jest prowadzone w warunkach szpitalnych.
- W przypadku niestabilności hemodynamicznej należy szybko wykonać kardiowersję elektryczną.11
- Tolerowany hemodynamicznie VT można również poddać kardiowersji elektrycznej lub leczyć farmakologicznie.
- Można stosować następujące leki:
- amiodaron (200–400 mg dożylnie)
- ajmalina (1 mg/kg m.c. dożylnie) – lek obecnie niedostępny w Polsce.
- Można stosować następujące leki:
- Pacjenci powinni być leczeni na oddziałach z możliwością wykonania natychmiastowej koronarografii.
- Jeśli VT prowadzi do migotania komór – resuscytacja (zaawansowane zabiegi resuscytacyjne, Advanced Life Support – ALS).
- U pacjentów z utrwalonym VT i niestabilnych hemodynamicznie zalecana jest kardiowersja elektryczna.3,11
- U pacjentów z utrwalonym VT i stabilnych hemodynamicznie, bez strukturalnej choroby serca, można rozważyć dożylne podanie:3
- amiodaronu
- flekainidu
- beta–-blokerów
- preferowane w VT z drogi odpływu prawej komory11
- werapamilu (w Polsce niedostępny preparat dożylny)
- preferowany w VT pęczkowym.11
Burza elektryczna
- Definicja
- ≥3 epizody VT w ciągu 24 godzin.
- Stan niestabilności elektrycznej serca z licznymi epizodami VT i/lub migotania komór.
- Najczęściej na podłożu strukturalnej choroby serca.
- U niestabilnych hemodynamicznie pacjentów kardiowersja elektryczna.
- Leczenie farmakologiczne beta–blokerami (najlepiej niekardioselektywnymi), często w połączeniu z amiodaronem.11
- Sedacja (np. za pomocą benzodiazepin) jest przydatna w celu zmniejszenia stymulacji adrenergicznej i ograniczenia stresu psychicznego.11
- W opornych przypadkach należy również rozważyć znieczulenie.
- W przypadku niedokrwienia należy dążyć do szybkiej rewaskularyzacji.
- W pojedynczych przypadkach próba interwencyjnej ablacji cewnikowej ogniska.
Dalsze leczenie częstoskurczu komorowego
Farmakoterapia
- Korzyści prognostyczne wykazano jedynie w przypadku beta–blokerów.
- Beta–blokery zmniejszają częstość występowania komorowych zaburzeń rytmu serca i ryzyka nagłego zgonu sercowego w szerokim zakresie schorzeń kardiologicznych zarówno bez i przy niewydolności serca.3
- W badaniach randomizowanych nie wykazano korzyści prognostycznych leków przeciwarytmicznych.3
- Stosowanie leków przeciwarytmicznych przede wszystkim w celu redukcji epizodów VT i tym samym poprawy objawów
- Uwaga: leki przeciwarytmiczne mogą mieć również działanie proarytmiczne!
- Leki przeciwarytmiczne:
- amiodaron
- flekainid
- meksyletyna (niedostępna w Polsce, ew. w procedurze importu docelowego)
- propafenon
- chinidyna (niedostępna w Polsce)
- sotalol
- beta–blokery
- werapamil
- ajmalina (tylko dożylnie) – niedostępna w Polsce.
Terapia przy użyciu ICD (Kardiowerter-defibrylator; implantable cardioverter-defibrillator)
- Skuteczna terapia u pacjentów ze zwiększonym ryzykiem nagłego zgonu sercowego.3
- ICD jest zalecany u pacjentów z udokumentowanym migotaniem komór lub niestabilnym hemodynamicznie VT bez odwracalnej przyczyny i przy optymalnej terapii lekowej.3
- Implantację ICD należy rozważyć u pacjentów z nawracającym trwałym VT bez odwracalnej przyczyny przy optymalnej terapii farmakologicznej.3
- Każdorazowo należy rozważyć stosunek korzyści do ryzyka powikłań – 12–letnie ryzyko:3
- nieadekwatnych wyładowań: 20%
- zakażeń: 6%
- usterki elektrody: 17%.
- Przy określaniu wskazania należy uwzględniać wiek pacjentów, ale nie ma ogólnej, górnej granicy wieku.
- Implantacja ICD może być również konieczna u dzieci i młodzieży z zagrażającymi życiu arytmiami.
- Konieczne jest tu szczególnie uważne rozważenie stosunku ryzyka do korzyści; 2 najczęstsze powikłania to nieadekwatne wyładowania i problemy z elektrodami związane ze wzrostem/aktywnością.
- W przypadku dorosłych pacjentów z wrodzonymi wadami serca (adult congenital heart disease – ACHD) obowiązują te same kryteria wskazań co w przypadku dzieci z wrodzonymi wadami serca.
- Przy towarzyszącej niewydolności serca z obniżoną funkcją skurczową lewej komory ewentualnie połączenie z terapią resynchronizującą serca (implantable cardioverter–defibrillator, cardiac resynchronization therapy – ICD–CRT).
Terapia interwencyjna
- Podniesienie rangi ablacji cewnikowej VT w nowych wytycznych3
- Pilna ablacja z użyciem cewnika jest zalecana u pacjentów z bliznami w mięśniu sercowym i trwałym VT lub burzą elektryczną.
- Ablacja z użyciem cewnika jest zalecana u pacjentów z chorobą niedokrwienną serca i powtarzającymi się wyładowaniami ICD z powodu trwałego częstoskurczu.
- Ablację z użyciem cewnika należy rozważyć po pierwszym epizodzie trwałego VT u pacjentów z chorobą niedokrwienną serca i ICD.
- Wysoki odsetek braku nawrotów po ablacji serca z użyciem cewnika, szczególnie u pacjentów z VT po zawale mięśnia sercowego
- Również redukcja częstości epizodów z burzą elektryczną.
- Przy kardiomiopatii niedokrwiennej odsetek pacjentów bez nawrotów wynosi około 60% po 1 roku i 47% po 2 latach.
- Jak dotąd brak dowodów na zmniejszenie śmiertelności, ale stabilizacja rytmu jest skuteczniejsza niż w przypadku leków przeciwarytmicznych i następuje poprawa jakości życia dzięki mniejszej liczbie wyładowań ICD.
- Nie ustalono jeszcze optymalnego momentu na wykonanie ablacji.
Przebieg, powikłania i rokowanie
Powikłania
- Omdlenia.
- Nagły zgon sercowy.
- Proarytmiczne działanie leków przeciwarytmicznych.
- Powikłania związane z ICD (nieadekwatne wyładowania, usterki elektrody, zakażenia).
Przebieg i rokowanie
Częstoskurcz komorowy
- Idiopatyczny częstoskurcz komorowy (częstoskurcz z drogi odpływu, częstoskurcz wiązkowy) bez strukturalnej choroby serca ma dobre rokowanie.12
- Nietrwały VT w pierwszych dniach po zawale nie jest związany z gorszym rokowaniem; jednak gdy występuje w późniejszym okresie, wiąże się z większą zachorowalnością i śmiertelnością.4
- U pacjentów z niedokrwienną kardiomiopatią rozstrzeniową znaczenie prognostyczne nietrwałego VT jest niejasne.4
- Utrwalony częstoskurcz w strukturalnej chorobie serca ma gorsze rokowanie ze zwiększonym ryzykiem nagłego zgonu sercowego.
- Decydujący wpływ na rokowanie ma podstawowa choroba serca.1
- Najlepszym predyktorem jest frakcja wyrzutowa lewej komory.
- Złe rokowanie u pacjentów z burzami elektrycznymi.
Dalsze postępowanie
- Regularne wizyty kontrolne u specjalistów, jeśli przebieg jest stabilny.
- Dalsze kontrole w przypadku nasilenia objawów lub pogorszenia się choroby podstawowej.
Dodatkowe informacje
Informacje dla pacjentów
Edukacja pacjenta
- Wskazane są regularne badania kontrolne u lekarzy ogólnych i specjalistów.
Materiały edukacyjne dla pacjentów
Ilustracje
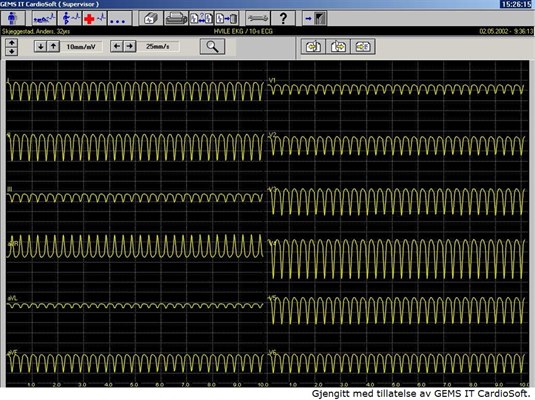
Częstoskurcz komorowy, EKG
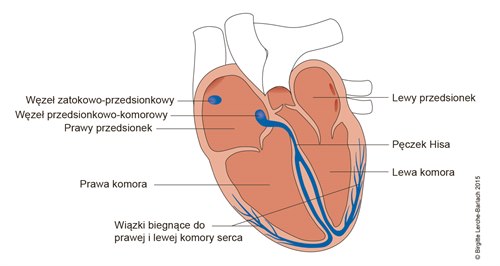
Układ przewodzący serca
Źródła
Wytyczne
- Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death, Eur Heart J. 2022, 43(40): 3997-4126, PubMed
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC), 2015 Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death, www.escardio.org
- American Heart Association/American College of Cardiology/Heart Rhythm Society, 2017 Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death, www.hrsonline.org
Piśmiennictwo
- Roberts-Thomson K., Lau D., Sanders P. The diagnosis and management of ventricular arrhythmias, Nature Reviews Cardiology 2011, 8: 311-21, doi:10.1038/nrcardio.2011.15, DOI
- Al-Khatib S., Stevenson W., Ackerman M., et al. 2017 AHA/ACC/HRS Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death, Heart Rhythm 2017, doi:10.1016/j.hrthm.2017.10.036, DOI
- Priori S., Blomström-Lundqvist C., Mazzanti A., et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death, Eur Heart J 2015, 36: 2793-867, doi:10.1093/eurheartj/ehv316, DOI
- Pedersen C., Kay G., Kalman J., et al. EHRA/HRS/APHRS Expert Consensus on Ventricular Arrhythmias, Heart Rhythm 2014, 11: 166-96, doi:10.1016/j.hrthm.2014.07.024, DOI
- Paudel B., Paudel K. The diagnostic significance of the Holter monitoring in the evaluation of palpitation, J Clin Diagn Res 2013, 7: 480-3, doi:10.7860/JCDR/2012/4923.2802, DOI
- Brugada J., Brugada R., Brugada P. Channelopathies: a New Category of Diseases Causing Sudden Death, Herz 2007, 32: 185-91, pdfs.semanticscholar.org
- Behere S., Weindling S. Catecholaminergic polymorphic ventricular tachycardia: An exciting new era, Ann Pediatr Cardiol 2016, 9: 137-46, www.ncbi.nlm.nih.gov
- P. Brugada, J. Brugada, L. Mont, et al. A new approach to the differential diagnosis of a regular tachycardia with a wide QRS complex, Circulation 1991, 88: 1649-59, pmid:2022022, PubMed
- Vereckei A., Duray G., Szenasi G., et al. New algorithm using only lead aVR for differential diagnosis of wide QRS complex tachycardia, Heart Rhythm 2008, 5: 89-98, doi:10.1016/j.hrthm.2007.09.020, DOI
- Wellens H. Ventricular tachycardia: diagnosis of broad QRS complex tachycardia, Heart 2001, 86: 579-85, doi:10.1136/heart.86.5.579, DOI
- Referowska M., Leśniak W.: Postępowanie u chorych z komorowymi zaburzeniami rytmu serca i zapobieganie nagłemu zgonowi sercowemu - cz. 1. Podsumowanie wytycznych European Society of Cardiology 2022,Med. Prakt., 2023, 1: 10-32, kardiologia.mp.pl
- Brugada P., Diez D. How to recognise and manage idiopathic ventricular tachycardia, ESC E-Journal of Cardiology Practice 2010, Vol.8,N°26, dostęp: 15.01.2018, www.escardio.org
- Badhwar N., Scheinman M. Idiopathic ventricular tachycardia: Diagnosis and management, Curr Probl Cardiol 2007, 32: 7-43, www.ncbi.nlm.nih.gov
Opracowanie
- Tomasz Tomasik (recenzent)
- Sławomir Chlabicz (recenzent)
- Adam Windak (redaktor)
- Małgorzata Marczewska (recenzent/redaktor)
- Michael Handke (recenzent/redaktor)
