Zusammenfassung
- Definition:Bei der Fallot-Tetralogie handelt es sich um einen kombinierten angeborenen Herzfehler mit Ventrikelseptumdefekt, Pulmonalstenose, überreitender Aorta und Rechtsherzhypertrophie.
- Häufigkeit:Häufigster zyanotischer Herzfehler. Prävalenz 2.7/100.000 Lebendgeborene.
- Symptome:Bereits in der Neonatalperiode auftretende Zyanose, Gedeihstörung.
- Befunde:Zyanose, systolisches Herzgeräusch im 2.- bis 3.-Interkostalraum links parasternal.
- Diagnostik:Diagnosestellung erfolgt durch Echokardiografie.
- Therapie:Chirurgische Korrektur des Herzfehlers. Katheteterinterventionen und medikamentöse Behandlung dienen der Stabilisierung bis zur definitiven Korrektur.
Allgemeine Informationen
Definition
- Die Fallot-Tetralogie ist ein angeborener Herzfehler mit vier gleichzeitig bestehenden strukturellen Veränderungen:
- subvalvuläre Pulmonalstenose
- Ventrikelseptumdefekt (VSD)
- reitende Aorta über dem VSD
- Rechtsherzhypertrophie (durch die Druckbelastung)
Häufigkeit
- Häufigster zyanotischer angeborener Herzfehler
- Prävalenz 2,7/10.000 Lebendgeborene
- 2,5 % aller angeborenen Herzfehler
- 6–15 % aller klinisch signifikanten angeborenen Herzfehler1
- Jungen zu Mädchen ca. 1,4:1
Ätiologie und Pathogenese
Ätiologie
- Bei der Mehrzahl der angeborenen Herzfehler wird eine multifaktorielle Ätiologie angenommen.
- Interaktion zwischen genetischer Disposition und Umweltfaktoren
- Bis zu 32 % der Patienten mit Fallot-Tetralogie weisen chromosomale Aberrationen wie Trisomie 21 oder Mikrodeletion 22q11.2 auf.2
Pathophysiologie
- Der Schweregrad des Krankheitsbildes ist vor allem vom Ausmaß der Pulmonalstenose bestimmt.
- Durch die Druckerhöhung im rechten Ventrikel in Kombination mit dem Ventrikelseptumdefekt (VSD) und der überreitenden Aorta kommt es zu einem Rechts-Links-Shunt.
- Hierdurch entsteht eine Zyanose.
- Der pulmonale Blutfluss ist vermindert, bei hochgradiger Pulmonalstenose (oder Atresie) ist die Lungenperfusion über einen offenen persistierenden Ductus arteriosus (PDA) lebenserhaltend.
- Die Fallot-Tetralogie kann mit weiteren Herzfehlern vergesellschaftet sein (z. B. rechtsseitiger Aortenbogen, Vorhofseptumdefekt (ASD), Koronaranomalien).
Prädisponierende Faktoren
- Pränatale Faktoren, die mit einer erhöhten Inzidenz der Fallot-Tetralogie assoziiert sind:3
- Röteln während der Schwangerschaft
- Alkoholabusus
- Alter > 40 Jahre
- Phenylketonurie
- Diabetes mellitus
- Carbamazepin-Einnahme in der Schwangerschaft
ICD-10
- Q21 Angeborene Fehlbildungen der Herzsepten
- Q21.3 Fallot-Tetralogie
Diagnostik
Diagnostische Kriterien
- Darstellung der vier den Herzfehler definierenden strukturellen Veränderungen (Pulmonalstenose, VSD, reitende Aorta, Rechtsherzhypertrophie)
- Diagnosestellung erfolgt mittels Echokardiografie.
Differenzialdiagnosen
- Andere zyanotische Herzfehler:
- Transposition der großen Arterien (TGA)
- univentrikuläres Herz
- Trikuspidalatresie
- Pulmonalatresie
- Nicht kardial bedingte Erkrankungen, die mit Zyanose einhergehen können:
- Atemnotsyndrom
- persistierende pulmonale Hypertonie des Neugeborenen (PPHN)
- rezidivierende Apnoen mit Bradykardie und Hypoxaemie des Frühgeborenen
- ein Teil der Neugeborenen von Müttern mit Schwangerschaftsdiabetes
- Gastroösophagealer Reflux bei Säuglingen kann mit Zyanoseanfällen einhergehen.
- Affektkrämpfe, mehrheitlich mit Zyanose
Anamnese
- Pränatale Diagnostik?
- Trotz des fetalen Screenings auf Organmalformationen werden Herzfehler häufig nicht erkannt.
- In einem Register liegt die pränatale Diagnose einer Fallot-Tetralogie nur bei 8 %.
- Schwangerschaft
- Alkohol
- teratogene Medikamente
- Infektionen
- Diabetes mellitus
- Zyanose
- früh nach der Geburt oder nach freiem Intervall („Late Onset")
- permanent oder nur bei Erregung/Schreien (hypoxämischer Anfall)
- Trinkschwierigkeiten/Gedeihstörungen
Klinische Untersuchung
- Leitsymptome sind Zyanose und ein systolisches Herzgeräusch.
- Zyanose
- beim Neugeborenen oft erst bei O2-Sättigung < 80 % erkennbar
- Auskultation (siehe auch Artikel Herzgeräusche bei Kindern)
- Systolikum 3/6–5/6 mit p. m. über 2.–3. ICR links und Fortleitung zum Rücken,
- singulärer 2. HT (wegen abgeschwächtem Pulmonalklappenschluss)
- Hypoxämischer Anfall (ausgelöst z. B. durch Schreien, Blutentnahme, Fieber)
- Zunahme der Zyanose
- Systolikum wird leiser (Zunahme der Obstruktion mit geringerem Fluss im Ausflusstrakt).
- Tachykardie
- blass-graues Hautkolorit
- evtl. zerebrale Krämpfe, Bewusstseinsverlust
Pulsoxymetrie als Screeningverfahren
- Pulsoxymetrie während der ersten 24 Stunden postnatal mit hoher Sensitivität und Spezifität in der Erkennung zyanotischer Herzfehler
- Bei Werten < 96 % weitere Abklärung notwendig
Diagnostik beim Spezialisten
Echokardiografie
- Die Echokardiografie ist das entscheidende Verfahren zur Diagnosestellung und präoperativen/-interventionellen Planung.
- Folgende Befunde sollten erhoben werden:
- Pulmonalklappe, Bifurkation und zentrale Pulmonalarterien
- Ausmaß der Pulmonalstenose
- Perfusion der Pulmonalarterien (Ductus arteriosus oder zusätzlich multifokal über aortopulmonale Kollateralen)
- Darstellung VSD
- Darstellung der überreitenden Aorta, Anomalien des Aortenbogens
- Koronaranomalien
- weitere Anomalien wie ASD, AVSD, linkspersistierende obere Hohlvene.
EKG
- zur Diagnosestellung nicht erforderlich, präoperativ als Ausgangsbefund
Labor
- Für die Diagnostik unerheblich
Rö-Thorax
- Zur Diagnosestellung nicht erforderlich
- Ausschluss extrakardialer Ursachen
MRT/CT
- Für die Diagnostik nicht von Bedeutung
Herzkatheteruntersuchung
- Keine routinemäßige Durchführung einer Herzkatheteruntersuchung
- Indiziert bei Verdacht auf aortopulmonale Kollateralen, anomalen Abgang der Pulmonalarterie, Verdacht auf einen anomalen Verlauf der Koronararterien
Indikationen zur Überweisung
- Eine Überweisung zur Pädiatrie sollte erfolgen bei:
- Vorliegen einer Zyanose
- Neugeborenen mit Herzgeräusch
- Siehe auch Artikel Herzgeräusche bei Kindern.
Checkliste zur Überweisung
Herzgeräusche beim Kind
- Zweck der Überweisung
- Bestätigende Diagnostik? Behandlung? Sonstiges?
- Anamnese
- Gedeihstörung, Schwindel, Synkope, Atemnot, Atemwegsinfekte, Husten, Brustschmerz, Palpitationen
- Familienanamnese: Herzfehler, plötzlicher Herztod
- Schwangerschaft: Alkohol, teratogene Medikamente, Infektionen, Diabetes mellitus
- Vor- und Begleiterkrankungen, die mit Herzfehlern assoziiert sind.
- Klinische Untersuchung
- Allgemeinzustand?
- Zyanose, Tachypnoe, Ödeme
- Blutdruckdifferenz Arme/Beine
- palpables Schwirren über Thorax, Lebervergrößerung
- Herzgeräusch: zeitliches Auftreten innerhalb des Herzzyklus, Dauer, Frequenz, Klangcharakter, Punctum maximum, Fortleitung
- Ergänzende Untersuchungen
Therapie
Therapieziele
- Ziel ist die anatomische Korrektur des Herzfehlers mit:
- VSD-Verschluss
- Beseitigung der rechtsventrikulären Ausflusstraktobstruktion.
Allgemeines zur Therapie
- Zur Behandlung stehen zur Verfügung:
- Medikamente
- operative Verfahren
- katheterinterventionelle Verfahren
Medikamentöse Therapie
- Zur Überbrückung bis zu einem operativen oder katheterinterventionellen Eingriff können verabreicht werden:
- bei Ductusabhängigkeit der Lungendurchblutung Prostaglandin E1 zum Offenhalten des Ductus
- Betablocker (Propanolol) zur hämodynamischen Verminderung der rechtsventrikulären Ausflusstraktobstruktion.
Operative Verfahren
Korrektur-OP (VSD-Verschluss, Erweiterung des rechtsventrikulären Ausflusstrakts)
- Wenn möglich, elektive Korrektur-OP zwischen 4. und 12. Monat
- Bei ausgeprägter Zyanose OP auch im Neugeborenenalter, allerdings mit erhöhter Mortalität
Palliative OP
- Zur Verbesserung der Lungendurchblutung bis zur definitiven Korrektur können palliative Voroperationen durchgeführt werden:
- modifizierter Blalock-Taussig-Shunt (aortopulmonaler Shunt)4
- Patcherweiterung des rechtsventrikulären Ausflusstrakts
Katheterinterventionelle Verfahren
- Auch durch Katheterinterventionen kann palliativ die Lungendurchblutung verbessert werden.
- Stentimplantation im Bereich des Ductus arteriosus bei Neugeborenen
- Stentimplantation in den rechtsventrikulären Ausflusstrakt
Verlauf, Komplikationen und Prognose
Komplikationen
- Komplikationen im postoperativen Verlauf sind vor allem:
- Pulmonalklappeninsuffizienz und/oder
- Stenose im rechtsventrikulären Ausflusstrakt
- Herzrhythmusstörungen
Prognose
- Unbehandelt Überlebensrate nach 10 Jahren nur ca. 30 %
- 95 % der Patienten versterben vor dem 40. Lebensjahr.5
- Bei elektiver Korrektur-OP perioperative Mortalität < 1 %5
- Recht gute Langzeitprognose mit 35-Jahres-Überleben von ca. 85 %5
- Die Patienten weisen im Verlauf ein erhöhtes Risiko für supraventrikuläre Arrhythmien und ventrikuläre Arrhythmien/plötzlichen Herztod auf.6-8
- Möglicherweise kann künftig die individuelle Prognose mithilfe von künstlicher Intelligenz besser eingeschätzt werden.9
Verlaufskontrollen
- Jährliche Kontrolluntersuchungen sind empfohlen.
- EKG (QRS-Breite! Cave: Zunahme der QRS-Breite um mehr als 3,5 msec/Jahr oder > 180 msec!)
- Echokardiografie
- Langzeit-EKG bei asymptomatischen Patienten > 10 Jahre mindestens alle 3 Jahre
- MRT bei zunehmender RV-Vergrößerung und bedeutsamer Insuffizienz der Pulmonalklappe
- Spiroergometrie ab einem Alter von 10 Jahren mindestens alle 5 Jahre (Leistungseinschränkung wird von Patienten subjektiv nicht erfasst)
Behandlung im Erwachsenenalter (EMAH = Erwachsene mit angeborenen Herzfehlern)
- Die Mehrzahl der EMAH-Patienten sind primär in hausärztlicher und allgemeininternistischer/kardiologischer Behandlung.10
- Je nach Komplexität des zugrunde liegenden Herzfehlers regelmäßige oder bedarfsadaptierte Vorstellung in einem spezialisierten Zentrum bzw. bei einem Kardiologen
- Eine gute Kommunikation zwischen Hausärztin/Hausarzt, niedergelassenen Kardiologen und EMAH-Zentrum sind für eine optimale Behandlung erforderlich.10
Mögliche Komplikationen der Fallot-Tetralogie im Erwachsenenalter
- Die häufigsten Spätfolgen sind:
- Pulmonalklappeninsuffizienz
- rechtsventrikuläre Dilatation und Dysfunktion
- supraventrikuläre Rhythmusstörungen
- ventrikuläre Rhythmusstörungen/plötzlicher Herztod
- Weitere mögliche Komplikationen:5
- residuale rechtsventrikuläre Ausflusstraktobstruktion
- residualer VSD
- Aortenwurzeldilatation
- linksventrikuläre Dysfunktion
- Endokarditis (selten)
Hausärztliche Verlaufskontrollen
- Hausärztliche Verlaufskontrollen sollten umfassen:
- Anamnese hinsichtlich Veränderungen von Symptomatik und körperlicher Belastbarkeit
- klinische Untersuchung auf:
- Zeichen der Herzinsuffizienz
- Veränderungen des Blutdrucks
- Veränderungen des Auskultationsbefundes (siehe auch Artikel Herzgeräusche bei Erwachsenen)
- EKG (siehe auch Checkliste EKG)
- bei V. a. Arrhythmien evtl. ergänzend Langzeit-EKG
- Belastungstests eher durch Spiroergometrie beim EMAH-Spezialisten
Mögliche sportliche Aktivitäten
Klassifizierung sportlicher Aktivitäten
- Gruppe 1: hohe dynamische und hohe statische Belastung
- Abfahrtsskilauf, Boxen, Eisschnelllauf, Fechten, Ringen, Rudern, Rennradfahren
- Gruppe 2: hohe dynamische und geringe statische Belastung
- Ballsportarten (Fußball, Volleyball, Handball, Hockey, Tennis, Basketball, Badminton), Laufen (kein Sprint), Radfahren, Tanzen, Schwimmen, Skilanglauf, Skaten, Tischtennis
- Gruppe 3: hohe statische und geringe dynamische Belastung
- Bogenschießen, Bodybuilding, Geräteturnen, Gewichtheben, Reiten (Galopp und Dressur), Segeln, Surfen, Skispringen, Tauchen, Wasserski
- Gruppe 4: geringe dynamische und geringe statische Belastung
- Wandern, Golfen, Kegeln, Bowling, Billard, Schießen, Eisstockschießen (Curling), ggf. Gymnastik mit geringer Intensität
- Gruppe 5: Klassifikation nicht möglich
- Turnen, Gymnastik, Ballett (Koordination und Flexibilität im Vordergrund, je intensiver das Training, desto höher die statische Belastung)
Sportliche Aktivitäten bei Fallot-Tetralogie
- Sport möglich in den Gruppen 2, 4 und 5 unter folgenden Voraussetzungen:
- unauffälliges 24-Stunden-EKG
- normale Belastungsuntersuchungen
- Druck in der rechten Herzkammer unter 40 mmHg
- keine bedeutsame Undichtigkeit der Pulmonalklappe (Pulmonalklappeninsuffizienz)
- kein oder nur geringer Restshunt (VSD).
- Sport aus der Gruppe 2, 4 oder 5 nicht als Wettkampf, sondern nur als lockere Freizeitbeschäftigung unter folgenden Voraussetzungen:
- systolischer Druck in der rechten Herzkammer > halber systolischer Blutdruck
- erhebliche Pulmonalklappeninsuffizienz.
- Kein Sport:
- bei belastungsabhängigen Herzrhythmusstörungen.
Risiko in der Schwangerschaft
- Bei den meisten Patientinnen mit angeborenem Herzfehler ist eine Schwangerschaft möglich, es bedarf aber einer vorherigen Beratung und Risikostratifizierung.
- Eine korrigierte Fallot-Tetralogie ohne Residualläsion wie schwere Pumonalklappeninsuffizienz oder rechtsventrikuläre Dysfunktion gehört zu den Herzfehlern mit niedrigem Risiko für kardiale Komplikationen/Tod (> 1 ‰ und < 1 %).
Endokarditisprophylaxe
- Eine Endokarditisprophylaxe ist indiziert bei:10
- nicht korrigierten Patienten
- Patienten 6 Monate nach der Korrekturoperation
- Patienten mit operativem oder interventionellem Pulmonalklappenersatz
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen
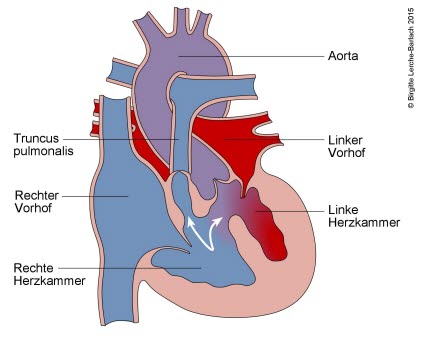
Fallot-Tetralogie

Das Herz

Quellen
Literatur
- Apitz C, Webb GD, Redington AN. Tetralogy of Fallot. Lancet 2009; 374: 1462-71. PubMed
- Bassett AS, Chow EW, Husted J, Weksberg R, Caluseriu O, Webb GD, Gatzoulis MA. Clinical features of 78 adults with 22q11 deletion syndrome. Am J Med Genet A 2005;138:307-313 PubMed
- Bhimji S. Tetralogy of Fallot in adults. Medscape, updated Nov 13, 2018. Zugriff 21.03.2020. emedicine.medscape.com
- Yuan SM, Shinfeld A, Raanani E. The Blalock-Taussig shunt. J Card Surg 2009;24:101-108. PubMed
- Baumgartner H, Bonhoeffer P, De Groot N, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010): the Task Force on the Management of Grown-up Congenital Heart Disease of the European Society of Cardiology (ESC). Eur Heart J 2010;31:2915–57. www.escardio.org
- Gatzoulis MA, Balaji S, Webber SA, Siu SC, Hokanson JS et al. Risk factors for arrhythmia and sudden cardiac death late after repair of tetralogy of Fallot: a multicentre study. Lancet 2000; 356: 975-81. PubMed
- Daliento L. Total correction of tetralogy of Fallot: late clinical follow-up. Ital Heart J 2002; 3: 24-7. PubMed
- Therrien J, Marx GR, Gatzoulis MA. Late problems in tetralogy of Fallot--recognition, management, and prevention. Cardiol Clin 2002; 20: 395-404. PubMed
- Diller G, Orwat S, Vahle J, et al. Prediction of prognosis in patients with tetralogy of Fallot based on deep learning imaging analysis. Heart 2020. doi:10.1136/heartjnl-2019-315962 DOI
- Diller GP, Breithardt G, Baumgartner H. Congenital heart defects in adulthood. Dtsch Arztebl Int 2011; 108: 452-459. doi:10.3238/arztebl.2011.0452 DOI
Autoren
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.