Streszczenie
- Definicja: Autoimmunologiczna choroba tarczycy, w której najczęściej wytwarzane są przeciwciała przeciwtarczycowe przeciwko receptorowi TSH (TRAb), co prowadzi do nadczynności tarczycy.
- Epidemiologia: Częstość występowania wynosi 0,5–2 %. Znacznie częściej występuje u kobiet.
- Objawy: Objawy nadczynności tarczycy, takie jak pocenie się, niepokój, drżenie.
- Badanie fizykalne: Klasyczna jest tzw. triada merseburska: tachykardia, wole, wytrzeszcz.
- Diagnostyka: Wykrycie TRAb w badaniu laboratoryjnym u osoby z nadczynnością tarczycy. Typowy obraz w badaniu USG z hipoechogenicznością i wzmożonym unaczynieniem tarczycy.
- Leczenie: Z reguły leczenie farmakologiczne tyreostatykami przez 12–18 miesięcy. W przypadku niepowodzenia terapii możliwe leczenie radykalne: terapia jodem radioaktywnym lub tyreoidektomia.
Informacje ogólne
Definicja
- Synonimy: autoimmunologiczna nadczynność tarczycy, choroba Gravesa-Basedowa.
- Autoimmunologiczna choroba tarczycy, w której najczęściej powstają przeciwciała przeciwtarczycowe przeciwko receptorowi TSH (TRAb), co prowadzi do stymulacji receptora oraz zwiększonej syntezy i uwalniania hormonów tarczycy, a w konsekwencji do nadczynności tarczycy.
- Nazwa choroby pochodzi od nazwiska irlandzkiego lekarza Roberta Gravesa, który opisał objawy choroby w 1832 roku oraz Carla Adolpha von Basedowa, którego zespół niezależnie opisał to zaburzenie w 1840 roku.
- Orbitopatia tarczycowa, która często występuje w tej chorobie, została opisana w artykule Zmiany w oku spowodowane nadczynnością tarczycy (orbitopatia tarczycowa).
Epidemiologia
- Częstość występowania wynosi 0,5–2%.
- Najczęstsza przyczyna nadczynności tarczycy w Polsce.
- Drugą najczęstszą przyczyną nadczynności (dominującą na obszarach z niedoborem jodu) jest gruczolak autonomiczny; dotyczy głównie starszych pacjentów.1
- Stosunek występowania u kobiet i mężczyzn: 5:1.
Etiologia i patogeneza
- Predyspozycja do wystąpienia choroby Gravesa-Basedowa ma uwarunkowanie poligenetyczne.
- 30% chorych ma w wywiadzie rodzinnym osoby chorujące na chorobę Gravesa-Basedowa lub chorobę Hashimoto.
- Predyspozycje genetyczną wiąże się z haplotypami HLA-DR3 i HLA-DR4.
- Opisano różne czynniki środowiskowe wyzwalające chorobę, m.in. palenie tytoniu.2
- W chorobie Gravesa-Basedowa pośredniczy humoralna odpowiedź immunologiczna.
- Typowym przeciwciałem, które powstaje w komórkach odpornościowych, jest przeciwciało przeciwko receptorowi TSH (TRAb).
- Związanie TRAb z N-końcową częścią receptora TSH naśladuje działanie TSH i prowadzi w przeważającej mierze do stymulacji. Skutkuje to pobudzeniem tyreocytów, zwiększeniem wychwytu jodu do tarczycy i wreszcie zwiększonym tworzeniem i uwalnianiem T3 i T4.
- Taka stymulacja nie podlega hamowaniu poprzez ujemne sprzężenie zwrotne, co prowadzi do niekontrolowanego, wzmożonego wytwarzania i wydzielania hormonów tarczycy.
- W rzadkich przypadkach przeciwciała TRAb mogą mieć też działanie blokujące.
- Dodatkowo ekspresja receptora TSH występuje na tkance pozagałkowej.
- Wiązanie TRAb w chorobie Gravesa-Basedowa prawdopodobnie prowadzi do stymulacji z narastającym włóknieniem tkanki oczodołu, z wyjściowo ograniczoną przestrzenią. Rozwija się orbitopatia tarczycowa.
Czynniki predysponujące
- Predyspozycja poligenetyczna:
- geny odpowiedzialne głównie w regionie HLA-DR3 i HLA-DR4.
- Nadużywanie nikotyny:
- prawdopodobnie tylko w niewielkim stopniu przyczynia się do ryzyka rozwoju choroby Gravesa-Basedowa
- wydaje się jednak niekorzystnie wpływać na częstość występowania i ciężkość orbitopatii tarczycowej.
- Duże spożycie jodu, stres oraz ciąża.
ICD-10
- E05.0 Tyreotoksykoza z wolem rozlanym (z chorobą Gravesa-Basedowa).
Diagnostyka
Kryteria diagnostyczne
- W wytycznych europejskich odnośnie nadczynności tarczycy zaleca się oznaczenie TRAb jako szybką i dokładną metodę diagnostyki różnicowej choroby Gravesa-Basedowa3:
- bardzo wysoka czułość (97%) i swoistość (98%).4
- Ponadto w wytycznych zaleca się badanie ultrasonograficzne jako metodę obrazową z wyboru w celu potwierdzenia diagnozy.3
Diagnostyka różnicowa
- Gruczolak autonomiczny.
- Zapalenie tarczycy.
- Ośrodkowa nadczynność tarczycy (np. gruczolak przysadki wytwarzający TSH).
- Hashitoxicosis (faza nadczynności choroby Hashimoto).
- Polekowe zapalenie tarczycy.5
Wywiad
- Zwykle nagły początek licznych objawów nadczynności tarczycy:
- np. niepokój, utrata masy ciała, zmęczenie, wzmożone pocenie się, drżenie, zaburzenia koncentracji, utrata włosów, a u kobiet także zaburzenia miesiączkowania.
- Narastający obrzęk tarczycy, czasem bolesność.
Badanie fizykalne
- Objawy nadczynności tarczycy, np.:
- tachykardia, nadciśnienie tętnicze
- nadmierne ucieplenie skóry
- wzmożone odruchy (hiperrefleksja)
- drżenie.
- Klasyczna triada merseburska:
- wole
- wytrzeszcz (orbitopatia tarczycowa)
- tachykardia.
- Orbitopatia tarczycowa (oftalmopatia):
- najczęstszy pozatarczycowy objaw choroby Gravesa-Basedowa
- objawy subiektywne: ból lub uczucie ucisku za gałką oczną, pieczenie, łzawienie, uczucie piasku pod powiekami, światłowstręt
- w badaniu przedmiotowym: wytrzeszcz, obrzęk powiek i tkanek okołooczodołowych, zaczerwienienie spojówek, ograniczenie ruchomości gałek ocznych.5
Badania uzupełniające w praktyce lekarza rodzinnego
Badania laboratoryjne
- Oznaczenie TSH, fT3 oraz fT4 w celu określenia stanu hormonalnego
- Często występuje nadczynność tarczycy, ale możliwa jest także niedoczynność.
- w zależności od statusu aktywności TRAb.
- Często występuje nadczynność tarczycy, ale możliwa jest także niedoczynność.
- Oznaczenie przeciwciał przeciw receptorom TSH (TRAb), wysoce specyficznych i czułych dla choroby Gravesa-Basedowa3 (dostępne w ścieżce endokrynologicznej Opieki Koordynowanej).
- Oznaczenie przeciwciał anty-TPO i anty-TG może być pomocne przy różnicowaniu z hashitoxicosis (dostępne w ramach ścieżki endokrynologicznej Opieki Koordynowanej).
USG
- Typowo powiększona objętość tarczycy z rozlaną hipoechogenicznością, niejednorodnym miąższem i wyraźnie wzmożonym unaczynieniem (hiperwaskularyzacją).
Diagnostyka specjalistyczna
Scyntygrafia z użyciem jodu radioaktywnego
- Przy nadczynności tarczycy i podejrzeniu zapalenia tarczycy:
- zmniejszony wychwyt lub brak wychwytu radiofarmaceutyku w nadczynności tarczycy przemawia za rozpoznaniem zapalenia tarczycy
- nadczynność tarczycy w zapaleniu tarczycy wynika ze zwiększonego uwalniania hormonów w przebiegu uszkodzenia tarczycy, a nie, jak w chorobie Gravesa-Basedowa, z nadmiernej aktywności tarczycy
- w chorobie Gravesa-Basedowa wychwyt jodu jest zwiększony z powodu wzmożonej stymulacji aktywności tarczycy.
- W przypadku podejrzenia guzka nadczynnego i gdy rozważa się leczenie jodem radioaktywnym.2
- Scyntygrafia tarczycy nie jest zwykle konieczna do postawienia diagnozy.
Wskazania do skierowania do specjalisty/hospitalizacji
- Pacjentów należy kierować do endokrynologa w razie wątpliwości lub konieczności dostosowania terapii.
- Lekarze rodzinni posiadający doświadczenie w leczeniu chorób endokrynologicznych mogą też samodzielnie poprowadzić leczenie i monitorowanie nadczynności tarczycy oraz koordynować dalsze postępowanie.
- Przy podejrzeniu orbitopatii tarczycowej należy skierować pacjenta do okulisty.
- Wskazania do hospitalizacji:
- pierwsze rozpoznanie migotania przedsionków
- podejrzenie przełomu tyreotoksycznego.
Skierowania w dalszym przebiegu choroby
- Planowanie ciąży u pacjentek z nadczynnością tarczycy.
- Objawy nadczynności tarczycy podczas lub po ciąży.
- W celu oceny wskazań do leczenia radykalnego (leczenie jodem radioaktywnym lub tyreoidektomia).
- Nawroty choroby po zakończonym leczeniu jodem radioaktywnym lub tyreoidektomii subtotalnej.
- Kontrole okulistyczne przy orbitopatii tarczycowej.
Leczenie
Cele leczenia
- Remisja choroby.
- Brak dolegliwości.
- Zapobieganie powikłaniom.
Ogólne informacje o leczeniu
Wytyczne europejskie dotyczące choroby Gravesa-Basedowa (stan z 2018 r.)3
- Pacjenci z nowo rozpoznaną chorobą Gravesa-Basedowa powinni być leczeni lekami tyreostatycznymi jako terapią pierwszego rzutu.
- Terapię jodem radioaktywnym lub tyreoidektomię należy rozważać indywidualnie jako opcje alternatywne.
- Tiamazol (alternatywnie karbimazol - niedostępny w Polsce) należy stosować jako lek tyreostatyczny u wszystkich nieciężarnych pacjentek.
- Leki tyreostatyczne należy podawać przez 12–18 miesięcy.
- Początkowa dawka tiamazolu wynosi 10–30 mg na dobę, w zależności od nasilenia objawów nadczynności tarczycy.
- Dawkę można zmniejszać w zależności od stężenia fT3 i fT4 3–4 tygodnie po rozpoczęciu leczenia.
- TSH jest często hamowany przez wiele miesięcy po rozpoczęciu terapii i dlatego nie jest to odpowiedni parametr do monitorowania przebiegu choroby.
- Dawka podtrzymująca tiamazolu wynosi zwykle 2,5–10 mg na dobę.
- Alternatywnie można podać 30 mg tiamazolu w połączeniu z lewotyroksyną (postępowanie „zablokuj i zastąp”, block and replace) - przeciwwskazana w ciąży!
- Po 12–18 miesiącach można podjąć próbę odstawienia, jeśli stężenia TSH i TRAb są prawidłowe.
- U chorych z utrzymującym się wysokim poziomem TRAb można kontynuować terapię tyreostatyczną przez kolejne 12 miesięcy, a następnie wykonać oznaczenie TRAb.
- Jako alternatywę należy omówić z pacjentami terapię jodem radioaktywnym lub tyreoidektomię.
- W przypadku objawów adrenergicznych, u wszystkich pacjentów zalecane jest leczenie beta-blokerem.
- propranolol 20–40 mg 4 x dziennie.
- Wskazania do stosowania tyreostatyków:
- choroba Gravesa-Basedowa z niskim ryzykiem nawrotu (kobieta, >40 lat, zmniejszenie objętości tarczycy i normalizacja TRAb pod wpływem leczenia)
- przeciwwskazania do operacji lub leczenia jodem radioaktywnym.
- Wskazania do leczenia chirurgicznego:
- choroba Gravesa-Basedowa z wysokim ryzykiem nawrotu, utrzymywaniem się lub nawrotem nadczynności tarczycy po 6–12 miesiącach leczenia zachowawczego, szczególnie w przypadku dużego wola
- choroba Gravesa-Basedowa z czynną orbitopatią tarczycową albo planowanie ciąży.
- Wskazania do leczenia jodem radioaktywnym:
- choroba Gravesa-Basedowa z wysokim ryzykiem nawrotu, utrzymywaniem się lub nawrotem nadczynności tarczycy po 6–12 miesiącach leczenia zachowawczego, szczególnie w przypadku małego albo średniego wola.
Zalecenia dla pacjentów
- Przy rozpoczęciu leczenia tyreostatykami należy poinformować pacjenta o możliwych objawach agranulocytozy (gorączka, zapalenie gardła lub zapalenie pęcherza moczowego) i zapalenia wątroby (żółtaczka, jasny stolec lub ciemny mocz).
- W przypadku wystąpienia takich objawów należy natychmiast odstawić tyreostatyki i skontaktować się z lekarzem.
- Należy niezwłocznie zaprzestać palenia, aby zmniejszyć ryzyko powikłań okulistycznych.
Leczenie farmakologiczne
- Wdrożenie farmakoterapii, zobacz Europejskie zalecenia dotyczące postępowania.
Leki tyreostatyczne
- Karbimazol (niedostępny w Polsce)/tiamazol:
- karbimazol jest prolekiem tiamazolu, który ulega przekształceniu w wątrobie
- ogranicza biosyntezę hormonów tarczycy poprzez hamowanie aktywności tyreoperoksydazy (enzymu odpowiedzialnego za przyłączanie jodu do hormonów tarczycy)
- lek z wyboru ze względu na korzystniejszy profil działań niepożądanych:
- uszkodzenie wątroby stwierdza się u 0,4% pacjentów w porównaniu do 2,7% pacjentów przyjmujących propylotiouracyl.6
- Propylotiouracyl (PTU):
Beta-blokery
- Wskazania:
- objawy adrenergiczne: drżenie, kołatanie serca, nietolerancja ciepła i nerwowość.
- Lekiem z wyboru jest propranolol3:
Inne metody leczenia
Terapia jodem radioaktywnym
- Wskazania:
- Zobacz sekcja Wskazania do leczenia jodem radioaktywnym.
- Procedura:
- leczenie w warunkach stacjonarnej ochrony radiologicznej w formie jednorazowej terapii na oddziale medycyny nuklearnej
- ogólnoustrojowe zastosowanie emitera promieniowania beta i gamma I–131 w postaci jodku sodu w celu uzyskania wysokich dawek promieniowania ukierunkowanego na tarczycę:
- zwykle stosuje się podanie doustne (kapsułka lub płyn)
- codzienny pomiar absorpcji i efektywnego okresu półtrwania
- w razie potrzeby: leczenie uzupełniające w trakcie tej samej hospitalizacji
- emisja dawki ≤3,5 miSv/h w odległości 2 m.
- Radioaktywny jod jest wchłaniany przez komórki pęcherzykowe, dzięki czemu promieniowanie uszkadza tylko tkankę tarczycy.7
- Pełen efekt leczenia widoczny po upływie 4–12 tygodni.
- Działania niepożądane:
- w wyniku leczenia często rozwija się trwała niedoczynność tarczycy:
- dotyczy 60–70% pacjentów
- należy wówczas stosować substytucję hormonów tarczycy (lewotyroksynę).
- inne działania niepożądane występują rzadko, a ten sposób leczenia nie wydaje się zwiększać ryzyka raka tarczycy.8
- możliwe działania niepożądane to łagodny ból w przedniej części szyi spowodowany popromiennym zapaleniem tarczycy oraz przejściowo nasilona nadczynność tarczycy (można jej zapobiec, stosując premedykację tyreostatykami).
- zwiększone ryzyko rozwoju nadczynności przytarczyc.9
- w wyniku leczenia często rozwija się trwała niedoczynność tarczycy:
- Przeciwwskazania:
- ciąża i karmienie piersią:
- nie zaleca się zachodzenia w ciążę ani płodzenia dzieci przez mężczyzn w ciągu pierwszych 6 miesięcy po leczeniu jodem radioaktywnym
- kobiety, które w przyszłości planują ciążę (przeciwwskazanie względne)
- orbitopatia tarczycowa (może się nasilić w trakcie leczenia).10
- W razie zastosowania leczenia jodem radioaktywnym pomimo orbitopatii należy jednocześnie podawać glikokortykosteroidy w wysokich dawkach.
- ciąża i karmienie piersią:
Tyreoidektomia
- Wskazania:
- patrz sekcja Wskazania do leczenia operacyjnego.
- Procedura:
- zgodnie z europejskimi wytycznymi, zawsze należy dążyć do całkowitej tyreoidektomii, ponieważ ryzyko powikłań jest takie samo jak w przypadku subtotalnej tyreoidektomii, ale przy niższym ryzyku nawrotu nadczynności tarczycy.3
- Postępowanie przygotowawcze:
- przedoperacyjnie należy dążyć do osiągnięcia eutyreozy
- należy wyrównać niedobór witaminy D, aby zmniejszyć pooperacyjne ryzyko hipokalcemii.3
- Powikłania:
- u większości pacjentów rozwija się pooperacyjna niedoczynność tarczycy w zależności od wielkości pozostawionych fragmentów tkanki tarczycy
- niedoczynność przytarczyc
- uszkodzenie nerwu krtaniowego wstecznego
- przemijająca hipokalcemia
- ogólne ryzyko okołooperacyjne, takie jak krwawienie lub zakażenie.
Ciąża
- Choroba Gravesa-Basedowa w ciąży jest związana z ryzykiem nadciśnienia tętniczego, stanu przedrzucawkowego, niewydolności serca oraz przełomu tarczycowego, ale również może powodować poronienia, porody przedwczesne oraz być przyczyną niskiej masy urodzeniowej dziecka. Prawidłowe leczenie może zapobiec tym powikłaniom.11
- Zalecenia dotyczące podawania tyreostatyków w ciąży:
- pacjentki w wieku rozrodczym leczone tiamazolem (TMZ) lub karbimazolem (CMZ - niedostępny w Polsce) powinny stosować skuteczną antykoncepcję przez cały okres leczenia, ponieważ leczenie TMZ lub CMZ może być związane z występowaniem wad wrodzonych, jeśli jest stosowane w okresie ciąży, a zwłaszcza w pierwszym trymestrze i w dużych dawkach
- należy unikać rutynowego stosowania PTU u pacjentek, które nie planują ciąży, ponieważ stosowanie PTU wiąże się z podwyższonym ryzykiem ostrej niewydolności wątroby
- pacjentkom z chorobą Gravesa-Basedowa, które planują ciążę, należy zapewnić konsultację endokrynologiczną, w celu omówienia złożoności postępowania w chorobie Gravesa-Basedowa w okresie ciąży oraz dostępnych alternatywnych opcji leczenia
- zasadniczo należy zalecić odroczenie poczęcia do czasu, gdy choroba podstawowa matki zostanie odpowiednio opanowana lub ostatecznie wyleczona
- jawna nadczynność tarczycy w okresie ciąży wymaga odpowiedniego leczenia, aby przeciwdziałać występowaniu ciężkich powikłań u matki i płodu
- jeśli rozważana jest ciąża podczas leczenia tyreostatykami, u pacjentek leczonych TMZ lub CMZ należy przed poczęciem, po indywidualnej ocenie ryzyka i korzyści, zmienić terapię na PTU, ponieważ obecnie dostępne dane wskazują, że ryzyko powstawania wad rozwojowych w terapii PTU jest tylko nieznacznie podwyższone
- stosowanie TMZ lub CMZ w pierwszym trymestrze ciąży należy ograniczyć do pacjentek, u których stwierdzono nietolerancję PTU
- aby ograniczyć ryzyko niewydolności wątroby u matki, po zakończeniu etapu organogenezy (po 16. tyg. ciąży), należy rozważyć przestawienie z PTU na TMA lub CMZ, po indywidualnej ocenie korzyści i ryzyka. Należy jednak wziąć pod uwagę potencjalne zagrożenia wynikające z przejściowych zaburzeń czynności tarczycy podczas zmiany leczenia
- jeżeli kobietom w ciąży podawane są tyreostatyki, należy zawsze stosować najniższą skuteczną dawkę, dobraną tak, aby utrzymać stężenie fT4 w górnym zakresie wartości referencyjnej dla populacji ogólnej5
- nie należy równocześnie stosować tyreostatyków i hormonów tarczycy ze względu na duże ryzyko rozwoju niedoczynności tarczycy u płodu (tyreostatyki lepiej przenikają przez łożysko niż preparaty lewotyroksyny)5
- jeżeli pacjentka w ciąży przyjmuje tyreostatyki, konieczna jest ścisła obserwacja matki (początkowo co 2 tygodnie, później co 2-4 tyg.), płodu i noworodka.5
Zapobieganie
- Rozwojowi chorób tarczycy może przeciwdziałać fizjologiczny poziom selenu.12
- Należy unikać zarówno niedoboru, jak i nadmiernej podaży selenu.
- Zaleca się dzienne spożycie selenu na poziomie 70 mcg u mężczyzn i 60 mcg u kobiet.
- Pokarmy bogate w selen to orzechy brazylijskie (UWAGA: radioaktywne, nadmierne spożycie jest niewskazane!), grzyby, szparagi i rośliny strączkowe.
- W Unii Europejskiej pasza dla zwierząt może być wzbogacana selenem. Pokarmy zwierzęce, takie jak mięso i jaja, mogą ułatwiać przyjmowanie stałej, odpowiedniej ilości selenu wraz z dietą.
Przebieg, powikłania i rokowanie
Przebieg
- Zazwyczaj nagły początek choroby z objawami nadczynności tarczycy.
- U niemal wszystkich pacjentów występują objawy okulistyczne, ale tylko u 5% pacjentów dochodzi do powikłań zagrażających wzrokowi.13
Powikłania
- Przełom tyreotoksyczny:
- zagrażający życiu stan dekompensacji nadczynności tarczycy.
- Orbitopatia tarczycowa:
- palenie tytoniu jest czynnikiem ryzyka rozwoju i zaostrzenia orbitopatii.8
- Niedoczynność tarczycy po leczeniu radykalnym.
- Zaburzenia rytmu serca, np. migotanie przedsionków.
Rokowanie
- Przy próbie odstawienia leku po co najmniej 6 miesiącach pierwszego leczenia tyreostatycznego, odsetek remisji wynosi 50–60%.
- Niemal jedna czwarta nawrotów (23%) występuje w pierwszym półroczu, a około dwie trzecie nawrotów (70%) w ciągu pierwszego roku po odstawieniu leków tyreostatycznych.
- W ocenie przebiegu choroby pomocne może być oznaczenie TRAb.
- Szanse na długoterminową remisję pod wpływem leczenia tyreostatycznego są niewielkie przy objętości tarczycy >40 ml oraz u młodych pacjentów ze stężeniem TRAb >10 U/l.
Dalsze postępowanie
- W większości przypadków leczenie jest prowadzone we współpracy z endokrynologiem.
- Po konsultacji ze specjalistą badania kontrolne mogą być wykonywane w praktyce lekarza rodzinnego.
Tyreostatyki
- Dawkę leku tyreostatycznego dostosowuje się na podstawie wartości fT4; początkowo dawkę zwiększa się co 3–4 tygodnie aż do osiągnięcia dawki podtrzymującej.
- Celem leczenia jest utrzymanie fT4 w górnym zakresie normy.
- Po osiągnięciu dawki podtrzymującej badania kontrolne należy powtarzać co 3–6 miesięcy.
- W trakcie leczenia tyreostatykami należy regularnie wykonywać morfologię krwi (UWAGA: agranulocytoza!) oraz próby wątrobowe (UWAGA: zapalenie wątroby!).
Po leczeniu jodem radioaktywnym lub leczeniu chirurgicznym
- Kontrole według wytycznych instytucjonalnych w placówce prowadzącej leczenie:
- u większości pacjentów po leczeniu radykalnym rozwija się niedoczynność tarczycy wymagająca dożywotniej substytucji hormonalnej
- prowadzenie substytucji hormonalnej na podstawie wyników fT4 i TSH.
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Ilustracje
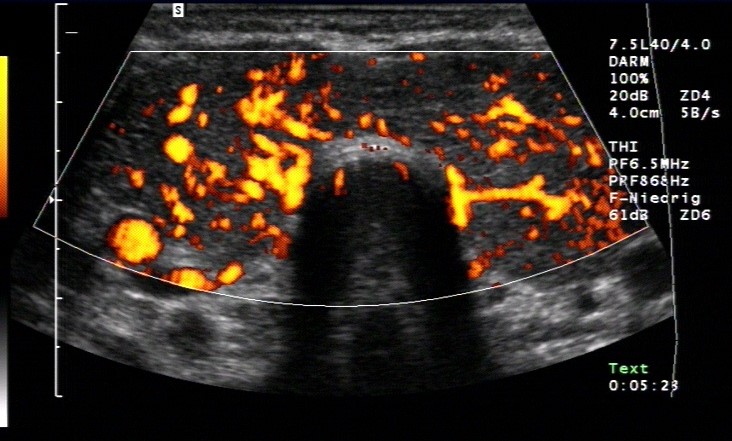
Badanie USG Doppler: choroba Gravesa-Basedowa z hiperwaskularyzacją
Źródła
Wytyczne
- European Thyroid Association (Europejskie Towarzystwo Tyreologiczne). Guideline for the Management of Graves' Hyperthyroidism (Wytyczne dotyczące postępowania w nadczynności tarczycy Gravesa). Stan z 2018 r. www.pubmed.ncbi.nlm.nih.gov
- American Thyroid Association (Amerykańskie Towarzystwo Tyreologiczne). Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis (Wytyczne dotyczące diagnostyki i postępowania w nadczynności tarczycy i tyreotoksykozach o innej etiologii). Stan z 2016 r. www.pubmed.ncbi.nlm.nih.gov
Piśmiennictwo
- Wiersinga WM, Poppe KG, Effraimidis G. Hyperthyroidism: aetiology, pathogenesis, diagnosis, management, complications, and prognosis.Lancet Diabetes Endocrinol. 2023 Apr;11(4): 282-98. pubmed.ncbi.nlm.nih.gov
- Jarząb B., Płaczkiewicz-Jankowska E. Postępowanie w nadczynności tarczycy w przebiegu choroby Gravesa i Basedowa. Omówienie wytycznych European Thyroid Association 2018. Med. Prakt., 2019; 3: 36–52 www.mp.pl
- Kahaly GJ, Bartalena L, Hegedüs L, et al. 2018 European Thyroid Association Guideline for the Management of Graves' Hyperthyroidism. Eur Thyroid J 2018; 7(4): 167-86. pubmed.ncbi.nlm.nih.gov
- Tozzoli R, Bagnasco M, Giavarina D, et al. TSH receptor autoantibody immunoassay in patients with Graves’ disease: improvement of diagnostic accuracy over different generations of methods: systematic review and meta-analysis. Autoimmun Rev 2012; 12(2): 107-13. pubmed.ncbi.nlm.nih.gov
- Jarząb B. Płaszczkiewicz-Jankowska E. Choroba Gravesa i Basedowa. Interna - mały podręcznik. Medycyna Praktyczna. (dostęp 25.11.2023) www.mp.pl
- Ross DS, Burch HB, Cooper DS et al. 2016 American Thyroid Association Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis. Thyreoid 2016; 26: 1343-421. pubmed.ncbi.nlm.nih.gov
- Metso S, Jaatinen P, Huhtala H, Luukkaala T, Oksala H, Salmi J. Long-term follow-up study of radioiodine treatment of hyperthyroidism. Clin Endocrinol (Oxf) 2004; 61: 641-8. www.ncbi.nlm.nih.gov
- Bahn Chair RS, Burch HB, Cooper DS, et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid 2011; 21: 593. pubmed.ncbi.nlm.nih.gov
- Colaco SM, Si M, Reiff E, Clark OH. Hyperparathyroidism after radioactive iodine therapy. Am J Surg 2007; 194: 323-7. pubmed.ncbi.nlm.nih.gov
- Ginsberg J. Diagnosis and management of Graves' disease. CMAJ 2003; 168: 575-85. www.cmaj.ca
- Karbownik-Lewińska M. Choroby tarczycy a ciąża. Wyd 1. 2018. Wyd. Termedia Wydawnictwa Medyczne. ISBN: 978-83-7988-110-9
- Ventura M, Melo M, Carrilho F. Selenium and Thyroid Disease: From Pathophysiology to Treatment. International Journal of Endocrinology 2017. pubmed.ncbi.nlm.nih.gov
- Bartalena L, Pinchera A, Marcocci C. Management of Graves' ophthalmopathy: reality and perspectives. Endocr Rev 2000; 21: 168-99. pubmed.ncbi.nlm.nih.gov
- Tun NN, Beckett G, Zammitt NN et al. Thyrotropin Receptor Antibody Levels at Diagnosis and After Thionamide Course Predict Graves’ Disease Relapse. Thyroid 2016; 26: 1004-9. pubmed.ncbi.nlm.nih.gov
Opracowanie
- Sławomir Chlabicz (recenzent/redaktor)
- Anita Fabian-Danielewska (recenzent)
- Adam Windak, P (redaktor)
- Lino Witte (recenzent/redaktor)
