Streszczenie
- Definicja: Hiperlipidemia jest terminem zbiorczym. Obejmuje szereg zaburzeń dotyczących stężenia poszczególnych frakcji cholesterolu we krwi. Obejmuje zarówno postaci zaburzeń lipidowych wrodzonych, jak i nabytych.
- Epidemiologia: Zaburzenia stężenia lipidów są najbardziej rozpowszechnionym czynnikem ryzyka sercowo-naczyniowego w populacji polskiej. Szacuje się, że częstość występowania dyslipidemii w Polsce dotyczy 60–80% osób powyżej 18. roku życia.
- Objawy: Dyslipidemia zwykle nie powoduje objawów, ale może istotnie zwiększyć ryzyko wystąpienia incydentów sercowo–naczyniowych, tj. zawału serca czy udaru mózgu, a także zgonu z przyczyn sercowo-naczyniowych. Bardzo wysoki poziom trójglicerydów wiąże się dodatkowo z ryzykiem zapalenia trzustki i stłuszczenia wątroby.
- Badanie fizykalne: Zasadniczo nie obserwuje się nieprawidłowości w badaniu przedmiotowym. W przypadku rodzinnej hipercholesterolemii mogą pojawić się żółtaki (xanthoma), najczęściej zlokalizowane w obrębie powiek (xanthelasma).
- Diagnostyka: Oznaczanie stężenia cholesterolu całkowitego, cholesterolu HDL, cholesterolu LDL i trójglicerydów.. W wybranych wypadkach oznaczenie stężenia apolipoproteiny B (apoB) oraz stężenia lipoproteiny (a) [Lp(a)]. W uzasadnionych przypadkach wykonywanie badań genetycznych.
- Leczenie: Profilaktyka pierwotna polega na modyfikacji diety i regularnej aktywności fizycznej. W przypadku zwiększonego ryzyka sercowo–naczyniowego rozpoczęcie terapii statynami. W przypadku nietolerancji statyn lub nieosiągnięcia celu terapeutycznego leczenie pozostałymi lekami hipolipemizującymi.
Informacje ogólne
Definicja
- Termin „dyslipidemia” obejmuje wszystkie postaci podwyższonego poziomu lipidów we krwi. Istnieje wiele podtypów dyslipidemii. W praktyce klinicznej wyróżnia się:
- hipercholesterolemię
- dyslipidemię aterogenną (w tym hiperlipidemię mieszaną; zwiększone stężenie trójglicerydów [TG], obniżone stężenie HDL, nieprawidłowe czasteczki LDL)
- hipertrójglicerydemię (zobacz także artykuł hipertrójglicerydemia)
- hiperlipoproteinemię Lp(a) (zwiększone stężenie lipoproteiny a).1-3
- Szczególne znaczenie ma podwyższone stężenie cholesterolu całkowitego i lipoprotein o niskiej gęstości (LDL) oraz niskie stężenie lipoprotein o wysokiej gęstości (HDL).
- Tłuszcze te mają wpływ na rozwój miażdżycy i związanych z jej rozwojem powikłań sercowo–naczyniowych. Ich stężenie można normalizować, stosując odpowiednie leczenie.
- Pomimo tendencji spadkowej, choroby sercowo–naczyniowe nadal należą do najczęstszych przyczyn zgonów w Europie.
- Do głównych czynników ryzyka chorób sercowo–naczyniowych zalicza się oprócz podwyższonego stężenia lipidów we krwi, nadciśnienie tętnicze, cukrzycę, palenie papierosów oraz predyspozycje genetyczne.
- We wszystkich aktualnych wytycznych dotyczących zapobiegania chorobom układu krążenia o podłożu miażdżycowym (atherosclerotic cardiovascular disease – ASCVD) w praktyce klinicznej, zaleca się ocenę całkowitego ryzyka sercowo–naczyniowego.
- Profilaktyka ASCVD powinna uwzględniać indywidualne ogólne ryzyko sercowo–naczyniowe: im wyższe ryzyko, tym intensywniejsze działania należy podjąć.
- Decyzję o terapii obniżającej stężenie lipidów należy zatem podjąć także na podstawie oceny ogólnego ryzyka sercowo-naczyniowego, a nie wyłącznie na podstawie podwyższonego stężenia lipidów.
Biochemia
- Cholesterol
- Pod względem chemicznym zaliczany jest do alkoholi wielopierścieniowych lub steroli,
- Jest niezbędny w produkcji hormonów steroidowych i kwasów żółciowych; jest syntetyzowany w około 90% w organizmie, tylko około 10% cholesterolu pochodzi z pożywienia.
- Lipoproteiny
- Cholesterol i trójglicerydy nie rozpuszczają się w wodzie, dlatego występują w osoczu w charakterystycznych proporcjach jako składniki kompleksów lipidowo–białkowych, czyli lipoprotein.
- Składniki białkowe zwane apoproteinami (m.in. apoproteina AI, AII, B48, B100, C I–III, E 2–4) pełnią rolę składników strukturalnych, ligandów dla receptorów lub kofaktorów reakcji enzymatycznych w różnym i charakterystycznym dla poszczególnych lipoprotein zakresie.
- W zależności od ich gęstości rozróżnia się następujące lipoproteiny: chylomikrony, lipoproteiny o bardzo niskiej gęstości (very low density lipoproteins – VLDL), lipoproteiny o niskiej gęstości (low density lipoproteins – LDL) i lipoproteiny o wysokiej gęstości (high density lipoproteins – HDL).
- Trójglicerydy występują głównie w chylomikronach i VLDL.
- 60–70% cholesterolu całkowitego to cholesterol LDL, a cholesterol HDL w normalnych warunkach stanowi zazwyczaj 20–30% cholesterolu całkowitego. Ponadto wyróżnia się warianty, takie jak lipoproteina a.
- Poszczególne lipoproteiny pełnią funkcje transportowe we krwi, np. pomiędzy wątrobą, a innymi narządami/mięśniami, przy czym LDL transportuje cholesterol z wątroby, a HDL transportuje cholesterol do wątroby.
- Statyny
- Leki z wyboru w przypadku rozpoczęcia farmakoterapii.
- Inhibitory reduktazy 3–hydroksy–3–metyloglutarylokoenzymu A (reduktazy HMG–CoA), czyli leki blokujące endogenną syntezę cholesterolu w wątrobie.
- Statyny, oprócz obniżania stężenia cholesterolu LDL, wykazują też tzw. działanie plejotropowe (m. in. ochrona śródbłonka naczyniowego, stabilizacją blaszki miażdżycowej, działanie przeciwzapalne i przeciwkrzepliwe) mogące wyjaśniać, dlaczego np. efekt wazoprotekcyjny statyn ujawnia się stosunkowo szybko i wydaje się być w dużej mierze niezależny od dawki.
Wyjaśnienie terminów
- Hipercholesterolemia
- Oznacza podwyższone stężenie cholesterolu w surowicy.
- Hipertrójglicerydemia
- Oznacza podwyższone stężenie trójglicerydów w surowicy.
- Hiperlipoproteinemia
- Termin ten stosuje się tylko, jeżeli zmierzono lub wyliczono wysokie stężenie co najmniej 1 lipoproteiny, głównie cholesterolu LDL lub lipoproteiny Lp(a).
- Dyslipidemia aterogenna
- Oznacza niekorzystny profil lipidowy, zwykle z podwyższonym poziomem cholesterolu całkowitego i trójglicerydów i niskim poziomem cholesterolu HDL.
Epidemiologia
- W ogólnopolskich badaniach NATPOL i WOBASZ częstość występowania hipercholesterolemii oszacowano odpowiednio na 59,5% wśród mężczyzn i 62% wśród kobiet w badaniu NATPOL oraz odpowiednio na 67% i 64% w badaniu WOBASZ.1,4
- W przedstawionych wynikach badania NATPOL stwierdzono, że hipertrójglicerydemia występuje u 30% badanych, częściej wśród mężczyzn niż kobiet (38% vs 23%).1 Natomiast w przypadku badania WOBASZ u 31% mężczyzn oraz 20% kobiet zaobserwowano nieprawidłowe stężenie TG.4
- W kolejnym badaniu – NATPOL 2011 – średnie stężenia lipidów, dla mężczyzn i kobiet, wynosiły odpowiednio: TC – 197,1 mg/dl (5,1 mmol/l) i 198,6 mg/dl (5,1 mmol/l), LDL–C – 123,6 mg/dl (3,2 mmol/l) i 123,7 mg/dl (3,2 mmol/l), HDL–C – 45,8 mg/dl (1,2 mmol/l) i 54,1 mg/dl (1,4 mmol/l), TG – 140,9 mg/dl (1,6 mmol/l) i 104,0 mg/dl (1,2 mmol/l). Stężenie cholesterolu całkowitego (total cholesterol – TC) powyżej normy: TC >190 mg (4,9 mmol/l) stwierdzono u 54,3% badanej populacji (54,4% kobiet i 54,3% mężczyzn).5
- W badaniu WOBASZ II, przeprowadzonym 2 lata później, hipercholesterolemię stwierdzono u 67,1% ogółu badanej populacji (tj. 70,3% mężczyzn i 64,3% kobiet), a hipertrójglicerydemię z prawidłowym stężeniem cholesterolu u 5,6% mężczyzn i 2,4% kobiet.6
- W najnowszych ogólnopolskich badaniach LIPIDOGRAM2015 i LIPIDOGEN2015, przeprowadzonych w latach 2015–2016 dotyczących rozpowszechnienia i leczenia dyslipidemii wśród pacjentów (n = 13 724) zgłaszających się do lekarzy POZ, wykazano brak istotnej poprawy opisywanej powyżej sytuacji epidemiologicznej zaburzeń lipidowych w Polsce.7-9
- Mimo coraz większej świadomości wśród pacjentów i lekarzy, różnice pomiędzy Polską a Europą Zachodnią w profilaktyce pierwotnej i wtórnej chorób sercowo–naczyniowych i modyfikacji czynników ich ryzyka (w tym zaburzeń lipidowych), nadal pozostają bardzo duże.10
Dzieci i młodzież
- Dokładne dane epidemiologiczne nie są dostępne.
- W licznych publikacjach z ostatnich lat zwraca się uwagę na znaczące zmiany stężenia cholesterolu u dzieci i młodzieży w związku ze wzrostem i rozwojem fizycznym, który przebiega inaczej u dziewcząt i chłopców.
- Leczenie dyslipidemii u dzieci i młodzieży powinno obejmować szeroką edukację zdrowotną, zmiany stylu życia oraz farmakoterapię. Edukacja powinna dotyczyć wszystkich członków rodziny dziecka.
- Hipercholesterolemia rodzinna (familial hipercholesterolemia – FH) jest jednym z najczęstszych wrodzonych zaburzeń metabolicznych; może objawiać się w bardzo zróżnicowany sposób, a zapadalność w populacji polskiej wynosi około 1:250.
Etiologia i patogeneza
- Przyczyny zaburzeń metabolizmu lipidów są różnorodne
- dyslipidemia pierwotna: dziedziczna
- dyslipidemia wtórna: następstwo innej choroby.
- Hipercholesterolemia może przyczynić się do rozwoju miażdżycy i jej powikłań, tj. chorób sercowo–naczyniowych (np. udaru mózgu i zawału serca).
- Patofizjologia miażdżycy charakteryzuje się procesami zapalnymi, których konsekwencją jest dysfunkcja śródbłonka i tworzenie się blaszek miażdżycowych.
Dyslipidemie pierwotne (przykłady)
Hipercholesterolemia poligeniczna
- W hipercholesterolemii poligenicznej uwarunkowania genetyczne nie są dominujące, a hiperlipidemia nie występuje stale u członków rodziny.
- Penetracja genu hipercholesterolemii zależy od diety i stylu życia osoby dotkniętej chorobą.
- Zwiększenie stężenia cholesterolu we krwi jest mniejsze niż w hipercholesterolemii rodzinnej i nie występuje ksantomatoza ścięgien, jednak ryzyko choroby niedokrwiennej serca jest również duże.
Hipercholesterolemia rodzinna (familial hipercholesterolemia – FH)
- Dziedziczona autosomalnie dominująco mutacja w genie receptora LDL
- Zmniejszenie liczby receptorów LDL w wątrobie.
- Już we wczesnym dzieciństwie następuje znaczący wzrost stężenia cholesterolu całkowitego (najczęściej >300 mg/dl) oraz cholesterolu LDL (najczęściej >200 mg/dl).
- W postaci homozygotycznej (bardzo rzadkiej, zapadalność 1:160 000–1:300 000)
- Ciężka hipercholesterolemia (zwykle >600 mg/dl).
- W razie braku leczenia często występuje zawał mięśnia sercowego przed 20. rokiem życia.
Rodzinny defekt apolipoproteiny B
- Współczynnik chorobowości w Europie Środkowej wynosi 1:200–1:700.
- Nieprawidłowości strukturalne apolipoproteiny B powodują jej nieskuteczne wiązanie z receptorem LDL.
- Fenotyp i ryzyko sercowo–naczyniowe są porównywalne do hipercholesterolemii rodzinnej.
Hiperlipidemia wtórna, przykładowe przyczyny
- Cukrzyca.
- Niedoczynność tarczycy.
- Zaburzenia nerek i wątroby.
- Spożywanie nadmiernej ilości alkoholu.
- Tiazydy.
- Beta–blokery.
- Glikokortykosteroidy.
- Estrogeny.
- Ciąża.
- Nadmierna podaż wysokotłuszczowych pokarmów/przekąsek.
- Nadwaga, otyłość.
- Choroby autoimmunologiczne, np. toczeń rumieniowaty układowy (SLE).
ICD–10
- E78 Zaburzenia metabolizmu lipoprotein i inne lipidemie.
- E78.0 Czysta hipercholesterolemia.
- E78.1 Czysta hiperglicerydemia.
- E78.2 Hiperlipidemia mieszana.
- E78.3 Hiperchylomikronemia.
- E78.4 Inne hiperlipidemie.
- E78.5 Hiperlipidemia, nieokreślona.
- E78.6 Niedobór lipoprotein.
- E78.8 Inne zaburzenia przemian lipoprotein.
- E78.9 Zaburzenia przemian lipoprotein, nieokreślone.
- H02.6 Kępki żółte.
Diagnostyka
Kryteria diagnostyczne
- Lipidogram należy oznaczyć u następujących pacjentów:
- W przypadku objawowej choroby wieńcowej.
- Przy innych chorobach naczyniowych o podłożu miażdżycowym
- chromanie przestankowe (claudicatio intermittens)/choroba tętnic obwodowych (peripheral arterial disease – PAD)
- udar/przemijający atak niedokrwienny (transient ischaemic attack – TIA)
- miażdżyca tętnic szyjnych.
- Przy zwiększonym ryzyku sercowo–naczyniowym
- U osób z ≥1 czynnikiem ryzyka, np. palenie papierosów, nadciśnienie tętnicze, cukrzyca, dodatni wywiad rodzinny (choroba naczyniowa u krewnych 1. stopnia: mężczyźni do 55. r.ż., kobiety do 65. r.ż.), nadwaga z odkładaniem tkanki tłuszczowej w okolicy jamy brzusznej lub otyłość.
- U kobiet z nadciśnieniem tętniczym w ciąży lub cukrzycą ciążową.
- U mężczyzn z zaburzeniem wzwodu.
- Systematyczne oznaczanie stężenia lipidów u bezobjawowych osób mężczyzn >40 r.ż. i kobiet >50 r.ż. bez rozpoznanej choroby sercowo-naczyniowej l/lub cukrzycy przyczynia się do lepszej kontroli ryzyka, jednak jego wpływ na efekty leczenia pozostaje niepewny.11
Hipercholesterolemia rodzinna (familial hypercholesterolemia – FH)
- Rozpoznanie FH bazuje na holenderskiej skali (Dutch Lipid Clinic Network – DLCN), której to kryteria zostały przyjęte w Genewie w 1998 roku przez WHO (TABELA 1).12
- Dodatkowo można się posłużyć kryteriami Simone Broome Register Group opierającymi się na oznaczeniach stężenia lipidów w surowicy krwi przed rozpoczęciem terapii, stwierdzeniu obecności żółtaków ścięgien w badaniu przedmiotowym oraz rodzinnym wywiadzie dotyczącym przedwczesnego wystąpienia zawału serca i/lub hipercholesterolemii.13
- Za pomocą wyżej wymienionych skal możemy ocenić rozpoznanie FH na pewne, prawdopodobne lub możliwe.
- W diagnostyce należy również pamiętać o wykluczeniu wtórnych przyczyn hipercholesterolemii, tj. niedoczynności tarczycy, która może prowadzić do znacznego wzrostu poziomu cholesterolu i skutkować szkodliwym wpływem na układ krążenia w przypadkach, gdy TSH osiąga poziom >10 mU/l. Ten rodzaj hipercholesterolemii jest często odwracalny dzięki substytucji lewotyroksyny.
Wywiad lekarski
- Wywiad rodzinny:
- zwiększone stężenie LDL u najbliższych krewnych
- choroba naczyniowa przed 55. (mężczyźni) lub 60. (kobiety) rokiem życia u krewnych pierwszego stopnia.
- Leki, których działaniami niepożądanymi może być dyslipidemia, np.:
- tiazydy
- beta–blokery
- glikokortykosteroidy.
- Choroby przewlekłe, które mogą być wtórną przyczyną dyslipidemii, np.:
- cukrzyca
- niedoczynność tarczycy
- zaburzenia czynności nerek i wątroby.
- Styl życia
- palenie tytoniu
- nawyki żywieniowe
- spożywanie alkoholu
- aktywność fizyczna.
Badanie fizykalne
Przesłanki wskazujące na hipercholesterolemię rodzinną
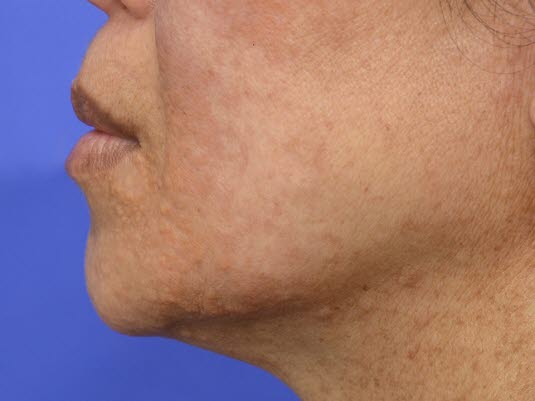
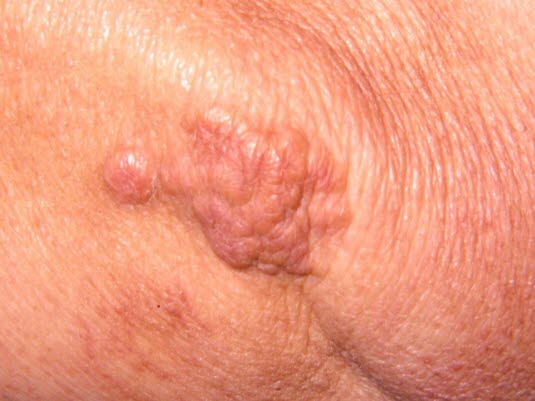
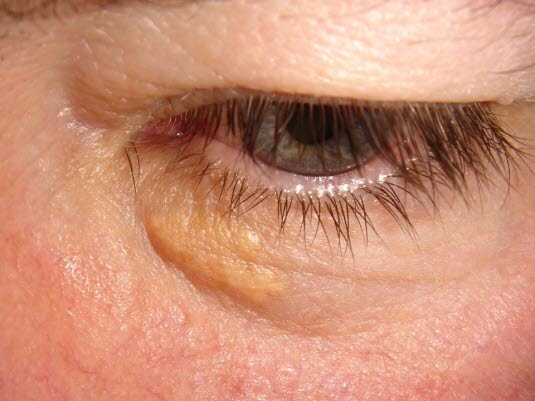
- Żółtaki, in. kępki żółte (ksantomy, xanthoma)
- miejscowe nacieki z zawierających lipidy „komórek piankowatych”, głównie na powiece (ksantelazmy, xantelasma)14
- wydają się być niezależnym czynnikiem ryzyka miażdżycowej choroby sercowo–naczyniowej, niezależnie od stężenia lipidów.
- żółtawe, guzkowe złogi lipidowe w skórze i ścięgnach
- częste lokalizacje w ścięgnie Achillesa i w ścięgnach powyżej paliczków
- żółtak jest twardy w dotyku, może ulec zapaleniu i doprowadzić do zapalenia pochewki ścięgnistej.
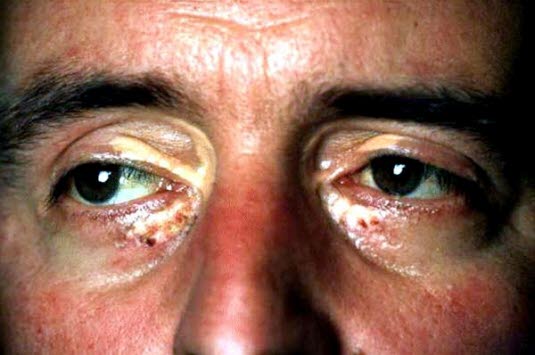
- Rąbek rogówkowy (arcus corneae)
- wąski, białawy pierścień złogów lipidowych w rogówce
- w przypadku pojawienia się przed 45. rokiem życia, stanowy jedno z kryteriów rozpoznania rodzinnej hipercholesterolemii
- nie wydaje się być niezależnym czynnikiem ryzyka choroby wieńcowej.14
- Wartości predykcyjne
- rąbek rogówkowy i kępki żółte nie są swoiste dla rodzinnej hipercholesterolemii, ale występują w tej postaci wcześniej niż w przypadku innych hipercholesterolemii.
Badanie w kierunku możliwych przyczyn wtórnej hiperlipidemii
- Obraz kliniczny mogący wskazywać na:
- Niedoczynność tarczycy
- zmęczenie
- przyrost masy ciała
- depresyjny nastrój
- wrażliwość na zimno
- zaparcia.
- Cukrzyca
- wielomocz
- polidypsja
- utrata masy ciała.
- Zaburzenia funkcji nerek i wątroby
- zmęczenie
- obrzęki
- wodobrzusze
- rumień dłoni/podeszw
- naczyniaki gwiaździste (spider naevi).
- Niedoczynność tarczycy
Badania laboratoryjne w praktyce lekarza rodzinnego
Lipidogram
- Pobieranie krwi na czczo nie jest bezwzględnie konieczne do oznaczeń stężenia cholesterolu całkowitego, HDL i LDL, ale do oznaczenia trójglicerydów już tak.
- Stężenie lipidów we krwi często oznacza się wraz ze stężeniem glukozy we krwi, warto więc pobrać krew, zanim pacjent zje pierwszy posiłek.
- Oznacza się następujące wartości:
- cholesterol całkowity
- cholesterol HDL – niezbędny do oszacowania ryzyka sercowo–naczyniowego na podstawie stosunku cholesterolu całkowitego do HDL, czyli frakcji n–HDL cholesterolu
- cholesterol LDL – ustalenie wartości wyjściowej, służy do oceny skuteczności leczenia oraz uzyskania docelowych wartości terapeutycznych
- trójglicerydy – w przypadku podwyższenia transaminaz z nieznanej przyczyny i/lub zwiększonego ryzyka zapalenia trzustki.
Inne badania
- Glukoza na czczo
- w przypadku podejrzenia cukrzycy, stanu przedcukrzycowego, zespołu metabolicznego.
Ocena ryzyka sercowo–naczyniowego
- We wszystkich aktualnych wytycznych dotyczących zapobiegania chorobom układu krążenia o podłożu miażdżycowym (atherosclerotic cardiovascular disease – ASCVD) w praktyce klinicznej, zaleca się ocenę całkowitego ryzyka sercowo–naczyniowego.
- Profilaktyka ASCVD u danej osoby powinna uwzględniać indywidualne ogólne ryzyko sercowo–naczyniowe: im wyższe ryzyko, tym intensywniejsze działania należy podjąć.
- W ramach profilaktyki pierwotnej głównym czynnikiem wpływającym na podejmowaną decyzję powinno być ogólne, bezwzględne ryzyko chorób układu krążenia.
- Skala SCORE 2, i SCORE 2–OP (dla pacjentów powyżej 70. roku życia) pozwala oszacować 10-letnie ryzyko wystąpienia zakończonych i niezakończonych zgonem zdarzeń sercowo-naczyniowych. Są przeznaczone dla zdrowych osób bez rozpoznanej uprzednio ASCVD.
- Poprzednio używana skala POLSCORE (porównanie skal dostępne w TABELI 2) pozwala szacować 10-letnie ryzyko zgonu z przyczyn sercowo-naczyniowych.
- Uwzględnia się w nich następujące czynniki ryzyka:
- wiek
- płeć
- palenie papierosów
- skurczowe ciśnienie tętnicze
- nie–HDL cholesterol w SCORE 2; cholesterol całkowity w POLSCORE.
- Pacjentów można zakwalifikować do grupy niskiego–pośredniego, wysokiego i bardzo wysokiego ryzyka SN (małego lub umiarkowanego, dużego i bardzo dużego). Osoby z uprzednio rozpoznaną AVSCD, cukrzycą (DM), przewlekłą chorobą nerek (CKD), kwalifikują się do grup wysokiego lub bardzo wysokiego ryzyka SN.
- Polska należy do krajów wysokiego ryzyka SN, stąd też używana jest zwalidowana skala punktowa.15 (RYCINA 1)
Wskazania do skierowania do specjalisty
- Rozpoznanie i leczenie hiperlipidemii jest zazwyczaj zadaniem lekarza rodzinnego.
- Skierowanie do kardiologa, angiologa, endokrynologa lub genetyka jest konieczne tylko w wyjątkowych przypadkach, takich jak:.
- homozygotyczna hipercholesterolemia rodzinna
- ciężka hipertrójglicerydemia >900 mg/dl (>10,3 mmol/l)
- brak zadawalającej odpowiedzi na leczenie.
- Skierowanie do specjalistycznych poradni w przypadku konieczności przeprowadzenia aferezy lipidowej lub leczenia inhibitorami PCSK9 (najnowsza opcja leczenia zamiast aferezy LDL).
Leczenie
Ogólne informacje o leczeniu
- Decyzję o terapii obniżającej stężenie lipidów należy podjąć oszacowaniu całkowitego ryzyka sercowo-naczyniowego i uwzględnieniu wszystkich czynników ryzyka, a nie wyłącznie na podstawie podwyższonego stężenia lipidów.
- Wyjątki:
- jeśli występuje rodzinna hipercholesterolemia, zawsze należy zaproponować statyny.
- farmakoterapia statynami niemal zawsze jest niezbędna w profilaktyce wtórnej, czyli u osób po przebytym incydencie zercowo-naczyniowym.
- Przed rozpoczęciem przyjmowania leków obniżających stężenie lipidów, należy wykonać co najmniej 2 oznaczenia lipidów we krwi w odstępach 1–12 tygodni, z wyjątkiem okoliczności, w których zalecana jest natychmiastowa farmakoterapia, takich jak ostry zespół wieńcowy (acute coronary syndrome – ACS) oraz u pacjentów z bardzo wysokim ryzykiem. Ponadto należy wykluczyć niedoczynność tarczycy.
Zalecenia dotyczące terapii
Leczenie niefarmakologiczne
- Należy przekazać zalecenia dotyczące ćwiczeń, diety, zaprzestania palenia papierosów.
- Wszystkich pacjentów należy zachęcać do regularnej aktywności fizycznej
- Zaleca się, żeby osoby dorosłe niezależnie od wieku poświęcały co najmniej 150–300 minut tygodniowo na aerobową aktywność fizyczną o umiarkowanej intensywności lub 75–150 minut tygodniowo o dużej intensywności w celu zredukowania śmiertelności oraz chorobowości.
- Zaleca się całkowite zaprzestanie palenia papierosów.
- Dieta powinna być zróżnicowana i zgodna z zaleceniami diety śródziemnomorskiej. Dzienne spożycie soli kuchennej nie powinno przekraczać 5 g.
- Zaleca się także ograniczenie ilości spożywanego alkoholu.
Leczenie farmakologiczne
- Leczenie hipolipemizujące jest zalecane u pozornie zdrowych osób z podwyższonym stężeniem lipidów i bardzo wysokim ryzykiem sercowo-naczyniowym (SCORE2 ≥7,5% dla wieku <50 lat; SCORE2 ≥10% dla wieku 50–69 lat; SCORE2-OP ≥15% dla wieku ≥70 lat)
-
Leczenie hipolipemizujące należy rozważyć u pozornie zdrowych osób z podwyższonym stężeniem lipidów i wysokim ryzykiem sercowo-naczyniowym (SCORE2 2,5% do <7,5% dla wieku <50 lat; SCORE2 5% do <10% dla wieku 50–69 lat; SCORE2-OP 7,5 do <15% dla wieku ≥70 lat).
-
U osób < 70 r.ż. należy rozważyć obniżenie stężenia LDL cholesterolu początkowo <100 mg/dl (2,6 mmol/l), a w drugim kroku w zależności od ryzyka sercowo-naczyniowego do <70 mg/dl (1,8 mmol/l) dla ryzyka wysokiego lub <55 mg/dl (1,4 mmol/l) dla ryzyka bardzo wysokiego.
-
U osób ≥70 r.ż. można rozważyć obniżenie stężenia LDL cholesterolu <100 mg/dl (2,6 mmol/l).
-
U osób z rozpoznaną chorobą sercowo-naczyniową należy dążyć do 50% redukcji wyjściowego stężenia LDL cholesterolu i początkowo <70 mg/dl (1,8 mmol/l), a w drugim kroku <55 mg/dl (1,4 mmol/l).
-
Terapię statynami należy włączyć w przypadku hipercholesterolemii rodzinnej.
- Zalecenia ogólnomedyczne:
- Przed rozpoczęciem leczenia należy wykonać 2–krotnie lipidogram.
- Leczenie statynami zaczynamy w zależności od wyjściowego stężenia frakcji LDL–cholesterolu wybierając odpowiednią dawkę jednej z dostępnych statyn.
- W razie braku uzyskania docelowych wartości frakcji LDL–cholesterolu, należy zwiększyć dawkę, zamienić statynę na posiadającą silniejsze działanie hipolipemizujące lub dołączyć inny lek hipolipemizujący.
- Po włączeniu leczenia zaleca się wykonanie kontrolnego lipidogramu po 6 ±4 tygodniach. Taki odstęp czasu należy również zachować po modyfikacji leczenia.
- Jeśli uzyskano cel terapeutyczny, wystarczy kontrolować stężenie lipidów 1–2 razy w ciągu roku.
- Najczęstszym działaniem niepożądanym podczas leczenia statynami są dolegliwości ze strony układu mięśniowego, bóle mięśni, osłabienie siły mięśniowej. Rzadko występuje hepatotoksyczność i zwykle ma charakter przejściowy.
- Przed włączeniem statyny należy oznaczyć ALT, CK oraz rozważyć badanie HbA1c lub stężenie glukozy, a przed zastosowaniem fibratu należy oznaczyć ALT, CK oraz stężenie kreatyniny.
- Nie należy rozpoczynać leczenia, gdy CK ≥4 ULN (górna granica normy) lub ALT ≥3 razy ULN.
- Nie zaleca się rutynowego oznaczania CK i ALT. Badania wykonuje się, gdy pojawią się objawy mięśniowe lub wątrobowe.
- W przypadku nietolerancji statyn nie są dostępne żadne równoważne alternatywne opcje leczenia; należy wówczas zmniejszyć dawkę lub zastosować inną statynę, aż do uzyskania dobrej tolerancji terapii. W przypadku nietolerancji statyn należy rozważyć inne leki hipolipemizujące. Do oceny prawdopodobieństwa nietolerancji statyn możemy posłużyć się zmodyfikowaną skalą SAMS – Clinical Index.
- Zalecenia kardiologiczne:
- W zależności od ogólnego ryzyka sercowo–naczyniowego określa się stałe wartości docelowe poszczególnych lipidów.
- Zaleca się zwiększenie dawki statyny, aby osiągnąć wartości docelowe.
- Jeśli statyny nie wystarczają, aby osiągnąć wartość docelową, należy stosować w skojarzeniu dodatkowe leki (ezetymib, inhibitory PCSK9 lub leki wiążące kwasy żółciowe, fibraty).
- Podsumowanie leków dostępnych w terapii w zależności od ryzyka sercowo naczyniowego i intensywności terapii dostępne jest w TABELI 4.
- Dawki równoważne najpopularniejszych statyn dostępne są w TABELI 5.
- Wielkość spodziewanej redukcji stężenia cholesterolu frakcji LDL w zależności od rodzaju i dawki statyny przedstawiono w TABELI 6.
Wnioski
- Leczenie statynami może być zasadne, jeśli spełnione są następujące warunki:
- brak przesłanek wskazujących na wtórną hiperlipidemię lub nieskuteczność/brak opcji terapii przyczynowej
- bezwzględne ryzyko sercowo–naczyniowe w okresie 10 lat jest umiarkowane lub powyżej albo występuje potwierdzona hipercholesterolemia rodzinna
- informacja o skutkach długotrwałej terapii i zgoda pacjenta na jej stosowanie
- potwierdzenie tolerancji i sprawdzenie terapii skojarzonej
- u osób w stanie terminalnym i leczonych paliatywnie decyzje należy podejmować indywidualnie
Zalecenia pediatryczne
- Diagnostyka
- W przypadku wskazań w wywiadzie dotyczących możliwości wystąpienia dziedzicznej postaci hiperlipidemii w rodzinie, oznaczenie lipidów należy proponować w każdym wieku, z reguły od 2. roku życia.
- Jednorazowe oznaczenie cholesterolu w ramach badań przesiewowych należy rozważyć u każdego dziecka (najlepiej w wieku przedszkolnym) lub nastolatka niezależnie od wywiadu rodzinnego, ponieważ u większości dzieci z wyraźną hipercholesterolemią nie wykrywa się jej poprzez diagnostykę opartą wyłącznie na wywiadzie rodzinnym.
- Leczenie
- Hiperlipidemię należy diagnozować i leczyć w dzieciństwie i młodości, aby zmniejszyć ryzyko długotrwałych skutków zdrowotnych.
- Zmiana stylu życia i diety
- U dzieci i młodzieży z cholesterolem LDL powyżej odpowiedniego dla wieku zakresu referencyjnego i prawidłowym cholesterolem HDL, należy od 2. roku życia wdrożyć odpowiednią dla wieku modyfikację diety w celu obniżenia cholesterolu LDL.
- W przypadku otyłych pacjentów utrata masy ciała często prowadzi do normalizacji stężenia lipidów i należy do niej dążyć.
- Regularna aktywność fizyczna/sportowa wspomagająca terapię żywieniową jest absolutnie konieczna, zwłaszcza w przypadku nadwagi i otyłości.
- Farmakoterapia
- W przypadku pierwotnej prewencji sercowo–naczyniowej rozpoczęcie farmakoterapii wskazane jest po 6 miesiącach, jeśli zmiany stylu życia nie są wystarczające.
- Terapię statynami należy rozważyć u dzieci w wieku ≥10 lat bez czynników ryzyka z utrzymującym się LDL–C >190 mg/dl, a z czynnikami ryzyka przy LDL–C >160 mg/dl, zaczynając od małej dawki statyny i stopniowo ją zwiększając.
- U dzieci z FH rozpoczęcie farmakoterapii można rozważyć w młodszym wieku, tj. po ukończeniu 8. roku życia.
- Leczenie farmakologiczne obniżające stężenie lipidów należy rozważyć u dzieci ≥8. roku życia, u których konsekwentnie realizowano przez od 3 do 6 miesięcy modyfikację stylu życia i diety oraz spełnione są następujące warunki:
- Cholesterol LDL >190 mg/dl (>4,9 mmol/l) bez dodatniego wywiadu rodzinnego i bez czynników wysokiego lub umiarkowanego ryzyka lub stanów związanych z ryzykiem SN.
- Cholesterol LDL ≥160 mg/dl (≥4,1 mmol/l) i dodatni wywiad rodzinny lub co najmniej 1 czynnik wysokiego ryzyka lub stan związany z wysokim ryzykiem, lub co najmniej 2 czynniki umiarkowanego ryzyka lub stany związane z umiarkowanym ryzykiem
- Celem terapii obniżającej stężenie LDL–C u dzieci i młodzieży jest uzyskanie stężenia LDL–C <130 mg/dl (< 3,4 mmol/l), a u dzieci z cukrzycą i FH <100 mg/dl (<2,6 mmol/l) oraz redukcja stężenia LDL–C o co najmniej 50%.
- U dzieci farmakoterapia powinna być prowadzona pod nadzorem lekarzy doświadczonych w leczeniu hiperlipidemii.
- Statyny są zalecane jako leki pierwszego rzutu dla dzieci i młodzieży z hipercholesterolemią i są dopuszczone do stosowania od 6. roku życia (pitawastatyna), 8. roku życia (prawastatyna) lub 10. roku życia (wybrane inne statyny).
- W razie nieskuteczności leczenia, włączenie ezetymibu powinno rozpocząć się w poradni specjalistycznej.
- W przeprowadzonych badaniach z alirokumabem i ewolokumabem zarówno u dzieci z homo–, jak i heterozygotyczną postacią FH, dostępne wyniki wskazują na bezpieczeństwo inhibitorów PCSK9 w populacji dziecięcej i ich dużą skuteczność (redukcja LDL–C od 44,5% do 46%). Konieczne są jednak dalsze badania w tym obszarze.
- Wsparcie
- Dzieciom i młodzieży z hiperlipidemią oraz ich rodzicom należy zapewnić profesjonalne, empatyczne i dostosowane do wieku wyjaśnienia i rzetelne informacje.
- W razie potrzeby należy zaoferować dodatkowe wsparcie psychologiczne.
- Wymagane jest dostosowane do wieku, profesjonalne doradztwo żywieniowe i seria szkoleń prowadzonych przez dietetyka dziecięcego.
- Opieka nad pacjentami dotkniętymi chorobą powinna być prowadzona w ścisłej współpracy między pediatrami i lekarzami rodzinnymi oraz doświadczonym ośrodkiem leczenia chorób metabolicznych.
Szczególna charakterystyka terapii statynami
Interakcje leków
- Statyny są metabolizowane za pośrednictwem izoenzymów CYP, więc może wystąpić zwiększona częstość działań niepożądanych w przypadku kojarzenia statyn z lekami hamującymi CYP.
- Leki przeciwwskazane w terapii statynami:
- Kwas fusydowy w trakcie terapii i 7 dni po jej zakończeniu.
- Leki istotnie zwiększające ryzyko rabdiomiolizy: w przypadku konieczności stosowania łącznie należy rozważyć korzyści i ryzyko związane ze stosowaniem. W przypadku leków zwiększających stężenie statyn w osoczu, zalecana jest redukcja dawki m.in. takich leków jak:
- itrakonazol, ketokonazol, pozakonazol
- erytromycyna, klarytromycyna, telitromycyna (lek niedostępny w Polsce)
- inhibitory proteazy HIV
- cyklosporyna
- danazol.
- Leki, które można podawać, jeżeli dzienna dawka simwastatyny nie przekracza 10 mg:
- amiodaron
- werapamil
- diltiazem.
- Leki, które można podawać, jeżeli dzienna dawka simwastatyny nie przekracza 20 mg:
- amlodypina
- ranolazyna.
- Ponadto nie należy spożywać soku grejpfrutowego w dużych ilościach.
- Wszystkie statyny są przeciwwskazane w okresie ciąży i karmienia piersią.
Działania niepożądane
- Najczęstszym działaniem niepożądanym są objawy mięśniowe związane ze stosowaniem statyn (statin–associated muscle symptoms – SAMS). Stanowią one najczęstszą przyczyną przerwania terapii statynami. Czasami towarzyszy im wzrost stężenia kinazy kreatynowej (CK).
- Przejściowe zwiększenie stężenia enzymów wątrobowych (w tym szczególnie AlAT) jest zwykle odwracalne i nie prowadzi do trwałego uszkodzenia wątroby. Monitorowanie aktywności enzymów wątrobowych w trakcie terapii statynami nie jest konieczne.
- Potencjalne zwiększenie ryzyka wystąpienia cukrzycy nie powinno ograniczać terapii statynami, gdyż korzyści sercowo–naczyniowe są znacznie wyższe niż ryzyko wynikające z cukrzycy.15
- Prawdopodobnie istnieje również zwiększone ryzyko zaćmy, zwłaszcza w 1. roku leczenia (wskaźnik NNH – liczba osób leczonych przez 5 lat, zanim pojawi się niekorzystny punkt końcowy terapii: 33).15
Objawy mięśniowe związane ze stosowaniem statyn (statin–associated muscle symptoms – SAMS)
- Częstość występowania objawów mięśniowych związanych ze statynami wynosi co najmniej 5%.
- Typowo objawy dotyczą proksymalnych mięśni (symetryczny ból, napięcie, sztywność lub skurcze), którym może towarzyszyć ich osłabienie.
- Objawy pojawiają się zwykle po 4–6 tygodniach od rozpoczęcia terapii.
- SAMS mogą również wystąpić dopiero po kilku latach leczenia.
- Wiele dolegliwości można przypisać zakażeniom wirusowym, nieprzyzwyczajeniu do aktywności fizycznej oraz interakcjom z innymi lekami, szczególnie działającym hamująco na metabolizm statyn.
-
Czynniki zwiększające ryzyko wystąpienia SAMS to także m.in. zaawansowany wiek (powyżej 75 lat), płeć żeńska, upośledzenie funkcji nerek lub wątroby, niedoczynność tarczycy czy nadużywanie alkoholu.
- Zalecane postępowanie w przypadku wystąpienia SAMS
- Wstrzymanie przyjmowania leków z grupy statyn, rozważyć włączenie ezetymibu.
- Ponowne włączenie statyny po 2(–4) tygodniach.
- Ostrożna próba stosowania mniejszej dawki statyny pod ścisłą kontrolą objawów i kinazy kreatynowej (CK).
- Jeśli objawy ustępują po przerwie w leczeniu i nawracają po ponownym włączeniu leczenia, kolejnym krokiem jest ustalenie najwyższej tolerowanej dawki statyny.
- Zaleca się rozpoczęcie leczenia od bardzo małej dawki statyny, np. simwastatyny 10 mg. Ewentualnie pacjent może przyjmować statynę tylko co 2. dzień lub rzadziej (1–2 x w tygodniu).
- Ustalenie dawki wymaga czasu, gdyż nie należy zwiększać jej częściej niż co 2 tygodnie.
- Po optymalizacji leczenia poprzez zmianę statyny, dawki lub częstotliwości podawania, ponad 90% pacjentów z SAMS może być stale leczonych statyną.
Nietolerancja statyn
- Nietolerancję statyn można zdefiniować jako15:
- Niemożność tolerowania co najmniej 2 statyn – (1 w najmniejszej dawce i 2 w każdej dawce);
- Obecność potwierdzonych objawó niepożądanych po statynie i/lub istotny wzrost CK
- Zmniejszenie objawów i/lub spadek CK po zmniejszeniu dawki lub przerwaniu terapii (dechallenge),
- Występowanie objawów i/lub wzrost CK niezwiązane z innymi czynnikami/chorobami/lekami.
- Wyniki metaanalizy 176 badań z udziałem ponad 4 mln pacjentów wskazują, że całkowita częstość występowania nietolerancji statyn wynosi 9,1% (95% CI 8,0-10%). (RYCINA 2)16
Alternatywne opcje farmakoterapii
Ezetymib
- Ezetymib selektywnie hamuje jelitowe wchłanianie cholesterolu zarówno z diety, jak i wydzielanego przez wątrobę z żółcią.
- Ezetymib jest dopuszczony do stosowania w skojarzeniu ze statynami u pacjentów dużego, bardzo dużego i ekstremalnego ryzyka SN oraz w profilaktyce wtórnej u pacjentów z np. OZW, u których nie uzyskano wystarczającej odpowiedzi na leczenie statyną w monoterapii.
- Ezetymib dołączony do statyny powoduje obniżenie stężenia LDL–C o dalsze 15–20%.
- Ezetymib nie jest wskazany w monoterapii, z wyjątkiem niezwykle rzadkiej rodzinnej sitosterolemii, ze względu na brak dowodów dotyczących zmniejszenia liczby zdarzeń sercowo–naczyniowych.
- Według polskich wytycznych, ezetymib w monoterapii należy natychmiast rozważyć u pacjentów z całkowitą nietolerancją statyn.
- Szczególnie należy rozważyć zastosowanie ezetymibu w skojarzeniu ze statynami u pacjentów z wysokim i bardzo wysokim stężeniem cholesterolu LDL, u których nie można osiągnąć docelowego obniżenia stężenia cholesterolu LDL za pomocą odpowiednio dawkowanej statyny.
- W badaniu IMPROVE–IT wykazano, że ezetymib podawany w skojarzeniu ze statyną w prewencji wtórnej po OZW prowadził do obniżenia wskaźnika pierwszorzędowych punktów końcowych (zgon z przyczyn sercowo–naczyniowych, zawał serca, niestabilna dławica piersiowa, rewaskularyzacja lub udar mózgu) o 2% (z 35% w grupie placebo do 33% w grupie ezetymibu).17
- Oznacza to, że aby zapobiec wystąpieniu pierwszorzędowego punktu końcowego, leczenie musiałoby przyjmować 50 pacjentów przez 7 lat (wskaźnik NNT = 50).
Fibraty
- Aktywują wewnątrzkomórkowe receptory PPAR, co w efekcie powoduje nasilenie degradacji kwasów tłuszczowych w peroksysomach.
- Gemfibrozyl (lek niedostępny w Polsce), fenofibrat i bezafibrat (lek niedostępny w Polsce) są dopuszczone do stosowania w leczeniu ciężkiej hipertrójglicerydemii i hiperlipidemii mieszanej w razie nietolerancji statyn lub przeciwwskazań do ich stosowania.
- Fenofibrat jest dodatkowo dopuszczony do stosowania w leczeniu skojarzonym ze statynami.
- Pozytywny efekt leczenia występuje prawdopodobnie w szczególności u mężczyzn z cukrzycą i dyslipidemią złożoną (cholesterol HDL >40 mg/dl [1,0 mmol/l], trójglicerydów >200 mg/dl, [2,3 mmol/l]).18
- Występuje co prawda mniej zdarzeń sercowo–naczyniowych, ale nie wykazano żadnego wpływu na dalszą długość życia.
Przeciwciała anty–PCSK9 (ewolokumab, alirokumab) oraz inklisiran
- PCSK9 to proteaza serynowa (enzym), która nasila degradację receptorów cholesterolu LDL na hepatocytach.
- Przeciwciała dezaktywują ten enzym i sprawiają, że receptory LDL nie ulegają degradacji, skutkując większym wchłanianiem cholesterolu LDL z krwi.
- W kilku badaniach z randomizacją wykazano, że ewolokumab znacząco zmniejsza stężenie cholesterolu LDL (o 60% więcej niż placebo), jeżeli jest podawany w skojarzeniu ze statyną u pacjentów z rodzinną hipercholesterolemią oraz w skojarzeniu ze standardowym leczeniem u pacjentów z chorobami układu krążenia.
- Alirokumab (przeciwciało anty–PCSK9) znacząco obniżył stężenie cholesterolu LDL w ciągu 52 tygodni leczenia w porównaniu z terapią maksymalną dawką statyny lub terapią skojarzoną statyną i ezetymibem. Nie ustalono, czy ma to również istotny wpływ na twarde kliniczne punkty końcowe.
- Inklisiran to tzw. krótki interferujący RNA – dwuniciowa cząsteczka RNA, której podstawowym mechanizmem działania jest hamowanie syntezy białka PCSK9, a w konsekwencji zmniejszanie stężenia LDL–C.
- Aktualnie stosowanie inhibitorów PCSK9 oraz inklisiranu jest dostępne w ramach programu lekowego NFZ B.101 Leczenie pacjentów z zaburzeniami lipidowymi. Placówki biorące udział w programie są dostępne na stronie Polskiego Towarzystwa Lipidologicznego.
Inne leki w leczeniu zaburzeń lipidowych
- Żywice jonowymienne (cholestyramina, kolestipol, kolesewelam)
- Wiążą w jelicie kwasy żółciowe, co zmniejsza ich krążenie jelitowo–wątrobowe i zmniejszają stężenie LDL–C w surowicy.
- Leczenie w monoterapii należy rozważyć u pacjentów, którzy nie tolerują statyn i można rozważyć w terapii skojarzonej, jeżeli przy maksymalnych dawkach statyn nie udaje się osiągnąć celu terapeutycznego.
- Są bezpieczne u kobiet w ciąży i w okresie karmienia piersią.
- Kwasy omega–3 (ikozapent etylowy)
- Mechanizm działania słabo poznany, są prekursorami eikozanoidów.
- Można rozważyć zastosowanie kwasów omega–3 w skojarzeniu ze statyną u pacjentów z grupy co najmniej dużego ryzyka sercowo–naczyniowego i z TG ≥200 mg/dl (2,3 mmol/l) pomimo leczenia statynami.
- Kwas bempediowy
- Obniża stężenie LDL–C przez hamowanie syntezy cholesterolu w wątrobie.
- Można rozważyć zastosowanie w terapii skojarzonej u pacjentów z FH i/lub ASCVD, którzy nie osiągają celu przy maksymalnej tolerowanej dawce statyny i ezetymibu.
- Nowe leki
- apabetalon
- wolanesorsen
- ewinakumab.
Zalecenia dla pacjentów
- Ćwiczenia: regularna aktywność fizyczna (efektów można się spodziewać już po 15 minutach ćwiczeń o umiarkowanej intensywności dziennie lub 90 minutach takich ćwiczeń tygodniowo).
- Dieta: dieta śródziemnomorska (jak najmniejsza zawartość tłuszczów nasyconych)
- codziennie: zboża, warzywa, owoce, 1,5–2l wody i niesłodzonej herbaty, nabiał, oliwa z oliwek, oliwki, orzechy, ziarna/nasiona, przyprawy takie jak zioła, czosnek czy cebula (w celu ograniczenia spożycia soli)
- co tydzień: ryby/owoce morza, białe mięso, jaja, ziemniaki
- jedynie okazjonalnie: słodycze, ciasta/ciastka, soki owocowe, napoje gazowane, umiarkowane spożycie alkoholu do 1 kieliszka wina dziennie (kobiety) lub 2 kieliszków wina dziennie (mężczyźni), czerwone mięso (w miarę możliwości całkowicie unikać mięsa przetworzonego przemysłowo).
- Zaprzestanie palenia papierosów.
Dowody dotyczące profilaktyki pierwotnej z zastosowaniem statyn
- Korzyści ze stosowania statyn w profilaktyce pierwotnej są tym większe, im wyższe ryzyko wystąpienia choroby sercowo–naczyniowej.
- W przeglądzie Cochrane stwierdzono następujące efekty profilaktyki pierwotnej z zastosowaniem statyn w stałej dawce u pacjentów z grupy wysokiego ryzyka:19
- zmniejszenie śmiertelności ogólnej (zmniejszenie ryzyka względnego o 14%)
- zmniejszenie śmiertelności z przyczyn sercowych (o 18%)
- zmniejszenie liczby zdarzeń sercowych (o 27%)
- zmniejszenie liczby zdarzeń mózgowych (o 22%)
- zdarzeń sercowo–naczyniowych łącznie (o 25%).
Przebieg, powikłania i rokowanie
Przebieg
- Stężenie lipidów różni się w zależności od wieku i płci oraz regularnie wzrasta wraz z wiekiem.
Powikłania
- Zdarzenia sercowo–naczyniowe o podłożu miażdżycowym.
- Działania niepożądane farmakoterapii
- Bardzo wysokie stężenie trójglicerydów predysponuje do zapalenia trzustki.
Rokowanie
- Rokowanie zależy zarówno od stężenia cholesterolu, jak i od ogólnego ryzyka wystąpienia chorób układu krążenia (patrz akapit ocena ryzyka sercowo–naczyniowego).
Dalsze postępowanie w ramach farmakoterapii
Profil lipidowy
- Przed rozpoczęciem leczenia należy wykonać 2–krotnie lipidogram.
- Leczenie statynami należy zaczynać w zależności od wyjściowego stężenia frakcji LDL–cholesterolu wybierając odpowiednią dawkę 1 z dostępnych statyn.
- W razie braku uzyskania docelowych wartości frakcji LDL–cholesterolu, należy:
- zwiększyć dawkę
- zamienić statynę na posiadającą silniejsze działanie hipolipemizujące (patrz TABELA 5 Dawki równoważne najpopularniejszych statyn) lub
- dołączyć inny lek hipolipemizujący.
- W razie braku uzyskania docelowych wartości frakcji LDL–cholesterolu, należy:
- Po włączeniu leczenia zaleca się wykonanie kontrolnego lipidogramu po 6 ±4 tygodniach. Taki odstęp czasu należy również zachować po modyfikacji leczenia.
- Jeśli uzyskano cel terapeutyczny, wystarczy kontrolować stężenie lipidów 1–2 x w ciągu roku (chyba, że występują problemy z przestrzeganiem zaleceń lub inne szczególne powody uzasadniające częstsze oznaczenia).
Enzymy wątrobowe (ALT)
Przed leczeniem
- Przed włączeniem statyny należy oznaczyć ALT, CK oraz rozważyć badanie HbA1c lub stężenia glukozy, a przed zastosowaniem fibratu należy oznaczyć ALT, CK oraz stężenie kreatyniny.
- Nie należy rozpoczynać leczenia, gdy CK ≥4 ULN lub ALT ≥3 x górnej granicy normy.
- Nie zaleca się rutynowego oznaczania CK i ALT w trakcie leczenia. Badania należy wykonać, gdy pojawią się objawy mięśniowe lub sugerujące zaburzenie funkcji/uszkodzenie wątroby.
W trakcie leczenia
- Podczas leczenia fibratami zalecane jest monitorowanie poziomu ALT.
- Co robić, jeżeli u pacjentów przyjmujących leki obniżające poziom lipidów wzrasta poziom enzymów wątrobowych?
- Bezobjawowy wzrost stężenia aminotransferaz w przebiegu terapii występuje rzadko (<1%) i zwykle ma charakter przejściowy.
- Jeśli ALT wzrośnie do poziomu nieprzekraczającego 3–krotności GGN
- Kontynuowanie terapii.
- Oznaczanie enzymów wątrobowych co 4–6 tygodni.
- Jeśli poziom ALT jest co najmniej 3–krotnie wyższy (≥3 x) od górnej granicy przedziału referencyjnego:
- Należy przerwać terapię obniżającą stężenie lipidów lub zmniejszyć dawkę i w ciągu 4–6 tygodni ponownie oznaczyć poziom enzymów wątrobowych.
- Po unormowaniu ALT można rozważyć ostrożne wznowienie terapii.
- Jeśli ALT pozostaje podwyższone, należy szukać innych przyczyn.
Enzymy mięśniowe (CK)
Przed rozpoczęciem leczenia
- Jeśli wartość wyjściowa CK przekracza czterokrotność (>4 x) górnej granicy przedziału referencyjnego, nie należy rozpoczynać farmakoterapii; powtórzyć oznaczenie CK.
Monitorowanie podczas leczenia
- Rutynowe monitorowanie CK nie jest wymagane.
- Należy monitorować CK u pacjentów, u których występuje mialgia (Uwaga: objawy mięśniowe związane ze stosowaniem statyn!).
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Nadwaga i redukcja masy ciała
Ilustracje
Źródła
Wytyczne
- Wytyczne ESC dotyczące prewencji chorób układu sercowo-naczyniowego w praktyce klinicznej. Tłumaczenie polskie dostępne na stronie Polskiego Towarzystwa Kardiologicznego, ptkardio.pl
- Wytyczne ESC dotyczące postępowania w dyslipidemiach. Tłumaczenie polskie dostępne na stronie Polskiego Towarzystwa Kardiologicznego, ptkardio.pl
- Banach M., Burchardt P., Chlebus K. et al. Wytyczne PTL/KLRwP/PTK/PTDL/PTD/PTNT diagnostyki i leczenia zaburzeń lipidowych w Polsce 2021, Lekarz POZ 4/2021, termedia.pl
Piśmiennictwo
- Jóźwiak J. Dyslipidemie. W: Windak A., Mastalerz-Migas A., Chlabicz S. (red.). Medycyna rodzinna. Podręcznik dla lekarzy i studentów. Termedia, Poznań 2015, www.termedia.pl
- Durrington P. Dyslipidaemia, Lancet. 2003, 362(9385): 717-31, doi:10.1016/S0140-6736(03)14234-1, pubmed.ncbi.nlm.nih.gov
- Szczeklik A., Gajewski P. Interna Szczeklika 2022, Medycyna Praktyczna, 2022, www.mp.pl
- Pająk A., Wiercińska E., Polakowska M. i wsp. Rozpowszechnienie dyslipidemii u mężczyzn i kobiet w wieku 20-74 lat w Polsce. Wyniki programu WOBASZ, Kardiol Pol 2005, 63 (supl. 4): 620-6.
- Zdrojewski T., Solnica B., Cybulska B. i wsp. Prevalence of lipid abnormalities in Poland. The NATPOL 2011 survey, Kardiol Pol 2016, 74: 213-23, PubMed
- Pająk A., Szafraniec K., Polak M. i wsp. Changes in the prevalence, management and treatment of hypercholesterolemia and other dyslipidemias over 10 years in Poland. The WOBASZ study, Pol Arch Med Wewn 2016, 126: 642-52, PubMed
- Jóźwiak J.J., Studziński K., Tomasik T. i wsp.; LIPIDOGRAM2015 Investigators. The prevalence of cardiovascular risk factors and cardiovascular disease among primary care patients in Poland: results from the LIPIDOGRAM2015 Study. Atheroscler Suppl 2020, 42: 15-24.
- Jóźwiak J.J., Kasperczyk S., Tomasik T. i wsp. Design and rationale of a nationwide screening analysis from the LIPIDOGRAM2015 and LIPIDOGEN2015 studies, Arch Med Sci 2020, doi.org
- Harrison S.L., Lane D.A., Banach M. i wsp. Lipid levels, atrial fibrillation and the impact of age: results from the LIPIDOGRAM2015 study, Atherosclerosis 2020, 312: 16-22, PubMed
- Gańczak M., Miazgowski T., Kożybska M. i wsp. Changes in disease burden in Poland between 1990-2017 in comparison with other Central European countries: a systematic analysis for the Global Burden of Disease Study 2017, PLoS One 2020, 15: e0226766.
- Patel R, Barnard S, Thompson K, et al. Evaluation of the uptake and delivery of the NHS Health Check programme in England, using primary care data from 9.5 million people: a cross-sectional study. BMJ Open. 2020 Nov 5;10(11):e042963. doi: 10.1136/bmjopen-2020-042963. PMID: 33154064; PMCID: PMC7646358. pubmed.ncbi.nlm.nih.gov
- Nordestgaard B.G., Chapman M.J., Humphries S.E., et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society, European heart journal. 2013, 34: 3478-90a, pubmed.ncbi.nlm.nih.gov
- Austin M.A., Hutter C.M., Zimmern R.L., Humphries S.E. Genetic causes of monogenic heterozygous familial hypercholesterolemia: a HuGE prevalence review, American journal of epidemiology, 2004, 160: 407-20, pubmed.ncbi.nlm.nih.gov
- Christoffersen M., Frikke-Schmidt R., Schnohr P., et al. Xanthelasmata, arcus corneae, and ischaemic vascular disease and death in general population: prospective cohort study, BMJ 2011, 343: d5497, pubmed.ncbi.nlm.nih.gov
- Banach M., Cybulska B., Burchardt P et al. PTL/KLRWP/PTK/PTDL/PTD/PTNT wytyczne diagnostyki i leczenia zaburzeń lipidowych w Polsce 2021. Nadciśnienie tętnicze w Praktyce. 2021, tom 7, nr 3: 113–222, www.termedia.pl
- Bytyçi I, Penson PE, Mikhailidis DP et al. Prevalence of statin intolerance: a meta-analysis. Eur Heart J. 2022 Sep 7;43(34):3213-3223. doi: 10.1093/eurheartj/ehac015. PMID: 35169843; PMCID: PMC9757867. pubmed.ncbi.nlm.nih.gov
- Cannon C.P., Blazing M.A., Giugliano RP, et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes, N Engl J Med. 2015, 372(25): 2387-97, doi:10.1056/NEJMoa1410489, pubmed.ncbi.nlm.nih.gov
- Bruckert E., Labreuche J., Deplanque D., Touboul P.J., Amarenco P. Fibrates effect on cardiovascular risk is greater in patients with high triglyceride levels or atherogenic dyslipidemia profile: a systematic review and meta-analysis, J Cardiovasc Pharmacol. 2011, 57(2): 267-72, doi:10.1097/FJC.0b013e318202709f, pubmed.ncbi.nlm.nih.gov
- Taylor F., Huffman M.D., Macedo A.F., et al. Statins for the primary prevention of cardiovascular disease, Cochrane Database Syst Rev. 2013, 2013(1): CD004816, 31.01.2013, doi:10.1002/14651858.CD004816.pub5, DOI
- Hippisley-Cox J., Coupland C. Unintended effects of statins in men and women in England and Wales: population based cohort study using the QResearch database, BMJ. 2010, 340: c2197, Published 20.05.2020, doi:10.1136/bmj.c2197, pubmed.ncbi.nlm.nih.gov
Opracowanie
- Anna Pachołek (recenzent)
- Tomasz Tomasik (redaktor)
- Lino Witte (recenzent/redaktor)
- Günther Egidi (recenzent/redaktor)
