Streszczenie
- Definicja:Złośliwy nowotwór żołądka. W 95% przypadków jest to gruczolakorak.
- Częstość występowania:Zapadalność wynosi ok. 14 na 100 000 kobiet i ok. 22 na 100 000 mężczyzn.
- Objawy:Często pojawiają się dopiero w zaawansowanym stadium z dysfagią, wymiotami, brakiem apetytu lub utratą masy ciała.
- Obraz kliniczny:Objawy niedokrwistości, kacheksji, ewentualnie tkliwość nadbrzusza.
- Diagnostyka:Biopsja i potwierdzenie histopatologiczne za pomocą gastroskopii.
- Terapia:Leczenie dostosowane do stadium choroby, resekcja chirurgiczna jako jedyna opcja leczenia.
Informacje ogólne
Definicja
- Nowotwór złośliwy żołądka
- Rozwój możliwy w proksymalnej (podsercowej), środkowej jednej trzeciej (dno i trzon) i dystalnej części (antrum) żołądka
- w części podsercowej płynne przejście do guzów przejścia żołądkowo-przełykowego (guz AEG typu III wg Siewerta).
- Nowotwory żołądka i połączenia przełykowo-żołądkowego są jednymi z najczęstszych przyczyn zgonów związanych z nowotworami na całym świecie.
- guz bezobjawowy przez długi czas
- rozpoznanie często dopiero w zaawansowanym i nieoperacyjnym stanie
- Guzy dzieli się na stadia w zależności od stopnia naciekania i rozprzestrzeniania się.
- Endoskopowe badania przesiewowe populacji ogólnej w celu wykrycia raka żołądka nie są zalecane.
- zbyt niska ogólna zapadalność
Klasyfikacja TNM
- Patrz tabela Rak żołądka, klasyfikacja TNM.
Stopnie zaawansowania1
- Patrz tabela Rak żołądka, stopnie zaawansowania według FIGO.
Częstość występowania
- Zapadalność w Europie Środkowej
- ok. 14 na 100 000 kobiet
- ok. 22 na 100 000 mężczyzn.
- Śmiertelność
- Rak żołądka jest 6. najczęstszą przyczyną zgonów z powodu raka u kobiet i 5. u mężczyzn.
- Ogólnoświatowa tendencja
- stały spadek zachorowalności i śmiertelności w krajach uprzemysłowionych od dziesięcioleci.
- Typ histopatologiczny
- 95% guzów to gruczolakoraki, pozostałe to guzy neuroendokrynne i guzy podścieliskowe przewodu pokarmowego.
Etiologia i patogeneza
- Zakłada się, że kolejność rozwoju gruczolakoraka jest następująca: atrofia - metaplazja - dysplazja - neoplazja.2-3
- Przyczyną rozwoju raka żołądka może być zakażenie, styl życia i/lub czynniki genetyczne.
- Najważniejszym czynnikiem ryzyka jest zakażenie bakterią Helicobacter pylori.
- Ryzyko zachorowania na raka żołądka jest w tym przypadku 3-krotnie wyższe.4-5
- Natomiast ryzyko wystąpienia raka wpustu jest niższe (OR = 0,3).6
- 87,8% pacjentów z wczesnym rakiem żołądka jest zakażonych bakterią Helicobacter pylori.7
- Wykrycie antygenu CagA/VacA w szczepach Helicobacter pylori jest często związane z przewlekłym zapaleniem żołądka, dysplazją i rakiem żołądka, ale nie ze zmianami przedrakowymi.8-10
- Styl życia
- Palenie tytoniu, spożywanie alkoholu, wysokie BMI lub związana z nadwagą choroba refluksowa odpowiadają za ponad 70% przypadków raka żołądka.11-12
- Dieta
- Inhibitory pompy protonowej
- Brak dowodów klinicznych na to, że inhibitory pompy protonowej zwiększają ryzyko raka żołądka.
- Choroba refluksowa żołądkowo-przełykowa
- prawdopodobny związek z gruczolakorakiem połączenia żołądkowo-przełykowego.
- Czynniki genetyczne
- Krewni pierwszego stopnia osób chorych mają od 2 do 3 razy wyższe ryzyko niż ogólna populacja.
- dziedziczny rozsiany rak żołądka (mutacja genu CDH1): w ok. 1% wszystkich przypadków raka żołądka13
- Nosicielom genu należy zaoferować profilaktyczną gastrektomię od 20 roku życia.
- HNPCC (zespół Lyncha): ryzyko raka żołądka zwiększone o 2-9%14
- Po ukończeniu 35. roku życia oprócz kolonoskopii należy regularnie wykonywać badanie endoskopię górnego odcinka przewodu pokarmowego (esophago-gastro-duodenoscopy - EGD).
- zespół Peutza-Jeghersa (ZPJ): ryzyko raka żołądka zwiększone o 29%15
- grupa krwi A.
Typy histologiczne: podział według lokalizacji
- Nowotwory zlokalizowane w promieniu 5 cm powyżej i poniżej wpustu nazywane są gruczolakorakami połączenia przełykowo-żołądkowego (Adenocarcinoma of the Esophagogastric Junction – AEG). Są one podzielone na trzy typy:
- AEG I: rak dystalnego odcinka przełyku
- AEG II: rak wpustu
- AEG III: rak podwpustowy/rak dna żołądka.
Typy histologiczne: podział według histologii
- Gruczolakoraki stanowią 95% wszystkich raków żołądka.
- Klasyfikacja WHO
- typ brodawkowaty, cewkowy lub śluzowy lub rak sygnetowatokomórkowy.16
- Klasyfikacja Lauréna
- typ jelitowy (54%)
- rozwija się ze zmian przedrakowych, jest lepiej zróżnicowany, gruczołowy i ma ograniczony kształt
- typ rozlany (32%)
- występuje rodzinnie i nie rozwija się ze zmian przedrakowych
- pozostałe 14 % nieokreślone typy mieszane.
- typ jelitowy (54%)
- Makroskopowa klasyfikacja zaawansowanego raka żołądka według Borrmanna uwzględnia różne stopnie naciekania:
- typ I: polipowato-egzofityczny
- typ II: owrzodzenie o ostrym odgraniczeniu
- typ III: rozległe owrzodzenie
- typ IV: naciekanie rozlane.
- Rzadziej występujące nowotwory żołądka (około 5%) obejmują raka drobnokomórkowego, guzy podścieliskowe przewodu pokarmowego, guzy neuroendokrynne, mięśniakomięsaki gładkokomórkowe i chłoniaki.16,17
- Badanie HER2 (Human Epidermal Grothfactor 2) jest zalecane u pacjentów z zaawansowanym rakiem żołądka i przy rozważaniu leczenia celowanego.18
Czynniki predysponujące
- Zakażenie Helicobacter pylori.
- Starszy wiek, płeć męska, palenie tytoniu, spożywanie alkoholu.
- Predyspozycje rodzinne.
- Wcześniejsze operacje żołądka (pacjenci po resekcji metodą Billroth II).
- Wysokie spożycie słonych pokarmów.19-20
- Wysokie spożycie żywności z dużą zawartością składników pochodzenia zwierzęcego.
- Niski status społeczno-ekonomiczny.
- Niedokrwistość Addisona-Biermera.
- Nadwaga.
ICD-10
- C16 Nowotwór złośliwy żołądka
- C16.0 Wpust
- C16.1 Dno żołądka
- C16.2 Trzon żołądka
- C16.3 Ujście odźwiernika
- C16.4 Odźwiernik
- C16.5 Krzywizna mniejsza żołądka, umiejscowienie nieokreślone
- C16.6 Krzywizna większa żołądka, umiejscowienie nieokreślone
- C16.8 Zmiana przekraczająca granice jednego umiejscowienia w obrębie żołądka
- C16.9 Żołądek, umiejscowienie nieokreślone.
Diagnostyka
Kryteria diagnostyczne
- Pacjenci z co najmniej jednym z poniższych objawów alarmowych powinni zostać skierowani na wczesną EGD z biopsją:
- dysfagia
- nawracające wymioty
- brak apetytu
- stały ból w nadbrzuszu
- niewyjaśniona utrata masy ciała
- krwawienie z przewodu pokarmowego
- niewyjaśniona niedokrwistość z niedoboru żelaza.
Diagnostyka różnicowa
- Choroba wrzodowa.
- Dyspepsja.
- Achalazja.
- Zapalenie żołądka.
- Choroba Ménétriera
- hiperplazja błony śluzowej żołądka.
- Chłoniak MALT.
- Inne nowotwory złośliwe.
Wywiad lekarski
- Objawy są niejasne i różnią się w zależności od lokalizacji guza. Do 80% pacjentów znajduje się w długiej fazie bezobjawowej na początku choroby.
- W późniejszym przebiegu pojawiają się objawy wymienione powyżej w kryteriach diagnostycznych.
- Wrzodziejące zmiany mogą prowadzić do ostrego krwawienia z przewodu pokarmowego i wynikających z niego krwawych wymiotów i smolistych stolców.
- Niedrożność odźwiernika prowadzi do wymiotów po posiłkach.
- Niedrożność w dolnej części przełyku może prowadzić do narastającej dysfagii.
Badanie przedmiotowe
- Badanie fizykalne
- Objawy niedokrwistości lub wyniszczenia?
- Tkliwość w nadbrzuszu?
- Wyczuwalne powiększone węzły chłonne?
- węzeł chłonny Virchowa w lewym dole nadobojczykowym
- ostatni węzeł chłonny w przebiegu przewodu piersiowego, często powiększony w przypadku guzów wewnątrz jamy brzusznej.
- Zwykle brak specyficznych objawów klinicznych.
Badania w gabinecie lekarza rodzinnego
- Endoskopia górnego odcinka przewodu pokarmowego -biopsja wszystkich podejrzanych zmian.
- Morfologia krwi.
Diagnostyka specjalistyczna
Ocena stopnia zaawansowania
- Przerzuty odległe należy wykluczyć za pomocą USG, TK klatki piersiowej i TK jamy brzusznej, w tym miednicy.
- Badanie ultrasonograficzne
- USG jamy brzusznej
- pierwsza procedura obrazowania do wykrywania przerzutów do wątroby
- USG szyi
- w przypadku raka połączenia przełykowo-żołądkowego w celu wykrycia przerzutów do węzłów chłonnych
- W przypadku raka żołądka można ją przeprowadzić, jeśli istnieje kliniczne podejrzenie przerzutów do węzłów chłonnych.
- USG jamy brzusznej
- Endosonografia przezustna
- pomiar głębokości penetracji guza i badanie miejscowych węzłów chłonnych.
- Scyntygrafia kości
- tylko z odpowiednimi objawami klinicznymi.
- PET-CT
- metoda niezalecana.
- Laparoskopia
- w celu wykluczenia przerzutów do wątroby i otrzewnej w zaawansowanych stadiach (cT3, cT4).
- Laparoskopowa ocena stopnia zaawansowania jest w stanie wykryć 92% zaawansowanych raków żołądka.21
Badania przesiewowe
- Populacyjne endoskopowe badania przesiewowe w celu wczesnego wykrywania raka żołądka nie są zalecane.
- Nie należy wykonywać serologicznych badań przesiewowych bezobjawowej populacji w kierunku H. pylori, EBV i patologicznych pepsynogenów w surowicy.
Wskazania do skierowania do specjalisty
- W każdym przypadku podejrzenia lub rozpoznania.
Leczenie
Cele leczenia
- Terapia lecznicza we wczesnym stadium.
- Jeśli nie jest to możliwe, należy zastosować leczenie paliatywne:
- przedłużenie życia
- poprawa jakości życia
- złagodzenie objawów
- maksymalne ograniczenie skutków ubocznych.
Ogólne informacje o leczeniu
- Multidyscyplinarne planowanie terapii przez wykwalifikowany zespół onkologiczny
- wydawanie zaleceń dotyczących terapii dostosowanej do stadium choroby.
- Immunoterapia (pembrolizumab, niwolumab, ipilimumab) jest dla pacjentów bezpłatna, po spełnieniu określonych kryteriów w ramach programu lekowego B.58 (Leczenie chorych na raka przełyku, połączenia żołądkowo-przełykowego i żołądka).22
- O ile to możliwe, leczenie w ramach badań klinicznych.
Leczenie chirurgiczne
- Standardowa terapia wszystkich potencjalnie resekcyjnych raków żołądka.
- Celem leczenia chirurgicznego raka żołądka jest całkowite usunięcie guza i regionalnych węzłów chłonnych z potwierdzonymi histologicznie wolnymi od nowotworu proksymalnymi, dystalnymi i obwodowymi marginesami resekcji (R0).
Wczesny rak
- Endoskopowa resekcja en bloc możliwa w następującym przypadku:
- nowotwory śródnabłonkowe (tzw. dysplazje) dowolnej wielkości oraz wczesne raki żołądka spełniające wszystkie cztery z poniższych kryteriów:
- <2 cm średnicy
- bez owrzodzeń
- rak błony śluzowej
- typ jelitowy lub histologiczny stopień zróżnicowania dobry bądź umiarkowany (G1/G2).
- nowotwory śródnabłonkowe (tzw. dysplazje) dowolnej wielkości oraz wczesne raki żołądka spełniające wszystkie cztery z poniższych kryteriów:
- Pacjenci leczeni za pomocą resekcji endoskopowej powinni być objęci nadzorem endoskopowym w ramach obserwacji onkologicznej.
Choroba miejscowo zaawansowana
- U większości pacjentów choroba jest miejscowo zaawansowana w momencie rozpoznania.
- W przypadku miejscowo zaawansowanej, ale potencjalnie resekcyjnej (stadium IB-III), standardowym leczeniem jest dodatkowa chemoterapia przed- i pooperacyjna.
Resekcja lub gastrektomia
- Zakres resekcji jest określany na podstawie lokalizacji guza, kategorii TNM i typu histologicznego (typ jelitowy lub rozlany według klasyfikacji Lauréna).
- proksymalna bezpieczna odległość w żołądku wynosząca 5 cm (typ jelitowy wg Lauréna) lub 8 cm (typ rozlany wg Lauréna).
- Laparoskopowa lub otwarta resekcja równoważna pod względem onkologicznym.
Operacja paliatywna
- W wyjątkowych przypadkach istnieje wskazanie do operacji paliatywnej.
Limfadenektomia
- W zabiegu leczniczym wykonuje się zmodyfikowane preparowanie węzłów chłonnych D2 (przedział I i II).
- Aby uzyskać status pN0, co najmniej 16 regionalnych węzłów chłonnych musi zostać zbadanych histologicznie i musi być wolnych od komórek nowotworowych.
Niepełna resekcja
- W pierwszej kolejności należy rozważyć możliwość przeprowadzenia leczniczej resekcji.
- Jeśli resekcja nie jest możliwa, pooperacyjną radiochemioterapię można przeprowadzić zgodnie z konsensusem interdyscyplinarnego konsylium onkologicznego.
Rekonstrukcja
- Obecnie nie ma ogólnie przyjętego standardu rekonstrukcji po gastrektomii lub subtotalnej dystalnej resekcji żołądka.
- Na całym świecie preferowana jest wyłączana pętla Roux.
Nawrót
- W przypadku izolowanego nawrotu miejscowego można przeprowadzić nową operację.
Przerzuty
- W indywidualnych przypadkach tylko ograniczone przerzuty wykryte śródoperacyjnie mogą być wycinane, jeśli R0 jest resekcyjny.
Chemioterapia
Chemioterapia okołooperacyjna
- Wskazana w stadiach IB-III.
- Obecnie schemat FLOT (5-fluorouracyl/kwas folinowy/oksaliplatyna/docetaksel) zapewnia najdłuższe przeżycie wolne od progresji i przeżycie całkowite.
Chemioterapia neoadiuwantowa
- Celem jest zmniejszenie rozmiaru guza przed operacją i osiągnięcie lepszej resekcyjności.
- Po zakończeniu leczenia przedoperacyjnego należy przeprowadzić ponowną ocenę stopnia zaawansowania w celu oceny odpowiedzi na leczenie za pomocą TK i EGD.
- W przypadku miejscowej progresji guza podczas leczenia neoadiuwantowego należy je przerwać i przeprowadzić wczesną operację.
Chemioterapia uzupełniająca
- Po chemioterapii przedoperacyjnej i późniejszej operacji decyzje dotyczące chemioterapii pooperacyjnej powinny być podejmowane interdyscyplinarnie.
- Decyzja ta powinna uwzględniać stopień regresji, odpowiedź kliniczną, tolerancję chemioterapii i ogólny stan fizyczny.
Chemioterapia paliatywna
- Pacjentom w dobrym ogólnym stanie fizycznym (ECOG 0-1, Eastern Co-operative Oncology Group: 0 = brak ograniczenia aktywności lub 1 = ograniczenie związane z wysiłkiem fizycznym), należy zaproponować chemioterapię systemową.
- Celem terapii jest poprawa przeżywalności i utrzymanie jakości życia.
- Podeszły wiek nie jest przeciwwskazaniem.
- Wskazana w przypadku miejscowo zaawansowanej nieoperacyjnej lub przerzutowej choroby.
- Terapię należy rozpocząć jak najszybciej po postawieniu rozpoznania.
- Podczas trwającej chemioterapii paliatywnej ponowna ocena kliniczna i odpowiednie badania obrazowe powinny być wykonywane co 6-12 tygodni, aby w porę wykryć negatywny rozwój choroby i nie narażać pacjentów na nieskuteczne terapie przez niepotrzebnie długi czas lub dać im szansę na bardziej skuteczne terapie.
- Przed zastosowaniem paliatywnej medycznej terapii nowotworów należy określić status HER-2 (Human Epidermal Growthfactor 2) jako pozytywny czynnik predykcyjny dla terapii trastuzumabem.
- Standardową chemioterapią w leczeniu paliatywnym jest podwójna chemioterapia oparta na platynie i fluoropirymidynie.
- w zależności od statusu Her2/neu, w razie potrzeby dodatkowo trastuzumab
Chemioterapia drugiego rzutu
- Chemioterapia drugiego rzutu jest wskazana, jeśli ogólny stan fizyczny pacjenta jest dobry. Schemat leczenia opiera się na odpowiedniej wcześniejszej terapii.
Ostateczna radiochemioterapia
- W przypadku funkcjonalnej nieoperacyjności pacjenta lub nieresekcyjności miejscowo ograniczonego gruczolakoraka żołądka lub połączenia przełykowo-żołądkowego można przeprowadzić ostateczną radiochemioterapię.
Terapie niekonwencjonalne
- Chińskie mieszanki ziołowe nie powinny być stosowane w przypadku raka żołądka.
- Probiotyki mogą być stosowane w przypadku biegunki. Jednak ze względu na pojedyncze przypadki sepsy w trakcie chemioterapii/immunosupresji, wskazania powinny być ściśle regulowane.
- W celu złagodzenia bólu związanego z rakiem można stosować akupunkturę w ramach wielospecjalistycznego programu leczniczego.
- Metody oparte na technikach koncentracyjnych / medycyna umysłu i ciała mogą być stosowane w sposób uzupełniający w celu poprawy jakości życia oraz złagodzenia lęku i stresu.
Zalecenia dla pacjentów
- Stan odżywienia wszystkich pacjentów onkologicznych, począwszy od diagnozy, powinien być oceniany przy każdym przyjęciu do szpitala i kontakcie ambulatoryjnym, aby móc rozpocząć interwencje na wczesnym etapie.
- Wszystkim pacjentom powinno się oferować kinezyterapię.
- Poza tym powinni oni mieć dostęp do informacji przez cały czas trwania choroby i leczenia, w zależności od potrzeb.
- Opieka psychoonkologiczna poprzez odpowiednie profesjonalne wsparcie powinna być integralną częścią diagnostyki onkologicznej, terapii i opieki pooperacyjnej przez cały okres trwania choroby.
Inne metody leczenia paliatywnego
- Objawowe zwężenie guza
- możliwości leczenia: założenie stentu, wykonanie gastroenterostomii, przetoka żywieniowa jelita czczego lub radioterapia paliatywna
- W wyjątkowych przypadkach konieczna może być paliatywna częściowa resekcja żołądka.
- Krwotok z guza
- W zależności od lokalizacji i nasilenia krwotoku można rozważyć angiograficzną embolizację lub paliatywną resekcję.
- W przypadku przewlekłego krwawienia sączącego można zastosować radioterapię paliatywną.
Artykuły na temat paliatywnej kontroli objawów
- Ból.
- Nudności i wymioty.
- Zaparcia.
- Niedrożność o charakterze złośliwym.
- Suchość w ustach.
- Kacheksja i odwodnienie.
- Trudności z oddychaniem.
- Depresja.
- Lęk.
- Majaczenie.
Opieka po zakończeniu leczenia
- Ustrukturyzowana opieka po zakończeniu leczenia obejmuje kontrolę kliniczną, kontrolę endoskopową i kontrolę za pomocą obrazowania.
- Przez pierwsze 2 lata kontrole powinny odbywać się w odstępach co najmniej sześciomiesięcznych, a następnie corocznie do 5. roku.
- Po gastrektomii należy stosować regularną pozajelitową suplementację witaminy B12 przez całe życie.
- U pacjentów ze stolcami tłuszczowymi należy stosować suplementację enzymów trzustkowych.
Zapobieganie
- Eradykację H.pylori w celu zapobiegania rakowi żołądka należy przeprowadzić u następujących osób z grupy ryzyka:
- zapalenie żołądka wysokiego ryzyka (zapalenie trzonu i całego żołądka)
- krewni pierwszego stopnia pacjentów z rakiem żołądka
- wcześniejsze nowotwory żołądka (gruczolak żołądka, chłoniak MALT).
- Opcjonalnym wskazaniem jest rozległa atrofia lub metaplazja jelitowa.
- ASA lub NLPZ nie powinny być stosowane w profilaktyce raka żołądka.
- Styl życia
- Ograniczenie czynników ryzyka wymienionych w sekcji Etiologia, w tym:
- zaprzestanie palenia
- regularna aktywność fizyczna
- utrata masy ciała w przypadku nadwagi
- unikanie produktów zawierających składniki pochodzenia zwierzęcego lub o wysokiej zawartości soli.
- Ograniczenie czynników ryzyka wymienionych w sekcji Etiologia, w tym:
Przebieg, powikłania i rokowanie
Powikłania
- Niedożywienie.
- Niedrożność.
- zwężenie połączenia żołądkowo-przełykowego
- zwężenie odźwiernika żołądka.
- Krwawienia.
- Perforacja.
- Niedrożność jelita cienkiego.
- Refluks.
- Wczesne lub późne zespoły poposiłkowe po operacji żołądka.
- Wodobrzusze.
Rokowanie
- Rokowanie w przypadku raka żołądka zależy od lokalizacji guza, głębokości miejscowego naciekania, zajęcia naczyń, dysocjacji komórek nowotworowych na froncie naciekania, zajęcia węzłów chłonnych i obecności odległych przerzutów. Ogólnie rzecz biorąc, jest ono niekorzystne.
- U pacjentów w stadium II-III obserwuje się niski wskaźnik 5-letniego przeżycia i wysokie ryzyko nawrotu lub przerzutów pomimo resekcji leczniczej.
- Względny wskaźnik 5-letniego przeżycia wynosi obecnie około 34% dla kobiet i 32% dla mężczyzn.
- Rokowanie jest mniej korzystne dla typu histologicznie rozlanego niż dla typu jelitowego. Gruczolakoraki śluzowe i raki sygnetowatokomórkowe mają szczególnie złe rokowanie.23-25
- Zajęcie węzłów chłonnych i przerzuty, zwłaszcza przerzuty do wątroby i kości lub rakowatość otrzewnej, pogarszają rokowanie.26-28
Informacje dla pacjentów
Informacje dla pacjentów w Medibas
Leczenie paliatywne przy zaawansowanej chorobie nowotworowej
- Opieka paliatywna.
- Leczenie lęku u osób chorych na raka.
- Leczenie bólu.
- Nudności i wymioty.
- Zaparcia.
- Suchość w ustach
- Trudności z oddychaniem.
- Utrata masy ciała i kacheksja.
- Depresja.
- Majaczenie.
Ilustracje
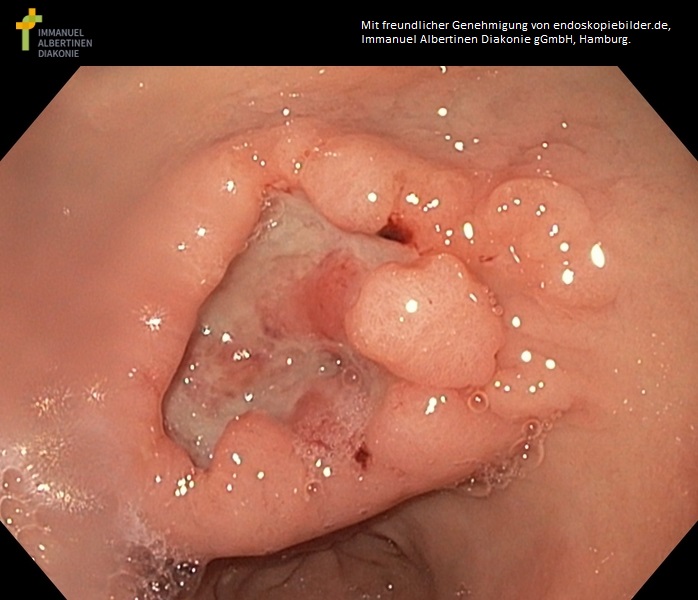
Wrzodziejący rak jamy odźwiernikowej (dzięki uprzejmości endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
Żołądek, przegląd

Badanie ultrasonograficzne: Niskoechowe nieregularne zgrubienie ściany żołądka spowodowane rakiem jamy odźwiernikowej (dzięki uprzejmości sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg).
Źródła
- Richter P, Wallner G, Zegarski W et al. Polski konsensus diagnostyki i leczenia raka żołądka – aktualizacja 2022. Pol Przegl Chir 2022; 94(4): 53-60. pph.pl
Piśmiennictwo
- American Joint Committee on Cancer (AJCC). Cancer Staging Manual. 7 ed. Springer, 2010.
- Kuipers EJ. Review article: Exploring the link between Helicobacter pylori and gastric cancer. Aliment Pharmacol Ther 1999; 13 (suppl 1): 3-11. www.ncbi.nlm.nih.gov
- Schaffalitzky de Muckadell OB. Ulcus pepticum og cancer ventriculi - infektionssygdomme fremkaldt af Helicobacter pylori?. Ugeskr Læger 2002; 164, nr. 50: portal.findresearcher.sdu.dk
- Wu I-C, Wu D-C, Yu F-J, Wang J-Y, Kuo C-H, Yang S-F, Wang C-L, Wu M-T.. Association between Helicobacter pylori seropositivity and digestive tract cancers. World J.Gastroenterol 2009; 15(43): 5465-71. pmid:19916178 PubMed
- Cavaleiro-Pinto M, Peleteiro B, Lunet N, Barros H.. Helicobacter pylori infection and gastric cardia cancer: systematic review and meta-analysis. Cancer Causes Control 2011; 22(3): 375-87. pmid:21184266 PubMed
- Kamangar F, Dawsey SM, Blaser MJ, Perez-Perez GI, Pietinen P, Newschaffer CJ, Abnet CC, Albanes D, Virtamo J, Taylor PR.. Opposing risks of gastric cardia and noncardia gastric adenocarcinomas associated with Helicobacter pylori seropositivity. J.Natl.Cancer Inst. 2006; 98(20): 1445-52. pmid:17047193 PubMed
- Wang C, Yuan Y, Hunt RH.. The association between Helicobacter pylori infection and early gastric cancer: a meta-analysis. Am J Gastroenterol 2007; 102(8): 1789-98. pmid:17521398 PubMed
- Palli D, Masala G, Del Giudice G, Plebani M, Basso D, Berti D, Numans ME, Ceroti M, Peeters PHM, Bueno de Mesquita HB, et al.. CagA+ Helicobacter pylori infection and gastric cancer risk in the EPIC-EURGAST study. Int.J.Cancer 2007; 120(4): 859-67. pmid:17131317 PubMed
- Plummer M, van Doorn LJ, Franceschi S, Kleter B, Canzian F, Vivas J, Lopez G, Colin D, Munoz N, Kato I.. Helicobacter pylori cytotoxin-associated genotype and gastric precancerous lesions. J.Natl.Cancer Inst. 2007; 99(17): 1328-34. pmid:17728213 PubMed
- Suriani R, Colozza M, Cardesi E, Mazzucco D, Marino M, Grosso S, Sanseverinati S, Venturini I, Borghi A, Zeneroli ML.. CagA and VacA Helicobacter pylori antibodies in gastric cancer. Can.J.Gastroenterol 208; 22(3): 255-8. pmid:18354754 PubMed
- Olsen CM, Pandeya N, Green AC, Webb PM, Whiteman DC. Population attributable fractions of adenocarcinoma of the esophagus and gastroesophageal junction. Am.J.Epidemiol 2011; 174(5): 582-90. pmid:21719746 PubMed
- Gonzalez CA, Lopez-Carrillo L. Helicobacter pylori, nutrition and smoking interactions: Their impact in gastric carcinogenesis. Scand J Gastroenterol 2010; 45(1): 6-14. pmid:20030576 PubMed
- Sharma RR, London MJ, Magenta LL, Posner MC, Roggin KK. Preemptive Surgery for premalignant foregut lesions. J.Gastrointest.Surg 2009; 13(10): 1874-87. pmid:19513795 PubMed
- Watson P, Vasen HFA, Mecklin JP, Bernstein I, Aarnio M, Jarvinen HJ, Myrhoj T, Sunde L, Wijnen JT, Lynch HT. The risk of extra-colonic, extra-endometrial cancer in the Lynch syndrome. Int.J.Cancer 2008; 123(2): 444-9. pmid:18398828 PubMed
- van Lier MGF, Wagner A, Mathus-Vliegen EMH, Kuipers EJ, Steyerberg EW, van Leerdam ME. High cancer risk in Peutz-Jeghers syndrome: a systematic review and surveillance recommendations. Am J Gastroenterol 2010; 105(6): 1258-64. pmid:20051941 PubMed
- Hamilton SR, Aaltonen LA. Pathology and Genetics of Tumours of the Digestive System. Lyon: IARC Press, 2000.
- Okines A, Verheij M, Allum W, Cunningham D, Cervantes A. Gastric cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann.Oncol. 2010 2010; 21 Suppl 5: v50-v54. pmid:20555102 PubMed
- Bartley AN, Washington MK, Colasacco C et al. HER2 Testing and Clinical Decision Making in Gastroesophageal Adenocarcinoma: Guideline From the College of American Pathologists, American Society for Clinical Pathology, and the American Society of Clinical Oncology. J Clin Oncol 2017 Feb; 35(4): 446-464. pmid:28129524 PubMed
- Ge S, Feng X, Shen L, Wei Z, Zhu Q, Sun J. Association between habitual dietary salt intake and risk of gastric cancer: A systematic review of observational studies. Gastroenterol.Res.Pract. 2012. pmid:23125851 PubMed
- D'Elia L, Rossi G, Ippolito R, Cappuccio FP, Strazzullo P. Habitual salt intake and risk of gastric cancer: a meta-analysis of prospective studies. Clin Nutr 2012; Aug;31(4): 489-98. pmid:22296873 PubMed
- Burke EC, Karpeh MS, Conlon KC, Brennan MF. Laparoscopy in the management of gastric adenocarcinoma. Ann Surg 1997; 225: 262-77. PubMed
- Ministerstwo Zdrowia. Obwieszczenie Ministra Zdrowia - lista leków refundowanych. www.gov.pl
- Gold JS, Al Natour RH, Saund MS, Yoon C, Sharma AM, Huang Q, Boosalis VA, Whang EE. Population-based outcome of stage IA-IIA resected gastric adenocarcinoma: Who should get adjuvant treatment?. Ann.Surg.Oncol 2013; 20(7): 2304-10. pmid:23344580 PubMed
- Liu L, Wang ZW, Ji J, Zhang JN, Yan M, Zhang J, Liu BY, Zhu ZG, Yu YY. A cohort study and meta-analysis between histopathological classification and prognosis of gastric carcinoma. Anticancer Agents Med.Chem 2013; 13(2): 227-34. pmid:22934699 PubMed
- Matsubara J, Shimada Y, Kato K, Nagai Y, Iwasa S, Nakajima TE, Hamaguchi T, Yamada Y, Takagi S, Kobayashi K, et al. Phase II study of bolus 5-fluorouracil and leucovorin combined with weekly paclitaxel as first-line therapy for advanced gastric cancer. Oncology 2011; 81(5-6): 291-7. www.ncbi.nlm.nih.gov
- Park SH, Cho MS, Kim YS, Hong J, Nam E, Park J, Cho EK, Shin DB, Lee JH, Lee WK. Self-reported health-related quality of life predicts survival for patients with advanced gastric cancer treated with first-line chemotherapy. Qual.Life Res 2008; 17(2): 207-14. www.ncbi.nlm.nih.gov
- Chau I, Norman AR, Cunningham D, Waters JS, Oates J, Ross PJ. Multivariate prognostic factor analysis in locally advanced and metastatic esophago-gastric cancer--pooled analysis from three multicenter, randomized, controlled trials using individual patient data. J.Clin.Oncol 2004; 22(12): 2395-403. www.ncbi.nlm.nih.gov
- McGuill MJ, Byrne P, Ravi N, Reynolds J. The prognostic impact of occult lymph node metastasis in cancer of the esophagus or esophago-gastric junction: systematic review and meta-analysis. Dis Esophagus 2008; 21(3): 236-40. PubMed
Autorzy
- Sławomir Chlabicz (redaktor)
- Lino Witte (recenzent/redaktor)
- Jutta Hübner (recenzent/redaktor}
