Streszczenie
- Definicja: Nowotworowa proliferacja niedojrzałych komórek progenitorowych (blastów) powstałych ze zmienionej nowotworowo komórki mieloidalnej i kumulacja ich w szpiku, ewentualnie z uwalnianiem do krwi obwodowej.
- Epidemiologia: Zapadalność w skali roku wynosi 3–4 przypadki na 100 000 osób i wzrasta wraz z wiekiem. Stanowią ok. 80% wszystkich białaczek u dorosłych.
- Objawy: Typowe objawy to zmęczenie i znużenie, zawroty głych, zasłabnięcia, częste zakażenia dróg oddechowych i spontaniczne krwawienia pod skórą i z błon śluzowych.
- Badanie fizykalne: Badanie może ujawnić bladość, plamicę i wybroczyny na skórze, powiększenie węzłów chłonnych i łagodną hepatosplenomegalię, nadżerki w jamie ustnej (owrzodzenia neutropeniczne).
- Diagnostyka: Obraz kliniczny, badania laboratoryjne, w tym badanie szpiku kostnego, ew. USG jamy brzusznej, RTG klatki piersiowej, EKG i USG serca.
- Leczenie: Dostosowane do ryzyka protokoły leczenia (ewentualnie w ramach badań klinicznych) w zależności od typu ostrej białaczki szpikowej (acute myleoid leukemia – AML), biologicznego wieku pacjenta i chorób współistniejących; mogą obejmować chemioterapię skojarzoną lub również allogeniczne przeszczepianie allogenicznych krwiotwórczych komórek macierzystych (allogenic stem cell transplantation – allo-HSCT) w trakcie leczenia.
Informacje ogólne
- Całą sekcję opracowano na podstawie niniejszego źródła literaturowego:1
Definicja
- Ostra białaczka szpikowa (acute myleoid leukemia – AML) to złośliwy nowotwór mielopoetycznej części układu krwiotwórczego ze zmiennym uczestnictwem mieloidalnych linii komórkowych, dominujących w szpiku i krwi, a także mogących tworzyć nacieki w różnych narządach upośledzając ich czynność.2
- Niejednorodne zaburzenie klonalne krwiotwórczych komórek progenitorowych (komórek blastycznych) i rzadziej komórek macierzystych
- zaburzenie różnicowania komórek
- zaburzenie regulacji proliferacji.3-4
- Przed wprowadzeniem skutecznych leków choroba zwykle prowadziła do zgonu w ciągu 1 roku z powodu zakażeń, krwawień i naciekania narządów.
- Podział na poszczególne grupy na podstawie morfologii i histochemii (zobacz poniżej).5
Epidemiologia
- Zapadalność 3–4 przypadki na 100 000 osób.
- Stanowią ok. 80% wszystkich białaczek u dorosłych.
- Mężczyźni chorują częściej niż kobiety (M:K = 4,56:3,0).
- Wzrost zapadalności wraz wraz z wiekiem.
Etiologia i patogeneza
- Cała sekcja została opracowana na podstawie niniejszego źródła literaturowego:1,7-8
- Pochodzenie: patologiczna proliferacja klonalnych komórek szpikowych
- głównie w wysoce proliferacyjnej puli progenitorów (tzn. CD34+/CD38+)
- rzadziej w puli komórek macierzystych (tzn. CD34+/CD38-).
- Proliferujący klon przerasta zdrowy szpik kostny i prowadzi do obniżenia zdrowej hematopoezy. Powoduje to:
- granulocytopenię (podatność na zakażenia, posocznicę)
- małopłytkowość (skłonność do krwawień)
- niedokrwistość (duszność, obniżoną wydolność).
- Różne istotne rokowniczo aberracje cytogenetyczne:
- translokacje genów, np.:
- translokacje t(8;21), t(15;17)
- inwersja inv(16)
- aberracje numeryczne, np.:
- trisomia 8
- monosomia 7
- zmiany złożone (>3 powtarzające się aberracje chromosomowe w 1 klonie).
- translokacje genów, np.:
- Heterogeniczność klonalna
- Nawet u 1 osoby choroba może obejmować genetycznie różne podklony.
- U około 50% pacjentów oprócz dominującego klonu głównego występuje co najmniej 1 inny podklon.
- Proporcje różnych klonów mogą zmieniać się w trakcie trwania choroby.
- We krwi obwodowej zmiany genów są często wykrywalne tylko w komórkach złośliwych.1,7
- Prawie zawsze co najmniej 1 mutacja w jednej z 9 grup funkcjonalnych krytycznych dla transformacji:
- aktywujące mutacje transdukcji sygnału (FLT3, KIT, KRAS, NRAS, itp.)
- mutacje mieloidalnych czynników transkrypcyjnych (RUNX1, CEBPA, itp.)
- fuzje genów czynników transkrypcyjnych (PML–RARA, MYH11–CBFB, itp.)
- mutacje modyfikatorów chromatyny (MLL–PTD, ASXL1, itp.)
- mutacje w kompleksie kohezyny (SMC1S i inne)
- mutacje spliceosomu
- mutacje w genach supresorowych nowotworów (TP53, WT1 itp.)
- mutacje NPM1
- mutacje w genach metylacji DNA (TET1, TET2, IDH1, IDH2, DNMT3B, DNMT1, DNMT3A).
Czynniki predysponujące
- Narażenie na:
- promieniowanie jonizujące9
- benzeny i inne rozpuszczalniki organiczne
- produkty naftowe
- farby
- tlenek etylenu (zatwierdzony do sterylizacji urządzeń medycznych i do 1990 r. do fumigacji środków spożywczych)
- herbicydy i środki owadobójcze.
- Palenie10
- Zwiększone ryzyko AML w porównaniu z osobami niepalącymi
- u aktywnych palaczy o 40%
- u byłych palaczy o 25%.
- Ryzyko koreluje z ilością wypalanych papierosów.
- Równie często u kobiet i u mężczyzn.
- Zwiększone ryzyko AML w porównaniu z osobami niepalącymi
- Leczenie cytostatykami11, np.:
- lekami alkilującymi
- początek białaczki 4–6 lat po narażeniu
- aberracje chromosomów 5 i/lub 7
- inhibitory topoizomerazy II
- antracykliny, antrachinony, epipodofilotoksyny
- początek białaczki 1–3 lat po narażeniu
- często aberracje chromosomu 11 w prążku q23
- ewentualnie zrównoważona translokacja t(1,17).
- lekami alkilującymi
- U niektórych pacjentów AML wykazuje związek z zespołami mielodysplastycznymi (MDS), np.:
- MDS w wywiadzie
- typowa dla MDS morfologia lub cytogenetyka.
- Czynniki genetyczne
- Zwiększone ryzyko w przypadku wrodzonych nieprawidłowości chromosomalnych (np. trisomii 21 lub niedokrwistości Fanconiego).
- Rodzinna kumulacja nie została udowodniona.
ICD–10
- C92 Białaczka szpikowa.
- C92.0 Ostra białaczka szpikowa.
- C92.2 Podostra białaczka szpikowa.
- C92.4 Ostra białaczka promielocytowa.
- C92.5 Ostra białaczka szpikowo–monocytowa.
- C92.7 Inna białaczka szpikowa.
- C92.9 Białaczka szpikowa, nieokreślona.
Diagnostyka
Kryteria diagnostyczne
- Definiujące chorobę (różnicowanie z MDS)
- Odsetek komórek blastycznych ≥20% we krwi obwodowej lub szpiku kostnym.
- Nie dotyczy białaczek z powtarzalnym aberracjami cytogenetycznymi: t(8;21), inv(16) lub t(15;17), w których stwierdzenie tych aberracji wystarcza do rozpoznania białaczki niezależnie od liczby blastów.12
- Odsetek komórek blastycznych ≥20% we krwi obwodowej lub szpiku kostnym.
- Typowe wyniki badań laboratoryjnych
- Krew obwodowa
- Cytopenia (niedokrwistość i/lub neutropenia i/lub małopłytkowość) lub pancytopenia.
- Liczba krwinek białych podwyższona do >20 tys./mcl
- Leukostaza przy dużej ilości komórek białaczkowych: zespół objawów (np. zaburzenia widzenia i/lub OUN, bóle głowy, niewydolność serca) związanych z zaburzeniami w przepływie krwi obwodowej na skutek nadmiernej lepkości wywołanej hiperleukocytozą.12
- U 40-50% chorych możliwa fizjologiczna leukocytoza lub leukopenia.12
- Głównie w przypadku AML wtórnej lub związanej z leczeniem oraz u starszych pacjentów.
- Uwaga: dla ostrej białaczki charakterystyczna jest tzw. przerwa białaczkowa (hiatus laukaemicus) w rozmazie krwinek białych, która polega na obecności we krwi obwodowej komórek blastycznych i resztkowych dojrzałych granulocytów oraz braku form o pośrednim stopniu dojrzałości.12
- Biopsja aspiracyjna, trepanobiopsja (przy braku możliwości wykonania biopsji aspiracyjnej), rozmaz szpiku kostnego (silnie zwiększona liczba komórek blastycznych)13-14 i badanie cytologiczne
- morfologia
- cytochemia
- immunofenotypowanie
- cytogenetyka i genetyka molekularna.
- Krew obwodowa
- Typowy obraz kliniczny (często tylko nieswoiste objawy na początku):
- niedokrwistość
- skłonność do krwawień
- podatność na zakażenia, w tym grzybicze.2
- Ewentualnie objawy pozaszpikowe (częste w AML różnicowanych na mielomonocytowe/monoblastyczne):
- nacieki skórne
- białaczka opon mózgowo–rdzeniowych
- przerost dziąseł
- owrzodzenia błony śluzowej jamy ustnej (owrzodzenia neutropeniczne)
- nacieki w śledzionie i wątrobie.
Klasyfikacja WHO
- Cała sekcja została opracowana na podstawie niniejszego źródła literaturowego:15
- Klasyfikacja WHO dzieli AML według etiologii na podstawie cytogenetycznej i molekularno–genetycznej charakterystyki komórek białaczkowych obecnych w szpiku kostnym. Na podstawie tego podziału chorobę można obecnie sklasyfikować u ponad 50% pacjentów. Jest to znacznie więcej niż w przypadku dominujących kryteriów morfologicznych poprzednio stosowanej klasyfikacji FAB (francusko–amerykańsko–brytyjskiej).1,3,5,7,16
- Ostra białaczka szpikowa z definiującymi nieprawidłowościami cytogenetycznymi:
- AML z t(8;21)(q22;q22); RUNX1–RUNX1T1
- AML z inv(16)(p13.1q22) lub t(16;16)(p13.1;q22); CBFB–MYH11
- APL (ostra białaczka promielocytowa, FAB M3) z t(15;17)(q22;q12); PML–RARA
- AML z t(9;11)(p22;q23); MLLT3–KMT2A
- AML z t(6;9)(p23;q34); DEK–NUP214
- AML z inv(3)(q21q26.2) lub t(3;3)(q21;q26.2); GATA2, MECOM
- AML (megakarioblastyczna) z t(1;22)(p13;q13); RBM15–MKL1
- jednostka tymczasowa: AML z BCR-ABL1
- AML z mutacją NPM1
- AML ze zmutowanym CEBPA
- jednostka tymczasowa: AML z mutacją RUNX1.
- Ostra białaczka szpikowa ze zmianami powiązanymi z mielodysplazją.
- Nowotwory szpiku związane z leczeniem.
- Ostra białaczka szpikowa bez dodatkowej kategorii:
- AML z minimalnym różnicowaniem (FAB M0)
- AML bez dojrzewania (FAB M1)
- AML z dojrzewaniem (FAB M2)
- ostra białaczka mielomonocytowa (FAB M4)
- ostra białaczka monoblastyczna/monocytowa (FAB M5a, b)
- ostra białaczka erytroidalna (FAB M6)
- czysta erytroleukemia
- erytroleukemia, erytroidalna/mieloidalna
- ostra białaczka megakarioblastyczna (FAB M7)
- ostra białaczka bazofilowa
- ostra szpikowica uogólniona z mielofibrozą (synonim: ostra mielofibroza; ostra mieloskleroza).
- Mięsak mieloidalny (synonim: pozaszpikowy guz mieloidalny; mięsak granulocytarny; zieleniak).
- Proliferacje mieloidalne w zespole Downa (związane z trisomią 21):
- białaczka szpikowa związana z zespołem Downa
- przejściowa nieprawidłowa mielopoeza (synonim: przejściowy zespół mieloproliferacyjny).
- Ostre białaczki o niejednoznacznym pochodzeniu liniowym:
- ostra białaczka niezróżnicowana
- ostra białaczka z fenotypem mieszanym i t(9;22)(q34;q11.2); BCR-ABL1
- ostra białaczka z fenotypem mieszanym i (v;11q23); rearanżacja MLL/KMT2A
- ostra białaczka z fenotypem mieszanym, B/mieloidalna (bliżej nieokreślona)
- ostra białaczka z fenotypem mieszanym, T/mieloidalna (bliżej nieokreślona).
Diagnostyka różnicowa
- Ostra białaczka limfoblastyczna.
- Zespoły mielodysplastyczne.
- Niedokrwistość aplastyczna.
- Przerzuty nowotworowe do szpiku z obecnością mieloblastów i erytroblastów.12
- Chłoniaki białaczkowe, np.:
- Zespoły mieloproliferacyjne, np.:
- Zakażenia wirusowe, np.:
- Angina Plauta-Vincenta.
- Odczyny białaczkowe w przebiegu gruźlicy z wysoką leukocytozą.
- Niedokrwistość z niedoboru witaminy B12 (niedokrwistość złośliwa).
- Niedokrwistość z niedoboru folianów (kwasu foliowego).
Wywiad lekarski
- AML zwykle rozpoczyna się podostro, z poniższymi objawami:
- niedokrwistość
- znużenie/zmęczenie
- częstoskurcz
- bladość
- granulocytopenia
- częste zakażenia górnych dróg oddechowych
- zakażenia skóry
- trombocytopenia
- skłonność do krwawień podskórnych (petocje, wybroczyny)
- krwawienie z błony śluzowej
- miesiączka krwotoczna
- krwawienie z nosa.
- niedokrwistość
- Częste, ale nieswoiste objawy:
- U niektórych pacjentów występują:
- ból głowy
- nudności i wymioty (naciekanie opon mózgowo–rdzeniowych)
- zaburzenia widzenia
- wysypka skórna
- bóle kości i stawów.
- U 50% pacjentów objawy występowały w ciągu ostatnich 3 miesięcy przed rozpoznaniem.
- Choroby współistniejące
- ocena np. na podstawie wyniku HCT–CI.
Badanie fizykalne
- Często znacznie pogorszony stan ogólny.
- ocena statusu sprawności według skali ECOG (Eastern Cooperative Oncology Group).
- Bladość związana z niedokrwistością.
- Krwotoki skórne
- petocje
- wybroczyny
- krwiaki.
- Utrzymujące się zakażenia.
- Powiększenie węzłów chłonnych.
- Umiarkowana hepatosplenomegalia.
- Ewentualnie owrzodzenia błony śluzowej, np. afty, uaktywnienie opryszczki.2
- Wrażliwość na ból przy badaniu palpacyjnym kości, zwłaszcza mostka i kości piszczelowej.
- Objawy leukostazy (zaburzenia przepływu krwi w mikrokrążeniu związane z leukocytozą >100 000/mcl) - zobacz wyżej.2
Badania uzupełniające w gabinecie lekarza rodzinnego
- Morfologia krwi bez rozmazu i z rozmazem.
- Możliwe podwyższone OB, kwas moczowy i LDH.
- Koagulologia (objawy koagulopatii ze zużycia, DIC?).
- Badanie moczu.
- W razie potrzeby test ciążowy.
- Wirusowe zapalenie wątroby (HBV, HCV) i serologia HIV.
- RTG klatki piersiowej.
- EKG.
- Echo serca.
- Czynność płuc.
- USG jamy brzusznej.
Badanie rozmazu krwi
- Dominacja leukocytarnych komórek progenitorowych o podobnej morfologii – białaczkowych komórek blastycznych – z pałeczkami Auera
- eozynofile zawierające w cytoplazmie ziarnistości przypominające igły
- patognomoniczna dla AML
- występuje u 20–30% pacjentów.
Diagnostyka specjalistyczna
Biopsja i rozmaz szpiku kostnego u hematoonkologa
- Hiperkomórkowy i zdominowany przez komórki blastyczne (>20%).
- Histochemiczne metody barwienia mogą potwierdzić, że białaczka pochodzi z komórek szpikowych, np. barwienie peroksydazą.
- Klasyfikacja według WHO na podstawie badań cytogenetycznych i molekularnych badań genetycznych.
- Cytogenetyka
- FISH (fluorescence in situ hybridisation) – fluorescencyjna hybrydyzacja in situ.
- Jeśli analiza cytogenetyczna nie przyniesie skutku, wtedy stwierdzenie:
- translokacji, takich jak RUNX1–RUNX1T1, CBFB–MYH11, KMT2A (MLL), EVI1
- utraty chromosomu 5q, 7q lub 17p.
- Genetyka molekularna (mutacje)
- NPM1
- CEBPA
- RUNX1
- FLT3 (wewnętrzne duplikacje tandemowe (ITD), iloraz mutant: typ dziki)
- TKD (kodon D853 i I836)
- TP53
- ASXL1.
- Genetyka molekularna (rearanżacje genów)
- PML–RARA
- CBFB–MYH11
- RUNX1–RUNX1T1
- BCR–ABL1.
- Przed allogenicznym przeszczepem komórek macierzystych
- typowanie HLA (ewentualnie również rodzeństwa)
- status CMV.
Dalsze badania
- W większości przypadków diagnostyka obrazowa nie jest konieczna.
- Tomografia komputerowa i rezonans magnetyczny są wskazane w przypadku klinicznego podejrzenia objawów pozaszpikowych.
Wskazania do skierowania do specjalisty
- W przypadku podejrzenia ostrej białaczki pacjenta należy niezwłocznie skierować do ośrodka hematoonkologicznego.
- Objawy alarmowe:
- nowo rozwinięta skłonność do samoistnych krwawień
- niedokrwistość
- utrata masy ciała
- nawracające zakażenia
- niedokrwistość z leukopenią i małopłytkowością.
Leczenie
Cele leczenia
- Warunkiem wstępnym wyleczenia lub znacznej poprawy przeżywalności jest osiągnięcie jak najpełniejszej i całkowitej remisji.1,7 Mają tu zastosowanie następujące kryteria remisji:
- Stan morfologicznie wolny od białaczki (morphologic leukemia–free state – MLFS)
- komórki blastyczne w szpiku kostnym <5%
- brak pałeczek Auera i objawów pozaszpikowych
- brak komórek blastycznych we krwi obwodowej.
- Morfologiczna całkowita remisja (complete remission – CR)
- komórki blastyczne w szpiku kostnym <5%
- brak pałeczek Auera i objawów pozaszpikowych
- neutrofile ≥1000/mcl i płytki krwi ≥100 000/mcl
- brak komórek blastycznych we krwi obwodowej.
- Morfologiczna całkowita remisja z niepełną regeneracją (CRi/CRp)
- komórki blastyczne w szpiku kostnym <5%
- brak pałeczek Auera i objawów pozaszpikowych
- neutrofile
- brak komórek blastycznych we krwi obwodowej.
- Cytogenetyczna całkowita remisja (CRc)
- CR z brakiem aberracji cytogenetycznej wykrywanej przy początkowym rozpoznaniu.
- Całkowita remisja molekularna (CRm)
- CR bez zmiany molekularnej wykrywanej przy początkowym rozpoznaniu.
- Całkowita remisja z częściową regeneracją hematologiczną (CRh)
- komórki blastyczne w szpiku kostnym <5%
- brak pałeczek Auera i objawów pozaszpikowych
- neutrofile ≥500/mcl i płytki krwi ≥50 000/mcl
- brak komórek blastycznych we krwi obwodowej.
- Częściowa remisja (PR)
- zmniejszenie liczby komórek blastycznych w szpiku kostnym do 5–25%
- neutrofile ≥1000/mcl i płytki krwi ≥100 000/mcl
- brak komórek blastycznych we krwi obwodowej.
- Nawrót po CR
- zwiększenie liczby komórek blastycznych w szpiku kostnym do ≥5% lub liczby komórek blastycznych we krwi obwodowej, którego nie można wytłumaczyć reaktywną regeneracją obrazu krwi lub
- pozaszpikowa manifestacja AML.
- Stan morfologicznie wolny od białaczki (morphologic leukemia–free state – MLFS)
Planowanie leczenia
- Decyzję należy podjąć wspólnie z pacjentem w sposób dostosowany do ryzyka.
- Uwzględnienie wieku biologicznego (wydolności) pacjenta i chorób współistniejących
- Różne protokoły dla różnych grup AML
- Wiele nowszych terapii znajduje się w fazie badań klinicznych.
- Leczenie w ramach badań klinicznych jest często uzasadnione.
- Sekwencja podstawowa:
- terapia indukcyjna
- terapia konsolidacyjna
- terapia reindukcyjna
- chemioterapia podtrzymująca remisję.
- U 60–80% pacjentów otrzymujących leczenie indukcyjne dochodzi do remisji. Odsetek 5–letniego braku nawrotów wynosi 30–40%.
- Nowo zdiagnozowani pacjenci z AML powinni być kierowani do doświadczonego ośrodka w celu określenia optymalnej strategii leczenia.
Leczenie pierwotne młodszych pacjentów
- Ta grupa wiekowa obejmuje pacjentów w wieku biologicznym poniżej 60–65 lat i bez chorób współistniejących lub z niewielką ich liczbą.
- Leczenie składa się z 2 faz: leczenia indukcyjnego i konsolidującego.3
Chemioterapia indukcyjna
- Należy rozpocząć jak najszybciej po potwierdzeniu rozpoznania.
- Opóźnienie terapii o więcej niż 5 dni u młodszych pacjentów z AML prowadzi do znacznego pogorszenia rokowania i wyników leczenia.17
- Standardowa kombinacja (schemat 3+7)
- Wlew cytarabiny (Ara-C) przez 7 dni i
- 3–dniowe leczenie antracykliną/antracenedionem, np.:
- daunorubicyną (DNR)
- idarubicyną (IDA)
- mitoksantronem.
- Prowadzi do całkowitej remisji u 60-80% chorych.12
- Podczas terapii może dojść do potencjalnie zagrażającej życiu granulocytopenii, małopłytkowości i aplazji szpiku kostnego trwających 2–4 tygodni.
- W tym czasie konieczne są transfuzje czerwonych krwinek i płytek krwi, aby zapobiec krwawieniom.
- W celu zapobiegania zakażeniom stosuje się antybiotyk o szerokim spektrum działania.
- Wielu chorych wymaga żywienia pozajelitowego.
- Śmiertelnośc w fazie indukcji wynosi 5-10%, najczęściej z powodu infekcji, krwawienia lub oporności na leczenie.12
Terapia konsolidacyjna (terapia po remisji)
- Wszyscy pacjenci po osiągnięciu całkowitej remisji wymagają leczenia konsolidującego, w przeciwnym razie należy spodziewać się szybkiego nawrotu AML.
- Celem jest eliminacja resztkowych komórek białaczkowych i zapobieganie wczesnym nawrotom.12
- Terapia konsolidacyjna może być prowadzona przy użyciu cytarabiny w wysokich dawkach, autologicznego przeszczepu krwiotwórczych komórek macierzystych krwi (autologous haematopoietic stemm cell transplantation - auto-HSCT) lub allogenicznego przeszczepu krwiotwórczych komórek macierzystych (allogeneic hematopoietic stemm cell transplantation - allo-HSCT) .
- Wybór terapii konsolidującej opiera się na profilu ryzyka AML i ogólnym stanie fizycznym pacjenta.
- Wysokodawkowa chemioterapia mieloablacyjna z autologicznym przeszczepem ma podobnie niską śmiertelność związaną z leczeniem jak wysokodawkowa cytarabiną i jest czasami stosowana jako alternatywna opcja konsolidacji.
- W porównaniu z przeszczepem allogenicznym ryzyko nawrotu przy tej opcji jest jednak znacznie zwiększone, a jej przewaga w zakresie całkowitego przeżycia w porównaniu z wysoką dawką cytarabiny nie została jeszcze wykazana.
- Chemioterapia konsolidacyjna cytarabiną
- Poza badaniami klinicznymi pacjenci z korzystnym ryzykiem cytogenetycznym, tj. t(8;21) lub inv(16), powinni otrzymać chemioterapię konsolidacyjną wysoką dawką cytarabiny (high–dose cytarabine – HDAC), ponieważ ta opcja ma wysokie prawdopodobieństwo osiągnięcia długotrwałej remisji.
- Dotyczy to również pacjentów z prawidłowym kariotypem i mutacją NPM1 bez współistniejącej mutacji FLT3–ITD.
- Choroba tych pacjentów może być monitorowana poprzez pomiar minimalnej choroby resztkowej (minimal residual disease – MRD) w oparciu o zmutowany NPM1, a w przypadku nawrotu molekularnego można zastosować koncepcję ratunkową, najlepiej obejmującą allogeniczny przeszczep komórek macierzystych.
- Allogeniczne przeszczepienie krwiotwórczych komórek macierzystych (allogeneic hematopoietic stem cell transplantation – allo-HSCT)
- Pacjenci z niekorzystną cytogenetyką lub genetyką molekularną (ASXL–1, TP53, RUNX1) albo mutacją FLT3–ITD z wysoką gęstością mutacji, mają wysokie ryzyko nawrotu i powinni jako terapię po remisji otrzymać allogeniczny HSCT.
- Ponieważ wyniki przeszczepu zależą od ryzyka choroby, ryzyka przeszczepu i chorób współistniejących, pacjenci ci powinni być zgłaszani do ośrodka transplantacyjnego na wczesnym etapie, nawet jeśli są w gorszym stanie ogólnym lub mają choroby współistniejące, aby móc podjąć decyzję co do tego wskazania wspólnie z zespołem transplantacyjnym.
- Przeszczep komórek macierzystych ma skutki uboczne, a ryzyko śmiertelności związanej z tym procesem wynosi 15–20% u młodszych pacjentów w pierwszej remisji – jest to wyższa śmiertelność niż w przypadku intensywnej chemioterapii.
- Indywidualne ryzyko śmiertelności jest obliczane przy użyciu systemu punktacji, który uwzględnia choroby współistniejące, wiek i typ dawcy.
- U pacjentów ze średnim ryzykiem cytogenetycznym i brakiem korzystnych markerów molekularnych (NPM1, CEBPAdm) należy – poza badaniami przy dostępności identycznego pod względem HLA rodzeństwa lub identycznego pod względem HLA niespokrewnionego dawcy – dążyć do allogenicznego HSCT.
- Pacjenci bez dawcy, z istotnymi chorobami współistniejącymi lub w złym stanie klinicznym, powinni otrzymać, jeśli to możliwe, chemiokonsolidację z 2–3 cyklami cytarabiny w wysokich dawkach.
- Alternatywnie u kwalifikujących się pacjentów bez dawcy identycznego pod względem HLA należy rozważyć allogeniczne przeszczepienie komórek macierzystych od rodzinnego dawcy haploidentycznego pod względem HLA.
- Dawca i biorca komórek macierzystych powinni przed przeszczepem zostać zaszczepieni przeciwko wirusowemu zapaleniu wątroby typu B, Haemophilus influenzae typu B i pneumokokom.
- Leczenie podtrzymujące
- Po terapii indukcyjnej obejmującej wysokie dawki Ara–C comiesięczna mielosupresyjna terapia podtrzymująca przez okres do 3 lat; można osiągnąć równoważne wyniki terapeutyczne w porównaniu z innymi formami konsolidacji, chociaż skutkuje to znacznie dłuższym czasem trwania leczenia.
- Możliwym standardem chemioterapii dla młodszych pacjentów poza badaniami klinicznymi, jest zaadaptowany protokół CALGB (4 pięciodniowe cykle cytarabiny w dużych dawkach, a następnie 4 miesięczne cykle daunorubicyny i cytarabiny).
Starsi sprawni pacjenci
- Ta grupa wiekowa obejmuje pacjentów w wieku biologicznym powyżej 60–65 lat i bez chorób współistniejących lub z niewielką ich liczbą.
- Ponieważ zarówno odsetki remisji, jak i długotrwałe remisje zmniejszają się wraz z wiekiem, a równocześnie wzrasta ryzyko powikłań związanych z leczeniem, w tej grupie wiekowej należy szczególnie dokładnie rozważyć szanse i zagrożenia i omówić je z pacjentem.
- Pomocne może być oszacowanie indywidualnego prawdopodobieństwa CR i ryzyka wczesnej śmiertelności za pomocą punktacji oraz określenie ryzyka genetycznego.
- Dzięki intensywnemu leczeniu nawet starsi pacjenci mogą osiągnąć długotrwałą remisję.
- Starszym pacjentom w wieku biologicznym powyżej 75 lat i/lub z istotnymi chorobami współistniejącymi nie powinno się oferować intensywnej terapii ze względu na wysoką toksyczność i wczesną śmiertelność z szansą jedynie na około 10% długotrwałej remisji. Celem leczenia jest przedłużenie życia przy zachowaniu jak najlepszej jego jakości.
- Uwzględniając uwarunkowania podane poniżej, należy raczej rozważyć terapię paliatywną z cytoredukcyjną chemioterapią ambulatoryjną lub najlepsze możliwe leczenie wspomagające, ponieważ spodziewane powikłania intensywnego leczenia przewyższają wszelkie możliwe korzyści:
- wiek biologiczny >75 lat
- choroby współistniejące
- cukrzyca z powikłaniami
- choroba wątroby lub nerek
- niewydolność serca (EF <30%)
- ECOG ≥3
- brak zgody pacjenta na intensywną chemioterapię
- niekorzystna sytuacja społeczna
- niewielkie szanse na wyleczenie, wysokie ryzyko wczesnego zgonu w czasie indukcji.
- Wszyscy pozostali pacjenci powinni zostać poddani ocenie pod kątem intensywnego leczenia.
Terapia indukcyjna
- Analogicznie do leczenia młodszych pacjentów, standardowa terapia pacjentów w wieku powyżej 60 lat przebiega następująco:
- Chemioterapię indukcyjną przeprowadza się w jednym cyklu schematu 3+7 (patrz sekcja chemioterapia indukcyjna).
- Drugi cykl jest stosowany opcjonalnie, jeśli w wykonanej 15. dnia punkcji szpiku kostnego wykrywanych jest jeszcze 5% lub więcej komórek blastycznych.
Terapia konsolidacyjna (terapia po remisji)
- W przypadku starszych pacjentów ważne jest również rozważenie czasu trwania i rodzaju terapii konsolidacyjnej.
- Chemokonsolidacja cytarabiną u starszych sprawnych pacjentów
- Poza badaniami klinicznymi, pacjenci z korzystnym ryzykiem cytogenetycznym, tj. t(8;21) lub inv(16), powinni otrzymać chemioterapię konsolidacyjną cytarabiną, ponieważ istnieje wysokie prawdopodobieństwo, że pozwoli to osiągnąć w ich przypadku długotrwałą remisję.
- Ponieważ w grupie starszych pacjentów cytarabina wiąże się z wysoką toksycznością, w celu poprawy tolerancji stosuje się u nich średnie dawki tego leku.
- Allogeniczne przeszczepienie krwiotwórczych komórek macierzystych (allogenic hematopoietic stem cell transplantation – allo-HSCT)
- Starsi sprawni pacjenci bez t(8;21) lub inv(16), którzy osiągnęli CR po terapii indukcyjnej, powinni mieć, po kondycjonowaniu ze zmniejszoną dawką, możliwość otrzymania allogenicznego HSCT, ponieważ można dzięki niemu osiągnąć długoterminowe remisje na poziomie 30%, nawet w przypadku niedopasowania HLA.
Pacjenci w podeszłym wieku bez możliwości intensywnego leczenia
- Pacjenci
- w wieku biologicznym powyżej 75 lat lub
- z istotnymi chorobami współistniejącymi, takimi jak:
- cukrzyca z powikłaniami
- choroby wątroby
- choroby nerek
- niewydolność serca (EF <30%)
- ECOG ≥3 albo
- z małymi szansami na wyzdrowienie z powodu niekorzystnej cytogenetyki oraz zespołem kruchości (frailty syndrome).
- W przypadku tych pacjentów celem terapeutycznym jest przedłużenie życia przy zachowaniu jego najwyższej możliwej jakości.
- Do najefektywniejszej możliwej terapii wspomagającej (patrz sekcja terapia wspomagająca) pacjentom tym należy zaoferować cytoredukcyjną chemioterapię ambulatoryjną.
- Oprócz objawowego podawania hydroksymocznika w celu obniżenia liczby leukocytów, zaleca się stosowanie leków hipometylujących (hypomethylating agents – HMA) – 5–azacytydyny i decytabiny, ponieważ mogą one powodować wyższe wskaźniki odpowiedzi i dłuższe przeżycie w porównaniu z historycznym standardem niskiej dawki cytarabiny.
- Ze względu na mechanizm działania HMA, odpowiedź może wystąpić z opóźnieniem, dlatego ocena skuteczności jest zalecana dopiero po 3–4 miesiącach.
- Leki należy podawać co 4 tygodnie aż do progresji, ponieważ po przerwaniu leczenia szybko występują nawroty.
- W przypadku przeciwwskazań do HMA lub postępu choroby jako alternatywę można zastosować małą dawkę cytarabiny (low–dose cytarabine – LDAC). LDAC ma w tej sytuacji wyższą skuteczność niż hydroksymocznik.
- Oprócz objawowego podawania hydroksymocznika w celu obniżenia liczby leukocytów, zaleca się stosowanie leków hipometylujących (hypomethylating agents – HMA) – 5–azacytydyny i decytabiny, ponieważ mogą one powodować wyższe wskaźniki odpowiedzi i dłuższe przeżycie w porównaniu z historycznym standardem niskiej dawki cytarabiny.
- Jeśli to możliwe, leczenie powinno odbywać się w środowisku domowym pacjenta.
Leczenie nawrotów
- Brak prospektywnych, kontrolowanych badań dotyczących wyższości określonej strategii terapeutycznej przy nawrocie AML.
- Jednakże istnieje zgoda co do prowadzenia indukującej remisję terapii reindukcyjnej prowadzonej za pomocą średnich lub wysokich dawek Ara–C.
- W przypadku konsolidacji terapią z wyboru jest allogeniczne przeszczepienie komórek macierzystych.
- Jeśli nie ma dawców rodzinnych z identycznym HLA ani dawców niespokrewnionych, można skorzystać z alternatywnych źródeł komórek macierzystych, takich jak krew pępowinowa czy przeszczepy haploidentyczne.
- W nawrotach po allogenicznym HSCT można w indywidualnych przypadkach choroby chemiowrażliwej rozważyć ponowny HSCT.
- Pacjenci z nawrotem, którzy nie kwalifikują się do intensywnego leczenia ratunkowego, mogą być leczeni HMA.
Leczenie wspomagające
- W przypadku AML najlepsze możliwe leczenie wspomagające znacząco przyczynia się do poprawy rokowania, a także jakości życia osoby chorej. Jego składnikami są m.in.:
- leczenie i profilaktyka zakażeń u pacjentów o zmniejszonej odporności i po przeszczepie komórek macierzystych
- w razie potrzeby transfuzje
- leczenie przeciwwymiotne
- leczenie powikłań żołądkowo–jelitowych.
- Zmęczenie, przewlekłe zmęczenie
- subiektywne uczucie zwiększonej męczliwości i ograniczonej sprawności funkcjonalnej – brak poprawy nawet po odpoczynku i śnie
- szczególnie często występuje u pacjentów po radioterapii lub leczeniu cytostatycznym
- zgłaszane przez wielu pacjentów onkologicznych jako najbardziej dokuczliwa dolegliwość związana z leczeniem.
- leczenie
- wyjaśnienie przebiegu choroby, w razie potrzeby towarzysząca psychoterapia
- zalecany jest lekki i indywidualny program treningowy.
- leczenie
Opieka paliatywna
- Leczenie łagodzące objawy, np.:
- Przywrócenie witalności fizycznej i psychicznej, np. leczenie:
- Przywrócenie zdolności do uczestnictwa w życiu społecznym.
- O ile pacjent jest jeszcze czynny zawodowo: utrzymanie lub przywrócenie zdolności do pracy (rehabilitacja).
- Nawet w chorobie nieuleczalnej należy zalecać działania rehabilitacyjne ukierunkowane na objawy.
Sytuacje szczególne
- Ostra białaczka promielocytowa
- Według klasyfikacji WHO (zobacz sekcja klasyfikacja WHO) przypisana do ostrych białaczek szpikowych z nawracającymi nieprawidłowościami cytogenetycznymi (wcześniej sklasyfikowana jako AML FAB M3).
- W Europie Środkowej około 5% wszystkich przypadków AML u dorosłych
- Wyższa zapadalność we Włoszech, Hiszpanii, Ameryce Północnej, Środkowej i Południowej.
- Diagnostycznie rozstrzygające: wykrycie swoistej dla APL translokacji chromosomowej t(15;17) (q22;q21) lub genu fuzyjnego PML/RARA.
- Głównie hipergranularna z leukocytopenią
- W 5–10% przypadków: wariant mikrogranularny z leukocytozą.
- Zwykle powikłana nieskompensowanym wykrzepianiem wewnątrznaczyniowym z ciężką i szybko postępującą skłonnością do krwawień
- Wysokie ryzyko zagrażającego życiu krwotoku śródmózgowego i krwotoków do skóry i błon śluzowych, przewodu pokarmowego oraz płuc.
- Podobnie jak w przypadku wszystkich innych postaci ostrej białaczki, na pierwszy plan mogą się wysuwać także objawy pancytopenii.
- Często objawy niedokrwistości i neutropenii (zobacz wyżej).
- Rzadkie powikłania zakrzepowo–zatorowe, które mogą również dotyczyć dużych naczyń żylnych.
- Ważne jest, aby szybko rozpoznać chorobę, ponieważ rokowanie może być dobre, jeśli zostanie wcześnie zastosowana terapia indukcyjna.
- W przypadku APL o standardowym ryzyku (leukocyty ≤10 000/mcl) połączenie pochodnej witaminy A, kwasu all–trans–retinowego (all–trans retinoic acid – ATRA) z trójtlenkiem arsenu (arsenic trioxide – ATO) jest obecnie standardem, zarówno u dorosłych, jak i u dzieci i młodzieży (według stanu z kwietnia 2020 r.).
- Kombinacja ATRA + antracykliny + Ara-C, która wcześniej była stosowana jako standardowa terapia, jest nadal wskazana jedynie w przypadkach APL wysokiego ryzyka.
- Po terapii indukcyjnej następuje chemioterapia konsolidująca, a w przypadku APL wysokiego ryzyka – 2–letnia terapia podtrzymująca.
- Białaczka monoblastyczna, często z hiperleukocytozą (liczba komórek blastycznych AML >50–100 x 109 we krwi obwodowej)
- Stan zagrażający życiu ze względu na ryzyko niewydolności krążenia
- Wymaga szybkiego rozpoczęcia leczenia indukcyjnego, np. cytarabiną (zobacz wyżej).
- Dodatkowe leczenie wspomagające, np.:
- rasburykaza dla przyspieszenia metabolizmu kwasu moczowego
- nawodnienie
- korekta zaburzeń krzepnięcia.
- Stan zagrażający życiu ze względu na ryzyko niewydolności krążenia
- Izolowany mięsak szpiku
- Intensywne leczenie cytostatyczne, ewentualnie połączone z radioterapią.
- Ewentualnie allogeniczny przeszczep komórek macierzystych.
- Białaczki OUN
- Dokanałowe leczenie cytostatyczne (metotreksat).
Przebieg, powikłania i rokowanie
Przebieg
- Często podostre lub ostre objawy początkowe.
- Tempo progresji jest różne.
- U 60–80% pacjentów otrzymujących leczenie indukcyjne dochodzi do remisji.
- Im młodsi pacjenci, tym większe szanse na remisję.
- U około 50% wszystkich pacjentów dochodzi do nawrotu choroby; u większości z nich w ciągu 2–3 lat po uzyskaniu remisji.
- Ryzyko nawrotu wynosi mniej niż 35% u pacjentów w grupie o najlepszym rokowaniu i ponad 70–80% w grupie o najgorszym rokowaniu.
- Grupa rokownicza zależy od wieku, wyników badań cytogenetycznych i chorób współistniejących.
- Jeśli nawrót wystąpi po zakończeniu leczenia konsolidującego, wiąże się to z lepszym rokowaniem niż nawrót podczas trwającego leczenia konsolidującego.
- Ponowną remisję można uzyskać w 30–50% przypadków.
- Im dłużej trwała pierwsza remisja, tym większe są szanse na kolejną.
Powikłania
- Zagrażające życiu zakażenia lub krwawienia.
- Płodność
- Może być zmniejszona po leczeniu cytostatycznym.
- U pacjentek i pacjentów w wieku rozrodczym: w razie potrzeby środki mające na celu zachowanie płodności (zamrożenie plemników lub zapłodnionych komórek jajowych).
- Późne dolegliwości: zmęczenie, przewlekłe zmęczenie (zobacz sekcja Terapia wspomagająca).
Rokowanie
- U większości pacjentów leczenie prowadzi do pierwotnej remisji.
- U 70–80% wszystkich dorosłych w wieku poniżej 60 lat, u około 50% powyżej 60 lat.
- Rokowania dla pacjentów w wieku powyżej 60 lat są gorsze niż dla młodszych pacjentów
- częstsze występowanie niekorzystnych aberracji cytogenetycznych
- częstsza oporność na leczenie
- wyższy odsetek AML wtórnej lub związanej z leczeniem18
- wyższa współchorobowość
- często gorszy stan ogólny.
- Przeżycie 4–letnie w AML zależy od danego typu i danej grupy ryzyka
- w ostrej białaczce promielocytowej: 94%
- w innej ostrej białaczce szpikowej niskiego ryzyka: 77%
- przy średnim ryzyku: 39%
- u pacjentów wysokiego ryzyka: 29%.
Dalsze postępowanie
Podczas leczenia u hematoonkologa
- W niektórych przypadkach lekarze rodzinni przejmują niektóre zadania między cyklami.
- Należy wówczas wspólnie z pacjentem opracować plan przebiegu kontroli.
- Bieżące problemy
- diagnostyka chorób współistniejących
- kontrola parametrów krwi
- w przypadku problemów, takich jak zmiany w morfologii krwi, należy skonsultować się z hematoonkologami leczącymi pacjenta lub kliniką.
Monitorowanie zakażeń
- Gorączka neutropeniczna
- gorączka powyżej 38°C i neutrofile <500/mcl
- pacjenta należy skierować do szpitala
- w fazie paliatywnej w przypadku takich zakażeń może być niekiedy wskazane leczenie pacjentów w domu antybiotykami doustnymi.
- Neutropenia bez gorączki lub objawów zakażenia powinna być ściśle obserwowana.
- Wzrost CRP jest często spowodowany zakażeniem bakteryjnym (a nie zwiększoną aktywnością komórek białaczkowych).
Cewnikowanie żył centralnych
- Pacjenci często mają zakładany cewnik do żyły centralnej (kaniulę centralną, cewnik typu Hickman) do pobierania krwi, transfuzji i leczenia farmakologicznego.
- Otwieranie i zamykanie tych kaniul powinno być wykonywane wyłącznie przez przeszkolony i zaznajomiony z procedurą personel opiekuńczy (ryzyko zatoru powietrznego i zakażeń).
- Jeżeli nie ma możliwości fachowego stosowania kaniuli centralnej, do pobierania krwi i ewentualnego leczenia należy używać żyły obwodowej.
Inne problemy
- Zapotrzebowanie na transfuzję: ocenić stopień nasilenia objawów.
- Przy Hb <8g/dl (<5 mmol/l) lub płytkach krwi <10 000/mcl w celu ewentualnej transfuzji należy pacjenta skierować do hematoonkologa prowadzącego lub do kliniki.
- Leczenie przeciwkrzepliwe
- Małopłytkowość w wyniku leczenia lub choroby prowadzi do zwiększonego ryzyka krwawienia.
- W przypadku płytek krwi <50 000/mcl – ustalenie/zmniejszenie dawki leków przeciwkrzepliwych należy skonsultować z hematoonkologiem.
- W okresach znacznej małopłytkowości często wskazane jest przejście z doustnego leczenia przeciwkrzepliwego na heparynę drobnocząsteczkową (w zmniejszonej dawce), a nawet odstawienie leku.
Po zakończeniu leczenia w klinice/przez hematoonkologa
- Szczepienia są wskazane po indywidualnej konsultacji z ośrodkiem leczącym. HSCT wiąże się z głębokim przejściowym niedoborem odporności humoralnej i komórkowej. Po HSCT gwałtownie spadają stężenia obecnych przeciwciał. Z tego względu po HSCT uzasadnione jest powtarzanie szczepień.
- W przypadku allogenicznego HSCT zwykle wymagana jest tylko tymczasowa immunosupresja. Jeśli przebieg jest prawidłowy, oczekuje się, że pacjent będzie miał sprawny układ odpornościowy po 1–2 latach.
- Szczepionki inaktywowane
- Niebudząca zastrzeżeń, ale ograniczona odpowiedź immunologiczna bezpośrednio po przeszczepie, dlatego w razie potrzeby po przeszczepie wielokrotne szczepienie z kontrolą skuteczności szczepienia, a także dawka przypominająca po 1 roku.
- Szczepionki żywe
- Obecnie brak wystarczających danych przemawiających za stosowaniem szczepionek żywych w tej grupie pacjentów.
- Podanie żywych szczepionek należy zaplanować najwcześniej 2 lata po przeszczepie komórek macierzystych i przy braku leczenia immunosupresyjnego lub aktywnej przewlekłej reakcji przeszczep przeciwko gospodarzowi oraz gdy liczba limfocytów jest wystarczająca (>1500/mcl).
- Zalecane od 6 miesięcy po HSCT
- coroczne szczepienie przeciwko grypie.
- Zalecane 1 rok po HSCT
- DTPa–IPV (błonica, tężec, krztusiec, inaktywowane wirusy polio): 3 szczepienia.
- Hib: 3 szczepienia.
- Pneumokoki: od 1 do 2 razy szczepionka skoniugowana, a następnie 23–walentna szczepionka polisacharydowa.
- Przeciwwskazane: szczepienie przeciwko półpaścowi.
- Opieka po leczeniu i leczenie zmęczenia/przewlekłego zmęczenia (zobacz sekcja Leczenie wspomagające).
- Po allogenicznym przeszczepieniu komórek macierzystych
- monitorowanie pod kątem możliwego nawrotu choroby
- rozpoznanie przewlekłej reakcji przeszczep przeciwko gospodarzowi
- diagnostyka późnych uszkodzeń.
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
- Ostra białaczka szpikowa.
- Ostra białaczka szpikowa, rozpoznanie.
- Leki stosowane w terapii nowotworów.
- Jedzenie przy utracie apetytu.
Leczenie łagodzące w zaawansowanej chorobie nowotworowej
- Opieka paliatywna.
- Lęk.
- Ból i leczenie bólu.
- Nudności i wymioty, opieka paliatywna.
- Zaparcia, opieka paliatywna.
- Dolegliwości w jamie ustnej w opiece paliatywnej.
- Utrata masy ciała w chorobie nowotworowej, opieka paliatywna.
- Depresja, opieka paliatywna.
- Majaczenie w opiece paliatywnej.
Ilustracje
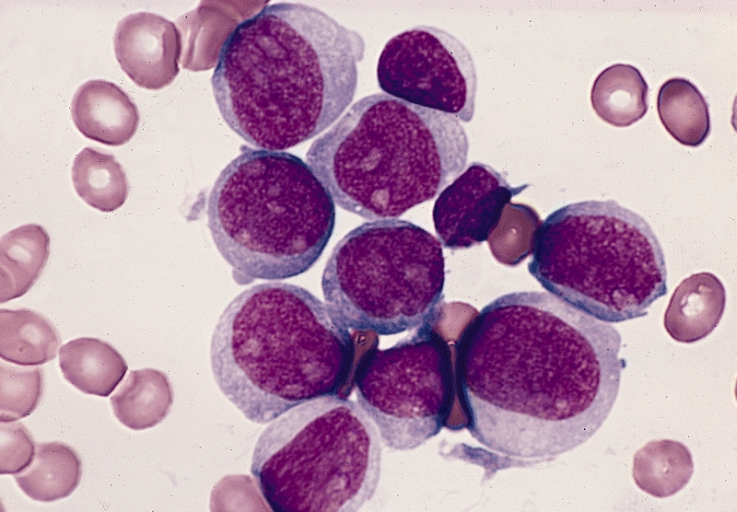
Komórki białaczkowe (blasty, niedojrzałe krwinki białe) w AML (Źródło: Wikimedia)
Źródła
Wytyczne
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Acute Myeloid Leukemia 2023. www.nccn.org
- Zalecenia postępowania diagnostyczno-terapeutycznego 2021. Polskie Towarzystwo Onkologii Klinicznej. Ostra białaczka szpikowa. onkologia.zalecenia.med.pl
- European Society for Medical Oncology. Acute myeloblastic leukaemias in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, 2020. www.esmo.org
Piśmiennictwo
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology 2023: Acute Myeloid Leukemia. jnccn.org
- Hołowiecki J. Białaczki ostre. W: Gajewski P. Red. Interna Szczeklika 2023, Medycyna Praktyczna, Kraków, 2023.
- Raj K., Mehta P. Acute myelogenous leukaemia, BMJ Best Practice, aktualizacja: 01.2016, bestpractice.bmj.com
- Estey E., Döhner H. Acute myeloid leukaemia, Lancet 2006, 368: 1894-907, PubMed
- Vardiman J.W., Thiele J., Arber D.A., et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes, Blood. 2009,114: 937-51, PubMed
- Juliusson G., Antunovic P., Derolf A., et al.: Age and acute myeloid leukemia: real world data on decision to treat and outcomes from the Swedish Acute Leukemia Registry, Blood 113: 4179-87, 2009, DOI:10.1182/blood-2008-07-172007, DOI
- European Society for Medical Oncology. Acute myeloblastic leukaemias in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, 2020., www.esmo.org
- Youn B.S., Mantel C., Broxmeyer H.E. Chemokines, chemokine receptors and hematopoiesis. Immunol Rev. 2000, 177:150-74, PubMed
- Cardi E., Gilbert F.S., Carpenter L., et al. Effects of low doses of and low dose rates of external ionizing radiation: cancer mortality among nuclear industry workers in three countries, Radiat Res 1995, 142: 117-32, PubMed
- Fircanis S., Merriam P., Khan N., Castillo J.J.: The relation between cigarette smoking and risk of acute myeloid leukemia: an updated meta-analysis of epidemiological studies, Am J Hematol 89: 125-32, DOI:10.1002/ajh.23744, DOI
- Smith S.M., Le Beau M.M., Huo D., et al. Clinical-cytogentic associations in 306 patients with therapy-related myelodysplasia or myeloid leukemia: the University of Chicago series, Blood 2003, 102: 43-52, www.ncbi.nlm.nih.gov
- Zalecenia postępowania diagnostyczno-terapeutycznego 2021. Polskie Towarzystwo Onkologii Klinicznej. Ostra białaczka szpikowa. onkologia.zalecenia.med.pl
- Kelly L.M., Gilliland D.G. Genetics of myeloid leukemias, Annu Rev Genomics Hum Genet 2002, 3: 179-98, PubMed
- Fröhling S., Scholl C., Gilliland D.G., Levine R.L. Genetics of myeloid malignancies - pathogenetic and clinical implications, J Clin Oncol 2005, 23: 6285-95, PubMed
- Arber D.A., Orazi A., Hasserjian R. et al.: The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia, Blood 127: 2391-405, 2016, DOI:10.1182/blood-2016-03-643544, DOI
- Swerdlow S.H., Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H et al., red. WHO classification of tumours of haematopoietic and lymphoid tissue. 4 utg. Lyon: IARC; 2008. www.ncbi.nlm.nih.gov
- Sekeres MA, Elson P, Kalaycio ME et al.: Time from diagnosis to treatment initiation predicts survival in younger, but not older, acute myeloid leukemia patients. Blood 113:28-36, 2009. DOI:10.1182/blood-2008-05-157065 DOI
- Leone G, Pagano L, Ben-Yehuda D, et al. Therapy-related leukemia and myelodysplasia: susceptibility and incidence. Haematologica. 2007;92:1389-1398. PubMed
Opracowanie
- Joanna Dąbrowska-Juszczak (redaktor)
- Ewa Rudnicka–Drożak (recenzent)
- Tomasz Tomasik (redaktor)
- Thomas M. Heim (recenzent/redaktor)
- Dirk Nonhoff (recenzent/redaktor)
