Streszczenie
- Definicja: Przewlekła białaczka szpikowa (PBS, chronic myeloid leukemia — CML) jest jedną z chorób mieloproliferacyjnych. Chorobę definiuje skrócony chromosom 22 z genem fuzyjnym BCR-ABL (chromosom Filadelfia). Zwiększona aktywność kinazy tyrozynowej prowadzi do nadprodukcji w szczególności granulocytów i ich komórek prekursorowych i hamowanie apoptozy.
- Epidemiologia: Roczna zapadalność 1,5 przypadków na 100 000 osób.
- Objawy: Przeważnie powolny rozwój nieswoistych objawów, takich jak znużenie, utrata apetytu, utrata masy ciała, gorączka, nocne poty i dyskomfort w nadbrzuszu. Przy wysokiej leukocytozie (>200 tys./mcl) objawy leukostazy: bóle głowy, zaburzenia świadomości, szumy uszne.
- Badanie fizykalne: Powiększona śledziona i/lub wątroba, ewentualnie niedokrwistość.
- Diagnostyka: Często przypadkowe wykrycie po wykonaniu morfologii krwi. Leukocytoza (50 tys. - 100 tys./mcl) z przesunięciem w lewo w kierunku niedojrzałych prekursorów, trombocytoza, ewentualnie niedokrwistość normocytowa. Stwierdzenie BCR-ABL we krwi obwodowej metodą PCR. Biopsja aspiracyjna i trepanobiopsja szpiku kostnego z cytogenetycznym stwierdzeniem chromosomu Filadelfia.
- Leczenie: W przypadku leczenia inhibitorami kinaz tyrozynowych (tyrosine kinase inhibitors — TKI) oczekiwana długość życia jest tylko nieznacznie skrócona; interferon u kobiet w ciąży, ew. hydroksymocznik w leczeniu paliatywnym. W przypadku oporności na leczenie rzadko allogeniczny przeszczep komórek macierzystych.
Informacje ogólne
Definicja
- Przewlekła białaczka szpikowa jest jedną z chorób mieloproliferacyjnych.
- Chorobę definiuje skrócony chromosom 22 z genem fuzyjnym BCR-ABL (chromosom Filadelfia).
- CML jest uważana za chorobę modelową w diagnostyce i terapii chorób nowotworowych:
- choroba wywoływana przez pojedynczy gen z powstawaniem trwale aktywowanej kinazy tyrozynowej
- terapie celowane hamujące aktywność kinazy tyrozynowej (tyrosine kinase inhibitors - TKI).
Epidemiologia
- Roczna zapadalność 1,2–1,5 przypadków na 100 000 osób.
- Szczyt zachorowalności w wieku 55–60 lat, ale występowanie możliwe we wszystkich grupach wiekowych (bardzo rzadko u dzieci).
- Stosunek liczby mężczyzn do liczby kobiet: 3:2.
- CML stanowi 10% wszystkich białaczek.
Etiologia i patogeneza
- U ponad 90% pacjentów stwierdza się obecność tzw. chromosomu Filadelfia:
- patologicznie mały i zmieniony chromosom 22
- powstawanie przez zrównoważoną translokację między chromosomami 9 a 22, t(9;22)
- poprzez translokację powstaje onkogenny gen hybrydowy BCR-ABL, który jest zlokalizowany na chromosomie 22
- BCR-ABL koduje białko fuzyjne o wysokiej aktywności kinazy tyrozynowej
- wysoka aktywność kinazy tyrozynowej prowadzi do niekontrolowanej proliferacji krwiotwórczych komórek macierzystych
- powstawanie BCR-ABL jest konieczne i wystarczające do rozwoju CML.
- patologicznie mały i zmieniony chromosom 22
- Niski odsetek pacjentów z CML bez chromosomu Filadelfia, ale nadal z genem hybrydowym BCR-ABL w komórkach białaczkowych:
- przyczyną jest wariant translokacji między wieloma chromosomami.
Czynniki predysponujące
- Nie są znane czynniki dziedziczne ani zakaźne, które predysponują do wystąpienia CML.
- Promieniowanie jonizujące prowadzi do zwiększonego ryzyka.
- Długoletnie narażenie zawodowe na 1,3-butadien (przemysł tworzyw sztucznych).
ICD-10
- C92.1 Przewlekła białaczka szpikowa.
Diagnostyka
- Często przypadkowe rozpoznanie już na etapie bezobjawowym podczas kontroli morfologii krwi z innych powodów.
Wywiad lekarski
- W fazie przewlekłej występują nieswoiste objawy, takie jak,:
- znużenie
- brak apetytu
- utrata masy ciała
- gorączka
- nocne poty
- dyskomfort w nadbrzuszu
- ból w lewym podżebrzu (powiększenie śledziony)1
- bladość
- ból kości.
- Przy początkowej manifestacji w zaawansowanym stadium (przyspieszenie lub przełom blastyczny):
- objawy krwawienia (petocje i/lub krwiaki)
- zakażenia
- objawy niedokrwistości (bladość, przyspieszone tętno, duszność)
- przy leukocytozie >200 000/mcl możliwe objawy leukostazy (ból głowy, utrata wzroku przy zamknięciu żyły środkowej siatkówki, priapizm), stan nagły.
Badanie fizykalne
- Splenomegalia u 75% pacjentów:
- rozmiar śledziony (w centymetrach) pod łukiem żeber istotny dla rokowania.
- Hepatomegalia u 50% pacjentów.
- Powiększenie węzłów chłonnych (rzadko).
Badania uzupełniające w gabinecie lekarza rodzinnego
Badania laboratoryjne: morfologia krwi
- Podejrzenie CML w przypadku niewyjaśnionej w inny sposób uporczywej leukocytozy z następującymi zmianami w morfologii krwi:
- leukocyty — mediana na 100 000/mcl (zakres 12 000–1 000 000/mcl)
- przesunięcie w lewo w rozmazie krwi z niedojrzałymi komórkami mielopoezy (metamielocyty, mielocyty, promielocyty i mieloblasty), rzadziej erytroblasty1
- często bazofilia (istotna dla rokowania)
- często eozynofilia
- nadpłytkowość (od wysokich wartości prawidłowych do bardzo podwyższonych >1 000 000/mcl)
- często niedokrwistość.
Inne badania laboratoryjne
- LDH podwyższona.
- Kwas moczowy podwyższony.
- Elektrolity.
- eGFR, kreatynina, mocznik.
- Transaminazy.
USG jamy brzusznej
- Powiększenie śledziony i/lub wątroby.
EKG
- Wykluczenie wydłużenia odcinka QT przed rozpoczęciem leczenia inhibitorami kinazy tyrozynowej (zobacz także EKG, lista kontrolna).
Diagnostyka specjalistyczna
Krew obwodowa
- Badanie multiplex PCR wykrywające transkrypty BCR-ABL:
- potwierdzenie rozpoznania
- ważne również jako wartość początkowa do kontroli przebiegu.
Aspirat szpiku kostnego
- Cytologia: odsetek komórek blastycznych i promielocytów, eozynofili, bazofili.
- Cytogenetyka: analiza metafazy z wykrywaniem chromosomu Filadelfia.
Badanie cytogenetyczne szpiku kostnego
- Komórkowość, zwłóknienie, liczba i rozmieszczenie komórek blastycznych.
Fazy choroby
- Rozpoznanie jest zwykle ustalane w fazie przewlekłej, gdy choroba jest klinicznie niewidoczna lub skąpoobjawowa.
- Bez leczenia w dalszym przebiegu po różnym czasie obserwuje się progresję do akceleracji i przełomu blastycznego.
Faza przewlekła
- Leukocytoza z przesunięciem w lewo.
- Splenomegalia.
- Liczba komórek blastycznych i promielocytów we krwi obwodowej lub szpiku kostnym <10%.
- Bogatokomórkowy szpik kostny z dominującą granulopoezą.
Faza przyspieszenia — kryteria2
- 15–29% komórek blastycznych we krwi lub szpiku kostnym — lub —
- Komórki blastyczne plus promielocyty we krwi lub szpiku kostnym >30% (z <30% blastów) — lub —
- ≥20% bazofilów we krwi lub szpiku kostnym — lub —
- Niezależna od terapii małopłytkowość
- Płytki krwi >1 000 000/mcl — lub —
- Nowopowstała ewolucja klonalna — lub —
- Postępujące zwłóknienie szpiku kostnego — lub —
- Postępująca splenomegalia i wzrost liczby leukocytów, które nie reagują na leczenie.
Przełom blastyczny — kryteria2
- >30% komórek blastycznych we krwi lub szpiku kostnym — lub —
- Stwierdzenie proliferacji pozaszpikowych komórek blastycznych (poza śledzioną).
Stratyfikacja ryzyka
- Dostępne są cztery skale do oceny rokowania:
- Obecnie zaleca się stosowanie wskaźnika ELTS (EUTOS-Long Term Survival Score).
- W ELTS uwzględnia się następujące parametry (kalkulator ELTS):
- wiek
- wielkość śledziony (cm poniżej łuku żeber)
- płytki krwi (109/l)
- komórki blastyczne we krwi (%).
Diagnostyka różnicowa
- Reaktywne leukocytozy (np. zakażenia, choroby reumatologiczne, przyjmowanie glikokortykosteroidów).
- Inne przewlekłe nowotwory mieloproliferacyjne.
- Stany przebiegające z nadpłytkowością.1
Wskazania do skierowania do specjalisty/hospitalizacji
- W przypadku podejrzenia przewlekłej białaczki szpikowej skierowanie do hematologa/hematoonkologa.
- W przypadku przełomu blastycznego natychmiastowa hospitalizacja.
Leczenie
Cele leczenia
- Celem leczenia jest uzyskanie remisji:
- hematologicznej
- cytogenetycznej
- molekularnej.
- W zależności od skuteczności leczenia osiągane są różne poziomy remisji:
- Początkowo normalizacja obrazu krwi ze zmniejszającym się obciążeniem chorobą jako wyraz remisji hematologicznej.
- Spadek liczby metafaz z obecnością chromosomu Filadelfia jako wyraz remisji cytogenetycznej.
- Spadek liczby transkryptów BCR-ABL jako wyraz remisji molekularnej.
Definicja remisji
- Całkowita remisja hematologiczna we krwi obwodowej (complete hematologic response — CHR):
- leukocyty <10 000/mcl
- brak mielocytów, promielocytów lub mieloblastów
- bazofile <5%
- płytki krwi <450 000/mcl
- śledziona niewyczuwalna.
- Remisja cytogenetyczna (szpik kostny):
- całkowita (complete cytogenetic response — CCyR): brak metafaz chromosomu Filadelfia (Ph+)
- częściowa (PCyR): 1–35% metafaz Ph+
- mniejsza (mCyR): 36–65% metafaz Ph+
- minimalna (minCyR): 66–95% metafaz Ph+
- brak (brak CyR): >95% metafaz Ph+
- CCyR i PCyR definiują dużą odpowiedź cytogenetyczną na leczenie (MCyR).
- Remisja molekularna (krew obwodowa):
- większa (major molecular remission — MMR): transkrypty BCR-ABL <0,1%
- głęboka: transkrypty BCR-ABL <0,01%.
Definicja odpowiedzi na leczenie inhibitorami kinazy tyrozynowej
- Regularne monitorowanie kryteriów remisji hematologicznej, cytogenetycznej i molekularnej w celu oceny skuteczności leczenia.
- Optymalna odpowiedź na terapię inhibitorami kinazy tyrozynowej jest definiowana przez osiągnięcie następujących kamieni milowych:
- 3 miesiące:
- Ph+ ≤35%
- transkrypty BCR-ABL ≤10%
- 6 miesięcy:
- Ph+ 0%
- transkrypty BCR-ABL ≤1%
- 12 miesięcy:
- transkrypty BCR-ABL ≤0,1%
- >18 miesięcy:
- transkrypty BCR-ABL ≤0,01%.
- 3 miesiące:
Ogólne informacje o leczeniu
- Pacjenci z CML powinni być włączani do badań klinicznych, gdy tylko jest to możliwe.
- Rozpoczęcie leczenia po rozpoznaniu.
- Hydroksymocznik jako terapia początkowa nawet przed wyjaśnieniem statusu BCR-ABL, przy skrajnie podwyższonej liczbie leukocytów z ryzykiem zespołu nadlepkości.
- Natychmiast po wykryciu BCR-ABL należy rozpocząć leczenie inhibitorami kinazy tyrozynowej.
- TKI są zazwyczaj podawane jako terapia długoterminowa.
- Nieregularne przyjmowanie może prowadzić do rozwoju oporności.
- Niekontrolowane odstawienie TKI zazwyczaj prowadzi do nawrotu choroby w ciągu 3–6 miesięcy.
- Dlatego bardzo ważne jest, aby pacjenci w pełni przestrzegali wytycznych terapii; częstymi przyczynami nieprzyjmowania leku w sposób ciągły są:
- niezamierzone zapominanie, np. niezabranie leków w podróż
- celowe nieprzyjmowanie, np. z powodu nieprzyjemnych skutków ubocznych.
- Jeśli jednak remisja molekularna utrzymuje się, można rozważyć odstawienie TKI w ściśle kontrolowanych warunkach.
Specjalne leczenie w fazie przewlekłej
- Obecnie leczenie opiera się głównie na inhibitorach kinazy tyrozynowej.
- TKI hamują białko fuzyjne BCR-ABL, wykazujące aktywność kinazy tyrozynowej o kluczowym znaczeniu dla proliferacji i różnicowania komórek białaczkowych.
- TKI wpływają bezpośrednio na patomechanizm CML, dzięki czemu zrewolucjonizowały jej leczenie.
- Obecnie dostępne są trzy generacje TKI (patrz niżej).
Leczenie pierwszego rzutu
- TKI pierwszej generacji: imatynib:
- Imatynib jest lekiem pierwszego wyboru wśród TKI, o najlepiej udokumentowanej skuteczności.3-5
- Imatynib jest dopuszczony do leczenia CML od 2002 roku.
- Ogólnie dobrze tolerowany lek, rzadkie przerwanie leczenia z powodu działań niepożądanych — niehematologiczne działania niepożądane stopnia 3/4 (ciężkie lub zagrażające życiu):
- wzrost poziomu transaminaz
- zatrzymanie płynów.
- TKI drugiej generacji: nilotynib, dazatynib i bosutynib:
- Wyższy odsetek remisji cytogenetycznych i molekularnych w porównaniu z imatynibem.6
- Ze względu na wyższy wskaźnik remisji nilotynib, dazatynib i bosutynib dopuszczono jako leki pierwszego wyboru.
- Nie wykazano wydłużenia czasu przeżycia w porównaniu z imatynibem.7-10
- Oprócz poprawy wskaźnika remisji, TKI drugiej generacji mają inny profil działań niepożądanych w porównaniu z imatynibem.
- Nilotynib7,11 — niehematologiczne działania niepożądane stopnia 3/4:
- wzrost stężenia glukozy
- wzrost stężenia bilirubiny
- wzrost stężenia lipazy.
- Dazatynib8,12— niehematologiczne działania niepożądane stopnia 3/4:
- Bosutynib6 — niehematologiczne działania niepożądane stopnia 3/4:
- wzrost poziomu transaminaz
- biegunka.
- Wyższy odsetek remisji cytogenetycznych i molekularnych w porównaniu z imatynibem.6
- Niepowodzenie leczenia w przypadku TKI 2. generacji jest nieco rzadsze.
- Przy wyborze TKI istotne są różne profile działań niepożądanych, np. dazatynib jest niekorzystny w niewydolności serca, a nilotynib — w cukrzycy.13
- W przypadku wszystkich TKI zaleca się ostrożność w przypadku arytmii serca, bloków w badaniu EKG lub zapalenia trzustki.
TKI w skojarzeniu z interferonem alfa
- Przed wprowadzeniem TKI podstawą leczenia był interferon alfa, ale obecnie nie odgrywa on już żadnej roli jako monoterapia.
- Połączenie TKI i interferonu alfa może prowadzić do wyższych wskaźników remisji.
Przerwanie leczenia TKI w przypadku utrzymywania się remisji
- U pacjentów w głębokiej remisji molekularnej można rozważyć przerwanie terapii.14
- Może to być szczególnie ważne w przypadku młodszych pacjentów, którzy nie zakończyli planowania rodziny.
- Niektórzy pacjenci pozostają w stabilnej remisji po odstawieniu leku, podczas gdy u innych dochodzi do nawrotu, szczególnie w ciągu pierwszych kilku miesięcy po odstawieniu leku.15-17
- Korzystne kryteria odstawienia leków to m.in.:
- faza przewlekła CML
- optymalna reakcja na leczenie pierwszego rzutu
- całkowity czas trwania leczenia TKI ponad 5 lat
- osiągnięcie głębokiej remisji
- głęboka remisja molekularna utrzymująca się nieprzerwanie przez ponad 2 lata.
Leczenie drugiego rzutu
- W przypadku niewystarczającej odpowiedzi, oporności lub nietolerancji, można zastosować leczenie drugiego rzutu.
- Obejmuje ono zmianę na alternatywny TKI 1. lub 2. generacji lub leczenie TKI 3. generacji (ponatynib).
- Wybór TKI będzie uwzględniał:
- kryteria kliniczne (spektrum skutków ubocznych)
- status mutacji przy oporności na leczenie pierwszego rzutu.
Allogeniczne przeszczepianie komórek macierzystych (allo-HCT)
- W przypadku niepowodzenia leczenia TKI można rozważyć allogeniczne przeszczepianie komórek macierzystych (allogenic hematopoietic cell transplantation - allo-HCT), jeśli pacjent kwalifikuje się i jest dostępny dawca.
- Przeprowadzenie w fazie przewlekłej jest bardziej skuteczne niż w fazach późniejszych, więc wskazanie należy ustalić odpowiednio wcześnie.
Leczenie w fazie przyspieszonej lub w przełomie blastycznym
- Leczenie w zaawansowanych stadiach zależy od tego, czy wcześniej stosowano inhibitory TKI.
- Bez leczenia wstępnego można podać TKI, przy czym preferowane są TKI drugiej generacji.
- U wcześniej leczonych pacjentów można podać alternatywny inhibitor TKI.
- Wreszcie, jeśli dostępny jest odpowiedni dawca, można rozważyć przeszczepienie allogenicznych komórek macierzystych (allo-HCT).
CML a ciąża
- Ze względu na teratogenność, pacjentki leczone TKI nie powinny w żadnym razie zajść w ciążę, dlatego konieczna jest bezpieczna antykoncepcja.
- Przerwanie leczenia na potrzeby ciąży jest zalecane tylko w przypadku stabilnej remisji molekularnej.
- Alternatywnie można podawać interferon alfa.
- U pacjentów płci męskiej, którzy chcą mieć dzieci, przed rozpoczęciem leczenia TKI należy rozważyć kriokonserwację nasienia.
Przebieg, powikłania i rokowanie
Powikłania
- Częste przewlekłe działania niepożądane leków.
- Pogorszenie jakości życia związanej ze zdrowiem głównie z powodu:
- zmęczenia (wszystkie TKI)
- obrzęków lub zatrzymywania wody
- skurczów mięśni (szczególnie w przypadku imatynibu)
- negatywnego wpływu na działalność zawodową
- obaw i niepewności co do przyszłego stanu zdrowia.
- Progresja choroby z przyspieszeniem i przełomem blastycznym z powodu oporności na leczenie lub braku przestrzegania zaleceń.
Przebieg i rokowanie
- Jeszcze dwie dekady temu CML była chorobą zagrażającą życiu z ograniczoną długością życia.
- W erze terapii TKI oczekiwana długość życia pacjentów z CML jest tylko nieznacznie niższa niż w populacji ogólnej.18
- Długoterminowe przeżycie wolne od choroby przy stosowaniu imatynibu wynosi 85% po 8 latach.
- Ze względu na lepsze rokowanie wzrost chorobowości przy stałej zapadalności.
Dalsze postępowanie
- Opieka uzupełniająca we współpracy między ośrodkiem hematologicznym a lekarzem rodzinnym.
Centrum hematologii
- Zalecany kontakt z ośrodkiem z doświadczeniem w leczeniu CML:
- kontrole hematologiczne, cytogenetyczne i molekularne kontrole genetyczne zgodnie z planem.
Lekarz rodzinny
- Kontrola morfologii krwi przez lekarza rodzinnego w porozumieniu z ośrodkiem hematologicznym.
- Kliniczne wykrywanie objawów nawrotu (ponowne nasilenie się takich objawów, jak znużenie, utrata masy ciała, nocne poty, bladość, dyskomfort w nadbrzuszu).
- Rejestrowanie działań niepożądanych TKI (różne profile działań niepożądanych poszczególnych TKI):
- kliniczne: np. obrzęki, wysięk opłucnowy
- laboratoryjne: np. wzrost poziomu transaminaz (AST, ALT), bilirubina, lipaza
- EKG: wydłużenie odcinka QT.19
- Monitorowanie zakażeń:
- pacjenci powinni skontaktować się z lekarzem na wczesnym etapie zakażenia
- w razie potrzeby kontrola morfologii krwi, CRP
- szczególnie przy gorączce i neutropenii, nawet jeśli nie ma wyraźnego ogniska, natychmiastowe przyjęcie do szpitala (ryzyko posocznicy).
- Szczepienia:
- szczepienia przeciwko pneumokokom, grypie.
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
- Przewlekła białaczka szpikowa.
- Leki stosowane w terapii nowotworów.
- Ból i leczenie bólu.
- Jedzenie przy braku apetytu.
Organizacje samopomocy
- CML Advocates Network www.cmladvocates.net
Ilustracje
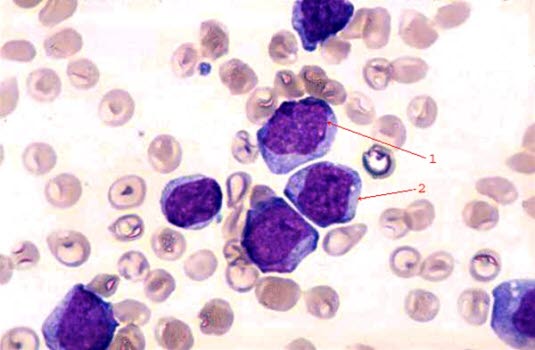
Rozmaz krwi, białaczkowe komórki blastyczne
Źródła
Piśmiennictwo
- Hellmann A, Preizner W. Przewlekła białaczka szpikowa. W: Gajewski P. Red, Interna Szczeklika 2023. Medycyna Praktyczna, Kraków, 2023.
- Baccarani M, Deininger M, Rosti G, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood 2013;122: 872-84. DOI: 10.1182/blood-2013-05-501569 DOI
- O'Brien SG, Guilhot F, Larson RA et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 2003; 348: 994-1004. New England Journal of Medicine
- Hochhaus A, O'Brien SG, Guilhot F, et al. Six-year follow-up of patients receicing imatinib for the first line treatment of chronic myeloid leukemia. Leukemia 2009; 23: 1054-61. PubMed
- Navas V, Simancas D, González LE, Hidalgo R, Cardona AF, Martí-Carvajal AJ. Imatinib for treating patients with chronic myelogeneous leukemia (Protocol). Cochrane Database of Systematic Reviews 2010, Issue 1. Art. No.: CD008259. DOI: 10.1002/14651858.CD008259. DOI
- Cortes J, Gambacorti-Passerini C, Deininger M, et al. Bosutinib Versus Imatinib for Newly Diagnosed Chronic Myeloid Leukemia: Results From the Randomized BFORE Trial. J Clin Oncol 2018;36:231-237. DOI: 10.1200/JCO.2017.74.7162 DOI
- Saglio G, Kim DW, Issaragrisil A, et al.. Nilotinib versus imatinib for newly diagnosed chronic myeloid leukemia. N Engl J Med 2010; 362: 2251-9. www.nejm.org
- Kantarjian H, Shah NP, Hochhaus A, et al. Dasatinib versus imatinib in newly diagnosed chronic phase chronic myeloid leukemia. N Engl J Med 2010; 362: 2260-70. New England Journal of Medicine
- Gurion R1, Gafter-Gvili A, Vidal L et al. Has the time for first-line treatment with second generation tyrosine kinase inhibitors in patients with chronic myelogenous leukemia already come? Systematic review and meta-analysis. Haematologica 2013 Jan; 98(1): 95-102. pmid: 22875617 PubMed
- Cortes JE, Saglio G, Kantarjian HM et al. Final 5-Year Study Results of DASISION: The Dasatinib Versus Imatinib Study in Treatment-Naïve Chronic Myeloid Leukemia Patients Trial. J Clin Oncol 2016 Jul 10; 34(20): 2333-40. pmid: 27217448 PubMed
- Kantarjian HM, Giles FJ, Bhalla KN, et al. Nilotinib is effective in patients with chronic myeloid leukemia in chronic phase after imatinib resistance or intolerance: 24-month follow-up results. Blood 2011; 117: 1141-5. pubmed.ncbi.nlm.nih.gov
- Hochhaus A, Baccarani M, Deininger M, et al. Dasatinib induces durable cytogenetic responses in patients with chronic myelogenous leukemia in chronic phase with with resistance or intolerance to imatinib. Leukemia 2008; 22: 1200-6. PubMed
- Jabbour E, Kantarjian H. Chronic myeloid leukemia: 2016 update on diagnosis, therapy, and monitoring. Am J Hematol 2016; 91: 252-65. pmid: 26799612 PubMed
- Mahon F-X, Rea D, Guilhot J, et al. Discontinuation of imatinib in patients with chronic myeloid leukemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre Stop Imatinib (STIM) trial. Lancet Oncol 2010; 11: 1029-35. PubMed
- Hochhaus A, Masszi T, Giles F, et al. Treatment-free remission following frontline nilotinib in patients with chronic myeloid leukemia in chronic phase: results from the ENESTfreedom study. Leukemia 2017; 31: 1525–31. pmid:28218239 PubMed
- Ross D, Masszi T, Gómez Casares M, et al. Durable treatment-free remission in patients with chronic myeloid leukemia in chronic phase following frontline nilotinib: 96-week update of the ENESTfreedom study. J Cancer Res Clin Oncol 2018;144: 945–54. doi: 10.1007/s00432-018-2604-x DOI
- Mahon F, Rea D, Guilhot J, et al. Discontinuation of imatinib in patients with chronic myeloid leukaemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre stop imatinib (STIM) trial. Lancet Oncol 2010;11:1029–1035. doi: 10.1016/S1470-2045(10)70233-3 DOI
- Sasaki K, Strom S, O'Brian S, et al. Relative survival in patients with chronic-phase chronic myeloid leukaemia in the tyrosine-kinase inhibitor era: analysis of patient data from six prospective clinical trials. Lancet 2015; 2: e186-e193. doi: 10.1016/S2352-3026(15)00048-4 DOI
- Kloth J, Pagani A, Verboom M, et al. Incidence and relevance of QTc-interval prolongation caused by tyrosine kinase inhibitors. Br J Cancer 2015; 112: 1011-6. doi: 10.1038/bjc.2015.82 DOI
Opracowanie
- Joanna Dąbrowska-Juszczak (redaktor)
- Ewa Rudnicka-Drożak (recenzent)
- Tomasz Tomasik (redaktor)
- Michael Handke (recenzent/redaktor)
