Streszczenie
- Definicja: Białaczki to złośliwe nowotwory układu krwiotwórczego cechujące się niekontrolowaną proliferacją nieprawidłowych lub niedojrzałych leukocytów w szpiku kostnym. Przyczyny nie są jednozancznie ustalone ale istnieje związek zachorowań z narażeniem na promieniowanie jonizujące, substancje chemiczne, cytostatyki oraz podłoże genetyczne.
- Częstość występowania: Ostre białaczki stanowią 30% wszystkich nowotworów u pacjentów w wieku poniżej 18 lat. Najczęstszą postacią jest ostra białaczka limfoblastyczna (ALL), która stanowi >80% wszystkich białaczek i jednocześnie jest najczęstsztm nowotworem wieku dziecięcego. Chorobowość jest wyższa w niektórych zespołach genetycznych - np. zespole Downa, wrodzonych niedoborach odporności, nerwiakowłókniakowatości I, zespole Fanconiego.
- Objawy: Niespecyficzne wczesne objawy takie jak zmęczenie, osłabienie, bóle kostne, poty nocne, wybroczyny, krwawienia.
- Badanie fizykalne: Bladość, gorączka, powiększone węzły chłonne, krwiaki, hepatosplenomegalia, nacieki skórne, przerost dziąseł, objawy zespołu żyły głównej górnej w przypadku nacieczenia śródpiersia.
- Diagnostyka: Morfologia krwi z rozmazem: leukopenia lub leukocytoza, zmniejszenie liczebności innych linii hematopoetycznych, obecność komórek blastycznych. Biopsja szpiku kostnego: obecność komórek blastycznych. Badanie biochemiczne: podwyższony poziom LDH i kwasu moczowego.
- Leczenie: Polichemioterapia dostosowana do wyjściowego ryzyka zgodnie z obowiązującymi protokołami terapii, w razie potrzeby radioterapia i przeszczep krwiotwórczych komórek macierzystych w określonych grupach ryzyka.
Informacje ogólne
Definicja
- Białaczki to złośliwe nowotwory układu krwiotwórczego
- niekontrolowana proliferacja nieprawidłowych leukocytów lub ich prekursorów w szpiku kostnym
- wyparcie prawidłowej hematopoezy w szpiku kostnym przez nieprawidłowe komórki i wypłukiwanie komórek białaczkowych do krwiobiegu
- w przebigu choroby możliwe naciekanie narządów i tkanek
- W dzieciństwie występują prawie wyłącznie postaci ostre
- Odsetek wszystkich zachorowań na nowotwory złośliwe w wieku <18 lat wynosi
- 22% w przypadku ostrej białaczki limfoblastycznej (ALL)
- 4% w przypadku ostrej białaczki szpikowej (AML)
- 2,5% dla zespołów mielodysplastycznych (MDS)
- 0,6% w przypadku przewlekłych chorób mieloproliferacyjnych
Częstość występowania
- Białaczki stanowią około 30% nowotworów wieku dziecięcego.
- Roczna zapadalność u dzieci w wieku poniżej 18 lat
- ALL występuje najczęściej u dzieci w wieku 1–4 lat. Chłopcy chorują częściej niż dziewczynki w stosunku 1,3:1.
Etiologia i patogeneza
- W dużej mierze nieznana
Czynniki predysponujące
- Czynniki genetyczne
- spontaniczne mutacje somatyczne lub istniejące wcześniej mutacje germinalne
- zespół Downa: 14- do 20-krotnie zwiększone ryzyko rozwoju ostrej białaczki1
- zespoły genetyczne (np. niedokrwistość Fanconiego, nerwiakowłókniakowatość typu I, zespół Blooma, niedobory odporności)
- Czynniki środowiskowe
- radioterapia lub chemioterapia w wywiadzie
- narażenie na szkodliwe czynniki chemiczne
ICD-10
- C91 Białaczka limfatyczna
- C91.0 Ostra białaczka limfoblastyczna
- C92 Białaczka szpikowa
- C92.0 Ostra białaczka szpikowa
Diagnostyka
Kryteria diagnostyczne
- Obraz kliniczny, rozmaz krwi i szpiku kostnego mają charakter diagnostyczny. Dalsze środki diagnostyczne są niezbędne do określenia stopnia zaawansowania i ustalenia terapii.
Diagnostyka różnicowa
- Samoistna plamica małopłytkowa (ITP)
- jest najczęstszą przyczyną ostrych wybroczyn i plamicy u dzieci
- nie ma związku z niedokrwistością; badanie szpiku kostnego wykazuje prawidłową hematopoezę
- z reguły stan ogólny jest dobry
- Mononukleoza zakaźna
- limfocytoza z atypowymi limfocytami, uogólniona limfadenopatia i splenomegalia
- wykrywanie przeciwciał EBV przy użyciu szybkich testów lub innych metod immunologicznych
- Odczyny białaczkowe, np. w sepsie, ostrej hemolizie, zakażeniu Bordetella pertussis
- wykrywanie leukocytozy i niedojrzałych komórek szpikowych we krwi obwodowej
- Chłoniaki
- limfadenopatia
- rozpoznanie m.in. na podstawie biopsji węzła chłonnego
- Młodzieńcze reumatoidalne zapalenie stawów
- ból stawów i kończyn, niekiedy utykanie
- obrzęki stawowe
- w niektórych przypadkach leukocytoza, niedokrwistość i splenomegalia
- Zapalenie kości i szpiku
- obrazowanie i wykrywanie drobnoustrojów w celu potwierdzenia rozpoznania
- Niedokrwistość aplastyczna
- rzadko limfadenopatia i splenomegalia
- hipokomórkowy szpik kostny
- pancytopenia
- Zespół mielodysplastyczny
- możliwa małopłytkowość, niedokrwistość i neutropenia
- w przebiegu choroby często dochodzi do wtórnej AML.
- Neuroblastoma z przerzutami
- w szpiku kostnym mogą być obecne neuroblasty podobne do limfoblastów
- zwiększone wydalanie katecholamin z moczem
Wywiad lekarski
- Często krótki wywiad medyczny (dni, tygodnie) z niespecyficznymi objawami ogólnymi, rzadko dłuższy przebieg
- Typowe objawy
- zmęczenie
- znużenie, ogólne złe samopoczucie
- ból kości i stawów, odmowa chodzenia u małych dzieci
- Objawy spowodowane zahamowaniem prawidłowej hematopoezy w szpiku kostnym
- bladość
- skłonność do zakażeń
- skłonność do krwawień, wybroczyny
- Objawy naciekania narządów
- ból brzucha i wzdęcia spowodowane naciekaniem wątroby i śledziony
- bóle kostne, obrzęk stawów2
- duszność i obniżenie tolerancji wysiłku z naciekaniem płuc, osierdzia lub opłucnej
- bóle głowy, sztywność karku, wymioty i deficyty neurologiczne w zakażeniach lub zajęciu OUN
Badanie fizykalne
- Bladość w przypadku niedokrwistości
- Wybroczyny lub krwiaki w przebiegu małopłytkowości
- Gorączka i niekiedy objawy miejscowego zakażenia, głównie w drogach oddechowych z powodu dysfunkcji leukocytów i leukopenii
- Limfadenopatia u około połowy wszystkich pacjentów, często asymetryczna
- Hepatosplenomegalia
- Obrzęki stawów
- Bezbolesny, twardy obrzęk jąder (zwykle jednostronny)
- Przerost dziąseł i nacieki skórne w niektórych podtypach AML
Badanie uzupełniające w praktyce lekarza rodzinnego
- Badania laboratoryjne
- określenie liczby leukocytów; można zaobserwować leukopenię jak i znaczną leukocytozę
- głównie niedokrwistość i małopłytkowość, ale prawidłowa morfologia krwi występuje w 3% przypadków
- podwyższony poziom dehydrogenazy mleczanowej i kwasu moczowego
- Badania ultrasonograficzne
- często współistniejąca hepatosplenomegalia, powiększone węzły chłonne, rzadko guzy śródpiersia, wysięk opłucnowy lub osierdziowy.
Diagnostyka specjalistyczna w szpitalu
Specjalistyczna diagnostyka białaczki
- Cytologia
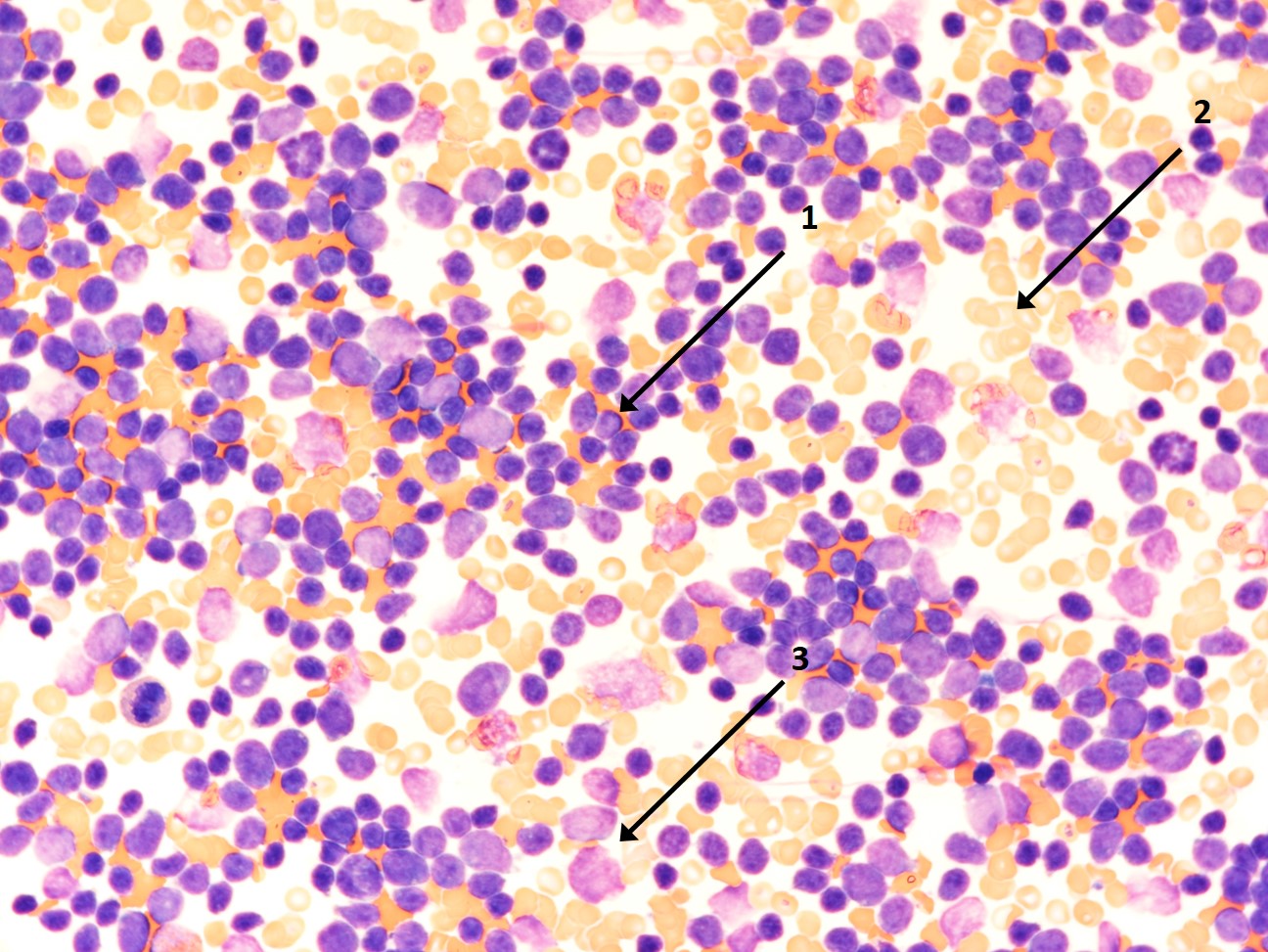
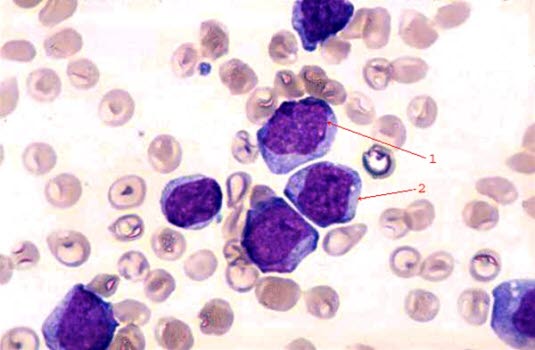
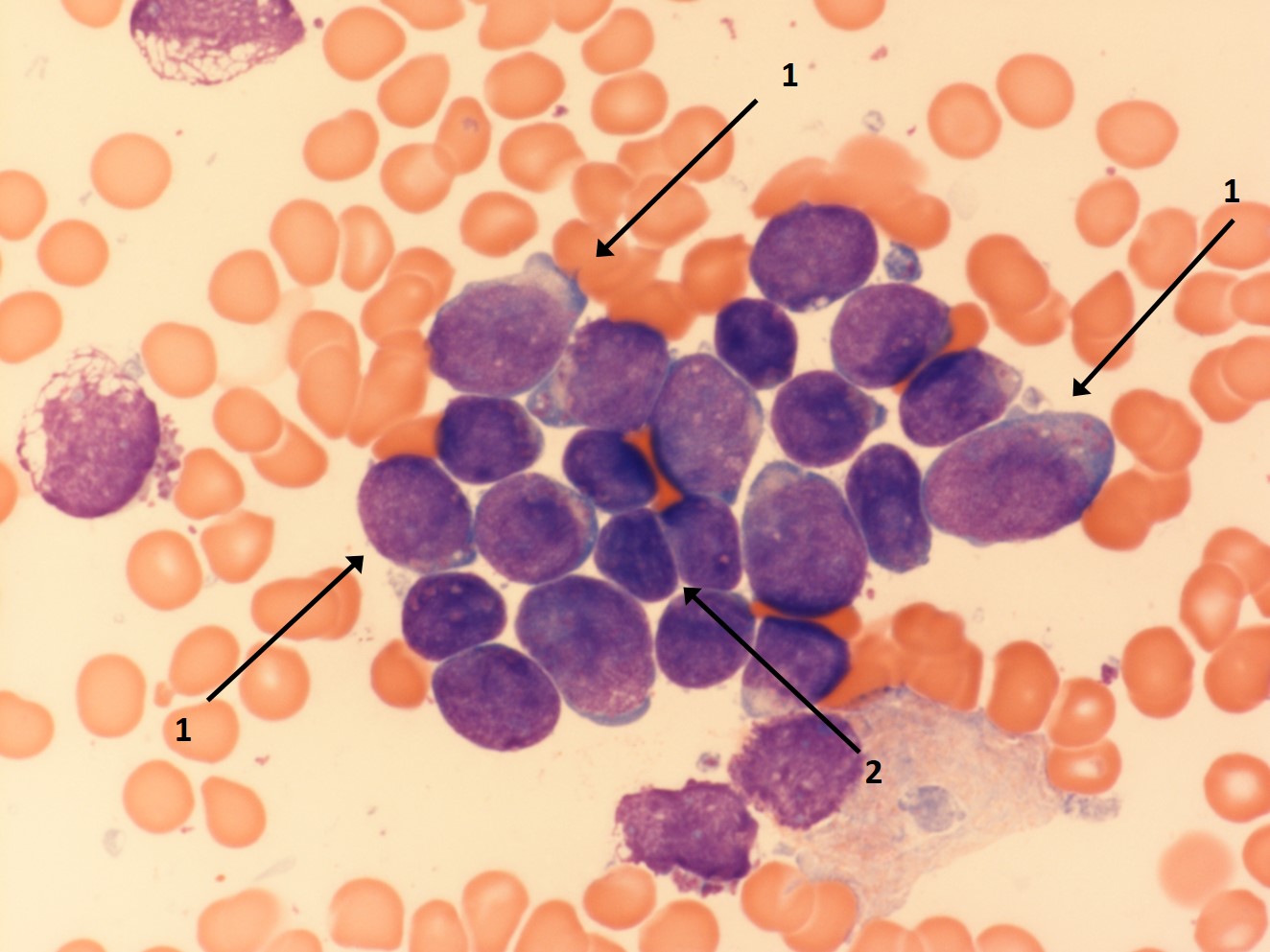
- rozmaz krwi i szpiku kostnego wykazujący obecność komórek blastycznych
- odsetek komórek blastycznych w szpiku kostnym ≥20 % w AML
- Badanie histopatologiczne
- biopsja szpiku kostnego
- Cytochemia
- Immunofenotypowanie
- różnicowanie między AML i ALL, identyfikacja podtypu poprzez wykrycie antygenu na lub w komórkach białaczkowych
- Cytogenetyka i specyficzna genetyka molekularna
- identyfikacja zmian patologicznych/mutacji na poziomie chromosomalnym i molekularnym
- niezbędne i coraz ważniejsze dla stratyfikacji ryzyka i planowania celowanego leczenia1
- Badanie płynu mózgowo-rdzeniowego
- ocena obecności komórek białaczkowych w OUN
- ocena cytozy płynu, określenie zawartości białka
- badanie morfologiczne wszelkich obecnych białaczkowych komórek blastycznych
- badanie cytogenetyczne
Diagnostyka laboratoryjna
- Morfologia krwi
- Badanie biochemiczne
- ferrytyna (zwykle podwyższona)
- CRP, OB
- Na, K, Ca, Mg, P, ALP, mocznik, kreatynina, kwas moczowy, ALT, AST, GGTP, bilirubina, glikemia, białko całkowite, LDH, immunoglobuliny
- Wskaźniki krzepnięcia
Diagnostyka obrazowa
- RTG klatki piersiowej w dwóch płaszczyznach
- USG jamy brzusznej, śródpiersia, węzłów chłonnych, jąder
- MRImózgowia (lub TK, jeśli RM nie jest dostępny), MRI klatki piersiowej, jamy brzusznej lub szkieletu
- EKG/echo serca
- EEG
- W razie potrzeby audiogram tonalny
Wskazania do pilnej hospitalizacji
- Natychmiastowe skierowanie w przypadku podejrzenia białaczki
- Uwaga: stany nagłe zagrażające życiu!
- niedrożność dróg oddechowych w przypadku dużej masy guza w śródpiersiu
- hiperleukocytoza (>100 000 leukocytów/μl)
- zespół lizy guza (masywny rozpad komórek, zaburzenia elektrolitowe, uszkodzenie nerek)
- zespół rozsianego wykrzepiania wewnątrznaczyniowego/krwawienie
Leczenie
Cele terapii
- Osiągnięcie szybkiej i trwałej remisji
- Terapia dostosowana do ryzyka w celu uniknięcia lub zminimalizowania długoterminowych szkód związanych z leczeniem
Ogólne informacje o leczeniu
- Leczenie prowadzone w wyspecjalizowanych ośrodkach w ramach aktualnych krajowych/międzynarodowych protokołów terapeutycznych
- Białaczka u dzieci jest złośliwą chorobą o dobrym rokowaniu. Leczenie jest intensywne i długotrwałe, ale w wielu przypadkach możliwe jest trwałe wyleczenie (około 90% wskaźnik przeżyć 5-letnich).
- Dokładna klasyfikacja/stratyfikacja ryzyka pacjenta z białaczką jest niezbędna do ustalenia optymalnego leczenia.
Zalecenia dla pacjentów
- Bezwarunkowe unikanie ryzyka zakażenia podczas trwania intensywnego leczenia
- rezygnacja ze żłobka, przedszkola, szkoły, dużych uroczystości rodzinnych, tłumów ludzi, transportu publicznego
- zakaz odwiedzin osób z objawami infekcji
- unikanie placów budowy (również zachowanie ostrożności podczas remontu własnego domu) i wilgotnych mieszkań, roślin doniczkowych w sypialni, wykonywania prac ogrodowych, bliskiego kontaktu ze zwierzętami, wizyt w zoo, spacerów po polach uprawnych
- odpowiednia higiena żywności
- Unikanie czynności stwarzających ryzyko urazu/krwawienia
- Pielęgnacja centralnego dostępu żylnego (portu lub CVC) zgodnie z instrukcjami
- Niezwłoczny kontakt ze szpitalem w przypadku gorączki (podejrzenie gorączki neutropenicznej lub zakażenia)
- Skontaktowanie się ze szpitalem natychmiast po kontakcie z ospą wietrzną, wirusem orpyszczki lub innymi chorobami zakaźnymi
- Najbliższe otoczenie pacjenta powinno korzystać z możliwości szczepień w ramach strategii kokonu według indywidualnych zaleceń lekarskich
Leczenie farmakologiczne
AML
- Głównym celem leczenia jest szybkie i trwałe uzyskanie remisji
- Polichemioterapia oparta na ustalonych protokołach terapeutycznych (obecnie obowiązujący międzynarodowy protokół AML-BFM 2019)
- leczenie składa się z trzech faz:
-
- Cytoredukcja (u pacjentów z wyjściową liczbą leukocytów >50 000/µl)
- Indukcja (może być zastąpiona lub uzupełniona przeszczepem komórek krwiotwórczyk szpiku; auto-HCT lub allo-HCT)
- Konsolidacja
- Reintensyfikacja (u pacjentów bardzo wysokiego ryzyka)
- w większości przypadków stosowane jest leczenie podtrzymujące, chociaż czas jego trwania i konieczność nie zostały jednoznacznie określone.
- W przypadku początkowego zajęcia OUN wskazana radioterapia
- Profilaktyczna terapia dokanałowa u dzieci bez zajęcia OUN
- Allogeniczny przeszczep krwiotwórczych komórek macierzystych tylko w przypadku niekorzystnej cytogenetyki lub słabej odpowiedzi na leczenie3
ALL
- Polichemioterapia oparta na ustalonych protokołach terapeutycznych:
- Leczenie przebiega zwykle w czterech fazach:
-
- Profaza cytoredukcyjna (glikokortykosteroidy)
- Indukcja remisji (polichemioterapia)
- Konsolidacja remisji (polichemioterapia)
- Terapia podtrzymująca (24 miesiące, metotreksat/merkaptopuryna) lub allo-HCT
- Allogeniczny przeszczep krwiotwórczych komórek macierzystych tylko w bardzo rzadkich przypadkach (bardzo niekorzystna cytogenetyka, brak odpowiedzi na leczenie indukcyjne)
- Radioterapia ośrodkowego układu nerwowego w przypadku początkowego zajęcia OUN zgodnie z odpowiednim protokołem
- Terapia dokanałowa u wszystkich pacjentów w celu zapobiegania nawrotom w OUN
- Immunoterapia z wykorzystaniem przeciwciał pozostaje przedmiotem badań
- Terapia inhibitorami kinazy tyrozynowej dla niektórych podtypów ALL (BCR-ABL1 dodatni)4-5
Leczenie wspomagające
- W przypadkach cytopenii przetoczenie preparatów krwiopochodnych uzupełniających liczbę erytrocytów i trombocytów
- Profilaktyka farmakologiczna zakażeń
- Odpowiednie i szybkie leczenie zakażenia/sepsy
- Leczenie przeciwwymiotne
- Leczenie przeciwbólowe
- Utrzymanie dobrego stanu odżywienia
Środki ochrony płodności
- W każdym przypadku należy udzielić szczegółowych, spersonalizowanych informacji pacjentom i rodzicom na temat metod dostępnych zachowania płodności
- przed rozpoczęciem i po zakończeniu leczenia
Wsparcie psychospołeczne
- Profesjonalnym wsparciem psychologicznym powinnna być objęta cała rodzina
- choroba onkologiczna jako ekstremalna sytuacja dla pacjenta, rodziców i rodzeństwa
- stres psychiczny, fizyczny i społeczny spowodowany chorobą, terapią i izolacją związaną z leczeniem
- Pomoc w radzeniu sobie z chorobą i promowanie przestrzegania zaleceń terapeutycznych
- Zapobieganie i leczenie problemów behawioralnych związanych z chorobą/terapią
- Wsparcie w zakresie prawa socjalnego
Leczenie w przypadku nawrotu
AML
- Stosunkowo częste wznowy, obserwowane u około 20% pacjentów
- Zalecenie allogenicznego przeszczepu komórek macierzystych
- Coraz częstsze stosowanie leczenia celowanego, np. przeciwciał takich jak gemtuzumab ozogamicyny6-7 lub inhibitorów kinazy tyrozynowej, inhibitorów bcl-2 takich jak wenetoklaks.
- Nawrót choroby obserwuje się u około 15% chorych
- Wznowy można zaklasyfikować w zależności od czasu pojawienia się od pierwotnego leczenia jako:
-
wznowę bardzo wczesną: <18 miesięcy od rozpoznania ALL i <6 miesięcy od zakończenia leczenia
-
wznowę wczesną: ≥18 miesięcy od rozpoznania ALL i <6 miesięcy od zakończenia leczenia
-
wznowę późną: ≥6 miesięcy od zakończenia leczenia
-
-
Odnowiona stratyfikacja ryzyka8
- wznowa wysokiego ryzyka: zwykle zalecany allogeniczny przeszczepu komórek macierzystych
- wznowa niskiego ryzyka: wznowienie leczenia farmakologicznego
- w fazie badań pozostają terapie celowane z zastosowaniem przeciwcial9
Terapia paliatywna
- Leczenie paliatywne może byc prowadzone w warunkach ambulatoryjnych, oddziału lub w ramach hospicjum domowego lub stacjonarnego, w zależności od potrzeb.
- Terapia paliatywna obejmuje leczenie objawowe wielu aspektów, najczęstsze z nich to:
Przebieg, powikłania i rokowanie
Przebieg
- Choroba ma ostry przebieg (krótki wywiad lekarski - dni, tygodnie). Objawy mogą być niespecyficzne i zróżnicowane, szczególnie we wczesnych stadiach.
- Po intensywnym, agresywnym leczeniu, które trwa zwykle kilka miesięcy, następuje kilkuletnia obserwacja po leczeniu i okresowe badania.
Powikłania
Ostre powikłania
- Zespół rozsianego wykrzepiania wewnątrznaczyniowego
- Zespół lizy guza (zespół rozpadu nowotworu) przebiegający z hiperkaliemią, hipokalcemią i hiperurykemią spowodowaną rozpadem komórek
- ryzyko wystąpienia zespołu rozpadu nowotworu jest największe szczególnie na początku chemioterapii, gdy liczba komórek białaczkowych jest bardzo duża; w przebiegu może dojść do uszkodzenia nerek, objawów tężyczki i zaburzeń rytmu serca.
- Hiperleukocytoza, zespół leukostazy
- objawy związane z nadmierną lepkością krwi spowodowane dużą ilością blastów, powoduje zastój krwi i powstawanie zakrzepów i zatorowości naczyń włosowatych, najczęściej zmiany narządowe występują w płucach, nerkach, sercu i OUN.
- Niedrożność dróg oddechowych
- w przypadku znacznego poszerzenia śródpiersia z efektem ucisku masy na drogi oddechowe w przebiegu chłoniaka/T-ALL
- Cukrzyca posteroidowa
- Konsekwencje pancytopenii
- zakażenia (zwłaszcza zapalenie błony śluzowej) i sepsa
- krwawienia
- niedokrwistość
Powikłania długoterminowe
- Występowanie wtórnych nowotworów złośliwych, zwłaszcza po przebyciu radioterapii OUN w wywiadzie
- Długotrwałe uszkodzenia spowodowane chorobą lub jej leczeniem możliwe we wszystkich układach narządów
- Uszkodzenie mięśnia sercowego po leczeniu antracyklinami
- Zaburzenia słuchu po leczeniu pochodnymi platyny
- Ostre lub przewlekłe zaburzenia czynności nerek
- Osteopenia, osteoporoza i martwica kości po leczeniu glikokortykosteroidami
- Uszkodzenie płuc i przewodu pokarmowego
- Zaburzenia neuropsychologiczne i neurorozwojowe, zwłaszcza po przebyciu radioterapii OUN
- Zaburzenia czynnościowe układu hormonalnego
- zaburzenia wzrostu, zaburzenia płodności, zaburzenia rozwojowe
- Dysfunkcje psychospołeczne
Rokowanie
- Wskaźnik 5-letniego przeżycia dzieci w wieku <18 lat w momencie rozpoznania:
Dalsze postępowanie
- Opieka nad pacjentem po zakończeniu leczenia dostosowana indywidualnie - w zależnośći od konkretnego rozpoznania i zaawansowania choroby, okresowe kontrole konieczne w celu rozpoznania ewentualnych nawrotów lub późnych skutków choroby/leczenia
- Onkologiczna opieka kontrolna jest koordynowana przez klinikę prowadzącą leczenie i odbywa się w ścisłej współpracy z lekarzami rodzinnymi/pediatrami
- Oprócz badań lekarskich, opieka po zakończeniu leczenia obejmuje doradztwo w zakresie szczepień, czynników ryzyka i planowania rodziny.
- Podczas opieki po zakończeniu leczenia należy zwrócić szczególną uwagę na następujące kwestie:
- wczesne wykrycie ewentualnego nawrotu
- nawrót choroby w szpiku kostnym (niedokrwistość, skłonność do zakażeń, krwawienia)
- nawrót w OUN
- nawrót w jądrach (bezbolesny, twardy obrzęk jąder)
- wczesne wykrycie późnych powikłań narządowych (patrz także sekcja Powikłania długoterminowe)
- wczesne wykrycie ewentualnego nawrotu
Informacje dla pacjentów
Informacje dla pacjentów w Medibas
- Białaczka u dzieci
- Cytostatyki (chemioterapia przeciwnowotworowa)
- Ból i leczenie bólu
- Jedzenie w przypadku utraty apetytu – wskazówki żywieniowe
Dodatkowe informacje
- Baker, Lynn S.: You and Leukemia: A Day at a Time. Philadelphia, London: Saunders, 2002
Ilustracje
Źródła
Literatura
- Creutzig U, van den Heuvel-Eibrink M, Gibson B, et al. on behalf of the AML Committee of the International BFM Study Group . Diagnosis and management of acute myeloid leukemia in children and adolescents: recommendations from an international expert panel . Blood 2012; 120: 3187-3205. doi.org
- Sinigaglia R, Gigante C, Bisinella G, et al. Musculoskeletal manifestations in pediatric acute leukemia. J Pediatr Orthop 2008; 28:20. PubMed
- Niewerth D, Creutzig U, Bierings MB, Kaspers GJ. A review on allogeneic stem cell transplantation for newly diagnosed pediatric acute myeloid leukemia. Blood. 2010 Sep 30;116(13):2205-14. pubmed.ncbi.nlm.nih.gov
- Cario G, Leoni V, Conter V, Baruchel A, Schrappe M, Biondi A. BCR-ABL1-like acute lymphoblastic leukemia in childhood and targeted therapy. Haematologica. 2020 Sep 1;105(9):2200-2204. www.ncbi.nlm.nih.gov
- Biondi A, Schrappe M, De Lorenzo P et al. Imatinib after induction for treatment of children and adolescents with Philadelphia-chromosome-positive acute lymphoblastic leukaemia (EsPhALL): a randomised, open-label, intergroup study. Lancet Oncol. 2012 Sep;13(9):936-45. pubmed.ncbi.nlm.nih.gov
- Niktoreh N, Lerius B, Zimmermann M et al. Gemtuzumab ozogamicin in children with relapsed or refractory acute myeloid leukemia: a report by Berlin-Frankfurt-Münster study group. Haematologica. 2019 Jan;104(1):120-127. pubmed.ncbi.nlm.nih.gov
- Zwaan CM, Reinhardt D, Zimmerman M et al; International BFM Study Group on Paediatric AML. Salvage treatment for children with refractory first or second relapse of acute myeloid leukaemia with gemtuzumab ozogamicin: results of a phase II study. Br J Haematol. 2010 Mar;148(5):768-76. pubmed.ncbi.nlm.nih.gov
- Tallen G, Ratei R, Mann G et al. Long-term outcome in children with relapsed acute lymphoblastic leukemia after time-point and site-of-relapse stratification and intensified short-course multidrug chemotherapy: results of trial ALL-REZ BFM 90. J Clin Oncol. 2010 May 10;28(14):2339-47. pubmed.ncbi.nlm.nih.gov
- Locatelli F, Zugmaier G, Rizzari C et al. Effect of Blinatumomab vs Chemotherapy on Event-Free Survival Among Children With High-risk First-Relapse B-Cell Acute Lymphoblastic Leukemia: A Randomized Clinical Trial. JAMA. 2021 Mar 2;325(9):843-854. pubmed.ncbi.nlm.nih.gov
- Queudeville M, Ebinger M. Blinatumomab in Pediatric Acute Lymphoblastic Leukemia-From Salvage to First Line Therapy (A Systematic Review). J Clin Med. 2021 Jun 8;10(12):2544. www.ncbi.nlm.nih.gov
- Kowalczyk J.R. Wprowadzenie do onkologii i hematologii dziecięcej. Warszawa, Centrum Medyczne Kształcenia Podyplomowego, 2011
Autorzy
- Natalia Jagiełła, lekarz (redaktor)
- Kristin Haavisto, Dr. med., specjalista chorób wewnętzrnych i hematoonkolog, Münster
- Anne Strauß, lekarz w trakcie szkolenia specjalizacyjnego z pediatrii, Dziecięcy Szpital Kliniczny Freiburg
