Streszczenie
- Definicja: Pełnościenne zapalenie mogące dotyczyć przewodu pokarmowego w każdym jego odcinku, najczęściej lokalizujące się w końcowym fragmencie jelita krętego, zastawce krętniczo–kątniczej i kątnicy.
- Epidemiologia: Współczynnik chorobowości to 100–200 przypadków na 100 000 osób.
- Objawy: Ból brzucha najczęściej zlokalizowany w prawym dolnym kwadrancie, biegunka bez krwi w kale, bolesne parcie na stolec i dyskomfort okołoodbytniczy.
- Badanie fizykalne: Owrzodzenia, przetoki lub ropnie okołoodbytnicze, wyczuwalny guz w dolnej części jamy brzusznej po prawej stronie z wyraźnym zapaleniem końcowego odcinka jelita krętego, niedożywienie.
- Diagnostyka: Na podstawie obrazu klinicznego wraz z wynikami badań endoskopowych, histopatologicznych, radiologicznych i laboratoryjnych.
- Leczenie: Celem jest wygojenie błony śluzowej i utrzymanie remisji. W trakcie epizodów zaostrzeń często krótkotrwale stosuje się glikokortykosteroidy, a dla podtrzymania remisji – leki immunosupresyjne, np. leki blokujące TNF–alfa.
Informacje ogólne
Definicja
- Pełnościenny, odcinkowy proces zapalny, w 60% o charakterze ziarniniakowatym, który może dotyczyć całego przewodu pokarmowego, od jamy ustnej do odbytu.1
- Często dochodzi do powstania zwężeń, przetok lub ropni
- Możliwe są również powikłania pozajelitowe (np. zapalenie stawów).
- U wielu pacjentów choroba rozpoczyna się w wieku, gdy zaczynają oni swoją edukację zawodową, i trwa przez cały okres aktywności na rynku pracy
- Wysokie koszty pośrednie (absencja chorobowa, utrata pracy, renta inwalidzka).
- Przebieg kliniczny, rozległość choroby i zakres objawów pozajelitowych są bardzo zróżnicowane
- Konieczność przeprowadzenia kompleksowej diagnostyki i stopniowego leczenia.
Klasyfikacja
- Indeks aktywności choroby według Besta (Crohn's Disease Activity Index – CDAI)2
- Klasyfikacja: remisja, łagodne, umiarkowane lub ciężkie zaostrzenie choroby.
- Suma 8 czynników:
- liczba luźnych stolców/tydzień
- ból brzucha w skali 0–3/tydzień
- ogólne samopoczucie w skali 0–4/tydzień
- powikłania (pozajelitowe)
- przyjmowanie leków przeciwbiegunkowych (loperamid)
- wyczuwalny opór (guz) w jamie brzusznej
- hematokryt
- masa ciała (procent poniżej masy należnej).
- Automatyczny kalkulator indeksu można znaleźć tutaj.
- Polskie strony z kalkulatorem:
Epidemiologia
- Zapadalność
- Dane dotyczące zachorowalności w Polsce są ograniczone. Współczynnik chorobowości na podstawie rejestrów NFZ wynosi 67 na 100 000 osób, a zapadalność 4,7 na 100 000 osób.
- Należy się spodziewać, że w ciągu kilkunastu lat zbliży się do wartości obserwowanych w krajach Europy Zachodniej i USA (100–200 na 100 000 osób).
- Częstość występowania znacznie wzrosła od lat 90. (USA).3
- Wiek i płeć
Etiologia i patogeneza
- Choroba prawdopodobnie jest wynikiem interakcji czynników genetycznych, mechanizmów układu immunologicznego i czynników środowiskowych.
- Z patofizjologicznego punktu widzenia mamy do czynienia z dysfunkcją układu immunologicznego, który błędnie interpretuje sygnały płynące z mikroflory jelitowej oraz ulega wpływom zewnętrznych czynników środowiskowych.
- Bakterie przenikają przez błonę śluzową z powodu zaburzeń bariery nabłonka jelitowego.
- W błonie śluzowej jelita następuje aktywacja komórek T, a mediatory prozapalne nasilają lub podtrzymują odpowiedź zapalną.
- Zwiększona produkcja TNF–alfa, interferonu–gamma oraz interleukiny 12 i 23.5
Czynniki genetyczne
- U 15% pacjentów z chorobą Leśniowskiego–Crohna wywiad rodzinny w kierunku tej choroby jest dodatni.
- Rodzice z nieswoistą chorobą jelit (inflammatory bowel disease – IBD):6
- oboje rodziców: >30% ryzyka wystąpienia IBD u dziecka
- 1 rodzic: >10% ryzyka wystąpienia IBD u dziecka.
- Rodzeństwo z IBD6
- 1 z rodzeństwa: 5% ryzyko wystąpienia IBD (10% u bliźniąt dwujajowych, 20–50% u bliźniąt jednojajowych).
- Wpływ genetyczny w przypadku choroby Leśniowskiego–Crohna jest prawdopodobnie większy niż w przypadku wrzodziejącego zapalenia jelita grubego.6
- Zidentyfikowano kilka genów zaangażowanych w proces chorobowy (NOD2, IL23R, ATG16L)7
- Mutacja genu NOD2 na chromosomie 16 znacząco zwiększa ryzyko wystąpienia choroby.
Czynniki środowiskowe
- Następujące czynniki mogą zwiększyć ryzyko rozwoju choroby Leśniowskiego–Crohna:
- Stosowanie leków NLPZ (ryzyko wzrasta wraz z wiekiem i czasem ich przyjmowania)
- Palenie papierosów (zwiększa ryzyko zachorowania 2–krotnie)
- Kontynuacja palenia po rozpoznaniu dodatkowo zmniejsza skuteczność farmakoterapii.
- Wycięcie wyrostka robaczkowego po 10. roku życia (niektóre badania sugerują, że jest to spowodowane błędnym rozpoznaniem choroby Leśniowskiego–Crohna jako zapalenia wyrostka robaczkowego).8
- Zakaźne zapalenie przewodu pokarmowego zwiększa ryzyko wystąpienia choroby Leśniowskiego–Crohna w kolejnym roku.9
- Zmniejszone spożycie błonnika i zwiększone spożycie przetworzonych węglowodanów.
- Inne czynniki zwiększające ryzyko zachorowania: mała aktywność fizyczna, zaburzenia snu.
- U pacjentów z noworozpoznaną chorobą częściej stwierdza się niedobór witaminy D3.
ICD–10
- K50 Choroba Leśniowskiego–Crohna [odcinkowe zapalenie jelita].
- K50.0 Choroba Leśniowskiego–Crohna jelita cienkiego.
- K50.1 Choroba Leśniowskiego–Crohna jelita grubego.
- K50.80 Choroba Leśniowskiego–Crohna żołądka.
- K50.81 Choroba Leśniowskiego–Crohna przełyku.
- K50.82 Choroba Leśniowskiego–Crohna przełyku i przewodu pokarmowego obejmująca więcej niż 1 odcinek.
- W tym: Choroba Leśniowskiego–Crohna zarówno jelita cienkiego, jak i grubego.
Diagnostyka
Kryteria diagnostyczne
- Rozpoznanie na podstawie obrazu klinicznego, przebiegu choroby wraz z wynikami badań endoskopowych, histopatologicznych, radiologicznych i laboratoryjnych.
- Ostry rzut choroby Leśniowskiego–Crohna powinien być zweryfikowany endoskopowo i należy wykluczyć możliwe rozpoznania różnicowe.
Diagnostyka różnicowa
- Wrzodziejące zapalenie jelita grubego.
- Zakaźne choroby biegunkowe.
- Zapalenie jelita wywołane przez Clostridium difficile.
- Zespół jelita drażliwego (irritable bowel syndrome – IBS).
- Zapalenie wyrostka robaczkowego.
- Niespecyficzne zapalenie jelita grubego.
- Zapalenie uchyłków.
- Nowotwory złośliwe (np. chłoniak, rak).
- Zaburzenie wchłaniania: celiakia, nietolerancja laktozy.
Wywiad
Informacje ogólne
- Na początku choroby objawy kliniczne mogą być bardzo różne (w zależności od lokalizacji i nasilenia stanu zapalnego).
- Typowe objawy:
- ból brzucha, najsilniejszy w prawym dolnym kwadrancie jamy brzusznej (w okolicy końcowego odcinka jelita krętego)
- u części pacjentów palpacyjnie wyczuwalny guz
- biegunka, zwykle bez krwi w kale
- silne bolesne parcie na stolec
- dyskomfort okołoodbytniczy (przetoki, ropnie).
- ból brzucha, najsilniejszy w prawym dolnym kwadrancie jamy brzusznej (w okolicy końcowego odcinka jelita krętego)
- Możliwe objawy:
- wzdęcia, nudności, wymioty i utrata masy ciała, osłabienie, rzadko gorączka
- hematochezja (krew w stolcu) i zaburzenie wchłaniania.
- Objawy są często niespecyficzne, a początek choroby jest bardzo powolny
- różnicowanie z zapaleniem żołądka i jelit, które często mają nagły początek.
- Wywiad lekarski przy wstępnym rozpoznaniu powinien obejmować:
- szczegółowe pytania o rodzaj i początek objawów
- dostępne wcześniejsze wyniki badań
- niedawna podróż w wywiadzie
- nietolerancje pokarmowe
- narażenie na kontakt z zakaźnymi chorobami biegunkowymi
- wywiad lekarski dotyczący palenia tytoniu
- wywiad rodzinny
- przyjmowane leki (w szczególności antybiotyki i niesteroidowe leki przeciwzapalne)
- status szczepienia
- objawy pozajelitowe (jama ustna, skóra, oczy i stawy), a także ropnie i przetoki okołoodbytnicze oraz szczeliny odbytu.
Badanie fizykalne
- Przy wstępnym rozpoznaniu oraz w przypadku wystąpienia objawów typowych dla choroby Leśniowskiego–Crohna, należy przeprowadzić badanie przedmiotowe obejmujące badanie jamy ustnej i okolicy odbytu oraz zwrócić uwagę na wszelkie objawy pozajelitowe.
- Badanie per rectum powinno być wykonane najpóźniej w ramach kolonoskopii.
Informacje ogólne
- Wyniki badań mogą być różne
- zależą od lokalizacji, rozległości i czasu trwania choroby.
- Gdy występują zaburzenia wchłaniania, w ciężkich przypadkach:
- niedokrwistość
- niski poziom witaminy B12, kwasu foliowego i żelaza
- Ostry rzut
- szczególną uwagę należy zwrócić na gorączkę lub dreszcze jako ogólnoustrojowe objawy zapalenia.
- Mogą być obecne zmiany okołoodbytnicze (ropnie, przetoki).
Objawy pozajelitowe
- Występują u do 50% pacjentów z chorobą Leśniowskiego–Crohna.10
- Typowe objawy pozajelitowe:
- niedokrwistość, zwłaszcza niedokrwistość z niedoboru żelaza
- zapalenie stawów
- rumień guzowaty (erythema nodosum), piodermia zgorzelinowa (pyoderma gangrenosum)
- zapalenie nadtwardówki, zapalenie tęczówki i ciała rzęskowego
- zesztywniające zapalenie stawów kręgosłupa (ZZSK)
- epizody zakrzepowo–zatorowe
- pierwotne stwardniające zapalenie dróg żółciowych (primary sclerosing cholangitis – PSC) i zespół nakładania (PSC + autoimmunologiczne zapalenie wątroby)
- osteoporoza
- kamica nerkowa
- afty w jamie ustnej
- opóźnienie wzrostu u dzieci.
Badania uzupełniające
- Badania krwi:
- morfologia, OB, CRP, ferrytyna, kreatynina, eGFR, ALT, AST, GGTP, AP, bilirubina
- stężenie witaminy B12 może być obniżone w przypadku ciężkiego zapalenia jelita krętego.
- sód, potas w przypadku ciężkiej biegunki.
- Badania kału:
- w diagnostyce różnicowej objawów, należy przeprowadzić ilościowe oznaczenie kalprotektyny w kale11
- we wstępnym rozpoznaniu oraz w przypadku epizodów objawowych w trakcie trwania choroby należy wykluczyć zakażenie jelit (w tym Clostridioides difficile)
- u pacjentów z odpowiednim wywiadem dotyczącym podróży należy przeprowadzić dodatkową diagnostykę pod kątem patogenów charakterystycznych dla danego kraju.
- USG jamy brzusznej
- pogrubienie ściany jelit >2,5 mm, zwężenie światła jelita, obecność ropni lub przetok.12-14
Diagnostyka specjalistyczna
Badania laboratoryjne
- Kalprotektyna (lub laktoferyna) w kale
- Badanie mikrobiologiczne na obecność w stolcu patogennych bakterii oraz Cl. difficile
- w diagnostyce różnicowej należy uwzględnić zakażenie cytomegalowirusem (CMV).
Diagnostyka aparaturowa
- Pacjenci z klinicznymi objawami choroby Leśniowskiego–Crohna w ramach wstępnej diagnostyki powinni być poddani ileokolonoskopii z biopsją losową.
- Oprócz wykrycia zmian typowych dla choroby Leśniowskiego–Crohna, takich jak nieciągłe zajęcia i owrzodzenia szczelinowe, umożliwia rozpoznanie lokalizacji i nasilenia zapalenia oraz diagnostykę i ocenę stopnia zaawansowania zwężeń.
- W diagnostyce wstępnej należy ocenić lokalizację i rozległość choroby Leśniowskiego–Crohna, wykonując diagnostykę jelita cienkiego.
- W celu diagnostyki jelita cienkiego należy wykonać enterografię RM jelita cienkiego.
- Alternatywnie można wykonać USG jelita cienkiego, jeśli wizualizacja jest dobra.
- W przypadkach wątpliwych, u pacjentów z podejrzeniem choroby Leśniowskiego–Crohna z zajęciem jelita cienkiego należy wykonać endoskopię kapsułkową.
- U każdego pacjenta z objawami z górnego odcinka przewodu pokarmowego należy wykonać badanie endoskopowe przełyku, żołądka i dwunastnicy (gastroskopia).
- W przypadku zmian okołoodbytowych (ropni, przetoki okołoodbytniczej) należy wykonać RM miednicy lub endosonografię przezodbytniczą w celu określenia obszarów zajętych chorobowo.
- Enteroskopia powinna być wykonana, jeśli wymagane jest histologiczne potwierdzenie rozpoznania w przypadku podejrzenia izolowanego zajęcia jelita cienkiego przez chorobę Leśniowskiego–Crohna lub jako zabieg leczniczy.
Skierowanie do specjalisty
- W przypadku podejrzenia choroby Leśniowskiego–Crohna pacjenci powinni zostać skierowani do gastroenterologa.
- W celu potwierdzenia rozpoznania, ustalenia planu leczenia i dalszego postępowania.
- W zależności od sytuacji może być konieczne przyjęcie do szpitala.
Lista kontrolna dotycząca skierowania – choroba Leśniowskiego–Crohna
- Cel skierowania
- Potwierdzenie rozpoznania? Leczenie? Inny?
- Wywiad lekarski
- Początek i czas trwania objawów? Przebieg? Czy wcześniej postawiono diagnozę: kiedy, gdzie?
- Objawy? Biegunka: liczba wypróżnień w ciągu dnia? Krwawienia z jelit? Ból? Czy mogą wystąpić powikłania? Ogólne objawy? Apetyt? Utrata masy ciała? Dolegliwości pozajelitowe?
- Obecnie w trakcie leczenia: Leki? Efekty/powodzenie leczenia?
- Czy choroba wpływa na odżywianie, jakość życia, zdolność do pracy lub wzrost u dzieci?
- Badanie fizykalne
- Ogólny stan fizyczny pacjenta? Zaostrzenie? Gorączka?
- Stan jamy brzusznej: obrzęk, masa, guz?
- Dyskomfort okołoodbytniczy? Pozajelitowe objawy badania fizykalnego?
- Badania uzupełniające
- Hb, OB, CRP, leukocyty, płytki krwi, próby wątrobowe, krew w stolcu?
- Ewentualnie badanie bakteriologiczne stolca? Testy serologiczne (diagnostyka różnicowa)?
- Ewentualnie wyniki poprzednich badań: endoskopia, USG, RM?
Leczenie
Cele leczenia
- Zmniejszenie nasilenia objawów chorobowych i zapobieganie powikłaniom.15
- Gojenie błony śluzowej w celu zapobiegania progresji choroby.
- Wspólne podejmowanie decyzji przez lekarza i pacjenta w zakresie koncepcji terapii może poprawić przestrzeganie schematu leczenia.
Ogólne informacje o leczeniu
- Należy unikać stosowania długotrwałej ogólnoustrojowej terapii glikokortykosteroidowej.
- Częstą praktyką jest leczenie ze stopniowym zwiększaniem dawki leków (step–up)
- Rozpoczyna się od terapii o niskiej sile działania, która stopniowo jest zwiększana. Jeśli po krótkich okresach obserwacji nie pojawia się odpowiedź na leczenie, stosuje się mocniejsze leki.
- Alternatywą w przypadku ciężkich rzutów lub u chorych z czynnikami negatywnie wpływającymi na rokowanie jest leczenie ze stopniowym obniżaniem dawki leków (top–down):
- Natychmiastowe zastosowanie silnie działających leków w skojarzeniu (np. infliksymab z tiopuryną) i ewentualne obniżenie dawek w przebiegu choroby.
- Po rozpoczęciu terapii lub zmianie na inną, w celu oceny odpowiedzi na leczenie w ciągu pierwszych 3 miesięcy, oprócz parametrów klinicznych należy sprawdzać markery biochemiczne, takie jak CRP i/lub kalprotektyna w kale, a także wykonywać USG jelit.
Leczenie bólu
- W ostrych rzutach choroby i w przewlekłych aktywnych przebiegach, można prowadzić objawowe leczenie bólu za pomocą paracetamolu, leków spazmolitycznych lub, w razie potrzeby, opioidów, jeśli ból brzucha utrzymuje się mimo leczenia przeciwzapalnego.10
- Należy unikać stałej terapii opioidami.10
Ostry rzut
Niewielka aktywność choroby
- W leczeniu łagodnej postaci ostrego rzutu choroby Leśniowskiego–Crohna powszechnie stosuje się mesalazynę. Jednak ze względu na niejednorodne wyniki badań i niską skuteczność kliniczną brakuje wystarczających dowodów na poparcie jej stosowania.
- U pacjentów z zajęciem okolicy krętniczo–kątniczej lub prawego odcinka okrężnicy i łagodną aktywnością zapalną należy początkowo podawać budezonid.
- Dawkowanie budezonidu10
- 9 mg budezonidu na dobę (1 dawka lub podzielona na 3 dawki pojedyncze).
Wysoka aktywność choroby
- Pacjenci z zajęciem okolicy krętniczo–kątniczej lub prawego odcinka okrężnicy i dużą aktywnością zapalną powinni być początkowo leczeni glikokortykosteroidami ogólnoustrojowymi.
- Pacjenci z aktywnym zapaleniem jelita grubego w chorobie Leśniowskiego–Crohna powinni początkowo otrzymywać glikokortykosteroidy ogólnoustrojowo.
- Celem ogólnoustrojowej terapii steroidowej jest szybka odpowiedź organizmu na leczenie.
- Dawkowanie glikokortykosteroidów ogólnoustrojowych:
- prednizon lub prednizolon 0,75–1 mg/kg m.c., maksymalnie 75 mg na dobę
- hydrokortyzon 300–400 mg na dobę dożylnie w dawkach podzielonych.
Zajęcie odcinka dystalnego
- W przypadku zajęcia dystalnego odcinka okrężnicy można zastosować czopki, zawiesinę (mesalazyna) lub piankę doodbytniczą (budezonid).
- Zastosowanie terapii miejscowych (czopki, zawiesina lub pianka doodbytnicza) w przypadku zapalenia dystalnego odcinka jelita grubego w chorobie Leśniowskiego–Crohna może być potencjalnym uzupełnieniem leczenia u wybranych pacjentów, ale brakuje danych z badań oraz wiarygodnych dowodów skuteczności.
Zajęcie górnego odcinka przewodu pokarmowego
- Pacjenci z rozległym zajęciem jelita cienkiego lub górnego odcinka przewodu pokarmowego powinni początkowo otrzymywać glikokortykosteroidy ogólnoustrojowe.
- Należy rozważyć wczesne leczenie immunosupresyjne lub terapię przeciwciałami anty–TNF–alfa (w przypadku infliksymabu rozważyć skojarzenie z tiopurynami), ustekinumabem lub wedolizumabem.
Przebieg oporny na działanie steroidów
Steroidooporna choroba Leśniowskiego–Crohna (brak skuteczności glikokortykosteroidów)
- W przypadku aktywności łagodnej do umiarkowanej, do leczenia należy dołączyć leki immunosupresyjne.
- Umiarkowaną lub dużą aktywności choroby należy leczyć przede wszystkim przeciwciałami anty–TNF–alfa (w przypadku infliksymabu ewentualnie w skojarzeniu z tiopuryną) lub ustekinumabem, lub wedolizumabem.
- W przypadku izolowanego zajęcia okolicy krętniczo–kątniczej, krótkiego wywiadu i braku odpowiedzi na steroidy, za równoważne z terapią infliksymabem uważa się postępowanie chirurgiczne (resekcję okolicy krętniczo–kątniczej).
- W przypadku elektywnej planowanej operacji chirurgicznej należy przedoperacyjnie ocenić stan odżywienia i przy stwierdzeniu niedoborów przeprowadzić wyrównanie żywieniem uzupełniającym dojelitowym lub pozajelitowym.
- Należy przed operacją zmniejszyć dawkę terapii steroidowej, jeśli to możliwe, odstawić ją, aby zmniejszyć ryzyko powikłań okołooperacyjnych.
Przebieg zależny od steroidów
- Leczenie steroidami jest skuteczne, jednak próba ich odstawienia lub zmniejszenia dawki powoduje szybki nawrót objawów.
- Pacjenci ze steroidozależną chorobą Leśniowskiego-Crohna powinni być leczeni immunosupresyjnie ze stopniowym zwiększaniem dawki glikokortykosteroidu do najmniejszej skutecznej. Po uzyskaniu efektu terapeutycznego należy redukować dawkę steroidu.
- U pacjentów ze steroidozależnością, leczonych jednocześnie lekami immunosupresyjnymi w optymalnych dawkach lub w razie braku tolerancji leczenia immunosupresyjnego, należy rozpocząć leczenie lekami biologicznymi.16
Zasady leczenia dzieci i młodzieży
- U dzieci i młodzieży w celu wywołania remisji choroby Leśniowskiego–Crohna należy przede wszystkim stosować wyłączne żywienie dojelitowe, a nie terapię steroidową.
- Dzieci z umiarkowaną lub ciężką chorobą Leśniowskiego–Crohna powinny otrzymać wczesne leczenie immunosupresyjne lub terapię lekami biologicznymi.
- W przypadku zahamowania wzrostu, ponownego rzutu lub utrzymującej się aktywności choroby pomimo optymalnej terapii zachowawczej, należy we wczesnym stadium rozważyć wykonanie elektywnej operacji.
- Opóźnienia rozwoju dojrzewania płciowego u pacjentów w wieku młodzieńczym nie powinny być leczone hormonami stymulującymi wzrost.
Utrzymanie remisji
Cel
- Celem długoterminowej terapii jest utrzymanie remisji klinicznej bez stosowania steroidów z normalizacją jakości życia.
Wskazanie
- Wskazanie do terapii podtrzymującej remisję, wybór stosowanego leku oraz czas trwania terapii powinny być ustalone z uwzględnieniem indywidualnego przebiegu choroby, określonego profilu ryzyka, dotychczasowych terapii oraz preferencji pacjenta.
- Jest na przykład wskazana u pacjentów z przebiegiem steroidoopornym lub steroidozależnym, ciężkim rzutem choroby czy rozległym zajęciem jelita cienkiego, częstymi epizodami (≥2/rok) lub niekorzystnymi czynnikami prognostycznymi.
- Przed rozpoczęciem terapii należy wykluczyć utajone zakażenia wirusem zapalenia wątroby lub gruźlicy oraz sprawdzić i w razie potrzeby uzupełnić stan szczepień.
- Uwaga: podczas terapii immunosupresyjnej nie powinny być podawane szczepienia żywymi szczepionkami!
Zasady utrzymania remisji
- Po indukcji remisji, w zależności od substancji indukującej remisję i historii choroby, należy zastosować leczenie podtrzymujące remisję za pomocą azatiopryny/6–merkaptopuryny, metotreksatu, przeciwciał anty–TNF–alfa, ustekinumabu lub wedolizumabu.
- W łagodnych przypadkach można rozważyć monitorowanie bez stosowania terapii podtrzymującej remisję.
- Uwaga: efekt leków podtrzymujących remisję pojawia się zwykle dopiero po kilku tygodniach!
- W przypadku przeciwciał anty–TNF–alfa lub ustekinumabu można oczekiwać szybszej odpowiedzi w porównaniu z wolno działającymi substancjami, takimi jak tiopuryny.
Czas trwania terapii
- Ze względu na brak dowodów nie można podać ogólnych zaleceń dotyczących czasu trwania terapii podtrzymującej remisję za pomocą leków immunosupresyjnych lub biologicznych.
- W przypadku przedłużającej się stabilnej fazy remisji klinicznej, bez wykrywalnych objawów zapalenia przy leczeniu tiopurynami lub lekami biologicznymi, bez jednoczesnego stosowania steroidów, można rozważyć przerwanie terapii immunosupresyjnej.
Przegląd stosowanych leków
Azatiopryna/6–merkaptopuryna (azatiopryna jest metabolizowana w wątrobie do 6–merkaptopuryny)
- Mechanizm działania:
- Analogi purynowe (antymetabolity).
- Dawkowanie (doustne w każdym przypadku, dotyczy pacjentów bez zaburzeń czynności nerek i wątroby):
- Azatiopryna: 2–2,5 mg/kg masy ciała na dobę.
- 6–merkaptopuryna: 1–1,5 mg/kg masy ciała na dobę.
- Działania niepożądane:
- Zapalenie trzustki, leukopenia, nudności, reakcje alergiczne i zakażenia.
- Monitorowanie terapii:
- W ciągu pierwszych 8 tygodni leczenia należy co najmniej 1 x w tygodniu wykonywać badanie morfologii krwi, w tym liczby płytek krwi.
- Po 8 tygodniach można zmniejszyć częstotliwość badań krwi.
- Zaleca się wykonywanie morfologii krwi z rozmazem co miesiąc, a przynajmniej co 3 miesiące.
- Ze względu na zwiększone ryzyko wystąpienia nieczerniakowego raka skóry zaleca się regularne badania przesiewowe w kierunku raka skóry.
- Szczególne uwagi:
- U około 10% pacjentów występuje niedobór metylotransferazy tiopurynowej (TPMT) spowodowany polimorfizmem genetycznym.
- W związku z tym mogą oni nie być w stanie całkowicie metabolizować azatiopryny, przez co są narażeni na silniejsze działanie mielotoksyczne.
- Z tego powodu szczególna ostrożność jest również wskazana przy jednoczesnym stosowaniu pochodnych kwasu aminosalicylowego, w tym sulfasalazyny, które hamują działanie enzymu TPMT.
- Oznaczenie aktywności TPMT przed zastosowaniem leku pozwala wykryć ewentualny niedobór transferazy tiopurynowej i zidentyfikować pacjentów ze zwiększonym ryzykiem działań niepożądanych.
Metotreksat (MTX)
- Ze względu na znacznie mniejszą ilość dostępność badań w porównaniu z tiopurynami, utrzymanie remisji za pomocą metotreksatu jest rozważane tylko w przypadku nietolerancji lub nieskuteczności tiopuryn.
- Mechanizm działania:
- antagonista kwasu foliowego (hamowanie enzymu dehydrogenazy tetrahydrofolianowej).
- Dawkowanie (u pacjentów bez zaburzeń czynności wątroby lub nerek):
- rozpoczęcie leczenia: 25 mg/tydzień podskórnie
- terapia podtrzymująca: 15 mg/tydzień podskórnie
- w przeprowadzonych badaniach, jedynie podawanie pozajelitowe (domięśniowo lub podskórnie) wykazało wystarczające działanie dla osiągnięcia remisji.
- Działania niepożądane (wybrane):
- zaburzenia układu krwiotwórczego i zaburzenia ze strony przewodu pokarmowego (zapalenie jamy ustnej, dyspepsja, ból brzucha, nudności, utrata apetytu oraz nieprawidłowe wyniki badań czynnościowych wątroby, takie jak podwyższone wartości ALT, AST, bilirubiny, ALP)
- działanie genotoksyczne/teratogenne: podczas leczenia i przez okres co najmniej 6 miesięcy po przerwaniu leczenia metotreksatem, należy stosować niezawodną metodę antykoncepcyjną (dotyczy zarówno kobiet, jak i mężczyzn).
- Monitorowanie terapii:
- przed rozpoczęciem leczenia: morfologia krwi z rozmazem i różnicowaniem leukocytów oraz liczbą płytek krwi, badanie enzymów wątrobowych, bilirubina, albumina w surowicy, RTG klatki piersiowej oraz badania czynności nerek
- podczas terapii (co 2 tygodnie przez pierwsze 2 miesiące leczenia, a następnie co 3 miesiące): badanie jamy ustnej i gardła pod kątem zmian błony śluzowej, morfologia krwi pełnej z różnicowaniem leukocytów i liczbą płytek krwi, badania czynnościowe wątroby i nerek.
Przeciwciała anty–TNF–alfa
- Produkty lecznicze:
- Mechanizm działania:
- hamowanie prozapalnego czynnika martwicy nowotworów (tumor necrosis factor – TNF).
- Dawkowanie:
- infliksymab: dożylnie 5–10 mg/kg masy ciała, leczenie indukujące: 0, 2, 6 tygodni, leczenie podtrzymujące co 8 tygodni
- adalimumab: 160 i 80 mg podskórnie co 2 tygodnie, leczenie podtrzymujące 40 mg co 2 tygodnie.
- Działania niepożądane (wybrane):
- ostre reakcje związane z wlewami, w tym reakcje anafilaktyczne (infliksymab)
- zwiększona predyspozycja do infekcji
- zaburzenia czynności wątroby, zwiększenie aktywności enzymów wątrobowych.
- Monitorowanie terapii:
- Szczególne uwagi:
- niepowodzenie terapii immunologicznej jest możliwe z powodu tworzenia przeciwciał17
- jednoczesne podawanie infliksymabu i metotreksatu lub innych leków immunomodulujących ogranicza powstawanie przeciwciał.
Ustekinumab
- Mechanizm działania:
- inhibitor IL–12 i IL–23.
- Dawkowanie:
- rozpoczęcie terapii: pojedyncza dawka dożylna, zależna od masy ciała
- dalsze leczenie: co 8 lub 12 tygodni podanie podskórne.
- Działania niepożądane:
- najczęstsze działania niepożądane to zakażenia górnych dróg oddechowych, zapalenie nosogardła, zapalenie zatok i bóle głowy
- ostre reakcje związane z wlewami, w tym reakcje anafilaktyczne.
- Monitorowanie terapii:
- regularne kontrole pod kątem podwyższonych parametrów stanu zapalnego i klinicznych objawów zakażenia (co 4 tygodnie przez pierwsze 3 miesiące, potem mniej więcej co 3 miesiące).
Wedolizumab
- Mechanizm działania:
- wybiórczy dla jelit antagonista integryn, który zapobiega migracji limfocytów T do tkanki jelitowej.
- Dawkowanie:
- rozpoczęcie terapii: 300 mg dożylnie w tygodniach 0, 2 i 6
- terapia podtrzymująca: 300 mg dożylnie co 8 tygodni lub podskórnie 108 mg co 2 tygodnie
- w przypadku braku dowodów na korzyść terapeutyczną po 14 tygodniach, przerwanie leczenia.
- Działania niepożądane (wybrane):
- najczęstsze: zakażenia (takie jak zapalenie nosogardła, zakażenia górnych dróg oddechowych, zapalenie oskrzeli, grypa i zapalenie zatok), ból głowy, nudności, gorączka, zmęczenie, kaszel, bóle stawów
- ostre reakcje związane z wlewami dożylnymi, w tym reakcje anafilaktyczne
- możliwy związek z postępującą wieloogniskową leukoencefalopatią (progressive multifocal leukoencephalopathy – PML).
- Monitorowanie terapii:
- przekazanie pacjentowi karty informacyjnej o przyjmowaniu leku
- regularna kontrola pod kątem objawów neurologicznych (PML)
- wlewy wykonywane tylko w specjalistycznym ośrodku medycznym.
Zalecenia dla pacjentów
- Należy natychmiast zaprzestać palenia papierosów
- U palaczy wskaźniki nawrotów są znacznie wyższe.18
- Zrównoważona dieta i wykluczenie jak najmniejszej liczby pokarmów.19
- Dieta FODMAP (fermentujące oligo– di– i monosacharydy oraz poliole)
- Metaanaliza z 2017 roku wykazała, że dieta o niskiej zawartości FODMAP może złagodzić objawy, ale potrzebne są dalsze badania.20
- Dzieciom i młodzieży oraz ich rodzinom należy zaoferować wsparcie psychospołeczne.
- Terapie niekonwencjonalne mogą być stosowane wspomagająco, jeśli pacjent sobie tego życzy.
Objawy pozajelitowe i ich leczenie
- W przypadku wystąpienia objawów pozajelitowych należy zweryfikować potrzebę intensyfikacji terapii.
Niedokrwistość
- Żelazo
- Uzupełnianie żelaza należy rozpocząć w przypadku wykrycia niedokrwistości z niedoboru żelaza.
- W przypadkach łagodnej niedokrwistości z niedoboru żelaza (hemoglobina 11–11,9 g/dl u kobiet niebędących w ciąży lub 11–12,9 g/dl u mężczyzn) i przy braku aktywności zapalnej, można podawać żelazo doustnie.
- W przypadku braku odpowiedzi na doustną suplementację żelaza lub w przypadku umiarkowanej lub ciężkiej niedokrwistości lub aktywnego IBD, należy podać żelazo dożylnie.
- Niedokrwistość z niedoboru witaminy B12
- W przypadku niedoboru witaminy B12 spowodowanego niedożywieniem, suplementacja może być podawana doustnie.
- W przypadku resekcji końcowego odcinka jelita krętego lub jego zapalenia, należy podać suplementację pozajelitowo (domięśniowo).
- Kwas foliowy
- W przypadku niedokrwistości makrocytarnej, niedobór kwasu foliowego powinien być wyrównany doustnie.
- Erytropoetyna
- W przypadkach niedokrwistości opornej na leczenie, pomimo uzupełnienia żelaza i optymalizacji terapii IBD, po wykluczeniu innych przyczyn, należy podjąć próbę terapii pochodnymi erytropoetyny.
- Przetoczenie krwi
- Przetoczenia koncentratu krwinek czerwonych powinny być przeprowadzane restrykcyjnie według kryteriów postępowania z krwią pacjenta i tylko w przypadkach ciężkiej, objawowej niedokrwistości.
Zaburzenia okulistyczne
- W przypadku podejrzenia okulistycznej manifestacji choroby należy przeprowadzić specjalistyczne badanie okulistyczne i odpowiednie leczenie.
- Zaburzenia występują u 4–12% pacjentów, najczęściej jest to zapalenie nadtwardówki (episcleritis).
Zajęcie stawów
- Jeśli intensyfikacja terapii nie jest wystarczająco skuteczna, leczenie przeciwbólowe może być prowadzone za pomocą fizjoterapii lub paracetamolu, metamizolu, inhibitorów COX2 i ewentualnie opioidów o niskiej sile działania.
- Nie powinno się stosować nieselektywnych leków NLPZ.
- W leczeniu zapalenia stawów obwodowych należy stosować sulfasalazynę, metotreksat lub przeciwciała anty–TNF–alfa.
- Spondyloartropatię osiową należy leczyć przeciwciałami anty–TNF–alfa.
Objawy skórne
- Rumień guzowaty (erythema nodosum)
- Często koreluje z aktywnością choroby Leśniowskiego–Crohna.
- Dlatego też należy przede wszystkim zintensyfikować terapię.
- Piodermia zgorzelinowa (pyoderma gangrenosum)
- Początkowo i przez ograniczony czas – ogólnoustrojowa terapia steroidowa w dużych dawkach, a w razie nieskuteczności – terapia inhibitorami kalcyneuryny lub przeciwciałami anty–TNF–alfa.
Pierwotne stwardniające zapalenie dróg żółciowych (primary sclerosing cholangitis – PSC)
- W przypadku stwierdzenia PSC można stosować kwas ursodeoksycholowy.
Osteopenia/osteoporoza
- Jeśli wyniki badań wskazują na osteopenię/osteoporozę, należy rozważyć intensyfikację terapii choroby podstawowej, rozpocząć uzupełnienie witaminy D, zaprzestać stosowania nikotyny, przy niedowadze rozpocząć terapię żywieniową oraz zalecić regularną aktywność fizyczną.
- W przypadku patologicznych złamań u osób z osteoporozą należy rozpocząć terapię bisfosfonianami.21
Kamica nerkowa
- Pacjenci z potwierdzoną kamicą szczawianową powinni być na diecie niskoszczawianowej.
Trombofilia
- Hospitalizowani i/lub unieruchomieni pacjenci z chorobą Leśniowskiego–Crohna powinni mieć zapewnioną farmakologiczną profilaktykę przeciwzakrzepową.
- W przypadku udowodnionej zakrzepicy żył głębokich lub zatorowości płucnej nie ma ogólnych przeciwwskazań do stosowania leków przeciwzakrzepowych u pacjentów z IBD.
Zmęczenie
- Pacjentom, którzy zgłaszają zmęczenie, można doradzić regularne, stopniowe zwiększanie aktywności fizycznej i ustrukturyzowanie trybu życia.
- Leczenie psychoterapeutyczne może pomóc w zmniejszeniu nasilenia objawów.
Leczenie chirurgiczne
- Przypadki pacjentów ze złożoną chorobą należy omawiać na forum interdyscyplinarnym, a leczenie chirurgiczne powinno być rozważane na wczesnym etapie ustalania planu leczenia.10
- Złożone operacje w chorobie Leśniowskiego–Crohna powinny być wykonywane w specjalistycznych ośrodkach.10
- Wskazanie do zabiegu operacyjnego powinno zawsze uwzględniać ogólny stan pacjenta i nigdy nie powinno być oparte wyłącznie na wynikach endoskopowych i radiologicznych.
- Jeśli resekcja jelita jest konieczna, należy wykonać odcinkową, oszczędną resekcję, aby uniknąć zespołu krótkiego jelita.10
- Pooperacyjna terapia podtrzymująca remisję może nie być konieczna w przypadku miejscowego zajęcia jelita chorobą Leśniowskiego–Crohna i chirurgicznego usunięcia zajętego odcinka jelita.17
- Warto przeprowadzić kontrolę endoskopową po 6 miesiącach.
Wskazania do leczenia chirurgicznego
- Operacja w trybie pilnym
- niedrożność jelita, perforacja, piorunujące zapalenie jelita grubego (fulminant colitis) lub masywne krwawienie.
- Operacja planowa
- w przypadku krótkoodcinkowych zwężeń, izolowanego zajęcia okolicy krętniczo–kątniczej o wysokiej aktywności choroby10
- Wielu z tych pacjentów będzie wymagało operacji w przyszłości, więc powinni oni zostać poinformowani o możliwości wczesnej operacji.
- zabiegi chirurgiczne ukierunkowane w przypadku określonych problemów, np. ropnie i przetoki22
- zwężenie jelita grubego o niejasnym charakterze10
- u dzieci i młodzieży, w przypadku zahamowania wzrostu, ponownego rzutu choroby lub utrzymującej się aktywności choroby pomimo optymalnej terapii zachowawczej, należy we wczesnym stadium rozważyć wykonanie elektywnej operacji.
- w przypadku krótkoodcinkowych zwężeń, izolowanego zajęcia okolicy krętniczo–kątniczej o wysokiej aktywności choroby10
Dalsze wskazania do operacji
- Zwężenia
- podział na zwężenia zapalne (do leczenia farmakologicznego) i bliznowate (do leczenia chirurgicznego)
- zwężenia na krótkim odcinku, do których jest dostęp, można poszerzyć endoskopowo, a dłuższe (≥5 cm) powinny zostać zoperowane.10
- Przetoki
- Ropnie
- w przypadku ropni w jamie brzusznej należy zastosować antybiotykoterapię, uwzględniając wywiad chorobowy pacjenta (zwłaszcza historię przyjmowania antybiotyków) oraz lokalną antybiotykooporność, w połączeniu z interwencyjnym lub chirurgicznym leczeniem drenażowym.10
Ciąża
- Pacjentki z chorobą Leśniowskiego–Crohna powinny dążyć do remisji przed planowanym poczęciem.
- Ostre rzuty choroby w ciąży należy leczyć bezzwłocznie.
- Preferowanymi lekami są glikokortykosteroidy.
- Dodatkowo można rozważyć zastosowanie przeciwciał anty–TNF–alfa.
- Przed planowaną ciążą należy odstawić metotreksat. Przeciwciała anty–TNF–alfa i tiopuryny powinny być kontynuowane w ciąży, jeśli utrzymują się wskazania do leczenia.
- Kontynuację w ciąży lub przerwanie stosowania innych leków w terapii choroby Leśniowskiego–Crohna, w tym wedolizumabu i ustekinumabu, należy oceniać indywidualnie.
- Glikokortykoteroidy i leki biologiczne należy przyjmować podczas karmienia piersią zgodnie ze wskazaniami.
Przebieg, powikłania i rokowanie
Przebieg
- Choroba Leśniowskiego–Crohna jest chorobą przewlekłą, charakteryzującą się ostrymi rzutami i okresami remisji.
- Po osiągnięciu remisji zawsze istnieje ryzyko wystąpienia kolejnego epizodu choroby.
- Trudno ocenić ryzyko w przypadku poszczególnych pacjentów.
- W badaniach klinicznych częstość nawrotów wynosiła 30–60% w 1. roku i 40–70% w 2. roku.
Powikłania
- Niedrożność jelita z powodu bliznowatego lub zapalnego zwężenia lub zrostów.
- Ropnie wewnątrz jamy brzusznej (intraabdominal abscess).
- Tworzenie się przetok i zmiany w okolicy odbytu.
- Zespół rozrostu bakteryjnego jelita cienkiego (Small Intestinal Bacterial Overgrowth – SIBO).
- Zaburzenia wchłaniania, niedobory i zaburzenia odżywiania
- Opóźnienie wzrostu u dzieci i młodzieży.
- Objawy pozajelitowe.
- Wielu młodych pacjentów z nieswoistymi zapaleniami jelit zmaga się z problemami psychologicznymi i jest podatnych na depresję lub obniżoną samoocenę.
- Problem dotyczy również rodziców i krewnych.
- Zmęczenie (zespół przewlekłego zmęczenia)
- Częsty w chorobie Leśniowskiego–Crohna (29–77%), może znacząco pogorszyć jakość życia i zdolność do pracy.23
- Osteoporoza
- Z powodu niedoboru witaminy D lub jako reakcja niepożądana przy terapii steroidowej.
Rokowanie
- Ogólnie rokowanie jest dobre z wyjątkowo niskim ryzykiem zgonu związanym z chorobą.
Niekorzystne czynniki prognostyczne
- Czynny nikotynizm.
- Młody wiek przy pierwszym wystąpieniu objawów (<40 lat).
- Konieczność stosowania terapii steroidowej przy pierwotnym rozpoznaniu.
- Dolegliwości okołoodbytnicze przy pierwotnym rozpoznaniu.
- Złożone dolegliwości okołoodbytnicze.
- Dolegliwości związane ze zwężeniami.
- Utrata masy ciała wynosząca ponad 5 kg przed rozpoznaniem choroby.
- Każda resekcja okrężnicy.
- ≥2 resekcje jelita cienkiego.
Dalsze postępowanie
Informacje ogólne
- Należy odbywać regularne wizyty kontrolne zarówno u lekarza rodzinnego, jak i u gastroenterologa.
- Odstępy czasowe zależą m.in. od aktywności i rozprzestrzeniania się choroby lub ewentualnych powikłań.
- Terapia i dalsze postępowanie są ustalane przez specjalistów, dalsze kontrole mogą być prowadzone w porozumieniu z lekarzem rodzinnym.
- Ważne jest, aby zwrócić uwagę na wtórne problemy ze zdrowiem psychicznym; regularne badania kontrolne mogą być istotną pomocą.
Profilaktyka nowotworowa
- Regularne monitorowanie onkologiczne powinno być prowadzone w chorobie Leśniowskiego–Crohna tylko wtedy, gdy zajęta jest okrężnica, podobnie jak we wrzodziejącym zapaleniu jelita grubego.
Postępowanie podczas pandemii COVID–19
- Pacjenci z IBD generalnie nie są narażeni na zwiększone ryzyko zakażenia SARS–CoV–2.
- Niemniej jednak powinni sumiennie stosować środki ochrony indywidualnej.
- Pacjenci z IBD i przyjmujący leczenie immunosupresyjne są narażeni na zwiększone ryzyko zakażenia SARS–CoV–2 i dlatego powinni starannie wdrożyć środki ochrony indywidualnej.
- Stopień zwiększenia ryzyka różni się dla poszczególnych leków immunosupresyjnych.
- Pacjenci z IBD i zakażeniem SARS–CoV–2 mają zwiększone ryzyko ciężkiego przebiegu choroby COVID w określonych warunkach (choroby współistniejące/czynniki ryzyka).
- Tacy pacjenci powinni być uważnie monitorowani pod kątem szybkiego pogorszenia się choroby.
- Ogólnie pacjenci z IBD przyjmujący leki immunosupresyjne nie są narażeni na zwiększone ryzyko ciężkiego przebiegu zakażenia SARS–CoV–2.
- Dlatego nie należy zmniejszać terapii immunosupresyjnej w przypadku COVID o łagodnym lub umiarkowanym przebiegu.
- Wyjątkiem jest długotrwała terapia steroidami ogólnoustrojowymi, zwłaszcza w dawkach większych niż 20 mg ekwiwalentu prednizonu na dobę.
- Należy zatem ich unikać, jeśli to możliwe, lub ograniczać i kończyć terapię, o ile jest to uzasadnione klinicznie.
- W przypadku ostrego rzutu IBD podczas pandemii SARS–CoV–2, warto wybierać terapię biologiczną o spodziewanym szybkim początku działania zamiast wysokodawkowej terapii steroidami ogólnoustrojowymi.
- U pacjentów z ciężką chorobą COVID-19 należy przerwać leczenie tiopurynami, metotreksatem i tofacitinibem, i wznowić je po pokonaniu zakażenia.
- Hospitalizowani pacjenci z IBD i chorobą COVID–19 powinni otrzymywać leki przeciwzakrzepowe co najmniej w dawce profilaktycznej.
- W przypadku pacjentów ambulatoryjnych z COVID–19 decyzja o zastosowaniu profilaktyki przeciwzakrzepowej powinna być podjęta zgodnie z indywidualnym profilem ryzyka i stosowanymi jednocześnie lekami.
- Podczas pandemii należy ograniczyć przyjmowanie pacjentów do placówek ochrony zdrowia.
- Konsultacje IBD powinny być kontynuowane z uwzględnieniem pilności przyjęcia i optymalizacji środków kontroli zakażeń, takich jak dystans przestrzenny oraz po wykorzystaniu możliwości telemedycyny.
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Ilustracje

Wrzód w esicy w chorobie Leśniowskiego-Crohna (dzięki uprzejmości endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
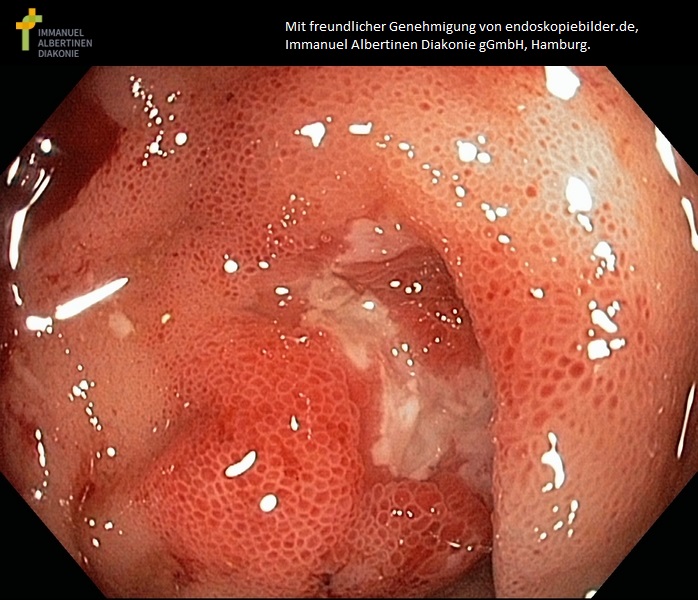
Zapalenie końcowego odcinka jelita krętego - ileitis terminalis (choroba Leśniowskiego-Crohna) (dzięki uprzejmości endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
Jelito grube, badanie przeglądowe
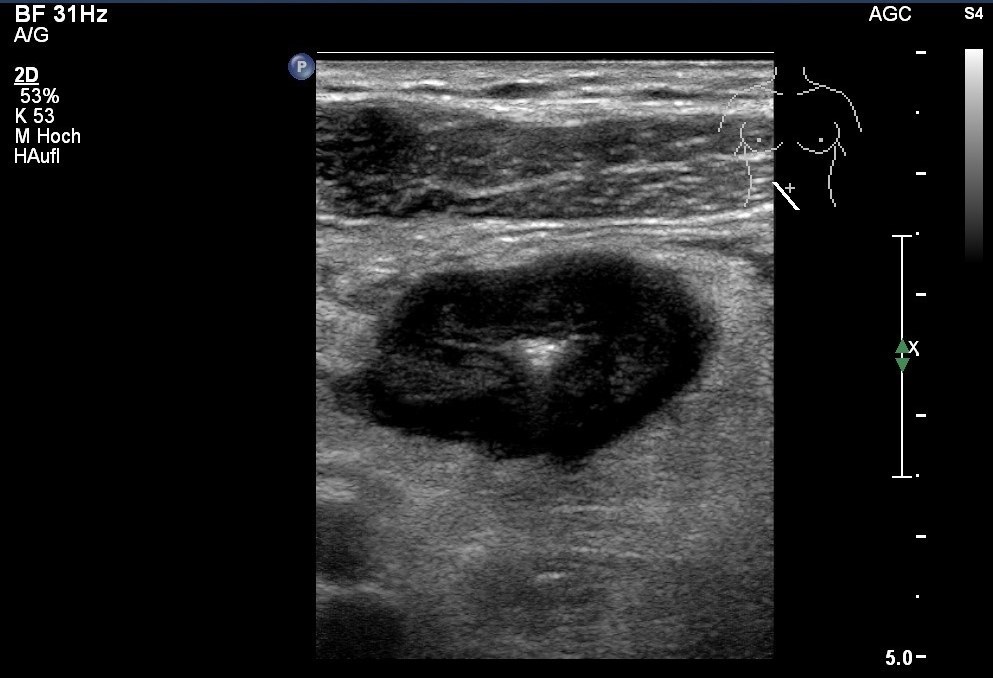
USG: zmiana hipoechogeniczna w chorobie Leśniowskiego-Crohna; pogrubienie ściany ze zwężeniem światła jelita, pogrubiona okołookrężnicza tkanka tłuszczowa o wysokiej echogeniczności (dzięki uprzejmości sonographiebilder.de ©Albertinen-Diakoniewerk e.V., Hamburg)
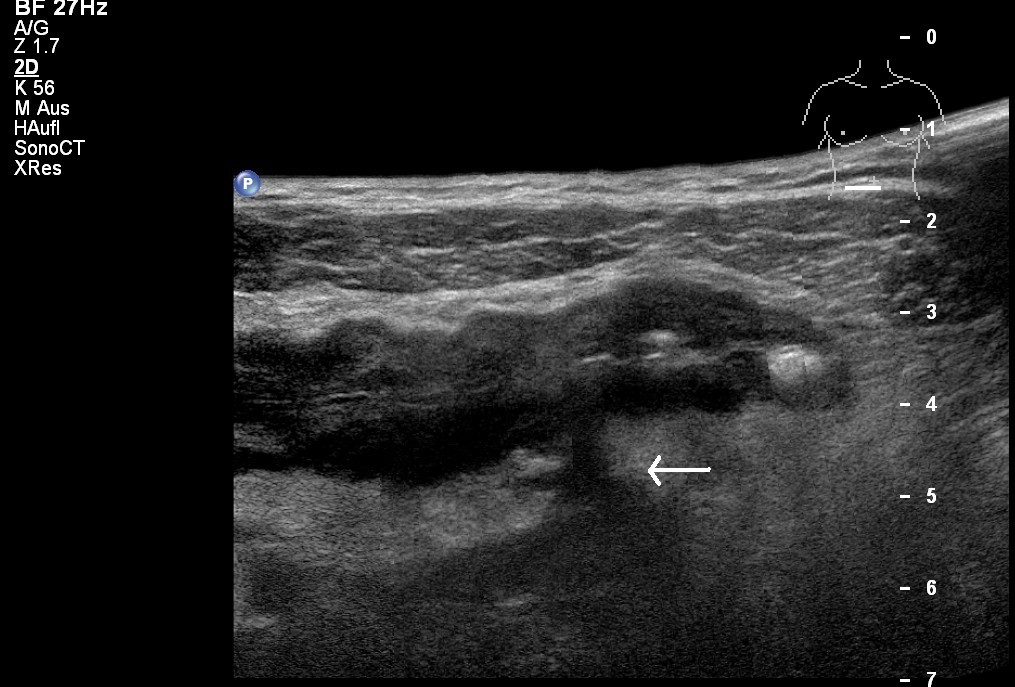
USG: Choroba Leśniowskiego-Crohna z przetoką do okołojelitowej tkanki tłuszczowej (dzięki uprzejmości sonographiebilder.de ©Albertinen-Diakoniewerk e.V., Hamburg)
Źródła
Wytyczne
- Łodyga M., Eder P, Gawron-Kiszka M. et al. Wytyczne Polskiego Towarzystwa Gastroenterologii i Konsultanta Krajowego w dziedzinie Gastroenterologii dotyczące postępowania z pacjentem z chorobą Leśniowskiego-Crohna, Gastroenterology Rev 2021, 16 (4): 257-96, DOI
- Gonciarz M., Szkudłapski D., Mularczyk A. et al. Wytyczne postępowania z chorymi na nieswoiste choroby zapalne jelit w praktyce lekarza rodzinnego, Lekarz POZ. 2017, 3(1): 1-11, termedia.pl
- Torres J., Bonovas S., Doherty G. et al. ECCO Guidelines on Therapeutics in Crohn's Disease: Medical Treatment, J Crohns Colitis, 01.01.2020, 14(1): 4-22, DOI
- Adamina M., Bonovas S., Raine T. et al. ECCO Guidelines on Therapeutics in Crohn's Disease: Surgical Treatment, J Crohns Colitis, 10.02.2020, 14(2): 155-68, DOI
- van Rheenen P.F., Aloi M., Assa A. et al. The Medical Management of Paediatric Crohn's Disease: an ECCO-ESPGHAN Guideline Update, J Crohns Colitis, 07.10.2020, jjaa161, DOI
- Gajendran M., Loganathan P., Catinella A.P., Hashash J.G. A comprehensive review and update on Crohn's disease, Dis Mon. 2018 Feb, 64(2): 20-57, DOI
Piśmiennictwo
- Wilkins T., Jarvis K., Patel J. Diagnosis and management of Crohn's disease, Am Fam Physician 2011, 84: 1365-75, www.ncbi.nlm.nih.gov
- Best W.R., Becktel J.M., Singleton J.W., et al. Development of a Crohn's disease activity index, National Cooperative Crohn's Disease Study, Gastroenterology 1976, 70(3): 439-44, pubmed.ncbi.nlm.nih.gov
- Loftus C.G., Loftus E.V., Jr., Harmsen W.S. et al. Update on the incidence and prevalence of Crohn's disease and ulcerative colitis in Olmsted County, Minnesota, Inflamm Bowel Dis 2007, 13: 254-61, pubmed.ncbi.nlm.nih.gov
- Dolinger M., Torres J., Vermeire S. Crohn's disease, Lancet 23.03.2024, 403(10432): 1177-91, pubmed.ncbi.nlm.nih.gov
- Suryaprasad A.G., Prindiville T. The biology of TNF blockade, Autoimmun Rev 2003, 2: 346-57, PubMed
- Halme L., Paavola-Sakki P., Turunen U., et. al. Family and twin studies in inflammatory bowel disease, World J Gastroenterol 2009, 12: 3668-72, PubMed
- Podolsky D.K. Inflammatory bowel disease, N Engl J Med 2002, 347: 417-29, PubMed
- Andersson R.E., Olaison G., Tysk C. et a. Appendectomy is followed by increased risk of Crohn's disease, Gastroenterology 2003, 124(1): 40-6, pubmed.ncbi.nlm.nih.gov
- Garcia Rodriguez L.A., Ruigomez A., Panes J. Acute gastroenteritis is followed by an increased risk of inflammatory bowel disease, Gastroenterology 2006, 130: 1588-94, pubmed.ncbi.nlm.nih.gov
- Preiß J.C., Bokemeyer B., Buhr H.J., et al. Updated German clinical practice guideline on “diagnosis and treatment of Crohn‘s disease”. Z Gastroenterol 2014, 52: 1431-84, pubmed.ncbi.nlm.nih.gov
- Tibble J., Teahon K., Thjodleifsson B. et al. A simple methood for assessing intestinal inflammation in Crohns's disease, Gut 2000, 47: 506-13, www.ncbi.nlm.nih.gov
- Dong J., Wang H., Zhao J., Zhu W., et al. Ultrasound as a diagnostic tool in detecting active Crohn's disease: a meta-analysis of prospective studies, Eur Radiol. 2014 Jan, 24(1): 26-33, doi: 10.1007/s00330-013-2973-0, www.ncbi.nlm.nih.gov
- Wang H., Zhao J., Zhu W., et al. Ultrasound as a diagnostic tool in detecting active Crohn's disease: a meta-analysis of prospective studies, Eur Radiol. 2014, 24(1): 26-33, doi: 10.1007/s00330-013-2973-0, DOI
- Panés J., Bouzas R., Chaparro M. et al. Systematic review: the use of ultrasonography, computed tomography and magnetic resonance imaging for the diagnosis, assessment of activity and abdominal complications of Crohn’s disease, Aliment Pharmacol Ther 2011, 34(2): 125-45, pubmed.ncbi.nlm.nih.gov
- Frøslie K.F., Jahnsen J., Moum B.A., et al. Mucosal healing in inflammatory bowel disease: results from a Norwegian population- based cohort. Gastroenterology 2007, 133: 412-22, pubmed.ncbi.nlm.nih.gov
- Gomollón F. et al. 3rd European evidence- based consensus on the diagnosis and management of Crohn’s disease 2016: part 1: diagnosis and medical management on behalf of ECCO, Journal of Crohn's and Colitis 2017, 11(1): 3-25, doi.org
- Lichtenstein G.R. et al. ACG Clinical Guideline: Management of Crohn's Disease in Adults,Am J Gastroenterol 2018, 113: 481-517, pubmed.ncbi.nlm.nih.gov
- Cosnes J., Beaugerie L., Carbonnel F. et al. Smoking cessation and the course of Crohn's disease: an intervention study, Gastroenterology 2001, 120: 1093-9, www.ncbi.nlm.nih.gov
- Kelly D., Fleming R. Nutritional considerations in inflammatory bowel disease, Gastroenterol Clin North Am 1995, 24: 597-611, www.ncbi.nlm.nih.gov
- Zhan Y.L., Zhan Y.A., Dai S.X. Is a low FODMAP diet beneficial for patients with inflammatory bowel disease? A meta-analysis and systematic review, Clin Nutr. 24.05.2017, pmid:28587774, PubMed
- Zhao X., Zhou C., Chen H., et al. Efficacy and safety of medical therapy for low bone mineral density in patients with Crohn disease: A systematic review with network meta-analysis, Medicine (Baltimore) 2017 Mar, 96(11): e6378, pubmed.ncbi.nlm.nih.gov
- Farmer R.G., Hawk W.A., Turnbull R.B., Jr. Indications for surgery in Crohn's disease: analysis of 500 cases, Gastroenterology 1976, 71: 245-50, www.ncbi.nlm.nih.gov
- Grimstad T., Norheim K.B., Isaksen K. et al. Fatigue in Newly Diagnosed Inflammatory Bowel Disease, J Crohns Colitis 2015, 9: 725-30, pmid:25994356, PubMed
- Takeuchi K., Smale S., Premchand P., et al. Prevalence and mechanism of nonsteroidal anti-inflammatory drug-induced clinical relapse in patients with inflammatory bowel disease, Clin Gastroenterol Hepatol 2006, 4: 196-202, PubMed
- Zagórowicz E., Walkiewicz D., Kucha P., et al. Nationwide data on epidemiology of inflammatory bowel disease in Poland between 2009 and 2020, Pol Arch Intern Med. 2022, 132: 16194, pubmed.ncbi.nlm.nih.gov
- Hampe J., Cuthbert A., Croucher P.J.P., Mirza M.M. et al. Association between insertion mutation in NOD2 gene and Crohn's disease in German and British populations, Lancet 2001, 357: 1925-8, PubMed
- Abraham C., Cho J.H. Inflammatory bowel disease, N Engl J Med 2009, 361: 2066-78, New England Journal of Medicine
- Rath H.C., Schultz M., Freitag R., et al. Different subsets of enteric bacteria induce and perpetuate experimental colitis in rats and mice, Infect Immun 2001, 69: 2277-85, PubMed
- Feagan B.G. Maintenance therapy for inflammatory bowel disease, Am J Gastroenterol 2003, 98: 6-17, PubMed
- van Rheenen P.F., de Vijver E.V., Fidler V. Faecal calprotectin for screening of patients with suspected inflammatory bowel disease: diagnostic meta-analysis, BMJ 2010, 341: c3369, BMJ (DOI)
- Yamamato T. The clinical value of faecal calprotectin and lactoferrin measurement in postoperative Crohn's disease, United European Gastroenterology Journal 2015, 3: 5-10, doi:10.1177/2050640614558106, DOI
- Holtman G.A., Lisman-van Leeuwen Y., Reitsma J.B., et al.. Noninvasive tests for inflammatory bowel disease: A meta-analysis, Pediatrics 2016, 137: 1-11, doi:10.1542, pediatrics.aappublications.org
- Yang Z., Clark N., Park K.T. Effectiveness and cost-effectiveness of measuring fecal calprotectin in diagnosis of inflammatory bowel disease in adults and children, Clin Gastroenterol Hepatol 2014, 12: 253-62, pmid:23883663 PubMed
Opracowanie
- Grzegorz Margas (recenzent)
- Adam Windak (redaktor)
- Lino Witte (recenzent/redaktor)
