Co to jest ostra białaczka szpikowa?
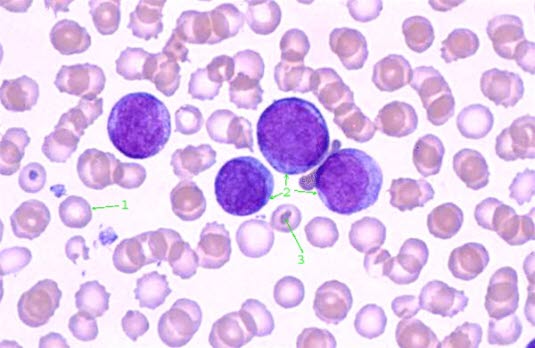
Ostra białaczka szpikowa (AML) to nowotwór krwi, charakteryzujący się niekontrolowanym wzrostem niedojrzałych komórek krwi, zwanych blastami. Choroba zaburza wczesny proces tworzenia krwi, wskutek czego komórki krwi różnych typów nie różnicują się dalej w określone typy prawidłowych krwinek, ale mnożą się w niedojrzałym stadium. Prowadzi to do niedoboru zdrowych komórek: białych krwinek, czerwonych krwinek i płytek krwi. Komórki nowotworowe gromadzą się głównie w szpiku kostnym oraz we krwi.
Objawy
Objawy AML mogą rozwijać się stosunkowo szybko, choć w niektórych przypadkach mogą trwać dłużej. Do najczęstszych objawów należą:
- Zmęczenie
Często związane z niedokrwistością, wynikającą z niedoboru czerwonych krwinek. - Podatność na zakażenia
Z powodu zmniejszonej liczby zdrowych białych krwinek, co osłabia układ odpornościowy. - Krwotoki skórne i z błon śluzowych
Wynikające z niedoboru płytek krwi (trombocytów). - Ból brzucha i utrata apetytu
Często występujące objawy towarzyszące.
Inne, rzadsze objawy mogą obejmować problemy z ostrością widzenia, wysypki, bóle głowy, owrzodzenia jamy ustnej, nudności, wymioty (spowodowane podrażnieniem opon mózgowych) oraz ból kończyn dolnych i stawów.
Częstość występowania
AML najczęściej występuje u osób dorosłych. W przypadku tej choroby diagnozuje się co roku ok. 3–4 nowe przypadki na 100 000 osób. AML może wystąpić w każdym wieku, ale częściej występuje w wieku zaawansowanym (między 70. a 80. rokiem życia).
Przyczyny
Komórki nowotworowe w AML mają zdolność do niekontrolowanego wzrostu i nie potrafią dojrzewać, przez co nie funkcjonują jak zdrowe komórki. To prowadzi do niedoboru czerwonych krwinek, płytek krwi i różnych białych krwinek. Ryzyko wystąpienia białaczki zwiększają niektóre substancje chemicznePromieniowanie jonizujące oraz chemioterapia, jednak u większości pacjentów przyczyna pozostaje niewyjaśniona.
Diagnostyka
Diagnostyka AML rozpoczyna się od oceny ogólnych objawów, takich jak zmęczenie, bladość, krwawienia czy nawracające zakażenia. Badania krwi mogą wskazywać na niedokrwistość i inne nieprawidłowości, co potwierdza podejrzenie białaczki. Kluczowe badania obejmują:
- Mikroskopowe badanie rozmazu krwi i szpiku kostnego: W badaniu wykazuje się wzrost liczby niedojrzałych komórek (blastów) powyżej 20% w krwi lub szpiku kostnym. Badania krwi mogą również wykazać podwyższone stężenie kwasu moczowego.
Pobranie próbki szpiku kostnego odbywa się najczęściej z tylnego grzebienia kości biodrowej, co jest zabiegiem o niskim ryzyku powikłań. Próbka jest następnie analizowana mikroskopowo, a charakterystyczne cechy dla AML to duża gęstość komórek i wysoka liczba blastów.
Leczenie
Cele leczenia
Leczenie ma na celu, o ile to możliwe, wyleczenie choroby i zapobieganie nawrotom. Pierwszym etapem leczenia jest próba zniszczenia komórek nowotworowych za pomocą określonej chemioterapii, celem przywrócenia prawidłowej morfologii krwi, prawidłowego rozmieszczenia komórek w szpiku kostnym i dobrego ogólnego stanu fizycznego. pacjenta. Kontynuacja leczenia skupia się na zapobieganiu nawrotom choroby. W każdym przypadku stosuje się leczenie w celu złagodzenia dolegliwości bólowych i objawów, nawet jeśli wyleczenie nie jest możliwe.
Terapia indukcyjna/chemioterapia
Leczenie ostrej białaczki szpikowej rozpoczyna się od intensywnej chemioterapii, znanej jako terapia indukcyjna. Ta forma leczenia ma na celu zniszczenie komórek nowotworowych, ale niestety również hamuje wzrost prawidłowych komórek krwi w szpiku kostnym. W związku z tym, aby zrekompensować niedobór krwinek, podczas terapii wykonuje się transfuzje krwi.
Regeneracja zdrowych komórek szpiku kostnego trwa zazwyczaj od 2 do 3 tygodni. W tym czasie pacjenci otrzymują leczenie profilaktyczne antybiotykami, aby zapobiec infekcjom, które mogą wystąpić w wyniku osłabienia układu odpornościowego. Po zakończeniu leczenia indukcyjnego, następuje terapia uzupełniająca (terapia konsolidacyjna), która ma na celu dalsze zniszczenie pozostałych komórek nowotworowych i zmniejszenie ryzyka nawrotu choroby.
Przeszczep komórek macierzystych
Rokowanie
Początek ostrej białaczki szpikowej (AML) jest często nagły, a objawy rozwijają się zwykle w ciągu kilku tygodni. W niektórych przypadkach przebieg choroby może być przedłużony. Szanse na wyleczenie są stosunkowo wysokie, zwłaszcza u osób młodszych: całkowitą remisję, oznaczającą normalizację wyników badań krwi i szpiku kostnego, osiąga 70–80% dorosłych w wieku poniżej 60 lat.
Leczenie AML jest intensywne i może być wyniszczające. Istnieje ryzyko powikłań, takich jak zakażenia czy krwotoki, które w rzadkich przypadkach mogą prowadzić do stanu zagrożenia życia. Podobnie jak w innych nowotworach, choroba i jej leczenie mogą wywierać znaczący wpływ na jakość życia pacjentów. Emocje, takie jak lęk, depresja, smutek, rozczarowanie, bezradność, bunt czy złość, są normalne w tej sytuacji. Wsparcie psychologiczne, zwłaszcza w formie psychoterapii, jest często pomocne.
Podczas leczenia mogą wystąpić również przejściowe zmiany fizyczne, takie jak utrata masy ciała, podrażnienie błon śluzowych oraz wypadanie włosów. Większość tych działań niepożądanych ustępuje całkowicie po zakończeniu terapii.
Życie codzienne z ostrą białaczką szpikową
AML to poważna choroba. Ma ona wpływ nie tylko na chorych, ale także na ich bliskich ze względu na ciężkie objawy i związaną z nią sytuację zmieniającą życie. Wsparcie psychoonkologiczne jest często ważne i pomocne.
Dodatkowe informacje
- ostra białaczka szpikowa, rozpoznanie
- ostra białaczka szpikowa — informacje dla personelu medycznego
Autorzy
- Joanna Dąbrowska-Juszczak, lekarz (redaktor)
- Kalina van der Bend, lekarz (recenzent)
- Thomas M. Heim, dziennikarz naukowy (recenzent/redaktor)
- Susanne Meinrenken, lekarz (recenzent/redaktor)
Link lists
Authors
Previous authors
Updates
Gallery
Snomed
References
Based on professional document Ostra białaczka szpikowa. References are shown below.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology 2023: Acute Myeloid Leukemia. jnccn.org
- Hołowiecki J. Białaczki ostre. W: Gajewski P. Red. Interna Szczeklika 2023, Medycyna Praktyczna, Kraków, 2023.
- Raj K., Mehta P. Acute myelogenous leukaemia, BMJ Best Practice, aktualizacja: 01.2016, bestpractice.bmj.com
- Estey E., Döhner H. Acute myeloid leukaemia, Lancet 2006, 368: 1894-907, PubMed
- Vardiman J.W., Thiele J., Arber D.A., et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes, Blood. 2009,114: 937-51, PubMed
- Juliusson G., Antunovic P., Derolf A., et al.: Age and acute myeloid leukemia: real world data on decision to treat and outcomes from the Swedish Acute Leukemia Registry, Blood 113: 4179-87, 2009, DOI:10.1182/blood-2008-07-172007, DOI
- European Society for Medical Oncology. Acute myeloblastic leukaemias in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, 2020., www.esmo.org
- Youn B.S., Mantel C., Broxmeyer H.E. Chemokines, chemokine receptors and hematopoiesis. Immunol Rev. 2000, 177:150-74, PubMed
- Cardi E., Gilbert F.S., Carpenter L., et al. Effects of low doses of and low dose rates of external ionizing radiation: cancer mortality among nuclear industry workers in three countries, Radiat Res 1995, 142: 117-32, PubMed
- Fircanis S., Merriam P., Khan N., Castillo J.J.: The relation between cigarette smoking and risk of acute myeloid leukemia: an updated meta-analysis of epidemiological studies, Am J Hematol 89: 125-32, DOI:10.1002/ajh.23744, DOI
- Smith S.M., Le Beau M.M., Huo D., et al. Clinical-cytogentic associations in 306 patients with therapy-related myelodysplasia or myeloid leukemia: the University of Chicago series, Blood 2003, 102: 43-52, www.ncbi.nlm.nih.gov
- Zalecenia postępowania diagnostyczno-terapeutycznego 2021. Polskie Towarzystwo Onkologii Klinicznej. Ostra białaczka szpikowa. onkologia.zalecenia.med.pl
- Kelly L.M., Gilliland D.G. Genetics of myeloid leukemias, Annu Rev Genomics Hum Genet 2002, 3: 179-98, PubMed
- Fröhling S., Scholl C., Gilliland D.G., Levine R.L. Genetics of myeloid malignancies - pathogenetic and clinical implications, J Clin Oncol 2005, 23: 6285-95, PubMed
- Arber D.A., Orazi A., Hasserjian R. et al.: The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia, Blood 127: 2391-405, 2016, DOI:10.1182/blood-2016-03-643544, DOI
- Swerdlow S.H., Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H et al., red. WHO classification of tumours of haematopoietic and lymphoid tissue. 4 utg. Lyon: IARC; 2008. www.ncbi.nlm.nih.gov
- Sekeres MA, Elson P, Kalaycio ME et al.: Time from diagnosis to treatment initiation predicts survival in younger, but not older, acute myeloid leukemia patients. Blood 113:28-36, 2009. DOI:10.1182/blood-2008-05-157065 DOI
- Leone G, Pagano L, Ben-Yehuda D, et al. Therapy-related leukemia and myelodysplasia: susceptibility and incidence. Haematologica. 2007;92:1389-1398. PubMed
