Streszczenie
- Definicja: Toksyczna nekroliza naskórka (toxic epidermal necrolysis – TEN) to ostra, zagrażająca życiu choroba skóry objawiająca się rozległą erytrodermią, odwarstwieniem naskórka i błon śluzowych, której towarzyszy gorączka i różnego stopnia zajęcia narządów. TEN jest maksymalnym wariantem skórnej reakcji na leki. Zespół Stevensa–Johnsona (Stevens–Johnson syndrome – SJS) ma tę samą etiologię, ale cechuje go mniejszy stopień zajęcia skóry (maksymalnie 10% powierzchni skóry).
- Epidemiologia: Częstość występowania (włącznie z zespołem Stevensa–Johnsona) szacuje się na 4–7 przypadków na 1 milion osób rocznie. Najczęstszym czynnikiem wyzwalającym w Europie jest allopurynol.
- Objawy: Choroba często rozpoczyna się objawami prodromalnymi w postaci gorączki i objawów grypopodobnych oraz dyskomfortem w obrębie błon śluzowych i oczu.
- Badanie fizykalne: Po upływie od 1 do 3 dni na twarzy, szyi i tułowiu pojawia się czerwona wysypka przypominająca odrę, która szybko rozprzestrzenia się na kończyny i prowadzi do powstawania pęcherzy i miejscowego odwarstwiania się skóry.
- Diagnostyka: Rozpoznanie na podstawie objawów klinicznych. W razie potrzeby biopsja skóry może potwierdzić rozpoznanie.
- Leczenie: Leczenie polega na odstawieniu leku wyzwalającego i natychmiastowym podjęciu intensywnego leczenia ogólnego.
- Rokowanie: Wysoka śmiertelność (do 50%). U pacjentów, którzy wyzdrowieją zwykle nie pozostają blizny. Częste są powikłania okulistyczne aż do ślepoty.
Informacje ogólne
Definicja
- Ciężki maksymalny wariant skórnej reakcji na lek
- Charakteryzuje się rozległym odwarstwieniem skóry i błon śluzowych.
- Czasami współistnieją poważne objawy układowe.
- Wysoka śmiertelność (20–50%).
- Synonimy: zespół Lyella wywołany lekami, Epidermolysis necroticans combustiformis, zespół oparzonej skóry, TEN.
- Ryzyko wystąpienia TEN jest najwyższe między 4. a 28. dniem po rozpoczęciu leczenia farmakologicznego.
- Choroba jest uważana za maksymalny wariant zespołu Stevensa-Johnsona, z minimalnym zajęciem >30% powierzchni ciała.
- Zespół Stevensa–Johnsona (SJS) i toksyczna nekroliza naskórka (TEN) są uważane za różne stadia rozwojowe tej samej choroby.
- W przypadku SJS zajęte jest tylko maksymalnie 10% skóry.
- Istnieją formy przejściowe z zajęciem od 10 do 30% powierzchni skóry.
- SJS i TEN są ostrymi, potencjalnie zagrażającymi życiu chorobami skóry i błon śluzowych z rozległym rumieniem, powstawaniem pęcherzy i ostatecznie odwarstwieniem naskórka.
- Choroba prawie wyłącznie wywoływana jest przez leki.
- W Europie za najczęstszy czynnik wyzwalający uważa się allopurynol.
- Zobacz również artykuł reakcje skórne wywołane przez leki.
Epidemiologia
- Zapadalność na zespół Stevensa-Johnsona i toksyczną nekrolizę naskórka (wraz z postaciami przejściowymi) wynosi 4–7 przypadków na 1 milion osób rocznie.1
- SJS jako łagodniejsza forma przebiegu występuje około 3 razy częściej niż TEN.
- Najnowsze dane sugerują, że zapadalność na toksyczną nekrolizę naskórka (TEN) wynosi 1,5–1,8/1 000 000 osób rocznie.
- TEN występuje znacznie częściej u pacjentów z jawnym AIDS: zapadalność wynosi do 1000/1 000 000 rocznie u osób zakażonych wirusem HIV.
- Choroba może wystąpić we wszystkich grupach wiekowych, ale najczęściej występuje u osób starszych (średni wiek to 60–70 lat), u biorców przeszczepu szpiku kostnego oraz u pacjentów z toczniem rumieniowatym układowym lub zakażeniem HIV.2
- Chorują głównie kobiety (nawet 10 razy częściej niż mężczyźni).
- TEN jest chorobą osób starszych, również dlatego, że osoby starsze zwykle przyjmują więcej leków, mają więcej chorób współistniejących, a reakcje układu odpornościowego zmieniają się wraz z wiekiem.
- Choroba bardzo rzadko występuje wśród dzieci i młodzieży.
Etiologia i patogeneza
- SJS, TEN i rumień (wysiękowy) wielopostaciowy charakteryzują pewne podobieństwa, przez długi czas związek między tymi 3 pęcherzowymi chorobami skóry był niejasny.
- Zgodnie z obecnym stanem wiedzy, rumień wielopostaciowy jest uważany za odrębną jednostkę chorobową, podczas gdy zespół Stevensa–Johnsona i toksyczna nekroliza naskórka są tą samą chorobą o różnym stopniu nasilenia.
Rozległa utrata naskórka
- Konsekwencją rozległej utraty naskórka jest duża utrata płynów, zaburzona termoregulacja, zwiększona utrata energii, zaburzenia immunologiczne i uszkodzona bariera mechaniczna, co czyni pacjentów bardziej podatnymi na zakażenia.
- Posocznica jest główną przyczyną zgonu.
Patofizjologia
- Uważa się, że choroba jest reakcją cytotoksyczną przeciwko naskórkowi, w której pośredniczą limfocyty T, co prowadzi do zaprogramowanej śmierci komórkowej (apoptozy) keratynocytów.2-5
- Choroba jest prawie wyłącznie wywoływana przez leki, ale opisano pojedyncze przypadki, w których uważano, że chorobę wywołały antygeny drobnoustrojów, takie jak szczepienia, zakażenia lub narażenie na toksyny.
- Ponad 100 różnych leków zostało zakwalifikowanych jako możliwe czynniki wyzwalające toksyczną nekrolizę naskórka. Najczęściej są to allopurynol, antybiotyki (sulfonamidy, fluorochinolony, minocyklina, cefalosporyny i penicyliny), leki przeciwdrgawkowe (lamotrygina, karbamazepina, fenytoina, fenobarbital), niektóre niesteroidowe leki przeciwzapalne, newirapina i sertralina.6-7
- Rozpoczęcie przyjmowania leków ma zwykle miejsce 2–4 tygodnie przed wystąpieniem objawów, ale można zaobserwować krótszy okres utajenia, zwłaszcza w przypadku wielokrotnej ekspozycji na lek.
- U niektórych pacjentów ze spowolnionym lub zmienionym metabolizmem leków, może dochodzić do wyższego stężenia leków i nadprodukcji reaktywnych metabolitów, które mogą zmieniać strukturę keratynocytów i predysponować do patologicznej odpowiedzi immunologicznej.
- W rezultacie dochodzi do apoptozy, która prowadzi do śmierci komórkowej keratynocytów, a następnie nekrolizy naskórka.
- Uwalnianie cytokin zapalnych powoduje wysoką gorączkę, syntezę białek ostrej fazy, hipoalbuminemię i leukopenię oraz prowadzi do wystąpienia objawów ogólnych.
- Konsekwencją rozległej utraty naskórka jest duża utrata płynów, zaburzona termoregulacja, zwiększona utrata energii, zaburzenia immunologiczne i uszkodzona bariera skórna, co zwiększa podatność na zakażenia.8
Czynniki predysponujące
- Przyjmowanie leków – najczęstszą przyczyną są następujące grupy:
- allopurynol
- zwiększone ryzyko w przypadku: istniejącej choroby serca lub nerek, wieku >70 lat, płci żeńskiej, pochodzenia azjatyckiego
- antybiotyki (sulfonamidy, penicyliny, cefalosporyny)
- leki przeciwpsychotyczne i przeciwdrgawkowe (lamotrygina, karbamazepina, fenytoina, fenobarbital)
- leki przeciwbólowe i NLPZ
- inne: pantoprazol, tramadol, sertralina.
- allopurynol
- Zwiększone ryzyko w przypadku:
- chorób serca i nerek
- zakażenia HIV
- innego zakażenia wirusowego w tym samym czasie
- uwarunkowań genetycznych
- chorób immunologicznych.
ICD–10
- L51.2 Toksyczna nekroliza naskórka [zespół Lyella].
- T88.7 Nieokreślone działanie niepożądane leku lub środka farmakologicznego.
Diagnostyka
Kryteria diagnostyczne
- Erytrodermia, powstawanie pęcherzy, oddzielanie się naskórka i gorączka, a także zły stan ogólny.
- Chorobę można często rozpoznać na podstawie badania przedmiotowego i potwierdzić za pomocą biopsji skóry.
- Biopsja: pęcherzy wewnątrznaskórkowych, a zwłaszcza podnaskórkowych; pęcherze pokryte są naskórkiem.
- Do rozpoznania zespołu Stevensa–Johnsona konieczne jest oddzielenie się do 10% naskórka, natomiast do rozpoznania toksycznej nekrolizy naskórka wymagane jest zajęcie ponad 30% powierzchni ciała.
Diagnostyka różnicowa
- Rumień (wysiękowy) wielopostaciowy (częściej wirusowy, samoistnie ustępujący).
- Inne reakcje skórne wywołane przez leki.
- Pemfigoid pęcherzowy.
- Pęcherzyca.
- Gronkowcowy zespół oparzeniowy skóry (staphylococcal scalded skin syndrome – SSSS, głównie u dzieci, pęcherze śródnaskórkowe, a zatem o mniejszym nasileniu).
- Zespół wstrząsu toksycznego (toxic shock syndrome – TSS, bardziej powszechny u pacjentów na intensywnej terapii lub miesiączkujących kobiet stosujących tampony).
Wywiad i badanie fizykalne
- Częste są objawy prodromalne, takie jak:
- Wysypka
- Najczęściej zajęte są twarz, tułów i powierzchnie wyprostne kończyn.
- Zlewający się rumień (erytrodermia), zaczerwienienie i obrzęk twarzy, bóle, martwica skóry, pęcherze i odwarstwianie się skóry.
- Pęcherze i strupy na błonach śluzowych.
- Początek stosowania leku wyzwalającego zwykle przypada na 2–4 tygodnie przed wystąpieniem objawów, ale można zaobserwować krótszy okres utajenia, szczególnie w przypadku wielokrotnej ekspozycji na działanie danego leku.
- W przebiegu choroby wyróżnia się fazę progresji, stabilizacji i regeneracji.
Faza progresji
- Przebieg
- Choroba często rozwija się etapami w ciągu 3–4 dni (faza progresji) aż do maksymalnego zajęcia skóry.
- Pacjenci mają wrażliwą, piekącą skórę, pojawiają się pęcherze, które szybko pękają, prowadząc do bolesnych nadżerek pokrytych martwiczymi komórkami nabłonka, fibryną lub krwotocznymi skorupami.
-
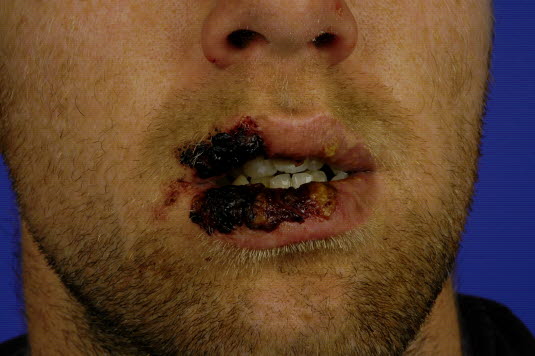 Zespół Stevensa-JohnsonaZmiany skórne
Zespół Stevensa-JohnsonaZmiany skórne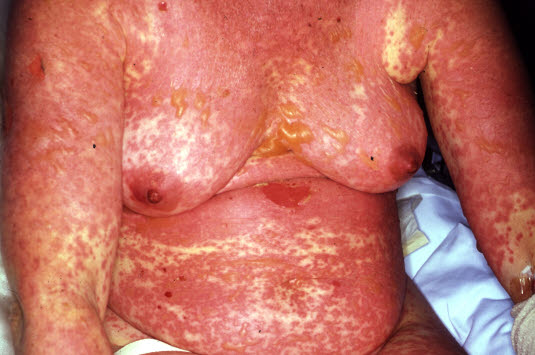 Toksyczna nekroliza naskórka
Toksyczna nekroliza naskórka- Po upływie od 1 do 3 dni na twarzy, szyi i tułowiu pojawia się czerwona wysypka przypominająca odrę, która szybko rozprzestrzenia się na kończyny.
- Często wrażliwe, szarawe, blade wykwity skórne zlewają się ze sobą i stają się obrzęknięte.
- W SJS można zaobserwować zmiany kształtem przypominające błyskawicę, ale mogą one być również całkowicie nieobecne.
- Objaw Nikolskiego jest dodatni: lekkie pocieranie skóry może powodować łuszczenie się naskórka, pozostawiając krwawiące nadżerki.
- Choroba przypomina rozległe oparzenia II stopnia. Zajęte jest średnio do 70% skóry, podczas gdy 100% utraty naskórka może nastąpić w ciągu 24 godzin.
- Zwykle szybko pojawia się potrzeba przyjęcia pacjenta na oddział intensywnej terapii!
- Zmiany błony śluzowej w ponad 90% przypadków
- Błony śluzowe zajmowane na wczesnym etapie.
- Objawy oczne są powszechne w przypadku nadżerkowego rzekomobłoniastego zapalenia spojówek, nadżerek rogówki i synechii.9
- Pacjentom grozi ślepota.
- Rozległe zmiany błony śluzowej przewodu pokarmowego mogą prowadzić do biegunki, krwawienia lub, w rzadkich przypadkach, perforacji jelit.
- W niektórych przypadkach może również dojść do zajęcia nabłonka dróg oddechowych (uwaga: duszność i nadmierne wydzielanie śluzu w oskrzelach!).10
- Inne zmiany
- Śródmiąższowy obrzęk płuc może występować u 30% pacjentów, ewentualnie też zespół ostrej niewydolności oddechowej (acute respiratory distress syndrome – ARDS).
- Uszkodzenie wątroby, zapalenie trzustki i zajęcie nerek są rzadszymi powikłaniami.11
Faza stabilizacji i faza regeneracji
- Po fazie progresji („faza mokra”) następuje faza stabilizacji („faza sucha”) z reepitelializacją, zwykle w okresie 1–3 tygodni.
- Zwykle gojenie bez blizn, ale możliwe ze zmianami pigmentowymi, prosakami, łysieniem i dystrofią paznokci.
- Gojenie się zmian na błonie śluzowej może trwać kilka miesięcy i pozostawiać synechie.
- Powikłania okulistyczne są powszechne i obejmują liczne zmiany, od suchości oczu do przewlekłego zapalenia spojówek, owrzodzeń, unaczynienia rogówki i zrośnięcia się powieki z gałką oczną, co może prowadzić do ślepoty.9
Badania uzupełniające (zwykle nie są wykonywane w trybie ambulatoryjnym)
- W przypadku podejrzenia choroby pacjenci muszą zostać natychmiast przyjęci do szpitala z oddziałem intensywnej opieki medycznej.
- Opóźnienie przyjęcia z powodu przeprowadzania badań krwi nie jest wskazane.
- W przypadku rozległego oddzielenia naskórka korzystne jest przeniesienie do ośrodka leczenia oparzeń.
- Zazwyczaj podwyższony OB, leukocytoza, małopłytkowość i niedokrwistość normochromiczna, normocytarna.
- Można również zaobserwować leukopenię (zwykle limfopenię), która jest objawem niekorzystnym rokowniczo.8
- Nieswoisty wzrost aktywności aminotransferaz wątrobowych (AST, ALT) od 2 do 3 razy powyżej górnej granicy normy.
- Wyraźny spadek albuminy w surowicy jest spowodowany utratą płynu bogatego w białko ze skóry, prawdopodobnie w postaci biegunki bogatej w białko.
Diagnostyka specjalistyczna
- Biopsja skóry
- Wycinek może potwierdzić rozpoznanie.
- Bezpośrednia immunofluorescencja preparatu w celu wykluczenia autoimmunologicznych pęcherzowych chorób skóry.
- Histologicznie występuje martwica naskórka, której towarzyszy rzadki naciek zapalny w skórze właściwej. Widoczne jest podnaskórkowe odwarstwienie martwiczego naskórka, prowadzące do rozszczepienia i powstawania pęcherzy między naskórkiem a skórą właściwą.
- Identyfikacja leku wyzwalającego
- Nie ma wiarygodnego testu in vitro, który mógłby zidentyfikować lek wyzwalający.
- Test punktowy, test śródskórny i testy płatkowe nie są wiarygodne.
- Prowokacja może wywołać nowy epizod choroby i dlatego nie jest wykonywana.
Wskazania do hospitalizacji
- Natychmiastowe skierowanie w przypadku podejrzenia rozpoznania.
- Leczenie wymaga interdyscyplinarnej współpracy między oddziałem dermatologii, ewentualnie oddziałem oparzeń, chirurgii plastycznej i oddziałem intensywnej terapii.
Leczenie
Cele leczenia
- Utrzymanie pacjenta przy życiu.
- Zapobieganie powikłaniom.
Ogólne informacje o leczeniu
- W przypadku podejrzenia zespołu Stevensa–Johnsona lub toksycznej nekrolizy naskórka, należy natychmiast odstawić wszystkie leki, które nie utrzymują pacjenta przy życiu. Szczególne podejrzenie obejmuje produkty lecznicze, które były stosowane w ciągu ostatnich 4 tygodni.12
- Terapia wspomagająca ma kluczowe znaczenie w leczeniu choroby: pielęgnacja ran, płynoterapia i uzupełnianie niedoborów elektrolitów, odżywianie, kontrola bólu i temperatury, kontrola zakażeń.
- Ewentualnie leczenie modyfikujące przebieg choroby.
- Leczenie bólu.
- Wczesne rozpoznanie i leczenie zakażeń.
Leczenie wspomagające (szpitalne)
Płynoterapia i leczenie żywieniowe
- Środki intensywnej opieki medycznej.
- Dożylne wyrównanie zaburzeń równowagi wodno-elektrolitowej.
- Zintensyfikowane odżywianie, np. za pomocą zgłębnika żołądkowego, jest konieczne, aby zapobiec spadkowi stężenia albumin.
Miejscowe leczenie skóry
- Pacjenci powinni leżeć na folii aluminiowej i materacu przeciwodleżynowym.
- Pacjenci są leczeni w ogrzewanym pomieszczeniu o temperaturze pokojowej 30–33°C, co obniża metabolizm.
- Dbanie o aseptyczność postępowania (odzież ochronna) zmniejsza ryzyko zakażenia.
- Do mycia i ewentualnie kremowania skóry stosuje się miejscowe środki antyseptyczne.
- Opatrunki hydrożelowe i impregnowane srebrem również można zastosować w ramach leczenia miejscowego.
- Obszary zniszczonej skóry z odsłoniętą skórą właściwą należy chronić, aby poprawić kontrolę ciepła i zmniejszyć utratę płynów, ból i ryzyko zakażenia bakteryjnego.
- Zalecany jest nieprzylegający bandaż.
- Obszary z powierzchnią naskórka należy chronić przed urazami i w jak największym stopniu zachowywać nienaruszony naskórek, w razie szybkiej reepitelializacji.
- Oderwany i martwiczy naskórek należy ostrożnie usunąć za pomocą chusteczek nasączonych sterylną solą fizjologiczną.
- Strupy w uszach, nosie i ustach należy codziennie usuwać, aby zapobiec wtórnym zakażeniom.
- Do pielęgnacji jamy ustnej można stosować środki antyseptyczne i miejscowo znieczulające.
- Zmiany śluzówkowe w oczach wymagają szczególnej uwagi i codziennej opieki okulisty.
Leczenie farmakologiczne
Leczenie modyfikujące przebieg choroby
- Nie ma jeszcze wytycznych opartych na dowodach, ponieważ brakuje większych badań ze względu na rzadkość występowania choroby.
- Okno terapeutyczne trwa od 2 do 4 dni.
- Wskazane preparaty mogą obejmować glikokortykosteroidy, cyklosporynę i dożylną immunoglobulinę (IVIG), ale zastosowanie każdego z nich jest kontrowersyjne.13-15
- Glikokortykosteroidy16-25
- Z jednej strony mogą one łagodzić progresję choroby, ale jednocześnie zwiększają ryzyko powikłań, takich jak posocznica, krwawienie z przewodu pokarmowego i przedłużona reepitelializacja.11,26
- Niemniej jednak nadal zaleca się krótkotrwałą terapię uderzeniową.
- Nie zaleca się długotrwałego stosowania.
- Immunoglobuliny podawane dożylnie
- Zyskały szerokie zastosowanie po pozytywnych wynikach badań.
- Jednak metaanaliza danych obserwacyjnych z 2012 roku wykazała, że leczenie prawdopodobnie nie przynosi oczekiwanego efektu.27
- Cyklosporyna.28
- Infliksymab i etanercept (inhibitory TNF–alfa)
- Dają obiecujące efekty w indywidualnych przypadkach, ale nie zostały wystarczająco ocenione pod kątem powszechnego stosowania.29-30
Inne możliwe metody leczenia
- Antybiotyki
- Tylko w przypadku zakażenia.
- W związku z udokumentowanymi zakażeniami lub klinicznymi objawami posocznicy, antybiotyki są podawane w zależności od wyniku posiewu.13
- Plazmafereza
- Może być stosowana początkowo w celu usunięcia z krążenia leku wyzwalającego chorobę, jego metabolitów i reaktywnych cytokin.31
- Czynnik stymulujący tworzenie kolonii granulocytów (G–CSF)
Inne metody leczenia
- Wsparcie psychologiczne pacjentów.
Zapobieganie
- Należy unikać leku zidentyfikowanego jako czynnik wyzwalający.
Przebieg, powikłania i rokowanie
Przebieg
- Choroba przebiega w 3 fazach – progresji, stabilizacji i regeneracji.
- Proces całkowitego powrotu do zdrowia jest powolny i trwa 3–6 tygodni.
Powikłania
- Ostre
- posocznica
- krwawienie z przewodu pokarmowego
- powikłania płucne.
- Uszkodzenia następcze
- Powikłania okulistyczne są powszechne i obejmują wszystkie postaci, od suchości oczu do przewlekłego zapalenia spojówek, owrzodzeń, unaczynienia rogówki i zrośnięcia się powieki z gałką oczną, co może prowadzić do ślepoty.9
- Zmiany skórne bez nadkażeń, często goją się bez powstawania blizn.
Rokowanie
- Toksyczna nekroliza naskórka jest ciężką chorobą o wysokim wskaźniku śmiertelności, który zależy od wieku pacjenta i stopnia zajęcia skóry.
- Rokowanie jest gorsze niż w przypadku pacjentów z oparzeniami o tym samym stopniu zajęcia skóry.
- Przy toksycznej nekrolizie naskórka główną przyczyną zgonu jest posocznica.
- Zgony często występują również po regeneracji skóry, a nie w fazie ostrej.
- Zatwierdzony system punktacji (Severity of Illness Score for Toxic Epidermal Necrolysis – SCORTEN) może pomóc w oszacowaniu ryzyka śmiertelności w warunkach intensywnej terapii.33
- Skala SCORTEN jest bardziej wiarygodna u chorych dorosłych, ponieważ uwzględnia takie kryteria, jak wiek >40. roku życia, stan czynności nerek, procent powierzchni ciała zajęty chorobą, stężenie glukozy, częstotliwość rytmu serca oraz współistniejące nowotwory złośliwe.
- Śmiertelność wśród dorosłych wynosi 25–50%.26,34
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Ilustracje
 .
.
Zespół Stevensa–Johnsona i toksyczna nekroliza naskórka charakteryzują się ciężkimi objawami z erytrodermią i pęcherzowym oddzielaniem się naskórka oraz zajęciem błon śluzowych.

Zespół Stevensa–Johnsona i toksyczna nekroliza naskórka to różne stadia rozwojowe tej samej choroby. SJS/TEN są ostrymi, potencjalnie zagrażającymi życiu chorobami skóry i błon śluzowych z rozległym rumieniem, powstawaniem pęcherzy i ostatecznie odwarstwieniem naskórka. W TEN odwarstwienie skóry obserwuje się na ponad 30% powierzchni ciała, a w SJS odwarstwienie skóry obserwuje się na maksymalnie 10% powierzchni skóry.
Źródła
Piśmiennictwo
- Yamane Y., Aihara M., Tatewaki S., et al. Analysis of treatments and deceased cases of severe adverse drug reactions–analysis of 46 cases of Stevens-Johnson syndrome and toxic epidermal necrolysis. Arerugi 2009;58(5):537-47, PubMed
- Schöpf E., Stuhmer A., Rzany B. et al. Toxic epidermal necrolysis and Stevens-Johnson syndrome. An epidemiologic study from West Germany, Arch Dermatol 1991, 127: 839-42.
- Wolkenstein P., Revuz J. Toxic epidermal necrolysis. Dermatol Clin 2000, 18: 485-95.
- Letko E., Papaliodis D.N., Papaliodis G.N. et al. Stevens-Johnson syndrome and toxic epidermal necrolysis: a review of the literature, Ann Allergy Asthma Immunol 2005, 94: 419-36.
- Chung W.H., Hung S.I., Yang J.Y., et al. Granulysin is a key mediator for disseminated keratinocyte death in Stevens-Johnson syndrome and toxic epidermal necrolysis, Nat Med 2008, 14: 1343, pmid:19029983, PubMed
- Caproni M., Torchia D., Schincaglia E., et al. Expression of cytokines and chemokine receptors in the cutaneous lesions of erythema multiforme and Stevens-Johnson syndrome/toxic epidermal necrolysis, Br J Dermatol 2006, 155: 722, pmid:16965421, PubMed
- Cattelan A.M., Trevenzoli M., Sasset L. et al. Toxic epidermal necrolysis induced by nevirapine therapy: description of two cases and review of the literature, J Infect 2001, 43: 246-54.
- Mockenhaupt M., Viboud C., Dunant A., et al. Stevens-Johnson syndrome and toxic epidermal necrolysis: assessment of medication risks with emphasis on recently marketed drugs, The EuroSCAR-study, J Invest Dermatol 2008, 128:35.
- de Prost N., Ingen-Housz-Oro S., Duong Ta., et al. Bacteremia in Stevens-Johnson syndrome and toxic epidermal necrolysis: epidemiology, risk factors, and predictive value of skin cultures, Medicine (Baltimore) 2010, 89:28.
- Morales M.E., Purdue G.F., Verity S.M., et al. Ophthalmic Manifestations of Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis and Relation to SCORTEN, Am J Ophthalmol 2010, 150:505.
- de Prost N., Mekontso-Dessap A., Valeyrie-Allanore L., et al. Acute respiratory failure in patients with toxic epidermal necrolysis: clinical features and factors associated with mechanical ventilation, Crit Care Med 2014, 42:118.
- Jha A.K., Goenka M.K. Colonic involvement in Stevens-Johnson syndrome: a rare entity, Dig Endosc 2012, 24:382.
- Garcia-Doval I., LeCleach L., Bocquet H. et al. Toxic epidermal necrolysis and Stevens-Johnson syndrome. Does early withdrawal of causative drugs decrease the risk of death? Arch Dermatol 2000, 136: 323-7.
- Chave T.A., Mortimer N.J., Sladden M.J. et al. Toxic epidermal necrolysis: current evidence, practical management and future directions, Br J Dermatol 2005, 153: 241-53.
- Arevalo J.M., Lorente J.A., Gonzalez-Herrada C. et al. Treatment of toxic epidermal necrolysis with cyclosporin A, J Trauma 2000, 48: 473-8.
- Sekula P., Dunant A., Mockenhaupt M., et al. Comprehensive survival analysis of a cohort of patients with Stevens-Johnson syndrome and toxic epidermal necrolysis, J Invest Dermatol 2013, 133:1197.
- Viard I., Wehrli P., Bullani R. et al. Inhibition of toxic epidermal necrolysis by blockade of CD95 with human intravenous immunoglobulin, Science 1998, 282: 490-3.
- Prins C., Kerdel F.A., Padilla R.S. et al. Treatment of toxic epidermal necrolysis with high-dose intravenous immunoglobulins: multicenter retrospective analysis of 48 consecutive cases, Arch Dermatol 2003, 139: 26-32.
- Al-Mutairi N., Arun J., Osama N.E. et al. Prospective, noncomparative open study from Kuwait of the role of intravenous immunoglobulin in the treatment of toxic epidermal necrolysis, Int J Dermatol 2004, 43: 847-51.
- Tan A.W., Thong B.Y., Yip L.W. et al. High-dose intravenous immunoglobulins in the treatment of toxic epidermal necrolysis: an Asian series, J Dermatol 2005, 32: 1-6.
- Campione E., Marulli G.C., Carrozzo A.M. et al. High-dose intravenous immunoglobulin for severe drug reactions: efficacy in toxic epidermal necrolysis, Acta Derm Venereol 2003, 83: 430-2.
- Trent J.T., Kirsner R.S., Romanelli P. et al. Analysis of intravenous immunoglobulin for the treatment of toxic epidermal necrolysis using SCORTEN: The University of Miami Experience, Arch Dermatol 2003, 139: 39-43.
- Barron S.J., Del Vecchio M.T., Aronoff S.C., et al. Intravenous immunoglobulin in the treatment of Stevens-Johnson syndrome and toxic epidermal necrolysis: a meta-analysis with meta-regression of observational studies, Int J Dermatol. 2015 Jan, 54(1): 108-15.
- Bachot N., Revuz J., Roujeau J.C. Intravenous immunoglobulin treatment for Stevens-Johnson syndrome and toxic epidermal necrolysis, Arch Dermatol 2003, 139: 33-6.
- Brown K.M., Silver G.M., Halerz M. et al. Toxic epidermal necrolysis: does immunoglobulin make a difference? J Burn Care Rehabil 2004, 25: 81-8.
- Shortt R., Gomez M., Mittman N. et al. Intravenous immunoglobulin does not improve outcome in toxic epidermal necrolysis, J Burn Care Rehabil 2004, 25: 246-55.
- Majumdar S., Mockenhaupt M., Roujeau J.C., Townshend AP. Interventions for toxic epidermal necrolysis, Cochrane Database of Systematic Reviews 2002, Issue 4. Art. No.: CD001435, DOI: 10.1002/14651858.CD001435, DOI
- Huang Y.C., Li Y.C., Chen T.J. The efficacy of intravenous immunoglobulin for the treatment of toxic epidermal necrolysis: a systematic review and meta-analysis, Br J Dermatol 2012, 167: 424-32, www.ncbi.nlm.nih.gov
- González-Herrada C et al. (2017) Cyclosporine Use in Epidermal Necrolysis Is Associated with an Important Mortality Reduction: Evidence from Three Different Approaches. J Invest Dermatol 137:2092-2100. pubmed.ncbi.nlm.nih.gov
- Zárate-Correa L.C., Carrillo-Gómez D.C., Ramírez-Escobar A.F., Serrano-Reyes C. Toxic epidermal necrolysis successfully treated with infliximab, J Investig Allergol Clin Immunol 2013, 23:61.
- Paradisi A., Abeni D., Bergamo F., et al. Etanercept therapy for toxic epidermal necrolysis, J Am Acad Dermatol 2014, 71:278.
- Egan C.A., Grant W.J., Morris S.E. et al. Plasmapheresis as an adjunct treatment in toxic epidermal necrolysis, J Am Acad Dermatol 1999, 40: 458-61.
- Goulden V., Goodfield M.J. Recombinant granulocyte colony-stimulating factor in the management of toxic epidermal necrolysis, Br J Dermatol 1996, 135: 305-6.
- Bastuji-Garin S., Fouchard N., Bertocchi M. et al. SCORTEN: A severity-of-illness score for toxic epidermal necrolysis, J Invest Dermatol 2000, 115: 149-53.
- Sekula P., Dunant A., Mockenhaupt M., et al. Comprehensive survival analysis of a cohort of patients with Stevens-Johnson syndrome and toxic epidermal necrolysis, J Invest Dermatol 2013, 133: 1197-204, pmid:23389396, PubMed
Opracowanie
- Katarzyna Nessler (recenzent)
- Adam Windak (redaktor)
- Caroline Beier (recenzent/redaktor)
