Streszczenie
- Definicja: Grupa nowotworów układu krwiotwórczego wywodzących się z prekursorów linii limfocytów B lub T (limfoblastów), które naciekają szpik i krew, węzły chłonne oraz tkanki pozawęzłowe.
- Epidemiologia: U dzieci ostra białaczka limfoblastyczna (acute lymphoblastic leukemia – ALL) stanowi 85% wszystkich białaczek i około 1/3 wszystkich nowotworów złośliwych. Zapadalność jest największa między 2. a 5. rokiem życia. Następnie częstość występowania spada, ale ponownie wzrasta po 50. roku życia.
- Objawy: Pierwsze wystąpienie zwykle podostre z niedokrwistością, granulocytopenią i małopłytkowością, znużeniem i zmęczeniem, skłonnością do zakażeń i krwawień.
- Badanie fizykalne: Niedokrwistość, krwawienie z błon śluzowych i skóry, uporczywe zakażenia, powiększenie węzłów chłonnych, powiększona wątroba/śledziona, bolesność uciskowa kości.
- Diagnostyka: Pełna morfologia krwi wykazuje tego samego rodzaju limfoblasty we krwi obwodowej, jak również cytopenię innych linii komórkowych. Rozpoznanie potwierdza biopsja szpiku kostnego.
- Leczenie: 85% dzieci i 50% dorosłych można wyleczyć za pomocą odpowiedniej chemioterapii; wskazana może być również radioterapia. W przypadku nawrotu do wyleczenia konieczne jest zwykle leczenie wysokimi dawkami z allogenicznym przeszczepem komórek macierzystych.
Informacje ogólne
Definicja1
- Ostra białaczka limfoblastyczna (acute lymphoblastic leukemia – ALL) jest złośliwą chorobą układu krwiotwórczego, która wywodzi się z szybko rosnących niedojrzałych komórek limfatycznych (prekursorów linii limfocytów B lub T– limfoblastów).2
- Różnicowanie z chłoniakiem limfoblastycznym:
- Dojrzałe komórki B–ALL są klasyfikowane jako białaczki/chłoniaki Burkitta. Często są one szybko postępujące i wymagają specjalnego leczenia.
Klasyfikacja
Według WHO (2016)4
- Białaczka limfatyczna B/chłoniak limfatyczny B
- Białaczka limfatyczna B/chłoniak limfatyczny, nieokreślony.
- Białaczka limfatyczna B/chłoniak limfatyczny z powtarzalnymi nieprawidłowościami genetycznymi
- białaczka/chłoniak limfoblastyczny B z t(9;22)(q34.1;q11.2);BCR–ABL1
- białaczka/chłoniak limfoblastyczny B z rearanżacją t(v;11q23.3);KMT2A
- białaczka/chłoniak limfoblastyczny B z t(12;21)(p13.2;q22.1);TEL-AML1 (ETV6–RUNX1)
- białaczka/chłoniak limfoblastyczny B z hiperdiploidią
- białaczka/chłoniak limfoblastyczny B z hipodiploidią
- białaczka/chłoniak limfoblastyczny B z t(5;14)(q31.1;q32.3) IL3–IGH
- białaczka/chłoniak limfoblastyczny B z t(1;19)(q23;p13.3); TCF3–PBX1
- jednostka tymczasowa: białaczka/chłoniak limfoblastyczny B, podobny do BCR-ABL1
- jednostka tymczasowa: białaczka/chłoniak limfoblastyczny B z iAMP21.
- Białaczka/chłoniak limfatyczny T
- jednostka tymczasowa: białaczka limfoblastyczna z wczesnych prekursorowych komórek T
- jednostka tymczasowa: białaczka limfoblastyczna z wczesnych prekursorowych komórek NK.3
Epidemiologia
Całkowita liczba przypadków
- Roczna zapadalność w całej populacji: 1,1 przypadków na 100 000 osób.
W wieku dziecięcym5
- Najczęstsza choroba nowotworowa wieku dziecięcego
- 85% wszystkich nowotworów złośliwych u dzieci.
- U dzieci w wieku poniżej 5 lat: 5,3 przypadków na 100 000 osób, największa częstość występowania przypada na okres między 2. a 5. rokiem życia.
- U dzieci w wieku poniżej 15 lat: 3,3 przypadków na 100 000 osób.
- W Polsce rozpoznaje się tę chorobę u 30 dzieci na 1 milion osób rocznie.6
W wieku dorosłym
- Dalszy spadek wraz z wiekiem, ponowny wzrost częstości występowania od 50. roku życia.
- U osób powyżej 80. roku życia: 2,3 przypadków na 100 000 osób.
Rozkład według płci
- Mężczyźni chorują nieznacznie częściej (1,4:1,0).
Etiologia i patogeneza
Patogeneza
- Pod wpływem czynników genetycznych i środowiskowych dochodzi do tranformacji nowotworowej prekursorowej komórki limfocytów i ich proliferacji.
- Dochodzi do namiernego namnażania, zaburzenia dojrzewania i gromadzenia się limfoblastów w szpiku, krwi obwodowej i innych narządach.3
- Niekontrolowana proliferacja powoduje wyparcie dojrzałych komórek szpiku kostnego i rozwój cytopenii w jednej lub kilku liniach komórkowych oraz infiltrację blastów do szpiku, węzłów chłonnych, wątroby, śledziony i innych narządów.2
Czynniki predysponujące
- Uszkodzenie chromosomalne, zarówno wrodzone (np. trisomia 21) lub nabyte (np. przez działanie mielotoksycznych substancji chemicznych, radioaktywności), zwiększają ryzyko białaczki.
- Niewielkie grupy chorych otrzymywały w przeszłości leki cytostatyczne lub radioterapię.
- Zakażenia wirusowe (np. wirusem Epsteina-Barr).3
ICD–10
- C91 Białaczka limfatyczna.
- C91.0 Ostra białaczka limfoblastyczna.
- C91.7 Inna białaczka limfatyczna.
- C91.9 Białaczka limfatyczna, nieokreślona.
- C83.5 Chłoniak nieziarniczy limfoblastyczny (rozlany).
- Chłoniak z prekursorowych komórek B.
- Chłoniak limfoblastyczny B–komórkowy.
- Chłoniak limfoblastyczny BNO.
- Chłoniak limfoblastyczny T–komórkowy.
- Chłoniak z prekursorowych komórek T.
Diagnostyka
Kryteria diagnostyczne
- Typowy obraz kliniczny niedokrwistości aplastycznej, skłonność do krwawień i podatność na zakażenia, a także objawy niedotlenienia tkanek i narządów (nietolerancja wysiłku fizycznego, osłabienie).3
- Cytopenia lub pancytopenia, blasty we krwi obwodowej.
- W rozmazie szpiku kostnego wzrost odsetka młodych komórek jednojądrowych z zahamowanym dojrzewaniem6
- kryterium rozpoznania ALL: 20% limfoblastów w szpiku.
- chłoniak limfoblastyczny: nacieczenie szpiku <20%
Diagnostyka różnicowa
- Zakażenia wirusowe: mononukleoza, cytomegalia.
- Posocznicze zakażenia bakteryjne.
- Ostra białaczka szpikowa.
- Przewlekła białaczka limfocytowa.
- Chłoniak Hodgkina.
- Chłoniak nie–Hodgkina.
- Młodzieńcze idiopatyczne zapalenie stawów, gorączka reumatyczna.6
Wywiad lekarski
- Przeważnie podostry początek z:
- częstymi zakażeniami z gorączką– neutropenia
- znużeniem i zmęczeniem – niedokrwistość
- skłonnością do krwawień w obrębie skóry i błon śluzowych – małopłytkowość.
- U niektórych pacjentów może występować:
- ból głowy
- nudności i wymioty
- niewyraźne widzenie
- krwawienie z nosa
- krwawienie do OUN
- podwójne widzenie
- wyprysk
- białaczkowe zapalenie opon mózgowo–rdzeniowych
- bóle kości i stawów
- obrzęk jąder
- owrzodzenia jamy ustnej
- nacieki skórne.
Badanie fizykalne
- Często pogorszony stan ogólny.
- Bladość, inne objawy niedokrwistości.
- Krwotoki skórne: petocje, wybroczyny, krwiaki.
- Przedłużające się zakażenia.
- Powiększenie węzłów chłonnych.
- Umiarkowana hepatosplenomegalia.
- Wrażliwość na ból przy badaniu palpacyjnym kości, zwłaszcza mostka i kości piszczelowej.
Badania uzupełniające w gabinecie lekarza rodzinnego
- Pełna morfologia krwi
- typowy obraz kliniczny: limfoblasty we krwi obwodowej i cytopenia w innych liniach komórkowych
- dominacja podobnych niedojrzałych limfoblastów
- rzadka aleukemiczna postać ALL: leukopenia.
- Funkcja wątroby (AST, ALT)
- Glukoza we krwi
- Kwas moczowy (podwyższony poziom).
- RTG kości może przyczynić się do postawienia wcześniejszego rozpoznania6
- Guz śródpiersia (RTG klatki piersiowej w 2 płaszczyznach)?
Diagnostyka specjalistyczna
- Ultrasonografia – regiony docelowe:
- jama brzuszna
- śródpiersie
- węzły chłonne
- jądra.
- Pytania o:
- organomegalię
- nacieki w nerkach
- nacieki w jelitach
- zajęcie grasicy
- zajęcie opłucnej
- wysięk osierdziowy.
Badania szpitalne
- Biopsja i aspirat szpiku kostnego (ocena morfologiczna i immunofenotypowa).
- Ewentualnie biopsja węzła chłonnego.
- TK, ewentualnie RM lub PET klatki piersiowej/ jamy brzusznej/ miednicy.
- Diagnostyka płynu mózgowo–rdzeniowego.
- Badania immunofenotypowe (markery linii B, linii T, komórek macierzystych i mieloidalnych, MPO)
Wskazania do skierowania do specjalisty
- W przypadku podejrzenia ALL natychmiastowa diagnostyka i leczenie w ośrodku hematoonkologicznym.
- Szybkie rozpoczęcie leczenia w ciągu 1–2 dni może mieć kluczowe znaczenie dla rokowania, szczególnie w przypadku nagłego początku, szybkiego przebiegu i zaawansowania choroby.
Leczenie
Cele leczenia
- Leczenie prowadzone jest z intencją wyleczenia i ma charakter radykalny.3
- Ewentualnie przed rozpoczęciem leczenia:
- zachowanie zdolności reprodukcyjnych poprzez kriokonserwację komórek rozrodczych.
- Terapia indukcyjna (indukcja remisji):
- całkowita remisja poprzez eradykację komórek białaczkowych z normalizacją morfologii krwi i szpiku kostnego
- ustąpienie objawów klinicznych.
- Leczenie konsolidujące i podtrzymujące:
- utrzymywanie remisji
- zapobieganie zakażeniom ośrodkowego układu nerwowego.
- Leczenie paliatywne:
- łagodzenie objawów
- poprawa jakości życia.
Ogólne informacje o leczeniu
- Indywidualne leczenie zgodnie z:
- fenotypem
- genotypem
- ryzykiem progresji
- wiekiem.
- Wybór schematu terapeutycznego determinuje głównie obecność lub brak genu fuzyjnego BCR-ABL1/t(9;22) i wiek chorego.3
- Faza indukcji z dużymi dawkami cytostatyków.
- Następnie leczenie konsolidujące cytostatykami w celu utrzymania remisji (terapia poremisyjna).
- Ewentualnie radioterapia.
- Ewentualnie allogeniczne przeszczepianie komórek macierzystych (autologous hematopoietic stemm cell transplantation - auto-HSCT ).
- Nowsze metody immunoterapeutyczne, po odpowiedniej kwalifikacji pacjentów. W Polsce leczenie ALL może być prowadzone w ramach programu lekowego B.65 (ponatynib, blinatumomab, inotuzumab ozogamcyny)
- np. inhibitory kinazy tyrozynowej (tyrosine kinase inhibitor - TKI) u chorych z obecnością chromosomu Filadelfia/genu BCR-ABL1 (ALL-Ph+)
- np. rituksymab u pacjentów z ekspresją CD20 na co najmniej 20% blastów jednocześnie z chemioterapią w fazie indukcji, konsolidacji i leczenia podtrzymującego.3
Ocena ryzyka
- Ocena indywidualnego ryzyka chorego ma decydujące znaczenie dla wyboru opcji leczenia.
- W momencie rozpoznania dorośli są przydzielani do 1 z 2 grup ryzyka (nawrotu):
- grupa ryzyka standardowego
- grupa wysokiego ryzyka.
- Dzieci są najczęściej klasyfikowane do grup standardowego, wysokiego i bardzo wysokiego ryzyka.
- Podstawy oceny ryzyka obejmują:
- wiek
- leczenie kliniczne
- wyniki badań, np. szpiku kostnego.
Leczenie wysokospecjalistyczne
- Intensywne leczenie cytostatyczne ostrej białaczki jest bardzo obciążające, ma znaczne skutki uboczne i może powodować poważne powikłania. Leczenie musi być prowadzone przez doświadczonych hematologów w wyspecjalizowanym oddziale.
- W przypadku nawrotu ostrej białaczki u młodszej osoby dorosłej, chemioterapia w wysokich dawkach w połączeniu z allogenicznym przeszczepianiem krwiotwórczych komórek macierzystych jest zwykle jedyną metodą, która daje szanse na wyleczenie.
- Przy niektórych podgrupach ALL i wyraźnie zwiększonym ryzyku nawrotu przeszczepianie komórek macierzystych może być również wskazane w pierwszej remisji.
- Zespół rozpadu guza
- masowy rozpad komórek nowotworowych z uwolnieniem toksycznych stężeń kwasu moczowego i fosforanu wapnia i ryzykiem rozwoju ostrej niewydolności nerek
- zaburzenia rytmu serca (na skutek wzrostu stężenia potasu)
- szczególnie wysokie ryzyko w przypadku chłoniaka/ białaczki Burkitta
- zapobiegawczo należy dostarczać dużo płynów (około 3000 ml/m2 na dobę) z monitorowaniem diurezy i stopnia nawodnienia (ew. kontrola przy zastosowaniu furosemidu)
- przed terapią indukcyjną: leczenie wstępne deksametazonem/ cyklofosfamidem
- ewentualnie allopurynol lub rasburykaza.
Leczenie farmakologiczne
- 85% dzieci i 50% dorosłych można wyleczyć za pomocą odpowiedniej chemioterapii.
- Leczenie indukcyjne cytostatykami jest mniej mielosupresyjne niż w przypadku białaczki szpikowej i nie zawsze prowadzi do aplazji szpiku kostnego.
- Podczas leczenia indukcyjnego: prowadzić profilaktykę zajęcia OUN
- metotreksat dokanałowo
- ewentualnie połączenie z cytarabiną i glikokortykosteroidem
- ewentualnie radioterapia odpowiedniej okolicy głowy.
Choroba nawracająca i oporna na leczenie
- W razie potrzeby dalsza terapia indukcyjna.
- Terapia immunologiczna
- Ponatynib - pan-inhibitor kinazy tyrozynowej BCR-ABL - wysoka skuteczność dzięki hamowaniu wielu szlaków sygnałowych komórek nowotworowych; ze względu na niską swoistość stosowanie wiąże się z dużą ilością działań niepożądanych.
- Stosowany w przypadku nietolerancji innych inhibitorów TKI.
- Rituksymab – przeciwciało anty–CD20 – znacząco poprawił wyniki leczenia chłoniaka/białaczki Burkitta i ALL z prekursorów komórek B.7
- Przeciwciało anty–CD19 – blinatumomab i koniugat przeciwciało–lek CD22 – inotuzumab ozogamcyny, we wczesnych nawrotach i opornych nawrotach ALL z prekursorów linii B osiągnęły lepsze wyniki niż standardowa chemioterapia.8-9
- Limfocyty T z chimerowym receptorem antygenowym (chimaeric antigen receptor T–cell – CAR–T): są wytwarzane ex vivo z komórek T osoby chorej na ALL. Komórki zostają wyposażone w receptor antygenowy przeciwko markerom powierzchniowym komórek białaczkowych, a także w różne elementy transdukcji sygnału. W 2018 r. tisagenlecleucel został zatwierdzony jako pierwszy lek CAR–T.10
- Ponatynib - pan-inhibitor kinazy tyrozynowej BCR-ABL - wysoka skuteczność dzięki hamowaniu wielu szlaków sygnałowych komórek nowotworowych; ze względu na niską swoistość stosowanie wiąże się z dużą ilością działań niepożądanych.
Opieka paliatywna
- Bóle.
- Nudności i wymioty.
- Zaparcia.
- Niedrożność złośliwa.
- Suchość w jamie ustnej.
- Niedożywienie i odwodnienie.
- Trudności z oddychaniem.
- Depresja.
- Lęk.
- Majaczenie.
Zapobieganie
- Profilaktyka OUN w trakcie terapii indukcyjnej.
- Profilaktyka zespołu rozpadu guza.
Przebieg, powikłania i rokowanie
Przebieg
- Często podostre lub ostre pierwsze wystąpienie.
- Często burzliwy, ale czasami także powolny przebieg.
- Większość chorych osiąga pierwotną remisję.
- W przypadku nawrotów wyleczenie można osiągnąć jedynie poprzez przeszczep szpiku kostnego.
Powikłania
- Zagrażające życiu zakażenia lub krwawienia.
- Psychospołeczne skutki uboczne
- Choroba i proces leczenia mogą powodować ból i dyskomfort, a także stres psychiczny, co z kolei może generować lęk, stany depresyjne, smutek i złość.
- Zmiany fizyczne, takie jak utrata masy ciała lub przyrost masy ciała, zaokrąglenie twarzy i wypadanie włosów czasami prowadzą do obniżenia poczucia własnej wartości i izolacji społecznej.
- Szczególnymi czynnikami ryzyka o negatywnych skutkach późnych (np. trudnościami w nauce szkolnej) są radioterapia i okres leczenia przekraczający 3 lata.
- Chemioterapia dokanałowa może w niekorzystnych okolicznościach skutkować niewielkimi deficytami poznawczymi.
Rokowanie
- Pierwotna remisja
- U 90% wszystkich dorosłych i 95% wszystkich dzieci.
- Leczenie po remisji
- Działa korzystnie u 30–50% wszystkich dorosłych i u 60–80% wszystkich dzieci.
- Wtórne nowotwory złośliwe
- Osoby, które chorowały na ostrą białaczkę limfoblastyczną w dzieciństwie, mają – w porównaniu z populacją ogólną – około 14 razy większe ryzyko rozwoju wtórnego nowotworu złośliwego.
Czynniki rokownicze
- Wrażliwość na chemioterapię
- Różni się w zależności od podtypów genetycznych ALL.
- Wiek
- Wysokie znaczenie rokownicze.
- ALL z obecnością chromosomu Filadelfia oznacza np. korzystne rokowanie u dzieci w wieku 1–9 lat, gorsze rokowanie u nastolatków i bardzo złe rokowanie u dorosłych.
- Osoby powyżej 60. roku życia mają zwykle gorsze rokowanie, z większą liczbą powikłań związanych z leczeniem i zgonów.
Dalsze postępowanie
- Na początku pierwszych 3 cykli leczenia podtrzymującego (w przybliżeniu co 3 miesiące w pierwszym roku) przeprowadzana jest konwencjonalna ocena remisji na podstawie rozmazu krwi i aspiratu szpiku kostnego.
- Comiesięczne kontrole w pierwszym roku z rutynowymi badaniami hematologicznymi krwi.
- W ciągu 2 następnych lat kontrola co 3 miesiące.
Kryteria remisji
- Całkowita remisja przy:
- Hb >10 g/dl (>6,2 mmol/l), granulocyty >1,5 x 109/l i płytki krwi >100 x 109/l
- brak blastów we krwi obwodowej, płynie mózgowo-rdzeniowym lub wcześniej występujących lokalizacjach pozaszpikowych
- w szpiku kostnym: prawidłowa hematopoeza trójliniowa i <5% komórek blastycznych.
Kryteria nawrotu
- >5% komórek blastycznych w szpiku kostnym.
- Ewentualnie komórki blastyczne w płynie mózgowo–rdzeniowym lub w innych lokalizacjach pozaszpikowych.
Po zakończeniu leczenia w szpitalu
- Po allogenicznym przeszczepieniu komórek macierzystych
- stwierdzanie nawrotów
- wykrycie przewlekłej reakcji przeszczep przeciwko gospodarzowi (graft versus host disease)
- diagnostyka późnych uszkodzeń.
- Szczepienia są wskazane po indywidualnej konsultacji z oddziałem leczącym.
- Po allogenicznym przeszczepie komórek macierzystych i wysokodawkowym leczeniu uzupełnionym przeszczepieniem autologicznych komórek macierzystych, może być wskazane pełne ponowne szczepienie.
- Szczepienie przeciwko pneumokokom po 1 roku, następnie kontrola miana przeciwciał co 5 lat i w razie potrzeby powtórzenie.
- Przez pierwsze 2 lata po wysokodawkowym leczeniu uzupełnionym przeszczepieniem autologicznych komórek macierzystych należy unikać żywych szczepionek i szczepionek doustnych.
- Zmęczenie, przewlekłe zmęczenie
- Subiektywne uczucie zmęczenia i ograniczonej sprawności funkcjonalnej; brak poprawy nawet po odpoczynku i śnie.
- Szczególnie często po radioterapii lub leczeniu cytostatycznym.
- Doświadczane przez wielu pacjentów jako największa ze wszystkich dolegliwości i stres związany z leczeniem.
- Leczenie
- wyjaśnienie tła dolegliwości
- lekki, indywidualny program treningowy uwzględniający ćwiczenia fizyczne.
- Diagnostyka skutków opóźnionych:
- kardiologiczna (kardiomiopatia poantracyklinowa)
- endokrynologiczna (po lekach alkilujących i radioterapiij)
- wątrobowa (po cytarabinie lub zapaleniu wątroby)
- mózgowa (po naświetlaniach głowy).
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Leczenie łagodzące w zaawansowanej chorobie nowotworowej
- Czym jest opieka paliatywna?
- Leczenie lęku w opiece paliatywnej.
- Nudności i wymioty, opieka paliatywna.
- Zaparcia, opieka paliatywna.
- Dolegliwości jamy ustnej w opiece paliatywnej.
- Utrata masy ciała w chorobie nowotworowej.
- Depresja w opiece paliatywnej.
- Majaczenie w opiece paliatywnej.
Ilustracje
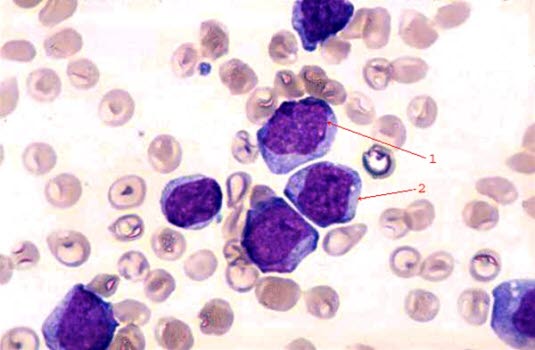
Białaczkowe komórki blastyczne: 1 duże jądro; 2 cytoplazma
Źródła
Wytyczne
- Zalecenia postępowania diagnostyczno-terapeutycznego w nowotworach złośliwych 2021. Polskie Towarzystwo Onkologii Klinicznej - Ostra białaczka limfoblastyczna i chłoniaki limfoblastyczne. onkologia.zalecenia.med.pl
Piśmiennictwo
- Cortelazzo S., Ponzoni M., Ferreri A.J.M., Hoelzer D. Lymphoblastic lymphoma, Crit Rev Oncol Hematol 2011, 79: 330-43, PubMed
- Hołowiecki J. Ostre białaczki limfoblastyczne. W: Interna - mały podręcznik, Medycyna Praktyczna, dostęp: 13.01.2024, www.mp.pl
- Czyż A., Giebel S. Zalecenia postępowania diagnostyczno-terapeutycznego w nowotworach złośliwych 2021. Polskie Towarzystwo Onkologii Klinicznej - Ostra białaczka limfoblastyczna i chłoniaki limfoblastyczne. (dostęp: 6.06.2025) onkologia.zalecenia.med.pl
- Arber D.A., Orazi A., Hasserjian R. et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia, Blood 2016, 127: 2391-405, PMID: 27069254, PubMed
- Kaatsch P., Spix C., German Childhood Cancer Registry - Annual Report 2015 (1980-2014). Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz, 2015, www.kinderkrebsregister.de
- Kawalec W., Grenda R., Kulus M. Pediatria, PZWL, Warszawa, 2019.
- Maury S., Chevret 1, Thomas X. et al. Rituximab in B-Lineage Adult Acute Lymphoblastic Leukemia, N Engl J Med 15.09.2016, 375(11): 1044-53, pmid:27626518, PubMed
- Kantarjian H.M., DeAngelo D.J., Stelljes M., et al. Inotuzumab Ozogamicin versus Standard Therapy for Acute Lymphoblastic Leukemia, N Engl J Med 2016; 375: 740-53, PMID: 27292104, PubMed
- Kantarjian H.M., Stein A.S., Bargou R.C., et al. Blinatumomab treatment of older adults with relapsed/refractory B-precursor acute lymphoblastic leukemia: Results from 2 phase 2 studies, Cancer 2016, 122: 2178-85, PMID: 27143254, PubMed
- European Medicines Agency. Kymriah. Human medicine European public assessment report (EPAR), aktualizacja: 29.10.2021, www.ema.europa.eu
Opracowanie
- Joanna Dąbrowska-Juszczak (redaktor)
- Ewa Rudnicka–Drożak (recenzent)
- Tomasz Tomasik (redaktor)
- Thomas M. Heim (recenzent/redaktor)
