Streszczenie
- Definicja: Niedobór dehydrogenazy glukozo-6-fosforanowej (G6PD) jest dziedzicznym zaburzeniem metabolicznym predysponującym do występowania niedokrwistości hemolitycznej.
- Częstość występowania: Współczynnik chorobowości zależy od położenia geograficznego, koreluje z obszarami występowania malarii. Ponadto, choroba częściej występuje u mężczyzn oraz u osób, których przodkowie pochodzą z Afryki, Azji lub krajów śródziemnomorskich.
- Objawy: Przebieg zwykle bezobjawowy. Okresowe przełomy hemolityczne pod wpływem czynników wyzwalających. W okresie noworodkowym u chłopców może wystąpić nasilona żółtaczka i niedokrwistość.
- Badanie fizykalne: Zazwyczaj brak szczególnych objawów klinicznych, w okresie hemolizy żółtaczka, bladość skóry, ciemne zabarwienie moczu, ból brzucha i pleców.
- Diagnostyka: Ilościowa analiza spektrofotometryczna lub szybki test fluorescencyjny.
- Leczenie: Zazwyczaj leczenie nie jest konieczne. Zaleca się unikanie stresorów oksydacyjnych, w razie potrzeby suplementację kwasu foliowego. Transfuzje krwi i erytropoetyna tylko w ciężkich przypadkach.
Informacje ogólne
Definicja
- Niedobór dehydrogenazy glukozo-6-fosforanowej (G6PD) jest dziedzicznym zaburzeniem metabolicznym predysponującym do występowania niedokrwistości hemolitycznej.1
- W przypadku niedoboru G6PD ograniczona jest ochrona erytrocytów przed stresem oksydacyjnym.
- U większości osób choroba przebiega bezobjawowo, ale zakażenia i niektóre leki mogą wywołać u nich hemolizę łatwiej niż u osób zdrowych.
- Klinicznie choroba może objawiać się jako ostra niedokrwistość hemolityczna, przewlekła niedokrwistość hemolityczna lub hiperbilirubinemia noworodków.
- Nazywany również fawizmem, ponieważ spożywanie fasoli fava (bobu, bobiku) w przypadku niedoboru G6PD może powodować hemolizę.
Częstość występowania
- Na świecie około 400-500 milionów osób choruje na niedobór G6PD.2
- najwyższa chorobowość w Afryce, Azji i krajach śródziemnomorskich
- Chorobowość koreluje z geograficznym występowaniem malarii, co doprowadziło do teorii, że nosiciele niedoboru G6PD mają częściową ochronę przed zakażeniem malarią.
- Przypadki spontanicznych mutacji genów upośledzających ekspresję G6PD występują we wszystkich populacjach.
Etiologia i patogeneza
Patofizjologia
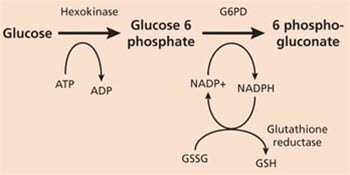
Szlak pentozofosforanowy
- G6PD katalizuje redukcję NADPH+ do NADPH w szlaku metabolizmu fosforanu pentozy (zob. rys.)3
- NADPH chroni komórki przed uszkodzeniami oksydacyjnymi.
- Ponieważ erytrocyty nie potrafią wytwarzać NADPH w żaden inny sposób, są one bardziej narażone na uszkodzenia spowodowane stresem oksydacyjnym niż pozostałe komórki.
- Poziom aktywności G6PD w erytrocytach jest niższy niż w innych komórkach.
- Prawidłowe erytrocyty, które nie są poddawane stresowi oksydacyjnemu, wykorzystują tylko około 2% całkowitej aktywności G6PD.
- Dlatego nawet przy znacznie zmniejszonej aktywności enzymu mogą nie występować objawy kliniczne jego niedoboru.
- Całkowity brak G6PD jest śmiertelny.
- Poszczególne warianty niedoboru G6PD zostały przyporządkowane do pięciu klas różniących się stopniem ciężkości choroby.
Genetyka
- Mutacje genowe wpływające na kodowanie G6PD są zlokalizowane w dystalnej części długiego ramienia chromosomu X.
- Objawy choroby występują tylko u hemizygotycznych mężczyzn oraz u homozygotycznych kobiet.
- Do tej pory zidentyfikowano ponad 400 wariantów G6PD (stan na 2023 r.).1,3
- Większość wariantów występuje sporadycznie, chociaż warianty G6PD Mediterranean i G6PD A- w niektórych populacjach występują ze zwiększoną częstością.
Czynniki predysponujące
Predyspozycja do choroby
- Genetyka, dodatni wywiad rodzinny
- Płeć męska
- Przodkowie pochodzący z Afryki, basenu Morza Śródziemnego lub Azji
Czynniki wywołujące niedokrwistość hemolityczną
- Spożywanie nasion fasoli fava (bobu)
- Kosmetyczne zastosowanie henny
- Leki o działaniu utleniającym
- Ryzyko wywołania przełomu hemolitycznego zostało dobrze udokumentowane m.in dla fluorochinolonów (np. dla ciprofloksacyny), nitrofurantoiny, pochodnych sulfonylomocznika (np. glibenklamidu), dapsonu i rasburykazy.
- Prawdopodobnie dotyczy również leków przeciwmalarycznych (takich jak chlorochina, chinina), kwasu acetylosalicylowego, sulfadiazyny, sulfasalazyny i innych.
- Możliwe, że dotyczy również antagonistów witaminy K, chloramfenikolu, doksorubicyny, probenecydu i innych substancji.
- Narażenie na naftalen (np. w preparatach odstraszających mole) może powodować hemolizę u osób z niedoborem G6PD oraz u zdrowych noworodków.
ICD-10
- D55.0 Niedokrwistość spowodowana niedoborem dehydrogenazy glukozo-6-fosforanowej [G6PD]
Diagnostyka
Kryteria diagnostyczne
- Rozpoznanie potwierdza się za pomocą ilościowej analizy spektrofotometrycznej lub za pomocą szybkiego testu, który fluoryzuje, gdy NADPH powstaje z NADP.1
Diagnostyka różnicowa
- Inne niedokrwistości hemolityczne1
- niedokrwistość sierpowatokrwinkowa
- autoimmunologiczna niedokrwistość hemolityczna
- wywołana zakażeniem
- wywołana lekami
- izoimmunologiczna niedokrwistość hemolityczna, np. niezgodność w układzie AB0
- niestabilna hemoglobina (rzadko)
- methemoglobinemia w niedoborze reduktazy methemoglobiny (rzadko)
Wywiad lekarski
- Niemal wszystkie osoby z niedoborem G6PD przez większość czasu pozostają bezobjawowe.
- Okresowo mogą występować objawy ostrej niedokrwistości hemolitycznej indukowanej stresorem oksydacyjnym.
- Czynnik wyzwalający jest zwykle obecny już kilka dni wcześniej.
- np. infekcja, przyjmowanie leków, spożywanie niektórych pokarmów (np. bobu)
- Czynnik wyzwalający jest zwykle obecny już kilka dni wcześniej.
- Tylko u niewielkiego odsetka chorych z najcięższą postacią niedoboru G6PD występują objawy przewlekłej niedokrwistości hemolitycznej.
- Uzasadnione podejrzenie istnieje u wszystkich dzieci, u których wywiad rodzinny obciążony jest żółtaczką, niedokrwistością, splenomegalią lub kamieniami żółciowymi, zwłaszcza jeśli pochodzą z Afryki lub krajów śródziemnomorskich.
Badanie fizykalne
- Zwykle bez charakterystycznych odchyleń
- W przypadku niedokrwistości hemolitycznej: bladość, żółtaczka, ciemne zabarwienie moczu, możliwy ból brzucha lub okolicy lędźwiowej4-5
- W przypadku umiarkowanej lub ciężkiej niedokrwistości: nieswoiste objawy niedokrwistości, takie jak zmniejszenie tolerancji wysiłku lub tachykardia
- Zobacz artykuł Niedokrwistość u dzieci oraz Niedokrwistość u dorosłych.
Badania uzupełniające
- W przypadku podejrzenia niedoboru G6PD należy rozważyć wykonanie następujących badań dodatkowych:
- morfologia krwi z rozmazem, retikulocyty, OB, CRP, bilirubina całkowita i bezpośrednia, parametry wątrobowe (AST, ALT, GGTP, ALP), kreatynina
- ewentualnie LDH, haptoglobina (badania niedostępne w POZ)
- badanie ogólne moczu (w przypadku hemolizy: białko i urobilinogen dodatnie)
- szybki test fluorescencyjny (badanie niedostępne w POZ)
- Wykrywa powstawanie NADPH z NADP+.
- Wynik testu jest dodatni, jeśli plama krwi nie fluoryzuje w świetle ultrafioletowym.
- ilościowa analiza spektrofotometryczna – bezpośrednie oznaczenie aktywności G6PD (niedostępne w ramach POZ)
- W trakcie przełomu hemolitycznego testy w kierunku niedobór G6PD mogą dać wynik fałszywie ujemny, ponieważ starsze krwinki czerwone z większym niedoborem enzymu uległy hemolizie, podczas gdy młodsze krwinki czerwone i retikulocyty mają prawidłową lub niemal prawidłową aktywność enzymu.
- Rozpoznanie może być trudne u heterozygotycznych kobiet.
- w przypadku wątpliwości diagnostycznych - badanie genetyczne na obecność wariantów G6PD
- Wskazania do wykonania testu w kierunku niedoboru G6PD
- Dzieci lub dorośli (zwłaszcza mężczyzni oraz osoby pochodzące z Afryki, Azji lub krajów śródziemnomorskich) z ostrą niedokrwistością hemolityczną wywołaną zakażeniem, narażeniem na znaną substancję wyzwalającą (patrz wyżej) lub spożyciem bobu.
- W poszczególnych endemicznych obszarach świata przeprowadza się badania przesiewowe noworodków.
Żółtaczka noworodków
- U hemizygotycznych chłopców oraz homozygotycznych dziewcząt z niedoborem G6PD żółtaczka noworodków występuje dwukrotnie częściej niż w populacji ogólnej.
- Choroba rzadko ujawnia się u dziewcząt z heterozygotycznością dla zmutowanego genu kodującego G6PD.
- Mechanizm hiperbilirubinemii noworodków nie został w pełni poznany, nie wyklucza hemolizy.
- Istnieje uzasadnione podejrzenie niedoboru G6PD u noworodka, u którego hiperbilirubinemia wystąpiła w ciągu pierwszych 24 godzin życia oraz:
- rodzeństwo również choruje na żółtaczkę
- stężenie bilirubiny przekracza 95 centyl
- jest to chłopiec pochodzenia azjatyckiego
- Niedobór G6PD zwiększa ryzyko wcześniejszego wystąpienia lub większego nasilenia hiperbilirubinemii, co może wymagać zastosowania fototerapii lub transfuzji wymiennej.
- W niektórych populacjach hiperbilirubinemia może być nasilona do tego stopnia, że zwiększa ryzyko żółtaczki jąder podkorowych i zgonu, podczas gdy w innych populacjach się to nie zdarza.
Ostra hemoliza
- Spowodowana zakażeniem (najczęściej), spożyciem bobu lub narażeniem na lek o działaniu oksydacyjnym (zobacz sekcja Czynniki predysponujące).
- Hemoliza występuje po narażeniu na czynnik stresogenny, ale ulega samoograniczeniu pomimo trwającego zakażenia lub kontynuacji przyjmowania leków.
- Prawdopodobnie jest to spowodowane tym, że najstarsze erytrocyty mają największy niedobór enzymów i ulegają hemolizie jako pierwsze, podczas gdy młodsze erytrocyty, o wyższej aktywności enzymatycznej, są w stanie przetrwać stres oksydacyjny.
- Hemoliza występuje w ciągu 24–72 godzin po zadziałaniu stresora i ustępuje w ciągu 4–7 dni.
- Klinicznie choroba może powodować żółtaczkę, ból pleców i ból brzucha.4-5
- Przy prawidłowej czynności wątroby żółtaczka rozwija się dopiero wtedy, gdy ponad 50% erytrocytów ulegnie hemolizie.
Przewlekła hemoliza
- Przewlekła niedokrwistość niesferocytowa (rzadki wariant niedoboru G6PD)
- Zwykle spowodowana spontaniczną mutacją genu.
- Hemoliza występuje jako postać przewlekła przy zwykłym metabolizmie erytrocytów, natomiast po zadziałaniu odpowiednich czynników wyzwalających ujawnia się w postać ostrą.
- Nasilenie jest różne - od łagodnej hemolizy do niedokrwistości wymagającej transfuzji.
Diagnostyka specjalistyczna
- Ultrasonografia jamy brzusznej (ewentualna splenomegalia, kamienie żółciowe)
Wskazania do skierowania do specjalisty
- W przypadku podejrzenia choroby: skierowanie do poradni hematologicznej
Leczenie
Cele leczenia
- Zapobieganie hemolizie
Opcje leczenia
- Postępowanie ogólne
- unikanie znanych stresorów oksydacyjnych
- przywiązywanie wagi do spożywania odpowiedniej ilości płynów
- fototerapia w przypadku żółtaczki noworodków
- Leczenie swoiste
- w ostrej hemolizie: kwas foliowy 1–5 mg na dobę doustnie przez 14–21 dni1
- W wyjątkowych przypadkach niedokrwistość może być tak nasilona, że konieczne będą transfuzje krwi i/lub podawanie erytropoetyny.
- Splenektomia nie jest zwykle zalecana.
Informacje dla pacjentów
Informacje dla pacjentów w Deximed
Ilustracje

Szlak pentozofosforanowy
Źródła
Piśmiennictwo
- Mehta AB. Glucose-6-phosphate dehydrogenase deficiency. BMJ Best Practice; last reviewed: 17 Feb 2024, last updated: 21 Jun 2023. (dostęp 17.03.2024) bestpractice.bmj.com
- Luzzatto L, Ally M, Notaro R. Glucose-6-phosphate dehydrogenase deficiency. Blood 2020; 136: 1225-40. PMID: 32702756 PubMed
- Glader B. Genetics and pathophysiology of glucose-6-phosphate dehydrogenase (G6PD) deficiency. UpToDate; last reviewed: Feb 2024, last updated: Jun 2023. (dostęp 17.03.2024) medilib.ir
- Adamowicz-Salach A, Podolak-Dawidziak M. Niedobór dehydrogenazy glukozo-6-fosforanowej. Podręcznik Pediatrii. Medycyna Praktyczna. (dostęp 17.03.2024) www.mp.pl
- Glader B. Diagnosis and management of glucose-6-phosphate dehydrogenase (G6PD) deficiency. UpToDate; last reviewed: Feb 2024, last updated: Jun 2023. (dostęp 17.03.2024( www.uptodate.com
Autorzy
- Magdalena Karpiuk, lekarz, w trakcie specjalizacji z medycyny rodzinnej, Uniwersytet Medyczny w Białymstoku (recenzent)
- Sławomir Chlabicz, Prof. dr hab. n. med., specjalista medycyny rodzinnej, Uniwersytet Medyczny w Białymstoku (redaktor)
- Thomas M. Heim, Dr med., Wissenschaftsjournalist, Freiburg
