Informacje ogólne
Definicja
- Rzadkie guzy mezenchymalne wywodzące się z podśluzówki przewodu pokarmowego.
- Mutacje genu KIT lub PDGFRA prowadzą do aktywacji receptorowych kinaz tyrozynowych, a w konsekwencji do zwiększonej proliferacji komórek.
- W zależności od charakterystyki guza, spektrum waha się od guzów bez cech złośliwości do zaawansowanych przerzutów odległych. Zasadniczo wszystkie nowotwory GIST (gastrointestinal stromal tumor) są podejrzewane o potencjał do złośliwienia1.
Częstość występowania
- Na całym świecie zapadalność szacuje się na 10–15 przypadków na 1 mln mieszkańców
- Z reguły nowotwory GIST występują w wieku 55–65 lat. Nowe przypadki w wieku poniżej 40. roku życia są rzadkie2.
- Umiejscowienie: najczęściej w żołądku (60%) i jelicie cienkim (30%), rzadziej w okrężnicy i odbytnicy, bardzo rzadko w przełyku3
Etiologia i patogeneza
- GIST stanowią odrębną grupę guzów o swoistych cechach histologicznych, immunofenotypowych i genetyczno-molekularnych, które odróżniają je od mięśniaków gładkokomórkowych.
- Makroskopia
- typowy guz guzowaty w ścianie jamistego narządu w przewodzie pokarmowym
- Guz może stać się bardzo duży (do 10 cm i więcej).
- Mikroskopia
- W odniesieniu do morfologii komórek, klasyfikacja na typ komórek wrzecionowatych (70%), typ komórek nabłonkowatych (20%) lub typ komórek mieszanych (10%); niejednorodna morfologia, trudno je odróżnić od mięsaków gładkokomórkowych4.
- Stopień złośliwości
- Ryzyko nawrotu lub progresji zależy od częstości mitoz, wielkości i umiejscowienia guza oraz jego pęknięcia5.
- Klasyfikacja UICC jest również oparta na tych parametrach.
Immunohistochemia i genotypowanie
- Ma kluczowe znaczenie dla rozpoznania GIST.
- Komórki GIST zwykle posiadają receptor naskórkowego czynnika wzrostu z aktywnością kinazy tyrozynowej (znany również jako c-Kit), który jest wykrywalny przez barwienie immunohistochemiczne CD117.
- Alternatywnie, markery CD34 lub DOG1 mogą być dodatnie (immunihistochemia)6.
- W większości przypadków występuje mutacja genu KIT lub PDGFRA.
- W mięśniakach gładkokomórkowych testy immunohistochemiczne są ujemne dla c-Kit i silnie dodatnie dla aktyny i/lub desminy; podczas gdy w GIST te ostatnie są ujemne.
- Ponadto analiza mutacji genów KIT i PDGFRA odgrywa rolę w ocenie wrażliwości guza na imatynib, a także w ocenie rokowania6.
ICD-10
- C16 Nowotwór złośliwy żołądka
- C17 Nowotwór złośliwy jelita cienkiego
- C18 Nowotwór złośliwy jelita grubego
Diagnostyka
Kryteria diagnostyczne
- Podejrzenie powstaje na podstawie wyników badań endoskopowych lub obrazowych - podśluzówkowego, okrągłego, ostro ograniczonego guza przewodu pokarmowego.
- Chorobę rozpoznaje się na podstawie histologicznego, immunohistochemicznego i molekularnego badania biologicznego próbki tkanki guza.
- GIST rozpoznaje się, jeśli obraz histologiczny wskazuje na GIST, oraz
- białka KIT (CD117), CD34 lub DOG1 są dodatnie, lub
- jeśli markery są ujemne, analiza mutacji genu KIT lub PDGFRA jest pozytywna6.
Diagnostyka różnicowa
- Rakowiak
- Nowotwór jelita grubego
- Rak żołądka
- Tłuszczakomięsak
- Czerniak złośliwy
- Chłoniak
- Mięśniak gładkokomórkowy
- Mięśniakomięsak gładkokomórkowy
Wywiad lekarski
- Różne objawy kliniczne w zależności od umiejscowienia i wielkości guza
- W oparciu o badanie przeprowadzone wśród pacjentów z GIST zaobserwowano:
- ból brzucha 36%
- krwawienie 28%
- wyczuwalny guz 11%
- ostry brzuch 5%
- brak objawów 19%3
- W zależności od umiejscowienia hematemeza (żołądek, jelito cienkie) lub hematochezja/zmiany stolca (okrężnica lub odbytnica)
- Coraz częstsi są bezobjawowi pacjenci/przypadkowe rozpoznania.
- Rzadko: niedrożność, niedrożność jelita, perforacja
Badanie przedmiotowe
- Różni się w zależności od umiejscowienia i wielkości guza.
Badania uzupełniające w praktyce lekarza rodzinnego
- Nie określono
Diagnostyka specjalistyczna
- Cel badania: zlokalizowanie istniejących GIST, ocena miejscowego rozprzestrzeniania się/zajęcia i identyfikacja ew. przerzutów odległych
- Metody
- gastroskopia: guzek podśluzówkowy, w zaawansowanych guzach z możliwym owrzodzeniem
- endosonografia: najlepszy środek do prowadzenia diagnostyki różnicowej i, w przypadku bardzo małych guzów, obserwacji4
- diagnostyka obrazowa: TK z kontrastem lub RM
- charakterystyka radiologiczna:
- Małe nowotwory GIST występują jako małe, ostro odgraniczone, śródścienne zgrubienia, czasami z owrzodzeniem.
- Większe, złośliwe nowotwory GIST mają postać złożonych zgrubień ze strefami martwiczymi, ponieważ guz rośnie szybciej niż jego ukrwienie.
Procedury diagnostyczne
- W przypadku guzowatych guzów podśluzówkowych mniejszych niż 2 cm: endosonografia
- Przy podejrzeniu GIST potwierdzenie histologiczne lub obserwacja ze względu na niskie ryzyko progresji
- dodatkowe kontrole najpierw po 3 miesiącach, a następnie co 6 miesięcy, w przypadku wzrostu: punkcja cienkoigłowa/wycięcie
- W przypadku guzów większych niż 2 cm: punkcja cienkoigłowa i/lub wycięcie7
Wskazania do hospitalizacji
- Jeśli podejrzewa się opisany guz
- Rzadka choroba: skierowanie do szpitala dysponującego odpowiednią wiedzą specjalistyczną i doświadczeniem w interdyscyplinarnym leczeniu guzów
Leczenie
Cele leczenia
- W zależności od stadium guza — wyzdrowienie, spowolnienie przebiegu choroby lub złagodzenie jej przebiegu
Ogólne informacje o leczeniu
- Guzy resekcyjne mogą być leczone chirurgicznie.
- Opóźnienie progresji poprzez leczenie inhibitorami kinazy tyrozynowej
- Stopień złośliwości
- często trudny do określenia
- Rozmiar i aktywność mitotyczna, a także umiejscowienie guza mają decydujące znaczenie dla rokowania5.
- Ponieważ nie można przewidzieć żadnego konkretnego wzorca wzrostu, a potencjał złośliwienia jest znaczny, międzynarodową rekomendacją jest resekcja wszystkich GIST.
Leczenie chirurgiczne
- Podejście terapeutyczne mające na celu wyleczenie
- Celem jest całkowita resekcja guza w zdrowej tkance (R0).
- Resekcja powiązanego obszaru drenażu limfatycznego nie jest konieczna ze względu na niskie ryzyko przerzutów do węzłów chłonnych.
- Za wszelką cenę należy unikać śródoperacyjnego pęknięcia guza, ponieważ wiąże się ono z praktycznie ze 100% częstością nawrotów, a tym samym znacznie pogarsza rokowanie.
- Guzy mniejsze niż 5 cm mogą być wycinane laparoskopowo, a guzy większe niż 5 cm należy wycinać w drodze zabiegu otwartego, ponieważ istnieje zwiększone ryzyko pęknięcia.
Leczenie farmakologiczne
Inhibitory kinaz tyrozynowych
- Standardowy preparat: imatynib
- Blokuje kinazę tyrozynową KIT (c-Kit).
- Wskazany w następujących przypadkach:
- terapia neoadjuwantowa w celu osiągnięcia resekcyjności przez 6–12 miesięcy
- terapia adjuwantowa wycinanych guzów o wysokim ryzyku nawrotu
- nawrót GIST
- opieka paliatywna
- Zalecana dawka początkowa wynosi 400–800 mg na dobę, w zależności od statusu mutacji.
- Warunek: mutacja wrażliwa na imatynib
- U niektórych pacjentów w trakcie leczenia rozwija się opór na imatynib.
- W przypadku oporu na imatynib: sunitynib lub regorafenib
- W zaawansowanej sytuacji: przyjmowanie przez całe życie
- Ważne dla pacjentów!
- potrzeba pilnego przestrzegania schematu leczenia: znaczne pogorszenie rokowania w przypadku przerwania leczenia i niskiego stężenia leku w osoczu
- interakcje z wieloma lekami i żywnością7
- najczęstsza reakcja niepożądana: mielosupresja, podwyższenie aktywności enzymów wątrobowych, obrzęki obwodowe
Przebieg, powikłania i rokowanie
Rokowanie
- W zależności od wielkości guza, indeksu mitotycznego, umiejscowienia, genetyki molekularnej i wcześniejszego pęknięcia
- 5 lat po leczeniu chirurgicznym u 59,9% pacjentów nie wykryto guza.
- Wciąż niewiele nawrotów po 10 latach; w związku z tym obserwacja powinna być kontynuowana dłużej niż 10 lat.
Informacje dla pacjentów
Illustrationen
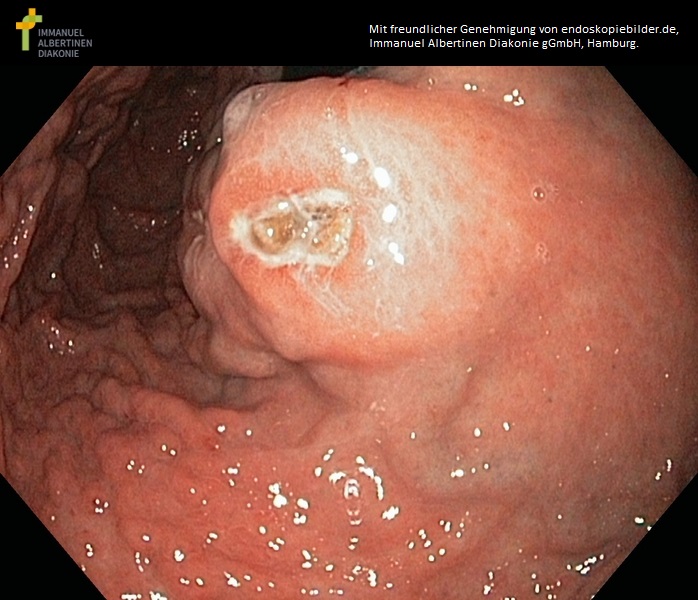
GIST im Corpus ventriculi (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
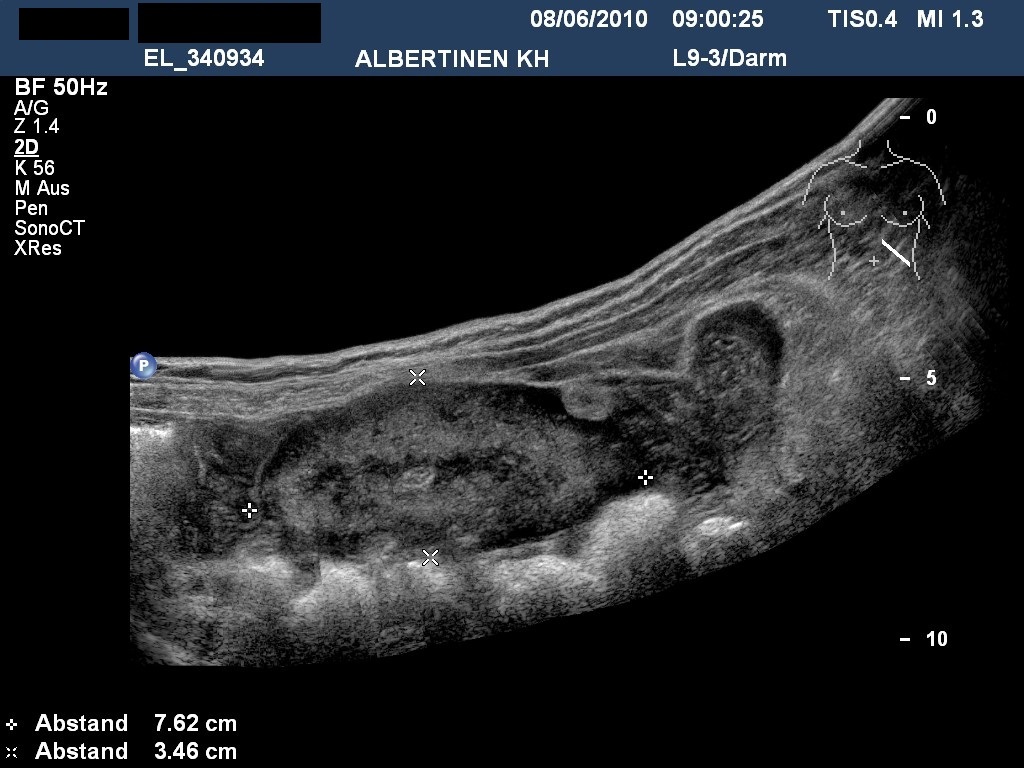
Sonongrafie: GIST im Dünndarm (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e.V., Hamburg)
Quellen
Literatur
- Huang HY, Li CF, Huang WW, et al. A modification of NIH consensus criteria to better distinguish the highly lethal subset of primary localized gastrointestinal stromal tumors: a subdivision of the original high-risk group on the basis of outcome. Surgery 2007; 141: 748. pubmed.ncbi.nlm.nih.gov
- Søreide K, Sandvik OM, Søreide JA, Giljaca V, Jureckova A, Bulusu VR . Global epidemiology of gastrointestinal stromal tumours (GIST): A systematic review of population-based cohort studies.. Cancer Epidemiol 2016; 40: 39-46. pmid:26618334 www.sciencedirect.com
- Caterino S, LLorenzon L, Petrucciani N ,Iannicelli E, Pilozzi E, Romiti A, Cavallini M, Ziparo V. Gastrointestinal stromal tumors: correlation between symptoms at presentation, tumor location and prognostic factors in 47 consecutive patients. World J Surg Oncol. 2011; 9: 13. pmid: 21284869 PubMed
- Akahoshi K, Oya M, Koga T, Shiratsuchi Y. Current clinical management of gastrointestinal stromal tumor. World J Gastroenterol. 2018; 24(26): 2806-2817. pmid:30018476 PubMed
- Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol . 2006; 23(2): 70-83. pmid:17193820 PubMed
- Nishida T, Blay JY, Hirota S, Kitagawa Y, Kang YK. The standard diagnosis, treatment, and follow-up of gastrointestinal stromal tumors based on guidelines. Gastric Cancer. 2016;19:3-14. PubMed
- Casali PG, Abecassis N, et al. Gastrointestinal Stromal Tumours: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29 (Suppl 4): 68-78. www.esmo.org
- von Mehren M et al. NCCN Guidelines Insights: Soft Tissue Sarcoma, Version 1.2021. J Natl Compr Canc Netw . 2020; 12(18): 1604-1612. pmid:33285515 PubMed
- Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Hum Pathol 2008; 39(10): 1411-9. pmid:18774375 PubMed
- Joensuu H, Martin-Broto J, Nishida T, Reichardt P, Schöffski P, Maki RG.. Follow-up strategies for patients with gastrointestinal stromal tumour treated with or without adjuvant imatinib after surgery. . Eur J Cancer. 2015; 51: 1611–1617. pmid:26022432 PubMed
Autor*innen
- Franziska Jorda, Dr. med., Viszeralchirurgin, Ärztin in Weiterbildung Allgemeinmedizin, Kaufbeuren