Streszczenie
- Definicja: Czerniak to nowotwór złośliwy wywodzący się z melanocytów – zwykle z warstwy podstawnej naskórka.
- Częstość występowania: Chorobowość w Polsce w 2020 roku wynosiła 85 przypadków na 100 000 osób.
- Objawy: Pacjenci zgłaszają zmiany w obrębie istniejącego znamienia lub zmianę charakteryzującą się szybkim wzrostem lub nadmierną pigmentacją, czasem świąd, ból, krwawienie w obrębie zmiany.
- Badanie fizykalne: Klinicznie podejrzenie czerniaka budzi zmiana spełniająca kryteria reguły ABCDE – asymetryczna, o nieregularnych brzegach, kilku kolorach, średnicy >6mm, zmieniająca się z biegiem czasu.
- Diagnostyka: Złotym standardem pozostaje badanie histopatologiczne wyciętej zmiany.
- Leczenie: Wstępne leczenie opiera się na chirurgicznym wycięciu zmiany, ewentualnie dodatkowo chemioterapii i radioterapii w zaawansowanych stadiach.
Informacje ogólne
Definicja
- Czerniaki skóry wywodzą się z melanocytów warstwy podstawnej naskórka, ale mogą również wywodzić się z melanocytów w błonach śluzowych lub oczach.1
- Około 40% wszystkich czerniaków błon śluzowych i tylko 10% wszystkich czerniaków skóry to czerniaki amelanotyczne.2
- We wzroście czerniaka istnieją dwie fazy – wzrostu horyzontalnego i wertykalnego (charakteryzującej się szybkim naciekaniuem w głąb skóry).3
Klasyfikacja
- Klasyfikacja kliniczna i histologiczna według WHO4:
- czerniak szerzący się powierzchownie
- czerniak guzkowy
- czerniak lentiginalny (dawniej czerniak wywodzący się z plamy soczewicowatej)
- czerniak złośliwy odsiebnych części kończyn.
- Rzadkie warianty histologiczne:
- czerniak spitzoidalny (morfologiczne podobieństwo do znamienia Spitz)
- czerniak nevoidalny
- czerniak desmoplastyczny/neurotropowy.
- Czerniaki błony śluzowej:
- dotychczas nie ustalono standardów oceny histopatologicznej.
Klasyfikacja TNM i stopień zaawansowania według AJCC (American Joint Committee on Cancer)
- Patrz tabela Klasyfikacja TNM czerniaka – T (guz pierwotny).
- Patrz tabela Klasyfikacja TNM czerniaka – N (przerzuty do węzłów chłonnych).
- Patrz tabela Klasyfikacja TNM czerniaka – M (przerzuty odległe).
Klasyfikacja stadiów czerniaka
- Patrz tabela Czerniak klasyfikacja stadiów.
Epidemiologia
- Współczynnik chorobowości w Europie Środkowej wynosi około 100–120 przypadków na 100 000 osób.
- W Polsce w 2020 roku wynosił 85 przypadków na 100 000 osób.5
- Ryzyko rozwoju czerniaka w ciągu całego życia wynosi około 2%.
- Zapadalność: około 25/100 000 osób rocznie.
- Znaczący wzrost zapadalności w ostatnich dziesięcioleciach:
- prawdopodobnie w dużej mierze spowodowany zwiększoną wykrywalnością6
- w tym okresie śmiertelność związana z czerniakiem nieznacznie wzrosła u mężczyzn
- wzrost zapadalności dotyczy głównie wczesnych stadiów choroby
- pewną rolę mogą odgrywać zmiany w sposobie spędzania wolnego czasu związane ze zwiększoną ekspozycją na słońce i zmianami klimatycznymi.
- prawdopodobnie w dużej mierze spowodowany zwiększoną wykrywalnością6
- Czerniak jest drugim najczęściej występującym nowotworem złośliwym u młodych dorosłych.
- W przypadku osób pochodzenia europejskiego ryzyko jest 10 razy wyższe niż w przypadku innych grup etnicznych.
- Względny wskaźnik 5-letniego przeżycia w Polsce wynosił 65% u obu płci.7
- Średni wiek zachorowania wynosi 64 lata u mężczyzn i 60 lat u kobiet.
- Czerniak stanowi 3–5% wszystkich nowotworów skóry, ale jest przyczyną zgonu w 90% wszystkich zgonów z powodu raka skóry.8
Etiologia i patogeneza
- Znamiona:
- Promieniowanie ultrafioletowe:
- promieniowanie UV jest najważniejszą zewnętrzną przyczyną rozwoju czerniaka
- jest ono szczególnie niebezpieczne w postaci epizodycznej ekspozycji na słońce o wysokiej intensywności i powtarzających się oparzeń słonecznych12
- całkowita skumulowana ekspozycja na promieniowanie UV jest istotna w rozwoju czerniaka lentiginalnego
- krótkofalowe promieniowanie UVB światła słonecznego powoduje oparzenia słoneczne i odgrywa największą rolę w rozwoju czerniaka
- promienie UVA mogą również powodować uszkodzenia DNA, starzenie się skóry i polimorficzną osutkę świetlną („alergię słoneczną”).
- promieniowanie UV jest najważniejszą zewnętrzną przyczyną rozwoju czerniaka
- Zakłada się, że rozwój 5–10% przypadków czerniaka jest uwarunkowany genetycznie, podczas gdy promieniowanie UV jest czynnikiem wyzwalającym u 2/3 wszystkich pacjentów.3
- Czerniak może rozwinąć się wszędzie tam, gdzie znajdują się komórki produkujące melaninę: w obrębie skóry, błon śluzowych (jamie ustnej, jamie nosowej, zatokach, błonie śluzowej przewodu pokarmowego i zewnętrznych narządów płciowych), oczach i węzłach chłonnych.
- Około 90% czerniaków rozwija się w obrębie skóry.
- Czerniak może rozwijać się również w okolicach nienarażonych na działanie promieni słonecznych.
- W 8–10% wszystkich przypadków lokalizacja guza pierwotnego jest nieznana; rozpoznanie stawia się na podstawie przerzutów.
- Około 80% nawrotów występuje w ciągu pierwszych 3 lat; w rzadkich przypadkach opisywano nawet 15–20 lat, a nawet dłuższe okresy utajenia przed pojawieniem się przerzutów.
Czynniki predysponujące
- Predyspozycje do rozwoju czerniaka występują u osób z 1. i 2. fototypem skóry.13
- Osoby z 1. fototypem skóry po ekspozycji na słońce zawsze ulegają poparzeniom słonecznym, nigdy się nie opalają.
- Osoby z 2. fototypem skóry często ulegają oparzeniom słonecznym, czasami lekko się opalają.
- Znamiona wrodzone.
- Wcześniejsze zachorowanie na czerniaka.
- Wzrost ryzyka o 9–10%.
- Ryzyko jest najwyższe w ciągu pierwszych 2 lat od rozpoznania.16
- Predyspozycje rodzinne.
- Podwyższone ryzyko w przypadku występowania czerniaka u krewnych 1. lub 2. stopnia.17
- Duża liczba znamion.
- Ryzyko jest zwiększone u pacjentów z dużą liczbą znamion (u pacjentów z powyżej 100 znamionami barwnikowymi rośnie siedmiokrotnie).10
- Czerniak uwarunkowany genetycznie.
- Pacjenci z mutacją w genie CDKN2A lub CDK4.
- Mutacje prowadzą do znacznie zwiększonego ryzyka rozwoju czerniaka.
- Wrodzony defekt genu CDKN2A również stanowi ryzyko rozwoju raka trzustki.
- Predyspozycje u pacjentów z obniżoną odpornością, dzieci i młodzieży, którzy byli/są leczeni lekami immunosupresyjnymi.
- Długotrwała fototerapa PUVA np. w leczeniu łuszczycy.
- Predyspozycje przy skórze pergaminowej (xerodermia pigmentosum.
- Predyspozycja do chorób skóry z powodu braku zdolności do naprawy DNA.
- Oparzenia słoneczne w dzieciństwie i okresie dojrzewania wydają się mieć większe znaczenie niż oparzenia słoneczne w późniejszym okresie życia.12
- Korzystanie z solariów.
- Artykuły przeglądowe wskazują na względny wzrost ryzyka o około 20% wśród osób, które już korzystały solariów.18
- Ryzyko wzrasta o około 80%, jeśli z solarium korzystano przed 35. rokiem życia.18
- Solaria są czynnikiem ryzyka rozwoju czerniaka; ich znaczenie może być jeszcze większe niż wcześniej sądzono.19
- Możliwe, że ryzyko u osób o jasnej karnacji i jasnych włosach jest większe w przypadku korzystania z solarium niż ryzyko powodowane promieniowaniem słonecznym.20
- Osoby młodsze wydają się być bardziej zagrożone niż osoby starsze.
ICD-10
- C43 Czerniak złośliwy skóry.
- C43.0 Czerniak złośliwy wargi.
- C43.1 Czerniak złośliwy powieki, łącznie z kątem oka.
- C43.2 Czerniak złośliwy ucha i przewodu słuchowego zewnętrznego.
- C43.3 Czerniak złośliwy innych i nieokreślonych części twarzy.
- C43.4 Czerniak złośliwy owłosionej skóry głowy i skóry szyi.
- C43.5 Czerniak złośliwy tułowia.
- C43.6 Czerniak złośliwy kończyny górnej, łącznie z barkiem.
- C43.7 Czerniak złośliwy kończyny dolnej, łącznie z biodrem.
- C43.8 Czerniak złośliwy skóry przekraczający granice jednego umiejscowienia.
- C43.9 Czerniak złośliwy skóry, umiejscowienie nieokreślone.
Diagnostyka
Kryteria diagnostyczne
- Podejrzenie choroby stawia się w oparciu o badanie fizykalne, jeżeli to możliwe rozszerzone o badanie dermatoskopowe.
- Zastosowanie reguły ABCDE lub 7-punktowej skali Glasgow zwiększa czułość rozpoznania czerniaka.
- pozwala na identyfikację jedynie części czerniaków, głównie szerzących się powierzchownie i w znaczącej cześci czerniaków zaawansowanych.21
- nie służy jako przesiewowe narzędzie diagnostyczne w praktyce klinicznej
- nie pozwala na właściwa kwalifikację około 50% czerniaków (szczególnie wczesnych o średnicy <5 mm, czerniaków guzkowych, barwnikowych i zlokalizowanych w obrębie owłosionej skóry głowy)21
- Złotym standardem w diagnostyce czerniaka pozostaje badanie histopatologiczne.
Klasyfikacja kliniczna
Czerniak szerzący sie powierzchownie
- Stanowi około 70% wszystkich przypadków czerniaka.
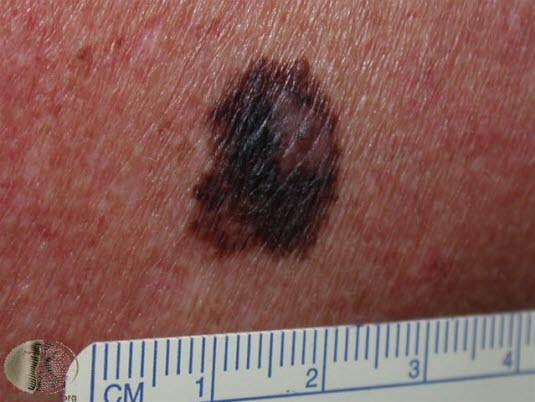 Czerniak szerzący się powierzchownie
Czerniak szerzący się powierzchownie - Najczęściej występuje na skórze tułowia i kończyn.
- Jest to lekko uniesiony, nieregularnie odgraniczony i wybarwiony guz skóry, który może mieć kolor od brązowego do czarno-niebieskiego, ewentualnie może też być całkowicie czarny.
- Krótka lub długa faza zwiększania się promienia może poprzedzać czas przed rozwojem nacieku.
Czerniak guzkowy
- Stanowi 10–15% wszystkich przypadków czerniaka.
- Choroba występuje najczęściej w grupie wiekowej 30–60 lat.
- Występuje najczęściej na skórze tułowia i kończyn.
 Czerniak guzkowy
Czerniak guzkowy - Może rozwinąć się w znamieniu lub de novo. Prezentuje się jako guzek o barwie od czarnej do niebieskiej, ewentualnie z czerwonymi lub niebiesko-białymi obszarami.
- Czerniaki guzkowe są bardzo inwazyjne i charakteryzują się brakiem początkowej fazy wzrostu horyzontalnego; wcześnie dają przerzuty. Ze względu na szybki wzrost, jedynie kilka procent diagnozowanych jest we wczesnym stadium.
Czerniak lentiginalny (czerniak wywodzący się z plamy soczewicowatej)
-
Postać inwazyjna stanowi około 5% wszystkich przypadków czerniaka.
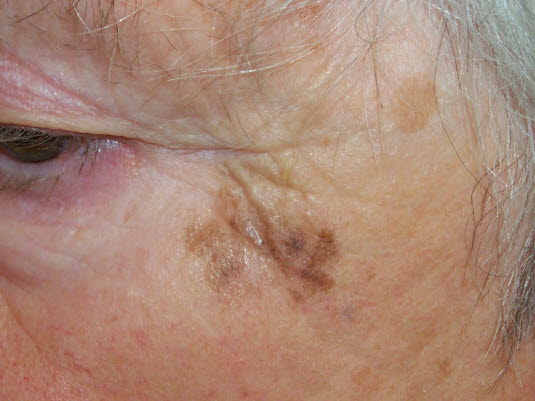 Czerniak lentiginalny
Czerniak lentiginalny - Powstaje na skórze silnie uszkodzonej słońcem, najczęściej na skórze twarzy u osób w podeszłym wieku.
- Większość przypadków przebiega w postaci przedinwazyjnej in situ, poniżej 5% przypadków czerniaka lentiginalnego przybiera charakter inwazyjny. Proces ten trwa zwykle kilka, kilkanaście lat.
- Postać przedinwazyjna klinicznie prezentuje się jako nieregularna zmiana barwy brązowej, zwykle ciemniejsza od innych zmian na skórze twarzy pacjenta. Pojawienie się kilku kolorów lub guzka wskazuje na przejście w formę inwazyjną.
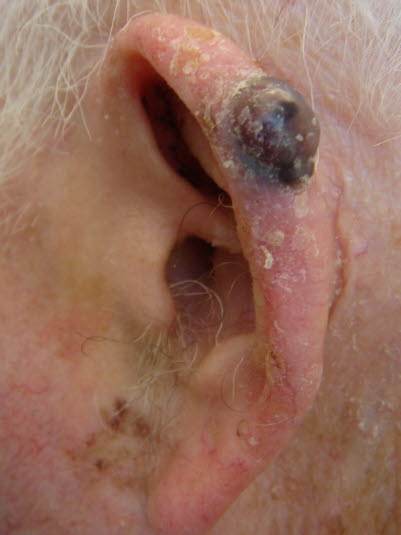
Czerniak odsiebnych części kończyn
-
Stanowi około 5% wszystkich przypadków czerniaka.
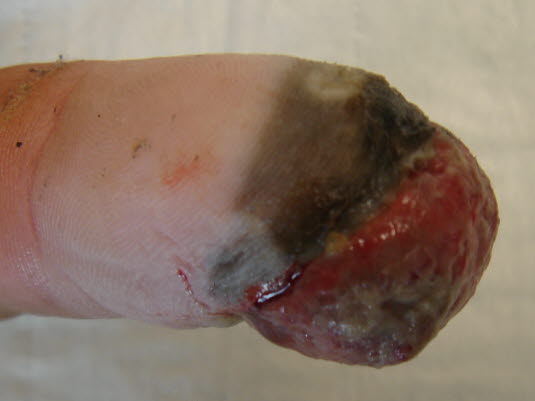 Czerniak odsiebnych części kończyn
Czerniak odsiebnych części kończyn - Występuje dystalnie na kończynach, najczęściej na skórze nienarażonej na działanie promieni słonecznych, takiej jak palce stóp, podeszwy, palce dłoni, dłonie lub pod paznokciami.
- Ten nowotwór złośliwy prawdopodobnie rozwija się w obrębie znamion łączących dłoni, podeszwy i błon śluzowych.
- Często w momencie rozpoznania występuje wertykalna faza wzrostu, prawdopodobnie z powodu późnego rozpoznania.
Warianty histologiczne
- Czerniak bezbarwnikowy:
- guz składa się z komórek bez widocznej produkcji melaniny
- szybko rosnący guz o guzkowej budowie, powierzchni w kolorze od białego do czerwonego, ewentualnie z owrzodzeniami lub krwawieniem
- możliwe rozpoznania w ramach diagnostyki różnicowej to ziarniniak ropotwórczy, szybko rosnące włókniaki lub przewlekłe rany
- usunięte guzki zawsze trzeba zbadać pod kątem histologicznym!
- rośnie szybko i często jest rozpoznawany dopiero po wystąpieniu przerzutów.
- Czerniak nevoidalny:
- klinicznie można go łatwo pomylić z łagodnym znamieniem
- wyraźnie odróżnia się od niego tylko w badaniu histologicznym
- często bezbarwnikowy.
- klinicznie można go łatwo pomylić z łagodnym znamieniem
- Czerniak desmoplastyczny (neurotropowy):
- rzadki wariant, w którym występuje tylko pionowa faza wzrostu
- rozwija się z czerniaka lentiginalnego lub czerniaka odsiebnych części kończyn
- ten nowotwór złośliwy szczególnie często występuje na głowie lub szyi u osób starszych.
- Czerniak spitzoidalny:
- czerniak przypominający znamię Spitz
- asymetryczny guzek o zabarwieniu od czerwonego do brązowawego
- przeważnie o gładkiej powierzchni.
Diagnostyka różnicowa
- Znamiona urodzeniowe.
- Znamię dysplastyczne.
- Znamię mieszane.
- Rogowacenie słoneczne.
- Plama soczewicowata.
- Rogowiak kolczystokomórkowy.
- Naczyniak.
- Grzybica paznokci.
- Krwiak podpaznokciowy lub podrogowy.
- Brodawka łojotokowa.
- Ziarniniak ropotwórczy.
- Powierzchowny rak podstawnokomórkowy.
- Włókniak.
Wywiad lekarski
- Pacjenci często zauważają zmiany w istniejących znamionach lub szybki rozwój nowej, barwnikowej zmiany.
- Zwiększenie wymiarów.
- Zmiana koloru.
- Krwawienie i/lub nadżerki.
- Zmieniony sposób odczuwania: świąd, ból, kłucie.
Badanie fizykalne
- Należy wykonać dokładne badanie fizykalne całej skóry ze szczególnym uwzględnieniem innych podejrzanych zmian barwnikowych, zmian satelitarnych lub/i in transit oraz ocenę węzłów chłonnych i badanie pod kątem obecności ewentualnych przerzutów odległych.21
- Kryteria rozróżnienia między prawidłowymi a atypowymi znamionami nie są precyzyjne.22 Zastosowanie reguły ABCDE (patrz poniżej) usprawnia proces rozpoznania czerniaka.
- Około 10% wszystkich czerniaków skóry to czerniaki amelanotyczne (nie produkują melaniny) i można je pomylić ze zmianami łagodnymi. Szczególnie ma to miejsce w przypadku czerniaków guzkowych (guzków), z których wiele jest bezbarwnikowych lub skąpobarwnikowych (czerwonych lub różowych).23
- Zmiany barwnikowe, które różnią się od innych znamion pacjenta i przyciągają uwagę, są często określane mianem „brzydkiego kaczątka”.
- Jest to ważna cecha w kontekście oceny podejrzanych zmian.
- Bardzo czuły objaw czerniaka.
- Jeśli całkowita liczba znamion na skórze jest wysoka (>100), istnieje zwiększone ryzyko rozwoju czerniaka.10
Reguła ABCDE
- Asymmetry (asymetria)
- Większość znamion jest symetryczna, patrząc wzduż ich promienia. W przypadku czerniaka jedna połowa nie jest lustrzanym odbiciem drugiej, a wybarwienie jest nierówne.
- Nawet jeśli mamy do czynienia z nieregularnymi znamionami dysplastycznymi, ich symetria jest lepiej zachowana niż w przypadku czerniaków.
- Border (odgraniczenie)
- W przypadku czerniaków, ich odgraniczenie jest zazwyczaj nieregularne, może występować rozmyte, postrzępione lub ostre odgraniczenie zmiany ze zwiększoną pigmentacją na brzegach, prawdopodobnie również w przypadku guzków satelitarnych.
- Znamiona dysplastyczne mają zwykle rozmyte, sączące i nieregularne odgraniczenie od skóry zdrowej.
- Colour (kolor)
- Nierównomierny rozkład barwnika.
- Odcienie kolorów znamion dysplastycznych wahają się od czerwonawo-brązowego do czarnego. Zmiany koloru są bardziej widoczne w przypadku czerniaka.
- Niebieskie, białe, szare, pomarańczowe i różowe wybarwienia zwiększają prawdopodobieństwo, że jest to czerniak.
- Czerniaki często mają błyszczącą powierzchnię, ponieważ światło odbija się od pigmentu, który gromadzi się w górnych warstwach naskórka pod cienką powierzchnią nabłonka płaskiego.
- W przypadku czerniaka może również występować zjawisko halo (odbarwiona otoczka).
- Diameter (średnica) lub Dynamics (dynamika)
- Średnica >5 mm.
- Znamiona barwnikowe zwykle mają średnice poniżej 5 mm, dlatego większe zmiany budzą podejrzenie czerniaka.
- Dynamika zmian morfologicznych w guzie.
- Evolution/Elevation (rozwój/uniesienie)
- Uniesienie powierzchni ponad poziom naskórka (Uwaga: cienkie czerniaki o grubości ≤1 mm mogą nie być wyczuwlane!)
- Zmiana średnicy lub rozwój asymetrii, koloru lub rozmiaru znamienia.
- Takie zmiany zawsze powinny wzbudzać podejrzenia.
Umiejscowienie
- Czerniaki rozwijają się na tułowiu w około 40% przypadków, w około 15% przypadków dotyczą głowy i szyi, w około 15% przypadków kończyn górnych i w około 30% przypadków kończyn dolnych.
- Czerniaki błon sluzowych okolicy głowy i szyi występują rzadko, ale cechują sie agresywnym przebiegiem i złym rokowaniem.21
- W 70-80% przypadków dotyczą jamy nosowej i zatok przynosowych, pozostałe przypadki jamy ustnej.21
- Czerniaki mogą dawać przerzuty do niemal każdej części ciała, jednak w większości przypadków przerzuty tworzą się w węzłach chłonnych, skórze, płucach, wątrobie, kościach, przewodzie pokarmowym i mózgu.
Diagnostyka z użyciem aparatury
-
Dermatoskopia:
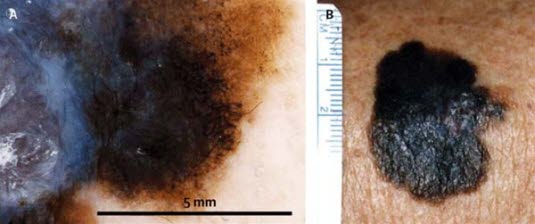 Obraz dermatoskopowy (A) czerniaka oraz obraz makroskopowy (B)
Obraz dermatoskopowy (A) czerniaka oraz obraz makroskopowy (B)- dermatoskopia wymaga doświadczenia i odpowiedniego szkolenia; jeśli lekarz rodzinny odbędzie takie szkolenie, może stosować dermoskopię w swoim gabinecie
- korzystając z dermoskopu, doświadczeni lekarze mogą wykrywać czerniaki z wysoką czułością i swoistością, zmniejszając liczbę łagodnych zmian usuwanych z powodu podejrzenia czerniaka
- daje też możliwość wykrycia czerniaka we wcześniejszym stadium24-26
- możliwe jest różnicowanie zmian melanocytarnych z niemelanocytarnymi
- struktury dermatoskopowe budzące podejrzenie czerniaka to m.in. atypowa siatka barwnika, asymetryczne kropki, globule, linie promieniste i pseudopodia, asymetryczne plamy, niebiesko-biały welon, białe lśniące linie, naczynia polimorficzne.
- Wszystkie zmiany melanocytarne, które są usuwane z powodów medycznych (wykluczenie czerniaka), powinny być całkowicie wycięte chirurgicznie jako biopsja wycinająca.
- Zmianę należy usunąć za pomocą nacięcia w kształcie osełki, 2–5 mm w głąb skóry prawidłowej i z poduszką tłuszczu podskórnego.
- Próbkę należy zawsze poddać badaniu histopatologicznemu.
- Biopsja:
- Pozwala na mikroskopowe potwierdzenie rozpoznania i określenie czynników rokowniczych.21
- wycięcie częściowe, biopsja sztańcowa, biopsja ścinająca i laserowe usuwanie nie są zalecane
- metody te utrudniają klasyfikację histologiczną, która jest niezbędna w celu zaplanowania dalszego leczenia
- w szczególnych sytuacjach, takich jak np. umiejscowienie guza na twarzy, guz u osób starszych, osłabionych lub w przypadku podejrzenia nowotworu w małej części dużej zmiany (np. wrodzonego znamienia melanocytowego), ograniczona biopsja (biopsja sztańcowa) może ułatwić proces rozpoznania histologicznego.
Diagnostyka specjalistyczna
Refleksyjna mikroskopia konfokalna
- Wstępną ocenę dermatoskopową można zweryfikować za pomocą refleksyjnej mikroskopii konfokalnej, w ramach sepcjalistycznej porady dermatologicznej.21
Badanie genetyczne
- Osobom z czerniakiem w wywiadzie rodzinnym należy zaoferować poradnictwo genetyczne.
- Rodzinne występowanie czerniaka może być spowodowane mutacją w dwóch różnych genach: CDKN2A i CDK4.
Grupy docelowe testu genetycznego
- Osoby z co najmniej 3 krewnymi chorymi na czerniaka.
- Osoby z 2 krewnymi 1. stopnia z czerniakiem (rodzeństwo, rodzice lub dzieci).
- Osoby z 2 krewnymi z czerniakiem, z których jeden chorował na przynajmniej 2 czerniaki.
- Osoby, które mają bliskiego krewnego lub ewentualnie u tej samej osoby także występował zarówno rak trzustki, jak i czerniak.
Diagnostyka rozsianego procesu nowotworowego
- Prowadzona w ramach diagnostyki specjalistycznej.
- Indywidualna ocena na podstawie pierwotnych wyników, z jednej strony w celu umożliwienia wczesnej terapii ukierunkowanej w kontekście stadium, a z drugiej strony w celu uniknięcia nadrozpoznawalności i fałszywie dodatnich wyników u pacjentów z miejscowym procesem i niskim ryzykiem przerzutów.3
- Zalecane bezobjawowym pacjentom w stadium IB–IIB:
- ultrasonografia węzłów chłonnych
- marker nowotworowy S-100B.
- U pacjentów z potwierdzonymi przerzutami lokoregionalnymi lub ich podejrzeniem (stadium IC–III):
- RM czaszki
- obrazowanie całego ciała bez głowy (PET/TK, TK, RM)
- ultrasonografia węzłów chłonnych
- marker nowotworowy S-100B
- dehydrogenaza mleczanowa (LDH)
- podwyższony poziom LDH i przerzuty trzewne wskazują na średnią długość życia wynoszącą zaledwie 4–6 miesięcy.27
Diagnostyka histopatologiczna
- Badanie histologiczne jest ważne w kontekście planowania leczenia.
- Klasyfikacja TNM rozróżnia klasyfikację kliniczną (TNM) i patologiczną (pTNM).
- Podział klasyfikacji TNM:
- T: guz (tumor)
- N: przerzuty do węzłów chłonnych (node)
- M: przerzuty narządowe (odległe) (metastases).
- Najważniejsze zmienne klasyfikacji pTNM:
- głębokośc nacieku (wg skali Breslowa)
- obecność owrzodzenia
- liczba mitoz.
- Następujące parametry guza są rutynowo opisywane przez lekarza:
- typ histologiczny, inwazyjny lub in situ, faza wzrostu
- głębokośc nacieku (wg Breslowa), w dziesiątych częściach milimetra
- głębokość nacieku (wg klasyfikacji Clarka 1–5)
- owrzodzenia (potwierdzone/niepotwierdzone)
- liczba mitoz (ilość mitoz/mm2)
- inne czynniki (naciek naczyń, nerwów, naciek limfocytów, inne)
- marginesy chirurgiczne
- ewentualnie przerzuty w węzłach chłonnych.
- Patrz tabele Klasyfikacja TNM i Klasyfikacja stadiów czerniaka.
Leczenie
Cele leczenia
- Usunięcie czerniaka z zachowaniem marginesu chirurgicznego oraz ewentualnie leczenie uzupełniające.
Leczenie chirurgiczne
- Podstawową metodą leczenia jest zabieg chirurgiczny.
Pierwotna resekcja/biopsja wycinająca
- Wszystkie zmiany barwnikowe usuwane ze wskazań medycznych (wykluczenie czerniaka), powinny być usunięte w całości z marginesem bocznym 1–3 mm niezmienionej chorobowo skóry.21
- Całą zmianę należy usunąć za pomocą nacięcia w kształcie osełki, 2–5 mm w głąb skóry właściwej i z warstwą podskórnej tkanki tłuszczowej.
- Wycinek należy poddać badaniu histopatologicznemu.
- W przypadku potwierdzenia wstępnego rozpoznania czerniaka pacjenta należy poszerzyć marginesy wycięcia w zależności od głębokości nacieku.
- Przed wycięciem należy przeprowadzić badanie węzłów chłonnych, ponieważ zabieg chirurgiczny może powodować stan zapalny i powiększenie lokalnych węzłów chłonnych.
Poszerzenie marginesów
- Patrz tabela Czerniak, zalecane bezpieczne odległości w kontekście szerokiego wycięcia.
- Poszerzone cięcie powinno sięgać powięzi leżącej poniżej.
- Szerokość jest mierzona przed nacięciem (in vivo), a nie na utrwalonym wycinku.
- Większość ran można zamknąć klasycznym szwem, ale w zależności od lokalizacji i rozmiaru, w niektórych przypadkach może być niezbędny przeszczep skóry lub inna technika chirurgicznego zamknięcia rany.
- Szczególnej uwagi i wiedzy specjalistycznej wymagają przede wszystkim czerniaki twarzy, uszu, klatki piersiowej, palców dłoni lub palców/podeszew stóp.
Badanie wartowniczych węzłów chłonnych
- Wartowniczy węzeł chłonny jest pierwszym węzłem chłonnym, do którego spływa limfa z obszaru guza.
- Wyzwaniem jest zlokalizowanie wartowniczego węzła chłonnego.3
- Dane wynikające z badań retrospektywnych potwierdzają, że przerzuty w węźle wartowniczym wiążą się z gorszym rokowaniem.
- Wskazania do biopsji węzła wartowniczego zależą od parametrów guza pierwotnego i charakterystyki pacjenta.
- W celu określenia stadium, biopsja węzła chłonnego wartowniczego powinna być wykonana w momencie, gdy guz ma grubość przynajmniej 1,0 mm i gdy nie zostały potwierdzone przerzuty miejscowe lub odległe.
- Jeśli istnieją dodatkowe czynniki ryzyka przemawiające za dodatnim węzłem chłonnym wartowniczym, jego biopsję należy również wykonać w przypadku cieńszych guzów pierwotnych (0,75–1 mm). Do takich czynników należą owrzodzenia i/lub zwiększona częstość mitotyczna i/lub młodszy wiek pacjenta.
Wznowa miejscowa
- Chirurgiczna resekcja wznowy miejscowej jest zawsze leczeniem pierwszego wyboru.
- Złożone wznowy powinny zostać również ocenione w badaniach obrazowych.
- Wznowa miejscowa jest definiowana jako nawrót czerniaka w bliźnie pooperacyjnej lub pod nią.
- Przerzuty in transit to przerzuty w drogach limfatycznych między guzem pierwotnym a regionalnymi węzłami chłonnymi.
- Pojedyncze przerzuty tego typu leczy się poprzez resekcję zajętej okolicy.
Przerzuty do węzłów chłonnych
- Przerzuty do węzłów chłonnych leczone są drogą limfadenektomii.
- Celem jest miejscowa cytoredukcja, a także zapobieganie przedostawaniu się tkanki nowotworowej przez skórę.
- Leczenie chirurgiczne przerzutów do węzłów chłonnych szyi lub miednicy powinno być wykonywane w wyspecjalizowanych ośrodkach.
- W przypadku limfadenektomii w okolicy pachwiny, proces gojenia jest często dłuższy.
- Należy pamiętać o profilaktyce zakrzepicy i obrzęku limfatycznego.
Operacja czerniaka z przerzutami
- W leczeniu przerzutów czerniaka można podjąć próbę leczenia chirurgicznego, zwłaszcza u pacjentów z pojedynczym ogniskiem.
- Warunkiem wstępnym jest wcześniejsza dokładna diagnostyka obrazowa.
- Jeżeli nie istnieje możliwość usunięcia wszystkich ognisk, usunięcie pojedynczych przerzutów należy stosować jako terapię paliatywną.
- Leczenie chirurgiczne jest szczególnie ważne w przypadku ograniczonej liczby przerzutów, w przypadku pojedynczych przerzutów do płuc i mózgu oraz przerzutów do wątroby w określonym obszarze.
- Chirurgiczna resekcja pojedynczego przerzutu do mózgu z pooperacyjną radioterapią zapewnia lepszą kontrolę miejscową i dłuższe całkowite przeżycie w porównaniu z samą radioterapią lub obserwacją.28
- Skojarzenie terapii radiacyjnej i inhibitorów BRAF jest możliwe i powinno być wykonywane sekwencyjnie.
- Przerzuty do przewodu pokarmowego są zwykle zlokalizowane w obrębie jelita cienkiego i mogą powodować nietypowe objawy ze strony jamy brzusznej oraz niedokrwistość. Należy rozważyć ich usunięcie w przypadku zagrożenia niedrożnością jelita.
Radioterapia
Pierwotna radioterapia
- Radioterapia nie jest częścią podstawowego leczenia czerniaka; wyjątkami od tej zasady są:
- miejscowo zaawansowane czerniaki
- duże czerniaki lentiginalne na skórze twarzy
- mały czerniak złośliwy oka.
Adjuwantowa radioterapia po limfadenektomii
- W celu zwiększenia skuteczności leczenia w przypadku przerzutów do węzłów chłonnych, wskazana jest radioterapia loży pooperacyjnej w przypadku spełnienia co najmniej jednego z poniższych kryteriów:
- 3 zajęte węzły chłonne
- inwazja poza torebkę węzła chłonnego
- przerzuty do węzłów chłonnych >3 cm
- wznowa limfopochodna.
- Pozytywny wpływ pooperacyjnej, adjuwantowej radioterapii regionalnego obszaru drenażu limfatycznego na czas przeżycia nie został jeszcze udowodniony.
Paliatywna radioterapia
- W celu poprawy jakości życia, redukcji bólu i poprawy miejscowej kontroli guza, przerzuty w skórze, tkance podskórnej lub węzłach chłonnych, które są nieoperacyjne ze względu na ich liczbę, rozmiar lub lokalizację, mogą być poddane radioterapii na etapie odległych przerzutów.
- Pacjenci z przerzutami do kości powinni otrzymać radioterapię, aby poprawić kontrolę objawów klinicznych i zapobiec miejscowym powikłaniom.
- U pacjentów z ostrymi objawami spowodowanymi uciskiem zewnątrzoponowym w obszarze rdzenia kręgowego, radioterapia może być stosowana do kontroli objawów.
- Paliatywna radioterapia całego mózgu powinna być oferowana w przypadku mnogich objawowych przerzutów do mózgu, gdy spodziewany czas przeżycia jest dłuższy niż 3 miesiące.
- W przypadku ograniczonych przerzutów do mózgu, należy rozważyć zabieg chirurgiczny lub jednorazową radioterapię stereotaktyczną. Poprawiają one miejscową kontrolę guza i mogą wydłużyć czas przeżycia u pacjentów z pojedynczymi przerzutami.
- Radioterapia stereotaktyczna może być również wskazana w przypadku przerzutów w ograniczonych obszarach w innych narządach, takich jak płuca, wątroba, śledziona i nadnercza, a w niektórych przypadkach przerzutów w kręgosłupie.
Leczenie farmakologiczne
Immunoterapia
- Leczenie refundowane ze środków publicznych, po spełnieniu określonych kryteriów w ramach Programu Lekowego B.59 (Leczenie chorych na czerniaka skóry lub błon śluzowych)29:
- niwolumab
- pembrolizumab
- niwolumab w skojarzeniu z ipilimumabem
- wemurafenib w skojarzeniu z kobimetynibem
- enkorafenib w skojarzeniu z binimetynibem
- dabrafenib w skojarzeniu z trametynibem
- niwolumab w skojarzeniu z relatlimabem.
- W leczeniu uzupełniającym:
- niwolumab
- pembrolizumab
- dabrafenib w skojarzeniu z trametynibem
- W leczeniu przedoperacyjnym:
- niwolumab z skojarzeniu z imilimabem.
Terapia adjuwantowa
- Wskazania:
- w terapii adjuwantowej istotnym punktem końcowym dla oceny korzyści jest przeżycie całkowite
- pacjenci z wysokim ryzykiem przerzutów mogą być poddani obserwacji tylko wtedy, gdy wcześniej omówiono opcje terapii adjuwantowej
- wskazania według stadiów zaawansowania guza wg AJCC 2009:
- IIA – guz pierwotny 1,01–2,0 mm z owrzodzeniem lub 2,01–4,0 mm, bez owrzodzenia; N0, M0
- IIB – guz pierwotny 2,01–4,0 mm z owrzodzeniem lub >4,0 mm, bez owrzodzenia; N0, M0
- IIC – >4,0 mm z owrzodzeniem; N0, M0
- IIIA – mikroskopijne przerzuty do węzłów chłonnych; M0
- IIIC – guz pierwotny z owrzodzeniem, makroskopowymi przerzutami do węzłów chłonnych lub zbitymi węzłami chłonnymi lub zmianami satelitarnymi i/lub przerzutami przejściowymi z przerzutami do regionalnych węzłów chłonnych; M0.
- Ipilimumab:
- pacjentom z guzami w stadium IIIA–C wg AJCC 2009 można zaoferować adjuwantową terapię ipilimumabem; w tym przypadku przy podejmowaniu decyzji o terapii należy uwzględnić poważne działania niepożądane.
- Interferon:
- pacjentom ze stopniem zaawansowania guza IIB/C i IIIA–C wg AJCC 2009 należy zaoferować adjuwantową terapię interferonem
- pacjentom z guzami w stadium IIA wg AJCC 2009 można zaoferować adjuwantową terapię interferonem w niskich dawkach
- pegylowany interferon wydłuża przeżycie wolne od nawrotu choroby w porównaniu z nieleczonymi pacjentami z grupy kontrolnej w stadium III, ale nie wydłuża przeżycia całkowitego.
- Uzupełnienia poszczególnych substancji czynnych i schematów leczenia:
- interferon-alfa-2a i -2b:
- niskie korzyści i wysokie ryzyko poważnych działań niepożądanych
- skojarzenie inhibitorów BRAF + MEK
- dowody na korzyści ze stosowania dabrafenibu + trametynibu w stadium III choroby i z mutacją BRAF V600: zmniejszenie częstości nawrotów i prawdopodobnie także śmiertelności
- inhibitor PD-1:
- zmniejszenie częstości nawrotów niezależnie od statusu mutacji wykazane dla pembrolizumabu w stadium III i dla niwolumabu w stadiach III i IV
- wyższość niwolumabu nad ipilimumabem.
- interferon-alfa-2a i -2b:
Stopień zaawansowania przerzutów, przedłużanie życia i leczenie paliatywne nieresekcyjnych przerzutów
- W przypadku mutacji BRAF V600 należy zastosować terapię inhibitorem BRAF w skojarzeniu z inhibitorem MEK lub terapię inhibitorem punktu kontrolnego (PD-1 w monoterapii lub terapię skojarzoną PD-1 + przeciwciało CTLA-4).
- Obecnie nie ma danych na temat najlepszej terapii sekwencyjnej inhibitorami BRAF/MEK i inhibitorami punktów kontrolnych.
- Dane dotyczące jakości życia zostały opublikowane na podstawie badań rejestracyjnych III fazy inhibitora BRAF (wemurafenib/dabrafenib) w monoterapii oraz badań inhibitorów BRAF/MEK (dabrafenib + trametynib, wemurafenib + kobimetynib) w skojarzeniu. Wykazały one poprawę jakości życia w przypadku terapii skojarzonych w porównaniu z monoterapią inhibitorami BRAF.
- W porównaniu z terapią cytotoksyczną, przeciwciała PD-1 początkowo wykazują porównywalną jakość życia, która następnie w przebiegu terapii zaczyna odróżniać się na korzyść pacjentów leczonych przeciwciałami PD-1.
- Należy rozważyć immunoterapię inhibitorami punktów kontrolnych. Przeciwciała PD-1 lub ich skojarzenie z ipilimumabem dają lepsze wyniki niż ipilimumab w monoterapii pod względem przeżycia wolnego od progresji. Ponadto, przeciwciała PD-1 w monoterapii są lepsze od ipilimumabu pod względem całkowitego przeżycia.
- W przypadku mutacji c-KIT wrażliwej na inhibitor c-KIT, inhibitor kinazy c-KIT jest opcją terapii celowanej po nieskutecznej immunoterapii inhibitorami punktów kontrolnych.
- Jeśli nie można zastosować lepszych schematów leczenia (inhibitory BRAF/MEK lub przeciwciała PD-1), można zaproponować monochemioterapię dakarbazyną lub polichemioterapię (Ib/C).
- W przypadku polichemioterapii można oczekiwać wyższych wskaźników odpowiedzi niż w przypadku monochemioterapii.
- Jednak mediana całkowitego przeżycia nie wydłuża się.
Monitorowanie działań niepożądanych
- Zarówno terapia celowana inhibitorami BRAF/MEK, jak i inhibitorami immunologicznych punktów kontrolnych, może wpływać na inne narządy, powodując reakcje niepożądane. Interdyscyplinarną współpracę w zakresie leczenia należy podjąć szczególnie w przypadku rzadkich, poważnych działań niepożądanych.
- W przypadku ciężkiego autoimmunologicznego zapalenia jelita grubego wywołanego przez blokery immunologicznych punktów kontrolnych, należy zastosować leczenie immunosupresyjne glikokortykosteroidami i, w razie potrzeby, innymi lekami immunosupresyjnymi, jednocześnie przerywając terapię onkologiczną.
- W przypadku wystąpienia działań niepożądanych ze strony wątroby w trakcie terapii celowanej, należy wstrzymać podawanie środków terapeutycznych do czasu zmniejszenia toksyczności do stopnia 1 według CTCAE.
- W przypadku terapii inhibitorami punktów kontrolnych wywołanej autoimmunologicznym zapaleniem wątroby o wyższym stopniu nasilenia (stopień 2–4 wg CTCAE), należy również rozpocząć leczenie immunosupresyjne glikokortykosteroidami i, w razie potrzeby, innymi lekami immunosupresyjnymi.
- W przypadku zapalenia płuc, w zależności od nasilenia, należy zastosować leczenie immunosupresyjne glikokortykosteroidami i, w razie potrzeby, innymi lekami immunosupresyjnymi, jednocześnie przerywając terapię onkologiczną.
- W zależności od nasilenia, w przypadku endokrynopatii należy zastosować suplementację hormonów. Można dodatkowo prowadzić leczenie objawowe lub immunosupresyjne ze wstrzymaniem (do stopnia 1 wg CTCAE) lub przerwaniem terapii onkologicznej.
- Leczenie skórnych działań niepożądanych powinno być związane z objawami.
- W przypadku wystąpienia objawów okulistycznych, należy przerwać daną terapię, skonsultować się z okulistą i wspólnie ustalić dalsze postępowanie terapeutyczne.
- W przypadku wystąpienia klinicznie istotnych działań niepożądanych ze strony układu sercowo-naczyniowego pod wpływem terapii celowanej, leczenie należy wstrzymać lub przerwać. W przypadku autoimmunologicznych działań niepożądanych wywołanych przez blokery immunologicznych punktów kontrolnych, oprócz leczenia ukierunkowanego na objawy, należy zastosować leczenie immunosupresyjne glikokortykosteroidami oraz przerwać immunoterapię.
- Uzupełnienia poszczególnych substancji czynnych i schematów leczenia:
- inhibitor PD-1
- dowody na wydłużenie przeżycia dzięki niwolumabowi i pembrolizumabowi, zwłaszcza jako terapia pierwszego rzutu
- inhibitory CTLA-4
- Ipilimumab wydaje się charakteryzować mniejszą skutecznością i tolerancją niż inhibitory PD-1
- leczenie skojarzone
- w przypadku braku ekspresji PD-L1, połączenie niwolumabu z ipilimumabem może być skuteczniejsze niż sam niwolumab, ale jest również częściej związane z poważnymi działaniami niepożądanymi
- dłuższy czas przeżycia w przypadku skojarzenia inhibitora BRAF i MEK w porównaniu z samym inhibitorem BRAF
- ograniczenie
- pacjenci z czerniakiem z przerzutami do mózgu lub w złym ogólnym stanie fizycznym, nie mają dostatecznej reprezentacji w odpowiednich badaniach nad immunoterapiami i innymi terapiami ukierunkowanymi molekularnie.
- inhibitor PD-1
Leczenie wspomagające i opieka paliatywna
- Leczenie łagodzące objawy, np.:
- Przywrócenie witalności fizycznej i psychicznej, np. leczenie:
- Ewentualnie przywrócenie zdolności do uczestnictwa w życiu społecznym.
- O ile osoba chora jest jeszcze czynna zawodowo: utrzymanie lub przywrócenie zdolności do pracy (rehabilitacja).
- Nawet w chorobie nieuleczalnej należy zalecać rehabilitację ukierunkowaną na objawy.
- Leczenie u kresu życia.
Zapobieganie
Badania przesiewowe
- Nie udowodniono korzyści z powszechnych badań przesiewowych w kierunku czerniaka.30 Nawet w Australii, gdzie zapadalność na czerniaka jest bardzo wysoka, nie wprowadzono powszechnych badań przesiewowych.
- Pacjenci ze średnimi i dużymi wrodzonymi znamionami melanocytowymi (>20 cm) są narażeni na zwiększone ryzyko rozwoju czerniaka i powinni być regularnie badani.
- Pacjenci ze znamionami dysplastycznymi i wywiadem rodzinnym występowania czerniaka u bliskich krewnych powinni zostać skierowani do gabinetu dermatologicznego w celu regularnego badania dermatoskopowego.
- Pacjentom z wywiadem rodzinnym obciążonym czerniakiem, należy zaoferować poradnictwo genetyczne w celu przeprowadzenia oceny genetycznej i ewentualnie badań genetycznych (patrz sekcja Badania genetyczne).
- Pacjentów ze zwiększonym ryzykiem zachorowania na czerniaka z wykryciem mutacji genetycznych lub bez ich wykrycia, należy skierować do poradni dermatologicznej w celu regularnych kontroli dermatoskopowych. Celem jest wczesne rozpoznanie i leczenie czerniaka, ponieważ uważa się, że poprawia to rokowanie.
- W przypadku pacjentów z grup wysokiego ryzyka, do oceny rozwoju znamion mogą być przydatne wideodermatoskopia i total body photography, umożliwiające wykrycie czerniaka we wcześniejszym stadium.
Wczesne rozpoznanie
- Wczesne rozpoznanie jest najważniejszym czynnikiem powodzenia leczenia.3
- Należy zachęcać wszystkie osoby do zwrócenia się o pomoc medyczną, jeśli zauważą brązową (czarną) zmianę na skórze, która się zmienia lub różni od pozostałych, aby można ją było ocenić dermatoskopowo i w razie potrzeby usunąć.
- Duża liczba znamion:
- łączna liczba ponad 100 znamion na całej skórze znacznie zwiększa ryzyko zachorowania na czerniaka10
- jedno z badań wykazało, że więcej niż 11 znamion na jednym ramieniu lub więcej niż 100 znamion na całym ciele, oznacza ponad 10-krotnie wyższe ryzyko; uważa się, że może to służyć jako prostsze wstępne badanie przesiewowe.10
- Profilaktyczne usuwanie znamion:
- w przypadku podejrzenia czerniaka zmiana barwnikowa powinna być usunięta
- usunięcie wszystkich znamion u pacjentów wysokiego ryzyka nie zmniejsza potrzeby monitorowania, ponieważ większość czerniaków rozwija się na skórze niezmienionej.
- Wrodzone znamiona melanocytarne:
- wrodzone średnie i duże znamiona melanocytarne (>20 cm) powinny być regularnie kontrolowane przez dermatologa przez okres całego życia
- z podejrzanych obszarów znamienia należy pobrać biopsję.
Fotoprotekcja – korzystanie z solarium
- W świetle znanych uszkodzeń skóry powodowanych przez promienie UV i udokumentowanego zwiększonego ryzyka czerniaka u użytkowników solarium, odradza się korzystanie z tego typu opalania.
- Osoby poniżej 18. roku życia nie powinny w żadnym wypadku korzystać z solarium.
- Wyjątkowo niewskazane jest korzystanie z solarium przez pacjentów, których skóra nie brązowieje podczas opalania, z wywiadem oparzeń słonecznych, z dużą ilością piegów, rudymi włosami, dużą liczbą znamion lub dużymi znamionami, a także z wywiadem rodzinnym obciążonym czerniakiem.
Fotoprotekcja – ekspozycja na światło słoneczne
- Zaleca się unikanie ekspozycji na słońce, gdy natężenie promieniowania jest najsilniejsze około południa oraz unikanie krótkich, intensywnych ekspozycji, w ramach których istnieje ryzyko oparzeń słonecznych.
- Zaleca się stosowanie filtrów przeciwsłonecznych, o współczynniku ochrony (SPF) wynoszącym co najmniej 15, w celu zmniejszenia ryzyka oparzeń słonecznych i ograniczenia szkodliwego wpływu promieniowania ultrafioletowego na skórę.
- Zalecenie to ma zastosowanie, gdy inne fizyczne postępowanie nie zapewni odpowiedniej ochrony.
- Przed oparzeniami słonecznymi należy szczególnie chronić dzieci.31-32
- Ochronną, naturalną pigmentację powinno się osiągać stopniowo, nie dopuszczając do poparzeń słonecznych.
- Intensywna ekspozycja na słońce na wcześniej słabo opalonej skórze, na przykład wczesnym latem, najbardziej zwiększa ryzyko czerniaka.
- Filtry przeciwsłoneczne prawdopodobnie chronią przed szkodliwym działaniem promieniowania słonecznego i prawdopodobnie zapobiegają rozwojowi czerniaka. Dowody naukowe są jednak niewystarczające.
- Należy stosować produkty chroniące zarówno przed promieniowaniem UVA, jak i UVB (patrz również informacje dla pacjentów w sekcji Słońce i filtry przeciwsłoneczne).33
- Nawet w przypadku stosowania fotoprotekcji filtrami przeciwsłonecznymi, należy unikać bezpośredniej ekspozycji na słońce.
- Korzystanie z solarium nie jest zalecane u osób poniżej 18. roku życia oraz u wszystkich osób niezależnie od wieku, u których występuje zwiększone ryzyko zachorowania na czerniaka.
- Organy ds. zdrowia w Stanach Zjednoczonych zalecają poradnictwo dla jasnoskórych nastolatków i dorosłych w wieku od 10 do 24 lat w zakresie promieniowania ultrafioletowego w celu zapobiegania nowotworom skóry.34
Przebieg, powikłania i rokowanie
Przebieg
- Obecnie więcej pacjentów z czerniakiem udaje się wyleczyć, a więcej czerniaków jest wykrywanych we wczesnym stadium, niż miało to miejsce w przeszłości.
- Średnia szybkość nacieku w przypadku czerniaka szerzącego się powierzchownie wynosi około 0,12 mm na miesiąc, a czerniaka guzkowego 0,5 mm na miesiąc.35
Przewidywania
- Nowa zmiana melanocytarna u osób w wieku powyżej 40 lat powinna budzić podejrzenie czerniaka.
- Większość czerniaków rozwija się na skórze niezmienionej.
Przerzuty
- Umiejscowienie:
- u około 50% pacjentów, u których występują przerzuty odległe, najpierw występują przerzuty do skóry i tkanki podskórnej i/lub przerzuty do lokalnych węzłów chłonnych
- u około 30% pacjentów dochodzi do przerzutów do płuca
- u pozostałych 20% chorych przerzuty pojawiają się w wątrobie, OUN lub kościach.
- W wielu przypadkach przerzuty odległe występują w kilku narządach jednocześnie.
- Jeśli przerzuty zostaną całkowicie usunięte, rokowanie może poprawić się o prawie 40%; zastosowanie ma tutaj następujący rozkład:
- o 5–41% w przypadku przerzutów do skóry i tkanek miękkich
- o około 20% przy przerzutach do płuca
- o 28–41% w przypadku przerzutów do przewodu pokarmowego
- o 20–29% przy przerzutach do wątroby
- najlepszych wyników można oczekiwać u osób z chorobą oligometastatyczną, u których tempo wzrostu jest niskie.
Rokowanie
- Wczesne rozpoznanie i leczenie mają kluczowe znaczenie dla rokowania.3
- Czerniaki bez przerzutów do węzłów chłonnych i narządów mogą być z powodzeniem leczone chirurgiczne.
- Około 45% pacjentów umiera z powodu tej choroby.
- Elektywna limfadenektomia w przypadku czerniaka kończyn nie poprawia przeżywalności36, ale zwiększa ryzyko powikłań w postaci obrzęku limfatycznego.
- Wznowa po pierwotnym czerniaku.
- Jedno z badań wykazało, że 5-letnie skumulowane ryzyko wznowy wynosi 11,4%. W przypadku dodatniego wywiadu rodzinnego ryzyko wynosiło 19,1%.37
Ocena rokowania
- Rokowanie obejmuje przede wszystkim następujące czynniki3:
- głębokość nacieku zmiany pierwotnej
- przerzuty do regionalnych węzłów chłonnych.
- Dodatkowymi czynnikami prognostycznymi są:
- owrzodzenie38
- indeks mitotyczny
- płeć, wiek i lokalizacja guza.
- Węzły chłonne:
- rokowanie pogarsza się wraz z liczbą zajętych węzłów chłonnych
- wskaźnik 10-letniego przeżycia w przypadku 1 przerzutu wynosi około 50%; w przypadku 2–3 przerzutów wynosi on około 30%
- rokowanie znacznie pogarsza się wraz ze wzrostem pozawęzłowym
- jeśli regionalne węzły chłonne są zajęte makroskopowo, 5-letni wskaźnik przeżycia wynosi 20–50%.
- Płeć:
- rokowanie jest lepsze u paacjentów płci żeńskiej.
- Lokalizacja:
- rokowanie jest najlepsze w przypadku lokalizacji na twarzy, szyi i kończynach, a najgorsze w przypadku lokalizacji na stopie, dłoni i pod paznokciem.
Przeżywalność i śmiertelność
- Dane międzynarodowe:
- według jednego z badań, wskaźnik 5-letniego przeżycia wynosi ponad 95%, jeśli grubość guza jest mniejsza niż 0,8 mm; jeśli grubość guza jest mniejsza niż 1,5 mm, wskaźnik ten wynosi ponad 90%39
- grubość guza według Breslowa: jest mierzona jako odległość między warstwą ziarnistą naskórka a najgłębiej położoną komórką czerniaka
- podczas gdy w latach 60. ubiegłego wieku umierało około 60% pacjentów, według raportów międzynarodowych liczba ta spadła do 11%.40
- według jednego z badań, wskaźnik 5-letniego przeżycia wynosi ponad 95%, jeśli grubość guza jest mniejsza niż 0,8 mm; jeśli grubość guza jest mniejsza niż 1,5 mm, wskaźnik ten wynosi ponad 90%39
- Mediana przeżycia dla wszystkich pacjentów z odległymi przerzutami czerniaka wynosi 6–9 miesięcy.
Dalsze postępowanie
- Czas pomiędzy kontrolami lekarskimi zależy od stadium guza i jest ustalany oraz przeprowadzany interdyscyplinarnie – onkologicznie, dermatologicznie, radiologicznie.
Korzyści z badania kontrolnego
- Rozpoznanie wznów miejscowych i regionalnych, o ile są one nadal operacyjne.
- Rozpoznanie nowych czerniaków (2–8%).
- Informacje na temat regularnego samobadania i zasad fotoprotekcji.
- Dzięki badaniom kontrolnym wykrywa się około 50% więcej wznów niż w przypadku braku obserwacji.
- Wsparcie psychospołeczne dla pacjentów.
Co jest przedmiotem badania kontrolnego?
- Co rok: Wywiad lekarski: utrata masy ciała, ból, inne nowe objawy, w szczególności niepokojące obszary skóry.41
- Badanie przedmiotowe: obserwacja i badanie palpacyjne blizn pooperacyjnych, badanie palpacyjne wszystkich węzłów chłonnych, obserwacja powierzchni skóry.
- Co rok: Badanie dermatoskopowe całej skóry41
- u pacjentów z zespołem zmian atypowych lub dużą liczbą znamion: co 3-6 miesięcy
- Badania dodatkowe w zależności od stadium zaawansowania:
- badanie ultrasonograficzne jamy brzusznej i, w razie potrzeby, węzłów chłonnych
- TK jamy brzusznej i płuc
- oznaczanie markera nowotworowego S-100B.
- W kontekście tych badań należy jednak ocenić korzyści, jakie może odnieść pacjent po wykryciu rozprzestrzenienia się choroby.
Informacje dla pacjentów
Edukacja pacjenta
- Samobadanie blizny i regionalnych węzłów chłonnych.41
- Rehabilitacja:
- w celu profilaktyki i leczenia obrzęków limfatycznych u pacjentów po limfadenektomii
- mobilizacja blizny pooperacyjnej
- usprawnianie po zabiegach okaleczających, np. amputacji palca.
Materiały edukacyjne dla pacjentów
- Czerniak
- Znamiona skórne
- Cytostatyki (chemioterapia przeciwnowotworowa)
- Przygotowanie do radioterapii
- Ból i terapia bólu
- Słońce i filtry przeciwsłoneczne
- Jedzenie przy utracie apetytu
Leczenie łagodzące przy zaawansowanym nowotworze złośliwym
- Opieka paliatywna
- Leczenie lęku
- Nudności i wymioty
- Zaparcia
- Suchość błony śluzowej jamy ustnej
- Trudności z oddychaniem
- Utrata masy ciała w chorobie nowotworowej
- Depresja
- Majaczenie
Ilustracje

Kryteria ABCDE i kryterium „brzydkiego kaczątka” są pomocne w rozpoznaniu czerniaka
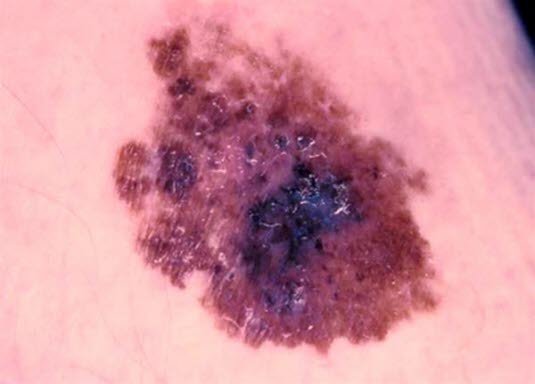
Najczęstszy podtyp histopatologiczny czerniaka szerzącego się powierzchownie: lekko uniesiony, nieregularnie odgraniczony i wielobarwny guz skóry

Inwazyjny czerniak lentiginalny stanowi 5% wszystkich czerniaków; rozwija się głównie na mocno uszkodzonej przez słońce skórze, szczególnie u starszych pacjentów; zwykle zlokalizowane są na twarzy lub szyi

Wariant guzkowy stanowi 10–15% wszystkich czerniaków; może rozwinąć się we wcześniej istniejącym znamieniu, ale częściej rozwija się na skórze niezmienionej; zazwyczaj są to niebiesko-czarne guzki, ewentualnie z czerwonymi lub niebiesko-białymi fragmentami
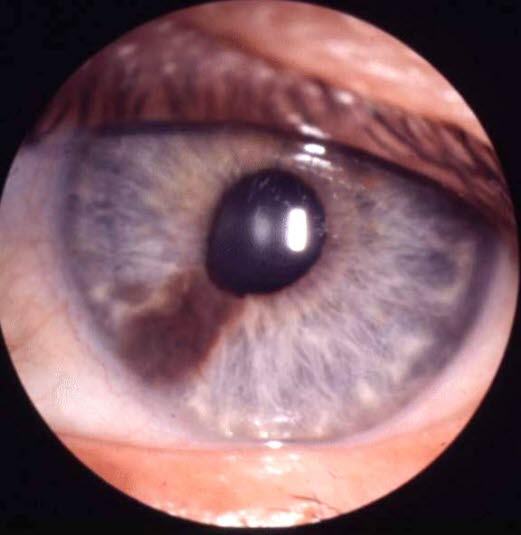
Czerniak tęczówki
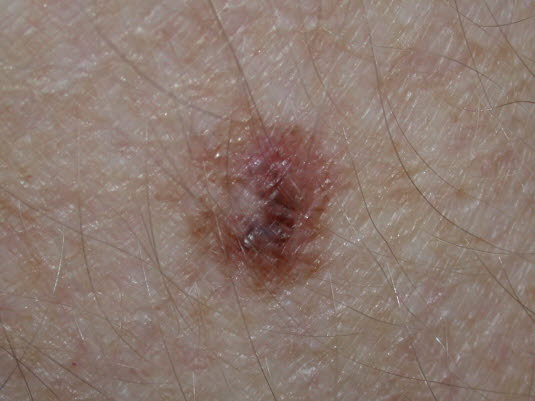
Czerniak in situ

Czerniaki odsiebnych części kończyn występują na dłoniach, podeszwach stóp, pod paznokciami
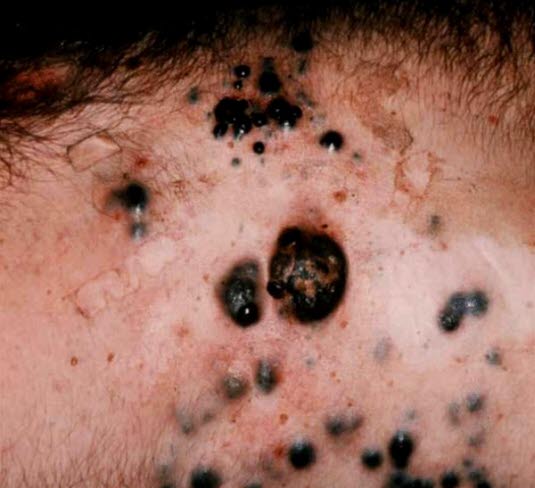
Przerzutowy czerniak do skóry

Obraz dermatoskopowy (A) oraz obraz makroskopowy (B); należy zwrócić szczególną uwagę na różne kolory, hiperpigmentowane plamy, atypowe czarne kropki, niebiesko-biały welon
Źródła
Wytyczne
- Rutkowski P. Wysocki PJ, Kozak K., et al. Expert recommendations on diagnostic-therapeutic management of melanoma patients. Oncol Clin Pract. 2022;18. DOI
- Zalecenia Sekcji standaryzacji nadzoru po leczeniu onkologicznym Polskiego Towarzystwa Onkologicznego w zakresie badań kontrolnych po zakończonym leczeniu u pacjentów z czerniakiem skóry. Polskie Towarzystwo Onkologiczne, 2024. pto.med.pl
Piśmiennictwo
- Tsao H, Atkins MB, Sober AJ. Management of cutaneous melanoma. N Engl J Med. 2004; 351: 998-1012. PubMed
- Carvajal RD, Spencer SA, Lydiatt W. Mucosal melanoma: a clinically and biologically unique disease entity. J Natl Compr Canc Netw. 2012; 10(3): 345-56. PMID: 22393195 PubMed
- Thompson JF, Scolyer RA, Kefford RF. Cutaneous melanoma. Lancet. 2005; 365: 687-701. PubMed
- LeBoit PE, Burg G, Weedon D, Pathology and Genetics of Skin Tumours. 2005: World Health Organization. 356.
- Wojciechowska U, Barańska K, Miklewska M, Didkowska JA. Cancer incidence and mortality in Poland in 2020. Nowotwory. J Oncol. 2023; 73: 129-45. journals.viamedica.pl
- Welch HG, Woloshin S, Schwartz LM. Skin biopsy rates and incidence of melanoma: population based ecological study. BMJ. 2005; 33: 481-4. British Medical Journal
- Dziankowska-Zaborszczyk E, Maniecka-Bryła I, Pikala M. Mortality Trends Due to Skin Melanoma in Poland in the Years 2000-2020. Int J Environ Res Public Health. 2022 Dec 2; 19(23): 16118 pubmed.ncbi.nlm.nih.gov
- Sladden MJ, Balch C, Barzilai DA, et al. Surgical excision margins for primary cutaneous melanoma. Cochrane Database Syst Rev. 2009; Issue 4: CD004835. Cochrane (DOI)
- Pampena R, Kyrgidis A, Lallas A, et al. A meta-analysis of nevus-associated melanoma: Prevalence and practical implications. J Am Acad Dermatol. 2017 Nov; 77(5): 938-45.e4. pmid:28864306 PubMed
- Ribero S, Zugna D, Osella-Abate S, et al. Prediction of high naevus count in a healthy UK population to estimate melanoma risk. Br J Dermatol. 2015. doi:10.1111/bjd.14216 DOI
- Gandini S, Sera F, Cattaruzza MS, et al. Metaanalysis of risk factors for cutaneous melanoma: I. Common and atypical naevi. Eur J Cancer. 2005; 41: 28-44. PubMed
- Wu S, Han J, Laden F, Qureshi AA. Long-term ultraviolet flux, other potential risk factors, and skin cancer risk: A cohort study. Cancer Epidemiol Biomarkers Prev. 2014; 23: 1080. doi:10.1158/1055-9965.EPI-13-0821 DOI
- Bliss JM, Ford D, Swerdlow AJ, et al. Risk of cutaneous melanoma associated with pigmentation characteristics and freckling: systematic overview of 10 case-control studies. Int J Cancer. 1995; 62: 367-76. PubMed
- Marghoob AA, Schoenbach SP, Kopf AW et al. Large congenital melanocytic nevi and the risk for the development of malignant melanoma. A prospective study. Arch Dermatol. 1996; 132: 170-5. PubMed
- Krengel S, Hauschild A, Schafer T. Melanoma risk in congenital melanocytic naevi: a systematic review. Br J Dermatol. 2006; 155: 1-8. PubMed
- Goggins WB, Tsao H. A population-based analysis of risk factors for a second primary cutaneous melanoma among melanoma survivors. Cancer. 2003; 97: 639-43. PubMed
- Kefford RF, Mann GJ. Is there a role for genetic testing in patients with melanoma? Curr Opin Oncol. 2003; 15: 157-61. PubMed
- The association of use of sunbeds with cutaneous malignant melanoma and other skin cancers: A systematic review. Int J Cancer. 2007; 120(5): 1116-22. PubMed
- Rivers JK. Is there more than one road to melanoma?. Lancet. 2004; 363: 728-30. PubMed
- Veierod MB, Weiderpass E, Thorn M, et al. A prospective study of pigmentation, sun exposure, and risk of cutaneous malignant melanoma in women. J Natl Cancer Inst. 2003; 95: 1530-8. PubMed
- Rutkowski P. Wysocki PJ, Kozak K., et al. Expert recommendations on diagnostic-therapeutic management of melanoma patients. Oncol Clin Pract. 2022;18. DOI: 10.5603/2021.0042 DOI
- American Academy of Dermatology Ad Hoc Task Force for the ABCDEs of Melanoma. Early detection of melanoma: reviewing the ABCDEs. J Am Acad Dermatol. 2015; 72(4): 717-23. doi: 10.1016/j.jaad.2015.01.025 DOI
- Chamberlain AJ, Fritschi L, Kelly JW. Nodular melanoma: patients' perceptions of presenting features and implications for earlier detection. J Am Acad Dermatol. 2003; 48: 694-701. PubMed
- Westerhoff K, McCarthy WH, Menzies SW. Increase in the sensitivity for melanoma diagnosis by primary care physicians using skin surface microscopy. Br J Dermatol. 2000; 143: 1016-20. PubMed
- Kittler H, Pehamberger H, Wolff K, Binder M. Diagnostic accuracy of dermoscopy. Lancet Oncol. 2002; 3: 159-65. PubMed
- Crotty KA, Menzies SW. Dermoscopy and its role in diagnosing melanocytic lesions: a guide for pathologists. Pathology. 2004; 36: 470-7. PubMed
- Balch CM, Soong SJ, Gershenwald JE, et al. Prognostic factors analysis of 17,600 melanoma patients: validation of the American Joint Committee on Cancer melanoma staging system. J Clin Oncol. 2001; 19: 3622-34. PubMed
- Margolin K, Douglas JG. Treatment of brain metastases from malignant melanoma. Semin Oncol. 2002 Oct; 29(5): 518-24. www.ncbi.nlm.nih.gov
- Ministerstwo Zdrowia. Ministerstwo Zdrowia. Obwieszczenie Ministra Zdrowia - lista leków refundowanych. www.gov.pl
- Edman RL, Klaus SN. Is routine screening for melanoma a benign practice?. JAMA 2000; 284: 883-6. PubMed
- Saraiya M, Glanz K, Briss PA, et al. Interventions to prevent skin cancer by reducing exposure to ultraviolet radiation: a systematic review. Am J Prev Med. 2004; 27: 422-66. PubMed
- Harris RB, Alberts DS. Strategies for skin cancer prevention. Int J Dermatol. 2004; 43: 243-51. PubMed
- Dennis LK, Beane Freeman LE, VanBeek MJ. Sunscreen use and the risk for melanoma: a quantitative review. Ann Intern Med. 2003; 139: 966-78. www.ncbi.nlm.nih.gov
- Moyer VA, LeFevre ML, Siu AL, et al. Behavioral counseling to prevent skin cancer: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2012; 157. www.ncbi.nlm.nih.gov
- Liu W, Dowling JP, Murray WK, et al. Rate of growth in melanomas: characteristics and associations of rapidly growing melanomas. Arch Dermatol. 2006; 142(12): 1551-8. pubmed.ncbi.nlm.nih.gov
- Cascinelli N, Morabito A, Santinami M, et al. Immediate or delayed dissection of regional nodes in patients with melanoma of the trunk: a randomised trial. WHO Melanoma Programme. Lancet. 1998; 351: 793-6. PubMed
- Ferrone CR, Ben Porat L, Panageas KS, et al. Clinicopathological features of and risk factors for multiple primary melanomas. JAMA. 2005; 294: 1647-54. www.ncbi.nlm.nih.gov
- Masback A, Olsson H, Westerdahl J et al. Prognostic factors in invasive cutaneous malignant melanoma: a population-based study and review. Melanoma Res. 2001; 11: 435-45. PubMed
- Schuchter L et al. A prognostic model for predicting 10-year survival in patients with primary melanoma. The Pigmented Lesion Group. Ann Intern Med. 1996; 125: 369. PMID: 8702087 PubMed
- Beddingfield FC 3rd. The melanoma epidemic: res ipsa loquitur. Oncologist. 2003; 8: 459-65. PubMed
- Zalecenia Sekcji standaryzacji nadzoru po leczeniu onkologicznym Polskiego Towarzystwa Onkologicznego w zakresie badań kontrolnych po zakończonym leczeniu u pacjentów z czerniakiem skóry. Polskie Towarzystwo Onkologiczne, 2024. www.pto.med.pl
Opracowanie
- Lek. Joanna Dąbrowska-Juszczak, (redaktor)
- Dr n. med. Paweł Falkowski, (recenzent)
- Prof. dr n. med. Sławomir Chlabicz, (redaktor)
- Lek. Thomas M. Heim, (recenzent)
- Dr n. med. Günther Egidi, (recenzent)
- Dr n. med. Dirk Nonhoff, (recenzent/redaktor)
