Streszczenie
- Definicja:Ogólnoustrojowa choroba szkieletu, która z powodu niskiej masy kości i ich zmienionej mikrostruktury powoduje wyższe ryzyko złamań.
- Epidemiologia:Zależna od wieku i płci, u kobiet po okresie menopauzy około 30%, częstość występowania wzrasta z wiekiem.
- Objawy:Przez dłuższy czas brak objawów, konieczność hospitalizacji z powodu złamań i ich skutków (bóle, pogorszenie funkcjonowania, unieruchomienie).
- Badanie fizykalne:Obniżenie wzrostu, skrócenie odległości żeber od miednicy, kifoza, ograniczenie ruchu i mobilności.
- Diagnostyka:Dwuetapowa: I etap – określenie ryzyka złamań i wysunięcie podejrzenia osteoporozy (pomiar długości ciała, siły mięśniowej, określenie ryzyka upadków, wykonanie podstawowych testów czynnościowych i ocena ryzyka złamań z wykorzystaniem FRAX). II etap – szczegółowa diagnostyka (DXA, wskaźniki biochemiczne, metaboliczne).
- Leczenie:U wszystkich pacjentów optymalna podaż wapnia i witaminy D. Wybór farmakoterapii w zależności od stopnia ryzyka złamań, płci i wieku. Istotne leczenie uzupełniające (zapobieganie upadkom, rehabilitacja, ograniczenie lub wyeliminowanie modyfikowalnych czynników ryzyka złamań, korekta diety).
Informacje ogólne
Definicja
- Osteoporoza to ogólnoustrojowa choroba kośćca charakteryzująca się:
- niską masą kości
- pogorszeniem jakości mikrostruktury tkanki kostnej.
- Jej skutkiem jest większa kruchość kości oraz podatność na złamania.
- W przypadku już obecnych złamań występuje jawna osteoporoza.
- Gęstość mineralną kości (bone mineral density – BMD) mierzy się w zakresie bliższego końca kości udowej (BKKU) lub alternatywnie w zakresie kręgów lędźwiowych, wykonując badanie DXA (dual–energy X–ray absorptiometry, densytometria).
- Wynik prezentowany jest w formie odchyleń standardowych (SD). Typowy wydruk wyniku zawiera obraz badanej okolicy oraz wyniki pomiaru:
- gęstość powierzchniową w g/cm2
- wskaźnik T (T–score; odchylenie od szczytowej masy kostnej u zdrowych osób osiąganej w wieku 20–29 lat; prawidłowo od +1,0 do –1,0)
- wskaźnik Z (Z–score; odchylenie od normy dla danego wieku i płci; prawidłowo >–2).
- Wynik prezentowany jest w formie odchyleń standardowych (SD). Typowy wydruk wyniku zawiera obraz badanej okolicy oraz wyniki pomiaru:
- Definicja osteoporozy według WHO1-2:
- dla kobiet po menopauzie i mężczyzn >50. roku życia T–score ≤–2,5 SD w zakresie szyjki kości udowej lub w lokalizacji alternatywnej – kręgi lędźwiowe lub
- wystąpienie złamania niskoenergetycznego u kobiet po menopauzie i u mężczyzn >50. roku życia w lokalizacjach głównych i T–score <–1,0 lub
- u osób obu płci z czynnikami ryzyka w młodszych grupach wiekowych na podstawie innych kryteriów, w tym wskaźnika Z (Z–score <–2), interpretowanego jako BMD poniżej wielkości oczekiwanej dla płci i wieku.
- Oparta na wyniku T–Score definicja obowiązuje dopiero po wykluczeniu innych chorób powodujących demineralizację kości (osteoporoza wtórna).
- Choć diagnoza osteoporozy opiera się w dużej mierze na niskiej gęstości kości, która stanowi jej zasadniczy objaw, podstawę oceny klinicznej, a zwłaszcza decyzji dotyczących rozpoczęcia leczenia, stanowi analiza indywidualnego profilu ryzyka (np. kalkulator FRAX, Q–Fracture i Garvan, które określają ryzyko złamań w ciągu 10 lat).
Epidemiologia
- WHO zalicza osteoporozę, na którą choruje około 200 milionów osób, do 10 najważniejszych chorób cywilizacyjnych.
- Częstość występowania: zależna od wieku i płci, zwłaszcza u kobiet po okresie menopauzy
- Statystyki dotyczące leczenia3
- Dostępne raporty wskazują, że odsetek osób otrzymujących adekwatne leczenie farmakologiczne w Polsce jest bardzo mały i wynosi 6% wszystkich chorych według raportu NFZ i 17% kobiet kwalifikujących się do leczenia według danych IOF.
- W Europie luka terapeutyczna wynosi 71% (kobiety, które kwalifikują się do leczenia osteoporozy, a nie są leczone), w Polsce 83%.
- Częstość złamań z powodu osteoporozy
- Rocznie w Polsce odnotowuje się 126 000 – 206 000 złamań niskoenergetycznych, a śmiertelność w pierwszym roku po złamaniu BKKU jest bardzo duża i sięga 30%.
- W UE szacunkowa liczba złamań i odsetek osób w wieku >50. roku życia w 2019 roku:
- z przebytym złamaniem szyjki kości udowej: 1,5%
- z przebytym złamaniem w obrębie kręgosłupa: 1,7%.
Etiologia i patogeneza
- Najwyższa masa kości występuje u kobiet i mężczyzn w wieku 20–30 lat.
- Początek zależnej od wieku resorpcji kości w 4.–5. dekadzie życia.
- Wzmożona resorpcja kości przez osteoklasty przy jednoczesnym ograniczeniu procesu kościotworzenia przez osteoblasty.
-
-
- U kobiet jest to związane przede wszystkim z obniżeniem poziomu estrogenów ze względu na wystąpienie menopauzy.
- W przypadku mężczyzn ważną rolę w metabolizmie kości odgrywa testosteron; mają oni wolniejszy ubytek masy kostnej z uwagi na wolniejszy spadek poziomu hormonów płciowych w stosunku do kobiet.
-
- Choroba wieloczynnikowa; zmienna wytrzymałość kości (na którą wpływa ich rozmiar, gęstość i mikrostruktura) jest w dużej mierze uwarunkowana genetycznie.
- Osteoporoza to niewydolność mechanicznych funkcji kości, której towarzyszy wyższe ryzyko złamań z powodu kruchości (u osób starszych) oraz drobnych urazów.
Osteoporoza pierwotna
- Do czynników sprzyjających rozwojowi tej choroby należą wiek i płeć. Należy jednak wykluczyć inne przyczyny zaburzenia mineralizacji, choć trzeba pamiętać, że różnice pomiędzy obiema postaciami osteoporozy są nieostre.
- Osteoporoza pomenopauzalna (typu 1)
- Najczęstsza postać choroby – związana ze spadkiem poziomu estrogenów.
- Osteoporoza starcza (typu 2)
- Występująca po 70. roku życia – spowodowana wiekiem utrata gęstości kości w równym stopniu u kobiet i mężczyzn.
Osteoporoza wtórna
- W przypadku osteoporozy wtórnej dominujący patomechanizm stanowią następujące czynniki:
- Leki:
- przede wszystkim glikokortykosteroidy.
- Choroby podstawowe:
- endokrynologiczne
- ogólnoustrojowe o podłożu zapalnym
- nowotworowe
- nerek
- zespół zaburzeń wchłaniania.
- Leki:
Czynniki ryzyka w przypadku złamań spowodowanych osteoporozą
Ogólne czynniki ryzyka
- Wiek: zaawansowany wiek to istotny czynnik ryzyka.
- Płeć: wyższe ryzyko u kobiet niż u mężczyzn.
- Złamania trzonu kręgu: rosnące ryzyko złamań incydentalnych, z wysoką liczbą przypadków złamań trzonu kręgu.
- Złamania pozakręgowe po 50. roku życia.
- Złamanie bliższego odcinka kości udowej u ojca lub matki.
- Kilka samoistnych upadków.
- Brak mobilności.
- Ograniczona siła chwytu dłoni.
- Palenie tytoniu.
- Niedowaga, spadek masy ciała, jadłowstręt psychiczny (anorexia nervosa).
- Niedobór witaminy D i wapnia.
- Podwyższony poziom homocysteiny, niedobór kwasu foliowego/witaminy B.
- Hiponatremia.
- Zwiększona podaż kadmu (np. wskutek palenia papierosów, spożywania zanieczyszczonych owoców morza).
- Alkohol.
Choroby podstawowe
- Choroby endokrynologiczne
- cukrzyca typu 1 i typu 2, zespół Cushinga i subkliniczna hiperkortyzolemia, pierwotna nadczynność przytarczyc, niedobór hormonu wzrostu w przypadku niedoczynności przysadki, męski hipogonadyzm, subkliniczna i jawna nadczynność tarczycy.
- Choroby reumatologiczne
- Choroby gastroenterologiczne
- celiakia i przewlekłe zapalne choroby jelit, resekcja żołądka B-II lub gastrektomia.
- Choroby neurologiczne
- padaczka i leki przeciwpadaczkowe, schizofrenia, udar mózgu, choroba Alzheimera, choroba Parkinsona, zwiększone ryzyko upadku.
- Inne choroby
- niewydolność serca, POChP, gammapatia monoklonalna o niezdefiniowanym znaczeniu (MGUS), alkoholowa choroba wątroby.
Leki wpływające na metabolizm kostny
- Glikokortykosteroidy: zależnie od dawki i czasu stosowania.
- Ablacja narządu wytwarzającego hormony, męski hipogonadyzm spowodowany innymi przyczynami.
- Inhibitor aromatazy.
- Leczenie tiazolidynedionami (glitazonami).
- Leki przeciwdepresyjne (SSRI, SNRI).
- Leki przeciwpadaczkowe (z wyjątkiem beznodiazepin i pregabaliny).
- Heparyna (zwłaszcza niefrakcjonowana i drobnocząsteczkowa).
- Antagoniści witaminy K (warfaryna).
- Leki immunosupresyjne (cyklosporyna A, takrolimus, metotreksat).
- Analogi GnRH.
- Opioidy.
- Inhibitory pompy protonowej w przypadku dłuższego stosowania.
- Diuretyki pętlowe.
- Hormony tarczycy w dużych dawkach (jatrogenna nadczynność tarczycy).
ICD–10
- M80 Osteoporoza ze złamaniami patologicznymi.
- M80.0 Osteoporoza pomenopauzalna ze złamaniem patologicznym.
- M80.1 Osteoporoza po zabiegu usunięcia jajników ze złamaniem patologicznym.
- M80.2 Osteoporoza w następstwie unieruchomienia ze złamaniem patologicznym.
- M80.3 Osteoporoza w następstwie pooperacyjnego zespołu upośledzonego wchłaniania ze złamaniem patologicznym.
- M80.4 Osteoporoza polekowa ze złamaniem patologicznym.
- M80.5 Osteoporoza idiopatyczna ze złamaniem patologicznym.
- M80.8 Inne postacie osteoporozy ze złamaniem patologicznym.
- M80.9 Nieokreślona osteoporoza ze złamaniem patologicznym.
- M81 Osteoporoza bez złamań patologicznych.
- M81.0 Osteoporoza pomenopauzalna.
- M81.1 Osteoporoza po zabiegu usunięcia jajników.
- M81.2 Osteoporoza w następstwie unieruchomienia.
- M81.3 Osteoporoza w następstwie pooperacyjnego zespołu upośledzonego wchłaniania.
- M81.4 Osteoporoza polekowa.
- M81.5 Osteoporoza idiopatyczna.
- M81.8 Inne postacie osteoporozy.
- M81.9 Osteoporoza, nieokreślona.
- M82 Osteoporoza w przebiegu chorób sklasyfikowanych gdzie indziej.
- M82.0 Osteoporoza w przebiegu szpiczaka mnogiego.
- M82.1 Osteoporoza w przebiegu chorób endokrynologicznych.
- M82.2 Osteoporoza w przebiegu chorób sklasyfikowanych gdzie indziej.
- M83 Osteomalacja dorosłych.
- M83.0 Osteomalacja połogowa.
- M83.1 Osteomalacja starcza.
- M83.2 Osteomalacja dorosłych w następstwie upośledzonego wchłaniania.
- M83.4 Choroba kości na skutek przewlekłego stosowania soli glinu.
- M83.5 Inna polekowa osteomalacja dorosłych.
- M83 Inna osteomalacja dorosłych.
- M83.9 Osteomalacja dorosłych, nieokreślona.
Diagnostyka4
- U pacjentów z podejrzeniem zwiększonego ryzyka złamań należy przeprowadzić badania przesiewowe i zakwalifikować do jednej z grup w zależności od stopnia ryzyka:
- bardzo wysoki
- wysoki
- średni
- niski.
Diagnostyka w gabinecie lekarza rodzinnego
- Ocena stopnia ryzyka złamań na podstawie:
- wywiadu
- wyników badania przedmiotowego (wzrost, siła mięśniowa)
- oceny ryzyka upadków
- wyników testów czynnościowych
- wyników oceny ryzyka złamań z zatosowaniem jednego z kalkulatorów (np. FRAX® – Fracture Risk Assessment Tool)5
- Uwaga: na etapie oceny w gabinecie lekarza rodzinnego nie ma konieczności ujęcia pomiaru gęstości mineralnej kości (BMD) w kalkulatorze FRAX.
Stany sugerujące występowanie osteoporozy
Złamania
- Niskoenergetyczne
- Występujące pomimo niewspółmiernie małej siły wywołującej, na przykład przy upadku z niskiej wysokości (np. własnego ciała) lub złamania samoistne.
- Najczęściej występuje w:
- bliższym końcu kości udowej
- trzonach kręgów
- bliższym końcu kości ramiennej
- kościach miednicy
- dalszym końcu kości promieniowej.
Choroby endokrynologiczne
- Zespół Cushinga i subkliniczna hiperkortyzolemia.
- Pierwotna nadczynność przytarczyc.
- Niedobór hormonu wzrostu przy niedoczynności przysadki.
- Męski hipogonadyzm.
- Subkliniczna i jawna nadczynność tarczycy.
- Cukrzyca typu 1.
- Cukrzyca typu 2.
- Jatrogenna nadczynność tarczycy, o ile ma charakter trwały.
Choroby reumatologiczne
- Reumatoidalne zapalenie stawów.
- Zesztywniające zapalenie stawów kręgosłupa.
- Toczeń rumieniowaty układowy.
Choroby gastroenterologiczne
- Celiakia.
- Resekcja żołądka B–II lub gastrektomia.
Zaburzenia neurologiczne i psychiatryczne
- Padaczka i stosowanie leków przeciwpadaczkowych.
- Schizofrenia.
- Udar mózgu.
- Choroba Alzheimera.
- Choroba Parkinsona.
- Depresja.
Inne choroby i stany
- Niewydolność serca.
- Gammapatia monoklonalna o niezdefiniowanym znaczeniu.
- Nadużywanie alkoholu i alkoholowa choroba wątroby.
- Jadłowstręt psychiczny (anorexia nervosa).
- Palenie tytoniu.
- Przewlekła obturacyjna choroba płuc (POChP).
Ryzyko złamań wskutek farmakoterapii
- Ablacja narządu wytwarzającego hormony, męski hipogonadyzm spowodowany innymi przyczynami.
- Stosowanie inhibitorów aromatazy.
- Obecne lub planowane leczenie glikokortykosteroidami ≥7,5 mg/dziennie ekwiwalentu prednizolonu, przez ponad 3 miesiące.
- Glikokortykosteroidy wziewne w wysokich dawkach.
- Leczenie tiazolidynedionami (glitazonami).
- Leki zwiększające ryzyko upadku.
- Leki przeciwdepresyjne.
- Leki przeciwpadaczkowe.
- Opioidy.
- Inhibitory pompy protonowej w przypadku przewlekłego stosowania.
Ogólne czynniki ryzyka
- Złamanie bliższego odcinka kości udowej u ojca lub matki.
- Kilka samoistnych upadków lub ich wysokie ryzyko.
- Brak mobilności.
Wywiad
- Stan po złamaniu niskoenergetycznym (lokalizacje główne).
- Bóle (lokalizacja, nasilenie, czas trwania).
- Upośledzenie czynnościowe.
- Upadki.
- Czynniki ryzyka złamań (patrz wyżej).
- Aktywność fizyczna lub unieruchomienie.
- Ekspozycja na promienie słoneczne.
- Dieta.
- Palenie tytoniu.
- Spożywanie alkoholu.
- Choroby podstawowe.
- Leki.
Badanie fizykalne
- Wzrost
- zmniejszenie wzrostu ≥3 cm.
- Masa ciała, BMI
- niedowaga.
- Kręgosłup
- kifoza, efekt „choinki”
- ból palpacyjny, wyrostki kolczyste
- odległość między żebrami i miednicą <2 cm.
- Ocena siły mięśniowej.
Ocena mobilności, koordynacji i ryzyka upadku
- W celu dokonania oceny zaleca się przeprowadzenie testu Tandem Stand oraz testu „Wstań i idź” (Timed up & go lub Chair Rising).
Test „Wstań i idź” (ocena mobilności)
- Wyposażenie: krzesło (z podłokietnikiem), oznaczenie trasy (podłoga) 3 m, stoper.
- Procedura
- Badana osoba siada prosto na krześle z podłokietnikiem.
- Polecenie: „Proszę wstać z krzesła, przejść do tego oznaczenia (3 m), obrócić się, wrócić do krzesła i ponownie usiąść. Będę mierzyć czas” (można korzystać ze sprzętu ułatwiającego poruszanie się).
- Ocena
- ≤10 s: nie stwierdza się zaburzeń mobilności.
- 11–29 s: interpretacja możliwa tylko w powiązaniu z innymi parametrami.
- ≥30 s: należy stwierdzić zaburzenia mobilności oraz zwiększone ryzyko upadku.
Chair Rising Test (ocena siły kończyn dolnych)
- Wyposażenie: krzesło (bez podłokietnika) oraz stoper.
- Procedura
- Osoba badana siedzi prosto na krześle bez podłokietnika.
- Polecenie: „Proszę jak najszybciej 5 razy wstać, prostując całkowicie nogi, bez podpierania się ramionami. Będę mierzyć czas, który będzie na to potrzebny” (jeśli jest to potrzebne ze względów bezpieczeństwa: „Proszę skrzyżować ramiona na piersiach”).
- Ocena
- ≤10 s: nie stwierdza się związanej z siłą niepewności chodu.
- ≥11 s: należy zakładać niepewność chodu (głównie osłabienie mięśni).
Tandem Stand Test (ocena równowagi)
- Wyposażenie
- Linia prosta (na podłodze) 0,5 m oraz stoper.
- Procedura
- Osoba badana stoi wyprostowana.
- Polecenie: „Proszę umieścić stopy dokładnie jedna za drugą na linii, kładąc piętę przedniej stopy dokładnie przed palcem tylnej. Jeżeli czuje się Pan/Pani przy tym niepewnie, proszę stabilnie oprzeć bok ciała, na przykład o ścianę lub o stół. Będę mierzyć czas, jaki wytrzyma Pan/Pani w tej pozycji”.
- Ocena
- ≥10 s: nie stwierdza się zaburzeń równowagi.
- <10 s: należy stwierdzić zaburzenie równowagi i zwiększone ryzyko upadku.
Badania uzupełniające w praktyce lekarza rodzinnego
Badania laboratoryjne
- Badania laboratoryjne pozwalają:
- wykryć laboratoryjne czynniki ryzyka oraz czynniki wpływające na rozwój osteoporozy wtórnej, a także, w przypadku diagnostyki różnicowej, inne rodzaje osteopatii
- określić przeciwwskazania do farmakoterapii.
- Podstawowe badania oraz powiązane kwestie:
- Wapń
- ↑ pierwotna nadczynność przytarczyc lub inne przyczyny hiperkalcemii
- ↓ np. wtórna nadczynność przytarczyc, zaburzenia wchłaniania
- hipokalcemia jako przeciwwskazanie do przyjmowania wielu leków na osteoporozę.
- ALP
- ↑ np. osteomalacja
- ↓ potencjalna wskazówka dotycząca występowania hipofosfatazji.
- GGTP
- w diagnostyce różnicowej wzrostu fosfatazy zasadowej związanego z chorobami wątroby
- celiakia lub nadużywanie alkoholu (ryzyko upadku).
- eGFR
- ↓ osteopatia nerkowa
- niewydolność nerek wyższego stopnia jako przeciwwskazanie do przyjmowania różnych leków.
- OB/CRP
- ↑ choroby reumatyczne o podłożu zapalnym, nowotwory złośliwe w zaawansowanym stadium.
- Morfologia
- wskazanie dotyczące chorób o podłożu zapalnym lub nowotworów złośliwych lub celiakii.
- Sód
- ↓ podwyższone ryzyko złamań kręgowych i pozakręgowych.
- TSH
- <0,3 mU/l endogenne lub spowodowane przyjmowaniem L–tyroksyny jako czynnik ryzyka złamań.
- Wapń
Badanie rentgenowskie
- Wykrywanie złamań (uwaga: rutynowe badanie rentgenowskie często nie pozwala jednoznacznie wykryć świeżych pęknięć trzonu kręgu).
Diagnostyka specjalistyczna
Według polskich rekomendacji4 etapy diagnostyki specjalistycznej obejmują:
- Diagnostykę różnicową (osteoporoza wtórna, inne choroby kości).
- Wykonanie badania densytometrycznego (dual energy X–ray absorptiometry – DXA).
- Szczegółowe ustalenie wszystkich czynników ryzyka złamań i precyzyjne określenie ryzyka złamań w ciągu kolejnych 10 lat (kalkulator FRAX z ujęciem BMD).
- Ocena bilansu wapniowego.
- Ocena aktywności markerów obrotu kostnego.
- Rozszerzone badania laboratoryjne:
- Fosforany
- ↑ niewydolność nerek stadium IV, wtórna nerkowa nadczynność przytarczyc
- ↓ zaburzenia wchłaniania.
- 25(OH)D3 (25–hydroksy–witamina D3)
- podejrzenie niedoboru witaminy D.
- Testosteron u mężczyzn
- podejrzenie niedoboru testosteronu.
- Wydalanie wapnia w dobowej zbiórce moczu
- w przypadku podejrzenia idiopatycznej hiperkalciurii.
- Określenie stężenia kadmu w moczu
- podejrzenie zwiększonej ekspozycji na kadm.
- Elektroforeza białek surowicy = proteinogram (z immunofiksacją w razie potrzeby)
- wskazana w przypadku budzących podejrzenia parametrów stanu zapalnego lub morfologii.
- Fosforany
Densytometria kostna (DXA)
- Złoty standard pomiaru gęstości kostnej (BMD):
- bardzo niewielka dawka promieniowania
- możliwość szybkiego przeprowadzenia badania
- niewielki koszt badania.
- Podstawa większości modeli kalkulatorów ryzyka złamania.
- Pomiaru dokonuje się na odcinku lędźwiowym kręgosłupa (L1–L4) oraz na kości udowej (szyjce kości udowej, całej kości udowej).
- Najważniejszym parametrem DXA jest tzw. wskaźnik T (T–score): odchylenie od średniej wartości u młodych osób dorosłych.
- Od wartości T <-1 występuje osteopenia, natomiast od wartości <–2,5 – osteoporoza.
- W ramach uzupełnienia można także określić tzw. wskaźnik Trabecular Bone Score (TBS) umożliwiający ocenę mikroarchitektury.6
- Badanie DXA pozwala:
- sprawdzić, czy występuje osteoporoza zgodna z definicją WHO (T–Score <–2,5)
- zoptymalizować ocenę ryzyka złamania
- ocenić wskazania do farmakoterapii.
QCT (ilościowa tomografia komputerowa)
- Pomocna w wybranych przypadkach, zwłaszcza osteoporozy wtórnej.
- Umożliwia określenie fizycznej gęstości kości kręgosłupa lub kości obwodowych.
- Umożliwia ocenę ryzyka złamania.
- Brak standaryzowanych danych referencyjnych i zakrojonych na szeroką skalę badań prospektywnych.
- Wskaźnika T w ilościowej tomografii komputerowej (QTC) nie da się przełożyć na wyniki badania DXA.
- Brak rutynowego zastosowania w diagnostyce osteoporozy.
- Znacznie większa dawka promieniowania i wyższe koszty.
Wskazania do opieki w poradni specjalistycznej lub szpitalnej
- Skierowanie do poradni leczenia osteoporozy:
- w przypadku konieczności wykonania badań diagnostycznych wykraczających poza zakres podstawowej opieki zdrowotnej.
- Skierowanie do szpitala:
- w przypadku poważnych złamań
- w przypadku konieczności leczenia bólu w warunkach szpitalnych.
Leczenie
Cele leczenia
- Unikanie złamań, również poprzez zmniejszenie ryzyka upadków.
- Wydłużenie oczekiwanej długości życia.
- Poprawa lub utrzymanie jakości życia pomimo choroby.
- Zwiększenie samodzielności lub jej utrzymanie.
- Ograniczenie bólu.
- Zwiększenie lub utrzymanie sprawności i ruchliwości (mobilności).
- Zapobieganie postępowi choroby.
Ogólne informacje o leczeniu
- Leczenie osteoporozy obejmuje:
- leczenie podstawowe
- określony rodzaj farmakoterapii
- uzupełniające procedury terapeutyczne.
- Kompleksowe leczenie, w tym leczenie farmakologiczne, rozpoczyna się u pacjentów:
- ≥50. roku życia bez złamań niskoenergetycznych, gdy ryzyko złamań w lokalizacjach głównych w ciągu 10 lat wynosi ≥10% lub
- z ryzykiem ≥3% złamań BKKU lub
- ze wskaźnikiem T (T–score) ≤–2,5 SD w zakresie BKKU lub w zakresie kręgów lędźwiowych.
- Ryzyko ocenione pomiędzy 5% a 10% jest wskazaniem do dalszej weryfikacji lekarskiej i ewentualnego leczenia. U pacjentów z niskim ryzykiem złamań (ryzyko złamań głównych według FRAX PL ≤5%) zaleca się wdrożenie działań profilaktycznych
- Wskazanie do określonej farmakoterapii występuje, gdy korzyści płynące z przyjmowania leków znacznie przewyższają związane z leczeniem ryzyko.
Leczenie podstawowe
- Ogólne działania dotyczące profilaktyki złamań należy wdrożyć we wszystkich grupach ryzyka.
- Zalecenie dotyczące ograniczenia czynników ryzyka, na które pacjent ma wpływ.
- Zalecenia dotyczące dodatkowego wsparcia w walce z chorobą (np. grupy samopomocowe).
- Należy zapewnić wystarczającą dawkę wapnia oraz witaminy D.
- Pacjenci, w przypadku których nie wdrożono określonej farmakoterapii, powinni przyjmować w diecie 1000 mg wapnia, a gdy nie ma takiej możliwości, należy stosować odpowiednie suplementy.
- Suplementacja witaminy D w profilaktyce niedoboru w poszczególnych grupach wiekowych:7
- dorośli 19–65 lat: 1000–2000 IU/dobę
- osoby starsze 65–75 lat: 1000–2000 IU/dobę
- seniorzy >75 lat: 2000–4000 IU/dobę.
- W przypadku pacjentów z otyłością rekomenduje się podwójną dawkę cholekalcyferolu w stosunku do osób z prawidłową masą ciała.
Aktywność fizyczna, unikanie upadków
- Wzmacnianie siły mięśni i koordynacji zgodnie ze stanem sprawności pacjenta
- Wystarczające obciążenie układu mięśniowo–szkieletowego: ćwiczenia z wykorzystaniem własnej masy ciała (weight–bearing exercises).
- Odpowiednie są np. wchodzenie po schodach, jazda na rowerze, wędrówki, taniec, gimnastyka tradycyjna i w wodzie, trening siłowy.
- Unikanie unieruchomienia.
- Roczna historia upadków w przypadku ich wysokiego ryzyka i od 8. dekady życia
- określenie przyczyn i ryzyka
- leczenie możliwych do uniknięcia przyczyn upadków.
- Doradztwo w zakresie odpowiednich środków leczniczych i sprzętu medycznego
- Pacjentom leczonym stacjonarnie należy zaproponować ochraniacze bioder.8-10
Styl życia
- Systematyczne przebywanie na świeżym powietrzu i ekspozycja na promienie słoneczne w celu uniknięcia niedoboru witaminy D (około 30 minut dziennie, bez zasłaniania głowy i dłoni).
- Rezygnacja z wyrobów nikotynowych.
- Ograniczenie spożywania alkoholu.
Dieta bogata w wapń i witaminę D
- Unikanie niedowagi, BMI >20 kg/m2, bez nadmiernego przybierania na wadze (unikanie otyłości).
- Zapewnienie całkowitej dziennej podaży 1000 mg wapnia oraz odpowiednich dawek witaminy D3.
- Suplementy wapnia należy stosować tylko w przypadku zbyt niskiej zawartości tego pierwiastka w diecie.
- Nie zaleca się podawania witaminy D3 bez codziennego przyjmowania 1000 mg wapnia.11-12
- W przypadku wysokiego ryzyka upadku lub złamań albo przy niewielkiej ekspozycji na promieniowanie słoneczne codzienne, doustna suplementacja witaminy D3.
- Uwaga: zalecenia dotyczące wapnia i witaminy D3 nie dotyczą m.in. pacjentów z pierwotną nadczynnością przytarczyc, kamicą nerkową, hiperkalciurią oraz aktywnymi chorobami ziarniniakowymi.
- Uwaga: zbyt wysoka podaż wapnia lub witaminy D (niebezpieczeństwo nefrokalcynozy, hiperkalcemii) wskutek jednoczesnego przyjmowania suplementów diety lub różnych wzbogaconych produktów leczniczych.
- Podawanie w bolusie dożylnym nie przynosi korzyści a może zwiększać ryzyko upadku.13
- Brak jednoznacznych dowodów na skuteczność witaminy B, kwasu foliowego i zielonej herbaty.
Ocena stosunku korzyści do ryzyka stosowania leków powodujących zwiększone ryzyko osteoporozy
- Systematyczna kontrola stosunku korzyści do ryzyka w przypadku stosowania następujących substancji:
- doustne i wziewne glikokortykosteroidy
- glitazony
- leki przeciwpadaczkowe
- leki przeciwdepresyjne
- neuroleptyki
- leki wywołujące hipotensję ortostatyczną
- inhibitory pompy protonowej (zwłaszcza w przypadku dłuższego stosowania)
- opioidy
- leki uspokajające
- w przypadku przyjmowania L–tyroksyny: TSH >0,3 mlU/l (wyjątki w przypadku zróżnicowanego raka tarczycy).
Wskazanie dotyczące określonego rodzaju farmakoterapii
Ogólne wskazanie
- Ogólne wskazanie w przypadku:
- spowodowanych osteoporozą złamań trzonu kręgu lub kości udowej
- trwającej przez dłuższy czas terapii glikokortykosteroidami w wysokich dawkach (≥7,5 mg ekwiwalentu prednizolonu) w połączeniu z obniżoną wartością T–score lub złamaniami niskoenergetycznymi.
- W przypadku typowego obrazu klinicznego i radiologicznego złamania trzonu kręgu lub złamania kości udowej spowodowanego osteoporozą, leczenie można wdrożyć nawet bez wcześniejszego przeprowadzenia badania DXA.
Ocena ryzyka złamań
- Zalecana indywidualna stratyfikacja ryzyka z 10–letnim ryzykiem złamań
- do oceny ryzyka wymagane przeprowadzenie badania DXA
- kalkulator FRAX.
- Na podstawie ryzyka złamań można ustalić odpowiednie leczenie.
Określony rodzaj farmakoterapii
Zasady leczenia
- Dostępne są następujące możliwości farmakoterapii:
- substancje antyresorpcyjne
- substancje osteoanaboliczne.
- Leczenie antyresorpcyjne zazwyczaj przy wstępnym rozpoznaniu:
- Martwica kości szczęki i żuchwy oraz atypowe złamania kości udowej stanowią w przypadku tych substancji rzadkie, ale ciężkie działania niepożądane.14-16
- Unikanie dalszej utraty gęstości kości, stabilizacja obecnej tkanki kostnej.
- Najczęściej przy wykorzystaniu bisfosfonianów lub przeciwciała monoklonalnego (denosumab).
- Leczenie osteoanaboliczne w przypadku już postępującej utraty struktury, wielokrotnych złamań lub kolejnych złamań pomimo leczenia antyresorpcyjnego.
- Odbudowa mikroarchitektury, poprawa wytrzymałości kości.
- Nowszą substancją o podwójnej skuteczności jest romosozumab17 – przeciwciało monoklonalne hamujące sklerostynę (inhibitor osteoblastów).
Wybór substancji czynnej
- Dokonując wyboru w przypadku poszczególnych pacjentów, należy uwzględnić następujące czynniki: potencjalne działania niepożądane, choroby współistniejące, okres działania po odstawieniu produktu leczniczego, sposób podawania, preferencje pacjenta i dopuszczenie do obrotu (lub jego brak).
- Leki dostępne w Polsce z udowodnioną skutecznością u kobiet:
- bisfosfoniany (kwas alendronowy18, kwas ryzedronowy, kwas zoledronowy19-20, kwas ibandronowy)
- denosumab21-22 (przeciwciało monoklonalne)
- estrogeny (tradycyjne leczenie osteoporozy jest wskazane tylko w przypadku, gdy pacjentka nie toleruje innych produktów leczniczych).
- W przypadku mężczyzn dopuszczone są następujące substancje (mniejsza dowiedziona skuteczność niż w przypadku kobiet):
- kwas alendronowy, kwas ryzedronowy, kwas zoledronowy
- denosumab
- Denosumab jest dopuszczony do leczenia osteoporozy w związku z ablacją narządu wytwarzającego hormony u mężczyzn chorujących na raka prostaty, u których występuje podwyższone ryzyko złamań.
Przeciwwskazania
- W przypadku różnych grup substancji należy uwzględnić następujące przeciwwskazania:
- bisfosfoniany: hipokalcemia, niewydolność nerek; przy stosowaniu doustnym choroby przełyku, choroba wrzodowa
- denusomab: hipokalcemia
- estrogeny: podejrzenie raka macicy/raka piersi, choroby płuc, incydenty zakrzepowo–zatorowe, żółtaczki, krwawienie z dróg rodnych o niewyjaśnionej etiologii, anemia sierpowata, otoskleroza, choroba niedokrwienna serca (dusznica bolesna, zawał mięśnia sercowego).
Substancje czynne oraz dawkowanie
Bisfosfoniany
- Kwas alendronowy (kobiety po okresie menopauzy i mężczyźni)
- Dawkowanie: 70 mg doustnie 1 x w tygodniu.
- Uwagi szczególne:
- Lek należy przyjmować rano bezpośrednio po wstaniu z łóżka i popijać całą szklanką wody (co najmniej 200 ml).
- Tabletki nie należy żuć/rozgryzać ani pozwalać, by rozpuściła się w jamie ustnej (ryzyko powstawania owrzodzeń).
- Nie kłaść się przez co najmniej 30 minut po przyjęciu leku.
- Jedzenie najwcześniej 30 minut po zażyciu leku.
Denosumab (kobiety po okresie menopauzy i mężczyźni)
- Dawkowanie: 60 mg podskórnie 1 x co 6 miesięcy.
- Uwagi szczególne: pacjentom należy przekazać ulotkę oraz kartkę przypominającą o przyjmowaniu leku.
Czas leczenia
- Specjalistyczne leczenie powinno zazwyczaj trwać co najmniej 3 lata.
- W zależności od indywidualnego ryzyka złamań może być konieczne kontynuowanie go przez całe życie.
- Co do zasady, po upływie od 3 do 5 lat leczenie należy ponownie ocenić pod kątem stosunku korzyści do ryzyka.
- Bisfosfoniany wykazują długo utrzymujące się działanie nawet po zakończeniu leczenia (są gromadzone w kościach). Dotyczy to zwłaszcza kwasu alendronowego i kwasu zoledronowego.
- W przypadku leczenia trwającego ponad 5 lat brak korzyści w stosunku do przerwania leczenia.
- Niewielka korzyść w przypadku złamań trzonu kręgu (badanie FLEX).23
- Okresowe przerwy w leczeniu – około 3 lata od rozpoczęcia podawania dożylnego i 5 lat od rozpoczęcia podawania doustnego.
- Bisfosfoniany wykazują działanie ograniczające złamania przez co najmniej 12 miesięcy od zakończenia leczenia.
- Czas trwania przerw w leczeniu nie jest dokładnie określony.
- W przypadku leczenia trwającego ponad 5 lat brak korzyści w stosunku do przerwania leczenia.
- W przypadku innych leków po zakończeniu leczenia ich efekty mogą szybko zniknąć.
- Trwające ponad rok leczenie denosumabem może spowodować „efekt odbicia” polegający na ponownym spadku masy kości.
- Leczenie denosumabem należy zatem zakończyć trwającą co najmniej 6 miesięcy fazą, w której podawany jest bisfosfonian.
- Trwające ponad rok leczenie denosumabem może spowodować „efekt odbicia” polegający na ponownym spadku masy kości.
Przestrzeganie zasad leczenia (compliance)
- Problemy z przestrzeganiem zasad leczenia znane są zwłaszcza w przypadku doustnego podawania leków.
- Już po upływie 1 roku zgodnie z zaleceniami lekarza przyjmuje je jeszcze tylko około 60% pacjentów.
- Ważne jest, aby uświadomić pacjentom konieczność systematycznego przyjmowania leków. Jak pokazuje doświadczenie, wiele osób nie rozumie bowiem jeszcze na początku swojej choroby.
- Przerwanie leczenia może powodować poważne działania niepożądane, np. dolegliwości ze strony przewodu pokarmowego.
- Lepsze przestrzeganie zasad można osiągnąć, podając bisfosfoniany dożylnie, a denosumab podskórnie.
Leczenie uzupełniające
Fizjoterapia
- Zabiegi fizjoterapeutyczne są nakierowane zarówno na profilaktykę złamań wskutek osteoporozy, jak i ich leczenie.24-26
- Celem fizjoterapii jest obecnie nie tylko leczenie złamań i pomoc w kontroli bólu, ale też zapobieganie głównym przyczynom złamań: upadkom i ograniczeniu zdolności nerwowo–mięśniowej.
- Profilaktyka fizjoterapeutyczna opiera się na 3 kluczowych zasadach:
- utrzymanie lub wzrost masy oraz wytrzymałości kości
- zapobieganie upadkom
- ograniczenie lęku przed upadkiem, przez to utrzymanie aktywności fizycznej.
- Warunkiem powodzenia leczenia jest odpowiednia komunikacja i współpraca pomiędzy fizjoterapeutą a lekarzem.
- Aby umożliwić niemal bezbolesny ruch, zwłaszcza w przypadku ostrych złamań, należy rozważyć stosowanie ortezy prostującej kręgosłup (gorset).
- Jednocześnie pacjenci powinni przy tym mieć możliwość skorzystania z programów ćwiczeń fizjoterapeutycznych oraz szkoleń na temat prawidłowej postawy.
- Zabiegi polem elektrycznym oraz elektroterapia, taka jak terapia prądem interferencyjnym, pozwala ograniczyć ból w przypadku wielokrotnych złamań trzonu kręgu, zapewniając poprawę sprawności.
- Nadzorowane przez fizjoterapeutę programy ćwiczeń uzupełnione o instruktaż dla pacjenta są w stanie złagodzić ból oraz zapewnić lepszą jakość życia.
- Jeżeli pomimo zastosowania domowego mono– lub multimodalnego, tradycyjnego leczenia, nadal utrzymują się ból i ograniczenie sprawności, może być konieczne leczenie stacjonarne.
Farmakologiczne leczenie bólu
- Co do zasady, leczenie przeciwbólowe powinno opierać się o drabinę analgetyczną opracowaną przez WHO.
- W leczeniu bólu wskutek złamania sprawdzają się niesteroidowe leki przeciwzapalne (NLPZ), metamizol i opiaty.
- Przeciwwskazania i działania niepożądane powodują nierzadko konieczność odejścia od opracowanego przez WHO schematu. Z uwagi na to, że leczeniu poddawane są zwykle osoby starsze, należy przestrzegać zasad „leczenia bólu u osób starszych”, uwzględniając choroby współistniejące, działania niepożądane i inne przyjmowane leki.
Przebieg, powikłania i rokowanie
Powikłania
- Złamania.
- Pogorszenie jakości życia.
- Unieruchomienie.
- Niepełnosprawność.
- Działania niepożądane określonego rodzaju farmakoterapii.
Przebieg i rokowanie
- Większość pacjentów z osteoporozą ma chorobę przewlekłą ze stale podwyższonym ryzykiem złamań.
- Znacznie pogorszona jakość życia zwłaszcza w przypadku istniejących złamań.
- U pacjentów ze złamaniami spowodowanymi przez osteoporozę wzrasta śmiertelność, zwłaszcza w pierwszym roku po złamaniu.
- W poszczególnych przypadkach podwyższone ryzyko złamania jest, po ustaniu potęgującego go czynnika, odwracalne w ciągu 1–2 lat.
- Np. zaprzestanie palenia, zakończenie leczenia lekami przeciwpadaczkowymi, zakończenie leczenia doustnymi glikokortykosteroidami, zakończenie leczenia inhibitorami aromatazy, itp.
- Leczenie podstawowe powinno trwać tak długo, jak utrzymuje się podwyższone ryzyko złamań.
- Przyjmowanie określonych leków może ograniczyć ryzyko złamań spowodowanych osteoporozą o średnio 50%, a w przypadku ciężkiej osteoporozy nawet do 80%. Ryzyko wszystkich złamań wymagających hospitalizacji zostaje zmniejszone o co najmniej 1/3.
Kontrola przebiegu
- Bez farmakoterapii: okresowa kontrola w zależności od zmiany występujących lub nowych dolegliwości, obecnego ryzyka, chorób współistniejących oraz wyników wcześniejszych badań.
- W ramach farmakoterapii: przeprowadzana co 3 do 6 miesięcy kontrola tolerancji leczenia oraz przestrzegania zasad, systematyczna kontrola przeciwwskazań, regularne kontrole stomatologiczne przy stosowaniu bisfosfonianu i denosumabu.
- Kontrola przebiegu choroby powinna obejmować następujące elementy:
- Wywiad dotyczący upadków.
- Wykrywanie złamań lub klinicznych objawów złamań.
- Ocenę wystarczającej podaży wapnia i witaminy D.
- Motywowanie do odpowiedniej i systematycznej aktywności fizycznej.
- U kobiet po menopauzie: hormonalną terapę zastępczą.
- Uwzględnienie innych przyjmowanych leków zwiększających ryzyko złamań.
- Kontrola leków stosowanych do leczenia osteoporozy:
- kontrola przeciwwskazań (np. występująca od niedawna niewydolności nerek)
- kontrola przestrzegania zasad leczenia
- zachowanie zalecanych schematów przyjmowania leków (zwłaszcza w przypadku bisfosfonianów)
- odnotowanie działań niepożądanych
- rozważenie kontynuacji leczenia osteoporozy zależnie od korzyści, działań niepożądanych i ryzyka.
- Badanie DXA celem kontroli przebiegu choroby i optymalizacji leczenia najwcześniej po 5 latach, jeśli nie będzie ono wskazane wcześniej z uwagi szczególnie elementy wywiadu lub obrazu klinicznego.
- Częstość pomiarów BMD powinna się opierać na wyjściowej gęstości mineralnej kości, a zwłaszcza na prawdopodobieństwie przekroczenia, w ramach okresu pomiędzy pomiarami, progu interwencyjnego dotyczącego określonego leczenia.
- W przypadku bieżącego leczenia korzyści kontrolnych pomiarów gęstości kości nie zostały udowodnione i mogą pomóc co najwyżej uzyskać lepsze przestrzeganie zasad leczenia.
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Ilustracje
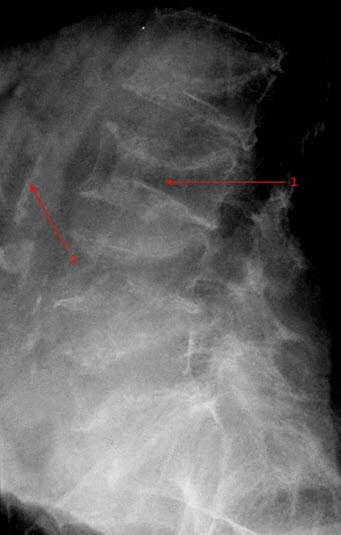
Osteoporoza kręgosłupa lędźwiowego: zmniejszona gęstość kości i złamanie blaszki granicznej górnej trzonów kręgu
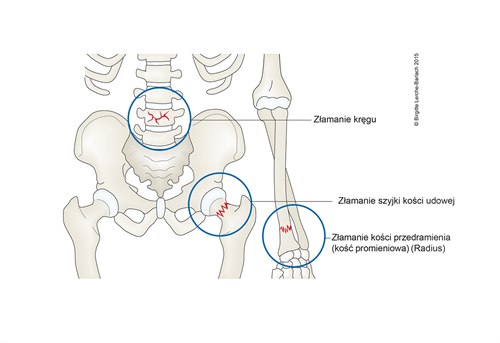
Ilustracja najczęstsze miejsca złamań w przebiegu osteoporozy
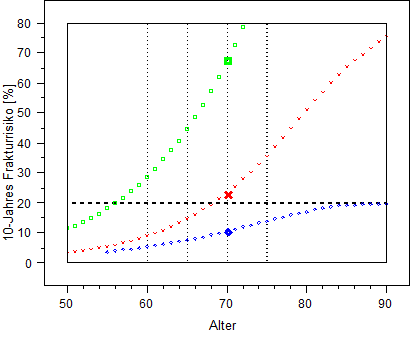
Ryzyko złamań w przebiegu osteoporozy w ciągu najbliższych 10 lat u mężczyzn (kolor niebieski) i kobiet (kolor czerwony) średnio dla populacji oraz w przypadku kobiet, u których wystąpiły już złamania trzonu kręgu (kolor zielony). Współczynniki powyżej 50% stanowią ekstrapolację i prawdopodobnie przeszacowują ryzyko (źródło: Dachverband der deutschsprachigen wissenschaftlichen Gesellschaften Osteologie [DVO]). Profilaktyka, diagnostyka i leczenie osteoporozy u kobiet po okresie menopauzy oraz u mężczyzn
Źródła
Wytyczne
- Głuszko P, Sewerynek E. Misiorowski W. et al. Guidelines for the diagnosis and management of osteoporosis in Poland, Update 2022, Endokrynol Pol. 2023, 74(1): 5-15. pubmed.ncbi.nlm.nih.gov
Piśmiennictwo
- Kanis J. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis: synopsis of a WHO report, WHO Study Group. Osteoporos Int 1994, 4: 368-81,doi:10.1007/BF01622200, DOI
- Kanis J.A. on behalf of the World Health Organization Scientific Group (2007) Assessment of osteoporosis at the primary health-care level, Technical Report. World Health Organization Collaborating Centre for Metabolic Bone Diseases, University of Sheffield, UK, www.sheffield.ac.uk
- International Osteoporosis Foundation - key statistics for Europe www.osteoporosis.foundation
- Głuszko P., Sewerynek E., Misiorowski W., et al. Guidelines for the diagnosis and management of osteoporosis in Poland, update 2022, Endokrynol Pol. 2023, 74(1): 5-15, doi:10.5603/EP.a2023.0012, pubmed.ncbi.nlm.nih.gov
- Kanis J.A., et al. FRAX™ and the assessment of fracture probability in men and women from the UK. Osteoporos Int. 04.2008, 19(4): 385-97, 22.02.2008, doi: 10.1007/s00198-007-0543-5, www.ncbi.nlm.nih.gov
- Buehring B., Thomas J., Wittkämper T., et al. Evaluation des Trabecular Bone Score (TBS) in der täglichen Praxis bei Patienten mit entzündlich rheumatischen und nichtentzündlichen Erkrankungen, Z Rheumatol 2020, 79: 1067-74, doi:10.1007/s00393-020-00764-9, DOI
- Płudowski P., Kos-Kudła B., Walczak M. i wsp.: Guidelines for Preventing and Treating Vitamin D Deficiency: A 2023 Update in Poland. Nutrients. 2023, 15(3): 695, https://doi.org/10.3390/nu15030695, pubmed.ncbi.nlm.nih.gov
- Kiel D.P., et al. Efficacy of a hip protector to prevent hip fracture in nursing home residents: the HIP PRO randomized controlled trial, JAMA 2007, 198: 413-22, www.ncbi.nlm.nih.gov
- Santesso N., Carrasco-Labra A., Brignardello-Petersen R. Hip protectors for preventing hip fractures in older people, Cochrane Database Syst Rev 2014, 3: CD001255. doi:10.1002/14651858.CD001255.pub5, DOI
- Koike T., Orito Y., Toyoda H., et al. External hip protectors are effective for the elderly with higher-than-average risk factors for hip fractures, Osteoporosis Int 2009, 20: 1613.20, pmid:19137351, PubMed
- Avenell A., Mak J., O'Connell D.Vitamin D and vitamin D analogues for preventing fractures in post-menopausal women and older men, Cochrane Database Syst Rev. 14.04.2014, 4:CD000227, pubmed.ncbi.nlm.nih.gov
- Reid I., Bolland M., et al. Effects of vitamin D supplements on bone mineral density: a systematic review and meta-analysis, Lancet 2013, doi:10.1016/S0140-6736(13)61647-5.
- Bischoff-Ferrari H.A., et al. The Effects of Four Doses of Vitamin D Supplements on Falls in Older Adults, JAMA Intern Med 2016, 176: 175-83, www.acpjournals.org
- Park-Wyllie L.Y., Mamdani M.M., Juurlink D.N., et al. Bisphosphonate use and the risk of subtrochanteric or femoral shaft fractures in older women, JAMA 2011, 305: 783-9, jama.jamanetwork.com
- Schilcher J., Michaëlsson K., Aspenberg P. Bisphosphonate use and atypical fractures of the femoral shaft, N Engl J Med 2011, 364: 1728-37. DOI: 10.1056/NEJMoa1010650, DOI
- Sawatari Y., Marx R.E. Bisphosphonates and bisphosphonate induced osteonecrosis, Oral Maxillofacial Surg Clin N Am 2007, 19: 487-98, www.ncbi.nlm.nih.gov
- McClung M.R., Grauer A., Boonen S., et al. Romosozumab in postmenopausal women with low bone mineral density, N Engl J Med 2014, doi:10.1056/NEJMoa1305224, DOI
- Wells G.A., Cranney A., Peterson J., Boucher M., Shea B., Welch V., Coyle D., Tugwell P. Alendronate for the primary and secondary prevention of osteoporotic fractures in postmenopausal women, Cochrane Database of Systematic Reviews 2008, Issue 1. Art. No.: CD001155, pubmed.ncbi.nlm.nih.gov
- Serrano A.J., Begona L., Anitua E., Cobos R., Orive G. Systematic review and meta-analysis of the efficacy and safety of alendronate and zoledronate for the treatment of postmenopausal osteoporosis, Gynecol Endocrinol, 2013 Dec, 29(12):1005-14, PMID: 24063695, PubMed
- Reid D.M., Devogelaer J-P., Saag K., et al. Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid-induced osteoporosis (HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial, Lancet 2009, 373: 1253-63, PubMed
- Austin M., Yang Y.C., Vittinghoff E., et al. Relationship between bone mineral density changes with denosumab treatment and risk reduction for vertebral and nonvertebral fractures, J Bone Miner Res. 2012 Mar, 27(3): 687-93, PMID: 22095631, PubMed
- Brown J.P., Roux C., Ho P.R., et al. Denosumab significantly increases bone mineral density and reduces bone turnover compared with monthly oral ibandronate and risedronate in postmenopausal women who remained at higher risk for fracture despite previous suboptimal treatment with an oral bisphosphonate, Osteoporos Int. 28.03.2014, pmid:24676847, PubMed
- Black D.M., et al. Effects of Continuing or Stopping Alendronate After 5 Years of Treatment, JAMA. 2006, 296(24): 2927-38, doi:10.1001/jama.296.24.2927, jamanetwork.com
- De Kam D., Smulders E., Weerdesteyn V., Smits-Engelsman B.C. Exercise interventions to reduce fall-related fractures and their risk factors in individuals with low bone density: a systematic review of randomized controlled trials, Osteoporos Int. 2009 Dec, 20(12): 2111-25, PMID: 19421702, PubMed
- Sherrington C., Whitney J.C., Lord S.R., et al. Effective exercise for the prevention of falls: a systematic review and meta-analysis, J Am Geriatr Soc. 2008 Dec, 56(12): 2234-43, PMID: 19093923, PubMed
- Newman M., Minns Lowe C., Barker K. Spinal Orthoses for Vertebral Osteoporosis and Osteoporotic Vertebral Fracture: A Systematic Review, Arch Phys Med Rehabil 2016, 97: 1013-25, pmid:26615791, PubMed
Opracowanie
- Katarzyna Nessler (recenzent)
- Adam Windak (redaktor)
- Michael Handke (recenzent/redaktor)
- Erika Baum (recenzent/redaktor)
