Streszczenie
- Definicja: Choroba neurodegeneracyjna z uszkodzeniem splotu mięśniowego prowadząca do upośledzenia motoryki odcinka dalszego przełyku i upośledzenia relaksacji dolnego zwieracza przełyku.
- Epidemiologia: Częstość występowania ok. 10 przypadków na 100 000 osób, zapadalność ok. 1 przypadek na 100 000 osób rocznie.
- Objawy: Zaburzenia połykania (dysfagia), regurgitacja niestrawionego pokarmu, ból zamostkowy.
- Obraz kliniczny: Dysfagia z regurgitacją, niedożywienie, utrata wagi, wyniszczenie, zachłystowe zapalenie płuc.
- Diagnostyka: Ezofagogastroduodenoskopia, ezofagografia (badanie RTG w czasie przełykania), manometria przełyku.
- Leczenie: Farmakoterapia z reguły bez zadowalającego długotrwałego efektu. Różne zabiegi interwencyjne (endoskopowe i chirurgiczne), np. pneumatyczne poszerzenie i laparoskopowa lub przezustna endoskopowa miotomia.
Informacje ogólne
Definicja
- Neurodegeneracyjna choroba splotu mięśniowego prowadząca do upośledzenia motoryki przełyku aż do czynnościowej niedrożności.1
- W szczególności zaburzona jest motoryka odcinka dalszego przełyku oraz funkcja dolnego zwieracza przełyku.
- Objawy kliniczne to zaburzenia połykania (dysfagia), regurgitacja niestrawionego pokarmu, ból zamostkowy.
- zwiększone ryzyko rozwoju raka przełyku
- Diagnostyka obejmuje endoskopię, manometrię przełyku i badanie przełyku w trakcie połykania.
- Leczenie farmakologiczne lub zabiegowe
- Dostępne są różne procedury interwencyjne (np. poszerzenie balonem).
Epidemiologia
- Jest to choroba rzadka.
- częstość występowania w ciągu całego życia 1 przypadek na 10 000 osób
- zapadalność około 1 przypadek na 100 000 osób rocznie.1-2
- Szczyt pierwszego zachorowania między 60. a 70. rokiem życia.
- Wiek i płeć
- Pierwsze wystąpienie najczęściej w wieku 60-70-lat, ale także u osób młodszych, niezależnie od płci.
- Choroba może rozpocząć się również w dzieciństwie, zwykle jednak nie wcześniej niż w 8. roku życia.
Etiologia i patogeneza
- Etiologia pierwotnej (idiopatycznej) achalazji w dużej mierze nieznana
- Pod uwagę bierze się wpływ czynników zakaźnych, autoimmunologicznych i genetycznych.1-4
- Zanikanie komórek nerwowych w splocie mięśniowym (splot Auerbacha)1
- Jest to część autonomicznego trzewnego układu nerwowego (TUN).
- Choroba często zaliczana jest do chorób neurodegeneracyjnych.
- Splot mięśniowy kontroluje ruchy w przewodzie pokarmowym.
- Choroba dotyczy głównie dolnego zwieracza przełyku (lower esophageal sphincter - LES).1
- W fazie wyjściowej LES znajduje sie w stanie skurczu, co zapobiega refluksowi kwasu żołądkowego.
- W czasie aktu połykania następuje rozkurcz LES w celu pasażu pokarmu do żołądka.
- W przebiegu achalazji występuje stały skurcz i brak zwiotczenia LES.
- Pokarm nie przechodzi do żołądka, dopóki nie zostanie pokonane ciśnienie skurczowe LES.
- Wzrost ciśnienia w przełyku i regurgitacja, a także aspiracja pokarmu, prowadzą do powikłań choroby.
ICD-10
- K22. Inne choroby przełyku.
- K22.0 Achalazja wpustu żołądka.
Diagnostyka
Kryteria diagnostyczne
- Często opóźnione rozpoznanie z powodu niespecyficznych dolegliwości.1
- Klinicznie postępująca dysfagia i regurgitacja niestrawionego pokarmu.
- Potwierdzenie rozpoznania rozszerzoną diagnostyką (endoskopia, ezofagografia, manometria).
Diagnostyka różnicowa
- Choroba refluksowa przełyku.
- Rak przełyku.
- Skurcz przełyku.
- Uchyłki przełyku.
- Twardzina układowa.
- Wrzód trawienny.
- Udar z dysfagią.
- Choroby neurodegeneracyjne (np. choroba Parkinsona).
- Choroba Chagasa
- Endemiczne występowanie w Ameryce Południowej, wywołana przez pierwotniakowe zakażenie świdrowcem Trypanosoma cruzi.
- Może prowadzić do uszkodzenia splotu błony mięśniowej, co utrudnia odróżnienie od achalazji.
Wywiad lekarski
- Zgłaszane dolegliwości1,5-6
- zaburzenia połykania (dysfagia) jako objaw wiodący (ok. 90%)
- początkowo tylko epizodyczne, z czasem przewlekle-postępujące
- ewent. pogorszenie stanu zdrowia z powodu obciążenia psychicznego
- zgaga
- odbijanie lub wymioty (regurgitacja), szczególnie w pozycji leżącej
- ból zamostkowy lub podczas przełykania (odynofagia)
- chrypka lub ból gardła
- częste krztuszenie się
- kaszel po jedzeniu/piciu (aspiracja)
- zgłaszane przez pacjenta „uwięźnięcie śliny/napojów/pokarmów w gardle"
- niejasne rzuty gorączkowe i/lub zapalenie płuc (ewent. nieme aspiracje!)
- zmniejszenie ilości jedzenia lub picia oraz niezamierzona utrata wagi.
- zaburzenia połykania (dysfagia) jako objaw wiodący (ok. 90%)
- W przebiegu choroby może dojść do zmniejszenia nasilenia bólu w miarę zmniejszania się napięcia ścian poszerzonego przełyku.
Badanie przedmiotowe
- Ogólne badanie przedmiotowe
- objawy niedożywienia i utrata wagi
- osłuchiwanie płuc (zachłystowe zapalenie płuc).
- Obserwacja procesu połykania
- Np. po podaniu 50–100 ml wody.
- Ból, regurgitacja, kaszel, zmieniony głos po przełknięciu?
Diagnostyka specjalistyczna
- Ezofagogastroskopia
- Rozpoznanie możliwe endoskopowo tylko w około 1/3 przypadków.
- Wyniki badania zależą od stadium choroby.
- Typowy jest zwiększony opór na granicy przełyku i żołądka.
- W zaawansowanym stadium widoczne poszerzenie przełyku przez zalegający pokarm.
- Wykluczenie innych przyczyn (rak przełyku, zwężenia).
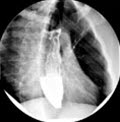 achalazja, RTG
achalazja, RTG
- RTG klatki piersiowej
- poszerzenie śródpiersia, brak bańki powietrza w żołądku.
- Badanie przełyku w czasie przełykania (ezofagografia ze środkiem cieniującym)
- dynamiczne badanie RTG procesu połykania z bolusem pokarmowym zawierającym kontrast1,7-8
- typowe wyniki
- osłabiona perystaltyka w odcinku dalszym
- poszerzenie odcinka przełyku przed zwężeniem, zwężenie połączenia żołądkowo-przełykowego, nitkowate przejście środka kontrastowego w okolicy wpustu żołądka („ptasi dziób” lub „kształt kieliszka do szampana”).
- Endoskopowa ultrasonografia (EUS)
- poszerzenie warstwy okrężnej mięśni przełyku na wysokości LES.
- Manometria przełyku
- pomiar ciśnienia w świetle gardła i przełyku podczas połykania
- złoty standard diagnostyczny (>90% przypadków)1
- typowe wyniki
- podwyższone ciśnienie spoczynkowe LES, nieprawidłowa relaksacja - niepełny rozkurcz LES podczas połykania
- zaburzenia dotyczące trzonu przełyku: nieprawidłowa perystaltyka (skurcze symultaniczne na różnych poziomach przełyku, skurcze spontaniczne, powtarzające się fale perystaltyczne, brak perystaltyki), wzrost ciśnienia wewnątrzprzełykowego.
Wskazania do skierowania do specjalisty
- W przypadku podejrzenia choroby.
Lista kontrolna dotycząca skierowania
Achalazja
- Cel skierowania
- Diagnostyka potwierdzająca? Leczenie? Inne?
- Wywiad lekarski
- Początek i czas trwania? Przebieg?
- Stopień trudności w połykaniu? Inne dolegliwości? Utrata masy ciała?
- Inne istotne choroby? Regularnie przyjmowane leki?
- Wpływ dolegliwości na zdolność do pracy, jakość życia?
- Badanie przedmiotowe
- stan ogólny.
- Badania uzupełniające
- Ewent. gastroskopia? Ewent. RTG?
Leczenie
Cele leczenia
- Poprawa zdolności połykania i złagodzenie objawów.
- Zapobieganie powikłaniom (zachłystowe zapalenie płuc, rak przełyku).
- Ogólna poprawa jakości życia.
Ogólne informacje o leczeniu
- Brak leczenia przyczynowego.1
- Farmakoterapia o długotrwałej skuteczności nie jest dostępna.
- Możliwe są różne zabiegi endoskopowe i chirurgiczne.
- Celem wykonywanych zabiegów jest zmniejszenie oporu w obrębie dolnego zwieracza przełyku (LES).
- Decyzja o leczeniu powinna być podejmowana indywidualnie i uwzględniać:
- wiek pacjenta, choroby współistniejące, ciśnienie tętnicze, ryzyko wystąpienia powikłań.
- Rekomendacje wytycznych amerykańskich (stan na 2020 r.)8 uznają za równoważne interwencyjne terapie podstawowe.
- poszerzanie pneumatyczne
- laparoskopowa miotomia z częściową fundoplikacją.
Farmakoterapia
- Antagoniści wapnia1,9-10
- Nifedypina doustnie 10–30 mg, 30-45 minut przed jedzeniem.1
- Prowadzi do szybkiego rozluźnienia dolnego zwieracza przełyku i niewielkiej poprawy w zakresie dysfagii.
- Krótkotrwałe złagodzenie objawów, brak skutecznego leczenia długoterminowego.1
- Opcja terapeutyczna w przypadku przeciwwskazań do zabiegów interwencyjnych.
- Nitraty
- Nitrogliceryna podjęzykowo 0,4 mg 10-15 minut przed jedzeniem.
- Ograniczone zastosowanie ze względu na małą skuteczność u dużego odsetka pacjentów, zjawisko tachyfilaksji i objawy niepożądane (bóle głowy, spadki ciśnienia).
- Do rozważenia u pacjentów, u których nie można zastosować innych metod leczenia.
Leczenie chirurgiczne
Procedury endoskopowe
- Poszerzenie pneumatyczne (pneumatic dilatation - PD)
- Endoskopowe mechaniczne rozszerzenie wpustu1,11
- Stosowane są rozszerzadła pneumatyczne, hydrostatyczne, metalowe lub z tworzyw sztucznych, jednorazowe lub wielokrotne o rosnącej średnicy („poszerzenie stopniowane”).
- Prowadzi do ustąpienia objawów na okres >5 lat u 40-85%.
- W badaniu obserwacyjnym, po 2 latach procedura miała podobną skuteczność jak zabieg laparoskopowy.11-12
- Gorsze wyniki u młodszych pacjentów.
- Powikłania: perforacja (0–10%), krwawienie (0,4%).1
- Często konieczne są powtórne zabiegi (ok. 50% w ciągu 5 lat).1
- Endoskopowe mechaniczne rozszerzenie wpustu1,11
- Wstrzyknięcie toksyny botulinowej do LES
- Leczenie z wszczepieniem stentu
- umieszczenie metalowego stentu w LES
- jak dotąd niewiele danych na temat długoterminowej skuteczności
- powikłania: przemieszczenie się stentu (do 27%).
Procedury chirurgiczne
- Laparoskopowa miotomia wpustu żołądka i LES (metodą Hellera)1
- Przezustna endoskopowa miotomia (peroral endoscopic myotomy - POEM)
- Otwarta miotomia wpustu żołądka i LES (zmodyfikowana metodą Gottsteina i Hellera).
- Ezofagektomia
- leczenie ostatniego wyboru
- ewent. konieczne w końcowym stadium choroby.
Przebieg, powikłania i rokowanie
Przebieg
- Nieleczona choroba ma charakter przewlekle postępujący.
Powikłania
- Aspiracja treści pokarmowych z ryzykiem zachłystowego zapalenia płuc.
- Niedożywienia i utrata wagi.
- Poszerzenie przełyku aż po przełyk olbrzymi.
- Rak przełyku.16
- Zapalenie przełyku.
- Perforacja po leczeniu.
Rokowanie
- Istotna poprawa objawów i obiektywnych kryteriów pomiaru po leczeniu (poszerzenie balonem lub operacja).9
- Pomimo leczenia często pozostają objawy resztkowe z dysfagią, bólem w klatce piersiowej lub objawami refluksu.17
Dalsze postępowanie
- Obserwacja pod kątem objawów klinicznych i ewentualnego nawrotu choroby
- w razie potrzeby ponowna manometria przełyku.
- Endoskopia kontrolna ze względu na zwiększone ryzyko wystąpienia raka
- np. co 2 lata w celu wykluczenia raka przełyku.
Informacje dla pacjentów
Informacje dla pacjentów w Medibas
Ilustracje

Achalazja z widocznym poszerzeniem w RTG (dzięki uprzejmości endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)

Achalazja
Źródła
Wytyczne
- ACG clinical guideline: diagnosis and management of achalasia. Am J Gastroenterol 2020; 115(9):p 1393-1411. journals.lww.com
Piśmiennictwo
- Pandolfino JE, Gawron AJ. Achalasia. A systematic review. JAMA. 2015;313(18):1841-1852 . doi:10.1001/jama.2015.2996 www.ncbi.nlm.nih.gov
- Enestvedt BK, Williams JL, Sonnenberg A. Epidemiology and practice patterns of achalasia in a large multi-centre database. Aliment Pharmacol Ther. 2011;33(11):1209-1214. PubMed
- Booy JD, Takata J, Tomlinson G, et al. The prevalence of autoimmune disease in patients with esophageal achalasia. Dis Esophagus. 2012;25:209-213 PubMed
- Park W, Vaezi MF. Etiology and pathogenesis of achalasia: the current understanding, Am J Gastroenterol. Am J Gastroenterol 2005; 100: 1404-1414. pmid:15929777 PubMed
- Tsuboi K, Hoshino M, Srinivasan A, et al. Insights gained from symptom evaluation of esophageal motility disorders: a review of 4,215 patients. Digestion. 2012;85(3):236-242. PubMed
- Sinan H, Tatum RP, Soares RV, Martin AV, Pellegrini CA, Oelschlager BK. Prevalence of respiratory symptoms in patients with achalasia. Dis Esophagus. 2011;24(4):224-228. PubMed
- Kopelman Y, Triadafilopoulos G. Endoscopy in the diagnosis and management of motility disorders. Dig Dis Sci. 2011;56:635-654. PubMed
- Vaezi MF, Pandolfino JE, Pandolfino JE. ACG clinical guideline: diagnosis and management of achalasia. Am J Gastroenterol 2020; 115(9):p 1393-1411 journals.lww.com
- Roll GR, Rabl C, Ciovica R et.al. A controversy that has been tough to swallow: is the treatment of achalasia now digested?. J Gastrointest Surg 2010; 14: 33-45. PubMed
- Wang L, Li YM, Li L. Meta-analysis of randomized and controlled treatment trials for achalasia. Dig Dis Science 2009; 54: 2303-11. pubmed.ncbi.nlm.nih.gov
- Katzka DA, Castell DO. Review article: an analysis of the efficacy, perforation rates and methods used in pneumatic dilation for achalasia. Aliment Pharmacol Ther. 2011;34:832-839. pubmed.ncbi.nlm.nih.gov
- Boeckxstaens GE, Annese V, des Varannes SB, et al. Pneumatic dilation versus laparoscopic Heller's myotomy for idiopathic achalasia. N Engl J Med 2011; 364: 1807-16. New England Journal of Medicine
- Leyden JE, Moss AC, MacMathuna P. Endoscopic pneumatic dilation versus botulinum toxin injection in the management of primary achalasia. Cochrane Database Syst Rev. 2014. (12): CD005046. www.cochranelibrary.com
- Campos GM, Vittinghoff E, Rabl C, Takata M, Gadenstätter M, Lin F, Ciovica R. Endoscopic and surgical treatments for achalasia: a systematic review and meta-analysis. Ann Surg. 2009 Jan;249(1):45-57. doi: 10.1097/SLA.0b013e31818e43ab Review. PubMed PMID: 19106675 www.ncbi.nlm.nih.gov
- Ponds FA, Fockens P, Lei A, et al. Effect of Peroral Endoscopic Myotomy vs Pneumatic Dilation on Symptom Severity and Treatment Outcomes Among Treatment-Naive Patients With Achalasia A Randomized Clinical Trial. JAMA 2019; 322: 134-44. pmid:31287522. www.ncbi.nlm.nih.gov
- Zendehdel K, Nyrén O, Edberg A et. al. Risk of Esophageal Adenocarcinoma in Achalasia Patients, a Retrospective Cohort Study in Sweden . Am J Gastroenterol 2011; 106: 57-61. PubMed
- Frankhuisen R, van Herwaarden MA, Heijkoop R, et al. Persisting symptoms and decreased health-related quality-of-life in a cross-sectional study of treated achalasia patients. Aliment Pharmacol Ther. 2007;26:899-904. PubMed
Autorzy
- Lek. Joanna Dąbrowska-Juszczak (redaktor)
- Dr n. med. Grzegorz Margas, (recenzent)
- Prof. dr hab. n. med.Adam Windak, (redaktor)
- Lek. Jonas Klaus, (recenzent)
