Streszczenie
- Definicja: Powolny chłoniak nieziarniczy z komórek B charakteryzujący się przebiegiem białaczkowym. We krwi obwodowej można wykryć populację monoklonalnych limfocytów B >5 × 109/l
- Częstość występowania: Najczęstsza postać białaczki, roczna zapadalność 3–5/100 000. Średni wiek zachorowania dla mężczyzn 72 lata, dla kobiet 75 lat.
- Objawy: U wielu pacjentów w momencie ustalenia nie występują żadne objawy., może wystąpić powiększenie węzłów chłonnych, uczucie ucisku w jamie brzusznej, znużenie, ewentualnie objawy B.
- Badanie fizykalne: Bezbolesne powiększenie węzłów chłonnych szyi, pachowych i pachwinowych, hepatosplenomegalia. Niedokrwistość, objawy krwotoczne (małopłytkowość) w zaawansowanej chorobie.
- Rozpoznanie: Morfologia krwi z rozmazem i immunofenotypowaniem są zazwyczaj wystarczające do postawienia rozpoznania.
- Leczenie: Klasyfikacja zaawansowania klinicznego według Bineta przed podjęciem decyzji o leczeniu. U bezobjawowych pacjentów w stopniu A lub B wg Bineta należy stosować zasadę obserwacji (strategia „Watch and Wait”). Jeśli wskazane jest leczenie, to postępowanie indywidualne w zależności od kondycji, wieku i genetycznych czynników ryzyka. Dostępne są chemoterapeutyki, przeciwciała anty-CD-20 i tak zwane leki ukierunkowane molekularnie (inhibitory szlaków sygnałowych), takie jak ibrutynib. Allogeniczny przeszczep komórek macierzystych jest rzadko wskazany.
Informacje ogólne
Definicja
- Powolny chłoniak nieziarniczy z komórek B charakteryzujący się przebiegiem białaczkowym.
- populacja monoklonalnych komórek B we krwi obwodowej >5 × 109 komórek/l, morfologicznie dojrzałych małych limfocytów
- Przed przejściem w przewlekłą białaczkę limfocytową (chronic lymphocytic leukemia -CLL) występuje faza z monoklonalną limfocytozą B-komórkową (MBL).
- MBL definiuje się jako klonalną populację komórek B ≤5 × 109/l we krwi bez innych dowodów choroby limfoproliferacyjnej.
- MBL jest zespołem paraneoplastycznym CLL, który na pozór nie ma żadnego związku z nowotworem i występuje stosunkowo często w populacji ogólnej (0,5–5%), a chorobowość wzrasta wraz z wiekiem.
- Ryzyko progresji do CLL średnio około 1%/rok w zależności od liczby komórek
Częstość występowania
- Najczęstszy rodzaj białaczki w zachodnich krajach uprzemysłowionych.
- Zapadalność
- roczna zapadalność 3–5/100 000.
- Stosunek płci
- stosunek liczby mężczyzn do liczby kobiet: około 2:1.
- Rozkład wiekowy
- zwykle jest to choroba wieku podeszłego
- średni wiek zachorowania u mężczyzn: 72 lata
- średni wiek zachorowania u kobiet: 75 lat
- diagnozowana coraz częściej w ostatnich latach nawet u młodszych pacjentów ze względu na rosnącą
- około 10% pacjentów jest w wieku <55 lat.1
- zwykle jest to choroba wieku podeszłego
Etiologia i patogeneza
Etiologia
- Etiologia nie jest jeszcze znana
- Wydaje się, że czynniki genetyczne mają pewien wpływ.
- Dzieci pacjentów z CLL mają zwiększone ryzyko zachorowania na chłoniaka nieziarniczego.
- rzadko w Azji
Patogeneza
- CLL charakteryzuje się proliferacją i akumulacją dojrzałych komórek B.
- Do głównych elementów patogenezy należą:
- zahamowanie apoptozy,
- deregulacja proliferacji.
- W przebiegu choroby dochodzi do stopniowych, kumulujących się zmian genetycznych z mutacjami i nieprawidłowościami chromosomalnymi, które sprzyjają proliferacji lub zapobiegają apoptozie.
- Mutacje i zmiany chromosomowe sprawiają, że CLL staje się z czasem bardziej agresywna, co prowadzi do oporności na leczenie.2
Czynniki predysponujące
- Nabyte
- rozpuszczalniki organiczne, np. benzen 1318
- zwiększony kontakt z herbicydami/pestycydami
- wirusowe zapalenie wątroby typu C
- skłonność do chorób alergicznych
- liczne infekcje dróg oddechowych w wywiadzie.
- Dziedziczna
- 8,5-krotnie zwiększone ryzyko u krewnych pierwszego stopnia pacjentów z CLL.
ICD-10
- C91.1 Przewlekła białaczka limfocytowa z komórkami B.
Diagnostyka
- Pobranie próbki krwi obwodowej (morfologia krwi z rozmazem, immunofenotypowanie) zwykle wystarczą do postawienia diagnozy.
- Pacjenci często nie mają żadnych objawów w momencie rozpoznania, diagnozowani przypadkowo na podstawie badania morfologii krwi zlecanej z innych wskazań.
- W przypadku utrzymującej się limfocytozy, której nie można wyjaśnić w inny sposób (>50% leukocytów lub >5 G/l odpowiadających 5000/mcl) lub w przypadku limfadenopatii lub splenomegalii lub autoimmunologicznego obniżenia ilości elementów morfotycznych krwi, należy przeprowadzić diagnostykę CLL.
- We wstępnej diagnostyce CLL należy zastosować następujące badania wstępne:
- wywiad lekarski
- badanie przedmiotowe z pełną oceną stanu obwodowych węzłów chłonnych oraz oceną wielkości wątroby i śledziony
- morfologia krwi (przynajmniej hemoglobina, liczba leukocytów, liczba płytek krwi)
- mikroskopowa morfologia WBC
- immunofenotypowanie krwi obwodowej.
Kryteria diagnostyczne
- Rozpoznanie CLL, jeśli spełnione są następujące kryteria:
- liczba komórek: >5 × 109 klonalnych limfocytów B/l (>5000 komórek/mcl) we krwi obwodowej przez co najmniej trzy miesiące
- Rozmaz krwi: przewaga małych, morfologicznie dojrzałych limfocytów
- Immunofenotypowanie: koekspresja antygenów komórek B CD19, CD20 i CD23 z antygenem komórek T CD5
- wykrywanie monoklonalności limfocytów poprzez wykrywanie restrykcji łańcucha lekkiego (tylko łańcuchy kappa lub wolne lekkie łańcuchy lambda ulegają ekspresji).
Diagnostyka różnicowa
- Najczęstsze rozpoznanie różnicowe to:
- monoklonalna limfocytoza B-komórkowa
- reaktywna limfocytoza (infekcje wirusowe, choroby tkanki łącznej)
- inne chłoniaki białaczkowe (chłoniak grudkowy, chłoniak limfoplazmocytowy, chłoniak strefy brzeżnej, chłoniak z komórek płaszcza, białaczka limfocytowa B (B-PLL))
- białaczka włochatokomórkowa.
Wywiad lekarski
- Około 25–50% pacjentów nie ma objawów w momencie rozpoznania!3
- Objawy
- ogólne objawy
- znużenie
- słaba wydolność organizmu
- zmęczenie
- objawy B (około 20 %): gorączka, nocne poty, utrata masy ciała >10% w ciągu ostatnich sześciu miesięcy
- szczególnie powiększenie węzłów chłonnych
- węzły chłonne szyi
- węzły chłonne pachowe
- węzły chłonne pachwinowe
- suchy kaszel, duszność (wraz z powiększeniem węzłów chłonnych w obrębie klatki piersiowej)
- uczucie ucisku w okolicy śledziony lub wątroby (50%)
- zwiększona podatność na infekcje.
- ogólne objawy
- Członkowie rodziny chorujący na CLL?
- Przebyte nowotwory złośliwe i ich leczenie?
- Narażenie na działanie substancji chemicznych (np. benzen) lub promieniowanie radioaktywne?
Badanie przedmiotowe
- Powiększenie węzłów chłonnych u około 80% pacjentów, którzy mają objawy3
- przeważnie węzły chłonne są
- bezbolesne
- liczące kilka centymetrów średnicy
- umiarkowanie twarde
- przesuwalne.
- przeważnie węzły chłonne są
- Hepatosplenomegalia (ok. 50 %).
- Ewentualnie bladość (niedokrwistość).
- Ewentualnie objawy krwotoczne (małopłytkowość)
- około 10% pacjentów początkowo z niedokrwistością lub małopłytkowością.
Badania uzupełniające w ramach podstawowej opieki zdrowotnej
Badanie krwi
- Morfologia WBC
- leukocyty: limfocytoza
- Oprócz maszynowego różnicowania leukocytów (czasami niedokładnego) należy przeprowadzić mikroskopowe różnicowanie komórek z rozmazem krwi.
- stężenie hemoglobiny: zwykle na początku nadal w normie
- trombocyty: zwykle na początku nadal w normie
- leukocyty: limfocytoza
- Badanie biochemiczne
- bilirubina, GGTP, AST, ALT
- stężenie kreatyniny, stężenie mocznika, kwas moczowy
- proteinogram z surowicy
- hipogammaglobulinemia w zaawansowanej chorobie
- bezpośredni odczyn Coombsa (w przypadku podejrzenia autohemolizy) - dodatni u 15-35% chorych.
Badania przesiewowe
- Nie zaleca się rutynowych badań przesiewowych w kierunku CLL w populacji ogólnej ani u krewnych pacjentów z CLL.1
USG jamy brzusznej
- Nie jest to absolutnie konieczne w ramach wstępnej diagnostyki, ale jest przydatne w ocenie watroby śledziony i węzłów chłonnych.
- Hepatosplenomegalia, powiększenie węzłów chłonnych
- Węzły chłonne >1 cm uważa się za powiększone.
- Śledziona do 12 cm – nie uważa się za patologicznie powiększoną.
Diagnostyka specjalistyczna
Badania laboratoryjne: Immunofenotypowanie
- W celu wykrycia CLL należy przeprowadzić immunofenotypowanie.
- ekspresja CD19 i CD23
- współekspresja CD5
- słaba lub nieobecna ekspresja CD20, CD79b, FMC7
- monoklonalność Igκ lub Igλ.
- LDH.
- Haptoglobina (w przypadku podejrzenia hemolizy).
- Z bezwzględnej liczby limfocytów we krwi i odsetka względnego monoklonalnych komórek B w immunofenotypizacji wynika bezwzględna liczba monoklonalnych komórek B.
- CLL występuje, gdy liczba monoklonalnych komórek B wynosi >5 × 109/l (co odpowiada 5000/mcl).
Badania laboratoryjne przed rozpoczęciem leczenia
- Analizy genetyczne (decydujące dla wyboru leczenia)
- delecja chromosomu 17p13
- mutacja w genie TP53
- mutacja IGHV.
- Dalsze badania laboratoryjne, np. ilościowe oznaczenie immunoglobulin w przypadku podejrzenia niedoboru odporności, beta-2-mikroglobulina (parametr prognostyczny).
Aspiracja lub biopsja szpiku kostnego
- Zazwyczaj niewymagane do postawienia diagnozy
- opcja przy niejednoznacznym immunofenotypowaniu.
- Ewentualnie w trakcie trwania choroby w celu oceny niejasnego niedoboru krwinek lub jakości remisji.
Biopsja węzłów chłonnych
- Zasadniczo niewymagane do postawienia rozpoznania
- opcja przy niejednoznacznym immunofenotypowaniu.
- Wskazania:
- brak monoklonalnej populacji limfocytów we krwi obwodowej
- podejrzenie transformacji w chłoniaka agresywnego (zespół Richtera).
Diagnostyka obrazowa
- Klasyfikacja stadiów odbywa się bez obrazowania.
- USG jamy brzusznej
- zalecane przed rozpoczęciem leczenia: śledziona, wątroba, węzły chłonne
- węzły chłonne >1 cm uważa się za powiększone (w trakcie i po zakończeniu leczenia uważa się za powiększone tylko węzły chłonne >1,5 cm).
- Tomografia komputerowa (TK)
- tylko w przypadku szczególnych kwestii diagnostycznych (np. zajęcie śródpiersia) lub w ramach badań klinicznych.
Klasyfikacja stadiów
- Klasyfikacja zaawansowania klinicznego według Bineta lub Raia jest przydatna u chorych z CLL, w ocenie:
- rokowanie
- wskazań do leczenia.
- Zarówno klasyfikację wg Bineta, jak i Raia można łatwo przeprowadzić (nie ma konieczności obrazowania). w oparciu o:
- badanie przedmiotowe
- morfologię krwi.
- W Europie dominuje klasyfikacja wg Bineta.
Klasyfikacja zaawansowania klinicznego wg Bineta
- Określenie stężenia hemoglobiny i liczby trombocytów.
- Ocena pięciu obszarów limfatycznych
- węzły chłonne szyjne (jedno- lub obustronnie)
- węzły chłonne pachowe (jedno- lub obustronnie)
- węzły chłonne pachwinowe (jedno- lub obustronnie)
- śledziona
- wątroba.
- Patrz tabela Klasyfikacja zaawansowania klinicznego CLL według Bineta.
- Przy wstępnej diagnozie:
- 60% chorych w stopniu A
- 30% chorych w stopniu B
- 10% chorych w stopniu C.
Wskazania do skierowania do specjalisty
- W celu ustalenia rozpoznania i w razie potrzeby podjęcia decyzji o leczeniu w przypadkach podejrzenia CLL.
Leczenie
Cele leczenia
- W większości przypadków CLL nie da się wyleczyć, więc cele leczenia to1:
- przedłużenie życia
- poprawa jakości życia.
- Przeszczepienie allogenicznych komórek macierzystych jest potencjalną opcją leczniczą dla małej liczby pacjentów.
Ogólne informacje o leczeniu
Ogólne zasady postępowania
- Wczesne leczenie bezobjawowych pacjentów nie wydłuża przeżycia.
- Leczenie należy zatem rozpocząć dopiero po wystąpieniu następujących objawów2:
- wyraźne oznaki niewydolności szpiku kostnego lub
- objawy związane z chorobą, takie jak objaw B lub zmęczenie.
Pacjenci bezobjawowi vs. pacjenci z objawami
- W przypadku bezobjawowych pacjentów wysokiego ryzyka należy dalej stosować obserwację.
- W przypadku umiarkowanej małopłytkowości lub niedokrwistości nadal można czekać pomimo obecności stopnia C wg Bineta, jeśli wartości pozostają stabilne w krótkoterminowych badaniach kontrolnych.
- Sama hepatomegalia nie jest zwykle wskazaniem do leczenia, wyraźna splenomegalia z powiększeniem śledziony >6 cm poniżej łuku żebrowego może już być.
- Jeśli same objawy przy stopniu B są wskazaniem do rozpoczęcia leczenia, należy przeprowadzić diagnostykę różnicową, zwłaszcza pod kątem infekcji lub chorób żołądkowo-jelitowych, endokrynologicznych i metabolicznych.
- Leczenie należy rozpocząć, jeśli nocne poty utrzymują się dłużej niż miesiąc i powodują stres psychologiczny.
Postępowanie
- CLL stopnia A i B wg Bineta, brak aktywnej choroby: strategia obserwacji dopóki choroba nie stanie się objawowa.
- CLL stopnia A i B wg Bineta, aktywna choroba: leczenie
- CLL stopnia C wg Bineta: leczenie
- Kryteria dotyczące aktywnej choroby
- Wystąpienie/zaostrzenie niewydolności szpiku kostnego
- Wyraźne (>10 cm) lub postępujące powiększenie węzłów chłonnych
- Wyraźna (>6 cm) lub postępująca splenomegalia
- Postępująca limfocytoza (u pacjentów z >30 000 limfocytów/mcl)
- >50% wzrost w ciągu dwóch miesięcy
- czas podwojenia liczby limfocytów <6 miesięcy
- Objawy ogólne
- utrata masy ciała (>10%) w ciągu ostatnich sześciu miesięcy
- gorączka >38°C przez ponad dwa tygodnie
- nocne poty
- wyraźne zmęczenie
- Niedokrwistość autoimmunologiczna lub małopłytkowość oporne na leczenie steroidami
Ocena sukcesu leczenia
- Patrz tabela Przewlekła białaczka limfocytowa, kryteria remisji.
Strategia leczenia
- Jeśli to możliwe, leczenie należy prowadzić w ramach badań klinicznych.
- Wskazania do leczenia i wybór konkretnej metody leczenia stoją na pierwszym planie.
- klasyfikacja zaawansowania klinicznego wg Bineta i objawy kliniczne
- sprawność fizyczna i choroby współistniejące – klasyfikacja według Cumulative Illness Rating Scale CIRS (14 kategorii dotyczących poszczególnych układów i organów, skala 0–44):
- dobry stan ogólny („go go”), CIRS ≤6
- upośledzenie wydolności fizycznej („slow go”), CIRS >6
- zły stan ogólny („no go”)
- cytogenetyczne i molekularne genetyczne czynniki ryzyka (zwłaszcza del(17p), mutacja genu TP53).
- Wiek również odgrywa rolę, a granica wieku dla niektórych schematów leczenia wynosi 65 lat; obecnie to kryterium schodzi na dalszy plan.
- Wybór leczenia powinien opierać się na chorobach współistniejących, a w mniejszym stopniu na wieku kalendarzowym.
- Zmiany w intensywności leczenia wcześniej i obecnie:
- wcześniej: stopniowe zwiększanie dawki leku w celu dopasowania do przebiegu choroby
- obecnie: leczenie, które od samego początku jest tak skuteczne, jak to tylko możliwe.
Stosowane substancje
- Leki o ugruntowanej pozycji przy leczeniu CLL to:
Leki chemioterapeutyczne
- Chlorambucyl (leki alkilujące).
- Bendamustyna (leki alkilujące).
- Fludarabina (analogi puryn).
- Cyklofosfamid (leki alkilujące).
Przeciwciała
- Rytuksymab (przeciwciało anty-CD 20).
- Obinutuzumab (przeciwciało anty-CD 20).
- Alemtuzumab (przeciwciało anty-CD52).
Substancje celowe (leki ukierunkowane molekularnie)
- Ibrutynib (inhibitor kinazy tyrozynowej.
- Idelalizyb (inhibitor PI3K).
- Wenetoklaks (inhibitor Bcl-2).
Leczenie pierwszej linii2
Dobry stan ogólny („go go”)
- Bez del(17p)/ mutacji TP53
- schemat FCR: fludarabina, cyklofosfamid, rytuksymab4, schemat BR w przypadku podejrzenia u pacjentów w wieku >65: bendamustyna5, rytuksymab
- Toksyczność schematu BR jest mniejsza niż schematu FCR.6
- Z del(17p) / mutacją genu TP53
- ibrutynib7
- wenetoklaks8 lub idelalizyb + rytuksymab (w przypadku przeciwwskazań dotyczących ibrutynibu).
Upośledzenie wydolności fizycznej („slow go”)
- Bez del(17p)/ mutacji TP53
- chlorambucyl + obinutuzumab lub
- ibrutynib.
- Z del(17p)/ mutacją genu TP53
- ibrutynib
- w przypadku przeciwwskazań do stosowania ibrutynibu: wenetoklaks, Idelalizyb + rytuksymab.
Zły stan ogólny („no go”)
- Leczenie wspomagające.
- W indywidualnych przypadkach również leki przeciwnowotworowe ze steroidami, chlorambucylem, bendamustyną, ibrutynibem, wenetoklaksem lub przeciwciałami anty-CD20.
Leczenie drugiej linii
- Wystąpienie nawrotu zdefiniowane przez:
- nawrót powiększonych węzłów chłonnych lub
- wzrost liczby limfocytów >5 × 109/l (>5000/mcl)
- Prawdopodobnie również z powodu nacieku szpiku kostnego niedokrwistość, małopłytkowość, lub neutropenia jako oznaka nawrotu.
- Leczenie drugiej linii również najlepiej w ramach badań klinicznych.
- Przed rozpoczęciem leczenia nawrotu ponowna diagnoza pod kątem genetycznych czynników ryzyka
- W przypadku późnych nawrotów >3 lat po leczeniu pierwszej linii możliwe jest powtórzenie leczenia pierwszej linii (jeśli nie wystąpiła nowa aberracja TP53).
- ibrutynib
- idelalizyb9 + rytuksymab
- wenetoklaks + rytuksymab
- W przypadku wczesnych nawrotów <3 lat po leczeniu pierwszej linii należy przejść na inne opcje leczenia.
Allogeniczny przeszczep komórek macierzystych
- Dzięki nowym opcjom dotyczącym leczenia allogeniczny przeszczep komórek macierzystych jest obecnie rzadkością.2
- Opcja w sytuacjach podwyższonego ryzyka, np. oporność na chemioimmunoterapie.
Opieka paliatywna
- Leczenie bólu.
- Nudności i wymioty.
- Zaparcia.
- Złośliwa niedrożność przewodu pokarmowego.
- Suchość błony śluzowej jamy ustnej.
- Niedożywienie i odwodnienie.
- Dolegliwości oddechowe.
- Depresja.
- Lęk.
- Majaczenie.
Przebieg, powikłania i rokowanie
Powikłania
- Infekcje
- w przebiegu choroby często występują powikłania infekcyjne (spadek stężenia immunoglobulin, dalsze mechanizmy nabytego niedoboru odporności).
- W pewnych warunkach (ciężkie, nawracające infekcje, nieskuteczne leczenie przeciwbakteryjna) można rozważyć profilaktyczne podawanie immunoglobulin.
- Autoimmunologiczne obniżenie ilości elementów morfotycznych krwi
- Obejmuje autoimmunologiczną niedokrwistość hemolityczną, małopłytkowość autoimmunologiczną, niedokrwistość układu czerwonokrwinkowego (Pure Red Cell Anemia, i autoimmunologiczną neutropenię.
- Opcje leczenia
- przede wszystkim glikokortykosteroidy, immunoglobuliny
- rytuksymab, leki immunosupresyjne
- splenektomia.
- Przejście do chłoniaka o wysokim stopniu złośliwości z niekorzystnym rokowaniem (transformacja Richtera).
- Wtórne nowotwory złośliwe
- ryzyko wzrasta od 2 do 7 razy.
Przebieg i rokowanie
- Najważniejszy dla oceny rokowania jest klasyczny stopień zaawansowania z następującymi wartościami mediany przeżycia:
- stopień A wg Bineta: >11,5 roku
- stopień B wg Bineta: >8,6 roku
- stopień C wg Bineta: 7 lat.
- Ocenę rokowania można wykorzystać do oceny przebiegu choroby, ponieważ w ramach jednego stadium klinicznego mogą występować różne przebiegi.
- W międzynarodowym indeksie prognostycznym CLL-IPI uwzględniono różne kliniczne i molekularne zmienne biologiczne:
- delecja lub mutacja TP53: 4 punkty
- IGHV bez mutacji: 2 punkty
- beta-2-mikroglobulina w surowicy >3,5 mg/l: 2 punkty
- stopień zaawansowania klinicznego wg Bineta B–C: 1 punkt
- wiek >65 lat: 1 punkt.
- Na podstawie CLL-IPI całkowite przeżycie po pięciu latach przedstawia się następująco:
- niskie ryzyko (punkty: 0–1): 93%
- średnie ryzyko (punkty: 2–3): 79%
- wysokie ryzyko (punkty: 4–6): 63%
- bardzo wysokie ryzyko (punkty: 7–10): 23,3%.
Dalsze postępowanie
- Lekarz podstawowej opieki zdrowotnej i specjalista hematolog w porozumieniu z ośrodkiem hematologicznym.
- Badania kontrolne należy przeprowadzać w odstępach 3–6 miesięcy:
- morfologia krwi, CRP, (badanie LDH niedostępne w POZ)
- badanie węzłów chłonnych, wątroby i śledziony
- Badania radiologiczne z użyciem TK/RM u pacjentów w fazie remisji zwykle nie są konieczne.
- Szczególną uwagę należy zwrócić na:
- infekcje
- występowanie cytopenii autoimmunologicznych
- gwałtowne powiększenie węzłów chłonnych
- objawy B lub podwyższenie stężenia LDH (mogą wskazywać na nawrót, transformację w chłoniaka o wysokim stopniu złośliwości = zespół Richtera).
- szczepienia (najlepiej przed rozpoczęciem leczenia)
- grypa
- pneumokoki
- Haemophilus influenzae typu B,
- COVID-19
- półpasiec.
Informacje dla pacjentów
O czym należy poinformować pacjentów?
- Pomimo rozpoznania „białaczki” osoby nią dotknięte mogą prowadzić normalne życie przez wiele lat.
Informacje dla pacjentów w Medibas
- Przewlekła białaczka limfocytowa.
- Leczenie raka, leki.
- Jedzenie w przypadku utraty apetytu – wskazówki żywieniowe.
Leczenie paliatywne przy zaawansowanej chorobie nowotworowej
- Opieka paliatywna.
- Lęk.
- Nudności i wymioty.
- Zaparcia.
- Dolegliwości jamy ustnej.
- Dolegliwości oddechowe.
- Utrata masy ciała przy chorobie nowotworowej.
- Depresja.
- Majaczenie.
Ilustracje
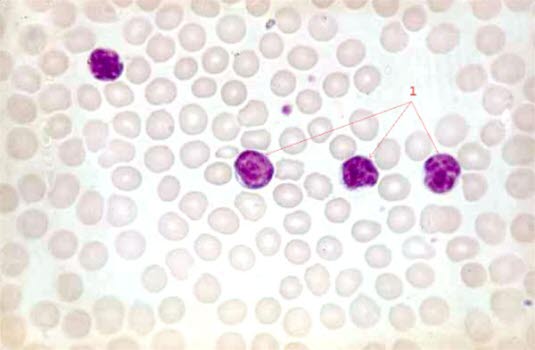
Rozmaz krwi u pacjentów z przewlekłą białaczką limfocytową (40-krotne powiększenie)
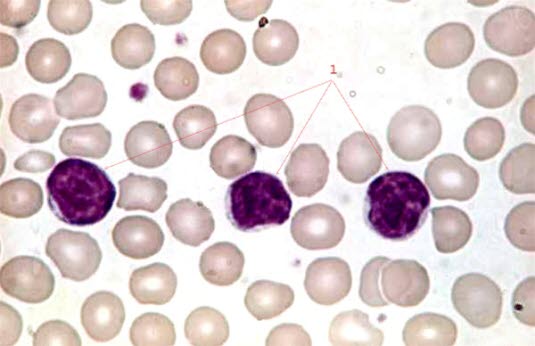
Rozmaz krwi u pacjentów z przewlekłą białaczką limfocytową (100-krotne powiększenie)
Źródła
Wytyczne
- European Society for Medical Oncology. Chronic Lymphocytic Leukaemia: Clinical Practice Guidelines for diagnosis, treatment and follow-up. Stan na 2020. www.esmo.org
Piśmiennictwo
- Eichhorst B, Robak T, Montserrat E, et al. Chronic Lymphocytic Leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2021; 32: 23-33. doi:10.1016/j.annonc.2020.09.019 DOI
- von Tresckow J, Eichhorst B, Bahlo J, et al. The treatment of chronic lymphatic leukemia. Dtsch Arztebl Int 2019; 116: 41-46. doi:10.3238/arztebl.2019.0041 DOI
- Chisti M. Chronic Lymphocytic Leukemia (CLL). Medscape, updated Oct 02, 2020. Zugriff 20.02.21. emedicine.medscape.com
- Hallek M, Fischer K, Fingerle-Rowson G, et al.. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet 2010; 376: 1164-74. pubmed.ncbi.nlm.nih.gov
- Vidal L, Gafter-Gvili A, Gurion R, et al. Bendamustine for patients with indolent B cell lymphoid malignancies including chronic lymphocytic leukaemia. Cochrane Database of Systematic Reviews 2012, Issue 9. Art. No.: CD009045. pubmed.ncbi.nlm.nih.gov
- Eichhorst B, Fink AM, Bahlo J et al. First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial. Lancet Oncol 2016 Jul; 17(7): 928-942. pmid:27216274 PubMed
- Byrd JC, Brown JR, O`Brien S, et al. Ibrutinib versus Ofatumumab in Previously Treated Chronic Lymphoid Leukemia. N Engl J Med 2014 May 31. www.nejm.org
- Jain N, Keating M, Thompson P et al. Ibrutinib and Venetoclax for First-Line Treatment of CLL. N Engl J Med 2019; 380: 2095-2103. pmid:31141631. www.ncbi.nlm.nih.gov
- Furman R, M.D., Sharman J, Coutre S, et al. Idelalisib and Rituximab in Relapsed Chronic Lymphocytic Leukemia. N Engl J Med 2014; 370: 997-1007. doi:10.1056/NEJMoa1315226 DOI
Autorzy
- Sławomir Chlabicz (redaktor)
- Michael Handke, prof. dr. n. med., specjalista chorób wewnętrznych, kardiologii i intensywnej opieki medycznej, Fryburg Bryzgowijski
