Streszczenie
- Definicja: Migotanie przedsionków (atrial fibrilation – AF) to tachyarytmia nadkomorowa, którą charakteryzuje nieskoordynowana aktywność przedsionków o częstotliwości 350–700/min. Przy częstotliwości aktywności przedsionków w zakresie 250–350/min. mamy do czynienia z trzepotaniem przedsionków (AFl). Migotanie może być wyzwalane przez strukturalną chorobę serca, chorobę ogólnoustrojową, zaburzenia elektrolitowe i inne przyczyny, jednakże u 20–30% pacjentów nie udaje się jednoznacznie ustalić etiologii. Migotanie przedsionków można zaklasyfikować jako: rozpoznane po raz pierwszy, napadowe, przetrwałe, długotrwale przetrwałe lub utrwalone.
- Epidemiologia: Częstość występowania u dorosłych na świecie to 2–4%. Prawdopodobieństwo wystąpienia migotania przedsionków wzrasta z wiekiem; częstość występowania w grupie wiekowej powyżej 65 lat wynosi ponad 10%.
- Objawy: Brak objawów lub nieregularny rytm serca, kołatanie serca, duszność, zmęczenie, zawroty głowy lub omdlenia.
- Badanie fizykalne: Nieregularne tętno, deficyt tętna.
- Diagnostyka: EKG spoczynkowe, w razie potrzeby monitorowanie EKG metodą Holtera.
- Leczenie: Kontrola częstotliwości rytmu ma na celu zmniejszenie objawów klinicznych. W zależności od sytuacji klinicznej można również podjąć próbę przywrócenia rytmu zatokowego (umiarowienia). Wskazania do antykoagulacji w zależności od ryzyka powikłań zakrzepowo-zatorowych, w tym udaru mózgu (skala CHA2DS2–VA).
Informacje ogólne
Definicja
Migotanie przedsionków (atrial fibrillation - AF)
- Migotanie przedsionków jest schorzeniem przewlekłym, przy czym napadowe migotanie przedsionków często przechodzi w przetrwałe i w końcu w utrwalone migotanie przedsionków.
- Charakteryzuje się nieskoordynowaną aktywacją przedsionków o częstotliwości 350–700/min. i całkowicie nieskoordynowanym przewodzeniem AV, prowadząc w rezultacie do utraty efektywności hemodynamicznej skurczu przedsionków i niemiarowej pracy komór.1
- Częstość akcji komór jest nieregularna, zwykle od 80 do 150/min., ale może wzrosnąć do 200/min., zwłaszcza w rozpoznanym po raz pierwszy migotaniu przedsionków.
- Kliniczny podział migotania przedsionków:
- Rozpoznane po raz pierwszy
- AF, które nie było rozpoznawane nigdy wcześniej, niezależnie od czasu jego trwania oraz występowania i nasilenia objawów związanych z AF.
- Napadowe
- Trwa do 7 dni, często ustępuje samoistnie, zwykle w ciągu 1–2 dni.
- Napadowe migotanie przedsionków, które zostało poddane kardiowersji w ciągu 7 dni, jest także uważane za napadowe.
- Przetrwałe
- AF utrzymujące się nieprzerwanie przez >7 dni, w tym epizody przerwane kardiowersją (farmakologiczną lub elektryczną) po ≥7 dniach.
- Nie ustępuje samoistnie, ale może zostać umiarowione do rytmu zatokowego.
- Utrwalone
- Kardiowersja elektryczna ani farmakologiczna nie przynosi rezultatów.
- AF zostało zaakceptowane przez pacjenta i lekarza i zrezygnowano z prób przywrócenia rytmu zatokowego.
- Rozpoznane po raz pierwszy
- Termin "długotrwale przetrwałe migotanie przedsionków" odnosi się do sytuacji, w której AF trwa ciągle przez >12 miesięcy, jednak próby przywrócenia rytmu zatokowego wciąż są rozważane jako możliwa opcja terapeutyczna..
- Migotanie przedsionków może być objawowe lub bezobjawowe.
- Pojęcie subklinicznego AF obejmuje AHRE potwierdzone jako epizody AF, trzepotanie przedsionków (atrial flutter – AFl) lub częstoskurcz przedsionkowy (atrial tachycardia – AT) lub epizody AF wykryte za pomocą wszczepialnych rejestratorów arytmii lub zewnętrznych urządzeń monitorujących, z wizualnym potwierdzeniem zapisów elektrokardiograficznych.
- Kliniczne rozpoznanie opiera się na stwierdzeniu w zapisie EKG niemiarowości zupełnej z nieregularnymi pobudzeniami przedsionków (często widocznymi jako fala F) i nierównymi odstępami RR bez widocznych załamków P, poprzedzających zespoły QRS. Do rozpoznania AF wymagane jest udokumentowanie jego obecności w zapisie EKG o czasie trwania ≥30 sekund.2
Trzepotanie przedsionków (atrial flutter – AFI)3
- Jest to tachyarytmia, w której przedsionek kurczy się od 250 do 350 razy na minutę.
- W nieleczonym trzepotaniu przedsionków często występuje stały blok AV 2:1; rzadziej blok AV 3:1 lub blok naprzemienny.
- Blok AV 2:1 powoduje, że regularna częstość komór/tętno wynosi około 150/min.
- Leki zmniejszające częstotliwość pracy serca mogą powodować naprzemienny blok AV (2:1, 3:1 i 4:1) i nieregularną akcję komór.
Epidemiologia
- Trzepotanie przedsionków jest jedną z najczęstszych tachyarytmii przedsionkowych.
- Częstość występowania migotania przedsionków szacowana jest średnio na 2–4 % populacji i rośnie wraz z wiekiem.5
- W badaniu niemieckim częstość występowania migotania przedsionków rosła z wiekiem w większym stopniu u mężczyzn – z 0,7% w przedziale wiekowym 35–44 lat do 10,6% w przedziale wiekowym 65–74 lata.7
- W badaniu brytyjskim8 u pacjentów z migotaniem przedsionków przyjętych do szpitala w trybie pilnym stwierdzono:
- chorobę niedokrwienną serca u 33%
- niewydolność serca u 24%
- nadciśnienie u 26%
- chorobę reumatyczną serca u 7%.
- Migotanie przedsionków często występuje również w okresie pooperacyjnym, zwłaszcza po zabiegach kardiochirurgiczych.9
Etiologia i patogeneza
- Migotanie przedsionków to tachyarytmia nadkomorowa, która charakteryzuje się nieskoordynowaną aktywacją elektryczną przedsionków i w konsekwencji ich nieskutecznym hemodynamicznie skurczem.10
- Migotanie przedsionków często związane jest z innymi chorobami układu krążenia takimi jak:
- nadciśnienie tętnicze i przerost lewej komory serca (LVH)
- choroba wieńcowa
- strukturalna choroba serca, kardiomiopatie, wady zastawek
- niewydolność serca, zapalenie mięśnia sercowego.
- Niekardiologiczne czynniki ryzyka migotania przedsionków:
- nadczynność tarczycy
- cukrzyca i stan przedcukrzycowy
- hipowolemia, np. przy zakażeniach
- otyłość
- przewlekłe nadużywanie alkoholu
- przewlekła obturacyjna choroba płuc (POChP)
- obturacyjny bezdech senny
- przewlekła choroba nerek
- brak aktywności fizycznej lub intensywna aktywność fizyczna.
- Istotne mogą być również czynniki genetyczne.11
Patofizjologia12
- Migotanie przedsionków jest spowodowane między innymi licznymi, niewielkimi elektrycznymi falami nawrotnego pobudzenia w przedsionkach. Pobudzenie krąży w przedsionkach powoli, napotyka tkankę pobudliwą wielokrotnie.
- Fale te są wywołane przez wyzwalacze elektryczne, głównie w obszarach mięśnia sercowego rozciągających się od lewego przedsionka do proksymalnych 5–6 cm żył płucnych.13
- Innymi czynnikami, które mogą przyczynić się do rozwoju migotania przedsionków, są na przykład aktywacja układu renina – angiotensyna – aldosteron, przeciążenie hemodynamiczne lub włóknienie przedsionków.14
- Migotanie przedsionków powoduje początkowo zmiany elektrofizjologiczne (tzw. „remodeling elektryczny"), a następnie zmiany strukturalne obejmujące zwłóknienie wywołane rozciąganiem, zmniejszoną kurczliwość, powstawanie nacieków tłuszczowych, miejscowy stan zapalny, przebudowę naczyń, niedokrwienie, dysfunkcję kanałów jonowych oraz zaburzenia równowagi wapniowej (tzw. „remodeling anatomiczny"), które w konsekwencji podtrzymują migotanie.14
- Jeśli migotanie przedsionków jest związane z szybką częstością komór, może to również prowadzić do poszerzenia komór i ostatecznie osłabienia ich funkcji skurczowej, co zwykle określane jest mianem „kardiomiopatii indukowanej tachykardią” lub „kardiomiopatii tachyarytmicznej”.
- Ze względu na remodeling towarzyszący przedłużającemu się migotaniu przedsionków, kardiowersja staje się trudniejsza.
Konsekwencje patofizjologiczne
- Ze względu na wysoką częstotliwość akcji przedsionka nie ma już istotnego skurczu przedsionka. Powoduje to zmniejszenia pojemności minutowej czyli rzutu serca nawet o 15%. Ponieważ węzeł AV przekazuje tylko część pobudzenia przedsionkowego, prowadzi to także do nieregularnej pracy komór.
- Może to prowadzić do dławicy piersiowej lub niewydolności serca.
- Migotanie przedsionków jest prawdopodobnie przyczyną około 25% wszystkich udarów zatorowych.15
Czynniki predysponujące
- Choroby układu krążenia
- Przede wszystkim nadciśnienie tętnicze, choroba wieńcowa, niewydolność serca lub choroba zastawkowa serca, kardiomiopatie.
- Inne choroby predysponujące
- Nadczynność tarczycy, cukrzyca, przewlekła choroba płuc, obturacyjny bezdech senny, przewlekła choroba nerek, choroby zapalne.
- Inne czynniki wyzwalające
- Ostre i przewlekłe nadużywanie alkoholu
- Spożywanie alkoholu powyżej 10 jednostek (1 jednostka – 10 g alkoholu etylowego) tygodniowo wiąże się ze zwiększoną częstością występowania i przedłużonym czasem trwania napadowego migotania przedsionków.16
- Inne ostre choroby, stan po operacjach, leki z substancjami bronchodylatacyjnymi.
- Palenie tytoniu
- Nadwaga/otyłość17
- Mała aktywności fizycznej lub jej brak17
- Ostre i przewlekłe nadużywanie alkoholu
ICD–10
- I48 Migotanie i trzepotanie przedsionków.
Diagnostyka
Kryteria diagnostyczne
- EKG wykazuje nieregularne odstępy RR (niemiarowość zupełna), brak załamków P (zastąpione falą f), a czynność pracy komór jest nieregularna.
- Tętno w czasie migotania ma nieregularny rytm i zmienną amplitudę.
- Tętno w czasie trzepotania może być regularne, ale jest szybkie.
- Rozpoznanie stawia się na podstawie spoczynkowego EKG lub 24–godzinnego monitorowania EKG metodą Holtera, ewentualnie przedłużonych zapisów w przypadku napadowego migotania przedsionków. Minimalny czas trwania zapisu EKG z AF wymagany do ustalenia rozpoznania klinicznego AF w przypadku 12 odprowadzeniowego zapisu wynosi 10 sekund, a w przypadku jedno- lub wielodprowadzeniowych zapisów ≥30 sekund.17
Diagnostyka różnicowa
- Inne arytmie.
- Dodatkowe pobudzenia.
Wywiad
- Nie wszyscy pacjenci odczuwają objawy migotania przedsionków.
- Objawy zależą przede wszystkim od częstości akcji komór: im szybsza, tym wyraźniejsze dolegliwości.
- Typowe są następujące objawy:
- kołatanie serca
- obniżona tolerancja wysiłku
- duszność
- ból w klatce piersiowej
- wyczerpanie, zmęczenie
- wzmożona potliwość, niepokój
- zawroty głowy, omdlenia i zasłabnięcia.
- Pacjenci z utrwalonym migotaniem często mają mniej nasilone objawy.
- Trzepotanie przedsionków jest zwykle napadowe i trwa od kilku sekund do kilku godzin, czasem przez kilka dni lub nawet dłużej.
- U pacjentów z napadowym migotaniem częste są epizody migotania przedsionków przebiegające bez objawów podmiotowych.
Dodatkowy wywiad chorobowy
- Czy objawy występują przez cały czas czy jedynie okresowo?
- Czy istnieją czynniki ryzyka?
- Aktywność fizyczna, spożywanie alkoholu, zakażenia, palenie papierosów.
- Choroby podstawowe?
- Choroba serca, nadciśnienie, cukrzyca, hipertyreoza, choroba płuc, obturacyjny bezdech senny.
- Ewentualne wcześniejsze epizody zakrzepowo–zatorowe w wywiadzie?
- Stosowanie leków, nadużywanie leków, spożywanie alkoholu?
Badanie fizykalne
Ocena tętna
- Szybkie i nieregularne tętno, często w zakresie 100–200/min., deficyt tętna.
- W przypadku trzepotania przedsionków z przewodzeniem 2:1, często regularne tętno, około 150/min.
Osłuchiwanie
- Nieregularny rytm (niemiarowość zupełna).
- Różna intensywność pierwszego tonu serca.
Inne istotne czynniki
- Ogólny stan fizyczny?
- Wartości ciśnienia tętniczego w pomiarach domowych i gabinetowych?
- Objawy zastoju w krążeniu płucnym, częstość oddechów?
- Poszerzenie żył szyjnych, przekrwienie wątroby, obecność obrzęków obwodowych?
Badania uzupełniające w praktyce lekarza rodzinnego
EKG w migotaniu przedsionków
- Brak załamków P przed każdym zespołem QRS – zastąpione falą f (migotania), są one niemiarowe i o zmiennej morfologii; zwykle najwyraźniej widoczne w odprowadzeniu V1, V2.
- Częstotliwość fal f migotania najczęściej powyżej 350/min.
- Całkowicie niemiarowy rytm zespołów QRS.
- Ewentualnie cechy przerostu lewej komory (LVH), oznaki przebytego niedokrwienia lub inne zaburzenia przewodzenia
- Lista kontrolna EKG.
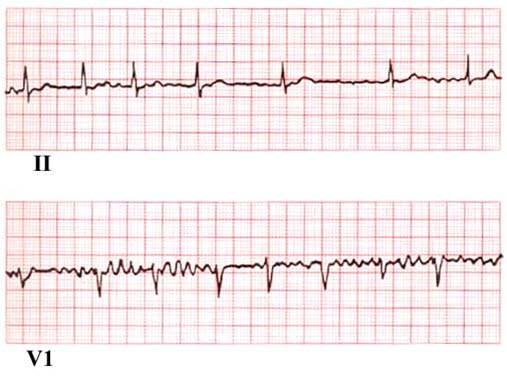
EKG przy migotaniu przedsionków
EKG w trzepotaniu przedsionków
- Fale trzepotania (fala F), „zęby piły” – fale F są miarowe i mają tę samą morfologię, w odprowadzeniach II, III, aVF dwufazowe.18
- Brak linii izoelektrycznej między falami F w odprowadzeniach kończynowych.
- W trzepotaniu przedsionków z przewodzeniem 2:1, częstość rytmu komór jest regularna, często wynosi około 150/min. – jednak fale trzepotania mogą być trudne do wykrycia.
- Stosunek częstości akcji przedsionków i komór może wahać się od 2:1, 3:1 do 4:1.
- Częstość akcji przedsionków wynosi 250–350/min.
- Różnicowanie rodzajów trzepotania przedsionków:
- Typowe (zależne od cieśni żylno–trójdzielnej, reentry w kierunku przeciwnym do ruchu wskazówek zegara) – dominują ujemne fale F w odprowadzeniach II, III, aVF, V6, dodatnie w V1.
- Typowe odwrócone (zależne od cieśni żylno–trójdzielnej, reentry w kierunku zgodnym z ruchem wskazówek zegara) – dominują dodatnie fale F w odprowadzeniach II, III, aVF, V6, ujemne w V1.
- Atypowe – obrazy EKG mniej charakterystyczne, często powstaje w lewym przedsionku, zwykle o częstości >240/min., ale morfologia zapisu nie spełnia kryteriów typowego i typowego odwróconego AFl.
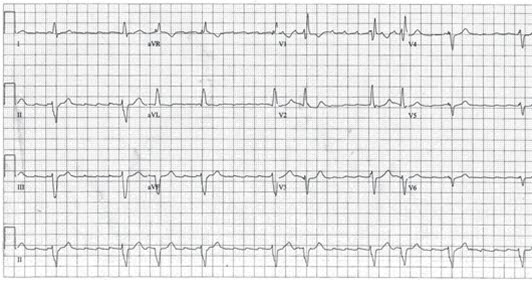
EKG przy trzepotaniu przedsionków
Badania laboratoryjne
- Istotne badania: Hb, glukoza na czczo, TSH, Na, K, w razie potrzeby Ca, kreatynina.
Badania przesiewowe w kierunku AF
- Aktywne poszukiwanie AF u bezobjawowych pacjentów niesie za sobą potencjalne ryzyka i korzyści.
- Ryzyko związane z badaniami przesiewowymi w kierunku AF obejmuje między innymi:
- niepokój pacjenta wywołany odchyleniami w wynikach badań
- niepotrzebna dalsza diagnostyka w przypadku wyników fałszywie dodatnich i związane z nimi potencjalne szkody, wynikające z możliwych powikłań.
- Identyfikacja bezobjawowych przypadków AF i wdrożenie odpowiedniego postępowania może potencjalnie zapobiec:
- udarowi mózgu
- zatorowości układowej
- mechanicznej i elektrycznej przebudowie przedsionków i komór włącznie z rozwojem kardiomiopatii tachyarytmicznej
- niepotrzebnej hospitalizacji
- zgonom związanym z konsekwencjami AF.
- Wytyczne Europejskiego Towarzystwa Kardiologicznego17 zalecają wykonywanie badań przesiewowych w kierunku AF migotania przedsionków, z uwzględnieniem:
- oceny tętna
- wykonania badania EKG, np.:
- klasyczne, 12-odprowadzeniowe
- Holter (24h, tygodniowy lub dłuższy, jeśli konieczne)
- TM-EKG (podczas hospitalizacji - telemetria wewnątrzszpitalna)
- przy użyciu urządzeń przenośnych lub wszczepialnych rejestratorów pętlowych
Diagnostyka specjalistyczna
Echokardiografia
- Echokardiografia powinna być wykonana u wszystkich pacjentów ze świeżo rozpoznanym migotaniem przedsionków w celu poszukiwania choroby serca leżącej u podłoża AF i oceny ryzyka jego nawrotu po kardiowersji.
- Echokardiografia przezprzełykowa jest badaniem koniecznym w celu wykluczenia obecności skrzeplin w przedsionkach przed kardiowersją12, jeśli u pacjentów z migotaniem przedsionków trwającym >48 godzin bez stosowania wcześniejszej odpowiedniej antykoagulacji planowane jest przeprowadzenie kardiowersji (farmakologicznej lub elektrycznej).
- W przypadku wykrycia skrzeplin w przedsionkach, przed kardiowersją konieczne jest zastosowanie leczenia przeciwkrzepliwego przez ≥3 tygodnie przed kardiowersją i 4 tygodnie po.
- Należy również wykonać badanie echokardiograficzne w celu ewentualnych wykrycia/wykluczenia chorób strukturalnych serca i innych zaburzeń (wady serca, wady zastawkowe, kardiomiopatia).
Długotrwałe monitorowanie EKG metodą Holtera
- W przypadku objawów arytmii i prawidłowego wyniku spoczynkowego EKG.
- W celu oceny zmian częstotliwości napadów/epizodów arytmii w ciągu doby.
- Do wykrywania napadów podczas wysiłku fizycznego.
- W razie potrzeby – aby ustalić związek między częstością akcji serca a objawami.
Próba wysiłkowa EKG
- Należy rozważyć w przypadku:
- konieczności oceny objawów wywołanych przez aktywność fizyczną
- w razie podejrzenia choroby wieńcowej
- przed rozpoczęciem stosowania leków antyarytmicznych klasy Ic.
Badanie elektrofizjologiczne (EPS)
- W przypadku współistnienia migotania przedsionków z zespołem WPW lub innymi formami preekscytacji.
- U pacjentów, u których istnieje podejrzenie, że migotanie jest związane z innymi zaburzeniami przewodnictwa wewnątrzsercowego.
Badania obrazowe
- W przypadku podejrzenia choroby wieńcowej badanie angio–CT tętnic wieńcowych lub koronarografia.
- Przy podejrzeniu udaru mózgu CT lub MRI mózgowia.
- Rezonans magnetyczny serca (cardiac magnetic resonance – CMR) może być przydatny w celu przeprowadzenia oceny uszkodzenia i żywotność mięśnia sercowego.
Skierowanie do specjalisty/szpitala
- Skierowanie do specjalisty lub hospitalizacja są zalecane po wykryciu pierwszego epizodu migotania przedsionków.
- W celu poszerzenia diagnostyki.
- W celu rozważenia strategii leczenia (przywrócenie rytmu zatokowego lub kontrola częstotliwości rytmu komór).
- Pilność zależy od czasu trwania napadów i objawów występujących u pacjenta.
- Krótki czas trwania napadów (pewny czas trwania napadu <48 h)
- Natychmiastowe skierowanie do szybkiej kardiowersji po podaniu heparyny.
- Czas trwania napadów >48 godzin i wyraźne objawy
- W przypadkach wymagających pilnej kardiowersji, konieczne wykonanie przezprzełykowego badania echokardiograficznego w celu wykluczenia obecności skrzepliny w lewym przedsionku.
- Czas trwania napadów >48 godzin i skąpe objawy
- Skierowanie do ambulatoryjnej oceny echokardiograficznej.
- Kardiowersja może być wskazana po odpowiednim leczeniu przeciwkrzepliwym.
- Krótki czas trwania napadów (pewny czas trwania napadu <48 h)
Lista kontrolna dotycząca skierowania
Migotanie i trzepotanie przedsionków
- Cel skierowania
- Diagnostyka potwierdzająca? Rozpoczęcie leczenia przeciwkrzepliwego lub antykoagulacja już rozpoczęta?
- Wywiad
- Początek i czas trwania arytmii? Utrwalone, nawracające objawy? Zmiana ich intensywności w czasie?
- Czas trwania napadów? Możliwe czynniki ryzyka: lęk? Objawy towarzyszące: trudności w oddychaniu, ból w klatce piersiowej, zawroty głowy, omdlenia?
- Choroby towarzyszące? Predyspozycje rodzinne?
- Czy przeprowadzono jakieś działania lecznicze i jaki był ich efekt?
- Przyjmowane leki?
- Badanie fizykalne
- Ogólny stan fizyczny? Objawy towarzyszące?
- Ciśnienie tętnicze, tętno, objawy zastoju w krążeniu płucnym?
- Badania uzupełniające
- Hb, TSH, elektrolity, kreatynina, ewentualnie HbA1c.
- EKG spoczynkowe (załączyć wynik badania).
Leczenie
Cele leczenia
- Zgodnie z wytycznymi ESC 2024, leczenie pacjenta z migotaniem przedsionków powinno być prowadzone w 4 obszarach (CARE)17:
- Comorbidity - modyfikacja czynników ryzyka i leczenie chorób towarzyszących
- Avoid - unikanie powikłań zakrzepowych, w tym udaru mózgu
- Reduce - redukcja objawów i kontrola rytmu serca
- Evaluate - ocena stanu pacjenta
Ogólne informacje o leczeniu
- Przed rozpoczęciem leczenia należy ustalić typ prezentacji klinicznej migotania przedsionków:
- rozpoznane po raz pierwszy (niezależnie od czasu trwania)
- napadowe: trwa do 7 dni, ustępuje samoistnie lub pod wpływem interwencji, zwykle w ciągu 48 godzin
- przetrwałe: trwające ponad 7 dni lub przerwane przez kardiowersję po 7 dniach
- w tym długotrwale przetrwałe: trwające ponad 12 miesięcy, gdy próba przywrócenia rytmu zatokowego jest wciąż rozważana jako opcja terapeutyczna
- utrwalone: zaakceptowana przez pacjenta i lekarza rezygnacja z prób przywrócenia rytmu zatokowego.
- Ustalenie czas trwania napadu migotania przedsionków ma duże znaczenie praktyczne dla wyboru sposobu leczenia.
- Decyzję co do włączenia leczenia antykoagulacyjnego należy podjąć po ocenie ryzyka powikłań:
- zakrzepowo–zatorowych w tym udaru mózgu – na podstawie skali CHA2DS2–VA 17
- krwotocznych – na podstawie obecności modyfikowalnych i niemodyfikowalnych czynników ryzyka krwawienia. Nie zaleca się wykorzystywania algorytmów (np. skali HAS–BLED) do oceny ryzyka krwawienia, gdyż ich stosowanie może prowadzić do niezasadnego wstrzymania leczenia przeciwkrzepliwego.17
- Zasadniczo zawsze należy leczyć możliwe do zidentyfikowania przyczyny leżące u podstaw AF lub je wywołujące, takie jak:
- zaburzenia elektrolitowe
- zakażenia
- hipertyreoza (nadczynność tarczycy)
- nadciśnienie tętnicze
- objawowa niewydolność serca (klasy NYHA II–IV)
- choroby zastawki serca
- kardiomiopatie
- wrodzone wady serca
- choroba wieńcowa
- cukrzycy
- przewlekła obturacyjna choroba płuc (POChP)
- obturacyjny bezdech senny
- przewlekła niewydolność nerek.
- Należy dokonać wyboru strategii leczenia – dążenie do przywrócenia rytmu zatokowego lub kontrola częstości rytmu komór.
- Początkowo – np. w zależności od nasilenia objawów – można podjąć próbę przywrócenia, a następnie ustabilizowania rytmu zatokowego (kardiowersja elektryczna lub farmakologiczna).
- W wielu przypadkach kontrola rytmu nie może być osiągnięta na dłuższy czas. Wymaga to wówczas zmiany strategii leczenia i dążenie do kontroli częstości rytmu komór.
- W zależności od wieku i istniejących schorzeń towarzyszących, kontrola częstotliwości rytmu komór może okazać się preferowanym postępowaniem od samego początku.
- Migotanie i trzepotanie przedsionków leczy się w ten sam sposób, z pewnymi wyjątkami.
Elementy postępowania terapeutycznego
Modyfikacja czynników ryzyka i leczenie chorób towarzyszących
- Optymalne leczenie chorób podstawowych (nadciśnienie, cukrzyca, choroba wieńcowa, niewydolność serca, obturacyjny bezdech senny.).
- U wszystkich pacjentów z migotaniem przedsionków i cukrzycą zaleca się stosowanie inhibitorów SGLT2.17
- Trwała redukcja masy ciała u osób z nadwagą zmniejsza ryzyko nawrotu migotania przedsionków.20
- U pacjentów ze skurczową dysfunkcją lewej komory lub przerostem lewej komory inhibitory ACE i blokery receptora AT1 (sartany) wykazały potencjał prewencyjny wobec migotania przedsionków.21
- Według metaanalizy leczenie statynami nie zmniejsza częstości występowania migotania przedsionków.22 Jest jednak powszechnie zalecane jako profilaktyka wtórna w przypadku udowodnionej choroby układu sercowo–naczyniowego.
- Podawanie 1 g kwasów tłuszczowych omega–323 lub 4 g kwasów tłuszczowych omega–3 na dobę przez 1 rok24 nie powodowało rzadszych nawrotów migotania u pacjentów z napadowym migotaniem przedsionków.
- Regularne ćwiczenia aerobowe mogą zmniejszyć nasilenie objawów związanych z AF, poprawić jakość życia i wydolność wysiłkową.25
- W małym randomizowanym, kontrolowanym badaniu klinicznym stwierdzono, że daleko idąca abstynencja od alkoholu przez 6 miesięcy u pacjentów regularnie spożywających alkohol, zmniejszyła nawroty migotania przedsionków o prawie 50%.26Aktualne wytyczne zaleceją ograniczenie spożycia alkoholu do ≤ 3 standardowych drinków (≤ 30 g alkoholu) na tydzień.17
Leczenie przeciwkrzepliwe
- Przed podjęciem decyzji o leczeniu przeciwkrzepliwym u pacjentów z potwierdzonym migotaniem przedsionków należy dokonać oceny wskazań w oparciu o skalę CHA2DS2–VA .
- W ocenie ryzyka udaru i powikłań zakrzepowych, nie ma znaczenia typ migotania przedsionków, aby rozpocząć doustną antykoagulację.17
- Doustne leczenie przeciwkrzepliwe należy rozpocząć u każdego pacjenta z migotaniem przedsionków, u którego w skali CHA2DS2-VA uzyskano ≥2 punkty.17
- Niezależnie od uzyskanej punktacji w skali CHA2DS2-Va, doustne leczenie przeciwkrzepliwe należy włączyć u wszystkich pacjentów z migotaniem przedsionków i kardiomiopatią przerostową lub amyloidozą serca.17
- Zwiększone ryzyko krwawienia stanowi silną przesłankę dla wczesnej i częstszej oceny klinicznej oraz podjęcia działań wpływających na modyfikowalne czynniki ryzyka krwawienia (np. labilne poziomy INR, nadciśnienie tętnicze, stosowanie NLPZ, nadużywanie alkoholu), a w rzadkich przypadkach być podstawą decyzji o nie włączeniu leczenia przeciwkrzepliwego.
- W przypadku pacjentów z umiarkowanym lub ciężkim zwężeniem zastawki mitralnej i/lub mechaniczną protezą zastawki serca, dopuszcza się stosowanie tylko antagonistów witaminy K (warfaryna lub acenokumarol).
- U pacjentów z AF bez umiarkowanego lub ciężkiego zwężenia zastawki mitralnej i/lub mechanicznej zastawki serca należy stosować nowe antykoagulanty doustne niebędące antagonistami witaminy K (non–vitamin K antagonist oral anticoagulants – NOAC) jako alternatywę dla antagonistów witaminy K (vitamin K antagonists – VKA).
- W przypadku braku możliwości leczenia NOAC i podjęciu decyzji o leczeniu VKA, należy wówczas utrzymać INR na poziomie 2,0-3,0.17
- Do NOAC zalicza się:
- inhibitor trombiny: dabigatran
- inhibitory czynnika Xa: riwaroksaban, edoksaban, apiksaban.
- Zabiegi przezskórnego zamknięcia uszka lewego przedsionka (Left Atrial Appendage Closure – LAAC) lub jego chirurgicznego wyłączenia (zwykle podczas operacji kardiochirurgicznej z innych przyczyn) można rozważyć jako alternatywną metodę profilaktyki udaru mózgu u pacjentów z AF i przeciwwskazaniami do długotrwałego leczenia przeciwkrzepliwego.
- LAAC należy rozważyć jako terapię wspomagającą leczenie przeciwkrzepliwe w celu zapobiegania zakrzepom i zatorom u pacjentów z migotaniem przedsionków.17
Redukcja objawów i kontrola rytmu serca
Regulacja częstotliwości (rate control)
- Leki kontrolujące częstość akcji serca (częstość rytmu komór)
- Beta–blokery, np. metoprolol, są lekami pierwszego wyboru u wszystkich pacjentów niezależnie od wartości frakcji wyrzutowej lewej komory (left-ventriculare ejection fraction - LVEF).17
- Niedihydropirydynowe blokery kanału wapniowego (werapamil lub diltiazem) są alternatywnym środkiem kontroli częstości u pacjentów, u których nie występuje niewydolność serca (LVEF>40%).17
- Uwaga: w przypadku połączenia beta-blokera i werapamilu ryzyko bloku przedsionkowo–komorowego!
- Amiodaron: pozwala na skuteczną kontrolę częstości w utrwalonym migotaniu przedsionków, ale ma liczne działania niepożądane.
- Stosowany u pacjentów niestabilnych hemodynamicznie lub z poważnie upośledzoną LVEF.17
- Digoksyna: zmniejsza częstość akcji komór w spoczynku, ale nie przy obciążeniu. Konieczna jest regularna kontrola stężenia we krwi.
- Dane dotyczące bezpieczeństwa i skuteczności digoksyny w migotaniu/trzepotaniu przedsionków są niedostateczne, a przy pierwszym przepisaniu i w zależności od stężenia w surowicy obserwowano związek ze zwiększoną śmiertelnością.
Regulacja rytmu (rhythm control)
- Kardiowersja (elektryczna lub farmakologiczna) ma na celu przerwanie migotania przedsionków i przywrócenie rytmu zatokowego. Po jej skutecznym przeprowadzeniu można rozważyć stosowanie leków zapobiegających nowemu napadowi AF.
- Regulacja rytmu jest szczególnie wskazana u młodych pacjentów oraz przy pierwszym wystąpieniu lub nawrocie napadowego migotania przedsionków.
- Kardiowersja migotania przedsionków
- Kardiowersja farmakologiczna lub elektryczna może być wykonana w trybie:
- Ratunkowym – u pacjentów niestabilnych hemodynamicznie (np. wstrząs kardiogenny, obrzęk płuc, niedokrwienie mięśnia serca).
- Planowym – natychmiastowo lub z opóźnieniem – u pacjentów stabilnych hemodynamicznie.
- Zabieg wymaga efektywnego leczenia przeciwkrzepliwego (z INR >2,0 w przypadku stosowania VKA) w ciągu ostatnich 3 tygodni lub echokardiografii przezprzełykowej w celu wykluczenia skrzeplin w lewym przedsionku.
- Kardiowersja farmakologiczna lub elektryczna może być wykonana w trybie:
- Profilaktyka napadów
- Należy zoptymalizować leczenie chorób podstawowych.
- Wybór jakiegokolwiek leku w profilaktyce napadów zależy między innymi od chorób współistniejących i nasilenia objawów.
- Wszystkie wskazane leki mają różny stopień ryzyka wywołania ciężkich komorowych zaburzeń rytmu (działanie proarytmiczne). Wybór metody profilaktyki napadów powinien być zatem dokonany w porozumieniu z kardiologiem.27
- Stosowane leki antyarytmiczne17:
- Amiodaron: może stabilizować rytm zatokowy, ale ma liczne działania niepożądane; pierwszy wybór w przypadku strukturalnej choroby serca, niewydolności serca ze zmniejszoną frakcją wyrzutową lub choroby wieńcowej. Przeciwwskazany w bradykardii zatokowej, bloku AV II i III stopnia oraz zatokowo–przedsionkowym, zespole chorego węzła zatokowego, a także w okresie ciąży i karmienia piersią.
- Dronedaron: jest zalecany u pacjentów wymagających długotrwałej kontroli rytmu, w tym u pacjentów z niewydolnością serca z łagodnie zmniejszoną i zachowaną frakcją wyrzutową, chorobą niedokrwienną serca lub strukturalną chorobą serca.
- Flekainid lub propafenon: przeciwwskazane w strukturalnej chorobie serca, niewydolności serca z upośledzoną funkcją skurczową lewej komory, przerostem lewej komory i chorobie wieńcowej.
- U pacjentów leczonych flekainidem lub propafenonem, można rozważyć jednoczesne stosowanie beta-blokerów, diltiazemu lub werapamilu, aby zapobiec przejściu w trzepotanie przedsionków z przewodzeniem 1:1.
- Zabieg ablacji za pomocą cewnika (ablacja prądem o częstotliwości radiowej albo krioablacja) jest alternatywą w zapobieganiu nowym napadom migotania przedsionków, zwłaszcza w przypadku znacznych dolegliwości i jeśli nie można uzyskać wystarczającej poprawy w zakresie kontroli objawów za pomocą co najmniej jednego leku przeciwarytmicznego klasy I i III.
- Wiele pytań dotyczących tej opcji pozostaje jeszcze bez odpowiedzi. W szczególności wydaje się, że ablacja cewnikowa nie jest lepsza od leczenia zachowawczego. Ponadto badania porównujące obie metody leczenia są nieliczne i o stosunkowo krótkim czasie obserwacji.28
- Danych z badań nie można również łatwo przenosić na grunt rutynowej opieki zdrowotnej, ponieważ wyniki są w zasadniczy sposób zależne od jakości interwencji.
- Ze względu na brak wystarczających danych nie można sformułować zaleceń odnośnie skuteczności zabiegu zamknięcia uszka lewego przedsionka.
Ocena stanu pacjenta
- U pacjenta z noworozpoznanym migotaniem przedsionków, należy po 6 miesiącach po postawieniu rozpoznania, a następnie co najmniej 1 raz w roku, dokonać ponownej oceny internistyczno-kardiologicznej, z wykorzystaniem zwalidowanych skal
- w celu oszacowania ryzyka powikłań zakrzepowo-zatorowych
- w celu oceny ryzyka krwawienia
- Podczas wizyty kontrolnej należy ocenić17:
- pojawienie się nowych czynników ryzyka
- obecność chorób współwystepujących
- ryzyko udaru
- charakter objawów migotania przedsionków
- ryzyko krwawienia
- skuteczność stosowanych leków przeciwkrzepliwych (ocena ryzyka w skali CHA2DS2-VA)
Nowy epizod migotania przedsionków
Informacje ogólne
- Strategia leczenia nowego epizodu migotania przedsionków zależy od tego, czy czas, który upłynął od jego początku był krótszy czy dłuższy niż 48 godzin (granica kardiowersji u pacjentów bez leczenia przeciwkrzepliwego) oraz od objawów występujących u pacjenta.
- Jeśli migotanie trwało krócej niż 48 godzin, kardiowersję można wykonać bez wcześniejszego doustnego leczenia przeciwkrzepliwego, zwłaszcza u pacjentów bez wcześniejszych incydentów i niskim ryzykiem powikłań zakrzepowo–zatorowych.
- Jeśli migotanie utrzymuje się dłużej niż 48 godzin, pacjenci powinni otrzymywać odpowiednie doustne leczenie przeciwkrzepliwe 3 tygodnie przed kardiowersją i co najmniej 4 tygodnie po kardiowersji (INR >2,0 w przypadku warfaryny/acenokumarolu).
- Kardiowersja może być wykonana bez wcześniejszego leczenia przeciwkrzepliwego, jeśli echokardiografia przełykowa wykluczyła skrzeplinę w przedsionku.
- Pacjenci niestabilni hemodynamicznie powinni mieć możliwie szybko wykonaną kardiowersję elektryczną, nawet jeśli czas trwania ataku wynosi >48 godzin.
- U większości pacjentów zaleca się dożywotnie leczenie przeciwkrzepliwe (szczegóły – zobacz sekcja leczenie przeciwkrzepliwe).
Leczenie migotania przedsionków o czasie trwania <48 godzin
- Jeżeli czas trwania epizodu migotania przedsionków nie przekracza 48 godzin, można wykonać kardiowersję wczesną lub opóźnioną z oczekiwaniem na spontaniczny powrót rytmu zatokowego.
- W jednym z badań stwierdzono, że u stabilnych hemodynamicznie pacjentów bezpiecznie jest czekać na spontaniczne umiarowienie do rytmu zatokowego do 48 godzin od początku migotania przedsionków.29
- Po kardiowersji pacjentom ze zwiększonym ryzykiem zakrzepowo-zatorowym zaleca się początkowo przyjmowanie heparyny drobnocząsteczkowej i rozpoczęcie doustnego leczenia przeciwkrzepliwego (warfaryna/acenokumarol). Po osiągnięciu docelowego INR (>2,0) odstawia się heparynę drobnocząsteczkową.
- Jeśli przed kardiowersją konieczne jest obniżenie częstości akcji serca, można zastosować 1 z następujących leków:
- Beta blokery: pierwszy wybór (np. metoprolol dożylnie).
- Niedihydropirydynowy antagonista kanału wapniowego (werapamil lub diltiazem): alternatywny środek kontroli częstości rytmu serca u pacjentów, u których nie występuje niewydolność serca.
- Amiodaron: alternatywa dla pacjentów niestabilnych hemodynamicznie lub z niewydolnością serca
- 300 mg dożylnie w ciągu 15–30 minut, ewentualnie następnie wlew 1000 mg w ciągu następnych 24 godzin.
- Wybór metody kardiowersji (elektryczna czy farmakologiczna) zależy m.in. od stanu klinicznego, hemodynamiki i danych z wywiadu lekarskiego u pacjenta.
Leczenie migotania przedsionków o czasie trwania >48 godzin
- Jeśli czas trwania napadu wynosi >48 godzin, pacjenci powinni otrzymywać odpowiednie leczenie przeciwkrzepliwe przez co najmniej 3 tygodnie. W przypadku pilnej potrzeby wykonania kardiowersji, szczególnie u pacjentów niestabilnych hemodynamicznie, należy wykluczyć obecność skrzepliny w uszku lewego przedsionka za pomocą echokardiografii przełykowej.
- Często konieczne jest leczenie regulujące częstotliwość.
- Beta–blokery są lekami pierwszego wyboru, ewentualnie niedihydropirydynowi antagoniści kanału wapniowego (werapamil lub diltiazem) u pacjentów bez niewydolności serca.
- Nie ustalono jednoznacznie korzyści wynikających z osiągnięcia rygorystycznego celu, jakim jest częstość akcji serca w spoczynku <80/min. w porównaniu z podejściem bardziej liberalnym (<110/min.).
Kardiowersja farmakologiczna (leczenie szpitalne)
- Wskazana u pacjentów stabilnych hemodynamicznie.
- Jeśli migotanie przedsionków trwało krócej niż 7 dni, u nawet 95% pacjentów można uzyskać przywrócenie rytmu zatokowego w ciągu 24 godzin dzięki leczeniu farmakologicznemu.30
- Jeśli czas trwania migotania przekracza 7 dni, jest skuteczna tylko w 15–40% przypadków.
- Flekainid lub propafenon
- Pierwszy wybór, jeśli nie ma dodatkowych chorób serca (stabilna choroba wieńcowa nie jest przeciwskazaniem), należy wcześniej wykonać echokardiografię.
- Dawkowanie:
- flekainid: 4 mg/kg m.c. doustnie, maksymalnie 300 mg (zamiennie wlew 1-2 mg/kg m.c. dożylnie w ciągu 10–30 minut).
- propafenon: 450-600 mg doustnie lub wlew dożylny w ciągu 10 minut.
- Amiodaron
- Pierwszy wybór w przypadku innych chorób serca.
- dawkowanie: 300 mg dożylnie w ciągu 15–30 minut, a następnie wlew 1000 mg w ciągu kolejnych 24 godzin.
- Vernakalant
- Nie należy stosować u pacjentów z niedawno przebytym OZW, z wartością skurczowego ciśnienia tętniczego <100 mmHg, z obniżoną frakcją wyrzutową lewej komory oraz zwężeniem aorty znacznego stopnia
- dawkowanie: 3 mg/kg m.c. (maksymalnie 339 mg) we wlewie dożylnym w ciągu 10 minut
Kardiowersja elektryczna
- Wskazania:
- przy zagrażającym wstrząsie kardiogennym (niedokrwienie, niedociśnienie, niewydolność serca) w wyniku migotania przedsionków
- przy migotaniu przedsionków i poszerzonym zespole QRS z podejrzeniem preekscytacji
- jako alternatywa dla kardiowersji farmakologicznej
- po nieudanej próbie kardiowersji farmakologicznej
- przy niepewności co do rodzaju występującej tachyarytmii.
- Wykonywana na czczo w znieczuleniu dożylnym, najczęściej propofolem.
Napadowe migotanie przedsionków
Zasady ogólne
- Należy podjąć następujące decyzje:
- Czy istnieją wskazania i warunki do przeprowadzenia kardiowersji?
- Czy należy wdrożyć profilaktykę napadów w postaci leczenia farmakologicznego lub ablacji?
- Czy istnieją wskazania do leczenia regulującego częstotliwość rytmu komór?
- Jakie są wskazania i przeciwwskazania oraz wynikająca z nich potrzeba leczenia przeciwkrzepliwego?
- Wielu pacjentów z migotaniem przedsionków ma krótkotrwałe ataki z objawami o różnym nasileniu.
- Istnieje duża skłonność do samoistnego powrotu rytmu zatokowego.
- Każda choroba podstawowa, np. niewydolność serca, leżąca u podłoża AF, powinna być optymalnie leczona.
Kardiowersja napadowego migotania przedsionków
- Postępowanie w przypadku objawów wyzwalających dolegliwości lub w przypadku ataków trwających dłużej niż 1 dzień opisano w sekcji nowy epizod migotania przedsionków.
- Następujące czynniki ograniczają sukces kardiowersji (z powodu zwiększonego ryzyka nawrotu):
- wiek ponad 75 lat
- niewydolność serca klasy III–IV według NYHA
- czas trwania powyżej 3 lat
- duży lewy przedsionek
- powtarzana wcześniejsza próba.
Leczenie farmakologiczne
Profilaktyka napadów
- Jest rozważana w przypadku objawów wyzwalających dolegliwości i chęci stabilizacji rytmu zatokowego.
- Wybór leczenia zależy między innymi od chorób współistniejących i objawów:
- U pacjentów bez choroby wieńcowej, niewydolności serca lub innych chorób serca17
- dronedaron: 400 mg 2 x na dobę
- flekainid: 50–150 mg 2 x na dobę
- propafenon 200-300 mg 2 x na dobę
- U pacjentów z niewydolnością serca (LVEF≤40%), braku efektu lub działaniach niepożądanych leków wymienionych powyżej
- amiodaron: 200 mg 3 x na dobę przez 1 tydzień, następnie 100-200 mg na dobę jako dawka podtrzymująca.
- U pacjentów z łagodnie zmniejszona frakcją wyrzutową - HFmrEF (LVEF 41-49%)17
- amiodaron 200 mg 3 x na dobę przez 1 tydzień, następnie 100-200 mg na dobę
- dronedaron 400 mg 2 x na dobę
- U pacjentów bez choroby wieńcowej, niewydolności serca lub innych chorób serca17
Leczenie kontrolujące częstość akcji serca
- Zalecane jako dodatek do ewentualnej profilaktyki napadów w celu zapobiegania szybkiej częstości akcji komór podczas nowego napadu.
- Beta–blokery są lekami pierwszego wyboru (zwłaszcza kardioselektywne - blokujące receptory beta-1 adrenergiczne), alternatywnie niedihydropirydynowi antagoniści kanału wapniowego (werapamil, diltiazem) oraz digoksyna (pod kontrolą stężenia w surowicy).17
- Ze względu na niekorzystny profil działań niepożądanych amiodaronu, stosuje sie go wyjątkowo u pacjentów, u których nie udało sie uzyskać kontroli częstości akcji serca maksymalną tolerowaną dawką innych leków.
Ablacja prądem o częstotliwości radiowej (RFA)
- Dobrze udokumentowane działanie u pacjentów z objawowym napadowym migotaniem przedsionków, gdy leczenie lekami przeciwarytmicznymi nie przynosiło efektu.30
- W przypadku wspólnie z pacjentem podjętej decyzji o leczeniu ablacyjnym, można zastosować je zamiast farmakoterapii.17
- W randomizowanym badaniu, opublikowanym w roku 2012 w New England Journal of Medicine, nie wykazano istotnej różnicy w częstości występowania migotania przedsionków po zastosowaniu pierwotnej ablacji w porównaniu z farmakologiczną profilaktyką arytmii.31
- Inne badanie wykazało nawrót choroby u 34% pacjentów w ciągu 9 miesięcy od ablacji w porównaniu do 84% nawrotów u osób leczonych lekiem przeciwarytmicznym.32
- Według rzetelnego metodologicznie, randomizowanego badania klinicznego z grupą kontrolną, obejmującego 2204 pacjentów, w porównaniu do leczenia farmakologicznego, ablacja nie zmniejsza istotnie złożonego punktu końcowego (zgon, udar z trwałym deficytem neurologicznym, poważne krwawienie, hospitalizacja z powodu choroby sercowo–naczyniowej lub nawrót migotania przedsionków).33
- Wykazano jednak, że ablacja doprowadziła do znaczącej i klinicznie istotnej poprawy subiektywnej jakości życia 12 miesięcy po zabiegu.34
- Wskazania:
- napadowe lub przetrwałe migotanie przedsionków i wyraźne objawy mimo braku efektu po co najmniej 1 próbie leczenia farmakologicznego
- nawrót po leczeniu farmakologicznym
- pacjenci w wieku poniżej 70 lat bez innej podstawowej choroby serca
- wskazana u pacjentów z dysfunkcją lewej komory, gdy ablacja może zapewnić długotrwałą poprawę czynności skurczowej.35
- Najczęściej stosowaną metodą jest izolacja żył płucnych (ablacja z użyciem cewnika).36
- Uzasadnienie stanowi fakt, że sygnały elektryczne z ognisk we włóknach mięśniowych w miejscu połączenia z żyłą płucną najczęściej wywołują epizody migotania.
- Ogniska te można zidentyfikować i odizolować od lewego przedsionka za pomocą energii fal radiowych.
- Często jest skuteczna pierwotnie u wybranych pacjentów, przy stosunkowo niskim ryzyku powikłań (3%).37
- W badaniu norweskim u 61% pacjentów osiągnięto uwolnienie od objawów. Istnieje jednak 30–50% ryzyko nawrotu w ciągu 1 roku.38
- Takie powikłania, jak tamponada serca, zatorowość mózgowa i zwężenie żył płucnych zdarzają się, ale są rzadkie.
- Zasadniczo nie można zrezygnować z leczenia przeciwkrzepliwego.
- Ablacja cewnikowa węzła AV/pęczka Hisa
- Szczególnie wskazana u pacjentów z utrwalonym migotaniem przedsionków, gdy odpowiednia kontrola częstości akcji serca nie może zostać osiągnięta za pomocą leków.
- W niektórych przypadkach, również w przypadku wyraźnie objawowego napadowego/przetrwałego migotania przedsionków, gdy inne metody ablacji nie są możliwe.
- Pacjenci poddani takiemu zabiegowi pozostają zależni od stymulatora serca przez całe życie. Migotanie przedsionków pozostaje, ale rytm komór jest regulowany przez stymulator.
- Przerwanie obiegu nawrotnego (reentry) w prawym przedsionku
- Wskazane w przypadku trzepotania przedsionków.
Przetrwałe lub utrwalone migotanie przedsionków
Regulacja częstości rytmu komór
- Dla większości pacjentów wybiera się leczenie regulujące częstość akcji komór.
- Nie ma różnicy rokowniczej między próbą kontroli rytmu zatokowego (strategia „kontroli rytmu”) a kontroli częstotliwości z ciągłym migotaniem przedsionków (strategia „kontroli częstotliwości”).
- We wcześniejszych badaniach nie wykazano różnicy w częstości występowania udaru niedokrwiennego, krwotoku mózgowego lub nagłego zgonu sercowego ani nie stwierdzono różnicy w jakości życia.
- W badaniu obserwacyjnym z 2012 roku wykazano mniejszą częstość występowania udaru i TIA przy regulacji rytmu niż przy regulacji częstotliwości.39
- W innym badaniu obserwacyjnym nie stwierdzono różnicy w śmiertelności między kontrolą rytmu a częstotliwości w ciągu pierwszych 4 lat, ale później występowała niewielka korzyść w przypadku kontroli rytmu.40
- Przegląd Cochrane'a wskazuje na taką samą śmiertelność i lepszą jakość życia przy kontroli rytmu w porównaniu z kontrolą częstotliwości41, natomiast inne badanie wskazuje na mniej więcej taki sam stan funkcjonalny przy leczeniu rytmu i częstotliwości.42
- Cel leczenia, jakim jest tętno spoczynkowe na poziomie <110 uderzeń na minutę, nie prowadzi do zwiększenia ryzyka zgonu, powikłań choroby serca ani zwiększenia obciążenia objawami w porównaniu z bardziej rygorystyczną kontrolą tętna.1
- Jeśli objawy utrzymują się lub występują cechy niewydolności serca, dąży się do ściślejszej kontroli tętna spoczynkowego poniżej 80 uderzeń na minutę i tętna 110 uderzeń na minutę przy umiarkowanym wysiłku.
- Nie ma różnicy rokowniczej między próbą kontroli rytmu zatokowego (strategia „kontroli rytmu”) a kontroli częstotliwości z ciągłym migotaniem przedsionków (strategia „kontroli częstotliwości”).
- Beta–blokery lub digoksyna są lekami pierwszego wyboru u pacjentów z frakcją wyrzutową lewej komory ≤40%.
- Np. metoprolol 50–200 mg 1 x na dobę.
- U pacjentów z frakcją wyrzutową lewej komory >40%, należy stosować beta-bloker, digoksynę, diltiazem lub werapamil.17
- Amiodaron: może być alternatywą przy szybkim migotaniu przedsionków i niewydolności serca.
- 600 mg amiodaronu na dobę przez 8–10 dni jako dawka nasycająca.
- Późniejsza redukcja do dawki podtrzymującej, która wynosi zazwyczaj 200 mg amiodaronu przez 5 dni w tygodniu.
- Leczenie amiodaronem jest zwykle rozpoczynane w warunkach szpitalnych i wymaga starannego monitorowania potencjalnych działań niepożądanych leku.
- Większość pacjentów wymaga terapii przeciwkrzepliwej przez całe życie.
Leczenie przeciwkrzepliwe, informacje ogólne
- Więcej informacji można znaleźć w artykule leczenie przeciwkrzepliwe.
- Przed podjęciem decyzji o leczeniu przeciwkrzepliwym u pacjentów z potwierdzonym migotaniem przedsionków, należy dokonać oceny ryzyka i korzyści w oparciu o skalę CHA2DS2–VA.
- Jeśli w skali CHA2DS2–VA uzyskano ≥2 punkty, należy rozpocząć doustne leczenie przeciwkrzepliwe.17
- Niezależnie od uzyskanej punktacji w skali CHA2DS2-VA, doustne leczenie przeciwkrzepliwe należy włączyć u wszystkich pacjentów z migotaniem przedsionków i kardiomiopatią przerostową lub amyloidozą serca.17
- Jest najważniejszym leczeniem zmniejszającym ryzyko wystąpienia udaru i powikłan zakrzepowych migotania przedsionków.43
- U pacjentów z niezastawkowym migotaniem przedsionków i zwiększonym ryzkiem powikłań zakrzepo-zatorowych i udaru, lekami pierwszego wyboru są nowe doustne leki przeciwzakrzepowe (NOAC): riwaroksaban, apiksaban, dabigatran, endoksaban.17
- Leki będące antagonistami witaminy K (VKA): acenokumarol/warfaryna
- Mają dobrze udokumentowane działanie zapobiegające udarowi zarówno w zastawkowym, jak i niezastawkowym migotaniu przedsionków.44
- Zastawkowe migotanie przedsionków: u pacjentów ze sztuczną zastawką serca, zwężeniem zastawki mitralnej lub niewydolnością serca spowodowaną wadą zastawki.
- W przypadku leczenia przeciwkrzepliwego antagonistami witaminy K z powodu migotania przedsionków należy dążyć do osiągnięcia i utrzymania docelowego INR na poziomie 2,0–3,0.17
- W przypadku każdego pacjenta z migotaniem przedsionków, rekomendowanym postępowaniem, jest docelowe stosowanie NOAC zamiast VKA.17
- Mają dobrze udokumentowane działanie zapobiegające udarowi zarówno w zastawkowym, jak i niezastawkowym migotaniu przedsionków.44
- Leczenie przeciwkrzepliwe antagonistami witaminy K (vitamin K antagonists – VKA) jest istotnie lepsze niż klopidogrel + ASA w zapobieganiu zdarzeniom naczyniowym u pacjentów ze zwiększonym ryzykiem udaru mózgu.45
- Po udarze lub TIA przy niezastawkowym migotaniu przedsionków doustne leczenie przeciwkrzepliwe powinno być preferowana w stosunku do podwójnej terapii przeciwpłytkowej (dual antiplatelet therapy – DAPT).
- W przypadku konieczności zastosowania leku przeciwpłytkowego u pacjentów z OZW lub PZW poddanych leczeniu rewaskularyzacyjnemu, dopuszczalne jest dołączenie do leczenia przeciwkrzepliwego innych niż klopidogrel leków z grupy P2Y12, takich jak tikagrelor lub prasugrel.17
- U pacjentów z OZW i PZW leczonych zachowawczo nie zaleca się stosowania leków przeciwpłytkowych łącznie z lekami przeciwkrzepliwymi.17
- U pacjentów poddanych leczeniu interwencyjnemu, można dołączyć kwas acetylosalicylowy do doustnego leczenia przeciwkrzepliwego i leczenia P2Y12 na maks. 7 dni (optymalnie na 24-48 godziny, wewnątrzszpitalnie)17
- Przed rozpoczęciem leczenia przeciwkrzepliwego, należy rozważyć stosunek korzyści (zapobieganie zdarzeniom zakrzepowo–zatorowym) do ryzyka (ryzyko krwawienia w wyniku leczenia).
- Wysokie ryzyko krwawienia nie zwalnia z obowiązku stosowania leczenia przeciwkrzepliwego.
- W celu zapobiegania krwawieniom podczas leczenia przeciwkrzepliwego, należy:
- unikać połączenia doustnych leków przeciwkrzepliwych z przeciwpłytkowymi
- w razie wskazań do takiej terapii, nie należy stosować jej dłużej niż 12 miesięcy.17
- unikać połączenia doustnych leków przeciwkrzepliwych z przeciwpłytkowymi
- Decyzja o rozpoczęciu leczenia przeciwkrzepliwego powinna zostać podjęta przy użyciu zwalidowanych kalkulatorów ryzyka.
- Skala CHA2DS2–VA: do obliczania ryzyka wystąpienia zdarzeń zakrzepowo–zatorowych.
- Zobacz tabela skala CHA2DS2–VA.
- Interpretacja i ocena ryzyka z wykorzystaniem skali CHA2DS2–VA – zobacz sekcja leczenie przeciwkrzepliwe: postępowanie dostosowane do ryzyka.
Nowe (niebędące antagonistami witaminy K) doustne leki przeciwzakrzepowe (novel [non–vitamin K antagonists] oral anticoagulant – NOAC)
- NOAC są lekami pierwszego wyboru w ochronie przed udarem i powikłaniami zakrzepowymi u pacjentów z migotaniem przedsionków.17
- W niedawnych publikacjach pojawiają się sygnały o zwiększonej częstości występowania udaru niedokrwiennego mózgu (w przypadku apiksabanu lub wszystkich NOAC) oraz większej śmiertelności (w przypadku apiksabanu i riwaroksabanu lub wszystkich NOAC).
- Przyczyną może być również niewystarczająca dawka NOAC.
- Należy unikać zmniejszania dawek nie wynikającego ze wskazań.
- Riwaroksaban, inhibitor czynnika Xa
- 20 mg 1 x na dobę.
- Dawka zredukowana do 15 mg 1 x na dobę
- przy GFR 15–49 ml/min.
- Nie zaleca się stosowania przy GFR <15 ml/min.
- Apiksaban, bezpośredni inhibitor czynnika Xa
- 5 mg 2 x na dobę.
- Dawka zredukowana do 2,5 mg 2 x na dobę przy spełnieniu co najmniej 2 z następujących warunków:
- wiek ≥80 lat
- masa ciała ≤60 kg
- stężenie kreatyniny ≥133 mcmol/l (≥1,5 mg/dl).
- Nie zaleca się stosowania leku u osób z GFR <15 ml/min., poddawanych dializie lub z ciężkimi zaburzeniami czynności wątroby.
- Dabigatran, bezpośredni inhibitor trombiny
- 150 mg 2 x na dobę.
- Dawka zredukowana do 110 mg 2 x na dobę:
- wiek ≥80 lat
lub
-
-
- jednoczesne stosowanie werapamilu .
- U pacjentów w wieku 75–80 lat z zapaleniem żołądka, zapaleniem przełyku lub refluksem żołądkowo–przełykowym, u pacjentów z umiarkowanie upośledzoną czynnością nerek (klirens kreatyniny 30–50 ml/min.) oraz innych osób pacjentów ze zwiększonym ryzykiem krwawienia, decyzję co do dawki należy podjąć po indywidualnej ocenie ryzyka powikłań zakrzepowo-zatorowych i krwotocznych.
- W przypadku przewlekłej choroby nerek zaleca się ostrożność ze względu na zwiększone ryzyko krwawienia.46
-
- Edoksaban, inhibitor Xa (niedostępny w Polsce)
- 60 mg 1 x na dobę.
- Dawka zredukowana do 30 mg 1 x na dobę przy:
- GFR 30–50 ml/min.
lub
-
-
- masie ciała ≤60 kg
-
lub
-
-
- jednoczesnym stosowaniu cyklosporyny, erytromycyny, ketokonazolu lub dronedaronu.
-
- Przeciwwskazania i środki ostrożności:40,44
- NOAC nie należy podawać przy:
- zastawkowym migotaniu przedsionków (mechaniczna proteza zastawki serca, umiarkowane/ciężkie zwężenie zastawki mitralnej lub niewydolność serca spowodowana wadą zastawki)
- ciąży/karmieniu piersią
- aktywnym krwawieniu
- nowotworze złośliwym wraz z ostrą zakrzepicą żylną
- ciężkiej niewydolności nerek (GFR <15 ml/min.)
- nieprawidłowej czynności wątroby z koagulopatią (klasa C w skali Childa–Pugha C, z riwaroksabanem już przy klasie B w skali Childa–Pugha).
-
- Zachować ostrożność przy:
- zmniejszaniu dawki u pacjentów w wieku powyżej 80 lat
- podejrzeniu słabego przestrzegania zaleceń
- stanach towarzyszących, które zwiększają ryzyko krwawienia, takich jak pogorszona czynność nerek lub wątroby, małopłytkowość, alkoholizm.
- Kontrole przed rozpoczęciem leczenia: Hb, płytki krwi, enzymy wątrobowe, bilirubina, kreatynina i INR.
- Nie ma potrzeby monitorowania wartości INR w trakcie leczenia.
- Zachować ostrożność przy:
- Zawsze należy sprawdzać możliwe interakcje.
- Jeśli to możliwe, nie podawać leków, które hamują lub pobudzają P–pg lub CYP3A4.
- Inhibitory enzymów zwiększają ryzyko krwawienia, np. amiodaron, werapamil, ketokonazol, klarytromycyna, erytromycyna, leki przeciwko HIV.
- Induktory zmniejszają działanie NOAC, np. ryfampicyna, dziurawiec, karbamazepina, fenytoina.
- Nowe doustne leki przeciwkrzepliwe zasadniczo nie powinny być łączone z innymi antykoagulantami.
- Należy zachować ostrożność przy równoczesnym stosowaniu z lekami przeciwpłytkowymi lub NLPZ i nie stosować takiego połączenie dłużej niż 12 miesięcy.17
- Informacje dla pacjentów: pacjentowi należy dać kartę z informacjami o dawce i wskazaniach, lekach towarzyszących i kontrolach laboratoryjnych.47
- Leczenie: należy zadbać o regularne przyjmowanie leku, w przeciwnym razie nie jest zapewniona antykoagulacja.
- Poinformować o przeciwwskazaniach i możliwości wystąpienia interakcji.
- W przypadku pacjentów poddawanych przewlekłej terapii NOAC z powodu migotania przedsionków, EHRA (European Heart Rhythm Association) zaleca ustrukturyzowaną obserwację. W jej ramach powinny zostać przeprowadzone następujące działania:
- dokumentacja wskazań do antykoagulacji
- wykonanie podstawowych badań laboratoryjnych z oznaczeniem poziomu hemoglobiny, próbami wątrobowymi, parametrami nerkowymi i koagulogramem
- informacje dla pacjentów/szkolenia
- co najmniej coroczne kontrole wartości podstawowych badań laboratoryjnych
- częstsze badania kontrolne u pacjentów z zaburzoną czynnością nerek lub u osób starszych (co 3–6 miesięcy).
- Należy pamiętać, że w starszym wieku funkcja nerek jest często upośledzona.
Wybór pomiędzy VKA a NOAC przy niezastawkowym migotaniu przedsionków
- W wytycznych ESC z 2024 roku17, preferowane jest stosowanie NOAC w stosunku do antagonistów witaminy K.
- Decyzja o wyborze antagonisty witaminy K lub NOAC powinna być oparta na takich przesłankach jak:
- ogólna sytuacja kliniczna
- choroby towarzyszące
- inne podawane leki
- preferencje pacjenta.
- NOAC nie powinny być stosowane zamiast VKA u pacjentów:
- U których INR w warunkach już prowadzonego leczenia za pomocą VKA jest stabilny w zakresie terapeutycznym (INR w zakresie terapeutycznym przez >70% czasu).
- U których nie ma pewności stosowania się do zaleceń.
- Z wysokim ryzykiem krwawienia z przewodu pokarmowego.
- Z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny <15 ml/min.).
- Przyjmujących leki opisane jako inhibitory lub induktory interakcji cytochromu P450–3A4 (CYP3A4) i glikoproteiny P (P–gp), tak, że zgodnie z charakterystyką produktu leczniczego jednoczesne leczenie jest przeciwwskazane lub należy go unikać (m.in. dronedaron, amiodaron, werapamil, klarytromycyna, inhibitory proteazy HIV, azolowe leki przeciwgrzybicze, cyklosporyna, karbamazepina, hiperycyna).
- Z zespołem antyfosfolipidowym spełniającym kryteria profilu wysokiego ryzyka ze względu na zwiększone ryzyko nawracających zdarzeń zakrzepowych
- U pacjentów z zespołem antyfosfolipidowym niespełniającym kryteriów profilu wysokiego ryzyka stosowanie NOAC powinno być krytycznie oceniane w każdym indywidualnym przypadku.
- Ze skrzeplinami w lewej komorze.
- Ze sztucznymi zastawkami serca (po wymianie zastawki serca na mechaniczną lub biologiczną).
- NOAC powinny być stosowane zamiast VKA w następujących przypadkach:
- Umiarkowane upośledzenie funkcji nerek (klirens kreatyniny 30–50 ml/min.: zmniejszenie dawki konieczne w przypadku dabigatranu, edoksabanu, rywaroksabanu, nie w przypadku apiksabanu).
- Występowanie dodatkowego wskazania do stosowania pojedynczego, a zwłaszcza podwójnego hamowania agregacji płytek krwi.
- Wielolekowość (≥5 leków): istotne klinicznie interakcje pomiędzy innymi lekami a NOAC są dotychczas znane tylko w ograniczonym zakresie i mogą nie być rejestrowane ze względu na brak możliwości kontroli laboratoryjnych.
- NOAC powinny być stosowane zamiast VKA u pacjentów:
- Z wysokim ryzykiem krwawienia śródmózgowego, jeśli korzyść z leczenia przeciwkrzepliwego jest uważana za zasadniczo większą niż ryzyko związane z krwawieniem śródmózgowym.
- Z dużymi wahaniami wartości INR mimo regularnego przyjmowania VKA.
- Ze zwiększonym ryzykiem wystąpienia specyficznych interakcji lekowych lub pokarmowych pod wpływem VKA.
- W przypadku których regularna kontrola wartości INR nie jest możliwa lub akceptowana przez pacjenta.
- Z nowo rozpoznanym niezastawkowym migotaniem przedsionków, którzy w trybie ostrym mają być poddani kardiowersji lub ablacji, jako alternatywa dla pozajelitowych leków przeciwkrzepliwych w trakcie i bezpośrednio po interwencji; następnie można rozważyć przejście na VKA, jeśli konieczne jest stosowanie leczenia przeciwkrzepliwego przez dłuższy czas.
- Przy wyborze NOAC należy wziąć pod uwagę m.in. to, że:
- Według danych z badań rejestracyjnych zmniejszenie liczby udarów/zatorowości, poważnych krwawień i śmiertelności z wszystkich przyczyn jest udowodnione tylko dla apiksabanu w porównaniu z warfaryną. Niezależne przeglądy wskazują również na przewagę apiksabanu w porównaniu z innymi NOAC.
- Podawanie dabigatranu 150 mg 2 x na dobę może być wskazane u osób z wysokim ryzykiem wystąpienia udaru niedokrwiennego.
Leczenie przeciwkrzepliwe: postępowanie dostosowane do ryzyka
- U wszystkich pacjentów z wynikiem CHA2DS2–VA ≥2 należy zalecić stosowanie doustnych leków przeciwkrzepliwych w celu zapobiegania udarowi mózgu z uwzględnieniem ewentualnych przeciwwskazań wynikających z analizy ryzyka krwawienia (patrz niżej).
- U chorych z wynikiem CHA2DS2–VA równym 1, leczenie przeciwkrzepliwe należy omówić z uwzględnieniem analizy korzyści i zagrożeń oraz preferencji pacjenta.
- VKA są pierwszym wyborem u pacjentów już je przyjmujących, u których przez ponad 70% czasu leczenia przeciwkrzepliwego INR utrzymuje się w zakresie terapeutycznym (2,0-3,0).
- Zobacz też skala CHA2DS2–VA.
Leczenie przeciwkrzepliwe: ocena ryzyka krwawienia17
- Przed rozpoczęciem leczenia przeciwkrzepliwego, należy przeprowadzić dokładny wywiad, z uwzględnieniem wszystkich czynników ryzyka krwawienia i ich okresową ewaluacją w trakcie leczenia.
- modyfikowalne czynniki ryzyka krwawienia
- nadciśnienie
- przyjmowanie NLPZ
- stosowanie leków przeciwpłytkowych
- konsumpcja alkoholu
- wahania wartości wskaźnika INR
- niemodyfikowalne czynnik ryzyka krwawienia
- wiek
- masywne krwawienia w wywiadzie
- poważne uszkodzenie funkcji nerek, dializoterapia lub stan po przeszczepie nerki
- poważne zaburzenie funkcji wątroby i/lub marskość
- choroba nowotworowa
- czynniki genetyczne (np. polimorfizm CYP2C9)
- udar krwotoczny w wywiadzie
- choroby OUN
- zaburzenia poznawcze i demencja
- modyfikowalne czynniki ryzyka krwawienia
- Obecnie nie rekomenduje się wykorzystywania dotychczas stosowanych skal oceny ryzyka krwawienia (np. HAS-BLED) w celu kwalifikacji do leczenia przeciwkrzepliwego lub jego zaprzestania.
- Podczas przyjmowania doustych antykoagulantów, należy regularne monitorować stan pacjenta i czynniki ryzyka krwawienia, we współpracy z zespołem multidyscyplinarnym.
- U większości pacjentów przeciwwskazania zwykle są względne lub tymczasowe.
- Bezwględne przeciwwskazania do stosowania leczenia przeciwkrzepliwego występują rzadko i obejmują:
- pierwotne guzy wewnątrzczaszkowe
- krwawienia śródmózgowe związane z angiopatią amyloidową
- W przypadku wyraźny przeciwwskazać do doustnej antykoagulacji, należy rozważyć zamknięcie uszka lewego przedsionka przezskórnie lub endoskopowo (LAAC).
Odwracalność w razie krwotoków: antagoniści witaminy K
- Witamina K: 5–20 mg doustnie albo dożylnie, w razie potrzeby powtórzenie po 8–12 godzinach.
- Koncentrat czynników zespołu protrombiny (prothrombin complex concentrate – PCC)48, preferowany w stosunku do świeżo mrożonego osocza (fresh frozen plasma – FFP).48
Odwracalność w razie krwotoków: NOAC
- Do 2015 roku nie były dostępne żadne specyficzne antidota dla NOAC.
- Dabigatran (bezpośredni inhibitor trombiny): w 2015 roku zatwierdzenie idarucyzumabu jako antidotum odwracającego działanie dabigatranu
- Idarucyzumab jest fragmentem humanizowanego przeciwciała monoklonalnego wiążącym swoiście dabigatran.
- Zniesienie działania antykoagulacyjnego wywoływanego przez dabigatran następuje w ciągu kilku minut.49
- Czas do skutecznej hemostazy: kilka godzin.
- Trwałe działanie przez ponad 12 godzin.
- Dawka: 5 mg 2 x dziennie dożylnie w odstępach maksymalnie 15 minut.50
- Riwaroksaban, apiksaban, edoksaban (inhibitory czynnika Xa)
- 2019 rok – warunkowe dopuszczenie do obrotu andeksanetu alfa jako antidotum dla apiksabanu i riwaroksabanu (pod warunkiem dalszego badania bezpieczeństwa i skuteczności).
- Andeksanet alfa jest rekombinowaną cząsteczką o wysokim powinowactwie do czynnika Xa.
- Konkurencyjne hamowanie antagonistów czynnika Xa.
- Zastosowanie bolusa, a potem wlewu powodują szybki i znaczący spadek aktywności anty–FXa.
- Dodatkowa korzyść stosowania andaksanetu alfa nie została udowodniona z powodu niewystarczających danych.
- 2019 rok – warunkowe dopuszczenie do obrotu andeksanetu alfa jako antidotum dla apiksabanu i riwaroksabanu (pod warunkiem dalszego badania bezpieczeństwa i skuteczności).
- Podawanie koncentratu czynników kompleksu protrombiny w przypadku ciężkich zdarzeń krwotocznych może częściowo znieść efekt antykoagulacyjny inhibitorów czynnika Xa.50
Leczenie przeciwkrzepliwe u pacjentów z migotaniem przedsionków po implantacji stentu w ostrym lub przewlekłym zespole wieńcowym
- Leczenie przeciwkrzepliwe u pacjenta z AF po implantacji stentu wieńcowego stanowi szczególne wyzwanie, w którym należy starannie ocenić równowagę między ryzykiem zakrzepowo–zatorowym a ryzykiem krwotoku. Ocena i wynikający z niej sposób postępowania powinny być dokonywana wspólnie z kardiologiem.
- Poniższe postępowanie jest zalecane w przypadku potrójnej terapii przy OZW i przewlekłym zespole wieńcowym:
- Antykoagulacja doustna + stent niepowlekany (przewlekły zespół wieńcowy, ostry zespół wieńcowy): potrójna terapia przez 4 tygodnie, potem tylko acenokumarol.
- Antykoagulacja doustna + stent uwalniający lek (przewlekły zespół wieńcowy): potrójna terapia przez 1–3 miesiące (stent uwalniający – limus) lub 6 miesięcy (stent powlekany paklitakselem), następnie acenokumarol + klopidogrel do 12 miesięcy, następnie tylko acenokumarol.
- Antykoagulacja doustna + stent uwalniający lek (ostry zespół wieńcowy): terapia potrójna 6 miesięcy, następnie acenokumarol + klopidogrel do 12 miesiąca, następnie tylko acenokumarol.
- Jako bloker receptora ADP w terapii potrójnej należy stosować wyłącznie klopidogrel (większe ryzyko krwotoku w przypadku tikagreloru).
- Na czas trwania potrójnej terapii docelowy INR obniżony do zakresu 2,0–2,5.
- Pacjenci powinni być starannie monitorowani, np. poprzez comiesięczne kontrole morfologii krwi.
- W wytycznych ESC zaleca się jak najkrótsze stosowanie potrójnej terapii po przezskórnej interwencji wieńcowej (percutaneous coronary intervention – PCI), zarówno u pacjentów z ostrym zespołem wieńcowym, jak i z przewlekłym zespołem wieńcowym.
Alternatywne postępowanie w prewencji udaru mózgu
Przezskórne zamknięcie uszka
- Przezskórne (przez cewnik) zamknięcie uszka lewego przedsionka (left atrial appendage) rozważa się głównie u pacjentów ze wskazaniem do leczenia przeciwkrzepliwego, ale nietolerujących tego leczenia, a ewentualnie u pacjentów, u których istnieje równocześnie wysokie ryzyko udaru i przeciwwskazanie do długotrwałej doustnej antykoagulacji.
- W metaanalizie sieciowej stwierdzono, że zamknięcie uszka lewego przedsionka i terapia NOAC są równoważne pod względem skuteczności, ale istniejące dane są nadal niewystarczające.51
Przebieg, powikłania i rokowanie
Przebieg
- Migotanie przedsionków często występuje napadowo, zanim rozwinie się w przetrwałą arytmię.
- U ponad 50% pacjentów z ostrym migotaniem przedsionków dochodzi do spontanicznego umiarowienia w ciągu 24–48 godzin.52
- Subiektywne dolegliwości często zmniejszają się, gdy migotanie przedsionków się utrwala.
- U wielu pacjentów występują okresy lub napady migotania bez objawów klinicznych. Rozpoznanie często następuje przypadkowo podczas rutynowego badania.
- U większości młodszych pacjentów z nowym migotaniem przedsionków należy rozważyć kardiowersję elektryczną.
Powikłania
- W porównaniu do osób z rytmem zatokowym, pacjenci z migotaniem przedsionków mają 2–krotnie większą śmiertelność i większe ryzyko wystąpienia udaru.53
- Utrwalone a napadowe migotanie przedsionków
- Według metaanalizy przy utrwalonym migotaniu przedsionków istnieje o 38% większe ryzyko wystąpienia skrzepliny w przedsionkach w porównaniu z napadowym migotaniem przedsionków.54
- W jednym z badań wykazano również znacznie zwiększone ryzyko powstawania skrzeplin przy utrwalonym migotaniu przedsionków w porównaniu z napadowym.55
- Utrwalone a napadowe migotanie przedsionków
- Ryzyko powikłań zakrzepowo–zatorowych
- Jest największe bezpośrednio po pierwszym wystąpieniu migotania przedsionków, w pierwszych latach przewlekłego migotania przedsionków oraz w pierwszym okresie po kardiowersji do rytmu zatokowego.
- Ryzyko powikłań jest szczególnie wysokie u pacjentów z wadą zastawki mitralnej jako podstawową przyczyną.
- Nieleczona szybka akcja komór może prowadzić do niewydolności serca i/lub kardiomiopatii.56
Rokowanie
- Predyktorami nawrotów migotania przedsionków są:
- długotrwałe migotanie przedsionków (czas trwania >3 miesięcy)
- niewydolność serca
- strukturalna choroba serca
- nadciśnienie
- podeszły wiek (powyżej 70 lat) oraz
- powiększony lewy przedsionek.57
- Ryzyko choroby zakrzepowo–zatorowej przy kardiowersji58
- 5–7% bez leczenia przeciwzakrzepowego.
- 1–2% przy konwencjonalnym leczeniu przeciwkrzepliwym.
- Nie dotyczy to nowego migotania przedsionków, wyleczonego w ciągu 48 godzin, gdy przedłużone leczenie przeciwkrzepliwe nie jest konieczne.
- Według metaanalizy roczna śmiertelność z powodu migotania przedsionków wynosi 4,7% (46% zgonów z przyczyn kardiologicznych i 11% z powodu udaru niedokrwiennego, krwotoku mózgowego lub innych poważnych krwotoków).59
- W amerykańskim badaniu obserwacyjnym obejmującym pacjentów z nowo występującym migotaniem przedsionków wykazano, że ryzyko śmiertelności było zwiększone w ciągu pierwszych 4 miesięcy od wystąpienia migotania (OR 9,6).60
- W późniejszym okresie ryzyko to było umiarkowanie zwiększone w stosunku do reszty populacji (OR 1,6).
Dalsze postępowanie
- Kontrola częstości akcji serca.
- Kontrola przebiegu leczenia przeciwkrzepliwego
- leczenie VKA – wartość INR 2,0–3,0
- leczenie NOAC – w razie potrzeby pomiar stężenia leku w surowicy.
- Tętno i częstość akcji serca w celu indywidualnego dawkowania leków zmniejszających częstotliwość.
- Ciśnienie tętnicze.
- Optymalizacja leczenia chorób podstawowych oraz chorób towarzyszących.
- Pacjenci przyjmujący amiodaron powinni mieć kontrolowane wartości parametrów tarczycowych i wątrobowych.
- Pacjenci przyjmujący flekainid są monitorowani za pomocą EKG (ryzyko wydłużenia czasu QT).
Informacje dla pacjentów
O czym należy poinformować pacjentów?
- O leczeniu.
- O konieczności regularnego przyjmowania leków przeciwkrzepliwych.
- O konieczności unikania niebezpiecznych połączeń leków, np. NLPZ/acenokumarol.
- Jak w razie krwawienia uzyskać pomoc lekarską.
Materiały edukacyjne dla pacjentów
Ilustracje
Układ przewodzący serca
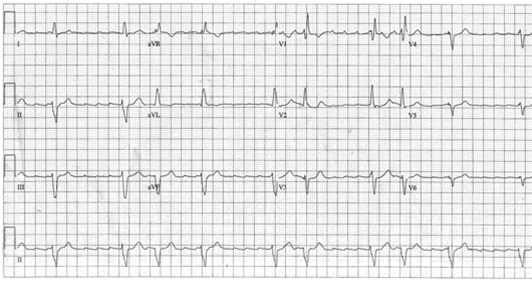
EKG przy trzepotaniu przedsionków
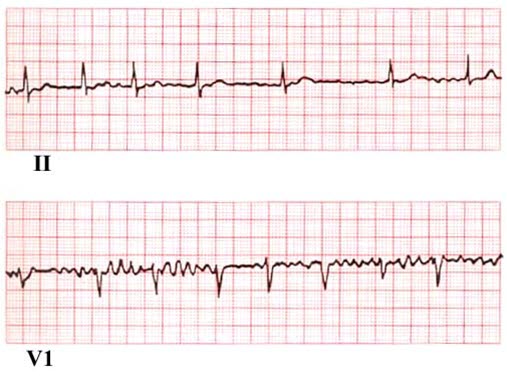
Zapis EKG przy migotaniu przedsionków
Szmery nad sercem przy migotaniu przedsionków
Źródła
Wytyczne
- 2024 ESC 2024 ESC Guidelines for the management of atrial fibrillation developed in collaboration
with the European Association for Cardio-Thoracic Surgery (EACTS)l fibrillation. escardio.org - The 2018 European Heart Rhythm Association. Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with atrial fibrillation (Praktyczny przewodnik Europejskiego Stowarzyszenia Rytmu Serca z 2018 r. dotyczące stosowania leków przeciwzakrzepowych niebędących antagonistami witaminy K u pacjentów z migotaniem przedsionków). Stan z 2018 roku. www.academic.oup.com
Piśmiennictwo
- January C.T., Wann L.S., Alpert J.S., Calkins H., et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society, J Am Coll Cardiol 2014, doi:10.1016/j.jacc.2014.03.021,
- Kirchhof P., Toennis T., Goette A., et al. NOAH-AFNET 6 Investigators. Anticoagulation with Edoxaban in Patients with Atrial High-Rate Episodes, N Engl J Med., 28.09.2023, 389(13): 1167-79, doi: 10.1056/NEJMoa2303062, Epub 25.08.2023, PMID: 37622677,
- Staerk L., Wang B., Preis S.R., et al. Lifetime risk of atrialfibrillation according to optimal, borderline, or elevated levels of risk factors: cohort study based on longitudinal data from the Framingham Heart Study, BMJ. 2018, 361: k1453, PubMed
- Granada J, Uribe W, Chyou PH, Maassen K, Vierkant R, Smith PN, et al. Incidence andpredictors of atrial flutter in the general population. J Am Coll Cardiol 2000;36:2242–6. pubmed.ncbi.nlm.nih.gov
- American Heart Association Council on Epidemiology and PreventionStatistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics 2019 update: a report from the American Heart Association Circulation, 05.03.2019, 139(10): 56-528, doi:10.1161/CIR.0000000000000659, DOI
- Magnussen C., Niiranen T.J., Ojeda F.M., et al. Sex differences and similarities in atrial fibrillation epidemiology, risk factors, and mortality in community cohorts: results from the BiomarCaRE Consortium (Biomarker for Cardiovascular Risk Assessment in Europe), Circulation. 2017, 136: 1588-97.
- Schnabel R.B., Wilde S. WIld P.S., Munzel T., Blankenberg S. Vorhofflimmern. Prävalenz und Risikofaktorenprofil in der Allgemeinbevölkerung, Dtsch Arztebl Int 2012, 109(16): 293-9, www.aerzteblatt.de
- Zarifis J., Beevers D.G., Lip G.Y.H. Acute admissions with atrial fibrillation in a British multiracial hospital population, Br J Clin Pract 1997, 51: 91-6, PubMed
- Kaireviciutre A., Aidietis A., Lip G.Y. Atrial fibrillation following cardiac surgery: clinical features and preventative strategies, Eur Heart J 2009, 30: 410-25, European Heart Journal
- Fuster V., Rydén L.E., Cannom D.S., et al. Task force report. ACC/AHA/ESC guide-lines for the management of patients with atrial fibrillation, Europace 2006, 8: 651-745, PubMed
- Lubitz S.A., Yin X., Fontes J.D., et al. Association between familial atrial fibrillation and risk of new-onset atrial fibrillation, JAMA 2010, 304: 2263-9, www.ncbi.nlm.nih.gov
- Bilal Iqbal M., Taneja A.K., Lip G.Y.H., Flather M. Recent developments in atrial fibrillation, BMJ 2005, 330: 238-43, PubMed
- Haissaguerre M., Jais P., Shah D.C., Takahashi A., Hocini M., Quiniou G., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins, N Engl J Med 1998, 339: 659-66, New England Journal of Medicine
- Nattel S., Burstein B., Dobrev D. Atrial remodeling and atrial fibrillation: mechanisms and implications, Circ Arrhytm Electrophysiol 2008, 1: 62-73, www.ncbi.nlm.nih.gov
- Gutierrez C., Blanchard D.G. Atrial fibrillation: diagnosis and treatment, Am Fam Physician 2011, 83: 61-8, www.ncbi.nlm.nih.gov
- Voskoboinik A., Kalman J.M., De Silva A., et al. Alcohol Abstinence in Drinkers With Atrial Fibrillation, N Engl J Med 2020, pmid:31893513, www.ncbi.nlm.nih.gov
- Gelder IC, Rienstra M, Bunting KV, et al. 2024 ESC Guidelines for the management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS) Eur Heart Journal 2024; 45: 3314–3414. academic.oup.com
- Baranowski R., Wojciechowski D., Maciejewska M. Zalecenia dotyczące stosowania rozpoznań elektrokardiograficznych: dokument opracowany przez Grupę Roboczą Polskiego Towarzystwa Kardiologicznego, Kardiologia Polska 2016, 74, 8: 812-9, DOI: 10.5603/KP.2016.0119, DOI
- Halligan S.C., Gersh B.J., Brown R.D., et al. The natural history of lone atrial flutter, Ann Intern Med 2004, 140: 265-8, www.ncbi.nlm.nih.gov
- Pathak R.K., Middeldorp M.E., Meredtih M., et al . Long-Term Effect of Goal Directed Weight Management in an Atrial Fibrillation Cohort: A Long-term Follow-Up StudY (LEGACY Study), J Am Coll Cardiol 2015, doi:10.1016/j.jacc.2015.03.002, DOI
- Healey J.S., Baranchuk A., Crystal E., et al. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis, J Am Coll Cardiol 2005, 45: 1832-9, PubMed
- Rahimi K., Emberson J., McGale P., et al. Effect of statins on atrial fibrillation: collaborative meta-analysis of published and unpublished evidence from randomised controlled trials, BMJ 2011, 342: d1250, pubmed.ncbi.nlm.nih.gov
- Macchia A., Grancelli H., Varini S., et al. Omega-3 fatty acids for the prevention of recurrent symptomatic atrial fibrillation: results of the FORWARD (Randomized Trial to Assess Efficacy of PUFA for the Maintenance of Sinus Rhythm in Persistent Atrial Fibrillation) trial, J Am Coll Cardiol 2013, 61: 463-8. doi:10.1016/j.jacc.2012.11.021, DOI
- Darghosian L., Free M., Li J., et al. Effect of Omega-three polyunsaturated fatty acids on Inflammation, oxidative stress, and recurrence of atrial fibrillation, Am J Cardiol. 2014, PMID: 25465932, PubMed
- Hegbom F, Stavem K, Sire S, Heldal M, Orning OM, Gjesdal K. Effects of short-term exercise training on symptoms and quality of life in patients with chronic atrial fibrillation. Int J Cardiol. 2007 Mar 2;116(1):86-92. doi: 10.1016/j.ijcard.2006.03.034. Epub 2006 Jun 30. PMID: 16815571. www.internationaljournalofcardiology.com
- Voskoboinik A., Kalman J.M., De Silva A., et al. Alcohol Abstinence in Drinkers with Atrial Fibrillation, N Engl J Med. 2020, 382(1): 20-8, doi:10.1056/NEJMoa1817591, www.ncbi.nlm.nih.gov
- Lafuente-Lafuente C., Valembois L., Bergmann J.F., et al. Antiarrhythmics for maintaining sinus rhythm after cardioversion of atrial fibrillation, Cochrane Database Syst Rev. 28.03.2015, 3:CD005049, Cochrane (DOI)
- Packer D.L. et al. Effect of Catheter Ablation vs Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest Among Patients With Atrial Fibrillation: The CABANA Randomized Clinical Trial, JAMA 02.04.2019, 321(13): 1261-74, doi: 10.1001/jama.2019.0693, DOI
- Pluymaekers N.A.H.A., Dudink E.A.M.P., Luermans J.G.L.M., et al. Early or Delayed Cardioversion in Recent-Onset Atrial Fibrillation, N Engl J Med 2019, pmid:30883054, pubmed.ncbi.nlm.nih.gov
- Dobrev D., Nattel S., New antiarrhythmic drug for treatment of atrial fibrillation, Lancet 2010, 375: 1212-23, PubMed
- Nielsen J.C., Johannessen A., Raatikainen P., et al. Radiofrequency ablation as initial therapy in paroxysmal atrial fibrillation, N Engl J Med 2012, 367: 1587-95, New England Journal of Medicine
- Wilber D.J., Pappone C., Neuzil P., et al. Comparison of antiarrhythmic drug therapy and radiofrequency catheter ablation in patients with paroxysmal atrial fibrillation. A randomized controlled trial, JAMA 2010, 303: 333-40, PubMed
- Packer D.L., Mark D.B., Robb R.A., et al. Effect of Catheter Ablation vs Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest Among Patients With Atrial Fibrillation The CABANA Randomized Clinical Trial, JAMA 2019, 321: 1261-74, pmid:30874766, jamanetwork.com
- Mark D.B., Anstrom K.J., Sheng S., et al. Effect of Catheter Ablation vs Medical Therapy on Quality of Life Among Patients With Atrial Fibrillation The CABANA Randomized Clinical Trial, JAMA 2019, 321: 1275-85, pmid:30874716, jamanetwork.com
- Anselmino M., Matta M., D'Ascenzo F., et al. Catheter ablation of atrial fibrillation in patients with left ventricular systolic dysfunction: a systematic review and meta-analysis, Circ Arrhythm Electrophysiol. 2014 Dec, 7(6): 1011-8, doi: 10.1161/CIRCEP.114.001938, DOI
- Oral H., Pappone C., Chugh A., et al. Circumferential pulmonary-vein ablation for chronic atrial fibrillation, N Engl J Med 2006, 354: 934-41, New England Journal of Medicine
- Shapira A.R. Catheter ablation of supraventricular arrhythmias and atrial fibrillation, Am Fam Physician 2009, 80: 1089-94, www.ncbi.nlm.nih.gov
- Wellens H.J. Pulmonary vein ablation in atrial fibrillation: hype or hope? Circulation 2000, 102: 2562-4, www.ncbi.nlm.nih.gov
- Tsadok M.A., Jackevicius C.A., Essebag V., et al. Rhythm versus rate control therapy and subsequent stroke or transient ischemic attack in patients with atrial fibrillation, Circulation 2012, 126: 2680-7, www.ncbi.nlm.nih.gov
- Ionescu R., Abrahamowicz M., Jackevicius C.A., et al. Comparative effectiveness of rhythm control vs rate control drug treatment effect on mortality in patients with atrial fibrillation, Arch Intern Med 2012, doi:10.1001/archinternmed.2012.2266, DOI
- Mead G.E., Elder A., Flapan A.D., Cordina J. Electrical cardioversion for atrial fibrillation and flutter, Cochrane Database of Systematic Reviews 2005, Issue 3. Art. No.: CD002903. DOI: 10.1002/14651858.CD002903.pub2, DOI
- Chung M.K., Shemanski L., Sherman D.G., et al. Functional status in rate- versus rhythm-control strategies for atrial fibrillation: results of the Atrial Fibrillation Follow-Up Investigation of Rhythm Management (AFFIRM) Functional Status Substudy, J Am Coll Cardiol 2005, 46: 1891-9, PubMed
- Nattel S., Opie L.H. Controversies in atrial fibrillation, Lancet 2006, 367: 262-72, PubMed
- Aguilar M., Hart R. Oral anticoagulants for preventing stroke in patients with non-valvular atrial fibrillation and no previous history of stroke or transient ischemic attacks, Cochrane Database Syst Rev 2005, 3: CD001927 Doi: 10.1002/14651858.CD001927.pub2, DOI
- Connoly S.J., Camm A.J., Halperin J.L., et al. Dronedarone in high-risk permanent atrial fibrillation, N Engl J Med 2011, 365: 2268-76, New England Journal of Medicine
- Hernandez I., Baik S.H., Piñera A., Zhang Y. Risk of bleeding with dabigatran in atrial fibrillation, JAMA Intern Med 2015, 175: 18-24, doi:10.1001/jamainternmed.2014.5398, DOI
- ESC: Novel Oral Anticoagulants for Atrial Fibrillation. NOAC for AF Practical Guide. www.escardio.org
- Zareh M., Davis A., Henderson S. Reversal of Warfarin-Induced Hemorrhage in the Emergency Department, West J Emerg Med 2011, 12: 386-92, doi:10.5811/westjem.2011.3.2051, DOI
- Pollack C., Reilly P., Eikelboom J., et al. Idarucizumab for Dabigatran Reversal, N Engl J Med 2015, 373: 511-20, doi:10.1056/NEJMoa1502000, DOI
- Steffel J, Verhamme P, Potpara TS et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation, European Heart Journal 2018, 16: 1330-39. pmid:30211938, www.ncbi.nlm.nih.gov
- Sahay S., Nombela-Franco L., Rodes-Cabau J., et al . Efficacy and safety of left atrial appendage closure versus medical treatment in atrial fibrillation: a network meta-analysis from randomised trials, Heart 2017, 103: 139-47, doi:10.1136/heartjnl-2016-309782, DOI
- Lip G.Y.H., Kamath S. Acute atrial fibrillation, Clinical Evidence 2001, 6: 1-7, www.ncbi.nlm.nih.gov
- Wolf P.A., Abbott R.D., Kannel W.B. Atrial fibrillation as an independent risk factor for stroke: the Framingham study. Stroke 1991, 22: 983-8, PubMed
- Ganesan A.N., Chew D.P., Hartshorne T., et al. The impact of atrial fibrillation type on the risk of thromboembolism, mortality, and bleeding: a systematic review and meta-analysis, Eur Heart J 2016, 37: 1591-602, pmid:2688818, pubmed.ncbi.nlm.nih.gov
- Kapłon-Cieślicka A., Budnik M., Gawałko M., et al. Atrial fibrillation type and renal dysfunction as important predictors of left atrial thrombus, Heart 2019, pmid:31040170, pubmed.ncbi.nlm.nih.gov
- Wang T.J., Larson M.G., Levy D., et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study, Circulation, 2003, 107: 2920-5, PubMed
- Van Gelder I.C., Crijns H.J., Tieleman R.G., Brugemann J., De Kam P.J., Gosselink AT, et al. Chronic atrial fibrillation: success of serial cardioversion therapy and safety of oral anticoagulation, Arch Intern Med 1996, 156: 2585-92, PubMed
- Consensus Conference on Atrial Fibrillation in Hospital and General Practice. Final consensus statement, Proc R Coll Physicians Edinb 1999, suppl 6: 2-3, www.ncbi.nlm.nih.gov
- Gomez-Outes A., Lagunar-Ruiz J., Terleira-Fernandez A.I., et al. Causes of Death in Anticoagulated Patients With Atrial Fibrillation, J Am Coll Cardiol. 2016, 68: 2508-21, pmid: 27931607, PubMed
- Miyasaka Y., Barnes M.E., Bailey K.R., et al. Mortality trends in patients diagnosed with first atrial fibrillation a 21-year community-based study, J Am Coll Cardiol 2007, 49: 986-92, PubMed
- Whitbeck M.G., Charnigo R.J., Khairy P., et al. Increased mortality among patients taking digoxin--analysis from the AFFIRM study, Eur Heart J 2013, 34: 1481-8, www.ncbi.nlm.nih.gov
- Adam S.S., McDuffie J.R., Ortel T.L., et al. Comparative Effectiveness of warfarin and new oral anticoagulants for the management of atrial fibrillation and venous thromboembolism: a systematic review, Ann Intern Med. 28.08.2012, pmid:22928173, PubMed
- Hicks T., Stewart F., Eisinga A. NOACs versus warfarin for stroke pevention inpatients with AF: a systematic review and meta-analysis, Open Heart 2016, doi:10.1136/openhrt-2015-000279, openheart.bmj.com
- Calkins H., Hindricks G., Cappato R., D.W. et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensusstatement on catheter and surgical ablation of atrial fibrillation: executive summary, Europace. 2018, 20: 157-208.
- Lopes R.D., Rordorf R., De Ferrari G.M., et al. Digoxin and Mortality in Patients With Atrial Fibrillation, J Am Coll Cardiol 13.03.2018, 71(10): 1063-74, pmid:29519345, PubMed
- Hobbs F.D.R. et al on behalf of The European Primary Care Cardiovascular Society (EPCCS) stroke prevention in atrial fibrillation (SPAF) working group. EPCCS consensus guidance on SPAF in primary care, European Journal of Preventive Cardiology, Vol. 23 (5): 460-73, 03.2016, www.ncbi.nlm.nih.gov
Opracowanie
- Natalia Jagiełła (recenzent)
- Adam Windak (redaktor)
- Thomas M. Heim (recenzent/redaktor)
- Hans–Otto Wagner (recenzent/redaktor)
- Joanna Dąbrowska-Juszczak (recenzent)
