Streszczenie
- Definicja: Zatorowość płucna to częściowe albo całkowite zamknięcie tętnicy płucnej spowodowane zatorem, który jest materiał zakrzepowy z obwodowego krążenia żylnego. W około 90% przypadków materiał zatorowy pochodzi z obszaru spływu żyły głównej dolnej wskutek zakrzepicy żył głębokich kończyny dolnej lub miednicy.
- Epidemiologia: Zatorowość płucna jest trzecią najczęściej występującą chorobą sercowo–naczyniową; roczna zapadalność wynosi 39–115/100 tysięcy osób. We wczesnej fazie śmiertelność wynosi około 10%; a do 90% zgonów dochodzi w fazie ostrej w ciągu pierwszych 2 godzin od wystąpienia objawów. W krajach uprzemysłowionych zatorowość płucna jest główną przyczyną zgonów po hospitalizacji i najczęstszą przyczyną zgonów kobiet w ciąży i połogu .
- Objawy: Szeroki wachlarz objawów: często występują duszność, ból w klatce piersiowej, tachypnoe i kaszel, rzadziej krwioplucie. Błędne rozpoznanie jest częste, a poszczególne objawy nie są patognomoniczne.
- Badanie fizykalne: Możliwe objawy kliniczne to tachypnoe, tachykardia, hipotensja do wstrząsu włącznie, obrzęk, bolesność jednej kończyny dolnej, niepokój i zmęczenie.
- Diagnostyka: Podstawowa diagnostyka obejmuje kontrolę parametrów życiowych, EKG, gazometrię krwi i D–dimery. RTG klatki piersiowej przede wszystkim dla diagnostyki różnicowej. Potwierdzenie rozpoznania na ogół na podstawie badania TK, przy niestabilności hemodynamicznej echokardiografia przezklatkowa w celu stwierdzenia przeciążenia prawej komory.
- Terapia: W fazie ostrej antykoagulacja heparynami lub bezpośrednimi doustnymi lekami przeciwkrzepliwymi; tromboliza u pacjentów we wstrząsie. Profilaktyka nawrotów na ogół przy użyciu antagonistów witaminy K lub bezpośrednich doustnych leków przeciwkrzepliwych (DOAC); u pacjentów onkologicznych głównie heparyny drobnocząsteczkowej.
Informacje ogólne
Definicja, obraz kliniczny
- Mianem zatorowości płucnej (ZP) określa się częściowe lub całkowite zamknięcie światła tętnicy płucnej spowodowane zakrzepami krwi z obwodowego krążenia żylnego.
- Pochodzenie czopa zatorowego
- Najczęściej (w około 90% przypadków) czop zatorowy pochodzi z obszaru spływu żyły głównej dolnej wskutek zakrzepicy żył głębokich (ZŻG) kończyn dolnych lub miednicy.
- Rzadko z obszaru żyły głównej górnej.
- Powstawaniu zatorów sprzyjają centralne cewniki żylne i elektrody stymulatora serca.
- Rozpoznanie utrudniają często niejednoznaczne, nieswoiste objawy lub choroby współwystępujące.
- W fazie ostrej śmiertelność wynosi około 10%.
- Wczesna śmiertelność zależy od rozległości ZP, występowania i stopnia dysfunkcji prawej komory oraz współwystępujących chorób krążeniowo–oddechowych.
- Nawet 90% zgonów następuje w ciągu 1–2 godzin od wystąpienia objawów.
- Konieczność natychmiastowej i konsekwentnie prowadzonej diagnostyki w przypadku klinicznego podejrzenia ostrej ZP.
- Dzięki odpowiedniej terapii przeciwkrzepliwej ograniczenie śmiertelności spowodowanej ZP w ciągu pierwszych 3 miesięcy do <2%.
- Żylna choroba zakrzepowo‑zatorowa to zakrzepica żył głębokich (ZŻG) i zatorowość płucna (ZP).1
Ważne!
- Niezwłoczna weryfikacja każdego klinicznego podejrzenia ZP w celu potwierdzenia diagnozy, podjęcia decyzji o leczeniu, poprawy wczesnego rokowania.
- Sam wywiad lekarski i badanie fizykalne nie wystarczą.
- Wstępna stratyfikacja ryzyka klinicznego ma ogromne znaczenie dla diagnostyki i leczenia.2
- Podejrzenie ostrej ZP z zatrzymaniem krążenia/reanimacją, wstrząsem lub niedociśnieniem; wysokie ryzyko zgonu.
- Podejrzenie ostrej ZP bez wstrząsu ani niedociśnienia: bez wysokiego ryzyka zgonu.
- W stanach ostrych: wdrożenie leczenia jeszcze przed potwierdzeniem rozpoznania.
Epidemiologia
- Zapadalność2
- ZP jest trzecią najczęściej występującą chorobą sercowo–naczyniową z roczną zapadalnością 39–115/100 tysięcy osób.
- Chorobowość
- ZP jest w badaniach post mortem pierwotną przyczyną 3–5% wszystkich zgonów.
- Tylko w maksymalnie 1/3 przypadków rozpoznanie następuje przed śmiercią.
- ZP jest w badaniach post mortem pierwotną przyczyną 3–5% wszystkich zgonów.
- U mężczyzn występuje zwiększone ryzyko nawrotów.3
- ZP stanowi przyczyną ok. 10% zgonów pacjentów hospitalizowanych i jest najczęstszą przyczyną, której można zapobiegać.1
- Choroba częściej dotyka pensjonariuszy domów spokojnej starości i domów opieki.
- W prospektywnym badaniu kohortowym przeprowadzonym w Wielkiej Brytanii zapadalność na ZP okazała się 7–krotnie wyższa w domach opieki w porównaniu do populacji ogólnej i 2–krotnie wyższa w porównaniu do wszystkich osób powyżej 70 r.ż.4
Etiologia i patogeneza
- „Sprowokowana” ZP ma miejsce przy obecności przemijającego lub odwracalnego czynnika ryzyka w ciągu 6 tygodni do 3 miesięcy przed rozpoznaniem.
- Przemijające czynniki ryzyka:
- operacja
- hospitalizacja
- unieruchomienie
- długie podróże
- ciąża
- doustne środki antykoncepcyjne
- hormonalna terapia zastępcza (HTZ).
- Przemijające czynniki ryzyka:
- U około 40% pacjentów występuje niesprowokowana ZP.
- Szczególnie w związku z urazami ZP często występuje bez stwierdzonej zakrzepicy żył głębokich.5
- Embolizacja jest możliwa również po powstaniu skrzepliny w prawym sercu (migotanie przedsionków, po zawale serca).
Patofizjologia
- Układ krążenia
- Zwiększony naczyniowy opór płucny w wyniku zawężenia i skurczu naczyń wywołanego przez ZP.
- Zwiększenie ciśnienia w tętnicy płucnej przy zamknięciu powyżej 30–50% przekroju łożyska naczyniowego.
- Przeciążenie prawej komory serca (RV) spowodowane wzrostem oporu i ciśnienia w tętnicy płucnej.
- Kompensacja przez prawą komorę możliwa tylko do poziomu średniego ciśnienia w tętnicy płucnej wynoszącego około 40 mmHg.2
- Zależnie od stopnia obciążenia, powiększenie prawej komory z towarzyszącą niewydolnością zastawki trójdzielnej.
- Przemieszczenie przegrody międzykomorowej z ograniczeniem napełniania lewej komory.
- Przy postępującej niewydolności serca niedociśnienie aż do wstrząsu/zatrzymania krążenia.
- Wymiana gazowa
- Hipoksemia i reaktywna hiperwentylacja/hipokapnia (hiperkapnia tylko w rozległej ZP).
- Zwężenie w obrębie oskrzeli o podłożu neurohumoralnym ze zwiększonym oporem oddechowym.
- Utrata surfaktantu ze zmniejszoną podatnością płuc.
Czynniki predysponujące
- Silne czynniki ryzyka (iloraz szans >10)
- Złamanie w obrębie kończyn dolnych.
- Hospitalizacja z powodu niewydolności serca lub migotania/trzepotania przedsionków w ciągu ostatnich 3 miesięcy.
- Wymiana stawu biodrowego lub kolanowego.
- Poważny uraz.
- Zawał serca (w ciągu ostatnich 3 miesięcy).
- Przebyta żylna choroba zakrzepowo–zatorowa.
- Uszkodzenie rdzenia kręgowego.
- Umiarkowane czynniki ryzyka (iloraz szans 2–9)
- Artroskopowa operacja stawu kolanowego.
- Zaburzenia autoimmunologiczne.
- Przetoczenie krwi.
- Cewnikowanie żył centralnych.
- Cewniki i dojścia dożylne.
- Chemioterapia.
- Niewydolność serca lub płuc.
- Udar z porażeniem.
- Substancje stymulujące erytropoezę.
- Zakażenie (zwłaszcza zapalenie płuc, zakażenie układu moczowego, zakażenie HIV).
- Przewlekła zapalna choroba jelit.
- Nowotwór złośliwy (wyższe ryzyko w przypadku przerzutów).
- Zapłodnienie in vitro.
- Przyjmowanie doustnych leków antykoncepcyjnych.
- Hormonalna terapia zastępcza (zależnie od składu).
- Połóg.
- Zakrzepica żył powierzchownych.
- Trombofilia.
- Słabe czynniki ryzyka (iloraz szans <2)
- Unieruchomienie w łóżku >3 dni.
- Cukrzyca.
- Nadciśnienie tętnicze.
- Bezruch spowodowany długim siedzeniem (np. długie podróże samochodem lub samolotem).
- Zaawansowany wiek.
- Laparoskopowe zabiegi chirurgiczne (np. cholecystektomia).
- Otyłość.
- Ciąża.
- Żylaki.
ICD–10
- I26 Zator płucny.
- I26.0 Zator płucny z informacją o ostrym sercu płucnym (ostre serce płucne)
I26.9 Zator płucny bez informacji o ostrym sercu płucnym
- I26.0 Zator płucny z informacją o ostrym sercu płucnym (ostre serce płucne)
Diagnostyka
Informacje ogólne
- Wiele przypadków ZP pozostaje nierozpoznanych.
- Objawy i wyniki badań bez wysokiej wartości predykcyjnej.
- Warto pamiętać: możliwe rozpoznanie różnicowe w przypadku niejasnych lub niejednoznacznych objawów!
- Zwłaszcza jeśli występują czynniki predysponujące.
- Często nic nie wskazuje na zakrzepicę żył głębokich.
- Częste choroby współwystępujące utrudniające rozpoznanie.
Wywiad
- Pytania o objawy: zmęczenie, duszność/tachypnoe, ból w klatce piersiowej, kołatanie serca, kaszel, krwioplucie, obrzęk i ból w obrębie kończyny dolnej.
- Najczęstsze objawy:
- ból w klatce piersiowej (57–64%), częściej o charakterze opłucnowym, rzadziej wieńcowym
- duszność (79%)
- tachypnoe (57–64%).
- Jeden z tych trzech objawów występuje u 92% pacjentów.
- Ból opłucnowy w klatce piersiowej (47%) częściej niż nieopłucnowy (17%).
- Rzadsze objawy:
- kaszel (43%)
- ból kończyn dolnych (35–42%)
- tachykardia (26–37%)
- krwioplucie (6%).
- Najczęstsze objawy:
- Nagłe wystąpienie dolegliwości.
- Powtarzające się epizody (zwiększają prawdopodobieństwo zatorowości płucnej).
- Systematyczny i szczegółowy wywiad uwzględniający czynniki predysponujące (patrz rozdział czynniki predysponujące).
Badanie fizykalne
Obserwacja
- Tachypnoe, niepokój.
- Możliwe poszerzenie żył szyjnych w niewydolności prawokomorowej serca.
- Obrzęk, ból jednej kończyny dolnej może być objawem ZŻG.
Ciśnienie tętnicze/puls
- Często tachykardia, zależnie od rozległości ZP ciśnienie prawidłowe lub obniżone.
Osłuchiwanie
- Najczęściej brak objawów lub wyniki nieswoiste.
- W przypadku zawału płuca możliwe tarcie opłucnej oraz czasami: większa głośność składowej płucnej II tonu serca i szmer rozkurczowy niedomykalności zastawki trójdzielnej.
Podstawowa diagnostyka
- Obejmuje parametry życiowe, EKG oraz D–dimery; RTG klatki piersiowej głównie jako diagnostyka różnicowa (rzadko zmiany typowe dla ZP).
- Każdy parametr z osobna nie jest wystarczająco swoisty ani czuły.6-8
- Jednak wszystkie razem są ważne we wstępnej ocenie klinicznej.
Ocena „prawdopodobieństwa klinicznego” ZP
- „Prawdopodobieństwo kliniczne” ZP (prawdopodobieństwo przed wykonaniem badania dodatkowego) decyduje o dalszym postępowaniu diagnostycznym!
- Ocena na podstawie wstępnej oceny klinicznej i z wykorzystaniem skal.
Określenie klinicznego prawdopodobieństwa zatorowości płucnej: skala Wellsa
- Najlepiej przebadano i zwalidowano skalę opracowaną przez Wellsa i wspólników oraz zmodyfikowaną skalę genewską.
- Skala Wellsa cechuje się większą trafnością niż skala genewska.
- Skala Wellsa obejmuje elementy wywiadu lekarskiego, badania fizykalnego i podstawowej diagnostyki.
- Oprócz wersji pierwotnej istnieje także wersja uproszczona.
- Prawdopodobieństwo kliniczne można ocenić na podstawie modelu trzypoziomowego (ryzyko ZP niskie/pośrednie/wysokie) lub dwupoziomowego (ZP mało prawdopodobna/prawdopodobna).
- Dokumentacja prawdopodobieństwa klinicznego jest ważna, ponieważ decyduje o dalszym postępowaniu.
- Wykazano następujące wartości parametrów oceny prawdopodobieństwa zatoru płuc wg skali Wellsa dla modelu dwupoziomowego u pacjentów hospitalizowanych:
- czułość 78,7%
- swoistość 92,2%
- wartość predykcyjna dodatnia (PPV) 92,9%
- wartość predykcyjna ujemna (NPV) 76,8%.9
Ocena klinicznego prawdopodobieństwo wystąpienia ZP: skala Wellsa2,10
- Patrz tabela zwalidowana skala kliniczna służąca do określenia klinicznego prawdopodobieństwa zatorowości płucnej skala Wellsa.
- Patrz tabel zatorowość płucna (ZP) skala Wellsa w trzech wersjach.
Dalsze postępowanie diagnostyczne
Podejrzenie ZP bez wstrząsu ani niedociśnienia2
- Niskie lub pośrednie prawdopodobieństwo kliniczne (ZP mało prawdopodobna)
- Oznaczenie D–dimerów
- D–dimery prawidłowe: bez żadnego specyficznego leczenia.
- D–dimery podwyższone: angiografia tomografii komputerowej (TK)
- angiografia TK bez zmian: bez antykoagulacji
- zmiany w angiografii TK: leczenie przeciwkrzepliwe.
- Przy ≤4 w pełnej skali Wellsa i niskich D–dimerach wskaźnik fałszywie ujemny wynosi 1,5%, co znaczy, że lekarz rodzinny może z dostateczną pewnością wykluczyć ZP.
- nie rozpoznawać ZP wyłącznie na podstawie podwyższonego (dodatniego) stężenia D-dimeru.1
- Oznaczenie D–dimerów
- Wysokie prawdopodobieństwo kliniczne (lub prawdopodobna ZP)
- Angiografia TK
- angiografia TK bez zmian: bez antykoagulacji
- zmiany w angiografii TK: leczenie przeciwkrzepliwe.
- Przy wysokim prawdopodobieństwie klinicznym (≥7 punktów w pełnej skali Wellsa): niezwłoczna hospitalizacja!
- Nie wykonywać pomiaru D-dimeru po uzyskaniu prawidłowego wyniku angiografi TK tętnic płucnych.1
Podejrzenie ZP ze wstrząsem lub niedociśnieniem2
- Przy natychmiastowym dostępie do angiografii TK – wykonanie angiografii TK.
- Angiografia TK bez zmian: poszukiwanie innych przyczyn niestabilności hemodynamicznej.
- Zmiany w angiografii TK: przywrócenie prawidłowej perfuzji płucnej (przede wszystkim tromboliza, alternatywnie leczenie chirurgiczne lub przezcewnikowe).
- Przy braku natychmiastowej dostępności angiografii TK – echokardiografia przezklatkowa.
- Brak cech przeciążenia prawej komory serca: poszukiwanie innych przyczyn niestabilności hemodynamicznej.
- Przeciążenie prawej komory serca: przywrócenie prawidłowej perfuzji płucnej (przede wszystkim tromboliza, alternatywnie leczenie chirurgiczne lub przezcewnikowe).
Podejrzenie ZP w ciąży2
- Skale określające prawdopodobieństwo kliniczne są w ciąży na ogół uznawane za bezużyteczne.
- W wytycznych ESC wspomina się jednak o skali YEARS stosowanej do celów diagnostycznych, zwalidowanej również dla kobiet w ciąży (brak zaleceń w tym zakresie w tych wytycznych oraz w wytycznych NICE).2
- Według tej skali przy klinicznym prawdopodobieństwie zatorowości płucnej i stwierdzeniu zakrzepicy w badaniu USG, stężenie D–dimerów.
- Jeśli nie ma objawów klinicznych, oznacza się stężenie D–dimerów.
- W wytycznych ESC wspomina się jednak o skali YEARS stosowanej do celów diagnostycznych, zwalidowanej również dla kobiet w ciąży (brak zaleceń w tym zakresie w tych wytycznych oraz w wytycznych NICE).2
- Niski poziom D–dimerów ma takie samo znaczenie dla wykluczenia ZP jak u innych pacjentów.2
- Stężenie D–dimerów rośnie w okresie ciąży, a w ostatnim trymestrze prawidłowy poziom D–dimerów należy do rzadkości.
- Jedynymi wiarygodnymi badaniami w diagnostyce ZP w okresie ciąży są badania obrazowe.11
- Jeśli przy podejrzeniu ZP potwierdzone zostanie rozpoznanie ZŻG, można ewentualnie zrezygnować z badań obrazowych płuc, ponieważ konieczne leczenie jest identyczne.
- Według przeglądu systematycznego Cochrane odpowiednim narzędziem diagnostycznym jest zarówno angio–TK płuc, jak i scyntygrafia płuc. Nie udało się znaleźć badań porównawczych z RM.12
- W Polsce dostępność scyntygrafii wentylacyjno‑perfuzyjnej płuc w diagnostyce ZP jest ograniczona1.
Diagnostyka różnicowa
- Ostry zawał mięśnia sercowego.
- Ostre zapalenie osierdzia (pericarditis).
- Obrzęk płuc.
- Rozwarstwienie aorty i tamponada serca.
- Pęknięcie przegrody międzykomorowej.
- Zapalenie osierdzia.
- Zapalenie płuc.
- Samoistna odma opłucnowa.
- Zapalenie opłucnej, nieswoiste.
- Hiperwentylacja.
- Neuralgia nerwu międzyżebrowego.
- Astma.
- Zaostrzenie POChP.
- Ostry brzuch (z podrażnieniem przepony).
- Wstrząs.
Badania w praktyce lekarza rodzinnego
- EKG
- Zespół S1Q3T3 (S w 1, załamek Q w 3 i ujemne T w 3) względnie swoisty dla ZP, ale o niskiej czułości.
- Ujemny załamek T w odprowadzeniu V2–V3 możliwy w ZP.
- Możliwy niepełny lub całkowity blok prawej odnogi pęczka Hisa.
- Nierzadko jedyną zmianą w badaniu EKG jest tachykardia zatokowa.
- Tak jak RTG klatki piersiowej, głównie w celu diagnostyki różnicowej (zawału mięśnia sercowego, zapalenia osierdzia).
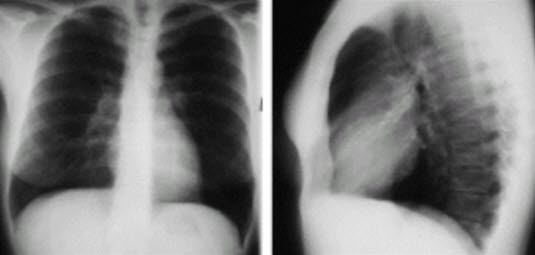
- RTG klatki piersiowej
- RTG klatki piersiowej przede wszystkim jako element diagnostyki różnicowej.
- Przy dużych zatorach płucnych ewentualnie poszerzenie tętnic płucnych, ograniczona perfuzja zajętych segmentów, ogniska niedodmy.
- Oznaczenie D–dimerów
- Badanie zaleca się w przypadku niskiego i pośredniego klinicznego prawdopodobieństwa ZP.
- Niemal 100% ujemnej wartości predykcyjnej.
- Ważne uzupełniające narzędzie diagnostyczne w praktyce lekarza rodzinnego (obecnie bez finansowania w ramach kontraktu z NFZ).
Wartość różnych procedur diagnostycznych
Badania laboratoryjne
- D–dimery (Latex/ELISA)
- Decyzja o wykonaniu oznaczenia D–dimerów po wcześniejszej ocenie prawdopodobieństwa klinicznego.
- Jeśli prawdopodobieństwo kliniczne jest niskie/pośrednie, a D–dimery niskie, dalsza diagnostyka w kierunku ZP nie jest konieczna.
- Na oddziale ratunkowym czułość 96–98%, swoistość niska (około 45%).
- Wysoka ujemna wartość predykcyjna (niemal 100%).
- Niska dodatnia wartość predykcyjna (podwyższony poziom D–dimerów m.in. przy zakażeniach, nowotworach złośliwych, krwawieniach, urazach, zabiegach chirurgicznych, ciąży).
- Wyraźnie podwyższony poziom D–dimerów ma wyższą dodatnią wartość predykcyjną dla ZP w porównaniu z nieznacznie podwyższonym poziomem.
- Gazometria krwi tętniczej
- Niska czułość i swoistość diagnostyczna.
- Ważna w kontekście ogólnej oceny wydolności oddechowej.
- Troponina
- Brak wartości diagnostycznej.
- Znaczenie prognostyczne w przypadku potwierdzonej ZP.
- BNP, NT–proBNP
- Brak wartości diagnostycznej.
- Znaczenie prognostyczne w przypadku potwierdzonej ZP.
- Diagnostyka trombofilii
- Do rozważenia w dalszym okresie po rozpoznaniu ZP:
- w przypadku pierwszorazowej ZP u pacjentów w wieku poniżej 50 lat
- przy nawracającej ZP
- w przypadku występowania ZP w rodzinie.
- Oporność na aktywowane białko C (APC) (mutacja genu czynnika V Leiden), AT–III, białko C i białko S, mutacja protrombiny G20210A, przeciwciała antyfosfolipidowe, ewentualnie hiperhomocysteinemia.
- Do rozważenia w dalszym okresie po rozpoznaniu ZP:
Diagnostyka obrazowa
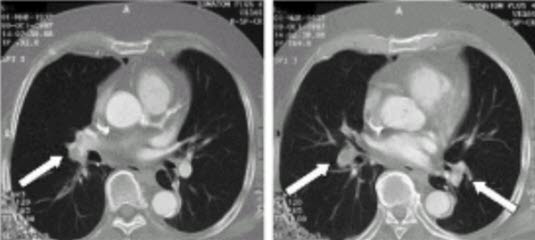
- Angiografia TK (wielowarstwowa spiralna tomografia)
- Metoda nieinwazyjna.
- Odpowiednia do wykrywania i wykluczania zatorowości płucnej.
- U pacjentów z małym prawdopodobieństwem zatoru najczęściej wykonywana po badaniu stężenia D-dimerów, a u pacjentów z dużym prawdopodobieństwem rozpoczęcie procesu diagnostycznego od wykonania angiografi TK.1
- Procedura podstawowa w razie konieczności wykonania badań obrazowych.2
- Czułość ponad 90%, swoistość 90–100%.
- Stosowanie u kobiet w ciąży uzasadnione (patrz algorytm diagnostyczny).
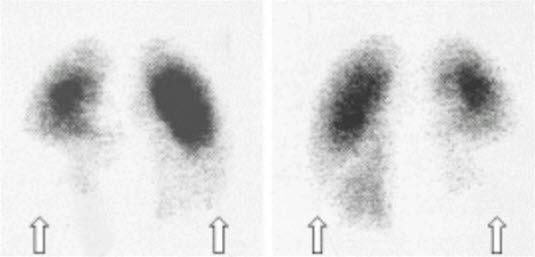
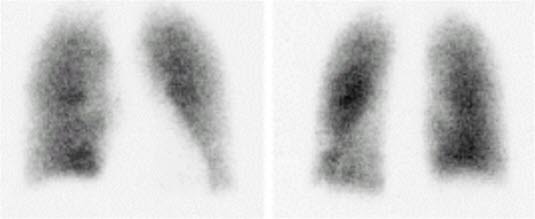
- Scyntygrafia wentylacyjno–perfuzyjna
- Odpowiednia do wykrywania i wykluczania ZP.
- U pacjentów z prawidłowym obrazem RTG klatki piersiowej uzasadnione jest ograniczenie się do scyntygrafii perfuzyjnej.
- Alternatywa dla TK w przypadku:
- uczulenia na środki kontrastowe, niewydolności nerek
- ciąży (mniejsze narażenie na promieniowanie).2
- Zastosowanie SPECT ogranicza liczbę niediagnostycznych wyników obrazowych.2
- W Polsce ograniczona dostępność badania.
- Angiografia płucna
- Metoda inwazyjna z założeniem cewnika do tętnicy.
- Przez długi czas złoty standard, dziś niemal bez wartości diagnostycznej.
- W ramach przezcewnikowego leczenia ZP.
- Angiografia RM
- Jeszcze niedostatecznie opracowana (niska czułość, wysoki odsetek obrazów niediagnostycznych).2
- Echokardiografia
- Rozpoznanie poszerzenia/dysfunkcji prawej komory serca, ewentualnie poszerzenie żyły głównej dolnej.
- Wartość badania echokardiograficznego zależna od sytuacji hemodynamicznej pacjentów.
- U pacjentów niestabilnych z podejrzeniem zatorowości płucnej wykonać na wczesnym etapie.
- Nie należy do podstawowej diagnostyki u pacjentów stabilnych hemodynamicznie.
- U stabilnych pacjentów z potwierdzoną zatorowością płucną w celu stratyfikacji ryzyka.2
- Ultrasonograficzny test uciskowy żył kończyn dolnych
- Rozpoznanie zakrzepicy żył głębokich kończyny dolnej u 30–50% pacjentów z ZP.
- Jeśli u pacjenta z wysokim klinicznym prawdopodobieństwem ZP badanie ultrasonograficzne potwierdziło zakrzepicę żył kończyny dolnej, zatorowość płucną można uznać za potwierdzoną.
Wskazania do skierowania do hospitalizacji
- W przypadku klinicznego podejrzenia zatorowości płucnej: skierowanie do szpitala
- U pacjentów z ZP oraz małym ryzykiem zgonu i innych powikłań rozważyć wczesny wypis ze szpitala i leczenie w domu.1
Leczenie
Cele leczenia
- Zapobieganie przedwczesnej śmierci.
- Poprawa perfuzji płuc.
- Unikanie nawrotów.
- Dodatkowe informacje w artykule leczenie przeciwkrzepliwe.
Opcje leczenia w fazie ostrej
- U chorych z podejrzeniem ZP i wysokim ryzykiem zgonu niezwłoczne stosowanie heparyny niefrakcjonowanej (HNF) w dawce 80 IU/kg i.v. już w trakcie prowadzonej diagnostyki1
- po ocenie przeciwwskazań do leczenia przeciwkrzepliwego.
- Pozajelitowa terapia przeciwkrzepliwa
- Heparyny drobnocząsteczkowe (HDCz), alternatywnie HNF lub fondaparynuks przez 5–10 dni.
- Przy średnim lub wysokim prawdopodobieństwie ZP wdrożenie leczenia jeszcze przed zakończeniem diagnostyki.
- Leczenie "na zakładkę" stosuje się w przypadku kontynuacji leczenia antagonistą witaminy K.
- Doustne leczenie przeciwkrzepliwe
- Antagoniści witaminy K
- Nowe (NOAC) lub bezpośrednie (DOAC) doustne leki przeciwkrzepliwe jako alternatywa dla antagonistów witaminy K (patrz poniżej)
- Dabigatran (inhibitor trombiny) lub edoksaban (inhibitor czynnika Xa): po wysyceniu heparyną bez leczenia "na zakładkę", od 5., 6. lub 7. dnia podawanie dabigatranu (2 x 150 mg/dziennie) lub edoksabanu (60 mg/dziennie).
- Rywaroksaban lub apiksaban (inhibitory czynnika Xa): natychmiastowe rozpoczęcie leczenia (bez pozajelitowego podawania heparyny) rywaroksabanem (2 x 15 mg/dziennie przez 3 tygodnie, następnie 20 mg/dziennie) lub apiksabanem (2 x 10 mg/dziennie przez 1 tydzień, następnie 2 x 5 mg/dziennie).
- O wyborze konkretnego leku decyduje: wybór pomiędzy dawkowaniem 1 lub 2 razy/dz., koszt leczenia, czynność nerek, potencjalne interakcje z innymi lekami stosowanymi przez chorego.
- Tromboliza – podstawowe leczenie reperfuzyjne we wstrząsie/niedociśnieniu
- Skuteczność trombolizy ogólnoustrojowej została udowodniona ponad wszelką wątpliwość.
- Dostępne są rekombinowany tkankowy aktywator plazminogenu (rt–PA), streptokinaza i urokinaza oraz ludzki aktywator plazminogenu - alteptaza (Actilyse).
- Znaczne ryzyko krwawienia wewnątrzczaszkowego.
- Obecnie w leczeniu trombolitycznym preferuje się podanie leku do tętnicy płucnej w stosunku do leczenia systemowego.1
- Embolektomia chirurgiczna
- Przy przeciwwskazaniach do lizy, po niepowodzeniu lizy, jeśli wystąpił wstrząs mogący doprowadzić do zgonu zanim liza zacznie działać.
- Przezcewnikowe leczenie interwencyjne
- Przy przeciwwskazaniach do lizy lub po niepowodzeniu lizy.
- Metody mechaniczne: trombektomia rotacyjna, aspiracyjna, hydrodynamiczna lub z odsysaniem.
- Filtr do żyły głównej dolnej (IVC filter)14
- Opcja w przypadku bezwzględnego przeciwwskazania do antykoagulacji lub nawracającej ZP pomimo odpowiedniego leczenia przeciwkrzepliwego.
- Często występują zarówno wczesne, jak i późne powikłania.
- Według retrospektywnego amerykańskiego badania kohortowego zastosowanie filtra do żyły głównej u starszych pacjentów nie zwiększa przeżywalności, istnieją zaś dowody na zwiększoną śmiertelność po 30 dniach i po 1 roku.15
Grupy specjalne
- U kobiet w ciąży16-18
- ZP jest najczęstszą przyczyną zgonu kobiet w ciąży i połogu w krajach rozwiniętych.1
- Leczenie przeciwkrzepliwe heparynami (najlepiej HDCz), ponieważ nie przenikają one bariery łożyskowej.
- W przypadku wysokiego ryzyka ZP należy rozważyć trombolizę lub embolektomię chirurgiczną.
- Nie podawać w ciąży antagonistów witaminy K (embriopatia, hepatopatia płodu, krwotok u płodu w III trymestrze).
- NOAC ze względu na brak badań są przeciwwskazane w ciąży.
- ZP wymaga leczenia przeciwkrzepliwego przez całą ciążę oraz później, w okresie poporodowym, ale łącznie nie krócej niż przez 3 miesiące.
- W okresie poporodowym leczenie przeciwkrzepliwe przez co najmniej 6 tygodni.
- W świeżym ZP, u kobiet obciążonych zwiększonym ryzykiem krwawienia lub osteoporozy sugeruje się zmniejszenie dawki HDCz lub HNF o 25% i w miarę możliwości leczenie pod kontrolą aktywności anty‑Xa.1
- Kobiety w okresie karmienia piersia1
- bezpieczne opcje leczenia: HNF, HDCz, warfaryna, acenokumarol, fondaparynuks.
- nie stosować NOAC ze względu na brak badań.
- Choroba nowotworowa
- Leczenie za pomocą HDCz przez co najmniej 3–6 miesięcy.2
- Po 3–6 miesiącach indywidualna decyzja o kontynuacji leczenia HDCz lub przejściu na antykoagulację doustną.2
- Alternatywą dla HDCz jest stosowanie NOAC, zalecane także przez co najmniej 3–6 miesięcy.13
- Prawdopodobnie brak istotnych różnic pomiędzy poszczególnymi NOAC.
- Stałe leczenie przeciwkrzepliwe (>6 mies.) lub do czasu wyleczenia choroby nowotworowej.2
- stosowanie NOAC lub HDCz.
- Choroby nowotworowe są czynnikiem ryzyka niekorzystnego przebiegu po ostrej ZP.2
- Ciężkie zaburzenia czynności nerek (eGFR2)
- U pacjentów z niewydolnością/chorobą nerek, szczególnie starszych, z cukrzycą lub dużym ryzykiem krwawienia należy uwzględniać te czynniki przy decydowaniu o terapii lekami przeciwkrzepliwymi wydalanymi przez nerki (HDCz, fondaparynuks i NOAC).
- postępowanie zgodnie z zaleceniem producenta, obejmuje następujące możliwości: 1) unikanie stosowania leku gromadzącego się w organizmie w przypadku niewydolności nerek; 2) zmniejszenie dawki; 3) laboratoryjne monitorowanie efektu przeciwkrzepliwego.1
- Dawka wysycająca heparyny niefrakcjonowanej (kontrola aPTT) lub HDCz, następnie antagonista witaminy K (VKA).
- VKA można również stosować w niewydolności nerek/przewlekłej chorobie nerek w stadium 4. i 5., o ile ryzyko udaru i zatoru znacznie przewyższa ryzyko krwawienia.
- Dabigatran jest przeciwwskazany u pacjentów z klirensem kreatyniny (CrCl)<30 ml/min. Apiksaban, edoksaban i rywaroksaban są przeciwwskazane przy CrCl<15 ml/min2.
- U pacjentów z niewydolnością/chorobą nerek, szczególnie starszych, z cukrzycą lub dużym ryzykiem krwawienia należy uwzględniać te czynniki przy decydowaniu o terapii lekami przeciwkrzepliwymi wydalanymi przez nerki (HDCz, fondaparynuks i NOAC).
- Zaburzenia czynności wątroby
Stratyfikacja ryzyka2
- Po rozpoznaniu, do celów strategii leczenia skorygowanej o ryzyko, podział na 4 grupy ryzyka (wysokie/średnio wysokie/średnio niskie/niskie). Uwzględnia się:
- Stan hemodynamiczny.
- Skalę ryzyka klinicznego (Pulmonary Embolism Severity Index – PESI)
- ryzyko zgonu w ciągu 30 dni w zależności od liczby punktów
- patrz tabela PESI (Pulmonary Embolism Severity Index).
- Czynność prawej komory serca (Echo, TK).
- Biomarkery (troponina, BNP).
Strategia leczenia w zależności od ryzyka2
- Wysokie ryzyko (wstrząs lub niedociśnienie)
- Reperfuzja (tromboliza, embolektomia chirurgiczna lub przezcewnikowa).
- Średnio wysokie ryzyko (stabilne krążenie, PESI III–IV, dysfunkcja prawej komory, biomarkery dodatnie)
- Leczenie przeciwkrzepliwe, monitorowanie, ewentualnie reperfuzja ratunkowa w przypadku dekompensacji hemodynamicznej.
- Korzyści z zastosowania trombolizy w grupie średnio wysokiego ryzyka są nadal przedmiotem dyskusji.
- Leczenie przeciwkrzepliwe, monitorowanie, ewentualnie reperfuzja ratunkowa w przypadku dekompensacji hemodynamicznej.
- Średnio niskie ryzyko (stabilne krążenie, PESI III–IV, dysfunkcja prawej komory lub biomarkery mogą być dodatnie)
- Leczenie przeciwkrzepliwe, hospitalizacja.
- Niskie ryzyko (stabilne krążenie, PESI I–II, prawidłowa funkcja prawej komory, biomarkery ujemne)
- Leczenie przeciwkrzepliwe, rozważyć wczesny wypis.
Profilaktyka wtórna z zastosowaniem antagonistów witaminy K lub NOAC
- Stosowanie profilaktyki znacznie zmniejsza ryzyko żylnej choroby zakrzepowo zatorowej (ŻChZZ), w tym zatorowości płuc (ZP). Jednak żadna ze stosowanych metod nie zapobiega całkowicie chorobie. U osób otrzymujących nawet optymalną profilaktykę, w razie wystąpienia objawów sugerujących ŻChZZ w diagnostyce różnicowej należy zawsze uwzględniać ZŻG i ZP!1
- Profilaktyka przeciwzakrzepowa jest skuteczna i znajduje uzasadnienie klinicznie oraz finansowe.
- Antagoniści witaminy K
- Docelowy INR: 2–3
- Przed operacją albo inwazyjną procedurą konieczne może być przerwanie doustnej antykoagulacji z przejściem na leczenie pozajelitowe (leczenie pomostowe).19
- Docelowy INR: 2–3
- Nowe lub bezpośrednie doustne antykoagulanty (NOAC lub DOAC): skuteczność NOAC jest porównywalna do skuteczności antagonistów witaminy K przy prawdopodobnie niższym ryzyku ciężkich powikłań krwotocznych.2
- Rywaroksaban
- 2 x 15 mg/dziennie przez pierwsze 3 tygodnie, następnie 20 mg/dziennie w leczeniu i profilaktyce nawrotu choroby.
- Apiksaban
- 2 x 10 mg/dziennie w pierwszym tygodniu, następnie 2 x 5 mg/dziennie przez 6 miesięcy; profilaktyka nawrotów 2 x 2,5 mg/dziennie.
- Edoksaban
- Po początkowym leczeniu przeciwkrzepliwym drogą pozajelitową przez co najmniej 5 dni, edoksaban 60 mg/dziennie jako leczenie i profilaktyka nawrotów choroby.
- Dabigatran
- Po początkowym leczeniu przeciwkrzepliwym drogą pozajelitową przez co najmniej 5 dni, dabigatran 2 x 150 mg/dziennie jako leczenie i profilaktyka nawrotów choroby.
- Uwaga: konieczne dostosowanie dawki NOAC albo w razie przeciwwskazań, szczególnie w przypadku zaburzonej czynności nerek, wymagana regularna kontrola!
- Rywaroksaban
- Zalety i wady DOAC w porównaniu z VKA nadal budzą kontrowersje.
- NOAC nie należy stosować zamiast VKA u pacjentów.
- Dobrze odpowiadających na VKA lub takich, u których INR jest stabilny w zakresie terapeutycznym w warunkach dotychczasowego leczenia VKA (INR w zakresie terapeutycznym >70% czasu).
- Przy braku pewności co do przestrzegania zaleceń.
- Z wysokim ryzykiem krwawienia z przewodu pokarmowego (np. przy wrzodach żołądka lub dwunastnicy, żylakach przełyku, przewlekłych chorobach jelit o charakterze zapalnym, zapaleniu uchyłków).
- Przy ciężkich zaburzeniach czynności nerek (CrCl<30 ml/min. dla dabigatranu, dla pozostałych CrCl<15 ml/min.).
- Przyjmujących leki, dla których jako inhibitorów lub induktorów cytochromu P450–3A4 (CYP3A4) i glikoproteiny P (P–gp) zostały opisane interakcje, a zatem ich jednoczesne stosowanie jest przeciwwskazane lub należy go unikać (w tym amiodaron, dronedaron, azolowe leki przeciwgrzybiczne, karbamazepina, cyklosporyna, klarytromycyna, preparaty z dziurawcem zwyczajnym, inhibitory proteazy HIV, werapamil).
- Z mechanicznymi zastawkami serca, w tym po przezskórnej wymianie zastawki aortalnej (TAVI).
- NOAC zamiast VKA można stosować tylko po przeprowadzeniu dokładnej oceny.
- Przy umiarkowanym upośledzeniu funkcji nerek (CrCl 30–50 ml/min.: zmniejszenie dawki konieczne w przypadku dabigatranu, edoksabanu, rywaroksabanu, nie w przypadku apiksabanu).
- W przypadku leczenia wielolekowego (więcej niż 5 leków o działaniu ogólnoustrojowym): istotne klinicznie interakcje pomiędzy innymi lekami a NOAC jak dotąd zbadano tylko w ograniczonym zakresie i nie uwzględnia się ich z uwagi na brak możliwości kontroli laboratoryjnej.
- NOAC mogą być opcją zamiast VKA dla pacjentów
- Potrzebujących doustnej antykoagulacji prawdopodobnie tylko przez krótki czas (np. do 3 miesięcy).
- Z wysokim ryzykiem krwotoku śródmózgowego, jeśli korzyść z leczenia przeciwkrzepliwego co do zasady przeważa nad ryzykiem krwotoku śródmózgowego.
- Przy zwiększonym ryzyku wystąpienia swoistych interakcji lekowych lub pokarmowych w warunkach stosowania VKA.
- Ze znaczącymi wahaniami poziomu INR mimo regularnego stosowania VKA, u których regularna kontrola INR jest utrudniona.
- Po 3–6 miesiącach ponowna ocena potrzeby leczenia, czasu trwania leczenia, stosowanej substancji.
- Decyzja podejmowana jest zawsze w kontekście istniejących lub nowych zagrożeń krwawieniem.
- Wszystkie NOAC zostały formalnie dopuszczone do stosowania również w przedłużonej terapii podtrzymującej.
- Pacjenci powinni otrzymać kartę informacyjną z danymi dotyczącymi wskazań i stosowanej substancji.
Czas trwania terapii przeciwkrzepliwej
- Patrz artykuł leczenie przeciwkrzepliwe.
- U wszystkich pacjentów z ZP minimalny czas trwania antykoagulacji wynosi 3 miesiące.2
- Po 3–6 miesiącach należy podjąć decyzję o zakończeniu lub kontynuowaniu antykoagulacji.
Wytyczne: czas leczenia przeciwkrzepliwego1
Pacjenci z ZP
- Leczenie przeciwkrzepliwe przez ≥3 miesiące jest zalecane u wszystkich pacjentów z ZP, w celu zapobiegania nawrotom.
- Po 3 miesiącach ocenić ryzyko nawrotu i krwawienia.
- Przy braku wysokiego ryzyka krwawienia, jeśli ryzyko nawrotu jest:
- Duże (np. aktywny nowotwór złośliwy, choroba reumatyczna, trombofilia) - bezterminowa antykoagulacja
- Umiarkowane (np. nawracająca lub niesprowokowana ŻChZZ, otyłość, niewydolność serca, POChP) - przedłużone leczenie, z nieokreślonym czasem trwania
- Małe (występowanie przemijającego/odwracalnego czynnika ryzyka, np. operacja, uraz kończyny dolnej, stosowanie doustnych środków antykoncepcyjnych) – przerwać antykoagulacje po 3 miesiącach.
- Stosować leczenie przeciwkrzepliwe, a nie ASA
- NOAC w pełnych dawkach (dla rywaroksabanu 20 mg 1 × dz., a dla apiksabanu 5 mg 2 × dz.) lub zredukowanych dawkach (dla rywaroksabanu 10 mg 1 × dz., a dla apiksabanu 2,5 mg 2 × dz.), w zależności od ryzyka nawrotu i ryzyka krwawienia
- VKA w dawkach pozwalających utrzymać INR w przedziale 2,0–3,0.
- Jeśli istnieją wskazania do przedłużonego leczenia przeciwkrzepliwego, ale pacjent nie może go stosować (np. działania niepożądane) rozważyć sulodeksyd 500 LSU 2 × dz. lub ASA 100 mg/d.
- U chorych z pierwszorazowym epizodem ZP profilaktykę wtórną, czyli przedłużone powyżej 3 miesięcy leczenie, z tzw. nieokreślonym czasem trwania (brak określania z góry czasu kontynuacji leczenia, okresowa ocena jego zasadności) stosować u pacjenta:
- bez uchwytnego czynnika ryzyka
- z utrzymującym się czynnikiem ryzyka
Pacjenci z aktywną chorobą nowotworową
- U pacjentów z ZP i chorobą nowotworową preferowane są HDCz wobec VKA w dawce dostosowanej do wagi, podawane podskórnie przez pierwsze 6 miesięcy.
- U chorych z ZP i nowotworem należy rozważyć przedłużoną terapię przeciwkrzepliwą (wykraczającą poza pierwsze 6 miesięcy) na czas nieokreślony lub do czasu wyleczenia nowotworu
- stosowanie NOAC lub HDCz.
Odwracanie działania w razie krwawienia
HDCz
- Odwracanie za pomocą protaminy.
- Protamina, ze względu na osłabione wiązanie HDC można zneutralizować tylko 50% (np. enoksaparyna) do 85% (np. tinzaparyna) aktywności anty–Xa.
- Rekombinowane białko andeksanet alfa, przeznaczone głównie do odwracania działania NOAC z bezpośrednim hamowaniem czynnika Xa, znosi również działanie enoksaparyny.20
Antagoniści witaminy K
- Witamina K: 5–20 mg doustnie albo dożylnie, w razie potrzeby powtórzenie po 8–12 godzinach.
- Koncentrat czynników zespołu protrombiny (PCC, prothrombin complex concentrate).21
- Osocze świeżo mrożone (FFP, Fresh Frozen Plasma).21
NOAC
- Do 2015 r. nie były dostępne żadne specyficzne antidota NOAC.
- Dabigatran (inhibitor czynnika IIa)
- 2015 r. – dopuszczenie do obrotu idarucizumabu jako antidotum dla dabigatranu.
- Rywaroksaban, apiksaban, edoksaban (inhibitory czynnika Xa (FXa))
- 2019 r. – warunkowe dopuszczenie do obrotu andeksanetu alfa jako antidotum dla apiksabanu i rywaroksabanu (pod warunkiem dalszego badania bezpieczeństwa i skuteczności).
- Andeksanet alfa jest rekombinowaną cząsteczką o wysokim powinowactwie do czynnika Xa.
- Konkurencyjne hamowanie antagonistów czynnika Xa.
- Zastosowanie bolusa, a potem wlewu powoduje szybki i znaczący spadek aktywności anty–FXa.
- Dodatkowa korzyść stosowania andaksanetu alfa nie została udowodniona z powodu niewystarczających danych.
- 2019 r. – warunkowe dopuszczenie do obrotu andeksanetu alfa jako antidotum dla apiksabanu i rywaroksabanu (pod warunkiem dalszego badania bezpieczeństwa i skuteczności).
- Podanie kompleksu protrombiny w ciężkich zdarzeniach krwotocznych.23
Pacjenci leczeni przeciwkrzepliwe poddawani zabiegom stomatologicznym
- Standardowe zabiegi stomatologiczne o ograniczonym zakresie przy wysokim/średnim ryzyku zakrzepowo–zatorowym wymagają przestrzegania następujących podstawowych zasad:
- Leczenie antagonistami witaminy K
- Oznaczenie INR 2 dni przed zabiegiem i poinformowanie o wyniku pacjentów i/lub gabinetu stomatologicznego.
- Jeśli INR jest w górnym zakresie terapeutycznym, należy przejściowo zmniejszyć dawkę, aby obniżyć INR do dolnego zakresu terapeutycznego.
- Leczenie NOAC
- Kontynuacja leczenia i przeprowadzenie zabiegu jak najpóźniej, tzn. tuż przed kolejnym planowym przyjęciem leku.
- Jeśli w indywidualnym okresie obserwacji pooperacyjnej nie dojdzie do krwawienia, należy niezwłocznie przyjąć kolejną dawkę NOAC.
- Leczenie antagonistami witaminy K
Zalecenia dotyczące leczenia stomatologicznego
- Standardowe zabiegi w ograniczonym zakresie (ekstrakcja zęba, osteotomia, implantacja lub zdefiniowane zabiegi w ramach chirurgii tkanek miękkich):
- Przy wysokim ryzyku zakrzepowo–zatorowym należy wykonywać bez przerywania leczenia przeciwkrzepliwego.
- Przy niskim lub średnim ryzyku zakrzepowo-zatorowym z wysokim ryzykiem krwawienia powinny być wykonywane po przerwaniu antykoagulacji (bez leczenia pomostowego).
- W przypadku antagonistów witaminy K przed zabiegiem należy oznaczyć INR (24–48 h przed zabiegiem) (w indywidualnych przypadkach możliwy krótszy odstęp czasowy).
- Działanie antagonistów witaminy K (VKA) powinno być utrzymywane w dolnym zakresie terapeutycznym.
- W przypadku nowych doustnych antykoagulantów (NOAC) zabieg należy przeprowadzić jak najpóźniej po przyjęciu ostatniej dawki (co najmniej 12 h).
- Dłuższy odstęp czasu w niewydolności nerek i przy przyjmowaniu dabigatranu.
- U pacjentów poddawanych terapii podwójnej lub potrójnej zabiegi planowe należy odłożyć w czasie. W przypadku zabiegów w trybie nagłym należy kontynuować terapię podwójną lub potrójną.
- Monoterapię niskimi dawkami ASA w przypadku chirurgicznych zabiegów stomatologicznych należy kontynuować.
- W przypadku zabiegów obarczonych większym ryzykiem krwawienia (np. zakażone rany/ropnie, zabiegi w obszarze dna jamy ustnej, zatoki szczękowej lub w jej sąsiedztwie) leczenie powinno być prowadzone przez lekarza specjalistę w zakresie chirurgii jamy ustnej/chirurgii szczękowej i chirurgii twarzoczaszki lub na oddziale w specjalistycznej klinice. W takich przypadkach może być wskazane przestawienie na heparynę (leczenie pomostowe).
Przebieg, powikłania i rokowanie
Przebieg
- We wczesnej fazie śmiertelność wynosi około 10% – do 90%, do zgonów dochodzi w fazie ostrej w ciągu pierwszych 2 godzin od wystąpienia objawów.
- Najbardziej narażone na zgonu są osoby starsze, pacjenci z nowotworami, CVD oraz osoby po ciężkich operacjach.
- Dalszy przebieg zależy głównie od rozległości ZP, ale jest bardzo zmienny w poszczególnych przypadkach i trudny do przewidzenia.
- Zwykle zatory ustępują w ciągu miesiąca.
- Rozwój przewlekłego zakrzepowo–zatorowego nadciśnienia płucnego jest prawdopodobnie częstszy niż dotychczas sądzono (4% po 2 latach).24
Powikłania
- Nawracająca ZP
- W różnych badaniach wykazano różną częstość występowania (2,5–5% w pierwszych 6–12 miesiącach); odsetek nawrotów ŻChZZ zakończonej zgonem w pierwszych 3 miesiącach przy stosowaniu antykoagulacji wynosi 0,4%.25
- Krwawienia
- Częstość zależy od wieku, chorób podstawowych, poziomu antykoagulacji i czasu trwania leczenia (2–6% w ciągu pierwszych 6–12 miesięcy); odsetek krwawień zakończonych zgonem u pacjentów z ŻChZZ w ciągu pierwszych 3 miesięcy stosowania antykoagulacji wynosi 0,2%.25
- Przewlekłe zakrzepowo–zatorowe nadciśnienie płucne.26
Rokowanie
Śmiertelności
- Wysoka śmiertelność przy masywnej zatorowości (30–50%).27
- Śmiertelność nieleczonej ZP do 30%.
- Śmiertelność spada do 1–4% przy szybkim rozpoznaniu i wdrożeniu leczenia przeciwkrzepliwego.
- Analizy trendów czasowych wskazują na spadek śmiertelności wskutek ostrej ZP, co może być spowodowane skuteczniejszym leczeniem i ściślejszym przestrzeganiem wytycznych.
Predykatory złego rokowania (Geneva Prognostic Index)
- Choroba nowotworowa.
- Niewydolność serca.
- Przebyta ZŻG.
- Niedociśnienie.
- Hipoksemia.
- ZŻG w badaniu USG.
Indeks ciężkości
- Patrz tabela PESI (Pulmonary Embolism Severity Index).
- Tabelę można również wykorzystywać w podejmowaniu decyzji o tym, u których pacjentów można rozważać wcześniejszy wypis i leczenie ambulatoryjne.
Dalsze postępowanie
- Dalsze postępowanie u pacjentów poddawanych doustnej antykoagulacji może prowadzić lekarz rodzinny.
Diagnostyka nowotworów w zakrzepicy żylnej niewiadomego pochodzenia
- W przypadku zakrzepicy żylnej niewiadomego pochodzenia należy zbadać pacjenta pod kątem ewentualnej choroby nowotworowej.
- Wybór działań diagnostycznych zależy od wywiadu lekarskiego oraz oceny ryzyka typowego dla wieku i płci.
- Około 15% pacjentów z ostrą ZŻG w chwili rozpoznania ma stwierdzoną chorobę nowotworową; ryzyko wystąpienia wcześniej niewykrytej choroby nowotworowej wynosi 3–15%.
- Decyzję o zakresie badań w przypadku samoistnej, niezwiązanej z ryzykiem ZŻG należy podjąć indywidualnie. Panuje zgodność co do przeprowadzenia ukierunkowanego wywiadu lekarskiego, badania fizykalnego, podstawowych badań laboratoryjnych i aktualizacji badań przesiewowych typowych dla płci i wieku.
- Dalsze postępowanie może obejmować: USG jamy brzusznej, RTG klatki piersiowej, TK jamy brzusznej/klatki piersiowej.
Informacje dla pacjentów
Edukacja pacjenta
- Ogólnie o chorobie, jej przyczynach, leczeniu i rokowaniu.
- O czynnikach ryzyka, a także objawach ewentualnego nawrotu choroby. Szybka konsultacja jest bardzo ważna ze względu na wczesne rozpoznanie i leczenie.
- Preparaty łączone (doustne środki antykoncepcyjne) nie są zalecane pacjentkom po zatorowości płucnej, także jako substytucja estrogenów w okresie menopauzy lub później.
- O podawanych lekach, w tym o działaniach niepożądanych i interakcjach.
Materiały edukacyjne dla pacjentów
- Zatorowość płucna (skrzep krwi w płucach).
- Podwyższona krzepliwość krwi (skłonności do tworzenia się skrzeplin).
Ilustracje
Źródła
Wytyczne
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC). Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (Wytyczne dotyczące diagnostyki i postępowania w ostrej zatorowości płucnej opracowane we współpracy z Europejskie Towarzystwa Chorób Płuc), stan z 2019 roku, www.esc.org
- National Institute for Health and Care Excellence, Venous thromboembolic diseases: diagnosis, management and thrombophilia testing (Żylna choroba zakrzepowo–zatorowa: diagnostyka, leczenie i badanie trombofilii), stan z 2020 roku, www.nice.org.uk
-
Podolak-Dawidziak M, Krasiński Z, Urbanek T, et al. Żylna choroba zakrzepowo-zatorowa - profilaktyka, rozpoznawanie i leczenie. Wytyczne polskie - aktualizacja 2024. Medycyna Praktyczna wydanie specjalne, grudzień 2024. MP
Piśmiennictwo
- Podolak-Dawidziak M, Krasiński Z, Urbanek T, et al. Żylna choroba zakrzepowo-zatorowa - profilaktyka, rozpoznawanie i leczenie. Wytyczne polskie - aktualizacja 2024. Medycyna Praktyczna wydanie specjalne, grudzień 2024. www.pto.med.pl
- Konstantinides S., Meyer G., Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS), Eur Heart J 2020, 41: 543-603, doi:10.1093/eurheartj/ehz405, DOI
- Douketis J., Tosetto A., Marucci M., et al. Risk of recurrence after venous thromboembolism in men and women: patient level meta–analysis, BMJ 2011, 342: d813, www.bmj.com
- Apenteng P.N., Hobbs F.R., Roalfe A., et al. Incidence of venous thromboembolism in care homes: a prospective cohort study, Br J Gen Pract luty 2017, 67 (655): 130-7, pmid:28093420, PubMed
- Velmahos G.C., Spaniola K., Tabbara M., et al. Pulmonary embolism and deep venous thrombosis in trauma: are they related?, Arch Surg 2009, 144: 928-32, PubMed
- Robert–Ebadi H., Le Gal G., Couturaud F.C.M. et al. Differenses in clinical presentation of pulmonary embolism in women and men, J Thromb Haemost 2010, 8: 693-8, PubMed
- Wells P.S. Integrated strategies for the diagnosis of venous thromboembolism, J Thromb Haemost 2007, 5 (suppl. 1): 41-50, www.ncbi.nlm.nih.gov
- Pollak A.W., McBane R.D. Succinct review of the new VTE prevention and management guidelines, Mayo Clinic Proceedings 2014, 89, 3; 394-408, www.ncbi.nlm.nih.gov
- Seghda TAA, Tall Thiam A, Diendéré A et al. Evaluation of the Diagnostic Accuracy of the Wells Score in Pulmonary Embolism. Cardiology and Cardiovascular Medicine 2024; 8:531-537. www.fortunejournals.com
- Gibson N.S., Sohne M., Kruip M.J., et al. Further validation and simplification of the Wells clinical decision rule in pulmonary embolism, Thromb Haemost 2008, 99: 229-34, www.ncbi.nlm.nih.gov
- ATS Guideline – Evaluation of Suspected Pulmonary Embolism in Pregnancy. Radiology 2012, 262 (2): 635-46, www.ncbi.nlm.nih.gov
- van Mens T., Scheres L., de Jong P., et al. Imaging for the exclusion of pulmonary embolism in pregnancy (Review). Cochrane Database of Systematic Reviews 2017, 1:1-64, doi:10.1002/14651858.CD011053.pub2, DOI
- National Institute for Health and Care Excellence. Venous thromboembolic diseases: diagnosis, management and thrombophilia testing, NICE Guideline, Stand 2020, www.nice.org.uk
- The PREPIC Study Group. Eight–year follow–up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prevention du Risque d`Embolie Pulmonaire par Interruption Cave) randomized study, Circulation 2005, 112: 416-22, www.ncbi.nlm.nih.gov
- Bikdeli B., Wang Y., Jimenez D., et al. Association of Inferior Vena Cava Filter Use With Mortality Rates in Older Adults With Acute Pulmonary Embolism, JAMA Intern Med 2018, pmid:30535318, www.ncbi.nlm.nih.gov
- Bates S.M., Greer I.A., Middeldorp S., et al. American College of Chest Physicians. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence–Based Clinical Practice Guidelines. Chest. luty 2012, 141(2 Suppl): e691S-736S, www.ncbi.nlm.nih.gov
- Rodina M.T., Pendleton R., Wheeler M., et al. The treatment of venous thromboembolism in special populations Thrombosis Research 2007, 119: 391-402, www.ncbi.nlm.nih.gov
- Deneux–Tharaux C., Saucedo M., Bouvier–Colle M.H. Pulmonary embolism in pregnancy. The Lancet 2010, 375: 1778-9, www.ncbi.nlm.nih.gov
- Spyropoulus A.C. To bridge or not to bridge: that’s the question. The argument FOR bridging therapy in patients on oral anticoagulants requiring temporary interruption for elective procedures, J Thromb Thrombolysis 2010, 29: 192-8, www.researchgate.net
- Connolly S., Milling T., Eikelboom J, et al. Andexanet Alfa for Acute Major Bleeding Associated with Factor Xa Inhibitors, N Engl J Med 2016, 375: 1131-41, www.ncbi.nlm.nih.gov
- Zareh M., Davis A., Henderson S. Reversal of Warfarin–Induced Hemorrhage in the Emergency Department, West J Emerg Med 2011, 12: 386-92, doi:10.5811/westjem.2011.3.2051, DOI
- Pollack C., Reilly P., Eikelboom J., et al. Idarucizumab for Dabigatran Reversal, N Engl J Med 2015, 373: 511-20, doi:10.1056/NEJMoa1502000, DOI
- Steffel J., Verhamme P., Potpara T.S. et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non–vitamin K antagonist oral anticoagulants in patients with atrial fibrillation, European Heart Journal 2018, 16: 1330-9, pmid:30211938, www.ncbi.nlm.nih.gov
- Pengo V., Lensing A., Prins M. Incidence of Chronic Thromboembolic Pulmonary Hypertension after Pulmonary Embolism, N Engl J Med 2004, 350: 2257-64, doi:10.1056/NEJMoa032274, DOI
- Carrier M., Le Gal G., Wells P.S. et al. Systematic review: case-fatality rates of recurrent Venous Thromboembolism and major Bleeding Events Among Patients treated for venous Thromboembolism, Ann Intern Med 2010, 152: 578-89, www.ncbi.nlm.nih.gov
- Klok F.A. and Huisman M.V. Epidemiology and management of chronic thromboembolic pulmonary hypertension, Neth J Med 2010, 68: 347-351, www.ncbi.nlm.nih.gov
- Reitter S.E., Waldhoer T., Mayerhofer M. et al. Long–term survival of patients with a history of venous thromboembolism, Ann Hematol maj 2011, 90(5): 585-94. www.ncbi.nlm.nih.gov
- Geersing G-J., Erkens P.M.G., Lucassen W.A.M., et al. Safe exclusion of pulmonary embolism using the Wells rule and qualitative D–dimer testing in primary care: prospective cohort study, BMJ 2012, 345: e6564, BMJ (DOI)
- Hansson P.O., Welin L., Tibblin G., et al.. Deep vein thrombosis and pulmonary embolism in the general population, Arch Intern Med 1997,; 157: 1665-70, www.ncbi.nlm.nih.gov
- Silverstein M., Heit J.A. et al. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25–year population–based study, Arch Intern Med. 23.03.1998, 158(6): 585-93, www.ncbi.nlm.nih.gov
- Karwinski B., Svendsen E. Comparison of clinical and postmortem diagnosis of pulmonary embolism, J Clin Pathol 1989, 42: 135-9, PubMed
- Le Gal G., Righini M., Roy P-M. et al. Prediction of Pulmonary Embolism in the Emergency department: The revised Geneva Score, Ann Int Med 2006, 144: 166-171, www.ncbi.nlm.nih.gov
- Hendriksen J.M.T., Geersin G-J., Lucassen W.A.M., et al. Diagnostic prediction models for suspected pulmonary embolism: systematic review and independent external validation in primary care, BMJ 2015, 351: h4438, doi:10.1136/bmj.h4438, DOI
- Shen J-H., Chen H-L., Chen J-R., et al. Comparison of the Wells score with the revised Geneva score for assessing suspected pulmonary embolism: a systematic review and meta–analysis, J Thromb Thrombolysis 2016, 41: 482-92, pmid:26178041, PubMed
- Ridge C.A., McDermott S., Freyne B.J., et al. Pulmonary embolism in pregnancy: comparison of pulmonary CT angiography and lung scintigraphy, Am J Roentgenol 2009, 193 (5): 1223-7, www.ncbi.nlm.nih.gov
- Shahir K., Goodman L.R., Tali A., et al. Pulmonary embolism in pregnancy: CT pulmonary angiography versus perfusion scanning, Am J Roentgenol. 2010, 195 (3): W214-20, www.ncbi.nlm.nih.gov
- Sharifi M., Bay C., Skrocki L., et al. Moderate pulmonary embolism treated with thrombolysis (from the "MOPETT" Trial), Am J Cardiol 2013, 111: 273-7, PubMed
- Chatterjee S., Chakraborty A., Weinberg I., et al. Thrombolysis for pulmonary embolism and risk of all–cause mortality, major bleeding, and intracranial hemorrhage: a meta–analysis,. JAMA 2014, 311: 2414-21, doi:10.1001/jama.2014.5990, DOI
Opracowanie
- Tomasz Tomasik (recenzent)
- Anetta Undas (recenzent)
- Adam Windak (redaktor)
- Michael Handke (recenzent/redaktor)
- Marlies Karsch–Völk (recenzent/redaktor)
- Guido Schmiemann (recenzent/redaktor)
