Streszczenie
- Definicja:Złośliwy guz przełyku. Spośród guzów nabłonkowych (95%) około 40% to rak płaskonabłonkowy, a 60% to gruczolakorak.
- Częstość występowania:Rak przełyku stanowi 1% wszystkich nowotworów. Zapadalność około 4–5/100 000, mężczyźni:kobiety = 5:1.
- Objawy:Najczęstszym objawem jest dysfagia, krzyuszenie się, a następnie utrata masy ciała i ból.
- Obraz kliniczny:Brak szczególnych objawów klinicznych, ale z powodu przerzutów często występuje znaczna utrata masy ciała i pogorszenie stanu ogólnego.
- Diagnostyka:Rozpoznanie stawia się na podstawie biopsji i badania histologicznego materiału uzyskanego endoskopowo.
- Terapia:Resekcja guza pierwotnego jest jedyną terapią ukierunkowaną na wyleczenie. W razie potrzeby można zastosować neoadiuwantową i/lub paliatywną radiochemioterapię, terapię celowaną w przypadku guzów HER-2-dodatnich, lokoregionalną ablację guza, leczenie wspomagające i paliatywne, np. umieszczenie stentu, PEG, leczenie bólu.
Informacje ogólne
Definicja
- Złośliwy guz przełyku.
- Guzy nabłonkowe stanowią ponad 95% wszystkich nowotworów przełyku, ok. 40% to rak płaskonabłonkowy, a ok. 60% to gruczolakorak (w części dystalnej).
- Najczęstszym objawem jest dysfagia, lrztuszenie się a następnie utrata masy ciała i ból. Dysfagia nie występuje, dopóki przejście przez przełyk nie zostanie zmniejszone o 50–75%.
- W momencie postawienia rozpoznania w wielu przypadkach guz rozprzestrzenił się już poza przełyk.
Podział na stadia zaawansowania według klasyfikacji TNM
- T – guz pierwotny
- TX – brak możliwości oceny guza pierwotnego
- T0 – brak dowodów na istnienie guza pierwotnego
- T1 – naciekanie blaszki właściwej lub błony podśluzowej
- T2 – naciekanie mięśniówki właściwej
- T3 – naciekanie przydanki
- T4 – naciekanie sąsiednich struktur.
- N – regionalne węzły chłonne
- NX – brak możliwości oceny regionalnych węzłów chłonnych
- N0 – brak przerzutów do regionalnych węzłów chłonnych
- N1 – przerzuty w 1-2 węzłach chłonnych
- N2 – przerzuty w 3-6 węzłach chłonnych
- N3 – przerzuty w ≥7 węzłach chłonnych.
- M – przerzuty odległe
- M0 – brak przerzutów odległych
- M1 – obecne przerzuty odległe
- pTNM: Klasyfikacja patologiczna (kategorie pT i pN odpowiadają kategoriom T i N).
- pM1 – przerzuty odległe potwierdzone mikroskopowo
- pN0 – regionalna limfadenektomia i badanie histologiczne zwykle 7 lub więcej węzłów chłonnych.
Częstość występowania1
- Rak przełyku stanowi 1% wszystkich nowotworów złośliwych.
- Zapadalność
- ok. 4–5/100 000
- Mężczyźni chorują ok. 5 razy częściej niż kobiety.
- Gruczolakoraki
- Częstość występowania gruczolakoraków (prawdopodobnie wywodzących się z przełyku Barretta) znacznie wzrasta w całym zachodnim świecie, a gruczolakoraki są obecnie najczęstszym typem guza w krajach uprzemysłowionych.
- Rak płaskonabłonkowy
- W niektórych krajach, takich jak Iran, RPA i Chiny, współczynnik chorobowości jest wysoki i wynosi około 200 przypadków na 100 000 osób.
- W Polsce w 2019 rku rozpowszechnienie raka przełyku szacowano na 7,9/100 000 osób.2
Etiologia i patogeneza
- Guzy nabłonkowe można podzielić na raki płaskonabłonkowe i gruczolakoraki.
- Gruczolakoraki
- Zwykle powstają w wyniku zmian metaplastycznych, przełyku Barretta, dystalnie do przełyku.
- Są prawdopodobnie powiązane z chorobą refluksową przełyku.
- Przyczyną zwiększonej zapadalności w krajach zachodnich są prawdopodobnie czynniki ryzyka, takie jak refluks żołądkowo-przełykowy i nadwaga.
- Rak płaskonabłonkowy
- Prawie wszystkie guzy powyżej dolnej jednej trzeciej przełyku to rak płaskonabłonkowy.
- Czynniki etiologiczne to palenie tytoniu, nadużywanie alkoholu i inne.
Czynniki predysponujące
- palenie tytoniu (papierosów, także fajki wodnej).
- Nadużywanie alkoholu (zwłaszcza wysokoprocentowego).
- Nadwaga.
- Nowotwory głowy i szyi.
- Zakażenie HPV.
- Wstępnie uszkodzony przełyk
- choroba refluksowa
- przełyk Barretta
- achalazja
- radioterapia okolicy szyjno-piersiowej
- oparzenia kwasami i zasadami.
- Przyjmuje się, że tytoń i alkohol odpowiadają za nawet 90% zachorowań.
ICD-10
- D00 Rak in situ jamy ustnej, przełyku i żołądka
- C15 Nowotwór złośliwy przełyku
- C15.0 Szyjna część przełyku
- C15.1 Piersiowa część przełyku
- C15.2 Brzuszna część przełyku
- C15.3 Górna trzecia część przełyku
- C15.4 Środkowa trzecia część przełyku
- C15.5 Dolna trzecia część przełyku
- C15.8 Zmiana przekraczająca granice jednego umiejscowienia w obrębie przełyku
- C15.9 Przełyk, umiejscowienie nieokreślone
- C16 Nowotwór złośliwy żołądka
- C16.0 Wpust
Diagnostyka
Kryteria diagnostyczne
- Najbardziej typowym objawem są narastające trudności z przełykaniem.
- Rozpoznanie stawia się na podstawie oceny histologicznej materiału pobranego podczas endoskopii.
Diagnostyka różnicowa
- Blizny i zwężenia spowodowane erozyjnym zapaleniem przełyku.
- Uchyłek przełyku.
- Achalazja.
- Rozlany skurcz przełyku (przełyk korkociągowaty).
Wywiad lekarski
- Zaawansowany wiek, w przypadku gruczolakoraka często nieco niższy wiek (od 50 lat) niż w przypadku raka płaskonabłonkowego (od 60 lat). Średni wiek w momencie rozpoznania wynosi ok. 70 lat.
- Pojawienie się dysfagii! (subiektywnego wrażenie utrudnionego połykania lub problemu w przechodzeniu pokarmu/płynu do żołądka). Początkowo jednak nie występuje ból podczas jedzenia pokarmów stałych. Często pacjenci mieli niewielkie lub umiarkowne dolegliwości przez kilka miesięcy przed konsultacją z lekarzem.
- Długotrwałe objawy refluksu są powszechne w gruczolakorakach.
- Utrata masy ciała, osłabienie apetytu, pogorszenie ogólnego stanu fizycznego.
- Odruchy wymiotne.
- Późne objawy
- ból w klatce piersiowej i chrypka (porażenie nerwu krtaniowego) jako oznaka procesu naciekającego śródpiersie
- ból w klatce piersiowej lub plecach podczas połykania, "nieświeży" oddech i zmiany kształtu palców (tzw. palce pałeczkowate)
- tworzenie się przetoki między przełykiem a tchawicą lub drzewem oskrzelowym, powodujące kaszel po przełknięciu, zapalenie płuc i wysięk opłucnowy
- zespół Hornera (zwężenie źrenic, opadanie powiek, brak pocenia się po tej samej stronie twarzy i szyi), nadobojczykowa limfadenopatia, uporczywy ból w klatce piersiowej niezależny od połykania, czkawka.
- Możliwe okresowe zmniejszanie się objawów.
Badanie przedmiotowe
- Brak szczególnych ustaleń.
- Utrata masy ciała i pogorszenie stanu ogólnego.
- Możliwa limfadenopatia szyjna.
Badania uzupełniające w gabinecie lekarza rodzinnego
- Brak szczególnych ustaleń.
- Badania ogólne, takie jak krew w stolcu, Hb i OB, poziom żelaza, parametry wydolności nerek.
- Próby wątrobowe w odniesieniu do podejrzenia przerzutów.
- Pacjenci w wieku powyżej 40-50 lat z nowo rozpoznaną dysfagią powinni jak najszybciej zostać skierowani na gastroskopię.
- W przypadku innych objawów ostrzegawczych lub podejrzeń klinicznych pacjenci powinni być również kierowani na gastroskopię.
Diagnostyka specjalistyczna
- Endoskopia górnego odcinka przewodu pokarmowego z biopsją.
- Konieczne jest wykonanie kilku biopsji, ponieważ wiele próbek tkanek wykazuje jedynie zmiany zapalne.
- W przypadku przełyku Barretta/dysplazji ważne jest przestrzeganie określonego protokołu biopsji.
- TK klatki piersiowej i górnej części jamy brzusznej
- efektywna metoda określania rozmiaru i rozprzestrzeniania się guza (ocena stopnia zaawansowania).
- USG przezprzełykowe
- Stosowane do określania stopnia zaawansowania, zwłaszcza we wczesnej fazie nowotworu: klasyfikacja T i N (lokalne węzły chłonne).
- Utrudnione w przypadku guzów zwężających przełyk i zaawansowanych.
- Ocena w dużym stopniu zależy od lekarza przeprowadzającego badanie.
- Przy doświadczonym badającym jest to najlepsza metoda z dokładnością około 75–90%.
Uzupełniająca diagnostyka obrazowa
- Rezonans magnetyczny.
- RM ma wysoką czułość w wykrywaniu przerzutów.
- PET/CT (klatki piersiowej, brzucha, miednicy)
- Badanie to może być stosowane w razie potrzeby jako uzupełnienie badania MR w celu wykrycia przerzutów.
- Bronchoskopia z ewentualnym USG.
- Do oceny wrastania/ucisku na drogi oddechowe
- Laparoskopia
- Może być wykonywana w przypadku gruczolakoraka połączenia przełykowo-żołądkowego w celu wykluczenia przerzutów do wątroby i/lub otrzewnej w zaawansowanych stadiach.
Dalsze badania przedoperacyjne
- Przedoperacyjne badania krwi.
- Spirometria.
- Kardiologiczna/anestezjologiczna ocena profilu ryzyka.
Wskazania do skierowania do specjalisty
Objawy ostrzegawcze
- W przypadku pojawienia się nowych trudności z przełykaniem należy zawsze skierować pacjenta na gastroskopię.
- Następujące objawy mogą skłonić do skierowania na gastroskopię:
- niedokrwistość z niedoboru żelaza
- duża, niewyjaśniona utrata masy ciała
- pojawienie się wczesnego uczucia sytości przez co najmniej 3 tygodnie
- krwawienie z przewodu pokarmowego
- pojawienie się wymiotów przez co najmniej 3 tygodnie.
- Wszystkie objawy należy sklasyfikować jako podejrzenie raka przełyku i należy je wyjaśnić za pomocą gastroskopii.
Leczenie
Cele leczenia
- Terapia lecznicza, albo
- Opieka paliatywna.
Ogólne informacje o leczeniu
- Decyzja o leczeniu powinna zostać podjęta w ramach interdyscyplinarnego konsylium onkologicznego.
- Resekcja chirurgiczna lub endoskopowa jest jedynym potencjalnie leczniczym sposobem postępowania.
- Około 1 na 4 pacjentów kwalifikuje się do resekcji.
- W zależności od stadium i biologii guza dostępne są następujące opcje:
- resekcja endoskopowa
- resekcja chirurgiczna
- chemioterapia neoadiuwantowa
- radiochemioterapia neoadiuwantowa
- chemioterapia pooperacyjna.
Leczenie farmakologiczne
- Neoadiuwantowa przedoperacyjna chemioterapia lub radiochemioterapia może poprawić możliwości operacji guza.3
- w przypadku stwierdzenia resztkowego guza w resekcji: leczenie uzupełniające niwolumabem (przeciwciało monoklonalne dla receptora PD-1 - programowanej śmierci komórki 1).
- Możliwe kombinacje cytostatyków:
- Alternatywna opcja dla pacjentów, u których nie można stosować pełnej dawki chemioterapii4
- oksaliplatyna–kapecytabina w obniżonej dawce.
- oksaliplatyna–kapecytabina w obniżonej dawce.
- Pembrolizumab zalecany w przypadku zaawansowanego, nieleczonego raka płaskonabłonkowego.4
- Terapia ukierunkowana molekularnie
- w przypadku zaawansowanych guzów z nadekspresją receptora HER2: trastuzumab + cisplatyna + fluoropirymidyna (5-FU lub kapecytabina).
Radioterapia
- W zaawansowanych stadiach jako uzupełnienie chemioterapii.
- Neoadiuwantowa i/lub paliatywna (nie stosowana celem leczenia radykalnego).
- Jako napromienianie zewnętrzne i/lub (paliatywnie) jako brachyterapia.
- Zmniejsza ból i objawy niedrożności.
- Promieniowanie wiąże się z krótko- i długoterminowymi skutkami ubocznymi, w tym podrażnieniem żołądka, zwężeniami lub perforacjami.
- Tendencja do większych korzyści w zakresie przeżycia w przypadku neoadiuwantowej radiochemioterapii w porównaniu z samą chemioterapią5
- W szczególności młodsi pacjenci wydają się odnosić z niej korzyści.
Leczenie chirurgiczne
Informacje ogólne
- Resekcja guza jest obiecująca u około 1/4 pacjentów. W pozostałych przypadkach leczenie polega głównie na założeniu stentu i/lub skojarzonej radioterapii i chemioterapii.
- Efekty
- Operacja raka przełyku wymaga dużych nakładów i wiąże się z wysokim ryzykiem powikłań.
- Długotrwałe przeżycie z całkowitym wyleczeniem uzyskuje się tylko u kilku procent pacjentów.
- Niemniej jednak, śmiertelność zmniejsza się dzięki operacji, a 5-letni wskaźnik przeżycia wzrasta ze średnio 4% do 20%.
- Technika resekcji
- endoskopowa resekcja we wczesnych stadiach
- operacja: w zależności od lokalizacji i rozległości guza można rozważyć ograniczoną lub rozległą resekcję:
- całkowite wycięcie przełyku
- szyjna resekcja przełyku
- przezklatkowe subtotalne wycięcie przełyku
- przezprzełykowe brzuszno-szyjne subtotalne wycięcie przełyku
- przezprzełykowa rozszerzona gastrektomia z dystalnym wycięciem przełyku
- całkowite wycięcie przełyku z żołądkiem.
- Wskazanie do operacji paliatywnej
- Paliatywna resekcja guza wiąże się z wysokim ryzykiem zachorowalności i śmiertelności, dlatego jest rzadko wykonywana.
- Dla większości pacjentów leczenie dysfagii w celu poprawy jakości życia jest głównym celem leczenia.
- endoskopowa implantacja samorozprężalnego stentu metalowego
- Średni czas przeżycia wynosi 2-3 miesiące
- Do zabiegu chirurgicznego pacjent powinien być przygotowany; chory niedożywiony wymaga wsparcie żywieniowego (preparaty wysokobiałkowe, wysokokaloryczne).
Leczenie pooperacyjne
- Sondę żołądkową (możliwie jak najcieńszą) za zespoleniem pozostawia się na miejscu do momentu osiągnięcia wystarczającego wygojenia zespolenia (zwykle 5 dni po operacji).
- Podczas torakotomii zakładany jest dren do klatki piersiowej.
- Pooperacyjne żywienie dojelitowe przez zgłębnik jelitowy, w razie potrzeby z suplementacją pozajelitową.
Opieka paliatywna
Choroba nieoperacyjna
- Leczenie endoskopowe (np. stent samorozprężalny).
- W razie potrzeby paliatywna chemoterapia lub radio(chemo)terapia.
- w zależności od wyników diagnostyki molekularnej (HER2, PD-L1 CPS) uzupełniona paliatywną immunoterapią trastuzumabem lub inhibitorem immunologicznego punktu kontrolnego
- W razie potrzeby termoablacyjna terapia wewnątrzświatłowa, ewentualnie w połączeniu z brachyterapią lub napromienianiem zewnętrznym.
- Sondę żywieniową najlepiej założyć przez PEG (przezskórna endoskopowa gastrostomia). Zabieg należy wykonać, zanim zespolenie stanie się zbyt wąskie, aby przejść przez nie gastroskopem.
Dodatkowe informacje na temat opieki paliatywnej
- Ból.
- Nudności i wymioty.
- Zaparcia.
- Złośliwa niedrożność żołądka i jelit.
- Dolegliwości w obrębie jamy ustnej.
- Kacheksja i odwodnienie.
- Duszność.
- Depresja.
- Lęk.
- Majaczenie.
Zapobieganie
- Regularne monitorowanie pacjentów z przełykiem Barretta.
- Odstawienie nikotyny.
- Umiarkowane spożywanie alkoholu.
Przebieg, powikłania i rokowanie
Przebieg
- Zwykle postępujący.
Powikłania
- Niedrożność przełyku.
- Ciężka dysfagia.
- Silny ból.
- Przerzuty do płuc, wątroby, kości.
Rokowanie
- Objawowy rak przełyku jest zwykle zaawansowany (naciekanie mięśniówki właściwej i nie tylko).
- Wskaźnik przeżycia zależy od stadium choroby.
- 85% chorych umiera w ciągu 2 lat od postawienia rozpoznania.
- Względny wskaźnik 5-letniego przeżycia wszystkich pacjentów <10%.
- Określenie potencjalnego mechanizmu sarkopenii u chorych na raka przełyku (np. niedobory żywieniowe, zmniejszona aktywność fizyczna, chemioterapia, czynniki zapalne) i wdrożenie odpowiednich interwencji jest ważne dla poprawy rokowania.6
Informacje dla pacjentów
Informacje dla pacjentów w Medibas
Leczenie paliatywne w zaawansowanej chorobie nowotworowej
- Czym jest opieka paliatywna?
- Leczenie lęku.
- Nudności i wymioty.
- Zaparcia.
- Dolegliwości jamy ustnej.
- Trudności z oddychaniem w raku płuc.
- Depresja.
- Majaczenie.
Ilustracje
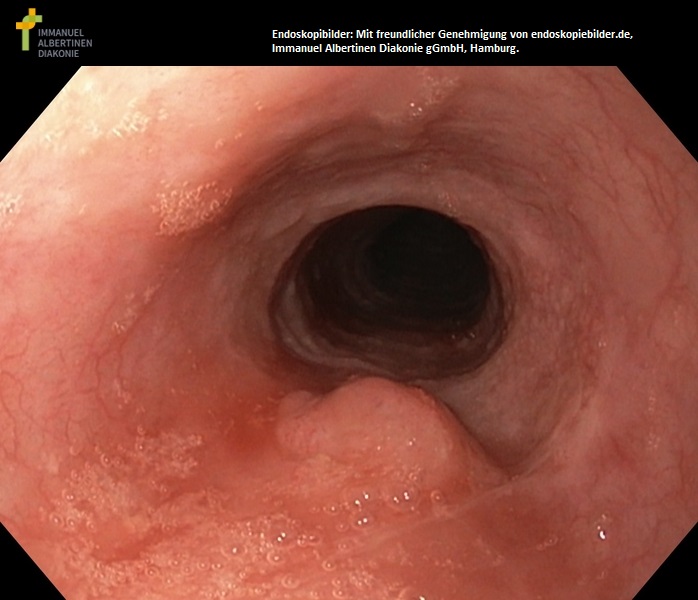
Rak płaskonabłonkowy przełyku (dzięki uprzejmości Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)

Gruczolak zwężający przełyk (dzięki uprzejmości Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
Piśmiennictwo
Wytyczne
- Obermannová R, Alsina M, Cervantes A, et al. ESMO Guidelines Committee. Oesophageal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022; 33(10): 992-1004. Pubmed.
Piśmiennictwo
- Starling N, Fong C. Oesophageal cancer. BMJ Best Practice; last reviewed: 14 Jan 2022, last updated: 18 Jan 2022 bestpractice.bmj.com
- Biuletyn Informacji Publicznej AOTMiT. Keytruda (pembrolizumab) w leczeniu raka przełyku i gruczolakoraka połączenia przełykowo-żołądkowego. cms.medibas.pl
- Kidane B, Coughlin S, Vogt K, Malthaner R. Preoperative chemotherapy for resectable thoracic esophageal cancer. Cochrane Database of Systematic Reviews 2015, Issue 5. Art. No.: CD001556. DOI: 10.1002/14651858.CD001556.pub3. DOI
- Obermannová R, Alsina M, Cervantes A, Leong T, Lordick F, Nilsson M, van Grieken NCT, Vogel A, Smyth EC; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Oesophageal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 Oct;33(10):992-1004. pubmed.ncbi.nlm.nih.gov
- Ronellenfitsch U, Schwarzbach M, Hofheinz R et al. Perioperative chemo(radio)therapy versus primary surgery for resectable adenocarcinoma of the stomach, gastroesophageal junction, and lower esophagus. Cochrane Database Syst Rev 2013; 5:CD008107. PMID: 23728671 PubMed
- Li S, Xie K, Xiao X, Xu P, et al. Correlation between sarcopenia and esophageal cancer: a narrative review. World J Surg Oncol. 2024 Jan 24;22(1):27. pubmed.ncbi.nlm.nih.gov
Autorzy
- Tomasz Tomasik (redaktor)
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg
