Streszczenie
- Definicja: Gruczolakorak trzustki o nieznanej etiologii.
- Epidemiologia: Zapadalność wynosi około 20 przypadków na 100 000 osób rocznie. Trzeci najczęściej występujący nowotwór układu pokarmowego po raku okrężnicy i żołądka. Nieznaczny wzrost zapadalności w ostatnich 20 latach.
- Objawy: Objawy są w większości niespecyficzne: utrata masy ciała, bóle brzucha i pleców oraz dyspepsja.
- Obraz kliniczny: Objawy kliniczne w postaci niedokrwistości, żółtaczki, utraty masy ciała i ew. wyczuwalnego guza pojawiają się późno.
- Diagnostyka: USG, ewentualnie endosonografia i TK/MRI jamy brzusznej.
- Leczenie: Jedyną metodą leczniczą jest resekcja chirurgiczna. Chemioterapia ma charakter uzupełniający i paliatywny. Można rozważyć radiochemioterapię w celu przedoperacyjnego zmniejszenia rozmiaru guza.
Informacje ogólne
Definicja
- Jest to nowotwór złośliwy trzustki. Istnieją różne typy histologiczne, z których najczęstszym jest gruczolakorak przewodowy, stanowiący ponad 95% przypadków.1
- Gruczolakorak trzustki jest również nazywany zewnątrzwydzielniczym rakiem trzustki.
- Innymi rzadszymi postaciami histologicznymi są gruczolakorak torbielowaty i guz zrazikowy z wydzielniczych komórek miąższowych.
- Równie rzadkie są guzy endokrynne wywodzące się z komórek endokrynnych wysepek Langerhansa.
- Zmiany przedrakowe inwazyjnego raka trzustki to:
- śluzowy nowotwór torbielowaty (mucinous cystic neoplasm – MCN)
- wewnątrzprzewodowy brodawkowaty nowotwór śluzowy (intraductal papillary mucinous neoplasm – IPMN)
- śródnabłonkowy nowotwór trzustki (pancreatic intraepithelial neoplasm – PanIN).
- Progresja od dysplazji do gruczolakoraka charakteryzuje się biologicznie akumulacją różnych aberracji genetycznych.
- Gruczolakorak trzustki jest jednym z nowotworów złośliwych o najwyższej śmiertelności. Charakteryzuje go agresywny przebieg, szybki wzrost miejscowy i przerzuty do węzłów chłonnych oraz wątroby.
- Postępy w diagnostyce i leczeniu raka trzustki jak dotąd doprowadziły jedynie do zmniejszenia śmiertelności w małych podgrupach.
- U prawie wszystkich pacjentów wcześnie rozwijają się przerzuty, do zgonu dochodzi po krótkim okresie trwania choroby.
- W momencie rozpoznania ponad połowa pacjentów ma przerzuty, a tylko 8% ma ograniczone miejscowo guzy.2
- Patrz tabela: stadium zaawansowania raka trzustki.
Epidemiologia
- Około 20 nowych przypadków rocznie na 100 000 osób.
- Ze względu na niekorzystne rokowania prawie tyle samo osób umiera na tę chorobę każdego roku.
- Brak różnic w zapadalności między mężczyznami i kobietami.
- Bezwzględna liczba przypadków nowych zachorowań i zgonów rośnie w ciągu ostatnich lat w sposób ciągły dla obojga płci, także w związku z tendencjami demograficznymi.
- Bezwzględny wskaźnik 5–letniego przeżycia szacuje się na 8% (mężczyźni) do 9% (kobiety), względny wskaźnik 5–letniego przeżycia, który uwzględnia śmiertelność w populacji ogólnej, wynosi 9% (mężczyźni) lub 10% (kobiety).
- Obok międzybłoniaka opłucnej, rak trzustki wykazuje najniższy wskaźnik przeżycia z wszystkich chorób nowotworowych.
- Rak trzustki jest 8. najczęściej występującym nowotworem u mężczyzn i 9. najczęściej występującym nowotworem u kobiet.
- W 2021r. w Polsce z powodu nowotworu złośliwego trzustki zmarło: 2363 kobiety oraz 2328 mężczyzn.3
- Choroba występuje zwykle po 70. roku życia.1 Występowanie przed 50. rokiem życia jest rzadkie.
- Oczekuje się, że w ciągu najbliższych 25 lat zmiana struktury wiekowej populacji doprowadzi do dalszego wzrostu liczby zachorowań o ponad 30%.
Etiologia i patogeneza
- Większość nowotworów trzustki to gruczolakoraki, które wywodzą się ze zmienionych złośliwie komórek nabłonka przewodowego.4-6
- Sekwencyjna akumulacja mutacji i innych aberracji genetycznych prowadzi poprzez zmiany przedrakowe do coraz bardziej złośliwej transformacji, aż do raka.
- Najczęstszymi zmianami genetycznymi są mutacje w onkogenie KRAS (wykrywane u ponad 90% pacjentów) oraz inaktywacja genów supresorowych, takich jak TP53, SMAD4 i CDKN2A.
- Międzyoosobnicza, ale także wewnątrznowotworowa, między– i wewnątrzprzerzutowa heterogeniczność raka trzustki jest ogromna.
- Rak zewnątrzwydzielniczy trzustki szybko rozprzestrzenia się miejscowo i tworzy przerzuty drogą limfatyczną i krwionośną już we wczesnym stadium.
- 75% guzów zlokalizowanych jest w głowie trzustki, pozostałe guzy – w trzonie i ogonie trzustki.
- Raki głowy trzustki często rozprzestrzeniają się do dróg żółciowych, co może wywołać żółtaczkę.
- Rak w trzonie lub ogonie trzustki rzadko prowadzi do objawów cholestazy.
Czynniki predysponujące
- Palenie tytoniu.4-6
- Podeszły wiek.
- Z rakiem trzustki wiąże się szereg uwarunkowań genetycznych i obciążenie rodzinne (2–3% nowych zachorowań)7-8.
- Krewni 1. stopnia pacjentów z rakiem trzustki mają zwiększone ryzyko zachorowania na raka trzustki w porównaniu z normalną populacją.
- Choroby genetyczne zwiększające ryzyko wystąpienia raka:
- zespół Peutza–Jeghersa
- dziedziczne zapalenie trzustki
- rodzinny rak trzustki FPC (rodziny z co najmniej dwojgiem krewnych 1. stopnia z rakiem trzustki)
- rodzinny zespół znamion atypowych i czerniaka (FAMMM)
- rodzinnie występujący rak piersi i rak jajnika
- zespół Lyncha
- zespół Li i Fraumeniego
- rodzinna polipowatość gruczolakowata (familial adenomatous polyposis – FAP).
- Nadwaga i mała aktywność fizyczna.9
- Cukrzyca typu 210
- Metaanaliza prospektywnych badań obserwacyjnych wskazuje na liniowy związek z 15% wzrostem ryzyka zachorowania na raka trzustki na każde 0,5 mmol/l (= 9 mg/dl) wzrostu stężenia glukozy we krwi na czczo.11
- Stosunek ten stwierdzono również w przypadku stanu przedcukrzycowego.
- To, czy i które doustne leki przeciwcukrzycowe zwiększają ryzyko zachorowania na raka, pozostaje przedmiotem aktualnych badań; wydaje się jednak, że metformina ma ochronny wpływ w odniesieniu do rozwoju raka trzustki.12
- Metaanaliza prospektywnych badań obserwacyjnych wskazuje na liniowy związek z 15% wzrostem ryzyka zachorowania na raka trzustki na każde 0,5 mmol/l (= 9 mg/dl) wzrostu stężenia glukozy we krwi na czczo.11
- Przewlekłe zapalenia trzustki.13
- Zakażenia patogenami takimi jak Helicobacter pylori i WZW B (lub także HIV) mogą sprzyjać rozwojowi raka trzustki.
- Bardzo częste spożywanie przetworzonego mięsa, wędzonych lub grillowanych potraw może również sprzyjać rozwojowi raka trzustki.
- Nadużywanie alkoholu14
- Regularne spożywanie alkoholu może sprzyjać rozwojowi raka trzustki. Nie ma zdefiniowanej wartości progowej.
- Regularne spożywanie alkoholu zwiększa również prawdopodobieństwo wystąpienia przewlekłego zapalenia trzustki, które z kolei jest czynnikiem ryzyka rozwoju raka trzustki.
- Zawodowe czynniki ryzyka
- Przedmiotem dyskusji jest m.in. kontakt z pestycydami, herbicydami i fungicydami jako czynnikami ryzyka.15-23
ICD–10
- C25 Nowotwór złośliwy trzustki.
- C25.0 Głowa trzustki.
- C25.1 Trzon trzustki.
- C25.2 Ogon trzustki.
- C25.3 Przewód trzustkowy.
- C25.4 Część wewnątrzwydzielnicza trzustki.
- C25.7 Inna część trzustki.
- C25.8 Zmiana przekraczająca granice jednego umiejscowienia w obrębie trzustki.
- C25.9 Trzustka, umiejscowienie nieokreślone.
Diagnostyka
Kryteria diagnostyczne
- Rozpoznanie jest zwykle stawiane na podstawie USG, ultrasonografii endoskopowej i/lub angiografii RM w połączeniu z RM dróg żółciowych (magnetic resonance cholangiopancreatography – MRCP); czasami stosuje się również spiralną tomografię komputerową i PET.
- Endoskopowa cholangiopankreatografia wsteczna (ECPW) nie jest obecnie zalecana, z wyjątkiem przypadków równoczesnej interwencji leczniczej.
Diagnostyka różnicowa
Wywiad
- W momencie postawienia rozpoznania choroba jest już u większości pacjentów bardzo zaawansowana.
- Objawy są niespecyficzne lub nie występują przez długi czas.
- Bezbolesna i stopniowo rozwijająca się żółtaczka, jak również utrata masy ciała mogą być objawami naciekającego raka głowy trzustki.
- Objawy zależą od lokalizacji guza.
- W przypadku guzów okolicy brodawki Vatera żółtaczka może wystąpić stosunkowo wcześnie.
- Typowe objawy, choć niespecyficzne, to ból pleców i ból brzucha, utrata apetytu, uczucie pełności, wzdęcia, utrata masy ciała i związane z tym ogólne osłabienie fizyczne.
- Bezbolesna żółtaczka u pacjentów w wieku powyżej 50 lat jest objawem alarmowym.
- Bóle
- Ból jest spowodowany naciekiem splotu trzewnego – jest uporczywy i rozdzierający.24
- Ból zwykle promieniuje z nadbrzusza do pleców i zmniejsza się nieco podczas pochylania się do przodu.
- Ból może nasilać się po posiłkach i przy leżeniu na płasko.
- Ból występuje również w nocy.
- Żółtaczka
- Żółtaczka występuje z powodu niedrożności (żółtaczka mechaniczna) i może jej towarzyszyć silny świąd.
- U niektórych pacjentów występuje biegunka/biegunka tłuszczowa z powodu niedrożności przewodu trzustkowego i wynikającego z tego niedoboru enzymów.
- U pacjentów w wieku powyżej 50 lat pierwsze ostre zapalenie trzustki o niejasnej etiologii może wskazywać na raka trzustki.
- Nowe wystąpienie lub pogorszenie kontroli cukrzycy może wskazywać także na raka trzustki.
- Nie należy wdrażać diagnostyki w kierunku raka trzustki, jeżeli nie ma innych objawów.
Badanie fizykalne
- Żółtaczka cholestatyczna z zabarwieniem moczu od ciemnożółtego do brązowego, zażółceniem skóry i twardówek oraz świądem.
- Utrata masy ciała.
- Badalny przez powłoki powiększony i niebolesny pęcherzyk żółciowy (objaw Courvoisier'a).
- Niedokrwistość.
- Łatwe powstawanie krwiaków z powodu zaburzeń krzepnięcia.
- Limfadenopatia nadobojczykowa po stronie lewej (węzły chłonne Virchowa).
- Przy przerzutach:
- niewydolność wątroby w zaawansowanych przerzutach do wątroby
- kaszel i duszność z przerzutami do płuc i/lub opłucnej
- wodobrzusze w przebiegu przerzutów do otrzewnej lub zaawansowanych przerzutach do wątroby
- ból kości w przebiegu przerzutów do układu kostnego
- objawy neurologiczne w przebiegu przerzutów do OUN.
- Następujące zespoły paranowotworowe są związane z rakiem trzustki:
- trombofilia
- wędrujące zakrzepowe zapalenie żył
- nawracające nieropne zapalenie tkanki podskórnej (zespół Pfeifera–Webera–Christiana).
Badania uzupełniające
- Diagnostyka laboratoryjna:
- morfologia krwi
- OB, CRP
- lipaza
- stężenie enzymów trzustkowych zwykle prawidłowe we wczesnej fazie
- ALP, GGTP, AST, ALT, bilirubina
- cechy cholestazy
- albumina, glukoza, ewentualnie HbA1C, kreatynina i elektrolity
- nowe wystąpienie cukrzycy.
- USG jamy brzusznej.
U specjalisty
- Rozszerzona diagnostyka laboratoryjna
- Antygen nowotworowy 9 (CA 19–9) należy oznaczyć w ramach diagnostyki różnicowej w przypadku wykrycia masy w trzustce.
- Zaleca się oznaczenie markera nowotworowego CEA przed planowanym leczeniem onkologicznym (zabieg chirurgiczny, radioterapia, leczenie farmakologiczne).
- CA19–9 nie znajduje zastosowania jako parametr przesiewowy, ponieważ obserwuje się jego wzrost także w innych chorobach przewodu pokarmowego.
- Czułość wynosi 50–75%, a swoistość 80%.
- Inne markery nowotworowe mające związek z rakiem trzustki to CA 72–4 i beta–hCG.
- Badanie przeprowadzone przez Louhimo i wsp. w 2004 r. wykazało, że markery nowotworowe beta–hCG i CA 72–4 są bardziej zależne od czynników prognostycznych niż CA 19–9.25
- Antygen nowotworowy 9 (CA 19–9) należy oznaczyć w ramach diagnostyki różnicowej w przypadku wykrycia masy w trzustce.
- Procedurami diagnostycznymi pierwszego wyboru w wykrywaniu raka trzustki są USG jamy brzusznej, endosonografia, wielorzędowa tomografia komputerowa i rezonans magnetyczny w połączeniu z MRCP.
- W przypadku podejrzenia wystąpienia raka trzustki, jako pierwsze wykonuje się przezbrzuszne badanie ultrasonograficzne, ponieważ procedura ta jest powszechnie dostępna i niedroga.
- Endosonografia jest coraz częściej stosowana.
- Rosnąca poprawa możliwości diagnostycznych z wykorzystaniem MRI (angiografia MR i MRCP) oraz możliwość uzyskania szczegółowych informacji na temat guza i jego rozprzestrzeniania się, doprowadziły do częstszego stosowania tej procedury.
Badania obrazowe
- USG jamy brzusznej
- W przypadku podejrzenia raka trzustki w pierwszej kolejności zaleca się wykonanie USG jamy brzusznej.
- Prosta, dostępna i niedroga procedura.
- Coraz częstsze stosowanie endosonografii (patrz poniżej).
- Spiralna TK
- Badanie to jest zalecane u otyłych pacjentów (utrudnione badanie USG) oraz w przypadku, gdy wyniki badania USG były niejednoznaczne lub konieczne jest dokładne określenie stopnia zaawansowania choroby.26-28
- Jeśli w USG jamy brzusznej nie stwierdzono przerzutów, jest ono obowiązkowe.
- Charakteryzuje się wysoką czułością.
- Małe, resekcyjne guzy mogą zostać przeoczone w badaniu TK.
- Wykorzystanie do oceny stopnia zaawansowania i planowania operacji.
- MRI/MRCP
- Połączenie angiografii MR i MRCP jest prostszą alternatywą dla TK i ECPW.
- W połączeniu z endosonografią można wykryć ponad 90% guzów.
- MRCP do nieinwazyjnego obrazowania dróg żółciowych i przewodu trzustkowego coraz częściej zastępuje endoskopową cholangiopankreatykografię wsteczną (ECPW).
- Wykorzystywane do oceny stopnia zaawansowania i planowania operacji.
- ECPW
- ECPW (endoskopowa cholangiopankreatografia wsteczna) jedynie pośrednio uwidacznia masę w obszarze przewodu trzustkowego i dlatego sama w sobie nie jest wystarczająca do postawienia rozpoznania.
- Połączenie z cytologią szczoteczkową również nie jest wystarczająco czułe i nie jest zalecane do diagnozowania raka trzustki.
- USG endoskopowe (EUS)
- Badanie to może mieć wysoką czułość, jeśli lekarze wykonujący badanie posiadają odpowiednie umiejętności techniczne do wykonania EUS.29
- Endoskopowe badanie ultrasonograficzne pozwala zdiagnozować raka trzustki we wczesnym stadium, uwidocznić powiększone węzły chłonne i wykonać biopsję.
- CT/MRI jest często preferowane do planowania leczenia chirurgicznego ze względu na jakość obrazu.
- Angiografia TK lub angiografia RM
- Do oceny operacyjności zmiany konieczne jest zobrazowanie nacieku guza na sąsiadujące struktury.
- Naczynia mogą być oceniane za pomocą angiografii TK lub angiografii RM, które zastąpiły konwencjonalną angiografię.
- Biopsja/cytologia
- Przedoperacyjna biopsja nie jest konieczna w przypadku podejrzanej o złośliwy charakter masy w trzustce, która wydaje się potencjalnie resekcyjna. W tym przypadku zalecana jest pierwotna resekcja.
- W przypadku podejrzenia przerzutów innego nowotworu złośliwego można wykonać biopsję pod kontrolą endosonografii.
- Przed rozpoczęciem chemioterapii paliatywnej należy wykonać biopsję.
- Reprezentatywny materiał może być pobrany z około 95% biopsji.30
- Laparaskopia, ewentualnie z USG
- Procedura odpowiednia do diagnozowania niewykrytych wcześniej przerzutów do wątroby i otrzewnej.31
- Bez rutynowego stosowania w ramach oceny stopnia zaawansowania.
- Możliwe pobranie biopsji w trakcie zabiegu.
Ocena stopnia zaawansowania
- USG jamy brzusznej.
- RTG klatki piersiowej.
- Ewentualnie tomografia komputerowa, jeśli w badaniu USG jamy brzusznej nie wykryto przerzutów odległych.
- Opcjonalnie:
- MRI
- TK klatki piersiowej
- laparaskopia.
- Endosonografia, ECPW i MRCP, a także scyntygrafia układu kostnego nie są wykorzystywane do określania stopnia zaawansowania nowotworu.
- Badanie FDG–PET nie mają w obecnej ocenie żadnej wartości diagnostycznej.
Leczenie
Cele leczenia
- Leczenie operacyjne stanowi jedyną opcję wyleczenia.
- W większości przypadków cel terapeutyczny ma charakter paliatywny.6
Ogólna informacja o leczeniu
- Raka trzustki można podzielić na raka resekcyjnego, miejscowo zaawansowanego i raka z przerzutami.32
- Chirurgiczna resekcja R0 - usunięcie guza z marginesem bez komórek nowotworowych (15% przypadków) z limfadenektomią jest jedyną możliwą szansą na wyleczenie.
- Ocena stanu sprawności jest ważnym elementem oceny ogólnego stanu pacjentów (onkologicznych, geriatrycznych) i jest często wykorzystywana do lepszego zaplanowania terapii.
- Najczęściej stosuje się wskaźnik Karnofsky'ego lub status ECOG (Eastern Co–operative of Oncology Group).
- Wskaźnik Karnofsky'ego dzieli stan aktywności na 11 stopni (100% = prawidłowy, 0 = zgon), status ECOG na 6 stopni (0 = prawidłowy, 5 = zgon).
- Najczęściej stosuje się wskaźnik Karnofsky'ego lub status ECOG (Eastern Co–operative of Oncology Group).
Ocena przedoperacyjna
- W przypadku planowanego w niedługim czasie zabiegu operacyjnego i występowania cholestazy, przedoperacyjne protezowanie dróg żółciowych jest zalecane tylko w przypadku współwystępowania zapalenia dróg żółciowych.
- Nieoperacyjny rak trzustki
- Z reguły nie operuje się pacjentów z naciekiem otrzewnej, przerzutami narządowymi, naciekiem na tętnicę krezkową górną lub pień trzewny, przerzutami odległymi do węzłów chłonnych lub z miejscowym naciekaniem struktur nieresekcyjnych.
- Operacyjny rak trzustki
- Tylko nieliczne guzy są operacyjne, rokowania są złe.33
- Lokalizacja ma decydujące znaczenie dla wyboru rodzaju i zakresu zabiegu.
- Guzy w trzonie lub ogonie trzustki są częściej operowalne niż guzy zlokalizowane w głowie trzustki.
- W takiej sytuacji wykonuje się pankreatektomię dystalną (rak w ogonie trzustki), subtotalną lewostronną resekcję trzustki lub radykalną pankreatoduodenektomię (rak trzonu).
- Operacja Whipple'a jest wykonywana w przypadku raka zlokalizowanego w głowie trzustki, brodawce Vatera i dwunastnicy.
Leczenie operacyjne
- Operacyjny rak trzustki
- Radykalna resekcja jest jedyną szansą na wyleczenie (około 15% przypadków, wskaźnik 5–letniego przeżycia po takim leczeniu wynosi 40%).
- Operacja Whipple'a jest standardowym sposobem leczenia nowotworów głowy trzustki, podczas gdy resekcje dystalne trzustki lub całkowita pankreatoduodenektomia są wykonywane w przypadku nowotworów trzonu lub ogona trzustki.
- Klasyczna operacja Whipple'a obejmuje resekcję głowy trzustki, dwunastnicy, pęcherzyka żółciowego, przewodu żółciowego i części odźwiernikowej żołądka. Usuwane są również lokalne węzły chłonne.
- Równoważna pod względem wyniku i powikłań pooperacyjnych jest jednak również operacja Whipple'a z zachowaniem odźwiernika (metodą Traverso), w której nie wykonuje się częściowej resekcji żołądka i istnieje możliwość skrócenia czasu zabiegu.
- Całkowita pankreatektomia może być konieczna w przypadku rozproszonego naciekania trzustki.
- Poważne powikłania pooperacyjne nie powinny przy tym przekraczać 30%, a śmiertelność nie powinna być wyższa niż 5%.
- Nieoperacyjny rak trzustki
- W przypadku obecności przerzutów odległych, naciekania tętnicy krezkowej górnej, żyły głównej dolnej, aorty lub pnia trzewnego oraz niedrożności żyły krezkowej górnej/żyły wrotnej resekcja chirurgiczna nie jest możliwa.30
- Pacjenci z miejscowo zaawansowanymi nowotworami w dostatecznie dobrym stanie ogólnym mogą najpierw otrzymać chemioterapię neoadiuwantową w celu uzyskania resekcyjności guza.
- Najwyższe wskaźniki remisji uzyskuje się w przypadku stosowania schematu FOLFIRINOX (patrz sekcja farmakoterapia) lub nab–paklitakselu/gemcytabiny.
- Możliwa jest również radiochemioterapia w celu miejscowej intensyfikacji leczenia.
- W przypadku miejscowo zaawansowanego raka i odległych przerzutów terapia ma charakter paliatywny (patrz poniżej).
Powikłania związane z zabiegiem
- Opóźnione opróżnianie żołądka, przetoka trzustkowa, nieszczelność zespolenia, zakażenie rany, ropień wewnątrzbrzuszny, krwotok, cukrzyca i zewnątrzwydzielnicza niewydolność trzustki.
Nieoperacyjny rak trzustki
- W przypadku bolesnej żółtaczki wykonuje się ECPW z protezowaniem dróg żółciowych przy pomocy stentu.34
- U pacjentów z nieoperacyjnymi nowotworami paliatywne protezowanie dróg żółciowych może przynieść ulgę w ciężkiej żółtaczce i świądzie, ale nie wydłuża czasu przeżycia.35-36
- Wykonanie zespolenia żółciowo–pokarmowego w cholestazie jest wskazane, jeśli nieoperacyjność stwierdza się dopiero śródoperacyjnie i zakłada się dłuższy czas przeżycia.
- W przypadku zaburzeń opróżniania żołądka związanych z nowotworem można zastosować leczenie farmakologiczne metoklopromidem.
- W przypadku niedrożności dwunastnicy związanej z nowotworem
- endoskopia z założeniem stentu
- gastroenterostomia
- tradycyjnie zespolenie żołądkowo–jelitowe jest wykonywane metodą laparotomii. W ostatnich latach wykonuje się coraz więcej zabiegów minimalnie inwazyjnych, np. laparoskopię lub samorozprężalne stenty metalowe37, przy czym ostatnia metoda jest prawdopodobnie najwłaściwsza.
- Zobacz także sekcję dalsze opcje leczenia.
Farmakoterapia
- Chemioterapia adiuwantowa w ciągu 6(–12) tygodni po zabiegu operacyjnym, trwająca 6 miesięcy, powinna być stosowana po resekcji R0 guza pierwotnego (usunięcie z marginesem 1 mm bez komórek nowotworowych), jeśli pacjenci są w dobrym stanie ogólnym (status ECOG 0–2).1
- W oparciu o aktualne dane wykazujące znaczną poprawę przeżycia całkowitego, zmodyfikowany schemat FOLFIRINOX (mFOLFIRINOX) jest uważany za nowy standard leczenia adiuwantowego u pacjentów w bardzo dobrym i dobrym stanie ogólnym (ECOG 0–1).
- mFOLFIRINOX to skrót oznaczający polichemioterapię z zastosowaniem oksaliplatyny, leukoworyny i irynotekanu w dniu 1. oraz 5–fluorouracylu (5–FU) podawanego z użyciem pompy przez 46 godzin co 14 dni przez 12 cykli.
- Często występujące poważne działania niepożądane związane ze stosowaniem mFOLFIRINOX to np. biegunka, polineuropatia czuciowa, zmęczenie, wymioty, leukopenia i zapalenie błon śluzowych; jednak zwykle zmniejszają się po 2 cyklach leczenia.
- U pacjentów w gorszym stanie ogólnym (ECOG ≥ 2) lub z przeciwwskazaniami do mFOLFIRINOX może być stosowana alternatywnie monoterapia gemcytabiną.
- W oparciu o aktualne dane wykazujące znaczną poprawę przeżycia całkowitego, zmodyfikowany schemat FOLFIRINOX (mFOLFIRINOX) jest uważany za nowy standard leczenia adiuwantowego u pacjentów w bardzo dobrym i dobrym stanie ogólnym (ECOG 0–1).
- Po resekcji R1 (z pozostawieniem nacieku w obrazie mikroskopowym, margines <1mm) zaleca się również 6–miesięczną chemioterapię według tego samego schematu.1
- Leczenie paliatywne
- Leczenie w zaawansowanych stadiach ma charakter paliatywny. Jak najszybsze wdrożenie chemioterapii prowadzi do wydłużenia czasu przeżycia i poprawy jakości życia.
- Chemioterapeutyki stosowane w dobrym stanie ogólnym w leczeniu pierwszego rzutu to nab–paklitaksel z gemcytabiną lub FOLFIRINOX (fluorouracyl, kwas folinowy, irinotekan i oksaliplatyna).
- Paliatywna terapia medyczna nowotworów może być prowadzona do momentu progresji lub – w przypadku bardzo dobrej odpowiedzi – jako terapia przerywana.
- W przypadku pacjentów w złym stanie ogólnym (ECOG >2, wskaźnik Karnofsky'ego <60%) korzyści z leczenia farmakologicznego są wątpliwe.
- Zazwyczaj stosowana jest gemcytabina (plus nab–paklitaksel).
- W innym przypadku prowadzi się leczenie zgodne z zasadą najlepszej opieki wspierającej.
Opieka paliatywne
Informacje ogólne
- Każda osoba dotknięta nieuleczalną chorobą nowotworową powinna mieć dostęp do opieki paliatywnej.
- Opieka paliatywna nad pacjentami z nieuleczalną chorobą nowotworową powinna obejmować następujące zadania:
- Leczenie objawów i wsparcie w przypadku problemów we wszystkich 4 wymiarach (fizycznym, psychologicznym, społecznym i duchowym), uwzględnienie preferencji pacjenta i jego potrzeb przy jednoczesnym poszanowaniu tożsamości kulturowej, ideologicznej i religijnej osób dotkniętych chorobą.
- Stworzenie warunków leczenia z poszanowaniem intymność pacjentów.
- Przeprowadzenie odpowiedniej diagnostyki różnicowej w celu wykrycia potencjalnie odwracalnych przyczyn zgłaszanych objawów, a także zastosowanie środków zapobiegawczych.
- Wdrożenie leczenia objawowego – niezależnie lub równolegle z leczeniem przyczynowym.
- Dokładne rozważenie możliwości osiągnięcia korzyści z działań ukierunkowanych na leczenie przyczynowe w opozycji do leczenia noszącego znamiona terapii uporczywej.
- Komunikacja, w tym zaangażowanie i wsparcie krewnych (grupy samopomocy, edukacja rodziny)
- Postawa nieoceniającego szacunku i szczerości wobec pacjentów.
- Szczerość, nie raniąc i nie podając więcej (szczegółowych) informacji, niż jest to wymagane przez zainteresowane osoby.
- W razie potrzeby aktywnie poruszane tematy umierania i śmierci.
- Leczenie objawów i wsparcie w przypadku problemów we wszystkich 4 wymiarach (fizycznym, psychologicznym, społecznym i duchowym), uwzględnienie preferencji pacjenta i jego potrzeb przy jednoczesnym poszanowaniu tożsamości kulturowej, ideologicznej i religijnej osób dotkniętych chorobą.
- Realistyczne planowanie celów leczenia (przedłużenie życia, poprawa/utrzymanie jakości życia, złagodzenie objawów, umożliwienie godnego umierania).
- Planowanie opieki w przyszłości
- Omówienie z chorym i rodziną możliwości leczenia w przypadku możliwych scenariuszy i powikłań.
- Indywidualne preferencje dotyczące opieki w ostatniej fazie życia, miejsca opieki i śmierci, a także ewentualnie pochówku.
- Koordynacja opieki
- Opieka hospicjum domowego lub stacjonarnego.
- W przypadku konieczności leczenia szpitalnego (niepewność co do celu terapeutycznego, wymagająca nakładów opieka medyczna lub pielęgniarska, przeciążenie lub brak możliwości zapewnienia należytej opieki w domu) – przyjęcie na oddział opieki paliatywnej, jeśli istnieją wskazania.
Leczenie objawowe zaawansowanego raka trzustki
- Najczęstsze objawy u pacjentów z zaawansowanym rakiem trzustki obejmują:
- Ból
- ogólne leczenie bólu zgodnie z drabiną analgetyczną WHO
- środki terapii miejscowej: radioterapia, blokada splotu trzewnego
- skuteczność paliatywnej terapii przeciwbólowej zwiększa jednoczesna chemioterapia (chemioradioterapia).
- Kacheksja
- w przebiegu niewydolności zewnątrzwydzielniczej trzustki: suplementacja enzymów trzustkowych
- uzupełniające lub wyłączne żywienie pozajelitowe
- gastroenterostomię można wykonać w przypadku zwężenia odźwiernika żołądka.
- Cholestaza
- implantacja metalowego lub plastikowego stentu (leczenie z wyboru)
-
przezskórny przezwątrobowy drenaż dróg żółciowych (percutaneous transhepatic cholangial drainage -PTCD)
-
chirurgiczne zespolenie żółciowo–pokarmowe (tylko w wyjątkowych przypadkach).
- Incydenty zakrzepowo–zatorowe
- rozważyć podawanie profilaktycznych dawek heparyny drobnocząsteczkowej.
- Wodobrzusze
- punkcja i odbarczenie
- w razie konieczności wielokrotne nakłucia, założenie stałego systemu drenażu otrzewnej.
- Ból
- Zobacz także następujące artykuły:
- ból, leczenie paliatywne
- nudności i wymioty, leczenie paliatywne
- zaparcia, leczenie paliatywne
- złośliwa niedrożność żołądka i jelit
- dolegliwości jamy ustnej, suchość w ustach
- niedożywienie i odwodnienie
- duszność, leczenie paliatywne
- lęk, leczenie paliatywne
- depresja, leczenie paliatywne
- majaczenie, leczenie paliatywne.
Inne możliwości leczenia
- Wsparcie psychoonkologiczne może mieć pozytywny wpływ na poziom bólu.
- Terapia immunomodulacyjna jest obecnie przedmiotem badań.
- W przypadku zewnątrzwydzielniczej niewydolności trzustki insulinoterapia i substytucja enzymów trzustkowych.
Zapobieganie
- Rezygnacja z używania tytoniu.
- Powstrzymywanie się od nadmiernego spożycia alkoholu.
- Unikanie nadwagi.
- Regularna aktywność fizyczna.
- Możliwe, choć nie zostało to wystarczająco udowodnione, że wczesna i skuteczna terapia stanów przedcukrzycowych i cukrzycy typu 2 może przyczynić się do zapobiegnięcia rozwojowi raka trzustki.
- Spożywanie pokarmów zawierających witaminę C może być korzystne w zmniejszaniu ryzyka zachorowania na raka trzustki.
- Profilaktyczne badania przesiewowe populacji nie okazały się, jak dotąd, zasadne. Dotychczas stosowane metody, np. oznaczenie CA19–9 w surowicy nie zmniejszyły śmiertelności specyficznej dla raka.
- Identyfikacja i badania przesiewowe pacjentów wysokiego ryzyka, takich jak rodzinny rak trzustki, w wyspecjalizowanych ośrodkach.
Przebieg, powikłania i rokowanie
- Objawy raka trzustki są tak niespecyficzne, że 80–85% guzów jest nieresekcyjnych w momencie postawienia diagnozy (zwykle zaledwie 4–6 miesięcy po pojawieniu się pierwszych objawów) ze względu na zaawansowane stadium.
- Rokowanie jest złe30, ponieważ guzy:
- są trudno dostępne
- znajdują się blisko innych ważnych narządów
- wykazują agresywny wzrost i dają przerzuty we wczesnym stadium
- wiążą się ze znaczną zachorowalnością
- są oporne na większość terapii.
- Wskaźniki przeżywalności
- Po rozpoznaniu średni czas przeżycia wynosi pół roku.
- Względny 5–letni wskaźnik przeżycia (%):1
- mężczyźni: 8%
- kobiety: 7%.
- Rokowanie jest lepsze w przypadku rakowiaków i innych rzadkich lub specjalnych postaci histologicznych raka trzustki.
- Lepsze wyniki operacji uzyskuje się w przypadku ich wykonywania wyłącznie w wyspecjalizowanych ośrodkach.
Dalsza opieka nad pacjentami po radykalnym zabiegu chirurgicznym
- Dostosowanie diety, ewentualnie konsultacja dietetyczna.
- Leczenie cukrzycy po całkowitej pankreatektomii.
- Schemat obserwacji w celu wykrycia miejscowych nawrotów lub postaci oligometastatycznej choroby
- Obserwacja odbywa się co 3 miesiące przez pierwsze 2 lata, a następnie co 6 miesięcy przez kolejne 3 lata i obejmuje:
- badanie fizykalne
- badania laboratoryjne: CA 19–9 i CEA
- TK klatki piersiowej/brzucha/miednicy.
- Obserwacja odbywa się co 3 miesiące przez pierwsze 2 lata, a następnie co 6 miesięcy przez kolejne 3 lata i obejmuje:
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
- Rak trzustki.
- Leczenie lęku w opiece paliatywnej.
- Co to jest medycyna paliatywna?
- Nudności i wymioty, medycyna paliatywna.
- Zaparcia, opieka paliatywna.
- Dolegliwości jamy ustnej, medycyna paliatywna.
- Depresja, medycyna paliatywna.
- Majaczenie, medycyna paliatywna.
- Ból i inne objawy, medycyna paliatywna.
Ilustracje
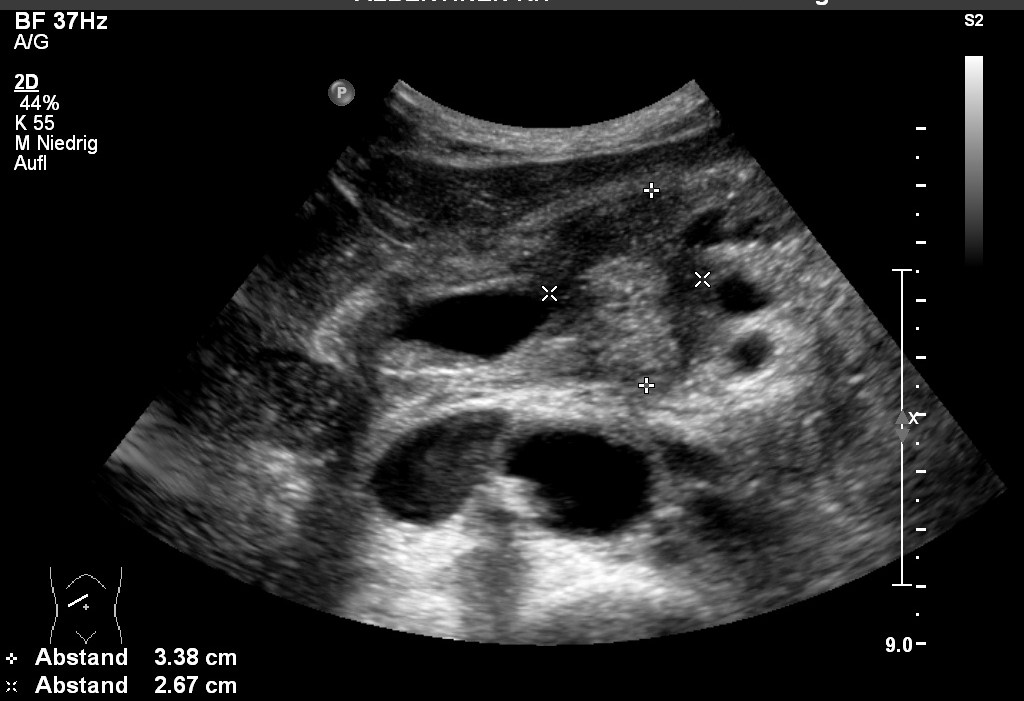
USG: Rak trzustki (dzięki uprzejmości sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg)
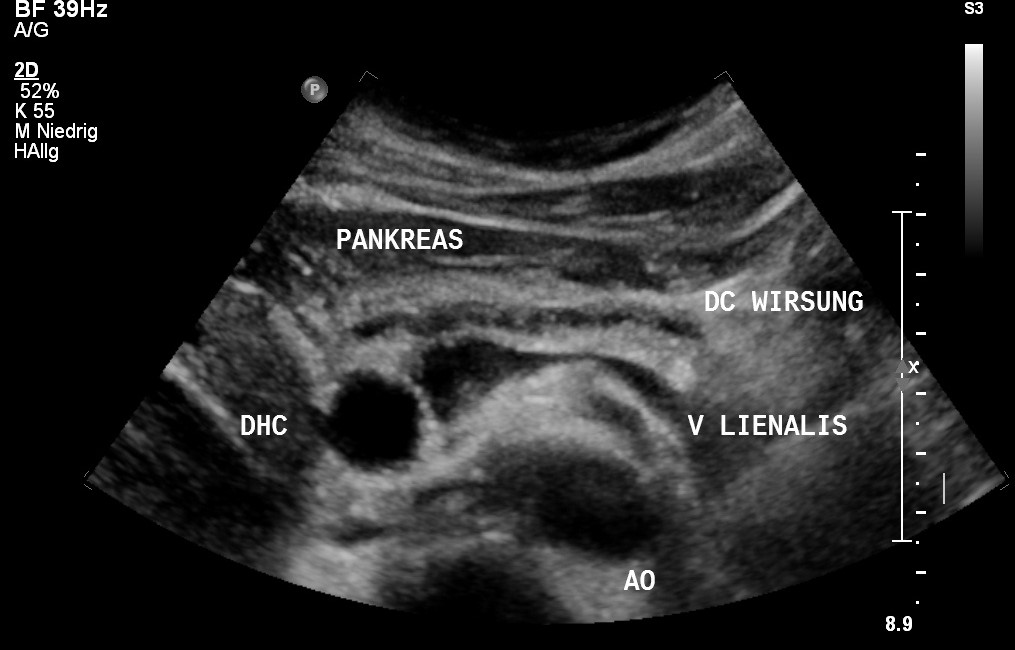
USG: Poszerzenie przewodu Wirsunga w raku trzustki (dzięki uprzejmości sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg)
Źródła
Wytyczne
- European Society for Medical Oncology. Cancer of the Pancreas: ESMO Clinical Practice Guidelines, 2023. www.esmo.org
Piśmiennictwo
- Takhar A.S., Palaniappan P., Dhingsa R., Lobo D.N., Recent developments in diagnosis of pancreatic cancer, BMJ 2004, 329: 668-73, PubMed
- Freelove R., Walling A.D. Pancreatic cancer: Diagnosis and management, Am Fam Physician 2006, 73: 485-92, PubMed
- Didkowska JA, Wojciechowska U, Barańska K et al. Nowotwory złośliwe w Polsce w 2021 roku. Narodowy Instytut Onkologii, Warszawa 2023. onkologia.org.pl
- Qiu D., et al.. Overview of the epidemiology of pancreatic cancer focusing on the JACC Study, J Epidemiol 2005, 15 Suppl 2: 157-67, pmid:16127228, PubMed
- de la Cruz M.S.D., Young A.P., Ruffin M.T. Diagnosis and management of oancreatic cancer, Am Fam Physician, 15.04.2014, 89(8): 626-32, PubMed
- European Society for Medical Oncology. Cancer of the Pancreas: ESMO Clinical Practice Guidelines, Stand 2015, www.esmo.org
- Schenk M., Schwartz A.G., O'Neal E., et al. Garabrant familial risk of pancreatic cancer, J Natl Cancer Inst 2001, 93: 640-4, PubMed
- Vincent A., Herman J., Schulick R., et al. Pancreatic cancer. Seminar, Lancet 2011, 378: 607-20, PubMed
- Michaud D.S., Giovannucci E., Willett W.C., Colditz G.A., Stampfer M.J., Fuchs C.S. Physical activity, obesity, height, and the risk of pancreatic cancer, JAMA 2001, 286: 921-9, PubMed
- Ben Q., Xu M., Ning X., et al. Diabetes mellitus and risk of pancreatic cancer. A meta-analysis of cohort studies, Eur J Cancer 2011, 47: 1928-37, PubMed
- Liao W-C., Tu Y.K., Wu M.S., et al. Blood glucose concentration and risk of pancreatic cancer: Systematic review and dose-response meta-analysis, BMJ 03.01.2015, 349:g7371, doi: 10.1136/bmj.g7371, DOI
- Navid Sadeghi et all. Metformin use is associated with better survival of diabetic patients with pancreatic cancer, Clinical Cancer Research 2012, 18: 2905-12, doi:10.1158/1078-0432.CCR-11-2994, DOI
- Hidalgo M. Pancreatic cancer. Review article, N Engl J Med 2010; 362: 1605-17, PubMed
- Gapstur S.M., Jacobs E.J., Deka A., et al. Association of alcohol intake with pancreatic cancer mortality in never smokers, Arch Intern Med 2011, 171: 444-51, PubMed
- Fryzek, J.P., et al.. A case-control study of self-reported exposures to pesticides and pancreas cancer in southeastern Michigan, Int J Cancer 1997, 72(1): 62-7, www.ncbi.nlm.nih.gov
- Ji B.T., et al.. Occupational exposure to pesticides and pancreatic cancer, Am J Ind Med 2001, 39(1): 92-9, www.ncbi.nlm.nih.gov
- Ojajarvi I.A., et al.. Occupational exposures and pancreatic cancer: a meta-analysis, Occup Environ Med 2000, 57(5): 316-24, www.ncbi.nlm.nih.gov
- Ojajarvi, A., et al.. of pancreatic cancer in workers exposed to chlorinated hydrocarbon solvents and related compounds: a meta-analysis, Am J Epidemiol 2001, 153(9): 841-50, www.ncbi.nlm.nih.gov
- Weiderpass E., et al. Occupational exposures and gastrointestinal cancers among Finnish women, J Occup Environ Med 2003, 45(3): 305-15, www.ncbi.nlm.nih.gov
- Yassi A. R.B. Tate, and M. Routledge. Cancer incidence and mortality in workers employed at a transformer manufacturing plant: update to a cohort study, Am J Ind Med 2003, 44(1): 58-62, www.ncbi.nlm.nih.gov
- Alguacil J., M. Pollan, and P. Gustavsson. Occupations with increased risk of pancreatic cancer in the Swedish population, Occup Environ Med 2003, 60(8): 570-6, www.ncbi.nlm.nih.gov
- Alguacil J., et al.. Occupation and pancreatic cancer in Spain: a case-control study based on job titles, PANKRAS II Study Group, Int J Epidemiol 2000, 29(6): 1004-13, www.ncbi.nlm.nih.gov
- Laakkonen A., T. Kauppinen, and E. Pukkala. Cancer risk among Finnish food industry workers, Int J Cancer 2006, 118(10): 2567-71, www.ncbi.nlm.nih.gov
- DiMagno E.P. Pancreatic cancer: clinical presentation, pitfalls and early clues, Ann Oncol 1999, 10(suppl 4): 140-2, pubmed.ncbi.nlm.nih.gov
- Louhimo J., Alfthan H., Stenman U.H., Haglund C. Serum HCG beta and CA 72-4 are stronger prognostic factors than CEA, CA 19-9 and CA 242 in pancreatic cancer, Oncology 2004, 66: 126-31, PubMed
- Pisters P.W., Hudec W.A., Hess K.R., et al. Effect of preoperative biliary decompression on pancreaticoduodenectomy-associated morbidity in 300 consecutive patients, Ann Surg 2001, 234: 47-55, PubMed
- Sewnath M.E., Karsten T.M., Prins M.H., et al. A meta-analysis on the efficacy of preoperative biliary drainage for tumors causing obstructive jaundice, Ann Surg 2002, 236: 17-27, PubMed
- Wong J.C., Lu D.S. Staging of pancreatic adenocarcinoma by imaging studies,. Clin Gastroenterol Hepatol, 2008, 6(12): 1301-8, pubmed.ncbi.nlm.nih.gov
- Gress F., Gottlieb K., Sherman S., Lehman G. Endoscopic ultrasonography-guided fine-needle aspiration biopsy of suspected pancreatic cancer, Ann Intern Med 2001, 134: 459-64, PubMed
- Li D., Xie K., Wolff R., Abbruzzese J.L. Pancreatic cancer, Lancet 2004, 363: 1049-57, PubMed
- Durup-Scheel H.J., Mortensen M.B., Qvist N., Hovendal C.P. TNM staging and assessment of resectability of pancreatic cancer by laparoscopic ultrasonography, Surg Endosc 1999, 13: 967-71, PubMed
- Jemal A., Clegg L.X., Ward E., Ries L.A., Wu X., Jamison P.M., et al. Annual report to the nation on the status of cancer, 1975-2001, with a special feature regarding survival, Cancer 2004, 101: 3-27, PubMed
- Sohn T.A., Yeo C.J., Cameron J.L., et al. Resected adenocarcinoma of the pancreas 616 patients: results, outcomes, and prognostic indicators, J Gastrointest Surg 2000, 4: 567-79, PubMed
- Burcharth F., Olsen S.D., Trillingsgaard J et al. Pancreaticoduodenectomy for periampullary cancer in patients more than 70 years of age, Hepato Gastroenterol 2001, 48: 1149-52, www.ncbi.nlm.nih.gov
- Povoski S.P., Karpeh M.S., Conlon K.C., Blumgart L.H., Brennan M.F. Association of preoperative biliary drainage with postoperative outcome following pancreaticoduodenectomy, Ann Surg 1999, 230: 131-42, PubMed
- Van der Gaag N.A., Rauws E.A., Van Eijck C.H., et al. Preoperative biliary drainage for cancer of the head of the pancreas, N Eng J Med 2010, 362: 129-37, www.nejm.org
- Dormann A., Meisner S., Verin N. et al. Self-expanding metal stents for gastroduodenal malignancies: systematic review of their clinical effectiveness, Endoscopy 2004, 36: 543-50, PubMed
Opracowanie
- Tomasz Tomasik (recenzent)
- Natalia Jagiełła (recenzent)
- Adam Windak (redaktor)
- Kristine Scheibel (recenzent/redaktor)
