Informacje ogólne
Definicja
- Jałowa martwica kości głowy kości udowej w dzieciństwie, która ustępuje samoistnie w ciągu około 2–4 lat, ale może powodować nieodwracalne uszkodzenie stawu biodrowego w formie deformacji przedzwyrodnieniowej o różnym nasileniu.
- Synonimy: choroba Perthesa, Coxa plana
- Istnieje kilka systemów klasyfikacji, w tym
- stopień zaawansowania radiologicznego według Waldenströma
- klasyfikacja według oceny bocznej kolumny nasady według Herringa jako czynnika prognostycznego
- Choroba została po raz pierwszy opisana niezależnie przez Legga, Calvégo i Perthesa w 1910 roku.
Klasyfikacja Herringa
- Wysokość bocznej jednej trzeciej głowy kości udowej (zmniejszająca się z powodu martwicy)
- A: zachowana wysokość bocznej kolumny nasady
- B: wysokość bocznej kolumny nasady zmniejszona o <50%>
- podtyp B/C: wysokość kolumny bocznej zmniejszona o 50%
- C: wysokość bocznej kolumny nasady zmniejszona o >50%
- Rokowanie w przypadku stadium A jest ogólnie uważane za korzystne, w przypadku stadium B nieprzewidywalne, a w przypadku stadium C niekorzystne.
Częstość występowania
- Choroba występuje z częstością ok. 11:100 000 dzieci. Jest to stosunkowo częsta choroba stawu biodrowego w dzieciństwie.
- Występuje częściej u chłopców, w stosunku 4–5:1.
- Najczęściej występuje w 5. i 6. roku życia.
- U 10% dzieci zajęta jest również druga noga1.
- Wiek predylekcji wynosi 3‒12 lat2.
Anatomia
- Głowa kości udowej jest kulista i pokryta chrząstką stawową.
- Dołek środkowy to owalne, nie do końca wyśrodkowane zagłębienie, które służy jako mocowanie dla więzadła głowy kości udowej (więzadła obłego).
- Głowa kości udowej (Caput femoris) jest zaopatrywana przez pierścień naczyniowy u podstawy szyjki kości udowej z gałęzi bocznych i przyśrodkowych tętnic okalających udo (Arteria circumflexa femoris). W mniejszym stopniu przyczyniają się do tego tętnice pośladkowe górne i dolne.
- Tętnica w więzadle głowy kości udowej odpowiada za 1/3 dopływu krwi do głowy kości udowej u dzieci, podczas gdy u dorosłych jej udział jest niewielki.
Etiologia i patogeneza
- Zmniejszony przepływ krwi do głowy kości udowej powoduje jałową martwicę3.
- Przyczyna jest nieznana, ale wydaje się być wieloczynnikowa.
- Następujące czynniki mogą przyczyniać się do zmniejszenia przepływu krwi:
- zwiększona lepkość krwi przy np. zaburzeniach trombolizy
- nawracające zawały kości
- anomalie naczyniowe
- opóźnienie rozwoju szkieletu z opóźnionym kostnieniem
- Przy braku kostnienia przepływ krwi w naczyniach nasadowych jest zmniejszony przez masę ciała.
- zwiększona lepkość krwi przy np. zaburzeniach trombolizy
Patofizjologia
- Niedostateczne ukrwienie głowy kości udowej prowadzi do martwicy kości.
- W przypadku rewaskularyzacji głowy kości udowej w przebiegu tej samoistnie ustępującej choroby, najpierw dochodzi do resorpcji martwiczej kości, zanim nowa kość zastąpi starą. Podczas tego procesu istnieje ryzyko, że głowa kości udowej spłaszczy się lub całkowicie zapadnie.
- Skuteczność naprawy zależy od wieku dziecka (im młodsze, tym lepiej), a także od współistniejącego zakażenia, przylegania stawu oraz innych czynników mechanicznych i fizjologicznych.
- Leczenie ma na celu optymalizację tych czynników.
- Wyniki i przebieg procesu naprawy z rewaskularyzacją i rekonstrukcją głowy kości udowej są różne.
- U niektórych pacjentów głowę kości udowej udaje się prawie całkowicie przywrócić, ale u większości pozostaje spłaszczona.
- Stopień przylegania stawu po zakończeniu procesu naprawy jest najważniejszym czynnikiem prognostycznym przyszłego rozwoju choroby zwyrodnieniowej stawów.
- Dla typowego przebiegu etapowego istnieje klasyfikacja według Waldenströma4:
- Stadium I: stadium początkowe
- Stadium II: stadium sklerotyzacji
- Stadium III: stadium fragmentacji
- Stadium IV: stadium odbudowy
- Stadium V: stadium końcowe
Czynniki predysponujące
- Uraz z uszkodzeniem naczyń krwionośnych
- Omawia się różne czynniki środowiskowe, które w przypadku predyspozycji genetycznych mogą zwiększać ryzyko wystąpienia choroby lub negatywnie wpływać na jej rokowanie5:
ICD-10
- M91 Młodzieńcza osteochondroza biodra i miednicy
- M91.1 Osteochondroza młodzieńcza głowy kości udowej [choroba Legga-Calvégo-Perthesa]
- M 91.2 Miednica płaska
Diagnostyka
Kryteria diagnostyczne
- Ból biodra związany ze stresem w dzieciństwie, często promieniujący na staw kolanowy.
- Wszystkie niejasne wyniki dotyczące kolana i biodra w wieku predylekcyjnym są podejrzane i wymagają diagnostyki.
- W przypadku podejrzenia choroby Perthesa należy wykonać ogląd RTG miednicy i projekcję według Lauensteina.
- Często badania dają ujemny wynik we wczesnej fazie, wtedy korzystnie jest wykonać RM.
Diagnostyka różnicowa
- Uwaga: towarzyszące objawy, takie jak złe samopoczucie, gorączka, utrata masy ciała lub niedokrwistość powinny sugerować chorobę układową!
- Surowicze zapalenie stawu biodrowego
- regresja wysięku stawowego po kilku dniach
- Dysplazja stawów biodrowych
- Młodzieńcze reumatoidalne zapalenie stawów
- Bakteryjne zapalenie stawów
- Młodzieńcze złuszczenie głowy kości udowej
- Zapalenie kości i szpiku
- Nowotwór
- Dysplazja Meyera (mnoga osteochondrodysplazja)
- symetryczne zmiany w badaniu radiologicznym
- ujemny wynik RM
Wywiad lekarski
- Pacjenci mają zwykle od 4 do 10 lat. Najczęściej choroba występuje w 5. i 6. roku życia.
- Choroba często zaczyna się od krótkotrwałych, przejściowych epizodów utykania i niewielkiego bólu lub w ogóle nie daje objawów bólowych. Epizody te występują głównie po obciążeniu i nasilają się z czasem.
- Stopniowo utykanie staje się bardziej wyraźne, a pacjenci skarżą się na ból w kolanie, pachwinie lub przedniej/zewnętrznej części uda.
- Zakres ruchu biodra może się zmniejszyć.
- Często objawy utrzymują się przez kilka tygodni przed konsultacją lekarską.
Badanie przedmiotowe
- Obserwacja — ocena:
- kondycji fizycznej (Nadwaga?)
- wzorca chodu (utykanie, późniejsze utykanie z powodu nierówności kończyn)
- atrofii mięśni
- Palpacja
- ból przy ucisku w pachwinie
- nieprawidłowe ustawienie miednicy (anatomiczna lub czynnościowa rozbieżność długości nóg)
- Badanie czynnościowe
- ruchomość stawów według metody badania zakresu ruchu (range of motion — ROM)
- ograniczony ruch, ból przy ruchu (najpierw ograniczona rotacja wewnętrzna i odwodzenie)
- dodatni wynik testu odwiedzenia
- Pacjent w pozycji na plecach
- Kostkę badanej nogi umieszcza się na udzie drugiej nogi.
- Z góry ta pozycja nóg przypomina liczbę cztery.
- Kiedy wywiera się nacisk na staw kolanowy zgiętej nogi (wymuszając w ten sposób rotację zewnętrzną i odwodzenie), pojawia się ból.
- objaw Trendelenburga
- opadanie miednicy po zajętej stronie przy staniu na jednej nodze z powodu niewydolności/zaniku odwodzicieli
- Uwaga: zawsze należy badać obie strony, ponieważ u 10% dzieci zajęta jest również druga noga!
Badania uzupełniające w praktyce lekarza rodzinnego
Diagnostyka specjalistyczna
- Zdjęcia rentgenowskie są częścią standardowej diagnostyki
- ogląd RTG miednicy i projekcja według Lauensteina
- Pokazują one różne stadia radiograficzne. Pierwsze zmiany są widoczne na zdjęciu rentgenowskim bez kontrastu po 6–8 tygodniach.
- Wcześniej wykonane zdjęcia rentgenowskie często dają prawidłowe wyniki. Alternatywnie można zaobserwować nieswoisty wzrost płynu maziowego z nieznacznie poszerzoną jamą stawową9-10.
- W początkowej fazie widoczny jest nieregularny dół nasadowy i cienka przynasada w porównaniu do zdrowej strony. Rozjaśnienie podchrzęstne występuje stosunkowo szybko.
- W stadium sklerotyzacji widoczna jest sklerotyczna głowa kości.
- W stadium fragmentacji widoczny jest grubszy rozpad.
- Dopiero w stadium odbudowy, w którym następuje sukcesywne tworzenie się nowej kości, stopniowo uzyskuje się pogląd na stopień deformacji głowy kości.
- RM
- Charakteryzuje się wyższą czułością niż badanie rentgenowskie wczesnych stadiów, a także większą dokładnością w śledzeniu różnych stadiów.
- Dostarcza przydatnych informacji na temat położenia, kształtu i rozmiaru głowy kości udowej oraz otaczających ją tkanek miękkich.
- Badanie RM zwykle wymaga sedacji lub znieczulenia ogólnego u młodszych dzieci.
- Badanie ultrasonograficzne stawu biodrowego
- diagnostyka różnicowa w kontekście przemijającego zapalenia stawu biodrowego
- Podejrzany jest wysięk utrzymujący się przez ponad 2 tygodnie.
Wskazania do skierowania do specjalisty
- Skierowanie do ortopedy powinno być wystawione w przypadku każdego uzasadnionego podejrzenia choroby, nawet jeśli diagnostyka rentgenowska daje ujemne wyniki we wczesnej fazie.
Leczenie
Cele leczenia
- Celem leczenia jest uwolnienie od bólu i zapewnienie prawidłowej czynności stawu biodrowego w zaawansowanych stadiach choroby oraz uzyskanie kulistego, przylegającego i wyśrodkowanego stawu bez stanu przedzwyrodnieniowego pod koniec stadium odbudowy.
Ogólne informacje o leczeniu
- Optymalne leczenie choroby Calvégo-Legga-Perthesa jest nadal przedmiotem dyskusji.
- Podstawową zasadą leczenia jest tzw. containment, czyli centrowanie głowy kości udowej w panewce.
- Opiera się ona na stwierdzeniu, że panewka stanowi bodziec formujący wzrost głowy kości udowej i odwrotnie, głowa kości udowej również stanowi bodziec formujący panewkę.
- Algorytm leczenia opiera się na wieku, mobilności, radiologicznej klasyfikacji ciężkości według Herringa i obecności objawów zagrożenia głowy kości.
- <6 lat>
- łagodna postać, A lub B wg Herringa, dobra ruchomość → leczenie zachowawcze
- ciężka postać, B/C lub C wg Herringa, słaba ruchomość → osteotomia międzykrętarzowa (intertrochanteric osteotomy — ITO)/osteotomia Saltera
- 6–10 lat
- centrowanie zachowane, A lub B wg Herringa, dobra mobilność → leczenie zachowawcze
- utrata wycentrowania, B/C lub C wg Herringa, słaba ruchomość → ITO/osteotomia Saltera
- >10 lat
- centrowanie zachowane, ale z biodrem szpotawym i powiększeniem główki kości udowej → epifizjodeza krętacza/korygująca ITO/wydłużenie szyjki kości udowej
- utrata wycentrowania, krótka panewka, powiększenie główki kości udowej → potrójna osteotomia miednicy/ustawienie krętarza/wydłużenie szyjki kości udowej
Leczenie zachowawcze
- Tylko w początkowym stadium
- bisfosfoniany hamujące resorpcję kości i wazoaktywne analogi prostacykliny jako leki wspomagające krążenie krwi
- Uwaga: bezpieczeństwo i skuteczność stosowania tych substancji u dzieci nie zostały potwierdzone. Jest to stosowanie poza wskazaniami rejestracyjnymi!
- Stosowanie tego leczenia farmakologicznego powinno być zatem ograniczone do wyspecjalizowanych ośrodków.
- bisfosfoniany hamujące resorpcję kości i wazoaktywne analogi prostacykliny jako leki wspomagające krążenie krwi
- Od stadium sklerotyzacji
- Poprawa ruchomości stawu biodrowego poprzez regularne ćwiczenia bez obciążania, takie jak fizjoterapia, pływanie, jazda na rowerze i kontrolowany trening mięśni.
- Zmniejszenie sił pionowych działających na staw poprzez częściowe odciążenie i zaprzestanie aktywności sportowych, które wiążą się z powtarzalnym obciążeniem stawu, takich jak bieganie, skakanie, przeskakiwanie itp.
- objawowe leczenie bólu za pomocą leków przeciwbólowych, przeciwzapalnych i rozciąganie
- Nie wykazano żadnego wpływu ortez i unieruchomień gipsowych na odciążanie stawu.
- Unieruchomienie w ortezie może skutkować wręcz zwiększonym ciśnieniem wewnątrzstawowym.
Zalecenia dla pacjentów
- Odciążenie chorej nogi jest ważne, zwłaszcza w przypadku bólu.
- Ważne jest, aby dziecko regularnie uczęszczało na fizjoterapię w celu kontrolowania i utrzymania mobilności.
- Podczas odciążania dziecko powinno przyjąć pozycję, w której kość udowa jest odwiedziona i obrócona do wewnątrz, tak aby głowa kości udowej była dobrze osadzona w okrągłej części panewki.
Operacja
- W metaanalizach stwierdzono, że leczenie chirurgiczne z większym prawdopodobieństwem prowadzi do uzyskania kulistej, przylegającej nasady kości udowej u pacjentów w wieku 6 lat i starszych niż zabiegi niechirurgiczne11-12.
Zapobieganie
- Aby zapobiec rozwojowi choroby zwyrodnieniowej stawów w późniejszym okresie, pacjenci powinni być chronieni przed niepotrzebnymi obciążeniami i nie powinni podejmować pracy, która wymaga dużo chodzenia lub stania i podnoszenia ciężkich przedmiotów.
Przebieg, powikłania i rokowanie
Przebieg
- Martwica i rekonstrukcja głowy kości udowej trwają przez okres 2‒4 lat. Następnie choroba ustępuje z różnymi stopniami deformacji resztkowych.
- Choroba zazwyczaj przechodzi przez 5 etapów według Waldenströma:
- stadium początkowe
- stadium sklerotyzacji
- stadium fragmentacji
- stadium odbudowy
- stadium końcowe
Powikłania
- Wtórna koksartroza
- Wolne ciała wewnątrzstawowe
Rokowanie
- Rokowanie krótkoterminowe i średnioterminowe (10‒20 lat) jest dobre u większości dzieci.
- Czynniki predykcyjne2
- Jeśli choroba zaczyna się wcześnie (przed ukończeniem 6. roku życia), rokowanie jest lepsze. Dotyczy to również przypadku martwicy obejmującej mniej niż 50% bocznej nasady kości udowej (A i B wg Herringa).
- Rokowanie jest nieco gorsze w przypadku dziewczynek niż chłopców.
- Rokowanie długoterminowe
- Choroba predysponuje do wtórnej choroby zwyrodnieniowej stawów.
- Rokowanie zależy w dużej mierze od stopnia przylegania stawu i zajęcia centrum nasady.
- U około 50% osób dotkniętych chorobą rozwija się w przebiegu koksartroza, a druga połowa wykazuje powrót do pełnego zdrowia13.
Dalsze postępowanie
- Odpowiedzialność za leczenie w fazie aktywnej spoczywa na specjalistach.
- Na wczesnych etapach aktywnych zaleca się kontrolę ambulatoryjną co 3 miesiące, po wygojeniu i zakończeniu plastyczności głowy kości udowej co 6–12 miesięcy do zakończenia procesu wzrostu.
Informacje dla pacjentów
Informacje dla pacjentów w Deximed
Ilustracje
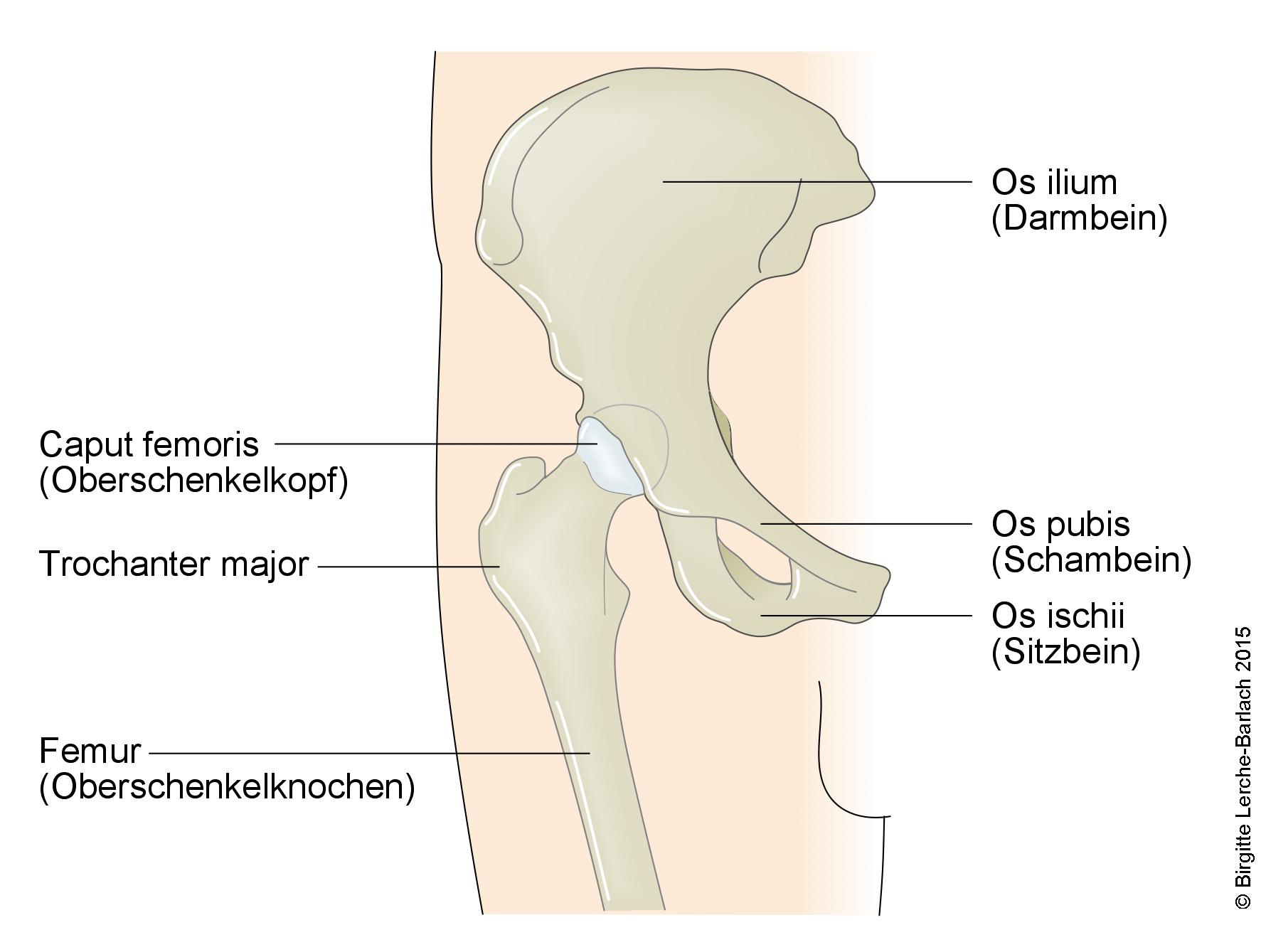
Udo, biodro i miednica
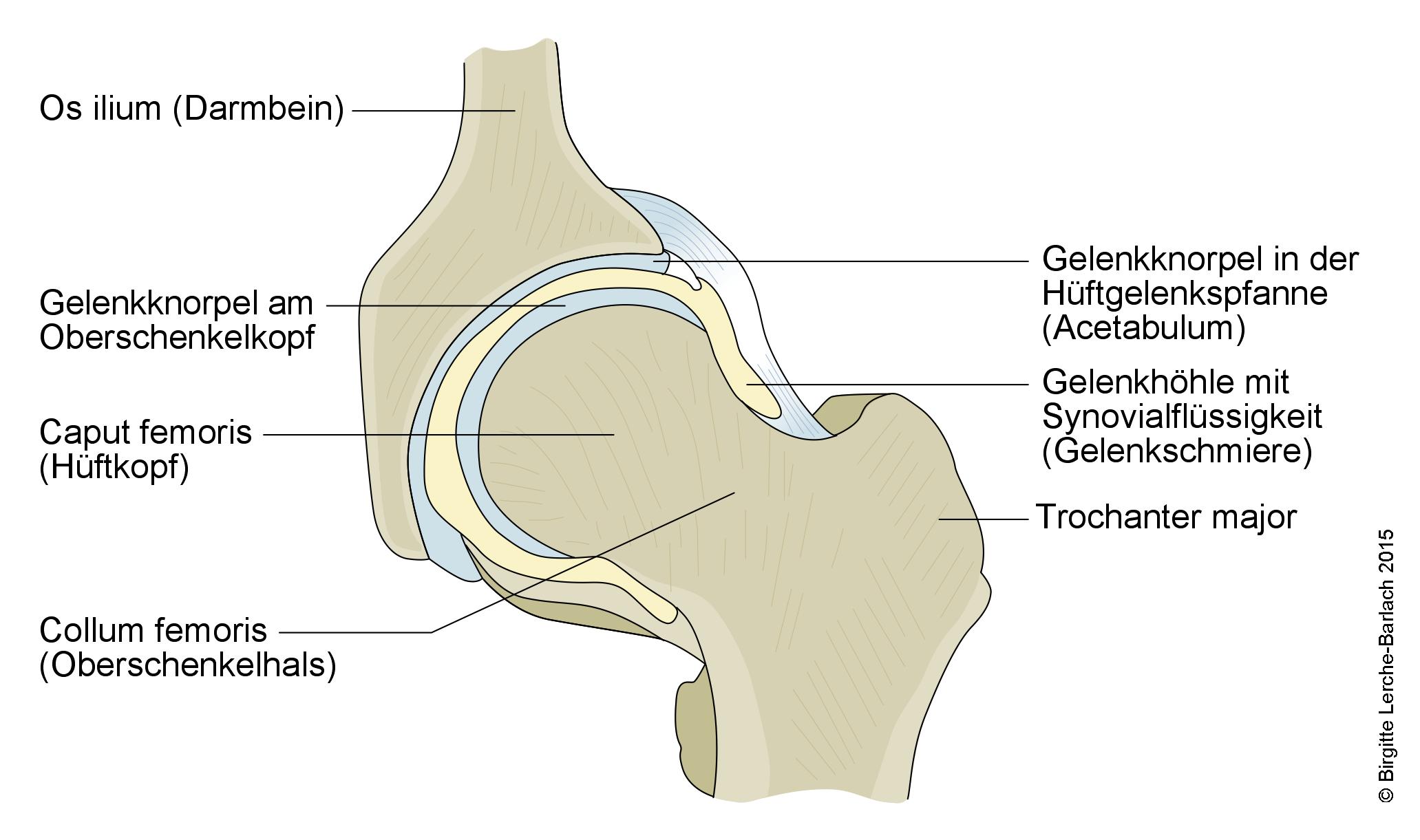
Staw biodrowy
Choroba Perthesa (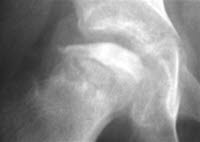 )
)
 )
)
Choroba Calvégo-Legga-Perthesa, RTG
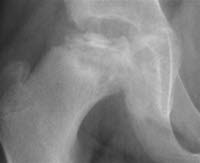
Calvé-Legg-Perthes-Krankheit, Röntgen
Quellen
Literatur
- Guille JT, Lipton GE, Tsirikos AI, Bowen JR. Bilateral Legg-Calvé-Perthes disease: presentation and outcome. J Pediatr Orthop 2002; 22: 458-63. PubMed
- Wiig O, Terjesen T, Svenningsen S, et al. The epidemiology and aetiology of Perthes’ disease in Norway. A nationwide study of 425 patients. J Bone Joint Surg Br 2006; 88: 1217-23. PubMed
- Harris GD. Legg-Calve-Perthes disease. Medscape, last updated Feb 06, 2020. emedicine.medscape.com
- Waldenström H. Coxa plana, Osteochondritis deformans coxae. Zentralbl Chir 1920; 47: 5395. PubMed
- Perry DC, Bruce CE, Pope D, et al. Perthes' disease of the hip: socioeconomic inequalities and the urban environment. Arch Dis Child 2012;97:1053-1057. PubMed
- Gordon JE, Schoenecker PL, Osland JD, et al. Smoking and socio-economic status in the etiology and severity of Legg-Calvé-Perthes' disease. J Pediatr Orthop B 2004;13:367-370. PubMed
- Bahmanyar S, Montgomery SM, Weiss RJ, et al. Maternal smoking during pregnancy and other prenatal and perinatal factors and the risk of Legg-Calvé-Perthes disease. Pediatrics 2008;122:459-464. europepmc.org
- Szepesi K, Posan E, Harsfalvi J, et al. The most severe forms of Perthes' disease associated with the homozygous Factor V Leiden mutation. J Bone Joint Surg Br 2004;86:426-429. PubMed
- Herring JA, Kim HT, Browne R. Legg-Calve-Perthes disease. Part II: Prospective multicenter study of the effect of treatment on outcome. J Bone Joint Surg Am 2004; 86: 2121-34. PubMed
- Herring JA, Kim HT, Browne R. Legg-Calve-Perthes disease. Part I: Classification of radiographs with use of the modified lateral pillar and Stulberg classifications. J Bone Joint Surg Am 2004; 86: 2103-20. PubMed
- Nguyen NA, Klein G, Dogbey G, et al. Operative versus nonoperative treatments for Legg-Calvé-Perthes disease: a meta-analysis. J Pediatr Orthop 2012;32:697-705. PubMed
- Saran N, Varghese R, Mulpuri K. Do femoral or salter innominate osteotomies improve femoral head sphericity in Legg-Calvé-Perthes disease? A meta-analysis. Clin Orthop Relat Res 2012;470:2383-2393. PubMed
- Heesakkers N, van Kempen R, Feith R, Hendriks J, Schreurs W. The long-term prognosis of Legg-Calvé-Perthes disease: a historical prospective study with a median follow-up of forty one years. Int Orthop. 2014 Nov 19. pubmed.ncbi.nlm.nih.gov
- Pavone V, Chisari E, Vescio A, et al. Aetiology of Legg-Calvé-Perthes disease: a systematic review. World J Orthop 2019; 10(3): 145-65. www.ncbi.nlm.nih.gov
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung, Innere Medizin, Frankfurt