informacje ogólne
Definicja
- Trofoblast: struktura komórkowa, która rozwija się na najwcześniejszych etapach ciąży i w przebiegu różnicuje się w embrionalną część łożyska.
- Choroby trofoblastyczne są spowodowane nieprawidłowym różnicowaniem się komórek trofoblastu.
- Choroba może, ale nie musi, być związana z ciążą.
- Ciążowa choroba trofoblastyczna (Gestational Trophoblastic Disease — GTD): cytogenetycznie i przedmiotowo niejednorodna grupa chorób spowodowanych nieprawidłowym różnicowaniem i/lub proliferacją nabłonka trofoblastycznego.
- Na podstawie obecności kosmków kosmówkowych lub ich braku rozróżnia się kosmówkową i nie kosmówkową GDT.
- Ogniskowa lub rozproszona proliferacja komórek trofoblastu
- Przyczyną jest zwykle nieprawidłowość chromosomu w czasie ciąży.
- Łagodne warianty
- całkowity zaśniad groniasty
- częściowy zaśniad groniasty
- Warianty złośliwe
- zaśniad inwazyjny (kosmówczak)
- rak kosmówki
- guzy łożyska
- Zazwyczaj rozwijają się one zaśniadu groniastego i charakteryzują się utrzymującym się wysokim stężeniem beta-hCG.
Klasyfikacja
- W oparciu o klasyfikację WHO, podział na ciążowe i nieciążowe choroby trofoblastyczne1
- Ciążowa choroba trofoblastyczna (Gestational Trophoblastic Disease — GTD): Na podstawie obecności kosmków kosmówkowych lub ich braku rozróżnia się kosmówkową i nie kosmówkową GDT.
- kosmkowe
- Częściowy zaśniad groniasty: zawiera zarówno tkankę płodową, jak i tkankę zaśniadu, bardzo rzadko zachodzi zwyrodnienie złośliwe.
- Zaśniad groniasty (pełny): cała macica jest wypełniona kosmkami przypominającymi winogrona, bez tkanki płodowej.
- Zaśniad inwazyjny: jest to złośliwe zwyrodnienie zaśniadu (przetrwała kosmówkowa ciążowa choroba trofoblastyczna), w 8–15% przypadków zaśniadów.
- niekosmkowe
- łagodne
- hiperplastyczne miejsce implantacji
- guzki łożyskowe
- złośliwe
- rak kosmówki: w 5% po zaśniadzie
- guz łożyska (rzadkość)
- nabłonkowy guz trofoblastyczny (bardzo rzadki)1
- łagodne
- kosmkowe
- Nieciążowe choroby trofoblastyczne: bardzo rzadkie
- rak kosmówkowy jajnika, błony śluzowej trzonu macicy lub w kontekście raka urotelialnego z różnicowaniem trofoblastycznym
- Choroby trofoblastyczne dają głównie przerzuty hematogenne, często do płuc.
- Guzy łożyska zwykle rozprzestrzeniają się limfogenicznie.
częstość występowania
Łagodna choroba trofoblastyczna
- Choroby trofoblastyczne rozwijają się w ok. 1 na 500–1000 ciąż w Ameryce Północnej i Południowej oraz w Europie, częściej w Azji Wschodniej, nawet w 1 na 120 ciąż2.
- Zapadalność zaśniadu wynosi 1:500 w Azji, 1:1000 na Bliskim Wschodzie i w Afryce, 1:1500 w Europie i Ameryce Północnej3.
- Częściowe i pełne zaśniady stanowią większość chorób trofoblastycznych (80%)4.
- Po ciąży z zaśniadem ryzyko w kolejnych ciążach wynosi 0,7–2,6%, po 2 ciążach z zaśniadem ryzyko w trzeciej ciąży wynosi 10%5.
- Zapadalność zaśniadu jest wyższa w granicach płodności.
- kobiety poniżej 20. roku życia: ryzyko 7 razy wyższe
- kobiety po 40. roku życia: ryzyko 2 razy wyższe6
Złośliwa choroba trofoblastyczna
- Zapadalność
- rak kosmówki: 1 na 20 000–40 000 ciąż
- Guzy łożyska: niezwykle rzadkie; na całym świecie opisano tylko około 300 przypadków.
Etiologia i patogeneza
- Ciąża jest punktem wyjściowym: trofoblast zawiera materiał genetyczny, który jest obcy dla kobiety. Może wystąpić podczas prawidłowej ciąży, ciąży pozamacicznej i poronienia.
- Podczas zapłodnienia komórki trofoblastu kolonizują endometrium, naczynia krwionośne i myometrium w celu ustanowienia krążenia płodowo-łożyskowego. Podczas prawidłowej ciąży w krwiobiegu matki krąży duża liczba komórek trofoblastycznych. Choroby trofoblastyczne prowadzą do niepohamowanej inwazji komórek trofoblastycznych do myometrium i krwiobiegu matki.
- Pełny zaśniad ma kariotyp 46,XX lub 46,XY z obydwoma gonosomami pochodzącymi od ojca. Plemnik (23,X) zapłodnił komórkę jajową, a następnie podwoił liczbę chromosomów; matczyne DNA zostało utracone podczas zapłodnienia. W rzadkich przypadkach może dojść do zapłodnienia przez dwa plemniki i utraty jądra matczynego.
- W przypadku częściowego zaśniadu rozwija się płód o kariotypie 69,XXY lub 69,XXX. Jedna komórka jajowa została zapłodniona dwoma plemnikami.
Czynniki predysponujące
ICD-10
- D39 Nowotwór o niepewnym lub nieznanym charakterze żeńskich narządów płciowych
- D39.2 Łożysko
- O01 Zaśniad groniasty
- O01.0 Klasyczny zaśniad groniasty
- O01.1 Niezupełny lub częściowy zaśniad groniasty
- O01.9 Zaśniad groniasty, nieokreślony
diagnostyka
Kryteria diagnostyczne
- częściowy zaśniad groniasty
- sonograficznie duże łożysko, częściowo struktury pęcherzykowe
- malformacje embrionalne, rzadkie osiągnięcie żywotności
- zwykle brak podwyższonego stężenia beta-hCG
- Zaśniad groniasty
- podwyższona produkcja beta-hCG bez wykrywalnych sonograficznie struktur płodu, zamiast tego wewnątrzmaciczne obszary przypominające pęcherzyki, duża macica
- Poniższe kryteria mają zastosowanie do rozpoznania przetrwałej kosmkowej ciążowej choroby trofoblastycznej (persistent gestational trophoblastic disease — GTD):
- przynajmniej cztery kolejne wartości hCG z efektem plateau lub
- wzrost wartości hCG w dwóch kolejnych pomiarach (dzień 0 i 7) lub
- utrzymujące się wartości hCG przez 6 miesięcy
Różicowanie
- Ciąża prawidłowa
- Ciąża ektopowa
- poronienie samoistne
Wywiad lekarski
- Najczęstszym objawem jest krwawienie z pochwy w 1. lub na początku 2. trymestru.
- Większość krwawień występuje wcześnie i jest rozpoznawana około 10. tygodnia ciąży7.
- Szybki wzrost macicy
- Macica, która jest zbyt duża jak na czas trwania ciąży.
- Nudności i wymioty
- Ew. możliwe wczesne oznaki stanu przedrzucawkowego
- wzrost ciśnienia krwi i białkomocz przed 20. tygodniem ciąży
- Nadczynność tarczycy, ew. przełom tarczycowy (wysokie stężenie hCG)
- Częściowy zaśniad często objawia się samoistnym lub zatrzymanym poronieniem.
Badanie uzupełniające w praktyce lekarza rodzinnego
- Oznaczenie beta-hCG oznaczanie w przypadku niepewnego rozpoznania
Badanie przedmiotowe przez ginekologa
- Krwawienie z szyjki macicy
- Ew. widoczne pęcherze przypominające winogrona wystające z kanału szyjki macicy z surowiczą zawartością lub spontaniczna wydzielina z pochwy
- W momencie rozpoznania macica jest zwykle większa niż oczekiwano.
Diagnostyka u specjalisty
- Badanie USG: powstawanie pęcherzy w macicy
- Jeśli spełnione są kryteria przetrwałej kosmkowej ciążowej choroby trofoblastycznej:
- obserwacja ginekologiczna i badanie palpacyjne
- TK klatki piersiowej i jamy brzusznej
- Ultrasonografia pochwy
- RM czaszki
- Rozpoznanie potwierdza badanie histologiczne wyskrobin.
Wskazania do skierowania do specjalisty
- Opieka perinatalna u ginekologa
- Szybkie skierowanie do ginekologa w przypadku podejrzenia Choroby trofoblastyczne
- Leczenie chorób trofoblastycznych w specjalistycznym ośrodku
Leczenia
Cele terapii
- Usunięcie wszystkich części trofoblastów z macicy
- Zapobieganie rozwojowi złośliwej postaci zaśniadu
- Zapobieganie przerzutom
- Wyleczenie nawet w przypadku zaawansowanej postaci z przerzutami
Ogólne informacje o leczeniu
- Częściowe i całkowite zaśniady leczy się chirurgicznie poprzez usunięcie tkanki trofoblastycznej za pomocą łyżeczkowania.
- W przypadku przetrwałych chorób trofoblastycznych/postaci złośliwych
- wskazana chemoterapia
- wyjątek: ponowne wyłyżeczkowanie przy niskim ryzyku według skali FIGO (0–6) w celu uniknięcia chemoterapii2
- U kobiet Rh-ujemnych podawanie anty-D jest obowiązkowe w przypadku częściowych zaśniadów!
Leczenie chirurgiczne
- Oczyszczanie jamy macicy pod kontrolą USG za pomocą łyżeczkowania z aspiracją
- usunięcie całego materiału trofoblastycznego
- Należy wykonywać je ze szczególną ostrożnością, jeśli istnieje wysokie ryzyko perforacji z powodu rozluźnienia macicy.
- U kobiet Rh-ujemnych podawanie anty-D jest obowiązkowe w przypadku częściowych zaśniadów!
- histerektomia
- w przypadku opornego na leczenie krwawienia zagrażającego życiu lub zakończonego etapu planowania rodziny
- Nie jest wystarczającą metodą, jeśli jest jedyną terapią złośliwych guzów trofoblastycznych.
- wskazana w rzadkich przypadkach
- w przypadku opornego na leczenie krwawienia zagrażającego życiu lub zakończonego etapu planowania rodziny
Leczenie farmakologiczne
- chemoterapii
- W celu określenia wskazań do chemoterapii należy stosować skalę ryzyka FIGO.
- wskazania
- przetrwała choroba trofoblastyczna z następującymi kryteriami (FIGO):
- co najmniej cztery kolejne wartości hCG z efektem plateau (zdefiniowanym jako <10% zmiany w stosunku do poprzedniej wartości) przez co najmniej 3 tygodnie>
- wzrost stężenia hCG o co najmniej 10% w porównaniu z poprzednią wartością w 2 kolejnych pomiarach (dzień 0 i 7) lub ciągły wzrost o co najmniej 20% w 3 kolejnych pomiarach w ciągu co najmniej 2 tygodni (np. dzień 0, 7, 14) lub
- utrzymujące się stężenie hCG przez 6 miesięcy po usunięciu zaśniadu
- postać złośliwa potwierdzona histologicznie
- przerzutów odległych
- przetrwała choroba trofoblastyczna z następującymi kryteriami (FIGO):
- wyjątek: możliwość ponownego łyżeczkowania w celu uniknięcia chemoterapii
- Zgodnie z wytycznymi
- Różne zalecenia dotyczące terapii w zależności od profilu ryzyka
- Stratyfikacja ryzyka na wysokie i niskie opiera się na skali FIGO do oceny czynników prognostycznych przy użyciu następujących kryteriów:
- wieku
- poprzednia ciąża: zaśniad, poronienie, ciąża donoszona
- odstęp w miesiącach między poprzednią ciążą a rozpoczęciem chemoterapii
- stężenie beta-hCG w surowicy przed rozpoczęciem leczenia
- największa średnica guza w centymetrach
- umiejscowienie przerzutów
- liczba przerzutów
- poprzednia chemoterapia
W przypadkach niskiego ryzyka (wynik FIGO <7)>
- Metotreksat 50 mg domięśniowo w dniach 1, 3, 5, 7 i kwas foliowy 15 mg doustnie w dniach 2, 4, 6, 8
- W przypadku wystąpienia oporności na metotreksat należy zastosować leczenie aktynomycyną D (1,25 mg/m2 powierzchni ciała co 2 tygodnie) lub polichemoterapię zgodnie ze schematem EMA-CO.
W przypadkach wysokiego ryzyka (wynik FIGO ≥7)
- Chemoterapia zgodnie ze schematem EMA-CO
- Przy wyniku FIGO >12, w razie potrzeby leczenie indukcyjne etopozydem i cisplatyną
- Daktynomycyna (aktynomycyna D)
- wyższe wskaźniki remisji pierwotnej, ale poważniejsze reakcje niepożądane8
- tylko w przypadku oporności na metotreksat
terapii radiacyjnej
- Wskazania do terapii radiacyjnej tylko w przypadku przerzutów
- W przypadku przerzutów do mózgu, niezwłocznie po rozpoznaniu, aby zapobiec krwotokom wewnątrzczaszkowym.
- Przy przerzutach do wątroby w przypadku chemiooporności
- W przypadku przerzutów do mózgu, podejście multimodalne z chemoterapią, terapią radiacyjną całego mózgu i miejscową resekcją
opiece po zakończeniu leczenia
- Badanie ginekologiczne po upływie 1 i 4 tygodni
- Regularne pomiary beta-hCG w surowicy
- po częściowym zaśniadzie: cotygodniowe monitorowanie stężenia beta-hCG do uzyskania wyniku ujemnego (2 kolejne ujemne pomiary)
- Po całkowitym zaśniadzie: cotygodniowa kontrola stężenia beta-hCG w surowicy, a jeśli wynik jest ujemny co najmniej dwukrotnie, comiesięczna kontrola beta-hCG przez kolejne 6 miesięcy.
- Po chemoterapii przy postaciach inwazyjnych: również cotygodniowa kontrola stężenia beta-hCG w surowicy, a po uzyskaniu 3 ujemnych wyników comiesięczna kontrola stężenia beta-hCG przez 1 rok
- Bezpieczna antykoncepcja w postaci doustnych środków antykoncepcyjnych jest zalecana w przypadku zaśniadu przez okres co najmniej 12 miesięcy, po którym możliwe jest ponowne zajście w ciążę.
- brak możliwości założenia wkładki wewnątrzmacicznej ze względu na ryzyko perforacji
- Ryzyko nawrotu zaśniadu w późniejszych ciążach: w przybliżeniu 0,7–2,6%; w związku z tym wysokie prawdopodobieństwo prawidłowej kolejnej ciąży
- W przypadku późniejszej ciąży należy przeprowadzić następujące badania dodatkowe:
- regularne pomiary stężenia beta-hCG
- przezpochwowe badanie ultrasonograficzne na wczesnym etapie ciąży
- Po porodzie łożysko powinno zostać dokładnie zbadane i wysłane do badania histologicznego.
- Jeśli ciąża wystąpi w ciągu 12 miesięcy od rozpoznania choroby trofoblastycznej, zaleca się przerwanie ciąży
.
Przebieg, powikłania i rokowanie
przebieg
- Utrzymujące się krwawienie po odpowiednim oczyszczeniu macicy: oznaki zmian złośliwych
- W przypadku łagodnych zaśniadów stężenie beta-hCG szybko spada do normy.
- W przypadku utrzymującej się, złośliwej choroby, stężenie beta-hCG nie normalizuje się całkowicie lub wartości stopniowo ponownie wzrastają.
- wskazanie do leczenia farmakologicznego
powikłania
- niedokrwistość
- Zespół rozsianego wykrzepiania wewnątrznaczyniowego (disseminated intravascular coagulation — DIC)
- Obfite, niekontrolowane krwawienie z pochwy
- zazwyczaj wymagana histerektomia
- Ostry brzuch przy perforacji macicy
Rokowania
- Rokowanie w przypadku zaśniadu
- >80% wyleczenia po usunięciu ciąży z zaśniadem groniastym
- W 8–15% przypadków występuje przetrwały lub inwazyjny zaśniad.
- Ryzyko złośliwego zwyrodnienia przy zaśniadzie częściowym wynosi 1–3%.
- W 5% przypadków następuje rozwój raka kosmówki.
- W przypadku złośliwych zmian trofoblastycznych rokowanie również jest dobre, nawet w sytuacji z przerzutami.
- prawie 100% przeżywalności u pacjentek niskiego ryzyka (wynik w skali FIGO <7)>
- 86% przeżywalności u pacjentek wysokiego ryzyka (wynik w skali FIGO >7)
- nawet 75% przeżywalności przy przerzutach do mózgu8
- Guzy łożyska: wskaźnik 5-letniego przeżycia wynosi 57%.
- W przypadku kolejnej ciąży po wystąpieniu choroby trofoblastycznej i ujemnym wyniku hCG nie ma niekorzystnych rokowań dla matki lub nienarodzonego dziecka.
informacje dla pacjentów
O czym należy poinformować pacjentki?
- Zaśniady są spowodowane błędami w dystrybucji chromosomów podczas zapłodnienia.
- Pacjentka wymaga obserwacji i kontroli przez okres 1 roku po zabiegu.
- W większości przypadków jest później możliwa ciąża prawidłowa.
- W przypadku postaci inwazyjnych należy zaoferować wsparcie psychospołeczne i psychoonkologiczne.
- Informacje i porady dotyczące możliwości medycznej rehabilitacji onkologicznej
Informacje dla pacjentów w Deximed
Ilustracje
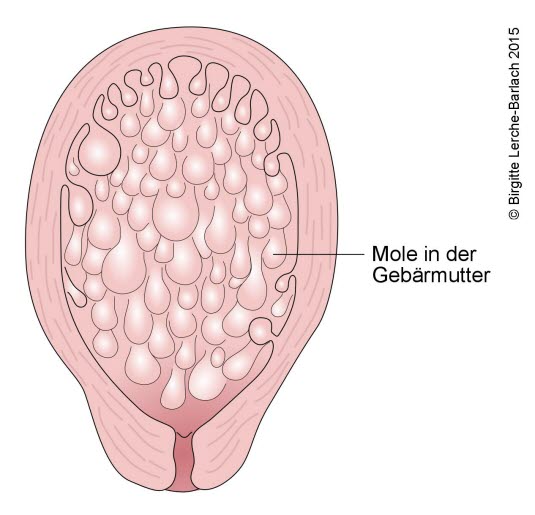
Zaśniad groniasty
Quellen
Literatur
- Kurman RJ, Carcangiu ML, Herrington CS, Young RHWHO Classification of Tumours of Female Reproductive Organs. IARC Lyon 2014, pp. 158-67 publications.iarc.fr
- Brown J, Naumann JR, Seckl MJ, Schink J. 15 years of progress in gestational trophoblastic disease: Scoring, standardization, and salvage. Gynecologic Oncology 2017; 144 200–207. pubmed.ncbi.nlm.nih.gov
- Ning F, Hou H, Morse AN, Lash GE. Understanding and management of gestational trophoblastic disease. F1000Res 2019; 10;8:F1000. pubmed.ncbi.nlm.nih.gov
- Yuk J et al. Incidence of gestational trophoblastic disease in South Korea: a longitudinal, population-based study. Peer J 2019; 20(7): 6490. pubmed.ncbi.nlm.nih.gov
- Gadducci A, Lanfredini N, Cosio S. Reproductive outcomes after hydatiform mole and gestational trophoblastic neoplasia. Gynecol Endocrinol 2015;31(9):673-8. pubmed.ncbi.nlm.nih.gov
- Gockley AA, Melamed A, Joseph NT, Clapp M, Sun SY, Goldstein DP, Horowitz NS, Berkowitz RS. The effect of adolescence and advanced maternal age on the incidence of complete and partial molar pregnancy. Gynecol Oncol 2016;140(3):470-3. pubmed.ncbi.nlm.nih.gov
- Fowler DJ, Lindsay I, Seckl MJ, et al. Routine pre-evacuation ultrasound diagnosis of hydatidiform mole: experience of >1000 cases from a regional referral centre. Ultrasound Obstet Gynecol 2006; 27: 56-60. PubMed
- Soper JT. Gestational Trophoblastic Disease: Current Evaluation and Management. Obstet Gynecol 2021; 137(2):355-370. pubmed.ncbi.nlm.nih.gov
Autorka
- Franziska Jorda, dr n. med., specjalista chirurgii trzewnej, lekarz podstawowej opieki zdrowotnej, Kaufbeuren