Streszczenie
- Definicja: Wady rozwojowe serca lub dużych naczyń wynikające z nieprawidłowego rozwoju w okresie embrionalnym.
- Częstość występowania: Około 1% wszystkich noworodków rodzi się z wrodzoną wadą serca. Ciężka, często sinicza wada serca występuje w 0,12% przypadków.
- Objawy: W przypadku ciężkich wad serca wkrótce po urodzeniu pojawiają się objawy niewydolności serca z tachypnoe, poceniem się, osłabionym ssaniem i ew. sinicą. W zależności od rodzaju i ciężkości wady serca, objawy mogą pojawić się dopiero w późniejszym okresie rozwoju dziecka lub w wieku dorosłym.
- Badanie fizykalne: W zależności od konkretnej wady możliwe są różne szmery serca, hipoksemia, tachykardia, unoszące uderzenie koniuszkowe, hepatosplenomegalia, osłabione tętno na tętnicy udowej.
- Diagnostyka: Pulsoksymetria jako część poporodowych badań przesiewowych, ostateczna diagnoza na podstawie echokardiografii.
- Leczenie: Chirurgiczna lub cewnikowa interwencyjna korekcja.
Informacje ogólne
Definicja
- Wrodzone wady serca to szereg wad rozwojowych serca lub wielkich naczyń, które wynikają z nieprawidłowego rozwoju w okresie embrionalnym.
- Strukturalnie, wrodzone wady serca są już obecne przy urodzeniu; klinicznie, w zależności od rodzaju i ciężkości wady serca, mogą ujawnić się tuż po urodzeniu lub dopiero później.
Klasyfikacja siniczych i niesiniczych wad serca
- Z klinicznego i diagnostycznego punktu widzenia wrodzone wady rozwojowe można podzielić na sinicze i niesinicze wady serca.
Sinicze wady serca
- Tetralogia Fallota (ToF).
- Przełożenie wielkich pni tętniczych (TGA).
- Serce jednokomorowe.
- Atrezja zastawki trójdzielnej.
- Atrezja płucna.
Niesinicze wady serca (z przeciekiem lewo-prawym)
- Ubytek przegrody międzykomorowej (VSD).
- Ubytek przegrody międzyprzedsionkowej (ASD).
- Przetrwały przewód tętniczy (PDA).
- Przetrwały pień tętniczy.
Niesinicze wady serca (bez przecieku)
- Zwężenie zastawki aortalnej (stenoza aortalna).
- Koarktacja aorty.
- Zwężenie zastawki płucnej.
Wada serca bez sinicy lub z sinicą, rozwój sinicy w przebiegu choroby
- Niektóre wrodzone wady serca mogą występować głównie z sinicą lub bez niej, w zależności od indywidualnych cech, np. ubytek przegrody przedsionkowo-komorowej (AVSD).
- W dalszym przebiegu sinica może również wystąpić w pierwotnych niesiniczych wadach serca z przeciekiem lewo-prawym, jeśli przeciek zostanie odwrócony w ramach wzrostu ciśnienia płucnego (reakcja Eisenmengera).
Klasyfikacja na podstawie złożoności anatomicznej wady1
- UWAGA: Pierwotna klasyfikacja wady może ulec zmianie, jeśli w jej przebiegu pojawią sie poważne powikłania.
Łagodne
- Izolowany, mały ASD, PDA lub VSD.
- VSD, PDA oraz ASD typu:
- ostium secundum
- zatoki żylnej
- po korekcji oraz bez powikłań.
- Izolowana wrodzona wada aortalna i dwupłatkowa zastawka aortalna.
- Łagodna izolowana stenoza płucna.
- Izolowana wrodzona wada mitralna.
Umiarkowane
- Koarktacja aorty.
- Przełożenie wielkich naczyń po korekcji anatomicznej.
- Tętniak zatoki Valsalvy.
- VSD, PDA umiarkowane lub duże oraz ASD typu ostium secundum bez korekcji.
- Nieprawidłowy spływ żył płucnych.
- Tetralogia Fallota po korekcji.
- Stenoza płucna umiarkowana lub ciężka.
- Zespół Ebsteina.
- Zespół Marfana.
- Zespół Turnera.
Ciężkie
- Serce jednokomorowe.
- Współny pień tętniczy.
- Atrezja płucna.
- Każda wada sinicza (operowana lub nieoperowana)
- Dwuujściowa prawa komora.
- Przerwanie ciągłości łuku aorty.
- Każda wada powikłana chorobą naczyń płucnych.
Częstość występowania
- Około 1% wszystkich noworodków rodzi się z wrodzoną wadą serca.2
- 80% wszystkich wad serca to izolowane wady rozwojowe.
- U ok. 0,12% noworodków występuje ciężka wada serca.
- Wady serca, które nie dają szansy na długotrwałe przeżycie, klinicznie objawiające się głównie sinicą.
- Obecnie ponad 90% pacjentów osiąga dorosłość.1
Częstość występowania różnych wrodzonych wad serca
- Ubytek przegrody międzykomorowej (VSD): 31%
- Ubytek przegrody międzyprzedsionkowej (ASD): 7%
- Przetrwały przewód tętniczy (PDA): 7%
- Zwężenie zastawki płucnej: 7%
- Zwężenie cieśni aorty (koarktacja): 5–8%
- Zwężenie zastawki aortalnej (stenoza aortalna): 3–6%
- Tetralogia Fallota (ToF): 5,5%
- Ubytek przegrody przedsionkowo-komorowej (AVSD): 4,8%
- Przełożenie wielkich pni tętniczych (TGA): 4,5%
- Zespół niedorozwoju lewego serca (HLHS): 3,8%
- Atrezja płucna z ubytkiem przegrody międzykomorowej: 2,5–3,4%
- Atrezja płucna bez ubytku przegrody międzykomorowej: 2,4%
- Atrezja zastawki trójdzielnej: 1–2%
- Dwunapływowa komora: 1,5%
- Dwuujściowa komora: 1,2%
- Wrodzone skorygowane przełożenie dużych naczyń: 1%
- Wspólny pień tętniczy: 0,5–1,0%
- kardiomiopatia przerostowa zawężająca: 0,4%
- Nadzastawkowe zwężenie aorty (zespół Williamsa): 0,4%
Etiologia i patogeneza
- W przypadku większości wad serca zakłada się wieloczynnikową etiologię.
- interakcja między predyspozycjami genetycznymi a czynnikami środowiskowymi
- Przypuszcza się, że wady genetyczne są związane z większością wad serca, ale znanych jest tylko kilka mutacji je wywołujących.
- Znane przyczyny genetyczne dotyczą mniej niż 20% wad serca.3
- Ryzyko dla rodzeństwa osób chorych jest około 3 razy wyższe niż ryzyko ogólne dla populacji wynoszące 1%, ale generalnie jest nadal niskie.4
- Niektóre zespoły chromosomalne charakteryzują się wysoką częstością występowania wad serca:
- trisomia 21 z wadami serca u ok. 50%, z czego około połowa to AVSD
- zespół Turnera z koarktacją aorty u ok. 30% chorych.
- Większość syndromicznych wad serca jest spowodowana mutacjami de novo, tj. rodzice nie są nosicielami zmiany patologicznej.4
- Bezobjawowe wady serca są prawdopodobnie częściej dziedziczne niż wcześniej sądzono.4
- Rzadkie mutacje genetyczne są dziedziczone po rodzicach, którzy sami nie są chorzy.4
Czynniki predysponujące
- Zaburzenia metaboliczne
- Czynniki żywieniowe
- Leki
- izotretynoina, leki przeciwpadaczkowe, lit, antagonisty kwasu foliowego, indometacyna itp.9
- Zakażenia
- różyczka i inne.
- Promieniowanie jonizujące.10
- Zaburzenia krzepnięcia u matki.11
ICD-10
- Q20 Wrodzone wady rozwojowe jam i połączeń sercowych.
- Q20.0 Wspólny pień tętniczy.
- Q20.1 Odejście obu dużych naczyń z prawej komory.
- Q20.2 Odejście obu dużych naczyń z lewej komory.
- Q20.3 Nieprawidłowe połączenia komorowo-tętnicze.
- Q20.4 Wejście obu dróg żylnych do jedynej komory.
- Q20.5 Nieprawidłowe połączenia przedsionkowo-komorowe.
- Q20.6 Izomeria uszek przedsionków serca.
- Q20.8 Inne wrodzone wady rozwojowe jam i połączeń sercowych.
- Q20.9 Wrodzona wada rozwojowa jam i połączeń sercowych, nieokreślona.
- Q21 Wrodzone wady rozwojowe przegród serca.
- Q21.0 Ubytek przegrody międzykomorowej.
- Q21.1 Ubytek przegrody międzyprzedsionkowej.
- Q21.2 Ubytek przegrody przedsionkowo-komorowej.
- Q21.3 Tetralogia Fallota.
- Q21.4 Ubytek przegrody aortalno-płucnej.
- Q21.8 Inna wrodzona wada rozwojowa przegród serca.
- Q21.9 Wrodzona wada przegrody serca, nieokreślona.
- Q22 Wrodzone wady rozwojowe zastawki pnia płucnego i zastawki trójdzielnej.
- Q22.0 Zarośnięcie zastawki pnia płucnego.
- Q22.1 Wrodzone zwężenie zastawki pnia płucnego.
- Q22.2 Wrodzona niedomykalność zastawki pnia płucnego.
- Q22.3 Inne wrodzone wady rozwojowe zastawki pnia płucnego.
- Q22.4 Wrodzone zwężenie zastawki trójdzielnej.
- Q22.5 Anomalia Ebsteina.
- Q22.6 Zespół niedorozwoju prawej części serca.
- Q22.8 Inne wrodzone wady rozwojowe zastawki trójdzielnej.
- Q22.9 Wrodzona wada rozwojowa zastawki trójdzielnej, nieokreślona.
- Q23 Wrodzone wady rozwojowe zastawki aortalnej i zastawki mitralnej.
- Q23.0 Wrodzone zwężenie zastawki aortalnej.
- Q23.1 Wrodzona niedomykalność zastawki aortalnej.
- Q23.2 Wrodzone zwężenie zastawki mitralnej.
- Q23.3 Wrodzona niedomykalność zastawki mitralnej.
- Q23.4 Zespół niedorozwoju lewej części serca.
- Q23.8 Inne wrodzone wady rozwojowe zastawki aortalnej i zastawki mitralnej.
- Q23.9 Wrodzona wada zastawki aortalnej i zastawki mitralnej, nieokreślona.
- Q24 Inne wrodzone wady rozwojowe serca.
- Q24.0 Prawostronne położenie serca.
- Q24.1 Lewostronne położenie serca.
- Q24.2 Serce trójprzedsionkowe.
- Q24.3 Wrodzone zwężenie stożka tętniczego prawej komory.
- Q24.4 Wrodzone zwężenie podzastawkowe drogi odpływu z lewej komory.
- Q24.5 Wada rozwojowa naczyń wieńcowych.
- Q24.6 Wrodzony blok serca.
- Q24.8 Inne określone wrodzone wady rozwojowe serca.
- Q24.9 Wrodzona wada rozwojowa serca, nieokreślona.
- Q25 Wrodzone wady rozwojowe dużych tętnic.
- Q25.0 Drożny przewód tętniczy.
- Q25.1 Zwężenie cieśni aorty.
- Q25.2 Zarośnięcie aorty.
- Q25.3 Zwężenie aorty.
- Q25.4 Inne wrodzone wady rozwojowe aorty.
- Q25.5 Zarośnięcie pnia płucnego.
- Q25.6 Zwężenie pnia płucnego.
- Q25.7 Inne wrodzone wady rozwojowe pnia płucnego.
- Q25.8 Inne wrodzone wady rozwojowe dużych tętnic.
- Q25.9 Wrodzona wada rozwojowa dużych tętnic, nieokreślona.
Diagnostyka
Kryteria diagnostyczne
- Ukłąd krążenia
- Niektóre wady serca prowadzą do szybkiego pogorszenia hemodynamiki z objawami wstrząsu po urodzeniu – szczególnie po zamknięciu przewodu tętniczego.
- Sinica
- U noworodków często rozpoznawalna dopiero przy saturacji O2 ≤80%.
- Jeśli sinica nie jest jeszcze widoczna, prosta pulsoksymetria w ciągu pierwszych 24-48 godzin po urodzeniu może poprawić wykrywanie wrodzonych wad serca z dobrą czułością i swoistością.12
- Szmery w sercu (patrz też artykuł Szmery w sercu u dzieci)
- Wysoki odsetek szmerów serca u noworodków jest spowodowany wrodzonymi wadami serca i wymaga szybkiej diagnostyki.
- Echokardiografia
- W zdecydowanej większości przypadków ostateczne rozpoznanie stawia się za pomocą echokardiografii: wizualizacja wady i rejestracja skutków czynnościowych.
Diagnostyka różnicowa
- Inne przyczyny wstrząsu.
- Sinica niekardiologiczna
- zespół niewydolności oddechowej
- aspiracja smółki
- refluks żołądkowo-przełykowy
- napady drgawek
- i inne.
- Fizjologiczne szmery w sercu (patrz również artykuł Szmery w sercu u dzieci).
Wywiad lekarski
- Ew. wywiad rodzinny w kierunku wrodzonych wad serca.
- Ew. wywiad rodzinny w kierunku monogenetycznych chorób dziedzicznych.
- Narażenie na czynniki teratogenne w czasie ciąży (cukrzyca, alkohol, leki, infekcje, promieniowanie jonizujące).
Badanie przedmiotowe
- W zależności od rodzaju i ciężkości wady serca.
- Ew. objawy niewydolności serca
- tachypnoe, tachykardia, zwiększona potliwość, hepatosplenomegalia.
- Ew. sinica.
- Ew. hiperdynamiczne uderzenie koniuszkowe podczas obciążenia objętościowego.
- Ew. osłabienie tętna na tętnicy udowej.
- Ew. szmery w sercu
- noworodki: obecność wady serca w ok. 1/3 przypadków (mniej niż 10% wymagających interwencji)
- dzieci i młodzież: patologiczne wyniki w mniej niż 10% „nowych” szmerów w sercu.
Badanie uzupełniające w praktyce lekarza rodzinnego
- EKG.
Diagnostyka u specjalisty
Echokardiografia (ECHO)
- Echokardiografia jest najważniejszą procedurą diagnostyczną.
- Obrazowanie struktury i wielkości wad(y).
- Wymiary jam serca.
- Czynność komór.
- Morfologia i funkcja zastawek serca.
- Wizualizacja i kwantyfikacja przetok.
- Odpływ i zmiany strukturalne dużych naczyń.
- Oszacowanie tętniczego ciśnienia płucnego.
Pulsoksymetria
- W ramach podstawowej diagnostyki przy podejrzeniu wady serca.
EKG
- Często niespecyficzne zmiany.
- W indywidualnych przypadkach (np. lewogram patologiczny w AVSD) oznaka określonej wady serca.
RTG klatki piersiowej
- Ogólnie badanie to nie jest konieczne w ramach podstawowej diagnostyki.
- U dorosłych w celu wykrycia/ rozpoznania przez wykluczenie w przypadku duszności.13
RM/ TK
- Uzupełniająco, zwłaszcza w przypadku nieodpowiednich warunków akustycznych echokardiografii.
- Rezonans magnetyczny serca może być stosowany zarówno u dzieci, jak i dorosłych z wrodzonymi wadami serca.
- U dorosłych choroby współistniejące, takie jak wtórne kardiomiopatie stają się bardziej widoczne wraz z wiekiem.
Cewnikowanie serca (koronarografia)
- Obecnie nie wykonywane w ramach podstawowej diagnostyki.
- Planowanie i wykonywanie zabiegów.
Wskazania dla skierowania do specjalisty
- Skierowanie do kardiologa dziecięcego jest wskazane w następujących przypadkach:14-15
- noworodki z szmerami w sercu
- podejrzenie szmeru patologicznego na podstawie osłuchiwania
- szmery holosystoliczne
- szmery późnoskurczowe
- głośność ≥3/6
- szmery ciągłe
- szmery z wyczuwalnym mrukiem
- szmery z jednoczesnymi objawami kardiologicznymi (ból w klatce piersiowej, palpitacje, omdlenie)
- osłabione tętno na kończynach dolnych
- patologiczny zapis EKG
- oznaki kliniczne chorób, które często wiążą się z wadami serca
- nagły zgon sercowy w wywiadzie rodzinnym
- zaburzenia rozwoju, obniżona sprawność w porównaniu z rówieśnikami
- silny niepokój rodziców pomimo uzyskanych wyjaśnień.
- Wiek dziecka jest ważnym aspektem przy podejmowaniu decyzji.
- Natychmistowa diagnostyka jest uzasadniona u noworodków ze szmerami w sercu
- wystepownie wad serca w 1/3 przypadków.
- W pierwszym roku życia, jeśli występuje podejrzany szmer, zwłaszcza w połączeniu z rozwijającymi się w międzyczasie objawami klinicznymi (sinica, zaburzenia rozwoju, niewydolność serca), konieczne jest wyjaśnienie.
- Do końca 1. roku życia wykrywa się przede wszystkim strukturalne choroby serca.
- W 2. i 3. roku życia szmery w sercu rzadko są powodem skierowania do specjalisty (przede wszystkim z powodu zwężenia cieśni aorty i ubytku przegrody międzyprzedsionkowej).
- U dzieci w wieku szkolnym rzadko wykrywane są ujawniające się wrodzone wady serca; przede wszystkim stwierdza się szmery w sercu spowodowane nabytym zapaleniem mięśnia sercowego i kardiomiopatiami (np. przerostową, rozstrzeniową).
- Natychmistowa diagnostyka jest uzasadniona u noworodków ze szmerami w sercu
- Rozróżnienie między patologicznymi a niepatologicznymi szmerami serca jest często możliwe już w praktyce lekarza rodzinnego.
- Pacjenci bezobjawowi z niskim prawdopodobieństwem strukturalnej choroby serca, po dokładnym badaniu przedmiotowym mogą pozostawać pod opieką lekarza rodzinnego.
Leczenie
Cele leczenia
- Przeżycie dziecka po urodzeniu w przypadku krytycznej hemodynamicznie wady serca.
- W przypadku wad serca o ograniczonym rokowaniu korekcja wady serca i normalizacja rokowania w miarę możliwości oraz osiągnięcie najlepszej możliwej jakości życia.
Opcje leczenia
Leczenie farmakologiczne
- Możliwość poporodowego podawania prostglandyny E w celu utrzymania drożności przewodu tętniczego w wadach serca zależnych od przewodu tętniczego.
- Leczenie paliatywne niewydolności serca, nadciśnienia płucnego.
Leczenie chirurgiczne i interwencyjne
- W niektórych przypadkach ostateczna korekcja wady serca jest możliwa za pomocą pojedynczego zabiegu chirurgicznego; w innych przypadkach konieczne jest również zastosowanie etapowych operacji w trakcie rozwoju dziecka.
- W przypadku niektórych wad serca dostępne dostępną opcję stanowią obecnie zabiegi interwencyjne z użyciem cewnika lub zabiegi hybrydowe polegające na połączeniu operacji i interwencji cewnikowej.
- Więcej szczegółowych informacji można znaleźć w odpowiednich artykułach dotyczących poszczególnych wad serca:
- Ubytek przegrody międzykomorowej (VSD).
- Ubytek przegrody międzyprzedsionkowej (ASD).
- Przetrwały przewód tętniczy (PDA).
- Koarktacja aorty.
- Zwężenie zastawki aortalnej (stenoza aortalna).
- Tetralogia Fallota (ToF).
- Przełożenie wielkich pni tętniczych (TGA).
- Zespół niedorozwoju lewego serca (HLHS).
- Atrezja płucna.
- Serce jednokomorowe.
- Wspólny pień tętniczy.
Dorośli z wrodzonymi wadami serca (ACHD)
Chorobowość i znaczenie dla praktyki lekarza rodzinnego
- Dzięki udoskonaleniu terapii i opieki pooperacyjnej rośnie liczba pacjentów z wrodzonymi wadami serca w wieku dorosłym (adult congenital heart disease – ACHD).16
- grupa pacjentów z niekiedy nowymi, nieoczekiwanymi problemami
- Lekarze rodzinni i interniści odgrywają kluczową rolę w opiece nad dorosłymi pacjentami z wrodzonymi wadami serca
- wyznaczanie kierunków prawidłowej, terminowej diagnostyki i leczenia
- przypominanie pacjentom o niezbędnych wizytach kontrolnych
- kierowanie do odpowiednich ośrodków kontaktowych.
- Specjaliści/ośrodki ACHD mają za zadanie
- zintensyfikowanie współpracy z osobami kierującymi
- przekazanie wiedzy niezbędnej do leczenia ACHD.
- Podczas gdy u większości pacjentów wada serca i jej leczenie są znane już w dzieciństwie i okresie dojrzewania, niektóre wady serca ujawniają się klinicznie i są diagnozowane po raz pierwszy dopiero w wieku dorosłym, np.:
- ubytek przegrody międzyprzedsionkowej: objawia się klinicznie nadciśnieniem płucnym, niewydolnością (prawokomorową)
- koarktacja aorty: objawia się klinicznie wtórnym nadciśnieniem tętniczym/nadciśnieniowym uszkodzeniem narządów wewnętrznych.
- W niektórych przypadkach przejście od podstawowej opieki medycznej do specjalistycznej opieki ACHD odbywa się zbyt późno.
Typowe problemy medyczne u pacjentów z ACHD
- Arytmie serca
- U znacznego odsetka pacjentów arytmia występuje jako część samej wady serca lub w wyniku zabiegów interwencyjnych/operacji.17
- Częstość występowania arytmii, zwłaszcza arytmii przedsionkowych, stale wzrasta wraz z wiekiem pacjentów z ACHD.
- Zasadniczo może występować całe spektrum arytmii.
- Rozwój niewydolności serca
- Zapalenie wsierdzia
- W przypadku podejrzenia (gorączka, nocne poty, zator) ważna jest wczesna diagnostyka (posiew krwi, echokardiografia).
- Profilaktyka zapalenia wsierdzia zalecana u pacjentów wysokiego ryzyka:16
- wady sinicze
- wady resztkowe w sąsiedztwie obcego materiału (łata, konduit)
- zastawka protetyczna
- 6 miesięcy po operacji/interwencji z użyciem obcego materiału
- stan po zapaleniu wsierdzia.
Dalsze postępowanie w praktyce lekarza rodzinnego
- Wywiad medyczny pod kątem zmian objawów i wydolności fizycznej.
- Badanie przedmiotowe:
- objawy niewydolności serca
- zmiany ciśnienia tętniczego
- zmiany osłuchowe (patrz również artykuł Szmery w sercu u dorosłych).
- EKG (patrz także artykuł Lista kontrolna EKG).
- W przypadku podejrzenia arytmii konieczne może być również wykonanie EKG metodą Holtera.
- Próby wysiłkowe, a raczej spiroergometria przeprowadzana przez specjalistów ACHD.
Aktywność fizyczna i sport
- Indywidualne zalecenia dotyczące aktywności fizycznej i sportu dla pacjentów z ACHD.
- W przeszłości lekarze sprawujący opiekę nad pacjentami raczej niechętnie zalecali im aktywność fizyczną.1
- Jednak w przeciwieństwie do wcześniejszych obaw dotyczących bezpieczeństwa, nagła śmierć sercowa podczas aktywności sportowej jest niezwykle rzadka.
- Zasadniczo aktywność fizyczna ma korzystny wpływ na:1
- wydolność fizyczną
- dobrostan psychospołeczny
- integrację społeczną
- zapobieganie przyszłym chorobom serca.
- Ćwiczenia dynamiczne są bardziej korzystne niż ćwiczenia statyczne.1
- Zakaz uprawiania sportu wyczynowego w przypadku poważnych zmian (np. nadciśnieniu płucnym, zespole Eisenmengera).
Ciąża a wady serca
- Obecnie więcej kobiet z istotnymi wrodzonymi wadami serca osiąga wiek rozrodczy niz miało to miejsce w przeszłości.
Stratyfikacja ryzyka
- Zasadniczo ciąża może być również rozważana u kobiet z wrodzoną wadą serca, ale decyzja musi opierać się na ocenie przewidywanego ryzyka dla matki i płodu.
- Czynniki ryzyka powikłań matczynych niezależne od konkretnej wady serca (niewydolność serca, objawowa arytmia, udar/przemijający atak niedokrwienny, zgon)
- niewydolność serca >NYHA II przed rozpoczęciem ciąży lub sinica
- frakcja wyrzutowa (EF) komory systemowej <40%
- niedrożność: zwężenie aorty <1,5 cm2 lub maks. gradient >30 mmHg (przed ciążą); zwężenie zastawki mitralnej <2 cm2
- powikłania sercowo-naczyniowe w wywiadzie (zaburzenia rytmu serca, obrzęk płuc, udar mózgu/TIA)
- dysfunkcja prawej komory związana z podzastawkowym zwężeniem/ ciężka niedomykalność zastawki płucnej
- Czynniki ryzyka powikłań pediatrycznych niezależne od konkretnej wady (wewnątrzmaciczne opóźnienie wzrostu, wcześniactwo, krwotok wewnątrzczaszkowy, poronienie, zgon noworodka, urodzenie martwego płodu).
- niewydolność serca >NYHA II przed rozpoczęciem ciąży lub sinica
- frakcja wyrzutowa (EF) komory systemowej <40%
- niedrożność: zwężenie aorty <1,5 cm2 lub maks. gradient >30 mmHg (przed ciążą); zwężenie zastawki mitralnej <2 cm2
- wiek matki <20 lub >35 lat
- palenie tytoniu przez matkę
- leczenie przeciwkrzepliwe u matki.
- Ryzyko zależne od konkretnej wady serca
- niskie ryzyko (powikłania sercowe lub zgon >1‰ i <1%)
- przeciek lewo-prawy bez nadciśnienia płucnego
- skorygowana tetralogia Fallota (bez ciężkiej niewydolności płucnej lub dysfunkcji prawej komory)
- skorygowane zwężenie cieśni aorty bez tętniaka lub restenozy
- stan po biologicznej wymianie zastawki z dobrą funkcją zastawki i prawidłową czynnością serca
- łagodne do umiarkowanego zwężenie zastawki płucnej
- średnie ryzyko (powikłania sercowe lub zgon 1–5%)
- łagodne do umiarkowanego zwężenie zastawki aortalnej lub zwężenie zastawki mitralnej
- sinicza wada serca bez nadciśnienia płucnego
- serce jednokomorowe z dobrą czynnością komór
- mechaniczna zastawka serca
- ciężkie zwężenie zastawki płucnej
- systemowa prawa komora z nieciężką dysfunkcją
- wysokie ryzyko (powikłania sercowe lub zgon >5%)
- ciężkie zwężenie zastawki aortalnej lub mitralnej
- nadciśnienie płucne/zespół Eisenmengera
- serce jednokomorowe ze słabą czynnością komór
- prawa komora serca z ciężką dysfunkcją.
- niskie ryzyko (powikłania sercowe lub zgon >1‰ i <1%)
Antykoncepcja
- Przy wyborze odpowiedniej metody antykoncepcji kobiety z wrodzoną wadą serca potrzebują indywidualnego doradztwa.
- Jednak ponad 40% kobiet z wrodzonymi wadami serca nie otrzymuje odpowiednich informacji na temat ryzyka związanego z ciążą i metod antykoncepcji.18
- 20% kobiet z wadą serca stosuje metody antykoncepcji, które są przeciwwskazane w ich konkretnej sytuacji.18
- Nieodpowiednie metody antykoncepcji są stosowane głównie przez kobiety z ciężkimi wadami serca, siniczymi wadami serca i zespołem Eisenmengera.
- Spośród kobiet o wysokim ryzyku zajścia w ciążę, 28% nie stosuje antykoncepcji pomimo utrzymywania stosunków seksualnych.18
- Zasady dotyczące antykoncepcji i w razie potrzeby przerwania ciąży
- Metody barierowe powinny być zalecane tylko kobietom z niskim ryzykiem sercowym co do których istnieje uzasadnione zaufanie dotyczące odpowiedzialności i pewności przestrzegania zaleceń.
- Środki antykoncepcyjne zawierające estrogen („pigułka złożona”) nie są zalecane w przypadku wad serca ze zwiększonym ryzykiem choroby zakrzepowo-zatorowej (sinicze wady serca, nadciśnienie płucne, słaba czynność komór, arytmie przedsionkowe, krążenie Fontana, protezy zastawek serca).
- Preparaty jednoskładnikowe z progestagenem: podawanie samego dezogestrelu nie jest związane ze zwiększonym ryzykiem choroby zakrzepowo-zatorowej.
- W przypadku tradycyjnych „minipigułek” (preparaty jednoskładnikowe zawierające niskie dawki progestagenu) owulacja jest hamowana tylko w około 45–50% przypadków.
- Implanty progestagenowe (naramienne) są szczególnie odpowiednie dla pacjentek mających problemy z przestrzeganiem zaleceń, podobnie jak powlekana progesteronem wkładka domaciczna, która jest skuteczną i bezpieczną metodą antykoncepcji.
- Preparatów zawierających progestagen w postaci depot („zastrzyk 3-miesięczny”) nie należy traktować jako środka antykoncepcyjnego pierwszego wyboru.
- Wkładki wewnątrzmaciczne z miedzią są opcją, jeśli chce się uniknąć antykoncepcji hormonalnej, ale często wiążą się ze zwiększonym krwawieniem miesiączkowym.
- Sterylizację jajowodów należy rozważyć w przypadku bardzo wysokiego ryzyka ciąży (nadciśnienie płucne, zespół Eisenmengera).
- wskazania medyczne do przerwania ciąży w przypadku średniego lub wysokiego ryzyka
- Łyżeczkowanie ssące w znieczuleniu miejscowym jest metodą z wyboru.
Echokardiografia płodu
- Ze względu na zwiększone ryzyko chorób serca u płodu, w 19–22 tygodniu ciąży zaleca się wykonanie echokardiografii różnicowej płodu.
Interwencje niekardiologiczne
- Okołooperacyjna śmiertelność i zachorowalność są zwiększone u pacjentów z ACHD.
- Decydujące znaczenie dla wyników okołooperacyjnych mają:
- identyfikacja pacjentów wysokiego ryzyka
- zrozumienie indywidualnego stanu patofizjologicznego
- śródoperacyjne zachowanie rzutu serca
- Najważniejszym badaniem służącym do oceny jest echokardiografia.
Przebieg, powikłania i rokowanie
- Przebieg i rokowanie, a także częste powikłania zależą od rodzaju wady serca i indywidualnych cech.
- Więcej szczegółowych informacji można znaleźć w odpowiednich artykułach dotyczących poszczególnych wad serca:
- Ubytek przegrody międzykomorowej (VSD).
- Ubytek przegrody międzyprzedsionkowej (ASD).
- Przetrwały przewód tętniczy (PDA).
- Koarktacja aorty.
- Zwężenie zastawki aortalnej (stenoza aortalna).
- Tetralogia Fallota (ToF).
- Przełożenie wielkich pni tętniczych (TGA).
- Zespół niedorozwoju lewego serca (HLHS).
- Atrezja płucna.
- Serce jednokomorowe.
- Wspólny pień tętniczy.
- Zdecydowana poprawa przeżywalności dzięki postępom w kardiologii dziecięcej i chirurgii serca u dzieci w ciągu ostatnich 50 lat
- Co najmniej 85% chorych noworodków osiąga dorosłość.
- Charakterystyczne dla długoterminowego przebiegu choroby są często:
- resztkowe i wtórne stany wady serca
- niekardiologiczne choroby współistniejące
- Pacjenci z ACHD powinni być również bardziej świadomi korzyści płynących z niefarmakologiczncyh działań profilaktycznych: odpowiedniego stylu życia z wystarczającą ilością sportu/ruchu i zdrową dietą.
Informacje dla pacjentów
Informacje dla pacjentów w Medibas
Ilustracje
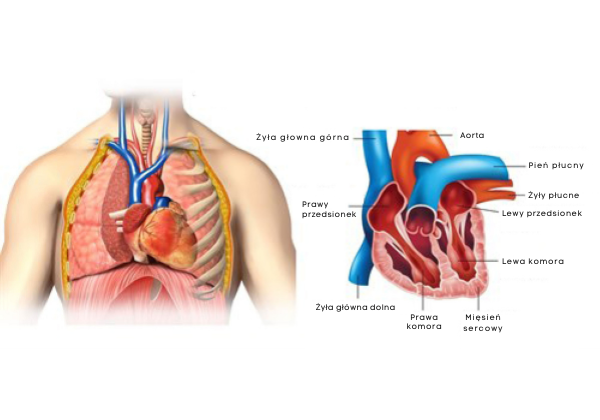
Położenie i anatomia serca
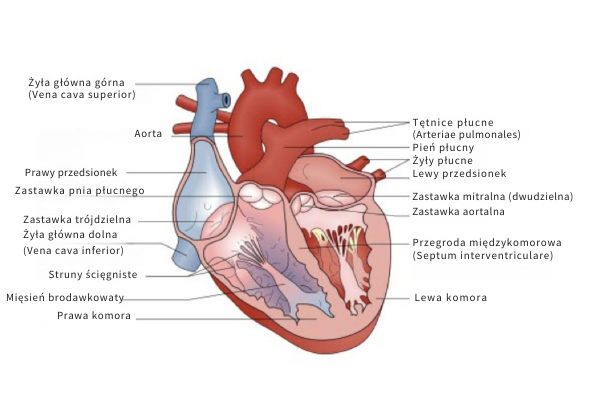 Serce
Serce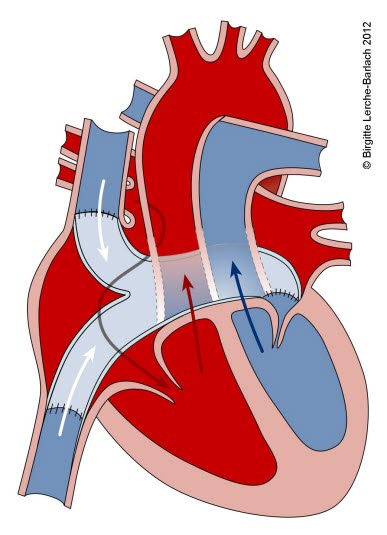
Przełożenie wielkich pni tętniczych
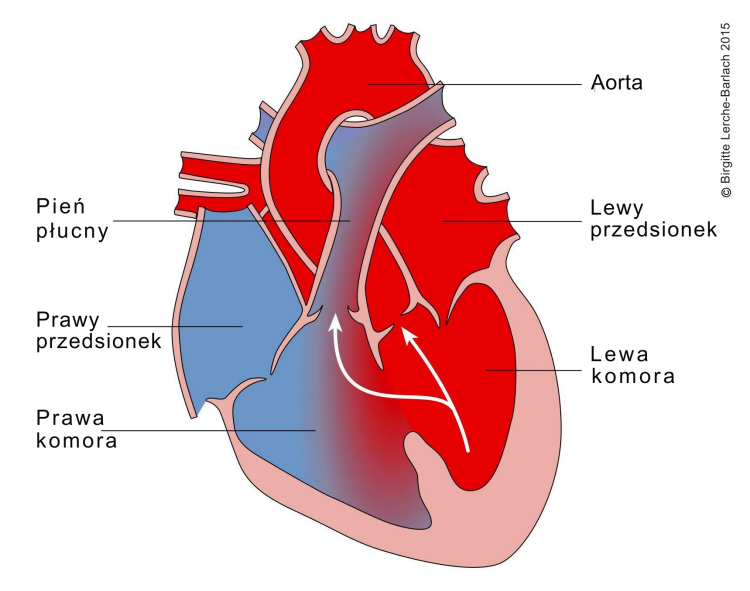
Ubytek przegrody międzykomorowej, VSD
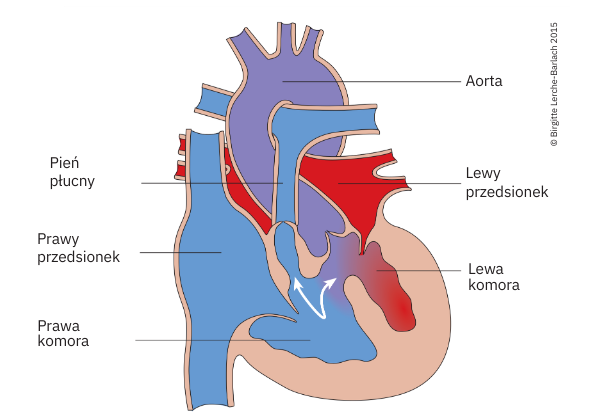 Tetralogia Fallota
Tetralogia Fallota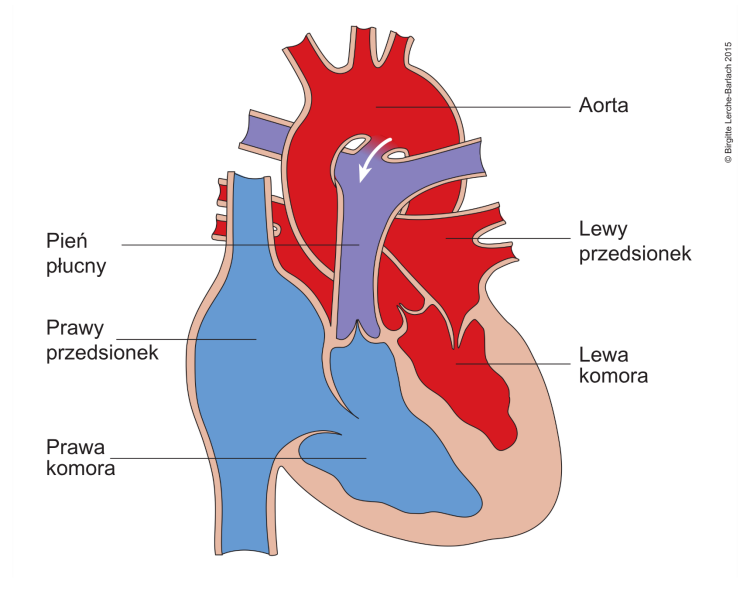
Przetrwały przewód tętniczy
Źródła
Wytyczne
- European Society of Cardiology. Management of adult congenital heart disease, 2020. www.escardio.org
Piśmiennictwo
- European Society of Cardiology. Management of adult congenital heart disease. Stand 2020. www.escardio.org
- Saenz RB, Beebe DK, Triplett LC. Caring for infants with congential heart disease and their families. Am Fam Phys 1999. pubmed.ncbi.nlm.nih.gov
- Gelb B, Chung W. Complex Genetics and the Etiology of Human Congenital Heart Disease. Cold Spring Harb Perspect Med 2014; 4: a013953. www.ncbi.nlm.nih.gov
- Sifrim A, Hitz M, Wilsdon A, et al. Distinct genetic architectures for syndromic and nonsyndromic congenital heart defects identified by exome sequencing. Nat Genet 2016; 48: 1060–1065. doi:10.1038/ng.3627 DOI
- Narchi H, Kulaylat N. Heart disease in infants of diabetic mothers. Images Paediatr Cardiol 2000; 2: 17–23. pmid:22368579 PubMed
- Levy H, Guldberg P, Güttler F, et al. Congenital heart disease in maternal phenylketonuria: report from the Maternal PKU Collaborative Study. Pediatr Res 2001;49:436-442. doi:11328945 www.ncbi.nlm.nih.gov
- Yang J, Qiu H, Qu P, et al. Prenatal Alcohol Exposure and Congenital Heart Defects: A Meta-Analysis. PLoS One 2015; 10: e0130681. doi:10.1371/journal.pone.0130681 DOI
- Ionescu-Ittu R, Marelli AJ, Mackie AS, Pilote L. Prevalence of severe congenital heart disease after folic acid fortification of grain products: time trend analysis in Quebec, Canada. BMJ 2009; 338: b1673. BMJ (DOI)
- Lynch T, Abel D. Teratogens and Congenital Heart Disease. J Diagn Med Sonogr 2015;31:310-305. doi:10.1177/8756479315598524 DOI
- Wiesel A, Stolz G, Queisser-Wahrendorf A. Evidence for a teratogenic risk in the offspring of health personnel exposed to ionizing radiation?! Birth Defects Res A Clin Mol Teratol 2016; 106: 475-479. doi:10.1002/bdra.23532 www.ncbi.nlm.nih.gov
- Dolk H, McCullough N, Callaghan S, et al. Risk factors for congenital heart disease: The Baby Hearts Study, a population-based case- control study. PLoS ONE 2020; 15: e0227908. doi:10.1371/journal.pone.0227908 DOI
- De-Wahl Granelli A, Wennergren M, Sandberg K, et al. Impact of puls oximetry screening on the detection of duct dependent congenital heart disease: a Swedish prospective screening study in 39821 newborns. BMJ 2009; 338: a3037. BMJ (DOI)
- Ho VB. Radiologic Evaluation of suspected congenital heart disease in adults. Am Fam Physician 2009; 80: 597-602. American Family Physician
- Punnoose A, Burke A, Golub R. Innocent (Harmless) Heart Murmurs in Children. JAMA 2012; 308: 305. doi:10.1001/jama.2012.6223 DOI
- Giuffre RM, Walker I, Vaillancourt S, et al. Opening Pandoras's box: parental anxiety and the assessment of childhood murmurs. Can J Cardiol 2002; 18: 406-14. www.ncbi.nlm.nih.gov
- Diller GP, Breithardt G, Baumgartner H. Congenital heart defects in adulthood. Dtsch Arztebl Int 2011; 108: 452-459. doi:10.3238/arztebl.2011.0452 DOI
- Hernandez A, Paul T, Abrams D, et al. Arrhythmias in congenital heart disease: a position paper of the European Heart Rhythm Association (EHRA), Association for European Paediatric and Congenital Cardiology (AEPC), and the European Society of Cardiology (ESC) Working Group on Grown-up Congenital Heart Disease, endorsed by HRS, PACES, APHRS, and SOLAECE. Europace 2018; 20: 1719-1720. doi:10.1093/europace/eux380 DOI
- Vigl M, Kaemmerer M, Seiffert-Klaus V, et al. Contraception in women with congenital heart disease. Am J Cardiol 2010; 106: 1317-1321. doi:10.1016/j.amjcard.2010.06.060 DOI
Autorzy
- Joanna Dąbrowska-Juszczak (redaktor)
- Michael Handke (recenzent)
