Streszczenie
- Definicja: Większość nowotworów jądra to guzy zarodkowe (germinalne). Można je podzielić na dwa główne typy: nasieniaki i nienasieniaki. Ponadto wyróżnia się nowotwory niegerminalne.
- Epidemiologia: Rocznie na nowotwór jądra zapada 10 na 100 000 mężczyzn. Względny wskaźnik 5-letniego przeżycia wynosi obecnie 97%. Nowotwór jądra jest najczęstszym typem nowotworu u młodych mężczyzn, ale stanowi jedynie ok. 2% wszystkich nowotworów rozpoznawanych u wszystkich mężczyzn.
- Objawy: Powiększenie jądra wyczuwalne palpacyjnie, niewrażliwe na dotyk, najczęściej niebolesne, możliwe uczucie ciężkości. 20% chorych zgłasza ból.
- Badanie fizykalne: W badaniu palpacyjnym zwykle powiększone jądro oraz wyczuwlany guz, ale chore jądro może być również mniejsze niż normalnie.
- Diagnostyka: Wczesne badanie biomarkerów nowotworowych i badanie ultrasonograficzne jąder. TK klatki piersiowej, jamy brzusznej i miednicy w celu oceny stopnia zaawansowania.
- Leczenie: Obecnie stosuje się leczenie chirurgiczne, chemioterapię i radioterapię. We wczesnym stadium choroby szansa na wyleczenie wynosi niemal 100%. Nawet w zaawansowanych stadiach wyleczalność wynosi 50–90%.
Informacje ogólne
Definicja
- Nowotwory jądra można podzielić na guzy zarodkowe (germinalne) i niegerminalne (guzy podścieliskowe, z komórek zrębu i sznurów płciowych).
- Guz zarodkowy należy do chorób nowotworowych o najwyższym prawdopodobieństwie przeżycia. Rokowanie zależy głównie od histologii, stopnia zaawansowania nowotworu, wieku i jakości opieki.
Podział na stopnie zaawansowania
- Dostępne są różne systemy klasyfikacji. Najpopularniejsze z nich to:
- Klasyfikacja TNM1, która w rozszerzonej kategorii S uwzględnia zawartość w surowicy różnych biomarkerów nowotworowych.
- stopnie zaawansowania według klasyfikacji UICC (Union Internationale Contre le Cancer)
- stopień 0: nieinwazyjny nowotwór zarodkowy (GCNIS), N0, M0, S0
- stopień I: brak wykrywalnych przerzutów
IA: pT1, N0, M0, S0
IB: pT2-4, N0, M0, S0
IS: pT1-4, N0, M0, S1-3 - stopień II: przerzuty do węzłów chłonnych zaotrzewnowych poniżej przepony
IIA: pT1-4, N1, M0, S0-1
IIB: pT1-4, N2, M0, S0-1
IIC: pT1-4, N3, M0, S0-1 - stopień III: zaawansowane przerzuty do węzłów chłonnych lub przerzuty odległe
IIIA: pT1-4, N1-3, M1a, S0-1
IIIB: pT1-4, N1-3, M0-1a, S2
IIIC: pT1-4, N1-3, M0-1b, S3
- Nowotwory jądra z przerzutami
- klasyfikacja IGCCCG (International Germ Cell Cancer Collaborative Group)2-4
- podział na dobre, średnie i złe rokowanie
- W rokowaniu uwzględnia się histologię, lokalizację guza pierwotnego, przerzuty, stężenie AFP w surowicy, beta-hCG, LDH.
Epidemiologia
- U mężczyzn między 20. a 44. rokiem życia guz zarodkowy jest najczęstszą chorobą nowotworową o charakterze złośliwym (około 25%).
- Około 95% wszystkich przypadków nowotworu jądra to guzy zarodkowe.
- Około 62% wszystkich guzów zarodkowych to nasieniaki, 1/3 to nienasieniaki.5-6
- Nowotwory gonadalne to najczęściej nowotwory z komórek Leydiga i z komórek Sertoliego. Rzadszymi wariantami są ziarniszczaki.6
- Zapadalność
- Każdego roku na nowotwór jądra zapada 10 na 100 000 mężczyzn.
- Wiek
- Najczęstszy typ raka u młodych mężczyzn w wieku od 25 do 45 lat.
- Średni wiek zachorowania wynosi 37 lat.
- Histologia
- Pacjentami z nasieniakami są zwykle mężczyźni w wieku 35–39 lat, natomiast pacjenci z nienasieniakami mają zwykle 25–29 lat.7
- Trendy na świecie
- Zapadalność utrzymuje się ostatnio na stałym poziomie po fazie stałego wzrostu obserwowanego od drugiej wojny światowej.
- Czynniki środowiskowe i styl życia nie wydają się mieć żadnego wpływu na prawdopodobieństwo zachorowania.
- Zapadalność jest najwyższa w Europie Północnej.8
- W Polsce rocznie odnotowuje się około 900 przypadków nowotworu jądra; u 1-3 % pacjentów rozwija się on w obu jądrach.9
Etiologia i patogeneza
- Dokładna przyczyna nie jest znana.
- 95% wszystkich nowotworów jądra powstaje w tkance zarodkowej.6
- W jądrze mogą się również rozwijać inne guzy podścieliskowe gonadalne, takie jak guzy z komórek Leydiga i guzy z komórek Sertollego, jak również inne rzadkie postaci nowotworów, w tym mięsaki i chłoniaki.6
Zmiany przedrakowe
- Przypuszcza się, że przyczyną rozwoju nowotworów zarodkowych mogą być komórki rozproszone już w stadium płodowym, które ulegają złośliwemu zwyrodnieniu w trakcie dojrzewania.
Rak in situ
- U około 5% wszystkich pacjentów z jednostronnym nowotworem jądra, w jądrze przeciwnym wykrywany jest rak in situ (rak przedinwazyjny, carcinoma in situ -CIS).4,10
- CIS można też wykryć u niektórych pacjentów z pozagonadalnymi guzami zarodkowymi w przestrzeni zaotrzewnowej.
- Jeśli nie zostanie podjęte leczenie, ryzyko przekształcenia się CIS w raka inwazyjnego w ciągu 5 lat wynosi 50%.6
- Rutynowa biopsja jądra przeciwnego nie jest obecnie zalecana. Biopsję można jednak rozważyć u pacjentów z czynnikami ryzyka.4,6
Rak inwazyjny6
- Guzy zarodkowe (germinalne) dzielą się na nasieniaki i nienasieniaki.
- Czyste nasieniaki stanowią nieco więcej niż połowę wszystkich nowotworów zarodkowych jądra.
- Większość nienasieniaków to guzy mieszane, które zawierają kilka różnych typów komórek, a nasieniak może być jednym z komponentów.
- Pozostałe typy to raki embrionalne, guzy zatoki endodermalnej, kosmówczaki i potworniaki.
- Jeśli w guzie znajdują się zarówno nasieniaki, jak i nienasieniaki, pacjent jest leczony w taki sam sposób, jak w przypadku guza nienasieniakowego, ponieważ ta postać guza jest najbardziej agresywna.
- Nowotwory z podścieliska gonad, komórek zrębowych i sznurów płciowych (niegerminalne)
- Do nowotworów gonadalnych zalicza się guzy z komórek Leydiga, guzy z komórek Sertollego, ziarniszczaki.
Czynniki predysponujące
- Wnętrostwo11
- Nowotwór w przeciwległym jądrze w wywiadzie4
- Istnieje zwiększone ryzyko wystąpienia nowotworu jądra u mężczyzn z zanikiem jądra, przepukliną pachwinową i/lub niepłodnością.12-13
- Zwiększone ryzyko zachorowania u braci (zwłaszcza bliźniaków), synów lub ojców pacjentów z nowotworem jądra14
- Zespoły powodujące nieprawidłowy rozwój jąder wydają się być związane ze zwiększonym ryzykiem wystąpienia nowotworów zarodkowych. Zaliczają się do nich np. zespół Downa czy zespół Klinefeltera.
ICD-10
- C62 Nowotwór złośliwy jądra
- C62.0 Jadro niezstąpione
- C62.1 Jądro zstąpione
- C62.9 Jądro, umiejscowienie nieokreślone
Diagnostyka
Informacje ogólne
- W przypadku klinicznego podejrzenia guza zarodkowego należy niezwłocznie wykonać badanie przedmiotowe oraz obustronną ultrasonografię jąder głowicą o częstotliwości min. 7,5 mHz.
- U mężczyzn z noworozpoznanym guzem zarodkowym należy wykonać TK brzucha/miednicy i klatki piersiowej ze wzmocnieniem kontrastowym w kierunku możliwego rozsiewu nowotworu.
- RM jamy brzusznej/miednicy należy wykonać w miejsce TK u mężczyzn z noworozpoznanym guzem zarodkowym, jeśli istnieją przeciwwskazania do podania środka kontrastowego zawierającego jod, takie jak alergia, upośledzona czynność nerek lub zaburzenia czynności tarczycy. Ponadto w przypadku wyżej wymienionych przeciwwskazań, należy wykonać TK klatki piersiowej bez środka kontrastowego w celu diagnostyki zajęcia płuc.
- U chorych ze złym rokowaniem według IGCCCG oraz u chorych ze znacznym podwyższeniem beta-hCG, licznymi przerzutami do płuc lub objawami neurologicznymi, w celu diagnostyki rozsiewu należy dodatkowo wykonać RM czaszki.
- W pierwotnej diagnostyce rozsiewu nie stosować rutynowo FDG-PET/CT.
- U chorych z podejrzeniem guza zarodkowego należy oznaczyć w surowicy biomarkery nowotworowe AFP, beta-hCG i LDH.
- Pooperacyjnie u pacjentów z przedoperacyjnie podwyższonymi wartościami biomarkerów nowotworowych w surowicy, należy co 5–7 dni oznaczać AFP, beta-hCG i LDH, aż do unormowania wartości/osiągnięcia odpowiedniej wartości najniższej lub wzrostu stężenia biomarkera nowotworowego w surowicy.
Kryteria diagnostyczne
- Uwiarygodnienie podejrzenia na podstawie wywiadu lekarskiego i wyniku badania przedmiotowego
- wyczuwalny guz/guzek w jądrze
- powiększone jądro
- w niektórych przypadkach również zmniejszenie jądra
- zwykle brak oznak zakażenia
- ewentualnie ból w jądrze lub pachwinie15
- Diagnostyka pierwotna obejmuje badanie ultrasonograficzne jąder, którego czułość wynosi niemal 100%.
Diagnostyka różnicowa
- Zapalenie najądrza
- Krwiak lub uraz
- Zapalenie jąder
- Nowotwór jądra może być mylony z zapaleniem najądrza lub zapaleniem jąder.
- Jeśli w badaniu przedmiotowym lub ultrasonograficznym zostanie stwierdzona zmiana zlokalizowana wewnątrz jądra, należy ją zawsze sprawdzić i obserwować.
- Wodniak
- Torbiel nasieniowa
- Skręt jądra
- Naczyniaki wewnątrz- lub zewnątrzjądrowe16
- Pierwotny chłoniak jądra (częściej dotyczy mężczyzn w wieku >60 lat)17
Wywiad lekarski
- W większości przypadków młodzi pacjenci (20–44 lata)
- Czynniki predysponujące
- rak w drugim jądrze w wywiadzie
- wnętrostwo
- obniżona jakość nasienia/niepłodność
- nowotwór jądra u brata lub ojca4,12-13
- Wczesne objawy to często powiększenie jednego jądra lub twardy guzek, który pacjent wyczuwa w jądrze.4
- Chore jądro nie jest zwykle wrażliwe na dotyk.
- Zazwyczaj pojawia się uczucie ciężkości.
- Ból występuje u około 20% chorych.
- Może występować zwiększona tkliwość jądra.
- Nieswoiste dolegliwości w obszarze pachwiny w wywiadzie
- Pierwszym objawem u młodych mężczyzn może być ginekomastia. Jeśli występuje ginekomastia (guzy zarodkowe wydzielające hCG), należy regularnie badać palpacyjnie jądra.
- Wodniak występuje u około 7% pacjentów.
- 10% pacjentów zgłasza ból pleców.
- Kaszel lub duszność spowodowane przerzutami do płuc
Badanie przedmiotowe
- Zawsze należy przeprowadzić badanie przedmiotowe moszny.
- Ponadto należy przeprowadzić ogólne badanie przedmiotowe w celu wykrycia ewentualnych przerzutów odległych (nadobojczykowych), wyczuwalnych guzów w jamie brzusznej lub ginekomastii.6
- U większości pacjentów można zaobserwować powiększone jądro lub nieregularnie odgraniczony guz, ale chore jądro może być również mniejsze niż normalnie.
Badania uzupełniające w gabinecie lekarza rodzinnego
- Nie są wymagane dalsze działania.
Diagnostyka specjalistyczna
Badania obrazowe6
- USG jądra: najczęściej w jądrze widoczna jest zmiana hipoechogeniczna; czułość wynosi niemal 100%.
- Należy również zbadać ultrasonograficznie jądro przeciwległe w celu wykluczenia nowotworu jądra.
- TK
- klatki piersiowej, jamy brzusznej i miednicy: z doustnie lub dożylnie podawanym środkiem kontrastowym, w celu oceny stopnia zaawansowania
- TK głowy: u pacjentów z odpowiednimi objawami oraz u pacjentów zaliczanych do grupy średniego i wysokiego ryzyka według klasyfikacji IGCCCG
- RM
- niestosowany rutynowo
- wykonywany w niejasnych przypadkach
- Scyntygrafia kości
- przy odpowiednich objawach
Biomarkery nowotworowe6
- Należy pamiętać, że biomarkery nowotworowe charakteryzują się niską ogólną czułością i wysokim odsetkiem wyników fałszywie dodatnich. Jednocześnie wynik ujemny nie wyklucza nowotworu jądra.6
- Przedoperacyjnie należy zbadać:
- alfafetoproteinę (AFP)
- beta-hCG
- dehydrogenazę mleczanową (LDH)
- AFP i hCG są podwyższone u odpowiednio 50–70% pacjentów z nasieniakami i 40–60% pacjentów z nienasieniakami.
- LDH charakteryzuje się niską swoistością dla nowotworów germinalnych jądra, która wydaje się nie przekraczać 40-60%.18
- Pooperacyjnie należy oznaczyć następujące biomarkery:
- AFP, beta-hCG i LDH; jeżeli wartości wyjściowe były podwyższone, oznaczenie należy powtarzać co 5–7 dni aż do unormowania wartości.
- Okres półtrwania AFP i beta-hCG wynosi odpowiednio 5–7 i 1–3 dni, więc normalizacja wartości może trwać kilka tygodni.
- Jeśli wartości pozostają podwyższone lub wzrastają po orchiektomii, należy szukać przerzutów.
- Pooperacyjne prawidłowe wartości markerów nowotworowych nie wykluczają jednak choroby przerzutowej.
Biopsja6
- W przypadku podejrzenia guza zarodkowego należy wykonać diagnostyczne odsłonięcie jądra z biopsją.
- Jeśli podejrzenie się potwierdzi, wykonuje się orchiektomię radykalną.
Wskazania do skierowania do specjalisty
- W przypadku podejrzenia nowotworu jądra, wątpliwego zapalenia najądrza lub zapalenia jądra, które nie ustępuje w ciągu 2–3 tygodni, należy pilnie zasięgnąć opinii urologa.
- Jeśli wyniki badań są niejasne, należy niezwłocznie skierować pacjenta do urologa.
Leczenie
Cele leczenia
- Wyleczenie (u ok. 95% pacjentów)
- W razie potrzeby opieka paliatywna w zaawansowanej chorobie nowotworowej
Ogólne informacje o leczeniu
- Rozróżnienie między nasieniakami i nienasieniakami ma zasadnicze znaczenie dla wyboru terapii.
- Zasadniczo wskaźniki wyleczenia nowotworu jądra są bardzo wysokie. W 1. stopniu zaawansowania sięgają niemal 100%, w stadium przerzutowym wynoszą 50–90%.4
Leczenie chirurgiczne6
- Leczenie nowotworu jądra odbywa się zasadniczo przez orchiektomię.
- Chemioterapię można stosować jako leczenie pierwszej linii dopiero w bardzo zaawansowanym, przerzutowym stadium.
- W większości przypadków wykonuje się orchiektomię radykalną przez pachwinę, tzn. usuwa się chore jądro wraz z powrózkiem nasiennym i najądrzem.
- Operację oszczędzającą narządu można rozważyć w raku jądra o niewielkich rozmiarach.
- Na życzenie pacjenta można wszczepić protezę jądra.
- Przy preparowaniu węzłów chłonnych zaotrzewnowych (retroperitoneal lymph node dissection — RPLND) usuwa się węzły chłonne znajdujące się w tylnej części jamy brzusznej. Ten zabieg wykonuje się głównie w leczeniu nienasieniaków, zarówno w leczeniu pierwszego rzutu, jak i po chemioterapii.
Farmakoterapia
Chemioterapia6
- Najskuteczniejszymi cytostatykami w leczeniu złośliwych guzów zarodkowych są cisplatyna, etopozyd i bleomycyna.
- Standardowym leczeniem w przypadku przerzutów jest schemat BEP (cisplatyna, etopozyd, bleomycyna).
- W zależności od stopnia zaawansowania podaje się 1–4 cykle. W przypadku przeciwwskazań do bleomycyny (choroba płuc) można podać EP lub PEI (cisplatyna, etopozyd i ifosfamid).
Radioterapia
- Sekcję opracowano na podstawie następujących źródeł:6,19
- Nasieniaki są bardzo wrażliwe na promieniowanie; w przypadku tych guzów bardzo skuteczne są zarówno radioterapia, jak i chemioterapia.
- W przypadku nienasieniaków radioterapia jest zwykle mało skuteczna.
- Wykazano, że po orchiektomii 80–85% pacjentów nie wymaga dalszego leczenia.20
- Szanse na wyleczenie i przeżycie są w większości przypadków bardzo wysokie, nawet bez adjuwantowej terapii radiacyjnej.
- Terapia radiacyjna może prowadzić do długotrwałych następstw, takich jak wtórne nowotwory złośliwe czy choroby układu krążenia.
- Radioterapia może przejściowo powodować złe samopoczucie, biegunkę i osłabienie, zwłaszcza jeśli leczenie obejmuje fragmenty przewodu pokarmowego.
Leczenie nasieniaków4,6,19
| Stopnia 1. |
|
| Stopnia 2. |
|
| Stopnia 3. |
|
Leczenie nienasieniaków
| Stopnia 1. |
|
| Stopnia 2. |
|
| Stopnia 3. |
|
Nawroty
- Leczenie nawrotu zależy od rokowania.
- korzystne rokowanie: odpowiedź całkowita na leczenie pierwszego rzutu, niskie stężenie biomarkerów nowotworowych w surowicy, guz pierwotny o małej objętości i umiejscowiony w jądrze
- niekorzystne rokowanie: niepełna odpowiedź na leczenie pierwszego rzutu, wysokie stężenie biomarkerów nowotworowych w surowicy, duża objętość guza pierwotnego, guzy pierwotne poza jądrem
- Późny nawrót: nawrót występujący nie wcześniej niż po upływie 2 lat po terapii pierwszego rzutu
- Leczenie obejmuje ponowną resekcję, jeśli jest to technicznie możliwe.
- Alternatywnie w pierwszej kolejności można podać chemioterapię lub chemioterapię wysokodawkową, a następnie wykonać resekcję.
Płodność6
- U mężczyzn z rakiem jądra występuje zwiększone ryzyko niepłodności.
- Mężczyznom w wieku rozrodczym i (lub) wyrażającym chęć posiadania dzieci należy doradzić, aby przed rozpoczęciem leczenia poddali się analizie nasienia i zabezpieczyli odpowiednią dawkę nasienia.
Leczenie paliatywne
- Jeśli choroba nie jest wyleczalna, należy na wczesnym etapie omówić z pacjentem opcje opieki paliatywnej.
Zalecenia dla pacjentów
- Bardzo ważna jest staranna realizacja programu badań kontrolnych.
- Jeśli pacjent wyraża chęć posiadania dzieci, przed rozpoczęciem leczenia należy rozważyć analizę i zabezpieczenie nasienia.
Przebieg, powikłania i rokowanie
Przebieg
- Nawroty po leczeniu występują w większości przypadków w ciągu 2 lat.
Powikłania
- W niektórych przypadkach już w momencie rozpoznania występuje obniżona jakość nasienia.21
- U mężczyzn z rakiem jądra występuje zwiększone ryzyko niepłodności.22-23
- Jeśli pacjent chce mieć dzieci, należy mu zaproponować analizę i zabezpieczenie nasienia.6
- Możliwe są zmniejszone libido, wytrysk wsteczny, zaburzenia erekcji i inne długoterminowe działania niepożądane leczenia.24
- Niedobór testosteronu6
- Rzadko wtórne nowotwory złośliwe (białaczki)
- Działania niepożądane chemioterapii
- utrata słuchu lub szumy uszne — w wyniku leczenia cisplatyną (>300 mg/m2)6
- uszkodzenie płuc i nerek
- Bardzo złe samopoczucie podczas przyjmowania cisplatyny. Wymagane jest kompleksowe leczenie przeciwwymiotne antagonistami 5-HT3 w połączeniu z deksametazonem i aprepitantem. Niezwykle istotna jest edukacja pacjentów na temat leków stosowanych doraźnie. W przypadku opóźnionych wymiotów, po kilku dniach pacjenci potrzebują recepty i instrukcji, jak przyjmować leki.
- Neurotoksyczności można zapobiec lub ją ograniczyć poprzez staranne nawodnienie podczas podawania cisplatyny.
- Leki nefrotoksyczne, takie jak aminoglikozydy, są przeciwwskazane podczas leczenia cisplatyną.25
Rokowanie
- Sekcję opracowano na podstawie następujących źródeł:4,6
- Rokowanie jest zasadniczo bardzo dobre.
- Niezależne od stopnia zaawansowania, wskaźnik 5-letnich przeżyć u pacjentów z nasieniakami i nienasieniakami zarodkowymi wynosi odpowiednio 98% i 95%.
- U chorych z guzem zarodkowym stopnia 1. wskaźnik 10-letnich przeżyć swoistych dla nowotworu i 10-letniego przeżycia całkowitego wynosi odpowiednio 99,7% i 95–99%.
- Nawet w stadium z przerzutami wyleczalność wynosi 50–90%.
- Wskaźnik 5-letnich przeżyć w przypadku raka zarodkowego z przerzutami wynosi od 86 do 95% u chorych z dobrym rokowaniem, od 72 do 85% u chorych ze średnim rokowaniem i od 48 do 64% u chorych ze złym rokowaniem.
- Korzystne rokowanie zależy w znacznym stopniu od wczesnego wdrożenia leczenia.
- Im bardziej zaawansowana choroba, tym większe ryzyko nawrotu.
Dalsze postępowanie
- Zalecane są regularne kontrole w kolejnych latach.
- Celem jest wykrycie nawrotów lub przerzutów, a w razie potrzeby jak najwcześniejsze wykrycie guzów w drugim jądrze.
- Większość nawrotów występuje w ciągu pierwszych 2 lat po leczeniu ukierunkowanym na wyleczenie (radykalnym), ale może też wystąpić po ponad 5 latach.
- Badanie kontrolne obejmuje6:
- wywiad lekarski, badanie przedmiotowe, badanie palpacyjne węzłów chłonnych nad- i podobojczykowych oraz drugiego jądra
- oznaczenie biomarkerów nowotworowych (AFP, hCG, LDH), poziomu lipidów i glukozy we krwi, poziomu hormonów, pomiar ciśnienia tętniczego, masy ciała, BMI
- kontrola ultrasonograficzna drugiego jądra oraz ewentualnie szczątkowego miąższu jądra
- RTG klatki piersiowej
- TK jamy brzusznej i miednicy
Dalsze postępowanie w zależności od stopnia zaawansowania
- Schemat postępowania po leczeniu zależy od rodzaju nowotworu oraz stopnia zaawansowania, a także zastosowanego leczenia pierwszego rzutu.
- W zależności od wytycznych, schematy postępowania mogą się znacznie różnić, zwłaszcza w odniesieniu do badań obrazowych.
- Schematy dalszego postępowania dostosowane do stopnia zaawansowania nowotworu nie wykazują przewagi pod względem wskaźników przeżycia nad standardowym schematem dalszego postępowania.
- Zmodyfikowane schematy dalszego postępowania są stosowane przede wszystkim w celu ograniczenia długoterminowych następstw procedur obrazowania.
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Informacje ogólne
- Terapie nowotworowe, leki
- Przygotowanie do terapii radiacyjnej
- Ból i terapia bólu
- Jeśli jesz bardzo mało — poradnik żywieniowy
Opieka paliatywna w zaawansowanej chorobie nowotworowej
- Leki w opiece paliatywnej
- Leczenie lęku
- Nudności i wymioty
- Zaparcia
- Suchość błony śluzowej jamy ustnej
- Trudności z oddychaniem
- Utrata masy ciała w chorobie nowotworowej
- Depresja
- Majaczenie
Ilustracje
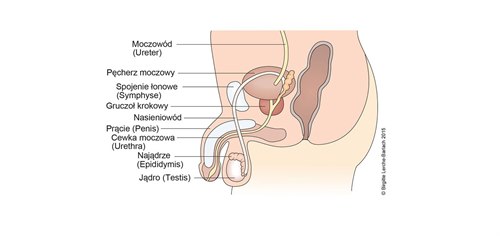
Męskie narządy płciowe
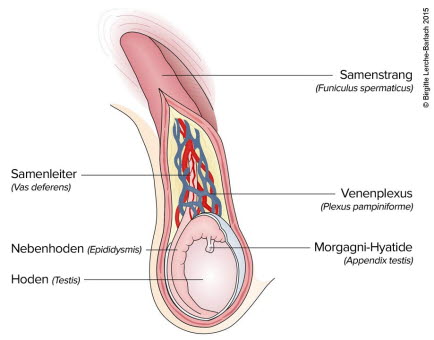
Prawidłowe jądro
Źródła
Wytyczne
- Patrikidou A, Cazzaniga W, Berney D, et al. European Association of Urology Guidelines on Testicular Cancer: 2023 Update. European Urology 2023; 84(3): 289-301 europeanurology.com
- Honecker F, Aparicio J, Berney D, et al. ESMO Consensus Conference Guidelines on testicular germ cell cancer: diagnosis, treatment and follow-up.Ann Oncol (2018); 29: 1658–1686. esmo.org
Piśmiennictwo
- Sobin LH, Witterkind C: TNM classification of malignant tumours., UICC Wiley-Liss, 2007.
- International Germ Cell Consensus Classification: a prognostic factor- based staging system for metastatic germ cell cancers. International Germ Cell Cancer Collaborative Group. J Clin Oncol 1997; 15: 594-603. PubMed
- Gangireddy Vgr, Liles GB, Sostre GD, Coleman T. Response of metastatic renal medullary carcinoma to carboplatinum and Paclitaxel chemotherapy. Clin Genitourin Cancer 2012; 10(2): 134-9. pmid:22409864 PubMed
- Oldenburg J, Fossa SD, Nuver J, Heidenreich A, Schmoll HJ, Bokemeyer C, Horwich A, Beyer J, Kataja V. Testicular seminoma and non-seminoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2013;24(suppl 6):vi125-vi132. www.esmo.org
- Ye H, Ulbright TM. Difficult differential diagnoses in testicular pathology. Arch.Pathol.Lab.Med 2012; 136(4): 435-46. pmid:22458906 PubMed
- Albers P, Algaba F, Bokemeyer C, et al. Guidelines on testicular cancer. European Association of Urology (EAU). Stand 2020. uroweb.org
- Chia VM, Quraishi SM, Devesa SS, Purdue MP, Cook MB, McGlynn KA. International trends in the incidence of testicular cancer, 1973-2002. Cancer Epidemiol Biomarkers Prev. 2010 May. 19(5):1151-9. pubmed.ncbi.nlm.nih.gov
- Horwich A, Shipley J, Huddart R. Testicular germ-cell cancer. Lancet 2006; 367: 754-65. PubMed
- Rabijewski M. Nowotwory jąder. (dostęp 29.12.2023) podyplomie.pl
- Bazzi WM, Raheem OA, Stroup SP, Kane CJ, Derweesh IH, Downs TM. Partial orchiectomy and testis intratubular germ cell neoplasia: World literature review. Urol.Ann 2011; 3(3): 115-8. pmid:21976922 PubMed
- Wood HM, Elder JS. Cryptorchidism and Testicular Cancer: Separating Fact From Fiction. The Journal of Urology 2009; 181(12): 452-61. pmid:19084853 PubMed
- Cook MB, Akre O, Forman D, Madigan MP, Richiardi L, McGlynn KA. A systematic review and meta-analysis of perinatal variables in relation to the risk of testicular cancer-experiences of the son. Int J Epidemiol 2010; 396: 1605-18. pmid:20660640 PubMed
- Peng X, Zeng X, Peng S, Deng D, Zhang J. The association risk of male subfertility and testicular cancer: a systematic review. PloS one 2009; 4(5): e5591. pmid:19440348 PubMed
- Neale RE, Carriere P, Murphy MFG, Baade PD. Testicular cancer in twins: A meta-analysis. British Journal of Cancer 2008; 98(1): 171-3. pmid:18071360 PubMed
- Shephard EA, Hamilton WT. Selection of men for investigation of possible testicular cancer in primary care: a large case-control study using electronic patient records. Br J Gen Pract 2018. pmid:29970393 www.ncbi.nlm.nih.gov
- Naveed S, Quari H, Sharma H. Cavernous haemangioma of the testis mimicking as testicular malignancy in an adolescent. Scott.Med.J 2013; 58(4): e5-e7. pmid:24215057 PubMed
- Lokesh KN, Sathyanarayanan V, Lakshmaiah KC, Suresh TM, Dasappa L, Kanakasetty GBK. Primary Diffuse large B-Cell lymphoma of testis: A single centre experience and review of literature. Urol.Ann 2014; 6(3): 231-4. pmid:25125896 PubMed
- Venkitaraman R, Johnson B, Huddart RA et al. The utility of lactate dehydrogenase in the follow-up of testicular germ cell tumours. BJU Int 2007; 100: 30-2. PubMed
- Alberta Health Services (AHS). Testicular germ cell tumours. Clinical Practice Guideline GU-001, version 7. Edmonton: AHS; 2016. www.albertahealthservices.ca
- Choo R, Thomas G, Woo T et al. Long-term outcome of postorchiectomy surveillance for stage I testicular seminoma. Int J Radiat Oncol Biol Phys 2005; 61: 736-40. PubMed
- Abouassaly R, Fossa SD, Giwercman A, Kollmannsberger C, Motzer RJ, Schmoll HJ, Sternberg CN. Sequelae of treatment in long-term survivors of testis cancer. Eur.Urol 2011; 60(3): 516-26. pmid:21684072 PubMed
- Cvancarova M, Samuelsen SO, Magelssen H, Fossa SD. Reproduction rates after cancer treatment: experience from the Norwegian radium hospital. J Clin Oncol 2009; 27(3): 334-43. pmid:19075285 PubMed
- Molnar Z, Mokanszki A, Bazsane ZK, Bhattoa HP, Benyo M, Olah E, Jakab A. Sperm concentration, hyaluronic acid-binding capacity, aneuploidy and persistent histones in testicular cancer. Hum.Reprod 2014; 29(9): 1866-74. pmid:25047166 PubMed
- Carpentier MY, Fortenberry JD. Romantic and sexual relationships, body image, and fertility in adolescent and young adult testicular cancer survivors: A review of the literature. J.Adolesc.Health 2010; 47(2): 115-25. pmid:20638003 PubMed
- Souchon R, Hartmann M, Krege S, Lorch A, Mayer F, De Santis M, Gillessen S, Beyer J, Cathomas R. Interdisciplinary Evidence-Based Recommendations for the Follow-Up of Early Stage Seminomatous Testicular Germ Cell Cancer Patients. Strahlenther Onkol 2011; (3): 158-66. pmid:21347634 PubMed
Autorzy
- Michał Sutkowski, lekarz, specjalista medycyny rodzinnej, NZOZ Medycyna Rodzinna w Osuchowie (recenzent)
- Tomasz Tomasik, Dr hab. n. med., Prof. UJ, specjalista medycyny rodzinnej, Uniwersytet Jagielloński Collegium Medicum w Krakowie (redaktor)
- Laura Morshäuser, lekarz, Freiburg im Breisgau
- Jessica Lobitz, B. Sc., Deutsche Krebsgesellschaft, Berlin
Link lists
Powiązane artykuły
Stany nagłe
Informacje dla pacjentów
- Leki stosowane w terapii nowotworów
- Przygotowanie do radioterapii
- Ból i leczenie bólu
- Co to jest opieka paliatywna?
- Leczenie lęku w opiece paliatywnej
- Nudności i wymioty, opieka paliatywna
- Zaparcia, opieka paliatywna
- Dolegliwości jamy ustnej w opiece paliatywnej
- Trudności z oddychaniem w chorobie nowotworowej
- Utrata masy ciała przy chorobie nowotworowej, opieka paliatywna
- Depresja, opieka paliatywna
- Majaczenie w opiece paliatywnej
