informacje ogólne
Definicja
- Utrzymujące się po urodzeniu połączenie naczyniowe między rozwidleniem tętnicy płucnej a dystalnym obszarem łuku aorty bezpośrednio po odejściu lewej tętnicy podobojczykowej.
- Nietypowe lokalizacje możliwe w złożonych wadach serca, anomaliach łuku aorty i pętlach naczyniowych
Częstość występowania
- Zapadalność około 1:2000 urodzeń1
- Odsetek na poziomie ok. 5–10% wrodzonych wad serca1
- Wysoka częstość występowania u wcześniaków (20–60%)2
- zapadalność na poziomie ponad 30% przy masie urodzeniowej <1500 g>
- zapadalność na poziomie 50–70% przy masie urodzeniowej <1000 g>
- Stosunek płci żeńskiej do męskiej ok. 2:11
Etiologia i patogeneza
Etiologia
- PDA najczęściej występuje u wcześniaków z powodu braku dojrzewania.1
- U noworodków urodzonych w terminie częściowo z przyczyn genetycznych1
- Dokładne mechanizmy nie zostały jeszcze wyjaśnione.
- zwiększone występowanie w niektórych zespołach genetycznych, np. trisomii 21
Patofizjologia
- Przepływ prenatalny ok. 90% objętości wyrzutowej prawej komory z tętnicy płucnej przez przewód tętniczy do aorty i ostatecznie do łożyska w celu wymiany gazowej2
- Drożny przewód Botalla jeszcze fizjologiczne połączenie bocznikowe w pierwszych 3 dniach u zdrowych noworodków
- Okluzja poporodowa regulowana przez tlen i czynniki wazoaktywne
- reakcja przewodu w zależności od dojrzałości dziecka
- Poporodowy spadek naczyniowego oporu płucnego z odwróceniem przecieku prawo-lewo na przeciek lewo-prawy
- Wielkość przecieku zależy od poniższych czynników:1
- Opór przepływu PDA jest określany głównie na podstawie następujących parametrów
- długość
- najwęższa średnica
- kształt
- elastyczność ściany kanału
- Gradient ciśnienia między aortą a tętnicą płucną
- Opór przepływu PDA jest określany głównie na podstawie następujących parametrów
- Hemodynamiczne konsekwencje przecieku lewo-prawego przez PDA
- obciążenie objętościowe i wzrost wielkości lewej jamy serca
- hipoperfuzja rozkurczowa narządów zaopatrywanych przez krążenie systemowe
- hiperperfuzja tętnic płucnych, wzrost oporu naczyniowego z rozwojem nadciśnienia płucnego
- Mechanizmy kompensacyjne lewej komory1
- zwiększenie objętości wyrzutowej
- przerost lewej komory serca
- Zwiększona aktywność współczulna ze wzrostem:1
- kurczliwości
- częstości akcji serca
- Możliwy rozwój niedokrwienia podwsierdziowego z następującego powodu:1
- obniżone ciśnienie rozkurczowe
- skrócony rozkurcz z powodu tachykardii
- zwiększone napięcie ściany poszerzonej lewej komory
- zwiększone zapotrzebowanie na tlen
Klasyfikacja
- Klasyfikacja na podstawie kryteriów klinicznych, hemodynamicznych i echokardiograficznych
- Grupa 1: mały, nieistotny hemodynamicznie, niemożliwy do osłuchania („niemy przewód")
- Grupa 2: mały, nieistotny hemodynamicznie, osłuchiwalny
- Grupa 3: istotny hemodynamicznie z szmerem skurczowo-rozkurczowym, z klinicznymi objawami niewydolności serca lub bez nich
- Grupa 4: duży z nadciśnieniem płucnym/zwiększonym oporem
Czynniki predysponujące
- Wcześniactwo
- Zakażenie różyczką w pierwszym trymestrze ciąży (szczególnie w pierwszych 4 tygodniach)1
- 80% wcześniaków z zespołem zaburzeń oddechowych ma przetrwały przewód tętniczy, prawdopodobnie z powodu podwyższonego poziomu prostaglandyn2
- Pobyt na dużej wysokości podczas porodu2
ICD-10
- Q25 Wrodzone wady rozwojowe dużych tętnic
- Q25.0 Drożny przewód tętniczy
Diagnostyka
Kryteria diagnostyczne
- Wstępne rozpoznanie na podstawie wyników badań klinicznych, dowody na obecność PDA w badaniu echokardiograficznym
- Cel diagnostyki są następujące:
- wizualizacja anatomii przewodu
- ocena efektów hemodynamicznych
- rozległość przecieku
- ciśnienie w tętnicy płucnej
- Zwłaszcza w przypadku wcześniaków ocena istotności hemodynamicznej na podstawie kryteriów klinicznych, echokardiograficznych, radiologicznych i laboratoryjnych
- kryteria kliniczne
- szmer skurczowy lub skurczowo-rozkurczowy (brak nie wyklucza PDA!)3)
- przedserce hiperdynamiczne
- silne tętno obwodowe
- duża amplituda ciśnienia tętniczego
- brak poprawy lub pogorszenie sytuacji oddechowej
- kryteria echokardiograficzne
- potwierdzenie (lub wykluczenie) klinicznego podejrzenia PDA
- kwantyfikacja przecieku
- wykluczenie/wykrycie innych wad rozwojowych
- ocena przebiegu (np. spontaniczne zamknięcie, powodzenie interwencji)
- kryteria radiologiczne (opcjonalnie RTG klatki piersiowej)
- zwiększone unaczynienie płucne
- obrzęk płuc
- kardiomegalia
- laboratoryjne kryteria chemiczne
- oznaczenie BNP lub NT-proBNP w celu oceny obciążenia lewej komory serca
- znaczenie prognostyczne w odniesieniu do potrzeby leczenia
- oznaczenie BNP lub NT-proBNP w celu oceny obciążenia lewej komory serca
- kryteria kliniczne
Diagnostyka różnicowa
- Okienko aortalno-płucne
- Zabezpieczenia aortalno-płucne
- Przetoki tętniczo-żylne, przetoki tętnic wieńcowych
- Złożona wada aortalna
- Wspólny pień tętniczy z niewydolnością zastawki pnia
- Pęknięty tętniak zatoki Valsalvy
Wywiad lekarski
- Wywiad rodzinny: W rodzinach z rodzeństwem z PDA ryzyko wystąpienia u dalszego potomstwa wynosi 3%.1
- Różyczka w czasie ciąży (pierwszy trymestr)?
Badanie fizykalne
- Szmer skurczowy lub skurczowo-rozkurczowy
- Mruk przedsercowy
- Unoszące uderzenie koniuszkowe
- Silne tętno obwodowe
- Duża amplituda ciśnienia tętniczego przy niskim rozkurczowym ciśnieniu tętniczym
- Objawy niewydolności serca
- tachypnoe (przyśpieszony oddech)
- tachykardia
- zastój w krążeniu płucnym
- powiększenie wątroby
- niedostateczny wzrost i przyrost masy ciała
Badanie uzupełniające w praktyce lekarza rodzinnego
- EKG u starszych dzieci/młodzieży/dorosłych z podejrzeniem PDA
Diagnostyka u specjalisty
- Echokardiografia (ECHO)
- decydująca procedura diagnostyczna do wykrywania PDA i oceny:
- różnicy ciśnień aortalno-płucnych
- wielkości przecieku
- płucnego ciśnienia tętniczego
- wielkości i czynności lewej komory serca
- rutynowe badanie echokardiograficzne u wcześniaków ze względu na wysoką zapadalność i niewystarczającą czułość badania klinicznego3
- decydująca procedura diagnostyczna do wykrywania PDA i oceny:
- EKG
- objawy obciążenia lewej komory serca z hemodynamicznie istotnym PDA
- możliwe objawy obciążenia prawej komory serca wskazujące na nadciśnienie płucne
- RTG klatki piersiowej
- Zwykle nie jest konieczne.
- powiększenie serca i zwiększone unaczynienie płucne
- Cewnikowanie serca
- zasadniczo niewskazane w diagnostyce
- w indywidualnych przypadkach w następującym celu
- zobrazowanie anatomii w przypadku bardzo dużego przewodu
- dalsze wyjaśnienie w przypadku nadciśnienia płucnego
- RM/TK
- zobrazowanie anatomii w przypadku starszych dzieci/młodzieży
- Badania laboratoryjne
- BNP, NT-proBNP jako markery niewydolności serca
- ew. kwasica metaboliczna w gazometrii krwi tętniczej
Wskazania do hospitalizacji
- Dzieci z niewyrównaną niewydolnością serca i/lub sinicą
Wskazania do skierowania do kardiologa dziecięcego
- Dziecko z klinicznie wyrównanym szmerem serca nasuwającym podejrzenie wrodzonej wady serca (patrz również artykuł Szmery w sercu u dzieci)
Leczenie
Cele terapii
- Zamknięcie istotnego hemodynamicznie PDA w celu zapobieżenia wtórnemu uszkodzeniu (niewydolności serca) i normalizacji rokowania
Ogólne informacje o leczeniu
- U wcześniaków należy podjąć próbę leczenia inhibitorami COX (indometacyna lub ibuprofen).
- W pozostałych przypadkach rodzaj leczenia zależy od klasyfikacji PDA (patrz wyżej) i wieku dziecka.
- Grupa 1
- mały „niemy przewód“ bez potrzeby leczenia i obserwacji
- bardzo niskie ryzyko zapalenia błony wewnętrznej naczyń
- Grupa 2
- Nie jest konieczne w przypadku nieistotnego hemodynamicznie zamknięcia PDA u niemowląt.
- często spontaniczna okluzja w dalszym przebiegu
- możliwe cewnikowo-interwencyjne zamknięcie w późniejszym terminie
- Grupa 3
- Istotny hemodynamicznie PDA powinien zostać zamknięty.
- bez objawów niewydolności serca / bez nadciśnienia płucnego: po pierwszych sześciu miesiącach życia
- z objawami niewydolności serca: po rozpoznaniu choroby
- Istotny hemodynamicznie PDA powinien zostać zamknięty.
- Grupa 4
- W przypadku przewodu z nadciśnieniem płucnym od 7. miesiąca życia przed zamknięciem konieczne jest wyjaśnienie oporu płucnego.
- Grupa 1
Leczenie farmakologiczne
- Inhibitory COX są stosowane do zamykania PDA za pomocą leków.
- indometacyna (wieloletnie doświadczenie od 1976 r.)
- ibuprofen (stosowany w Europie od 1995 r.),4
- Obie substancje są równie skuteczne.5
- Wskaźniki zamknięcia na poziomie 75–93%3
- Niższe ryzyko oligurii/wzrostu stężenia kreatyniny w przypadku ibuprofenu5
- Doustne podawanie ibuprofenu w dużych dawkach może być skuteczniejsze niż standardowe dożylne dawki ibuprofenu lub indometacyny.6
Leczenie chirurgiczne
- Chirurgiczne podwiązanie PDA zostało uznane za pierwszą metodę zamknięcia (13 lat przed zamknięciem farmakologicznym).
- Wysoki wskaźnik skuteczności wynoszący 94–100%1
- Obecnie głównie „leczenie ratunkowe” w przypadku nieskutecznego leczenia farmakologicznego
Interwencyjne leczenie przezcewnikowe
- Metoda z wyboru poza wcześniactwem i wiekiem noworodkowym
- Zamykanie za pomocą sprężynek lub okluderów; dostępnych jest wiele systemów o różnej konfiguracji1
- Wskaźnik zamknięcia na poziomie niemal 100% rok po interwencji
Profilaktyka
- Ogólna profilaktyka zapalenia wsierdzia nie jest już zalecana u osób z nieleczonym PDA.
- Wszystkie wady serca leczone chirurgicznie lub interwencyjnie z użyciem materiału protetycznego powinny być objęte profilaktyką zapalenia wsierdzia w ciągu pierwszych 6 miesięcy.
- w przypadku przetrwałego przecieku z turbulentnym przepływem również po tym okresie
- W przypadku nieszczepionych kobiet w wieku rozrodczym (lub o niejasnym statusie szczepień) zaleca się dwukrotne szczepienie przeciwko różyczce (szczepionka MMR) w celu zapobiegania chorobie w czasie ciąży. Kobiety, które zostały zaszczepione raz, powinny otrzymać drugą dawkę.
Przebieg, powikłania i rokowanie
Przebieg i powikłania
- Rozwój niewydolności lewokomorowej z powodu przeciążenia objętościowego
- U dorosłych niewydolność serca jest często związana z migotaniem lub trzepotaniem przedsionków.1
- Rozwój nadciśnienia płucnego
- w przypadku gwałtownego wzrostu oporu płucnego zespół Eisenmengera z odwróceniem przecieku (przeciek prawo-lewy) i sinicą
- Tętniak przewodu tętniczego
- zapadalność na poziomie do 8%1
- ucisk sąsiednich struktur lub epizody zakrzepowo-zatorowe
- Zapalenie błony wewnętrznej naczyń
- Rzadkie powikłanie; zgodnie z aktualnymi wytycznymi PDA nie jest już wskazaniem do profilaktyki zapalenia wsierdzia.
Rokowanie po zamknięciu
- Doskonałe rokowanie po wczesnym zamknięciu izolowanego PDA bez istotnych chorób współistniejących7
- U wcześniaków rokowanie zależy głównie od chorób współistniejących.7
Dalsze postępowanie
- Opieka kontrolna po interwencji/operacji koncentruje się głównie na wykrywaniu przecieku resztkowego.
- Zwykle ograniczona do 2 lat po udanym zamknięciu
Przetrwały przewód tętniczy w wieku dorosłym
- W przypadku pacjentów, u których wada serca nie została skorygowana we wczesnym dzieciństwie, w diagnostykę i dalszą opiekę w wieku dorosłym zaangażowany jest lekarz rodzinny.
- U dorosłych PDA jest zwykle diagnozowany jako zmiana izolowana.8
- Zarówno niewydolność lewokomorowa, jak i nadciśnienie płucne mogą dominować wśród objawów u dorosłych.8
- Dobra komunikacja między lekarzem rodzinnym, kardiologiem z prywatnej praktyki lekarskiej i ośrodkiem specjalistycznym, a także ścisła współpraca między kardiologami dziecięcymi i kardiologami dla dorosłych są niezbędne do optymalnego leczenia.9
- Metodą z wyboru jest zamknięcie interwencyjne.8
- Chirurgia alternatywna tylko w przypadku niekorzystnej anatomii uniemożliwiającej zamknięcie za pomocą urządzenia
- Rokowanie u dorosłych zależy od tego, czy wystąpiła już niewydolność lewokomorowa i nadciśnienie płucne.7
Informacje dla pacjentów
Informacje dla pacjentów w Deximed
Ilustracje


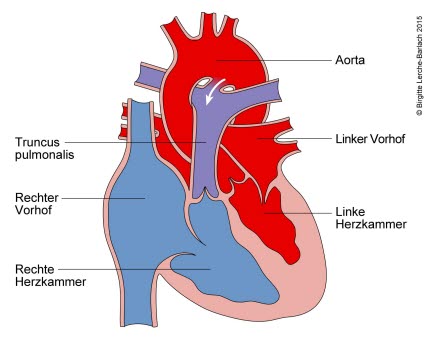
Przetrwały przewód tętniczy
Quellen
Leitlinien
- European Society of Cardiology. Guidelines for the management of grown-up congenital heart disease. Stand 2010. www.escardio.org
Literatury
- Schneider D, Moore J. Patent Ductus Arteriosus. Circulation 2006; 114: 1873-1882. doi:10.1161/CIRCULATIONAHA.105.592063 DOI
- Dice J, Bhatia J. Patent Ductus Arteriosus: An Overview. J Pediatr Pharmacol Ther 2007; 12: 138-146. www.ncbi.nlm.nih.gov
- Urquhart DS, Nicholl RM. How good is clinical examination at detecting a significant patent ductus arteriosus in the preterm neonate? Arch Dis Child 2003; 88: 85-86. PubMed
- Ohlsson A, Walia R, Shah SS. Ibuprofen for the treatment of patent ductus arteriosus in preterm or low birth weight (or both) infants. Cochrane Database Syst Rev. 2015 Feb 18;2:CD003481. The Cochrane Library
- Van Overmeire B, Smets K, Lecoutere D, Van de Broek H, Weyler J. A comparison of ibuprofen and indomethacin for closure of patent ductus arteriosus. N Engl J Med 2000; 343: 674-81. New England Journal of Medicine
- Mitra S, Florez ID, Tamayo MD, et al. Association of placebo, indomethacin, ibuprofen, and acetaminophen with closure of hemodynacically significant ductus arteriosus in preterm infants: A systematic review and meta-analysis. JAMA 2018; 319: 1221-38. pmid:29584842 PubMed
- Kim L. Patent Ductus Arteriosus (PDA). Medscape, updated: Dec 31, 2017. Zugriff 15.07.2018. emedicine.medscape.com
- Baumgartner H, Bonhoeffer P, De Groot N, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31: 2915–2957. doi:10.1093/eurheartj/ehq249 DOI
- Diller GP, Breithardt G, Baumgartner H. Congenital heart defects in adulthood. Dtsch Arztebl Int 2011; 108: 452-459. www.ncbi.nlm.nih.gov
Autoren
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i.Br.