Streszczenie
- Definicja: Najczęściej rak nabłonkowy (gruczolakorak) tkanki gruczołu krokowego. Zwiększone ryzyko występuje w przypadku predyspozycji dziedzicznej oraz w starszym wieku.
- Epidemiologia: Rak prostaty jest najczęstszym nowotworem u mężczyzn, z roczną zapadalnością około 40 na 100 000 mężczyzn.
- Objawy: W 90% przypadków choroba przebiega bezobjawowo. Najczęstszymi objawami są zaburzenia mikcji i miejscowy ból.
- Badanie fizykalne: We wczesnej fazie choroby nie stwierdza się nieprawidłowości. W późniejszym okresie u części chorych stwierdza się podczas badania per rectum nieprawidłowości na powierzchni gruczołu krokowego np. stwardnienia.
- Diagnostyka: Badanie PSA stanowi element diagnostyki raka stercza, ale nie jest dobrym testem przesiewowym. O rozpoznaniu rozstrzyga badanie histopatologiczne. Próbki pobiera się zwykle za pomocą biopsji punkcyjnej. W razie potrzeby jako uzupełnienie można wykonać RM.
- Leczenie: Decyzja o leczeniu oparta na czynnikach związanych z pacjentem i guzem. Możliwości leczenia są różne: od „uważnej obserwacji” poprzez terapię miejscową w postaci radykalnej prostatektomii, ablacji androgenowej i radioterapii aż do terapii czysto wspomagającej i paliatywnej.
Informacje ogólne
- O ile nie zaznaczono inaczej, cały rozdział opiera się na niniejszych referencjach.
Definicja
- Rak prostaty typowo jest rakiem nabłonkowym (gruczolakorakiem) tkanki gruczołu krokowego.
- Znacznie rzadsze są np.:
- rak podstawnokomórkowy
- rak płaskonabłonkowy
- dobrze zróżnicowany guz neuroendokrynny (rakowiak)
- słabo zróżnicowany rak neuroendokrynny (rak drobnokomórkowy).
- Histologicznie należy odróżnić od raka prostaty np.:
- śródnabłonkową neoplazję gruczołu krokowego (prostatic intraepithelial neoplasia – PIN) stanowiącą prekursora raka prostaty
- łagodny rozrost gruczołu krokowego (BPH) i inne, rzadsze hiperplazje.
- Rzadkie są m.in. również:
-
- gruczolistość szkliwiejąca
- gruczolak nefrogenny
- mięsak tkanek miękkich gruczołu krokowego.
-
- Podziału na stadia dokonuje się zgodnie z klasyfikacją TNM (tumor, lymph node, metastasis – guz, węzeł chłonny, przerzut).
- Klasyfikacja według skali oceny Gleasona
- 2 obszary komórek nowotworowych widoczne w próbce tkanki są podzielone na 5 różnych grup zróżnicowania (1 = dobrze zróżnicowany gruczolakorak do 5 = bardzo polimorficzne komórki nowotworowe). Wartości dodane obu obszarów (np. 3 + 4 = 7) dają w efekcie wynik na skali oceny Gleasona.
- Jeśli wynik na skali oceny Gleasona jest poniżej 7, rokowanie jest raczej korzystne. Jeśli jednak wynik jest powyżej 7, to rokowanie jest raczej mniej korzystne.
- Patrz także rozdział ocena prognostyczna.
Epidemiologia
- Nowotwór stercza jest najczęstszym nowotworem u mężczyzn.
- Około 1/4 wszystkich nowotworów u mężczyzn to nowotwory prostaty.
- Roczna zapadalność około 40 na 100 000 mężczyzn.1
- U około 40% mężczyzn w ciągu życia rozwija się nowotwór prostaty.
- Około 10% zachorowań staje się objawowych.
- 3% osób dotkniętych chorobą umiera z jej powodu.
- Wśród śmiertelnych chorób nowotworowych u mężczyzn nowotwór prostaty znajduje się na 3. miejscu, a w populacji ogólnej na 7. miejscu.
- Względny wskaźnik 5–letniego przeżycia wynosi 93%.
Etiologia i patogeneza
- Podstawowym warunkiem jest normalna lub zwiększona produkcja/ekspozycja na androgeny.
- Genetyka
- Występowanie w rodzinie (patrz poniżej).
- Zidentyfikowano szereg czynników genetycznych, które najczęściej występują u mężczyzn z nowotworem prostaty.
- Około 40% ryzyka wystąpienia choroby można wyjaśnić czynnikami genetycznymi.
- Miejscowe procesy zapalne
- Pewną rolę mogą odgrywać przewlekłe procesy zapalne, którym sprzyjają czynniki genetyczne, w tym czynniki epigenetyczne, rakotwórcze i wolne rodniki.
- Choroby przenoszone drogą płciową oraz zapalenie gruczołu krokowego zwiększają ryzyko, co przemawia na korzyść hipotezy związanej ze stanem zapalnym.
- Odżywianie
- Ryzyko zwiększa częste spożywanie czerwonego mięsa.
- Możliwe, że ochronnie działają:
- fitoestrogeny (zwłaszcza soja)
- żywność bogata w likopen (np. pomidory).
Czynniki predysponujące
- Wiek jest czynnikiem ryzyka o największym znaczeniu
- Średni wiek zachorowania wynosi 69 lat.
- Występowanie w rodzinie
- Prawdopodobieństwo zachorowania na raka prostaty wzrasta około 2,5 razy, jeśli choruje na niego krewny pierwszego stopnia.
- Jeśli 2 lub więcej krewnych pierwszego stopnia ma nowotwór prostaty, ryzyko rozwoju choroby jest od 5 do 11 razy większe.
- Czynniki geograficzne i etniczne
- Współczynnik chorobowości między 60. a 70. rokiem życia waha się od 70 na 100 000 osób (USA) do 14 na 100 000 osób (Grecja).
- Duże różnice w chorobowości przy porównywaniu różnych grup etnicznych
- Ryzyko jest wyższe u osób pochodzenia afrykańskiego i niższe u osób pochodzenia azjatyckiego niż u osób pochodzenia europejskiego.
- Czynniki stylu życia jako kowarianty (np. dieta, patrz wyżej).
- Substytucja testosteronu.
- Jak dotąd nie udokumentowano zwiększonego ryzyka zachorowania na raka stercza w związku z substytucją testosteronu u hipogonadalnych mężczyzn.
- Jeśli istnieją dowody na hipogonadyzm, pacjent przed substytucją testosteronu powinien poddać się badaniu per rectum i mieć oznaczoną wartość PSA.
- Leczenie testosteronem jest przeciwwskazane między innymi w następujących przypadkach:
- wykryty rak stercza
- PSA >4 ng/ml.
- Więcej szczegółów na temat bieżących badań przesiewowych w kierunku nowotworu prostaty w warunkach substytucji testosteronem można znaleźć w artykule leczenie testosteronem.
ICD–10
- C61 Nowotwór złośliwy gruczołu krokowego.
Diagnostyka
Kryteria diagnostyczne
- Potwierdzenie rozpoznania wyłącznie na podstawie badania histopatologicznego.
Obraz kliniczny
Miejscowo ograniczony
- Podwyższone wartości PSA.
- W badaniu palpacyjnym stercza (per rectum) można wyczuć stwardnienia lub guzki (25–35% guzów można wykryć palpacyjnie).2
- Zazwyczaj brak objawów klinicznych.
Miejscowo zaawansowany
- Mogą wystąpić dolegliwości typowe dla łagodnego rozrostu gruczołu krokowego, takie jak: częstomocz, osłabiony strumień moczu, nykturia, uczucie niepełnego opróżniania pęcherza moczowego, itd.
- Dolegliwości bólowe w podbrzuszu.
- Podwyższone wartości PSA.
- Ewentualnie wyczuwalny w badaniu per rectum guz.
Przerzuty
- Bóle kostne.
- Osłabienie.
- Nudności.
- Niedokrwistość.
- Objawy miejscowo zaawansowanego nowotworu stercza (patrz wyżej).
- Gorączka, nocne poty.
- Utrata masy ciała.
Wczesne wykrywanie i badania przesiewowe
- Jeśli jest powód, by poinformować pacjenta o badaniach mających na celu wczesne wykrycie nowotworu gruczołu krokowego, należy dokładnie wyjaśnić zalety i wady tych badań, w szczególności poinformować o miarodajności wyników ujemnych i dodatnich, nadwykrywalności i ewentualnych dalszych działaniach, które mogą być konieczne.
- Mężczyznom, którzy po otrzymaniu tych informacji będą chcieli poddać się badaniu w ramach wczesnej diagnostyki, należy zaproponować oznaczenie PSA.
- Dodatkowo można przeprowadzić badanie per rectum.
Zalecenia dla lekarzy rodzinnych
- Pacjentowi, który życzy sobie przeprowadzenie badań przesiewowych w kierunku raka stercza, należy przedstawić możliwe korzyści, jak również ryzyko związane z badaniem PSA (nadwykrywalność i niepotrzebne leczenie).
Wyniki międzynarodowych badań przesiewowych3-10
- Metaanaliza randomizowanych badań kontrolowanych (RCT) dotyczących badań przesiewowych w kierunku nowotworu stercza przy pomocy badania PSA, które obejmowały 341 351 pacjentów w wieku 50–74 lat, z kontrolą przebiegu po 7–15 latach, doprowadziła do następujących wniosków:11
- Badania przesiewowe w kierunku nowotworu gruczołu krokowego nie są w stanie w znaczącym stopniu ograniczyć śmiertelności ogólnej ani śmiertelności z powodu nowotworu gruczołu krokowego.
- Osiągnięcie ewentualnej korzyści z przeprowadzonych badań przesiewowych w kierunku nowotworu gruczołu krokowego zajmuje więcej niż 10 lat. Pacjentów z przewidywaną długością życia <10–15 lat należy poinformować o tym, że badania przesiewowe nie zapewniają im żadnych korzyści i niosą ze sobą istotne ryzyko.
- W metaanalizie uwzględniono istotne badania europejskie i amerykańskie.
- W dalszym ciągu nie ma żadnych miarodajnych danych dotyczących ewentualnych szkód związanych z badaniami przesiewowymi (nadwykrywalność i niewłaściwe leczenie).
- W dotychczasowych badaniach kohortowych z okresem obserwacji 9–14 lat uzyskano różne wyniki w zależności od badanej populacji i metodologii:12
- Bezwzględne zmniejszenie ryzyka: 0,11–1,07 zgonów na 1000 mężczyzn.
- Liczba osób, u których należy wykonać badanie (number needed to test — NNT), aby uniknąć 1 zgonu z powodu nowotworu gruczołu krokowego: 293–1410 mężczyzn.
- Liczba nowotworów gruczołu krokowego, które trzeba wykryć i leczyć, aby zapobiec 1 zgonowi: 12–48.
- Analiza kosztów i korzyści:13
- badanie przesiewowe PSA co 4 lata u mężczyzn w wieku 55–69 lat
- aktywne monitorowanie nowotworów złośliwych niskiego ryzyka.
- Sposób oceny szeroko zakrojonych badań przesiewowych PSA w dalszym ciągu budzi kontrowersje.
Podwyższona wartość PSA
- PSA nie jest specyficzne dla nowotworu stercza, a podwyższona wartość PSA nie zawsze świadczy o chorobie nowotworowej.
- Najczęstszą przyczyną podwyższonego stężenia PSA jest łagodny rozrost gruczołu krokowego (BPH). Mężczyźni z nowotworem stercza bez współistniejącego BPH mają większe ryzyko rozrostu zewnątrztorebkowego.
- Umiarkowanie podwyższony poziom PSA może być spowodowany łagodnym rozrostem gruczołu krokowego lub zakażeniem układu moczowego – dlatego pomiar należy powtórzyć.
- W jaki sposób wartość PSA koreluje z częstością występowania raka?
- Przeprowadzono duże badanie na grupie zdrowych mężczyzn w wieku 62–91 lat. U mężczyzn, u których poziom PSA utrzymywał się poniżej 4,0 ng/ml w ciągu 7–letniego okresu obserwacji, uzyskano następujący procentowy wskaźnik nowotworów gruczołu krokowego, rozpoznanych na podstawie wykonanej na koniec badania biopsji:14
- PSA <1,0 ng ml: 8,8%
- PSA 1,1–2,0 ng/ml: 17%
- PSA 2,1–3,0 ng/ml: 23,9%
- PSA 3,1–4,0 ng/ml: 26,9%.
- Zaawansowany rak prostaty (skala oceny Gleasona ≧ 7) został wykryty z następującą częstością występowania (%):
- PSA <1,0 ng ml: 0,9%
- PSA 1,1–2,0 ng/ml: 2,0%
- PSA 2,1–3,0 ng/ml: 4,6%
- PSA 3,1–4,0 ng/ml: 6,7%.
- W przypadku negatywnego wyniku badania per rectum i wartości PSA wynoszącej 4,1–10 ng/ml, nowotwór prostaty występuje w 25% wszystkich przypadków; w przypadku wartości PSA >10 ng/ml, nowotwór prostaty występuje w co najmniej 50% wszystkich przypadków.
- Przeprowadzono duże badanie na grupie zdrowych mężczyzn w wieku 62–91 lat. U mężczyzn, u których poziom PSA utrzymywał się poniżej 4,0 ng/ml w ciągu 7–letniego okresu obserwacji, uzyskano następujący procentowy wskaźnik nowotworów gruczołu krokowego, rozpoznanych na podstawie wykonanej na koniec badania biopsji:14
Stosunek wolnego PSA do całkowitego PSA
- Kolejnym kryterium przy podejmowaniu decyzji o ewentualnej biopsji gruczołu krokowego jest określenie stosunku PSA wolnego do PSA całkowitego (fPSA/tPSA).
- PSA, który dostaje się do krwi przy BPH, to głównie wolny PSA. U mężczyzn z wysokim stosunkiem wolnego do całkowitego PSA (około >0,24; wartość graniczna zależy od metody pomiaru) ryzyko istotnego klinicznie nowotworu gruczołu krokowego jest stosunkowo niskie.
- Jeśli nieznacznie podwyższonej wartości całkowitego PSA towarzyszą wyniki wskazujące na niskie ryzyko, sugeruje to podejście polegające na uważnej obserwacji.
Wzrost PSA
- Szybki wzrost stężenia PSA może świadczyć o nowotworze gruczołu krokowego.
- Nie ma stałych wartości progowych, a raczej zakres wartości progowych między 0,35 ng/ml a 0,75 ng/ml na rok.
- Wzrost o ponad 2 ng/ml na rok wiąże się ze zwiększoną śmiertelnością.
Diagnostyka różnicowa
Miejscowo ograniczony
Miejscowo zaawansowany
- Inne przyczyny niedrożności podpęcherzowej:
- łagodny rozrost gruczołu krokowego
- niedrożność szyi pęcherza moczowego
- zwężenie cewki moczowej.
- Choroby pęcherza:
- zakażenie układu moczowego
- niestabilność mięśnia wypieracza
- zmniejszona kurczliwość pęcherza moczowego
- rak pęcherza moczowego
- kamica nerek
- uchyłki pęcherza moczowego
- w przypadku nadreaktywności pęcherza moczowego
- zaburzenia neurologiczne
- zaburzenia metaboliczne (np. cukrzyca)
- czynniki psychiczne
- niewydolność serca z nykturią
- leki (np. diuretyki).
- Rak odbytnicy.
Przerzuty
- Polimialgia reumatyczna.
- Rwa kulszowa.
- Inne przyczyny niedokrwistości.
Wywiad lekarski
Miejscowo ograniczony
- Zazwyczaj nie powoduje żadnych objawów.
- Niektórzy pacjenci szukają porady z powodu obciążonego wywiadu rodzinnego.
Miejscowo zaawansowany
- Zaburzenia mikcji u 70% pacjentów.
- Zatrzymanie moczu u 25% pacjentów.
- Hematuria u 5% pacjentów.
Przerzuty
- Ogólne objawy, np.:
- U 30% pacjentów pierwsze objawy powodują przerzuty w kościach.
- Ostry ból pleców u 15%.
- Nefropatia zaporowa z mocznicą (u 5% pacjentów), możliwe objawy:
- zapach mocznicowy (foetor uraemicus)
- świąd
- brak apetytu
- nudności/wymioty
- drżenie
- osłabienie mięśni, skurcze mięśni
- zaburzenia krzepnięcia (dysfunkcja płytek krwi)
- ból w klatce piersiowej (zapalenie osierdzia)
- zaburzenia świadomości
- zespół niespokojnych nóg.
Badanie fizykalne
- W przypadku podejrzenia raka prostaty należy wykonać badanie per rectum.
Miejscowo ograniczony
- Zazwyczaj bez objawów klinicznych.
- Gruczoł krokowy jest prawidłowy lub wyczuwalne jest niewielkie stwardnienie. Większość raków zlokalizowana jest w strefie obwodowej gruczołu krokowego, dlatego możliwa jest palpacja guza.
Miejscowo zaawansowany
- Wyczuwalny:
- nieregularna powierzchnia
- asymetria gruczołu i jego konsystencja
- „przyklejona” błona śluzowa odbytnicy.
- Powtarzalność badania per rectum jest niska nawet u doświadczonych klinicystów.
- Dodatnia wartość predykcyjna
- Stosunkowo niska, ale zależy od stadium guza i wartości PSA.
- W przypadku podejrzanych wyników badania per rectum i wartości PSA 4–10 ng/ml, w około 40% wszystkich przypadków mamy do czynienia z rakiem prostaty; w przypadku wartości PSA >10 w późniejszej biopsji raka prostaty wykrywa się w około 70% wszystkich przypadków.
- W kończynach dolnych może wystąpić obrzęk spowodowany miejscową niedrożnością limfatyczną.
Badania uzupełniające w gabinecie lekarza rodzinnego
- Badanie moczu.
- Badanie krwi: kreatynina w surowicy i PSA (w razie potrzeby dalsze parametry takie jak morfologia krwi, parametry stanu zapalnego, krzepnięcia, elektrolity itp.).
PSA
- Trafność
- Czułość badania PSA jest wysoka przy niskiej swoistości w identyfikacji pacjentów z rakiem stercza.
- Wykonanie badania jest zalecane, jeśli istnieje kliniczne podejrzenie nowotworu prostaty.
- Przy podejrzanych wynikach badania palpacyjnego.
- W przypadku trudności w mikcji i objawów ze strony dolnych dróg moczowych u mężczyzn w wieku poniżej 70 lat.
- Szczegółowe informacje można znaleźć w artykule podwyższona wartość PSA.
- Mężczyźni, którzy udają się do lekarza na badania kontrolne, w tym na badanie gruczołu krokowego, powinni zostać poinformowani o możliwych konsekwencjach przed wykonaniem badania PSA.
Diagnostyka specjalistyczna (dostępna w AOS)
Diagnostyka obrazowa
- Badanie ultrasonograficzne transrektalne.
- Wieloparametryczny rezonans magnetyczny (mpRMI).
Biopsja
- W kontekście wczesnego wykrywania, biopsja gruczołu krokowego powinna być zalecana, jeśli występuje co najmniej 1 z poniższych kryteriów:
- wartość PSA na poziomie ≥4 ng/ml podczas wstępnej konsultacji przesiewowej, z uwzględnieniem czynników mających potencjalny wpływ na poziom PSA
- podejrzenie raka w wyniku badania per rectum
- obserwowany wzrost stężenia PSA (bez zmiany metody oznaczania).
- Przed podjęciem decyzji o wykonaniu biopsji pacjent powinien zostać poinformowany przez lekarza o potencjalnych korzyściach, ryzyku i konsekwencjach biopsji gruczołu krokowego.
- W następujących konstelacjach wyników należy zalecić powtórną biopsję w ciągu 6 miesięcy (IIb/A):
- wykrycie śródnabłonkowego nowotworu gruczołu krokowego wysokiego stopnia (high–grade PIN) w co najmniej 4 próbkach tkanek
- atypowy rozrost drobnozrazikowy (atypical small acinar proliferation – ASAP)
- izolowany wewnątrzprzewodowy rak stercza (IDC–P)
- podejrzana wartość PSA lub istotny wzrost wartości PSA.
- Przed każdą kolejną biopsją lekarz i pacjent powinni ponownie omówić potencjalne korzyści, ryzyko i konsekwencje.
- Działania niepożądane biopsji:
- miejscowy ból
- objawy ze strony układu moczowego
- często przemijające, niewielkie krwawienia odbytnicze, hematuria i obecność krwi w nasieniu o różnym nasileniu
- w razie potrzeby przed zabiegiem należy odstawić antykoagulanty (po oszacowaniu ryzyka krwawienia i ryzyka zatorowo–zakrzepowego)
- zakażenia (około 5%)
- ryzyko urosepsy.
Ocena prognostyczna
- W ocenie prognostycznej raka stercza należy brać pod uwagę 3 następujące parametry:
- skalę oceny Gleasona
- kategorię TNM
- marginesy resekcji chirurgicznej raka.
- Dla oszacowania rokowania nie powinno się w ramach rutynowej opieki wykonywać badań dodatkowych wykraczających poza patomorfologię, np.:
- biologia molekularna
- immunohistochemia
- cytometria.
- Zgodnie z uproszczonym systemem klasyfikacji Międzynarodowego Towarzystwa Patologii Urologicznej (International Society of Urological Pathology – ISUP) oba składniki skali oceny Gleasona można przeliczyć na ocenę rokowania:15
- skala Gleasona 3 + 3 = 6: grupa I. stopnia rokowania (ISUP 1)
- skala Gleasona 3 + 4 = 7: grupa II. stopnia rokowania (ISUP 2)
- skala Gleasona 4 + 3 = 7: grupa III. stopnia rokowania (ISUP 3)
- skala Gleasona 8: grupa IV. stopnia rokowania (ISUP 4)
- skala Gleasona 9–10: grupa V. stopnia rokowania (ISUP 5).
Ocena stopnia zaawansowania
- Ocena stopnia zaawansowania miejscowego nowotworu (stopień T), przerzutów do węzłów chłonnych (stopień N) i przerzutów odległych (stopień M).
- Oceny stopnia zaawansowania guza dokonuje urolog za pomocą palpacji, biopsji pod kontrolą transrektalnego badania USG gruczołu krokowego, a w zależności od wyników ewentualnie także RM, TK, PET lub scyntygrafii kości (badania obrazowe niedostępne w POZ).
- Ocenę stopnia zajęcia węzłów chłonnych przeprowadza się przed ewentualnym leczeniem radykalnym.
- W razie potrzeby scyntygrafia kości (diagnostyka przerzutów w kościach).
- W razie potrzeby ocena czynności nerek:
- kreatynina/klirens
- USG nerek
- ewentualnie urografia (badanie niedostępne w POZ).
- Ewentualnie TK/RM lub PET, np. do wykrywania przerzutów do węzłów chłonnych i kości.
Wskazania do skierowania do specjalisty
Lista kontrolna przy skierowaniu do specjalisty
- W Polsce leczenie raka stercza prowadzone jest przez urologa lub onkologa.
Rak prostaty
- Cel skierowania
- diagnostyka (biopsja)
- ewentualnie ocena stopnia zaawansowania, rokowanie i planowanie terapii.
- Wywiad lekarski
- początek i czas trwania – na czym opiera się rozpoznanie
- objawy ze strony dolnych dróg moczowych: zaburzenia oddawania moczu, nietrzymanie moczu, ból, hematuria
- inne zaburzenia
- wywiad rodzinny: rak stercza w rodzinie
- regularne przyjmowanie leków.
- Badanie fizykalne
- ogólny stan fizyczny
- gruczoł krokowy: powiększenie, guzy, konsystencja, odgraniczenie.
- Badanie uzupełniające
- wartość PSA, co najmniej 2 oznaczenia
- kreatynina, eGFR.
Leczenie
Cele leczenia
- Wyleczenie choroby nowotworowej lub
- Opieka wspomagająca i paliatywna, np.:
- łagodzenie miejscowych objawów ze strony dolnych dróg moczowych
- zapobieganie uszkodzeniom nerek
- łagodzenie objawów ogólnych.
Ogólne informacje o leczeniu
- Leczenie nowotworu stercza zależy od stadium klinicznego (TNM), liczby dodatnich wyników biopsji, stadium histologicznego (skala oceny Gleasona), wartości PSA oraz wieku lub oczekiwanej długości życia pacjenta.
Zalecenia dla pacjentów
- Poradnictwo w zakresie zdrowego trybu życia u mężczyzn (IV/A). Należy poruszyć następujące zagadnienia:
- dieta
- zaprzestanie palenia
- sytuacja psychospołeczna
- aktywność fizyczna
- w badaniu obserwacyjnym wysoki poziom aktywności fizycznej po wykryciu raka prostaty poprawiał rokowanie zarówno w odniesieniu do ogólnej śmiertelności, jak i śmiertelności z powodu raka prostaty.16
Radykalna prostatektomia lub podejście uważnej obserwacji w przypadku wczesnego stadium raka gruczołu krokowego
- Nie potwierdzono jednoznacznie korzyści z radykalnej prostatektomii we wczesnym stadium nowotworu
- Indywidualna decyzja oparta na ryzyku progresji.
- Aktywny nadzór
- Obejmuje ścisłe monitorowanie pacjenta i terapię ukierunkowaną na wyleczenie w przypadku wystąpienia oznak progresji.
- Strategia ta jest odpowiednia dla pacjentów, u których ryzyko dalszej progresji choroby jest niewielkie.
- Wybór takiego postępowania nie musi prowadzić do skrócenia czasu przeżycia w tej grupie chorych.
- Uważna obserwacja (watchful waiting)
- U pacjentów, których przewidywana dalsza długość życia wynosi mniej niż 10 lat, należy omówić wyniki długoterminowej obserwacji mającej wpływ na wybór tej formy postępowania i zasady terapii objawowej stosowanej w miejsce leczenia ukierunkowanego na wyleczenie (III/A).
Aktywny nadzór (active surveillance)
- Kryteria wyboru strategii aktywnego nadzoru:
- PSA ≤10 ng/ml
- skala oceny Gleasona ≤6
- stopień zaawansowania nowotworu cT1 i cT2a
- biopsja: maksymalnie 2 dodatnie wyniki z co najmniej 10–12 cylindrów wykrawających
- zmiany złośliwe w mniej niż 50% próbki biopsyjnej normalnej długości.
- Przy ustalaniu wskazań do strategii aktywnego nadzoru należy wziąć pod uwagę wiek i choroby współwystępujące.
- RM i ewentualnie biopsja (badania niedostępne w POZ)
- U pacjentów, u których rozważa się aktywny nadzór jako opcję postępowania, należy przed podjęciem decyzji wykonać badanie mpRM spełniające aktualne standardy jakości.
- W przypadku stwierdzenia w RM podejrzanych obszarów (PI–RADS 3–5) należy je poddać celowanej biopsji.
- Program nadzoru
- Kontrola stężenia PSA oraz badanie per rectum co 3 miesiące przez 2 lata.
- Jeśli w tym czasie wartość PSA pozostaje stabilna, kolejne oznaczenia należy wykonywać co 6 miesięcy.
- Należy powtórzyć biopsję.
- U pacjentów, u których wykonano początkowe RM i biopsję systematyczną oraz, jeśli to konieczne, biopsję celowaną, przed włączeniem do aktywnego nadzoru należy powtórzyć biopsję wraz z RM oraz wykonać biopsją systematyczną po 12 miesiącach.
- U pacjentów, u których nie wykonano początkowego RM, przed włączeniem do aktywnego nadzoru należy wykonać RM i biopsję systematyczną oraz, jeśli to konieczne, biopsję celowaną w ciągu 6 miesięcy.
- Biopsję należy następnie wykonywać co 12–18 miesięcy przez pierwsze 3 lata, a później co 3 lata, jeśli wyniki badań są stabilne.
- Początek leczenia (koniec aktywnego nadzoru)
- Zakończenie aktywnego nadzoru należy zalecić, jeśli pacjent nie spełnia już kryteriów włączenia do tego postępowania lub wartość PSA podwaja się przez okres krótszy niż 3 lata.
Aktywne leczenie ukierunkowane na wyleczenie
- Prostatektomia radykalna.
- Przezskórna terapia radiacyjna.
- Terapia hormonalna (ablacja androgenowa, także terapia deprywacji androgenów).
- Brachyterapia.
- Ogniskowe metody terapii.
Prostatektomia radykalna
Guzy ograniczone miejscowo
- Podstawowa opcja leczenia u pacjentów z klinicznie ograniczonym miejscowo rakiem prostaty niezależnie od grupy ryzyka.
- Pacjentów należy poinformować, że w prospektywnym randomizowanym badaniu u pacjentów z guzem klinicznie ograniczonym miejscowo (T1b–T2 N0 M0), wartością PSA poniżej 50 ng/ml i przewidywaną dalszą długością życia wynoszącą co najmniej 10 lat wykazano, że radykalna prostatektomia znacząco zmniejsza częstość progresji choroby, ryzyko wystąpienia przerzutów odległych, śmiertelność z powodu raka gruczołu krokowego i śmiertelność z dowolnej przyczyny w porównaniu ze strategią „uważnej obserwacji”.
- Pacjentów należy poinformować o możliwości wykonania radykalnej prostatektomii zachowującej potencję i ograniczeniach tej metody.
- Prostatektomię radykalną powinni wykonywać doświadczeni chirurdzy.
- Kryterium doświadczenia obejmuje wykonywanie co najmniej 50 prostatektomii w danym ośrodku rocznie i co najmniej 25 prostatektomii rocznie przez danego chirurga, a także odpowiedni program szkoleń.
Guzy miejscowo zaawansowane
- Radykalna prostatektomia jest podstawową opcją leczenia pacjentów z miejscowo zaawansowanym nowotworem prostaty.
- Pacjentów z miejscowo zaawansowanym rakiem gruczołu krokowego i planowaną terapią miejscową należy poinformować o zaletach i wadach zarówno radykalnej prostatektomii z limfadenektomią, jak i terapii radiacyjnej, w razie potrzeby uzupełnioną ograniczoną w czasie hormonalną terapią ablacyjną.
- Pacjentów z rakiem prostaty wysokiego ryzyka, którzy chcą poddać się radykalnej prostatektomii, należy poinformować o zwiększonym ryzyku dodatnich marginesów chirurgicznych po prostatektomii radykalnej i ryzyku nawrotu choroby, a także o dodatkowych działaniach, które często są w związku z tym konieczne (np. hormonalna terapia ablacyjna, radioterapia).
- Leczenie chirurgiczne wymaga hospitalizacji przez 1–2 tygodnie i jest wykonywane w większości oddziałów urologicznych.
- Do działań niepożądanych po operacji należą zaburzenia erekcji (u około 70%) oraz nietrzymanie moczu (do 30%).
Przezskórna radioterapia
- Pacjentów, u których wskazana jest radykalna radioterapia z powodu raka prostaty, należy poinformować o ryzyku wystąpienia nowotworu wywołanego promieniowaniem.
Pierwotna przezskórna radioterapia
- Przezskórna radioterapia jest podstawową opcją leczenia miejscowo ograniczonego raka prostaty niezależnie od grupy ryzyka.
- W połączeniu z długotrwałą hormonalną terapią ablacyjną, trwającą co najmniej 24, a najlepiej 36 miesięcy, przezskórna radioterapia jest opcją leczenia również u pacjentów z miejscowo zaawansowanym nowotworem prostaty.
- U pacjentów z miejscowo ograniczonym rakiem prostaty wysokiego ryzyka
- Stosować adjuwantową hormonalną terapię ablacyjną jako uzupełnienie przezskórnej radioterapii. Można ją rozpocząć nawet 6 miesięcy przed radioterapią.
Adjuwantowa przezskórna radioterapia
- Pooperacyjna radioterapia (60–64 Gy) po prostatektomii radykalnej i osiągnięciu zdefiniowanego zerowego stężenia PSA. Wskazanie jest ograniczone do określonych grup ryzyka, w oparciu o stadium zaawansowania guza i ryzyko progresji według skali oceny Gleasona lub ISUP.
- Podczas informowania pacjenta o adjuwantowej radioterapii, należy wspomnieć o alternatywnej opcji przezskórnej radioterapii, o ile wartość PSA przekroczyła zdefiniowany zakres zerowy.
- Chorym z nowotworem prostaty z przerzutami do węzłów chłonnych po prostatektomii radykalnej i limfadenektomii można zaproponować adjuwantową radioterapię miednicznych dróg spływu chłonki w połączeniu z hormonalną terapią ablacyjną.
- Częstymi działaniami niepożądanymi po zewnętrznym napromienianiu są zaburzenia erekcji, które jednak występują później i rzadziej niż po prostatektomii chirurgicznej, oraz zapalenie odbytnicy.17
- Więcej informacji na temat leczenia tych działań niepożądanych można znaleźć w sekcji opieka wspomagająca i paliatywna.
- W badaniu porównawczym leczenia chirurgicznego i radioterapii, w którym skupiono się na działaniach niepożądanych innych niż zaburzenia erekcji i nietrzymanie moczu, wykazano, że działania niepożądane były częstsze w przypadku radioterapii.17
- Radioterapia pooperacyjna poprawia rokowanie w miejscowo zaawansowanym nowotworze stercza.
Brachyterapia
- Źródła promieniowania (implanty) wszczepia się do prostaty. Pozwala to na leczenie prostaty stosunkowo dużymi dawkami promieniowania bez uszkodzenia innych narządów.18
- Stałe implanty w wariancie niskiej mocy dawki (Low Dose Rate – LDR).
- Tymczasowe implanty w wariancie wysokiej mocy dawki (High Dose Rate – HDR).
Terapia ogniskowa18
- Leczone są tylko części prostaty zajęte przez nowotwór.
- Postępowanie
- Krioterapia
- Polega na niszczeniu komórek nowotworowych przy pomocy zamrażania.
- Prostatę zamraża się za pomocą gazu, który wprowadza się przezskórnie do prostaty przez cienkie igły.
- Hipertermia
- Ogrzewanie obszaru docelowego do temperatury powyżej 42°C ma na celu wzmocnienie działania radioterapii lub chemioterapii, podawanej przed zabiegiem lub po nim.
- Skoncentrowane ultradźwięki o wysokiej intensywności (HIFU)
- Dzięki wiązce fal dźwiękowych w obszarze docelowym osiąga się temperaturę do 90°C.
- Celowana terapia fotodynamiczna ukierunkowana na naczynia (VTP) z użyciem padeliporfinu
- Światło lasera aktywuje wprowadzoną wcześniej dożylnie substancję fotouczulającą, padeliporfin. Wywołuje to martwicę tkanek w obszarze docelowym.
- Nieodwracalna elektroporacja
- Podawanie krótkich, silnych impulsów prądowych poprzez mikroelektrody niszczy komórki nowotworowe w obszarze docelowym.
- Ogniskowa terapia radiacyjna
- ablacja prądem o częstotliwości radiowej (RFA)
- radioterapia stereotaktyczna (SBRT)
- brachyterapia ogniskowa (patrz wyżej).
- Krioterapia
- Ocena
- Nie wykazano równoważności żadnej z tych procedur z postępowaniem standardowym.
- Brak jest danych porównawczych dotyczących skuteczności, bezpieczeństwa i tolerancji różnych zabiegów ogniskowych.
- VTP z padeliporfinem jest jedyną procedurą ogniskową, której skuteczność i bezpieczeństwo wykazano w randomizowanym badaniu kontrolowanym w leczeniu raka stercza niskiego ryzyka w porównaniu z aktywnym nadzorem.19
- Nie ma wystarczających danych do oceny skuteczności i bezpieczeństwa wszystkich innych terapii ogniskowych.
Leczenie nawrotów
- Uważna obserwacja
- Jako opcja u pacjentów z nawrotem PSA i korzystnymi kryteriami prognostycznymi (czas podwojenia PSA >12 miesięcy), skala oceny Gleasona <8, tj.>ISUP.
- U wszystkich pozostałych pacjentów można rozważyć 1 z następujących procedur:
- przezskórna ratunkowa raioterapia (SRT), w razie potrzeby w połączeniu z terapią deprywacji androgenów (ADT)
- prostatektomia ratunkowa
- terapia HIFU (patrz wyżej).
Opieka wspomagająca i paliatywna
- Leczenie łagodzące objawy, np.:
- Przywrócenie witalności fizycznej i psychicznej, np. leczenie:
- niedrożności przewodu pokarmowego (zwiększone ryzyko zwłaszcza w przypadku raka prostaty)
- niedożywienia i odwodnienia
- lęku
- depresji
- majaczenia.
- Przywrócenie zdolności do uczestnictwa w życiu społecznym.
- O ile pacjent jest jeszcze czynny zawodowo: utrzymanie lub przywrócenie zdolności do pracy (rehabilitacja).
- Nawet w chorobie nieuleczalnej należy zalecać rehabilitację ukierunkowaną na objawy.
Planowanie leczenia
- Możliwości terapii paliatywnej należy wszechstronnie i odpowiednio wcześnie omówić z chorym i jego bliskimi. Należą do nich:
- Informacje o wszystkich dostępnych opcjach opieki, np. grupy samopomocy, opieka ambulatoryjna/stacjonarna.
- Informacje o wszystkich metodach leczenia.
- Przygotowanie kompleksowego planu leczenia uwzględniającego osobiste preferencje pacjenta.
- Strategię postępowania medycznego należy ustalić w sposób interdyscyplinarny.
- Do dyspozycji chorego powinien być interdyscyplinarny zespół terapeutyczny, w tym specjaliści przeszkoleni w zakresie opieki psychospołecznej, psychoonkologicznej i medycyny paliatywnej.
- Należy regularnie oceniać dolegliwości fizyczne i psychiczne, takie jak lęk, niepokój, depresja, duszność, osłabienie i zmęczenie oraz zapewnić odpowiednią opiekę i leczenie.
Terapia paliatywna bólu
- Leczenie farmakologiczne bólu związanego z nowotworem powinno być oparte na drabinie analgetycznej WHO:
- leki nieopioidowe (ewentualnie z adiuwantami/koanalgetykami)
- słabe opioidy (ewentualnie z adiuwantami/koanalgetykami i/lub lekami nieopioidowymi)
- silne opioidy (ewentualnie z adiuwantami/koanalgetykami i/lub lekami nieopioidowymi).
- W ramach paliatywnej terapii bólu należy rozważyć również działania niefarmakologiczne:
- środki fizykalne (np. pozycjonowanie, drenaż limfatyczny, opieka aktywizująca)
- środki psychospołeczne (wsparcie psychologiczne, w razie potrzeby opieka duszpasterska).
- Więcej informacji na temat poszczególnych opcji terapii bólu, patrz również paliatywna terapia bólu.
Przerzuty do kości
- Terapia paliatywna bólu.
- Miejscowa radioterapia przezskórna
- Stosować w następujących sytuacjach:
- utrzymujący się zlokalizowany ból kości
- ryzyko ucisku na rdzeń kręgowy (w razie potrzeby po interwencji chirurgicznej)
- po stabilizacji chirurgicznej
- zwiększone ryzyko złamań.
- Stosować w następujących sytuacjach:
- Interwencja chirurgiczna
- Zazwyczaj w połączeniu z radioterapią.
- Bisfosfonian lub denosumab
- Aby zapobiec powikłaniom w przerzutach kostnych w stadium opornym na kastrację należy zaproponować przeciwciało monoklonalne denosumab lub należący do grupy bisfosfonianów kwas zoledronowy; należy przy tym poinformować pacjenta o potencjalnych wadach i korzyściach tych leków.
- Aby zapobiec martwicy kości szczęki i żuchwy, przed podaniem bisfosfonianów lub denosumabu powinno odbyć się badanie stomatologiczne i ewentualne konieczne leczenie stomatologiczne, a także instruktaż i motywacja pacjenta do utrzymania wysokich standardów higieny jamy ustnej.
- Bisfosfonianów nie należy stosować w profilaktyce powikłań w przerzutach kostnych w stadium wrażliwym na hormonoterapię.
- Obecnie nie można ocenić działania denosumabu w tym stadium.
- Aby zapobiec powikłaniom w przerzutach kostnych w stadium opornym na kastrację należy zaproponować przeciwciało monoklonalne denosumab lub należący do grupy bisfosfonianów kwas zoledronowy; należy przy tym poinformować pacjenta o potencjalnych wadach i korzyściach tych leków.
- Radionuklidy
- Można je stosować w terapii bólu w mnogich przerzutach kostnych w stadium opornym na kastrację.
- Terapia radem–223 prowadzi do wydłużenia czasu przeżycia u chorych w dobrym ogólnym stanie fizycznym (ECOG ≤2) bez dowodów na obecność przerzutów trzewnych.
- Jednak w dniu 13. lipca 2018 r. Komitet Oceny Ryzyka w ramach Nadzoru nad Bezpieczeństwem Farmakoterapii (PRAC) Europejskiej Agencji Leków (EMA) opublikował zalecenie dotyczące restrykcyjnego stosowania radu–223.20
- PRAC zaleca, aby rad–223 stosować w przewidzianych wskazaniach tylko wtedy, gdy 2 poprzednie terapie zawiodły lub gdy nie można zastosować innych skutecznych terapii.
- Zalecenie opiera się na retrospektywnej analizie danych z badań sugerujących możliwy związek leczenia radem–223 ze zwiększoną śmiertelnością i częstością złamań.
- W marcu 2018 roku wydano wyraźne ostrzeżenie przed łączeniem radu–223 z octanem abirateronu lub prednizolonem, lub prednizonem, ponieważ w przypadku tego skojarzenia udowodniono ponad wszelką wątpliwość zwiększone ryzyko śmiertelności i złamań.21 Wymienione skojarzenia są zatem przeciwwskazane.
Zaburzenia erekcji
- Jako środek wspomagający w leczeniu zaburzeń erekcji po terapii ukierunkowanej na wyleczenie należy w pierwszej kolejności zastosować inhibitor PDE–5.
- Jeśli to leczenie jest nieskuteczne, należy rozważyć następujące opcje w połączeniu z fizjoterapeutycznym treningiem zaburzeń erekcji, biorąc pod uwagę preferencje pacjenta:
- zastrzyki do ciał jamistych
- prostaglandyny podawane docewkowo (alprostadil – lek niedostępny w Polsce)
- system próżniowy do wspomagania erekcji.
- Jeśli to leczenie jest nieskuteczne, należy rozważyć następujące opcje w połączeniu z fizjoterapeutycznym treningiem zaburzeń erekcji, biorąc pod uwagę preferencje pacjenta:
- U chorych po operacji z obustronnym zachowaniem nerwów nie wykazano wyższości stosowania inhibitorów PDE–5 co wieczór nad stosowaniem doraźnym (I–III).
- Więcej szczegółów na temat wymienionych opcji leczenia można znaleźć w artykule zaburzenia erekcji.
Nietrzymanie moczu
- Pooperacyjne nietrzymanie moczu po radykalnej prostatektomii należy leczyć z zastosowaniem podejścia multimodalnego.
- W przypadku wysiłkowego nietrzymania moczu głównym punktem treningu kontynencji powinna być fizjoterapia.
- Inne formy nietrzymania moczu należy ocenić i w razie potrzeby odpowiednio leczyć.
- Nie przeprowadzono jeszcze odpowiednich badań skuteczności pojedynczych lub łączonych metod leczenia nietrzymania moczu po prostatektomii radykalnej. Dotyczy to m.in. następujących metod:22
- trening mięśni dna miednicy z biofeedbackiem lub bez
- elektrostymulacja
- pozaustrojowa stymulacja magnetyczna
- ucisk dystalnej części cewki moczowej
- zmiany w zachowaniu (np. zachowania związane z piciem, zachowania w toalecie).
Zastój moczu (wodonercze)
- Duże guzy lub przerzuty do węzłów chłonnych mogą zwężać lub naciekać moczowody i prowadzić do zastoju moczu w nerkach (wodonercza).
- W obustronnym zwężeniu, ewentualnie z mocznicą.
- Pacjentów, u których występuje zastój moczu w nerce z powodu wrażliwego na hormony raka stercza, należy zasadniczo leczyć wyłącznie hormonalną terapią ablacyjną.
- U pacjentów z objawowym zastojem moczu należy stosować instrumentalne odprowadzenie moczu.
- Drenaż najlepiej wykonać przezskórnie ze względu na:
- wysoki odsetek niepowodzeń sondowania wstecznego
- częste podrażnienia dolnego odcinka układu moczowego
- suboptymalny drenaż i ryzyko migracji stentu.
- Przed planowanym zabiegiem odprowadzenia moczu należy omówić z pacjentem, a w razie potrzeby także z jego bliskimi, możliwość wykonania tego zabiegu, jego zalety i wady oraz możliwe powikłania.
- W przypadku wskazania do odprowadzenia moczu u chorych z opornym na kastrację nowotworem prostaty i obustronną niedrożnością moczowodów, należy wziąć pod uwagę, że oczekiwana dalsza długość życia tych chorych jest krótka.
- W ciągu pierwszego miesiąca po odprowadzeniu moczu należy kilkukrotnie wykonać badania kontrolne.
- Następnie badania kontrolne wykonywać co miesiąc.
- Drenaż najlepiej wykonać przezskórnie ze względu na:
Zapalenie odbytnicy po radioterapii
- Ostre zapalenie odbytnicy można leczyć miejscowo, stosując:
- sukralfat (niedostępny w Polsce) lub
- maślan sodu lub
- hydrokortyzon.
- Leczenie biegunki należy leczyć objawowo.
- Więcej informacji można znaleźć w artykule uszkodzenie popromienne jelita.
Niedokrwistość
- W większości jatrogenna (ciężka postać u około 13% pacjentów z całkowitą blokadą androgenów):
- w przypadku niedokrwistości objawowej, w razie potrzeby transfuzja krwi
- ewentualnie substancje stymulujące erytropoezę (np. erytropoetyna) po dokładnym rozważeniu ryzyka.
Terapia hormonalna
- Ablacja androgenowa (deprywacja androgenów, supresja androgenowa) ma na celu zahamowanie (przez antyandrogeny) lub całkowite zablokowanie (przez kastrację chirurgiczną lub farmakologiczną) stymulacji androgenowej raka prostaty.
- Wzrost guza zostaje zahamowany nawet u 80% pacjentów.
- Działanie paliatywne jest dobrze udowodnione.
- Leczenie łagodzi np. objawy miejscowe i ból kości.
- Jeśli pacjent i lekarz zdecydują się na terapię ukierunkowaną na wyleczenie (patrz wyżej), pacjenta należy poinformować o uważnej obserwacji (watchful waiting) z zależną od objawów interwencją paliatywną oraz o natychmiastowej hormonalnej terapii ablacyjnej. Należy poinformować pacjenta w szczególności o:
- paliatywnym charakterze obu opcji
- działaniach niepożądanych związanych z hormonalną terapią ablacyjną
- wydłużeniu przeżycia wolnego od progresji dzięki natychmiastowej hormonalnej terapii ablacyjnej, ale niespójnych danych dotyczących przeżycia całkowitego.
- Pacjentom poddanym terapii deprywacji hormonalnej należy zalecić działania rehabilitacyjne obejmujące elementy kinezyterapii.
Leki
- Analogi GnRH
- Do analogów GnRH zalicza się goserelinę, buserelinę (niedostępna w Polsce) i leuprorelinę.
- Leczenie powoduje supresję aktywności komórek Leydiga, dzięki czemu można osiągnąć poziom testosteronu w surowicy odpowiadający poziomowi po kastracji chirurgicznej.
- Leczenie może przejściowo nasilić objawy, ponieważ początkowo prowadzi do wzrostu poziomu testosteronu.
- U pacjentów z dużym obciążeniem nowotworowym takie leczenie należy w pierwszych 4 tygodniach uzupełnić o antyandrogeny: bikalutamid lub flutamid.
- Dodatkowe podanie docetakselu na początku terapii hormonalnej może znacząco zwiększyć przeżycie. Jednak wiąże się to również ze zwiększoną częstością występowania działań niepożądanych.
- Estrogeny
- Nie są już stosowane do ablacji androgenowej w raku prostaty ze względu na ryzyko powikłań sercowo–naczyniowych.
- Ryzyko powikłań jest najwyższe przy stosowaniu estrogenów doustnych.
- Estrogeny i progesteron można rozważyć w leczeniu uderzeń gorąca związanych z kastracją.
- Możliwa alternatywa: klonidyna lub leki przeciwdepresyjne.
- Antyandrogeny (niesteroidowi antagoniści receptora androgenowego).
- Często stosowane w połączeniu z analogami GnRH w profilaktyce nawrotów w ciągu pierwszego miesiąca.
- Pierwsza generacja: bikalutamid, flutamid.
- Druga generacja: apalutamid, darolutamid, enzalutamid.
- Tolerancja
- W znacznym stopniu niwelują działania niepożądane po kastracji, takie jak uderzenia gorąca, zaburzenia funkcji seksualnych i osłabienie sprawności. Jedynym wyjątkiem jest ginekomastia, która występuje bardzo często pod wpływem antyandrogenów.
- Profilaktyczna radioterapia (pojedyncza frakcja) brodawek sutkowych może zmniejszyć ryzyko wystąpienia ginekomastii. Tamoksyfen lub inhibitory aromatazy mogą być również skuteczne, ale nie są dopuszczone do stosowania w tym wskazaniu (zastosowanie poza wskazaniami rejestracyjnymi, off label).
Miejscowo zaawansowany nowotwór prostaty
- Podstawowe opcje leczenia:
- prostatektomia radykalna
- przezskórna radioterapia w połączeniu z hormonalną terapią ablacyjną
- guzy kategorii klinicznej cT3: brachyterapia wysokodawkowa w połączeniu z przezskórną radioterapią.
Hormonowrażliwy, przerzutowy nowotwór gruczołu krokowego
- Terapia paliatywna, w zależności od stadium nowotworu, ogólnego stanu fizycznego i preferencji pacjenta
- deprywacja androgenów, ewentualnie w połączeniu z:
- terapią hormonalną apalutamidem lub enzalutamidem
- chemoterapią z zastosowaniem docetakselu.
- deprywacja androgenów, ewentualnie w połączeniu z:
Nowotwór gruczołu krokowego androgenoniezależny
- Androgenoniezależny (oporny na kastrację) nowotwór prostaty postępuje również przy niskim poziomie testosteronu.
- Obecnie nie ma dostępnej terapii ukierunkowanej na wyleczenie choroby.
Planowanie leczenia
- Przy wyborze terapii należy wziąć pod uwagę następujące czynniki (IV/A):
- objawy
- działania niepożądane poszczególnych opcji leczenia
- preferencje pacjenta
- choroby współistniejące, oczekiwana dalsza długość życia i jakość życia
- dynamika progresji
- lokalizacja przerzutów i ogólne obciążenie nowotworem.
- Jak dotąd nie wyznaczono żadnych konkretnych wartości progowych jako kryterium kwalifikacji do chemoterapii.
- Pacjenci z podwyższonym wynikiem oceny w skali sprawności ECOG (ECOG ≥2) lub obniżonym wynikiem oceny w skali sprawności Karnofsky'ego (<70%) oraz pacjenci z ograniczeniami w ocenie geriatrycznej zwykle kwalifikują się do leczenia tylko w ograniczonym stopniu.
- Ocena geriatryczna ułatwia podjęcie decyzji przed rozpoczęciem terapii swoistej dla danego nowotworu u obarczonych wielochorobowością chorych w wieku powyżej 70 lat.
Choroba przerzutowa, bezobjawowa lub skąpoobjawowa i postępująca
- Progresja w czasie leczenia ADT: rozważyć zmianę leczenia.
- Jeśli pacjent odrzucił podejście wyczekujące i preferuje zmianę leczenia, należy zaproponować 1 z następujących opcji:
- abirateron (w połączeniu z prednizonem/prednizolonem) lub enzalutamid
- docetaksel.
Choroba przerzutowa, objawowa i postępująca
- Pacjentom w dobrym ogólnym stanie fizycznym należy zaproponować terapię ogólnoustrojową, w razie potrzeby w połączeniu z terapią ukierunkowaną na objawy i wspomagającą.
- Pacjentom z postępującą chorobą i obniżonym ogólnym stanem fizycznym (ECOG ≥2, skala Karnofsky'ego <70) należy zaproponować terapię ukierunkowaną na objawy.
- Jako terapię pierwszego rzutu można również zaproponować jedną z następujących opcji terapeutycznych:
- abirateron
- chemoterapia, jeśli obniżony ogólny stan fizyczny jest spowodowany głównie przerzutowym rakiem stercza
- enzalutamid
- steroidy (deksametazon, prednizolon, prednizon).
Strategia postępowania po wstępnej terapii co najmniej 1 nową substancją hormonalną
- W przypadku progresji:
- Należy zaproponować zmianę strategii leczenia.
- Należy zaproponować badanie na obecność mutacji BRCA1/2.
- W przypadku wykrycia mutacji BRCA1/2 należy zaproponować terapię olaparibem.
Strategia postępowania po terapii docetakselem
- W przypadku progresji choroby można w zależności od ogólnego stanu fizycznego rozważyć zastosowanie następujących metod leczenia w połączeniu z terapią ukierunkowaną na objawy i wspomagającą:
- abirateron (w połączeniu z prednizonem/prednizolonem)
- enzalutamid
- kabazytaksel
- w przypadku przerzutów w kościach
- terapia radionuklidowa z użyciem radu–223 (przeciwwskazania i aktualne informacje dotyczące bezpieczeństwa, patrz sekcja przerzuty kostne – radionuklidy)
- bisfosfoniany lub denosumab (samodzielnie lub dodatkowo do 1 z powyższych opcji)
- chemoterapia
- steroidy (deksametazon, prednizolon, prednizon).
Zapobieganie
- Poradnictwo w zakresie zdrowego trybu życia u mężczyzn. Należy poruszyć następujące zagadnienia:
- dieta
- zaprzestanie palenia
- sytuacja psychospołeczna
- aktywność fizyczna.
- Inhibitory 5–alfa–reduktazy (finasteryd, dutasteryd)
- U mężczyzn przyjmujących inhibitory 5–alfa–reduktazy rzadziej występowały zmiany nowotworowe i przednowotworowe prostaty.
- Dotychczas nie potwierdzono ich wpływu na śmiertelność z powodu nowotworu ani śmiertelność ogólną.
- Inhibitory 5–alfa–reduktazy obniżają poziom PSA.
- Selen czy witamina E nie wykazują żadnego działania przeciwdziałającego rakowi prostaty.
- Przypuszcza się, że przyjmowanie suplementów witaminy E może nawet zwiększyć ryzyko nowotworu prostaty w dłuższej perspektywie.23
Przebieg, powikłania i rokowanie
Przebieg
- W raku prostaty naturalny przebieg choroby jest bardzo zmienny.
- Duże znaczenie ma histologia guza; u pacjentów z guzami słabo zróżnicowanymi często dochodzi do stosunkowo szybkiej progresji choroby.
- Rozsiew ma charakter zarówno limfogenny, jak i hematogenny.
- W przypadku rozsiewu limfogennego w pierwszej kolejności zajęte są biodrowe węzły chłonne.
- Rozsiew hematogenny dotyczy głównie kości oraz w mniejszym stopniu płuc i wątroby.
- Przerzuty kostne w większości przypadków mają charakter osteosklerotyczny; złamania patologiczne są więc rzadkie.
Powikłania
- Przerzuty:
- przerzuty kostne w miednicy i kręgosłupie
- ucisk nerwów lub rdzenia kręgowego, najczęściej spowodowany przerzutami do kręgosłupa
- przerzuty w wątrobie i płucach.
- przerzuty kostne w miednicy i kręgosłupie
- Niedrożność cewki moczowej lub moczowodu.
- Niedrożność jelita.
- Zastoinowy obrzęk limfatyczny kończyn dolnych (w guzach miejscowo zaawansowanych).
- Niedokrwistość.
- Wodonercze.
Powikłania prostatektomii
- Zaburzenia erekcji występują w około 70% przypadków.
- Nietrzymanie moczu 12 miesięcy po operacji w około 16% przypadków.
- W prowadzonym przez 12 lat badaniu kontrolnym u 41% uczestników wystąpiło nietrzymanie moczu, a u 84% zaburzenia erekcji (u pacjentów objętych „uważną obserwacją” wartości te wynosiły odpowiednio 11% i 80%).23
- Szczegółowe informacje na temat leczenia powikłań przedstawiono w sekcji opieka wspomagająca i paliatywna.
Powikłania terapii antyandrogenowej
- Terapia antyandrogenowa z powodu nowotworu prostaty wiąże się ze zwiększonym ryzykiem choroby Alzheimera (NNH 18) oraz zwiększonym ryzykiem otępienia (NNH 10).24
Rokowanie
- U chorych, którzy przeszli radykalną prostatektomię, guz rozprzestrzenił się w około 50% przypadków przez torebkę gruczołu.
- Wskaźnik przeżycia 5–letniego
- znormalizowany: 93%
- różni się znacznie w zależności od wielkości guza pierwotnego i stopnia zróżnicowania (histologia).
- Wskaźnik przeżycia 10–letniego
- w guzie wewnątrztorebkowym: 91%
- w guzie miejscowo zaawansowanym: 50%
- w guzie z przerzutami: 15%.
- W zależności od stopnia zróżnicowania
- śmiertelność z powodu raka gruczołu krokowego według badania kohortowego w USA z medianą czasu obserwacji 8,3 roku i leczeniem zachowawczym
- dobrze zróżnicowany guz: 8,3%
- umiarkowanie zróżnicowany guz: 9,1%
- słabo zróżnicowany guz: 25,6% (III).25
- śmiertelność z powodu raka gruczołu krokowego według badania kohortowego w USA z medianą czasu obserwacji 8,3 roku i leczeniem zachowawczym
- Rokowanie jest znacznie bardziej niepomyślne u pacjentów w wieku poniżej 55 lat w momencie rozpoznania.
- U ponad 70% chorych z przerzutami można uzyskać dalsze złagodzenie objawów i ewentualnie wydłużenie życia dzięki terapii hormonalnej.
Dalsze postępowanie
- Opieka nad pacjentami z rakiem prostaty odbywa się we współpracy urologów/onkologów i lekarzy rodzinnych.
- U bezobjawowych pacjentów po leczeniu radykalnym w ramach opieki kontrolnej należy stosować oznaczenie PSA w surowicy.
- Po prostatektomii radykalnej wartość PSA >0,2 ng/ml, potwierdzona w co najmniej 2 pomiarach PSA, wskazuje na wznowę biochemiczną.
- Nie jest wymagane bioptyczne potwierdzenie wznowy biochemicznej po prostatektomii radykalnej.
- Po samej radioterapii wznowę biochemiczną oznacza potwierdzony w co najmniej 2 pomiarach wzrost PSA o >2 ng/ml powyżej najniższego stężenia PSA po radioterapii.
- U chorych po radioterapii należy dążyć do bioptycznego potwierdzenia wznowy biochemicznej, z opcją miejscowej terapii nawrotu.
- U chorych z wznową biochemiczną po pierwotnym leczeniu z zamiarem wyleczenia i opcją miejscowej terapii nawrotu, należy dążyć do zróżnicowania nawrotu miejscowego i ogólnoustrojowego na podstawie następujących parametrów:
- czas podwojenia wartości PSA
- okres latencji do pierwotnej terapii z zamiarem wyleczenia
- skala oceny Gleasona,
- Po prostatektomii radykalnej wartość PSA >0,2 ng/ml, potwierdzona w co najmniej 2 pomiarach PSA, wskazuje na wznowę biochemiczną.
- Zalecany plan kontroli po leczeniu miejscowym prowadzonym z zamiarem wyleczenia:
- co 3 miesiące w ciągu pierwszych 2 lat
- co 6 miesięcy w 3. i 4. roku
- co roku począwszy od 5. roku.
- Pacjentów, u których stężenie PSA wzrasta podczas kontroli u lekarza pierwszego kontaktu, należy ponownie skierować do specjalisty.
- Pacjentów należy skierować natychmiast w przypadku podejrzenia wznowy po wcześniejszym leczeniu z zamiarem wyleczenia.
- Pacjenci objęci „uważną obserwacją”:
- kontrola co 3–4 miesiące
- badanie przedmiotowe i oznaczenie PSA.
- Po radioterapii
- konieczna czujność kliniczna w celu wyjaśnienia krwawienia lub innych objawów ze strony jelit lub układu moczowego rodzących podejrzane raka.
- Sprawdzić:
- PSA
- kreatyninę
- morfologię krwi
- badanie ogólne moczu
- ogólny stan fizyczny
- przy „uważnej obserwacji”: badanie gruczołu krokowego per rectum
- ewentualnie zaburzenia mikcji, np. przy użyciu International Prostate Symptom Score (IPSS).
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Ilustracje
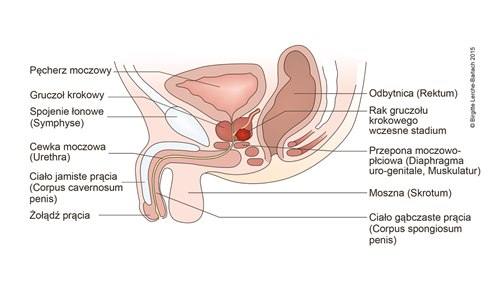
Rak prostaty
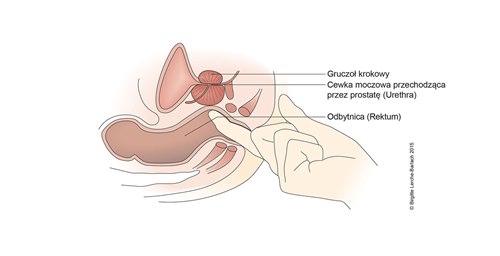
Badanie gruczołu krokowego per rectum
Źródła
Wytyczne
- Fizazi K., Gillessen S. et al. on behalf of the ESMO Guidelines Committee. Updated treatment recommendations for prostate cancer from the ESMO Clinical Practice Guideline considering treatment intensification and use of novel systemic agents (2023), esmo.org
Piśmiennictwo
- Wojciechowska U., Barańska K., Michałek I i in. Nowotwory złośliwe w Polsce w 2022 roku, onkologia.org.pl
- Rak gruczołu krokowego, Interna Szczeklika - mały podręcznik, www.mp.pl
- Andriole G.L., Crawford E.D., Grubb R.L., et al. Prostate cancer screening in the randomized prostate, lung, colorectal, and ovarian cancer screening trial: mortality results after 13 years of follow-up, J Natl Cancer Inst 2012, 104: 125-32, PubMed
- Schröder F.H., Hugosson J., Roobol M.J., et al. Prostate-cancer mortality at 11 years of follow-up, N Engl J Med 2012, 366: 981-90, New England Journal of Medicine
- Schroder F.H., Hugosson J., Roobol M.J., et al. Screening and prostate cancer mortality: results of the European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13 years of follow-up, Lancet. 2014, doi: 10.1016/S0140-6736(14)60525-0, DOI
- Carlsson S., Assel M., Sjoberg D., et al. Influence of blood prostate specific antigen levels at age 60 on benefits and harms of prostate cancer screening: population based cohort study, BMJ 2014; 348: g2296, BMJ (DOI)
- Gelfond J., Choate K., Ankerst D.P., et al. Intermediate-term risk of prostate cancer is directly related to baseline prostate specific antigen: Implications for reducing the burden of prostate specific antigen screening, J Urol 2015 Jul, 194:46, PMID: 25686543, PubMed
- American Urological Association (AUA) Guideline, Early detection of prostate cancer: AUA guideline, 2013, www.ncbi.nlm.nih.gov
- Chou R., Croswell J.M., Dana T., et al. Screening for prostate cancer: A review of the evidence for the US Preventive Services Task Force, Ann Intern Med 2011, 155: 762-71, www.ncbi.nlm.nih.gov
- Ilic D., Neuberger M.M., Djulbegovic M., Dahm P. Screening for prostate cancer. Cochrane Database of Systematic Reviews 2013, Issue 1. Art. No.: CD004720. DOI: 10.1002/14651858.CD004720.pub3, DOI
- Ilic D., Neuberger M.M., Djulbegovic M, Dahm P. Screening for prostate cancer, Cochrane Database of Systematic Reviews 2013, 1: CD004720. DOI: 10.1002/14651858.CD004720.pub3, DOI
- Hugosson J., Carlsson S., Aus G. et al. Mortality results from the Göteborg randomised population-based prostate-cancer screening trial, Lancet Oncol 2010; 11: 725-32, PMID: 20598634, PubMed
- de Carvalho T.M., Heijnsdijk E.A.M., de Koning H.J. Comparative effectiveness of prostate cancer screening between the ages of 55 and 69 years followed by active surveillance, Cancer 2018, 124: 507-13, PMID: 29231973, PubMed
- Thompson I.M., Pauler D.K., Goodman P.J., et al. Prevalence of prostate cancer among men with a prostate-specific antigen level <= 4.0 ng per milliliter, n engl j med 2004, 350: 2239-46, New England Journal of Medicine
- Epstein J.I., Egevad L., Amin M.B. et al. The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma: Definition of Grading Patterns and Proposal for a New Grading System, Am J Surg Pathol 2016, 40: 244-52, PMID: 26492179, PubMed
- Kenfield S.A., Stampfer M.J., Giovannucci E, Chan JM. Physical activity and survival after prostate cancer diagnosis in the health professionals follow-up study, J Clin Oncol 2011, 29: 726-32, PubMed
- Nam R.K., Cheung P., Herschorn S., et al. Incidence of complications other than urinary incontinence or erectile dysfunction after radical prostatectomy or radiotherapy for prostate cancer: a population-based cohort study, Lancet Oncol 2014 Feb, 15(2):,223-31, PubMed
- Ahmed H.U., Hindley R.G., Dickinson L., et al. Focal therapy for localised unifocal and multifocal prostate cancer: a prospective development study, Lancet Oncology 2012, doi:10.1016/S1470-2045(12)70121-3, DOI
- Azzouzi A.R., Vincendeau S., Barret E. et al. Padeliporfin vascular-targeted photodynamic therapy versus active surveillance in men with low-risk prostate cancer (CLIN1001 PCM301): an open-label, phase 3, randomised controlled trial. Lancet Oncol 2017, 18: 181-91, PMID: 28007457, PubMed
- European Medicines Agency. PRAC recommends restricting use of prostate cancer medicine Xofigo, London 2018, 13.07.2018, www.ema.europa.eu
- European Medicines Agency. Prostate cancer medicine Xofigo must not be used with Zytiga and prednisone/prednisolone, London 2018, 09.03.2018, www.ema.europa.eu
- Anderson C.A., Omar M.I., Campbell S.E., et al. Conservative management for postprostatectomy urinary incontinence. Cochrane Database of Syst Rev 2015, 1: CD001843. doi:10.1002/14651858.CD001843.pub5, DOI
- Johansson E., Steineck G., Holmberg L., et al. Long-term quality-of-life outcomes after radical prostatectomy or watchful waiting: the Scandinavian Prostate Cancer Group-4 randomised trial, Lancet Oncol 2011, 12: 891-9, PubMed
- Jayadevappa R., Chhatre S., Malkowicz B., et al. Association Between Androgen Deprivation Therapy Use and Diagnosis of Dementia in Men With Prostate Cancer, JAMA Netw Open 2019, 2: e196562. pmid:31268539, jamanetwork.com
- Lu-Yao G.L., Albertsen P.C., Moore D.F., et al. Outcomes of localized prostate cancer following conservative management, JAMA 2009, 302: 1202-9, www.ncbi.nlm.nih.gov
- European Association of Urology. EAU-ESTRO-SIOG Guidelines on Prostate Cancer, Stand 2021, uroweb.org
- European Society for Medical Oncology. Cancer of the Prostate, Stand 2020, www.esmo.org
- Kotb A.F., Tanguay S., Luz M.A. et al. Relationship between initial PSA density with future PSA kinetics and repeat biopsies in men with prostate cancer on active surveillance, Prostate Cancer Prostatic Dis 2011, 14:53-7, PMID: 20938463, PubMed
- Vickers A.J., Till C., Tangen C.M., et al. An empirical evaluation of guidelines on prostate-specific antigen velocity in prostate cancer detection, J Natl Cancer Inst 2011, 103: 462-9, PubMed
Opracowanie
- Mateusz Szmidt (recenzent)
- Sławomir Chlabicz (redaktor)
- Thomas M. Heim (recenzent/redaktor)
