Informacje ogólne
Definicja
- Międzynarodowe Towarzystwo Badania Bólu (International Association for the Study of Pain – IASP) definiuje ból jako „nieprzyjemne doznanie czuciowe i emocjonalne związane z rzeczywistym lub potencjalnym uszkodzeniem tkanek lub opisywane w kategoriach takiego uszkodzenia”.
- Doświadczanie bólu wymaga świadomości i uwagi i nigdy nie jest wolne od emocjonalnego zabarwienia.
- Rozpoznawanie istotnego klinicznie bólu oraz leczenie i monitorowanie wyników leczenia, jest obowiązkiem wynikającym z przepisów rozporządzenia Ministra Zdrowia dotyczącego standardu organizacyjnego leczenia bólu w warunkach ambulatoryjnych.1
Biopsychospołeczny model bólu
- Ból jest spowodowany interakcją czynników biologicznych i psychospołecznych. Należą do nich np.:
- nocycepcja
- aktywacja obwodowych nerwów czuciowych w wyniku uszkodzenia tkanki
- miejscowe i ogólnoustrojowe czynniki metaboliczne, np. na poziomie:
- mediatorów zapalnych
- hormonów stresu
- układu odpornościowego
- układu endorfinowego
- układu endokannabinoidowego
- modulacja bólu w OUN (bramkowanie):
- czynniki emocjonalne
- oczekiwanie i ocena bólu
- warunkowanie (pamięć bólu).
- nocycepcja
- Czynniki emocjonalne mogą wzmacniać lub zdominować doświadczanie bólu na poziomie ośrodkowego układu nerwowego, np. lęk, depresja.
Ból ostry
- To niemal codzienne doznanie.
- Trwa od kilku sekund do kilku tygodni.
- Zwykle wiąże się z rozpoznawalnymi czynnikami wyzwalającymi, takimi jak awersyjne (nieprzyjemne) i szkodliwe bodźce zewnętrzne lub procesy endogenne (np. nadwyrężenie stawu, stan zapalny).
- Ustaniu egzogennego bodźca lub ustąpieniu endogennego zaburzenia towarzyszy ustąpienie bólu.
Ból przewlekły
- Trwa dłużej niż normalny okres remisji choroby podstawowej.
- „Normalny czas remisji” nie jest jednolicie zdefiniowany.
- Brak rozpoznawalnego sprzężenia z wyzwalaczem
- Rozpoznawalne uszkodzenie nie ma współmiernego związku z odczuwanym bólem.
- Ból wydaje się przekształcać w chorobę samą w sobie, gdy staje się przewlekły.
- Kryterium czasowe
- Powszechnie uznano, że ból można uznać za przewlekły, jeżeli utrzymuje się dłużej niż 3–6 miesięcy.
Epidemiologia
Ból przewlekły
- Współczynnik chorobowości: 15–20%
- Współczynnik chorobowości różni się w zależności od przyczyny i definicji.
- Mniej więcej co 5 osoba odwiedzająca gabinet lekarza rodzinnego zgłasza przewlekły ból, zazwyczaj w różnych lokalizacjach.
- Szczególnie częste są przewlekłe:
- bóle barku i bóle szyi (33–45%)
- bóle pleców (ryzyko zachorowania w ciągu całego życia: 27%)
- z czego około 13% z przewagą komponentu neuropatycznego
- bóle stawów (19–28%).
- Ból neuropatyczny stanowi około 7% wszystkich przewlekłych zaburzeń bólowych.
- Około 13% wszystkich pacjentów z cukrzycą odczuwa ból w wyniku neuropatii cukrzycowej.
- Rozległy przewlekły ból występuje u około 8% populacji. Więcej informacji można znaleźć w artykułach fibromialgia i dolegliwości pod postacią somatyczną.
Inne częste zespoły bólowe
- Ból głowy:
- Ból brzucha:
- Ból zębów i ból żuchwy lub szczęki.
- Ból gardła.
- Ból w nowotworach złośliwych.
Rodzaje bólu
- Klasyfikacja według patomechanizmu.
- Konieczne środki terapeutyczne mogą znacznie różnić się w zależności od dominującej formy bólu i choroby podstawowej lub urazu.
- Następujące 3 rodzaje bólu mogą występować pojedynczo lub równolegle:
- nocyceptywny: somatyczny, trzewny
- neuropatyczny
- ból w zaburzeniach pod postacią somatyczną (ból nocyplastyczny).
Ból nocyceptywny
- Mechaniczne, chemiczne lub termiczne uszkodzenie tkanki prowadzi do bezpośredniego pobudzenia wolnych zakończeń nerwowych (receptorów bólu, nocyceptorów).
- Uwalniane w wyniku tego mediatory zapalne i neuropeptydy prowadzą do miejscowej hiperalgezji.
- Ból somatyczny
- Wywodzi się z nocyceptorów w skórze, tkance łącznej, mięśniach, okostnej.
- Charakterystyka bólu: tępy, wwiercający się, ciągnący, kłujący.
- W większości przypadków dobrze zlokalizowany.
- Ból trzewny
- Wywodzi się z nocyceptorów w otrzewnej, mięśniach narządów wewnętrznych, sercu.
- Często pojawia się w wyniku kompresji, rozciągania, nacieku.
- Charakterystyka bólu: tępy, uciskający, kurczowy.
- Raczej trudny do zlokalizowania.
- Często promieniuje na dermatomy (ból rzutowany).
Ból neuropatyczny
- Uszkodzenie obwodowych lub ośrodkowych struktur neuronalnych prowadzi do upośledzenia transmisji lub do spontanicznego generowania bodźców bólowych.
- Charakterystyka bólu: palący, przeszywający, „jak rażenie prądem”, ciągnący.
- Wrażenia towarzyszące: dyzestezje, parestezje, hipo– lub hiperestezje, allodynia.
- Postaci
- Neuropatie obwodowe w obrębie nerwów obwodowych, jako mono– lub polineuropatie, np.:
- Neuralgia: ból dermatomu w obszarze zaopatrywanym przez jeden lub więcej nerwów lub splotów, np.:
- Ból z ucisku na nerw, np.:
- zespół cieśni nadgarstka
- radikulopatia, np. w uszkodzeniu krążka lędźwiowego.
- Ból neuropatyczny ośrodkowy, np. przy:
- urazach rdzenia kręgowego lub chorobach rdzenia
- stwardnieniu rozsianym
- zespole parkinsonowskim.
- Deaferentacja i ból fantomowy:
- z powodu całkowitego lub częściowego przerwania przewodnictwa nerwowego, np. w wyniku amputacji
- patogeneza związana głównie z ośrodkowym układem nerwowym, z patologicznymi procesami przebudowy na poziomie rdzenia kręgowego i mózgu (neuroplastyczność)
- komponent deaferentacji może być również obecny w innych formach bólu, np. w przypadku radikulopatii z częściową utratą włókien nerwowych.
- Zespół wieloobjawowego bólu miejscowego (complex regional pain syndrome – CRPS): neuropatia z towarzyszącymi objawami głównie wegetatywnymi, np. po urazach:
- typ I: bez uszkodzeń w obrębie układu nerwowego
- typ II: z uszkodzeniem układu nerwowego (kauzalgia).
Ból nocyplastyczny lub ból w zaburzeniach pod postacią somatyczną
- Niejasne rozgraniczenie pojęć bólu „nocyplastycznego”, „pod postacią somatyczną”, „funkcjonalnego” i „idiopatycznego”.
- Ból nocyplastyczny zgodnie z definicją IASP z 2017 roku: „Ból wynikający z zaburzonej nocycepcji, bez jednoznacznych dowodów na istniejące lub grożące uszkodzenie tkanek, które aktywuje obwodowe nocyceptory i bez dowodów na chorobę powodującą ból lub uszkodzenie układu somatosensorycznego”.2
- Zaburzenia pod postacią somatyczną oznaczają, że nie można ustalić organicznej przyczyny dolegliwości.
- Im więcej miejsc, w których odczuwany jest ból i im częściej się one zmieniają, tym większe jest prawdopodobieństwo wysokiego udziału czynników psychospołecznych w rozwoju bólu.
- Ból pod postacią somatyczną jest niezależnym obrazem klinicznym, podtypem zaburzenia pod postacią somatyczną.
- Pacjenci z bólem pod postacią somatyczną zwykle odczuwają znaczny stres psychiczny.
- Ból może również występować jako dominujący objaw innego zaburzenia psychicznego, np.:
- Na percepcję i filtrowanie bólu w mózgu zawsze wpływają procesy emocjonalne i poznawcze, nawet w przypadku wyraźnie nocyceptywnej lub neuropatycznej przyczyny bólu.
- Orientacyjny podział na ból organiczny i ból pod postacią somatyczną (nocyplastyczny) może być zatem uzasadniony jedynie ze względów pragmatycznych.
- Wobec wszystkich pacjentów z bólem niezbędne jest podejście integralne, biopsychospołeczne.
- Kluczową rolę w chronifikacji bólu odgrywają złożone interakcje psychoneurologiczne.
Trudności diagnostyczne
- Pacjenci zgłaszający ból zazwyczaj go odczuwają.
- Rzadko udają, że odczuwają ból lub samodzielnie go wywołują.
- Jak na przykład w zespole Münchhausena.
- Nasilony ból zgłaszany przez pacjentów, np. podczas ubiegania się o świadczenie rentowe, jest często bardzo trudny do odróżnienia od bólu o wysokiej intensywności.
- Nie wszyscy pacjenci odczuwający ból go zgłaszają.
- Błędna ocena może wynikać z upośledzenia funkcji poznawczych i zdolności do komunikacji werbalnej, np. w otępieniu.
- Niewerbalna manifestacja bólu i innych nieprzyjemnych odczuć, takich jak lęk, głód lub nudności, może być podobna.
- U pacjentów z otępieniem ból może wyzwalać albo nasilać zaburzenia zachowania i objawy psychiczne. Ból jako podstawowa przyczyna jest często nierozpoznany.
- Więcej informacji można znaleźć w artykule ocena i kontrola bólu w otępieniu.
- Różne przyczyny i rodzaje bólu – nocyceptywny, neuropatyczny, nocyplastyczny/pod postacią somatyczną – wymagają odmiennego podejścia do terapii.
- Decydujące znaczenie dla powodzenia terapii ma więc jak najdokładniejsza diagnostyka.
ICD–10
- F45.0 Zaburzenie z somatyzacją.
- F45.4 Uporczywe bóle psychogenne.
- F45.40 Uporczywe zaburzenie bólowe pod postacią somatyczną.
- F45.41 Przewlekłe zaburzenie bólowe z czynnikami somatycznymi i psychicznymi.
- F45.4 Uporczywe bóle psychogenne.
- R52 Ból niesklasyfikowany gdzie indziej.
- R52.0 Ból ostry.
- R52.1 Przewlekły ból nieustępujący.
- R52.2 Inny ból przewlekły.
- R52.9 Ból, nieokreślony.
- G50–G59 Zaburzenia obejmujące nerwy, korzenie nerwów rdzeniowych i sploty nerwowe.
- G60–G64 Polineuropatie i inne zaburzenia obwodowego układu nerwowego.
Diagnostyka różnicowa
- Ból należy zawsze interpretować jako potencjalny sygnał ostrzegawczy przed zagrożeniami, którym można zapobiec, takimi jak:
- nowotwór złośliwy
- proces zapalny
- złamanie
- zakażenie
- ucisk nerwu
- przedawkowanie leku.
Procedury diagnostyczne
- Należy unikać powtarzania badań: warto zebrać wyniki poprzednio wykonanych badań.
- W przypadku nawracającego i długotrwałego bólu: koordynowanie diagnostyki prowadzonej w zespole interdyscyplinarnym.
- Podstawą diagnostyki i przypisania określonego rodzaju bólu do mechanizmu go wywołującego, jest obszerny wywiad.
- Wywiad jest ważniejszy niż badanie przedmiotowe i znacznie ważniejszy niż badania dodatkowe z wykorzystaniem aparatury diagnostycznej.
- Ból odczuwany przez pacjentów, jego charakter i nasilenie, często nie korelują z zakresem uszkodzeń narządów stwierdzonych w badaniu przedmiotowym i w badaniach z wykorzystaniem urządzeń medycznych.
- Należy unikać przedwczesnego organiczno–medycznego rozpoznania przyczyny bólu.
- Takie rozpoznania mogą utwierdzać pacjentów z zaburzeniami bólowymi pod postacią somatyczną w ich niechęci do psychospołecznego podejścia terapeutycznego i sprzyjać psychofizjologicznym mechanizmom chronifikacji.
Wywiad
Informacje ogólne
- Obserwacja pacjenta podczas rozmowy:
- Postawa ciała.
- Czy ruchy, mimika i gesty odpowiadają opisowi bólu?
- Czy objawy zmieniają się w chwilach napięcia emocjonalnego?
- Które pytania wywołują poruszenie emocjonalne?
- Czy podczas opisywania negatywnych i pozytywnych doświadczeń pacjent okazuje adekwatne emocje?
Opis bólu
Umiejscowienie bólu
- Należy poprosić o pokazanie dokładnej lokalizacji i obszaru promieniowania bólu.
- Ewentualnie poprosić o narysowanie ich na schemacie ciała.
- Gdzie ból jest najsilniejszy?
- Neuralgia może być zazwyczaj bardzo precyzyjnie zlokalizowana przez chorego.
- W ośrodkowym bólu wzgórzowym bolesny jest dla pacjenta kwadrant ciała albo cała połowa ciała.
- Zespoły uciskowe korzeni nerwowych zwykle promieniują do dermatomów kończyny górnej lub dolnej.
- Nie zawsze objęty jest cały dermatom.
- Promieniowanie może sięgać np. tylko do łydki.
- Jednak przekroczenie granic dermatomu zwykle wskazuje na promieniowanie rzekomokorzeniowe, np. zespół mięśnia gruszkowatego lub chorobę zwyrodnieniową stawów kręgowych.
- W CRPS (zespół wieloobjawowego bólu miejscowego) występuje większe nasilenie objawów w okolicy dystalnej, niezależnie od lokalizacji pierwotnego urazu.
- W przypadku bólu związanego z układem współczulnym, ból może obejmować całą kończynę lub kwadrant ciała.
- Ból o różnym i zmiennym umiejscowieniu
- zazwyczaj zaburzenie bólowe pod postacią somatyczną lub depresja
- sporadycznie polineuropatia lub neuroborelioza
- rozproszone umiejscowienie bólu w wielu lokalizacjach (panalgesia) jest charakterystycznym objawem chronifikacji.
Zależność od wysiłku
- Chromanie przestankowe w PAD: zmniejszenie nasilenia bólu po zatrzymaniu się („choroba wystaw sklepowych”).
- Chromanie przestankowe rdzeniowe w stenozie kanału kręgowego: zmniejszenie nasilenia bólu podczas siedzenia i przodozgięcia.
- Nieswoisty ból pleców zwykle ustępuje w trakcie odpoczynku.
Czas trwania bólu
- Ból napadowy?
- Ból ciągły?
- Obydwa typy łącznie?
- Liczba dni bez bólu w miesiącu
- Decydujące kryterium szczególnie przy bólu głowy.
- W typowej neuralgii, np. nerwobólu nerwu trójdzielnego napady bólu trwające tylko ułamki sekund (tic doloreux).
- Zmiany neurogenne: przeważnie ból ciągły z dodatkowymi napadami lub bez nich.
Pora dnia
- Ból w przebiegu chorób zapalnych i mięśniowych jest często mniej dokuczliwy w nocy niż w ciągu dnia (odciążenie).
- W przypadku bólu neurogennego jest odwrotnie.
- Bóle w okolicy kręgosłupa o maksymalnym nasileniu w nocy mogą również wskazywać na guzy lub przerzuty.
Początek i rozwój bólu
- Nagły czy stopniowy początek?
- Nagłe czy stopniowe nasilenie bólu na przestrzeni lat?
- Od kiedy ból jest tak silny jak obecnie?
- Stopniowe lub nagłe zmiany jakości lub lokalizacji bólu w przebiegu choroby
- Nagła zmiana jakości lub promieniowania bólu może być sygnałem alarmowym nowej, potencjalnie niebezpiecznej przyczyny bólu, np. guza mózgu, krwotoku wewnątrzczaszkowego, wypadnięcie krążka międzykręgowego, miejscowego zakażenia, bólu paranowotworowego.
- Neuralgie i uciski korzeni nerwowych
- Zwykle intensywny ból o nagłym początku.
- Nieswoisty ból pleców
- Zwykle nasila się stopniowo i skokowo.
- Początek bólu często przed wieloma laty i zwykle nie można go dokładnie określić po wielu latach przyjmowania leków przeciwbólowych.
- Ból neurogenny i ból w przebiegu choroby kręgosłupa lub nowotworu
- Zwykle nasila się z czasem.
- Nawracający przebieg ze stopniowym nasilaniem się objawów – charakterystyczny dla chorób ogólnoustrojowych, np.:
- kolagenozy
- osteoporozy.
- Wcześniejsze (spontaniczne) remisje?
- Ważne z punktu widzenia oceny skuteczności terapii.
Charakterystyka bólu
- Ból neuropatyczny, np.:
- przeszywający
- parzący
- piekący
- nasilający się pod wpływem dotyku.
- Pulsująco–tętniący, np.:
- migrena
- ból zapalny (np. w zapaleniu stawów).
- Mrowiące parestezje albo zaburzenia czucia, np.:
- polineuropatie zapalne
- polineuropatie.
- Ból prowokowany: ból już przy lekkim dotyku lub bodźcach termicznych
- typowy dla neuralgii popółpaścowej lub pourazowej.
Natężenie bólu
- Znany wcześniej ból jako czynnik porównawczy, np. ból po ekstrakcji zęba lub ostrym urazie.
- Numeryczna, wizualna lub werbalna skala analogowa od 0 do 10
- Wybór skali ma drugorzędne znaczenie.
- W wielu sytuacjach sprawdza się także uproszczona klasyfikacja od 0 = brak bólu do 3 = bardzo silny ból.
Objawy towarzyszące
- Zależność od wysiłku?
- Zależne od bólu?
- Związek czasowy z przyjmowaniem leków?
- Cechy wskazujące na chorobę ogólnoustrojową:
- internistyczne (np. reumatyczne, kolagenoza)
- onkologiczne (ból paranowotworowy?)
- neurologiczne (np. stwardnienie rozsiane)
- psychiczne (np. depresja).
- Mogą ułatwić przypisanie bólu do zmian, które można zlokalizować.
- Uszkodzenia korzeni nerwowych:
- zaniki odruchów
- zaburzenia czuciowe
- porażenia.
- Migrena:
- nudności i wymioty
- światłowstręt
- nadwrażliwość na dźwięki
- Klasterowy ból głowy:
- jednostronna ptoza
- łzawienie
- wyciek z nosa.
- CRPS:
- zmiana barwy skóry
- obrzęk
- utrata siły
- charakterystyczne zaburzenia koordynacji.
- Polineuropatia:
- zmniejszone czucie powierzchowne
- upośledzone odczuwanie wibracji.
- Ból mięśni i kręgów:
- postawa spoczynkowa i unikająca z określonymi zaburzeniami statyki: blokada stawu krzyżowo–biodrowego z zaburzeniami barku po przeciwnej stronie.
- Objawy odległe od uszkodzeń spowodowane złożonymi, zaburzonymi sekwencjami ruchów
- np. epicondylitis radialis z powodu używania nieodpowiednich kul łokciowych.
- Ogólne i wegetatywne objawy towarzyszące:
- nudności i wymioty (migrena)
- zaburzenia snu (np. polineuropatia, ból nowotworowy)
- brak apetytu (np. choroby nowotworowe).
Choroby wcześniejsze i współistniejące
- Choroby, które mogą powodować ból lub wpływać na jego przebieg, to np.:
- cukrzyca
- polineuropatie
- choroby nowotworowe
- zaburzenia endokrynologiczne, np. zaburzenia czynności tarczycy
- choroby metaboliczne, np. dyslipidemia
- zaburzenia autoimmunologiczne np.: reumatoidalne zapalenie stawów, łuszczycowe zapalenie stawów, kolagenozy.
- Choroby i niewydolność narządów należy uwzględnić w leczeniu farmakologicznym ze względu na to, że mogą stanowić przeciwwskazania lub wymagać dostosowania dawki lub rodzaju leków. Odnośne choroby i zaburzenia obejmują np.:
- niewydolność nerek
- zaburzenia czynności wątroby
- astmę
- jaskrę
- rozrost gruczołu krokowego
- zaparcia
- uzależnienie od alkoholu lub inne uzależnienia.
Wcześniejsze leczenie
- Należy zapytać o wszystkie wcześniejsze terapie farmakologiczne i niefarmakologiczne oraz prowadzoną rehabilitację.
- Zakończone powodzeniem czy niepowodzeniem?
- Wywiad dotyczący przyjmowanych leków u pacjentów z bólem przewlekłym i częstymi niepowodzeniami leczenia
Informacje o pacjentach
Życiorys i zawód
- Podstawowe informacje na temat biografii, sytuacji osobistej i zawodowej.
- Społeczny wpływ choroby na relacje z bliskimi osobami.
- Pozytywne skutki choroby?
- Aktywności w pracy i czasie wolnym, których pacjent nie jest już w stanie wykonywać z powodu choroby.
- Wpływ na sytuację zawodową i finansową.
- Wcześniejsza emerytura?
- Powody?
- Niezdolność do pracy – od jak dawna?
- Liczba dni nieobecności z powodu bólu w ciągu ostatnich 6 miesięcy?
- Charakterystyka pracy:
- stres fizyczny i psychiczny
- zagrożenia w miejscu pracy (np. przez maszyny, pojazdy).
- Perspektywy w pracy? (np. umowa o pracę na czas nieokreślony)
- Czy pacjenci mogą kontynuować zatrudnienie nawet z ograniczeniami fizycznymi?
- Dotychczasowe środki rehabilitacji i reintegracji: zakończone powodzeniem czy niepowodzeniem?
- Bezrobocie: od jak dawna i z jakich powodów?
- Toczące się postępowanie emerytalne lub odszkodowawcze?
- Odszkodowanie po wypadku?
- Spór sądowy z dotychczasowym pracodawcą?
- Ubezpieczenie dodatkowe, np. ubezpieczenie od niezdolności do pracy?
- Czy pacjent został zmuszony do przejścia na emeryturę przez osobę trzecią?
Postrzeganie choroby i oczekiwania pacjentów dotyczące powrotu do zdrowia
- „Jak Pan/Pani sądzi, jaka jest przyczyna Pana/Pani bólu?“
- „Jaki wpływ ma, Pana/Pani zdaniem, stres fizyczny?”
- „Jaki wpływ ma, Pana/Pani zdaniem, stres psychiczny?”
- Z jakich źródeł korzystali pacjenci przy formułowaniu swoich opinii?
- Należy poinformować o wiarygodności różnych źródeł (np. Internetu).
- Nierealistycznie wysokie oczekiwania dotyczące leczenia korelują z mniej korzystnym rokowaniem.
Standaryzowane kwestionariusze
- Mogą stanowić uzupełnienie wywiadu lekarskiego u pacjentów z bólem.
- Następujące instrumenty zostały zwalidowane w różnych obszarach diagnostycznych i sprawdziły się w praktyce:
- Pain Disability Index (PID).
- Ustrukturyzowany wywiad dotyczący bólu przewlekłego (SICS).
- Dzienniczek bólu prowadzony przez 1 tydzień – dokumentowanie:
-
- nasilenia (liczbowa skala oceny): 1–10
- czasu trwania
- leków
- aktywności
- nastroju
- ograniczeń w funkcjonowaniu.
Badanie fizykalne
- Szczegółowe informacje na temat badania przedmiotowego można znaleźć w artykułach dotyczących poszczególnych chorób powodujących ból.
- Badanie fizykalne:
- Ukierunkowane na dolegliwości, w tym objawy towarzyszące (patrz wyżej), i zależne od wcześniejszych badań.
- Szczególnie w przypadku różnicowania diagnostycznego między bólem nocyceptywnym a neuropatycznym konieczne jest przeprowadzenie orientacyjnego lub bardziej szczegółowego badania, w zależności od obszaru układu nerwowego, w którym występuje ból.
- Badanie czucia (dotyk, temperatura, wibracje) .
- Odruchy.
- Motoryka (siła, koordynacja).
- Czynność nerwów czaszkowych.
- Obserwacja zachowań (np. zachowania unikające).
- Badania czynnościowe (np. badanie ruchomości) w celu udokumentowania wartości wyjściowych do kontroli przebiegu.
Badania uzupełniające
Badania laboratoryjne
- W zależności od choroby podstawowej; więcej szczegółów można znaleźć w odpowiednich artykułach.
Badania obrazowe
- Z reguły nie są konieczne, tylko np. w podejrzeniu:
- potencjalnie niebezpiecznego przebiegu, którego można uniknąć
- choroby, która może wymagać leczenia inwazyjnego, np. nowotworu złośliwego
- procesu chorobowego w mózgu lub rdzeniu kręgowym.
Środki i zalecenia
Diagnostyka specjalistyczna
- Badanie neurofizjologiczne
- dodatnie wyniki mogą potwierdzać neuropatię
- jednak ujemne wyniki jej nie wykluczają.
- Biopsja skóry
- do wczesnego wykrywania uszkodzeń nerwów w niektórych chorobach neurologicznych, np. neuropatii małych włókien (więcej szczegółów w artykule neuropatie obwodowe)
- przy dodatnim wyniku ewentualnie również do celów kontroli przebiegu.
Wskazania do skierowania do specjalisty
- W podejrzeniu podstawowej choroby ogólnoustrojowej – skierowanie na przykład do:
- neurologa
- endokrynologa
- reumatologa
- diabetologa
- ortopedy.
- Jeżeli wyraźne rozróżnienie między bólem neuropatycznym a nocyceptywnym nie jest możliwe ze względu na obraz kliniczny (neurolog).
- W przypadku zaawansowanej chronifikacji: leczenie w zespole interdyscyplinarnym
- lekarze różnych specjalizacji, np. anestezjolog i neurolog
- psychiatra
- ewentualnie fizjoterapeuta.
- W razie konieczności przeprowadzenia inwazyjnej diagnostyki lub terapii.
- W złożonych przypadkach i/lub niepowodzeniach dotychczasowej terapii należy skierować pacjenta do poradni leczenia bólu.
Lista kontrolna w przypadku skierowania do specjalisty
Ból
- Cel skierowania
- Potwierdzenie rozpoznania?
- Leczenie?
- Planowanie dalszego postępowania w zespole interdyscyplinarnym?
- Wywiad
- Zależność od wysiłku?
- Zależne od bólu?
- Związek czasowy z przyjmowaniem leków?
- Cechy wskazujące na chorobę ogólnoustrojową: onkologiczną, neurologiczną, endokrynologiczną, reumatologiczną, psychiczną
- farmakologiczne
- niefarmakologiczne
- rehabilitacja i reintegracja
- skutki zaburzeń bólowych.
- Emerytura/renta lub postępowanie odszkodowawcze?
- Perspektywy?
- Czas trwania i przebieg? Progresja?
- Umiejscowienie, intensywność i rodzaj bólu?
- Promieniowanie?
- Zmiana podczas obciążenia lub w zależności od pory dnia?
- Objawy towarzyszące
- współistniejące i wcześniejsze choroby, somatyczne i psychiczne
- wcześniejsze leczenie
- sytuacja życiowa i zawodowa.
-
- Podobne dolegliwości u innych członków rodziny?
- Ocena punktowa na podstawie standaryzowanych kwestionariuszy.
- Badanie fizykalne
- Ogólny stan fizyczny?
- Stan neurologiczny?
- Badania uzupełniające
- Ewentualnie badania obrazowe.
- W podejrzeniu choroby ogólnoustrojowej
- odpowiednie wyniki badań laboratoryjnych
- ewentualnie wyniki badań z użyciem aparatury.
Wskazania do hospitalizacji
- Sytuacja zagrożenia życia (uraz, ostra dekompensacja choroby narządowej).
- W przewlekłym bólu w celu intensyfikacji:
- leczenia interdyscyplinarnego
- terapii multimodalnej
- rehabilitacji.
Podstawowe zasady leczenia
- Głównie ukierunkowane na przyczynę i mechanizm bólu
- Aby uzyskać bardziej szczegółowe informacje na temat leczenia bólu, należy zapoznać się z odpowiednimi artykułami dotyczącymi choroby podstawowej powodującej ból, np.:
- Ból neuropatyczny reaguje na terapie o innych mechanizmach działania niż ból nocyceptywny; więcej szczegółów można znaleźć w artykule ból neuropatyczny.
- Ból pod postacią somatyczną również wymaga innego podejścia niż ból nocyceptywny.
- Zobacz artykuł dolegliwości pod postacią somatyczną.
- Większość poniższych informacji dotyczy bólu z przewagą komponentu nocyceptywnego.
- Należy zwrócić uwagę na wiek pacjenta i choroby współistniejące.
- W przypadku osób starszych i pacjentów z otępieniem należy wziąć pod uwagę specyfikę związaną z wiekiem i chorobą; więcej informacji można znaleźć w artykule ocena bólu i kontrola bólu w otępieniu.
- Często wskazane jest połączenie metod niefarmakologicznych i farmakologicznych.
- W szczególności w bólu przewlekłym przed przepisaniem leków powinno się wyczerpać możliwości stosowania środków niefarmakologicznych.
- W ostrym bólu leki mogą być konieczne jako pierwsze działanie zapewniające szybką ulgę.
- Aktywne zaangażowanie pacjentów wzmacnia ważne czynniki odporności psychicznej
- niezależność
- doświadczenia związane z poczuciem własnej sprawczości.
Postępowanie lecznicze
- Indywidualny plan leczenia
- Sformułowanie celów wspólnie z pacjentem:
- łagodzenie bólu, np. poprawa o 30% w bólu ocenianym za pomocą skali analogowej
- jakość życia
- funkcjonowanie
- nastrój
- uczestnictwo w życiu społecznym, prywatnym i zawodowym
- ograniczenie spożycia leków przeciwbólowych.
- Włączenie pacjenta w podejmowanie decyzji
- omówienie z pacjentem możliwych korzyści i ryzyka związanych z terapią, np. opioidami, w porównaniu z innymi opcjami leczenia farmakologicznego, a także z opcjami leczenia niefarmakologicznego.
- Sformułowanie celów wspólnie z pacjentem:
- Ustrukturyzowana opieka nad pacjentem
- Regularne spotkania w celu monitorowania przebiegu i, w razie potrzeby, dostosowanie terapii.
Metody niefarmakologiczne
- Działania aktywujące, np. gimnastyka, joga, pilates, pływanie.
- Ewentualnie trening czynnościowy: fizjoterapia, ergoterapia.
- Rozmowy wspierające przynoszące ulgę i podtrzymujące na duchu.
- Psychoterapia (np. terapia poznawczo–behawioralna, hipnoterapia, psychoterapia ciała, terapia tańcem/muzyką/sztuką).
- Techniki relaksacyjne i unikanie stresu (np. relaksacja mięśni według Jacobsona, trening autogenny, medytacja).
- Metody fizykalne:
- terapia zimnem
- terapia ciepłem
- kąpiele
- leczenie bodźcami (np. akupunktura/akupresura, moksa, refleksologia, bańki, pijawki)
- masaż i terapia manualna
- zastosowanie radonu3
- skuteczność najlepiej udowodniona w chorobach zapalnych i zwyrodnieniowych stawów
- terapie z zastosowaniem prądu elektrycznego i pola magnetycznego
- doświadczenie wskazujące na skuteczność leczenia bólu, ale brak dowodów z badań kontrolowanych
- galwanizacja (np. kąpiele elektryczno–wodne Stangera)
- jonoforeza (np. z miejscowymi środkami znieczulającymi lub NLPZ)
- prądy o niskiej częstotliwości (np. diadynamika, TENS, inwazyjne zabiegi elektrostymulacji)
- terapie dynamicznym polem magnetycznym.
- Dieta
- Unikanie nadwagi/otyłości
- Jedyny środek, który, jak udowodniono, pozytywnie wpływa na przebieg choroby zwyrodnieniowej stawów.
- Nie unikać całkowicie rozpoznanych czynników wyzwalających migreny, ale stopniowo przyzwyczajać się do nich w niewielkiej ilości. Przykłady czynników wyzwalających: czerwone wino, żółty ser, banany, azotany, glutaminian sodu.
- Unikanie nadwagi/otyłości
- Dalsze działania:
- grupy wsparcia
- rehabilitacja: ambulatoryjnie, (częściowo) stacjonarnie
- pomoc w uzyskaniu doradztwa w zakresie świadczeń socjalnych (uprawnienia emerytalne, pomoc finansowa, itp.).
Farmakoterapia
- Kryteria doboru leków:
- przyczyna bólu
- natężenie bólu
- ryzyko
- interakcje.
- Należy wziąć pod uwagę wiek leczonej osoby.
- Ograniczenia czynności narządów i zaburzenia metabolizmu mogą zwłaszcza u starszych pacjentów powodować zmianę skuteczności i tolerancji leków przeciwbólowych.
- Ewentualnie ocena czynności nerek i wątroby.
- Indywidualne dostosowanie dawki.
- Start low, go slow!
- Odstępstwo od tej zasady tylko w przypadku konieczności natychmiastowego złagodzenia bardzo silnego bólu ostrego.
- Regularne monitorowanie możliwych działań niepożądanych.
- Próba odstawienia po usunięciu przyczyny bólu
- Opioidy należy odstawiać stopniowo.
- Zmniejszać dawkę wyjściową o 10% dziennie.
- Dotyczy to również innych leków przeciwbólowych po długotrwałym leczeniu.
- Opioidy należy odstawiać stopniowo.
- W szczególności w uporczywym bólu:
- Preferować podawanie w postaci o przedłużonym uwalnianiu.
- Leki stosowane doraźnie
- Szybko wchłaniające się, krótkodziałające preparaty przeznaczone wyłącznie do łagodzenia ostrego i silnego bólu oraz w fazie dobierania dawki.
- Ewentualnie w celu zapobiegania ograniczeniom ruchowym związanym z bólem, np. przed gimnastyką lub transportem pacjenta.
- Jeśli pacjent regularnie stosuje leki doraźne, należy je w miarę możliwości ograniczyć, intensyfikując terapię lekami o przedłużonym działaniu.
- Należy zwrócić uwagę na wysokie ryzyko uzależnienia w przypadku opioidów o normalnym uwalnianiu.
Ból nocyceptywny
- Drabina analgetyczna WHO
- I. Analgetyki nieopioidowe.
- II. Opioidy o niskiej sile działania (oraz leki ze stopnia 1.).
- III. Silnie działające opioidy (oraz leki ze stopnia 1.) w skojarzeniu z koanalgetykami, szczególnie w przypadku bólu neuropatycznego).
- Większość leków stopnia 1. przynosi korzyści, o ile są wystarczająco bezpieczne, np. pod względem działań niepożądanych ze strony ośrodkowego układu nerwowego, ale w zależności od indywidualnego profilu ryzyka na początku leczenia przydatne mogą być również opioidy.
- Jeśli skuteczność jest porównywalna, preferowana jest terapia z mniejszą liczbą działań niepożądanych.
- Np. przy krwawieniu z przewodu pokarmowego w wywiadzie, od samego początku należy preferować opioid w miejsce leku przeciwzapalnego, nawet jeśli np. nasilenie lub etiologia bólu przemawia za podaniem NLPZ.
Ból neuropatyczny
- Pierwszy wybór: leki przeciwpadaczkowe, leki przeciwdepresyjne.
- Drugi wybór: plastry z lidokainą lub kapsaicyną.
- Trzeci wybór: długo działające opioidy, iniekcje toksyny botulinowej.
Ból pod postacią somatyczną (nocyplastyczny)
- Ewentualnie leki przeciwdepresyjne.
- Bez opioidów!
- Zasadniczo dotyczy to bólu będącego objawem zaburzeń psychicznych, np. zaburzeń bólowych pod postacią somatyczną.
- Więcej szczegółów w artykule zaburzenia pod postacią somatyczną.
Leki nieopioidowe
Paracetamol
- W bólu o lekkim lub umiarkowanym nasileniu bez przyczyny zapalnej.
- Lepiej tolerowany niż NLPZ u pacjentów ze zwiększonym ryzykiem owrzodzeń i krwawień z przewodu pokarmowego.
- Tylko do krótkotrwałego leczenia.
- Unikać przedawkowania.
- najczęstsza przyczyna zatruć lekami.
- Zachować szczególną ostrożność w:
- zaburzeniach czynności wątroby i nerek
- niedożywieniu
- odwodnieniu
- nadużywaniu alkoholu.
NLPZ, w tym inhibitory COX–2 i kwas acetylosalicylowy
- Tylko do krótkotrwałego leczenia, szczególnie w przypadku bólu o etiologii zapalnej
- najlepiej nie dłużej niż 7 dni
- maksymalnie 4 tygodnie.
- Niskie dawki, w razie potrzeby w połączeniu z innymi lekami przeciwbólowymi.
- Prawdopodobnie najczęstsza przyczyna chorób wtórnych wywołanych przez leki.
- Zachować szczególną ostrożność w:
- zwiększonym ryzyku sercowo–naczyniowym
- zaburzeniach krzepnięcia
- upośledzonej czynności nerek lub wątroby
- owrzodzeniach przewodu pokarmowego.
- Niewielkie różnice w profilu ryzyka poszczególnych substancji
- Ryzyko zawału mięśnia sercowego wydaje się być istotnie wyższe w przypadku diklofenaku niż w przypadku ibuprofenu lub naproksenu.
- Ryzyko żołądkowo–jelitowe wydaje się niższe w przypadku ibuprofenu niż w przypadku innych klasycznych NLPZ.
- Leki z grupy IPP zmniejszają ryzyko krwawienia z żołądka, ale nie krwawienia z jelita.
- U pacjentów ze stężeniem kreatyniny w surowicy powyżej 2,5 mg/dl (>220 mcmol/l) nie należy stosować NLPZ oraz inhibitorów COX–2.
- Inhibitory COX–2
- Celekoksyb, parekoksyb, etorykoksyb.
- Wbrew oczekiwaniom, w przeprowadzonych badaniach nie wykazano większego bezpieczeństwa inhibitorów COX–2 nad klasycznymi NLPZ w zakresie wpływu na śluzówkę żołądka.
- Ogólne ryzyko wystąpienia poważnych działań niepożądanych nie jest niższe niż w przypadku klasycznych NLPZ.
Metamizol4
- Działanie przeciwbólowe, przeciwgorączkowe i spazmolityczne, ale słabe przeciwzapalne.
- Wskazania:
- ostry, silny ból, którego nie można zwalczyć innymi środkami
- jak dotąd brak dowodów na skuteczność w leczeniu bólu przewlekłego.
- Potencjalne ciężkie działania niepożądane:
- agranulocytoza
- spadek ciśnienia tętniczego
- reakcje alergiczne
- uszkodzenie wątroby.
- Należy wykonać morfologię krwi przed rozpoczęciem leczenia metamizolem i w ciągu pierwszych 7 dni po jego rozpoczęciu.
- Badanie powtarzać co 1–3 miesiące.
- Pacjenta oraz, w razie potrzeby, jego krewnych i/lub opiekunów, należy poinformować o objawach ostrzegawczych wskazujących na agranulocytozę (natychmiastowe zgłoszenie się do lekarza!):
- gorączka
- ból gardła
- zmiany zapalne błony śluzowej.
- Należy zachować ostrożność przy podawaniu dożylnym.
- Wstrzykiwać bardzo powoli lub lepiej w postaci krótkiego wlewu podawanego przez 30–45 minut z kontrolą ciśnienia tętniczego.
- Metamizolu nie podaje się już domięśniowo (również w postępowaniu ratunkowym).
Opioidy
- Stosowane głównie w leczeniu silnego lub bardzo silnego bólu
- Dłużej niż 3 miesiące tylko po uzyskaniu pierwotnej odpowiedzi.
- Należy omówić z pacjentami korzyści i ryzyko związane z opioidową terapią przeciwbólową w porównaniu z innymi opcjami leczenia farmakologicznego i niefarmakologicznego.
- Ponowna ocena w przypadku osłabienia działania:
- progresja choroby
- rozwój tolerancji
- hiperalgezja wywołana opioidami
- błędne stosowanie, nadużywanie lub uzależnienie od substancji.
- Powyżej pewnej dawki opioidów o niskiej sile działania, dalsze podwyższanie dawki nie zwiększa skuteczności przeciwbólowej, a jedynie nasila działania niepożądane.
- Niska dawka opioidu o dużej sile działania może być lepiej tolerowana niż wysoka dawka opioidu o małej sile działania i porównywalnym działaniu przeciwbólowym.
- Połączenie opioidów o niskiej sile działania (stopień 2. według WHO) z silnymi opioidami (stopień 3. według WHO) nie ma uzasadnienia farmakologicznego.
- Jeśli wymagane jest podanie opioidu na żądanie, należy wybrać lek, który jest już stosowany jako lek podstawowy.
- Ewentualnie zmiana leków podstawowych.
- Jeśli wymagane jest podanie opioidu na żądanie, należy wybrać lek, który jest już stosowany jako lek podstawowy.
- Przy wyborze opioidowego leku przeciwbólowego należy wziąć pod uwagę:
- choroby współistniejące
- przeciwwskazania do stosowania systemów transdermalnych lub przyjmowania doustnego
- profil działań niepożądanych leku
- preferencje pacjenta.
Leczenie zgodnie z ustalonym harmonogramem
- Leczenie należy prowadzić zgodnie z ustalonym harmonogramem i ukierunkowaniem na czas działania stosowanego preparatu.
- Jeśli nie jest konieczne szybkie złagodzenie silnego bólu, należy rozpocząć od niskiej dawki początkowej.
- U pacjentów starszych i z wieloma chorobami współistniejącymi ewentualnie tylko 25–50% standardowej dawki początkowej.
- Ewentualnie zwiększać dawkę w zależności od nasilenia bólu.
- Niezbędna dawka zależy wyłącznie od skuteczności i tolerancji w ocenie pacjenta.
- Przekroczenie dawki 120 mg na dobę dawki równoważnej morfiny tylko w wyjątkowych przypadkach; sprawdzić wcześniej: wskazania, inne opcje terapii, możliwe nadużywanie!
Zakończenie próby leczenia
- Leczenie opioidowymi lekami przeciwbólowymi należy stopniowo odstawiać, jeśli w trwającej maksymalnie 12 tygodni fazie dostosowania dawki:
- nie zostały osiągnięte indywidualne cele terapii z punktu widzenia pacjenta i/lub osoby prowadzącej leczenie albo
- jeżeli wystąpią działania niepożądane, których nie można odpowiednio leczyć lub których pacjent nie jest w stanie tolerować.
Zakończenie terapii trwającej >12 tygodni
- Długotrwałe leczenie opioidowymi lekami przeciwbólowymi należy stopniowo odstawiać, jeżeli:
- Leczenie nie spełnia już indywidualnych celów.
- Z punktu widzenia chorego i/lub osoby leczącej wystąpią działania niepożądane, których nie można już w wystarczającym stopniu opanować lub których pacjent nie jest w stanie tolerować.
- Indywidualne cele terapii zostały osiągnięte za pomocą innych środków medycznych.
- Pacjent nadużywa przepisanych opioidowych leków przeciwbólowych pomimo współleczenia przez specjalistów ds. uzależnień.
Przerwa w przyjmowaniu leków
- Po 6 miesiącach rozważyć przerwę w przyjmowaniu leków
- po pierwotnej odpowiedzi
- redukcja dawki i/lub próba odstawienia.
Rotacja opioidów (zmiana na inny opioid)
- Ewentualne wskazania:
- niewystarczająca analgezja
- zaparcia wywołane opioidami
- hiperalgezja wywołana opioidami
- oporne na leczenie nudności, wymioty, zmęczenie, zatrzymanie moczu, świąd, splątanie, omamy i reakcja skórna na plaster (transdermalny system terapeutyczny – TTS)
- interakcje z lekami lub zaburzenia czynności wątroby i/lub nerek.
Zaparcia wywołane opioidami
- Leczenie podstawowe
- dostosowanie diety i ilości płynów
- dużo aktywności fizycznej.
- Profilaktyka lekami przeczyszczającymi, w razie potrzeby przez cały czas trwania leczenia.
- Rotacja opioidów?
- Zmiana postaci?
- Klasy środków przeczyszczających:
- Działanie osmotyczne: makrogol jako lek pierwszego wyboru.
- Antyresorpcyjne i wydzielnicze, np. pikosiarczan sodu, bisakodyl, preparaty senesu.
- Skojarzenie z antagonistą receptorów opioidowych: np. skojarzenie w stałej dawce oksykodonu i naloksonu maksymalnie 40 mg/20 mg 2 x na dobę (nalokson może osłabiać działanie przeciwbólowe w dawkach wyższych niż dopuszczone; dostępne są preparaty skojarzone naloksonu z oksykodonem).
- Obwodowo działający antagoniści receptorów opioidowych (PAMORA): metylonaltrekson, naldemedyna.
- Więcej szczegółów przedstawiono w artykule zaparcia.
- W przypadku niewystarczającej odpowiedzi: zmiana klasy leków lub połączenie środków przeczyszczających o różnym mechanizmie działania
Nudności i wymioty
- Profilaktyka farmakologiczna od samego początku.
- Po 2–4 tygodniach należy sprawdzić wskazania do leczenia przeciwwymiotnego.
- Klasy leków przeciwwymiotnych:
- leki przeciwhistaminowe, np. difenhydramina do 50 mg co 8 godzin
- neuroleptyki, np. haloperidol 0,2–1,0 mg doustnie co 8 godzin lub lewomepromazyna 1–5 mg doustnie (krople) co 12 godzin
- prokinetyki, np. metoklopramid: 10 mg doustnie co 4–6 godzin
- ondansetron 4–8 mg doustnie co 12 godzin.
Depresja oddechowa i skurcz oskrzeli
- Można ich uniknąć, stosując następujące postępowanie:
Inne działania niepożądane
- Zaburzenia opróżniania pęcherza.
- Zmęczenie, senność, zwiększone ryzyko upadku.
- Spowolnienie poznawcze.
- Zaburzenia snu (ale głównie efekt nasenny).
- Koszmary senne.
- Depresja.
- Dysfunkcja seksualna.
- Zaburzenia endokrynologiczne.
- Rzadko stany splątania, objawy psychotyczne.
Zaburzenia psychiczne
- W zaburzeniach psychicznych związanych z opioidami rozważyć:
- redukcję dawki
- rotację opioidów
- stopniowe odstawianie.
Uzależnienie
- Wszystkie opioidy mogą prowadzić do uzależnienia fizycznego, jak również do wykształcenia się tolerancji.
Przeciwwskazania do stosowania opioidów
- Zaburzenia pod postacią somatyczną.
- Fibromialgia.
- Inne zaburzenia pod postacią somatyczną/czynnościowe, np. zespół jelita drażliwego.
- Przewlekłe zapalenie trzustki.
- Nieswoiste zapalenia jelit.
- Inne zaburzenia psychiczne, zwłaszcza przy dużym nasileniu choroby lub gdy głównym objawem jest przewlekły ból.
- Schorzenia pierwotnie związane z bólem głowy, takie jak:
- Uzależnienia, szkodliwe używanie substancji.
- Przekazywanie leków osobom nieupoważnionym.
- Niekontrolowane przyjmowanie leków.
- Brak chęci lub niezdolność do przestrzegania planu leczenia.
Zespół odstawienny
- Aby uniknąć objawów odstawienia:
- Nie należy przerywać stosowania leku nagle, lecz powoli zmniejszać jego dawkę.
- Unikać efektu „ból końca dawki” (end–of–drug failure) z powodu zbyt długich odstępów między dawkami.
- Preferować preparaty o przedłużonym uwalnianiu.
- Opioidy o szybkim uwalnianiu tylko w fazie zwiększania dawki i w sytuacjach, w których nie można szybko opanować ostrego, silnego bólu innymi środkami.
- Podawanie podpoliczkowe lub donosowe charakteryzujące się bardzo szybkim wchłanianiem, jest uzasadnione tylko w przypadku nowotworowego bólu przebijającego i nie jest dopuszczone poza tym wskazaniem.
W razie wykształcenia się tolerancji
- Ewentualnie zwiększenie dawki, zmiana opioidu lub jego odstawienie pod nadzorem specjalistów zajmujących się leczeniem uzależnień/leczeniem bólu.
W hiperalgezji wywołanej opioidami
- Stopniowa redukcja dawki i/lub odstawienie opioidu pod nadzorem specjalistów zajmujących się leczeniem uzależnień/leczeniem bólu.
Podanie przezskórne
- Wskazane tylko w przypadku stabilnego przebiegu bólu z niewielkimi wahaniami nasilenia
- Podanie przezskórne jest zasadniczo podaniem pozajelitowym i wymaga zachowania szczególnej czujności co do bezpieczeństwa stosowania leku.
- Nawet po usunięciu plastra, podwyższone stężenie w surowicy może utrzymywać się przez 24–48 godzin.
- Oprócz typowych dla opioidów działań niepożądanych, mogą wystąpić reakcje skórne.
Inne substancje
- Inne substancje działające na ośrodkowy układ nerwowy, np. środki nasenne i uspokajające
- Zmniejszenie dawki lub odstawienie przed rozpoczęciem terapii opioidami.
Kannabinoidy
- Substancje czynne z Cannabis sativa (konopi siewnych):
- delta–9–tetrahydrokannabinol (THC)
- kannabidiol (CBD).5
- Według metaanalizy skuteczność kannabinoidów w leczeniu przewlekłego bólu potwierdzono w badaniach, których jakość jest umiarkowana.6
- W opublikowanych w listopadzie 2019 roku brytyjskich wytycznych NICE NG144 Cannabinoids7 odradza się stosowanie kannabinoidów w leczeniu przewlekłego bólu, z wyjątkiem CBD w ramach badań klinicznych.
- Metaanaliza przeprowadzona przez American Academy of Neurology (AAN)8 oraz inne systematyczne metaanalizy kontrolowanych badań 9 dowodzą umiarkowanej, ale istotnej redukcji bólu:
- W warunkach stosowania delta–9–THC, czasami w połączeniu z CBD, u pacjentów z:
- bólem ośrodkowym w stwardnieniu rozsianym
- neuropatii czuciowej związanej z HIV
- bólu neuropatycznym spowodowanym innymi uszkodzeniami nerwów.
- W warunkach stosowania syntetycznego kannabinoidu w grupie mieszanej pacjentów z przewlekłym bólem neuropatycznym.
- W warunkach stosowania delta–9–THC, czasami w połączeniu z CBD, u pacjentów z:
- W 2 badaniach z udziałem pacjentów z neuropatią cukrzycową nie wykazano istotnej różnicy między działaniem przeciwbólowym delta–9–THC/CBD i placebo.
- Znaczenie kannabinoidów w leczeniu bólu neuropatycznego budzi kontrowersje.
- Meta–metaanaliza opublikowana w 2018 roku obejmowała 23 systematyczne metaanalizy dotyczące kannabinoidów w leczeniu bólu.10
- W ogólnym ujęciu autorzy doszli do następującego wniosku: „Nie ma pewności, czy kannabinoidy mają działanie przeciwbólowe, a jeśli tak, to w przypadku bólu neuropatycznego i prawdopodobnie z niewielkimi korzyściami”.
- Podobne wnioski przedstawili autorzy przeglądu systematycznego z roku 2023:11
- „Kanabidoidy zmniejszają ból przewlekły i poprawiają jakość snu, ale wielkość efektu ma wątpliwe znaczenie. Kanabidoidy nie wpływają na ból ostry i ból nowotworowy, a zwiększają ryzyko innych niż poważne działań niepożądanych. Szkodliwe działania kanabidoidów wydają się przeważać nad potencjalnymi korzyściami”.
- Więcej informacji przedstawiono w artykule leki zawierające kannabinoidy.
Leczenie skojarzone
- NLPZ + paracetamol w ostrym bólu
- niskie dawki składników jako alternatywa z mniejszą liczbą działań niepożądanych względem monoterapii wyższymi dawkami
- np. ibuprofen 200 mg + paracetamol 500 mg
- nie stosować dłużej niż 3 dni (uwaga: nasilenie działań niepożądanych).
- Analgetyk nieopioidowy + opioid.
Informacje dla pacjentów
Edukacja pacjenta
- Znaczenie czynników psychospołecznych.
- Aktywne strategie radzenia sobie z trudnymi sytuacjami
- Zbyt częste wystawianie zwolnienia lekarskiego może wzmacniać u pacjenta zachowania unikające i bierność.
- Oba te czynniki mogą sprzyjać chronifikacji bólu.
- Ewentualnie rozmowy z członkami rodziny
- Wyręczanie pacjenta cierpiącego z powodu bólu w określonych czynnościach, promuje chronifikację bólu.
- Zbyt częste wystawianie zwolnienia lekarskiego może wzmacniać u pacjenta zachowania unikające i bierność.
- Należy określić realistyczne cele terapii.
- Prowadzenie pojazdów mechanicznych i bezpieczeństwo pracy w trakcie stosowania opioidów
- Przed rozpoczęciem leczenia opioidowymi lekami przeciwbólowymi należy przedstawić pacjentowi poparte wiarygodnymi danymi wyjaśnienia na temat aspektów terapii związanych z uczestniczeniem w ruchu drogowym i bezpieczeństwem w miejscu pracy.
- Ustawa Prawo o Ruchu Drogowym z dnia 20 czerwca 1997 roku z późn. zm. (Art. 45. Pkt 1.1)12 zabrania: kierowania pojazdem, prowadzenia kolumny pieszych, jazdy wierzchem lub pędzenia zwierząt osobie w stanie nietrzeźwości, w stanie po użyciu alkoholu lub środka działającego podobnie do alkoholu.
- Opioidy są zaliczane do tej kategorii substancji, zgodnie z Rozporządzeniem Ministra Zdrowia z dnia 16 lipca 2014 roku.
- Nie należy wykonywać czynności zawodowych o nieznanym ryzyku lub zwiększonym potencjale ryzyka.
- Ewentualnie konsultacje z lekarzem medycyny pracy.
- Pośredniczenie w poradnictwie socjalno–medycznym (kontakt z opieką społeczną).
- Lokalne grupy samopomocy.
Materiały edukacyjne dla pacjentów
- Ból i leczenie bólu.
- Ostry ból pleców.
- Przewlekły ból kręgosłupa.
- Ból spowodowany wypadnięciem krążka międzykręgowego w odcinku lędźwiowym kręgosłupa.
- Ból stawu.
- Ból kilku stawów.
- Ból głowy.
- Przewlekły ból podbrzusza u kobiet.
- Ostry ból w okolicy boku tułowia.
Ilustracje
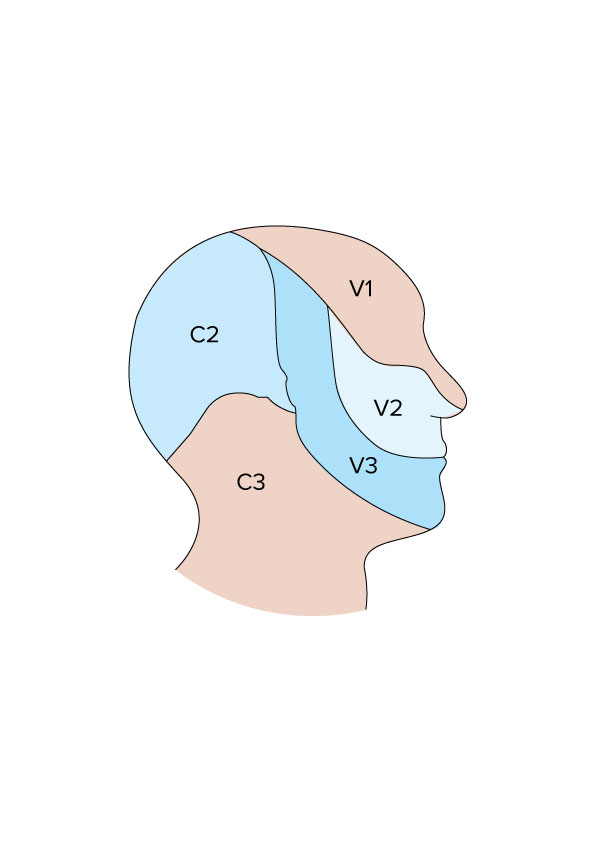
Głowa, unerwienie
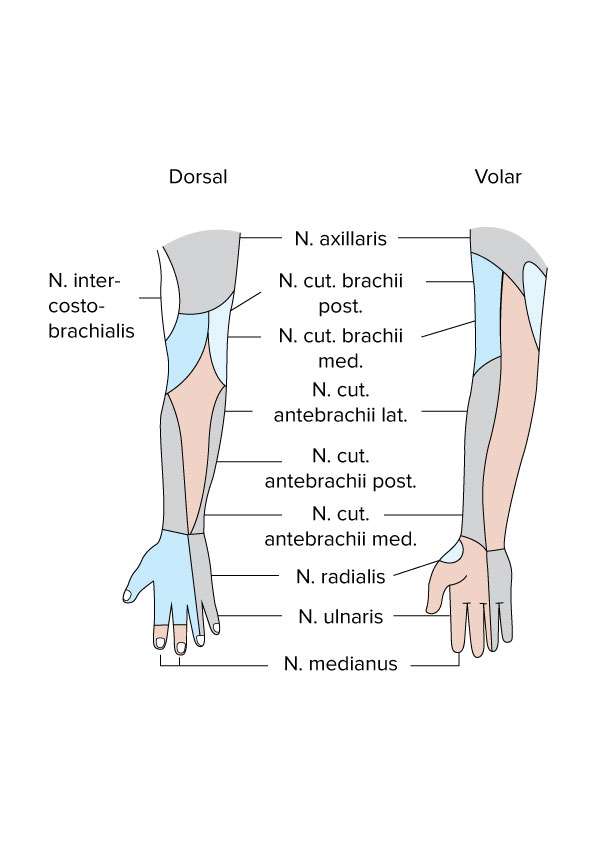
Kończyny górne, unerwienie
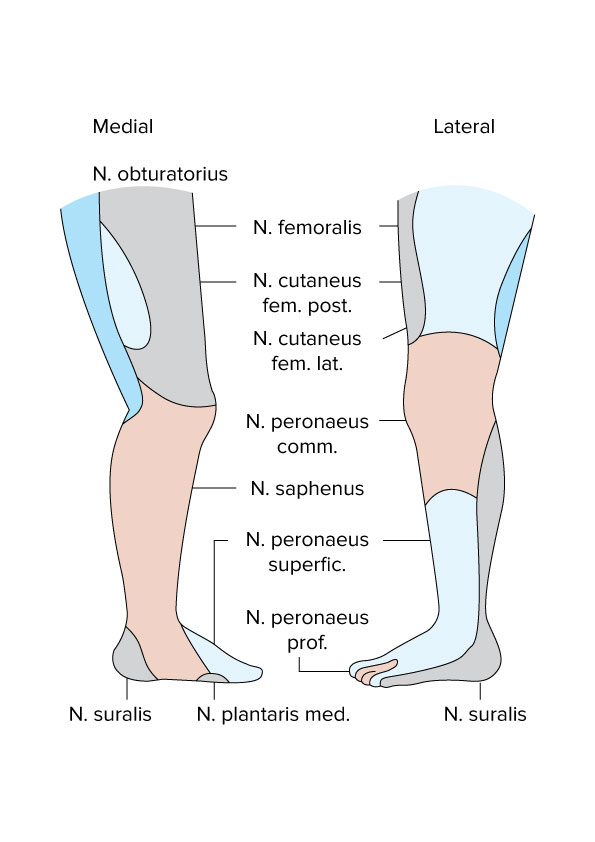
Kończyny dolne, unerwienie
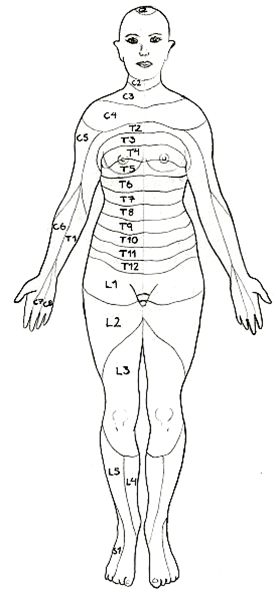
Dermatomy, widok od przodu
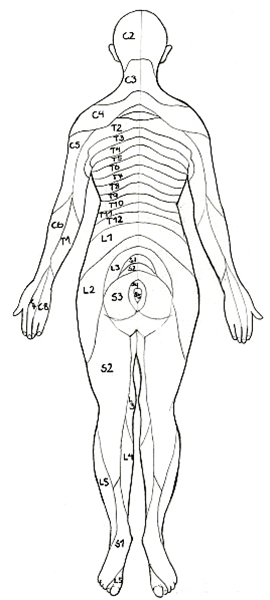
Dermatomy, widok od strony grzbietowej
Źródła
Piśmiennictwo
- Rozporządzenie Ministra Zdrowia z dnia 6 lutego 2023 r. w sprawie standardu organizacyjnego leczenia bólu w warunkach ambulatoryjnych, Dz.U. 2023 poz. 271 z późn. zm., dostęp: 06.04.2024, isap.sejm.gov.pl
- Aydede M., Shriver A. Recently introduced definition of "nociplastic pain" by the International Association for the Study of Pain needs better formulation, Pain 2018, 159(6): 1176-77, PubMed
- Verhagen A.P., Bierma‐Zeinstra S.M.A., Boers M. et al. Balneotherapy (or spa therapy) for rheumatoid arthritis, Cochrane Database of Systematic Reviews 2015, 4: CD000518. DOI: 10.1002/14651858.CD000518.pub2, pubmed.ncbi.nlm.nih.gov
- Stammschulte T., Ludwig W.D., Mühlbauer B. et al. Metamizole (dipyrone)-associated agranulocytosis. An analysis of German spontaneous reports 1990-2012, Eur J Clin Pharmacol 2015, 71: 1129-38, PMID: 26169297, PubMed
- Russo E., Guy G.W. A tale of two cannabinoids: the therapeutic rationale for combining tetrahydrocannabinol and cannabidiol, Med Hypotheses, 2006, 66(2): 234-46, PMID: 16209908, PubMed
- Whiting P.F., Wolff R.F., Deshpande S. et al. Cannabinoids for Medical Use: A Systematic Review and Meta-analysis, JAMA 2015, 313(24): 2456-73, PMID: 26103030, PubMed
- National Institute for Health and Care Excellence. Cannabis-based medicinal products. NICE guideline, 11.11.2019, www.nice.org.uk
- Koppel B.S., Brust J.C., Fife T. et al. Systematic review: Efficacy and safety of medical marijuana in selected neurologic disorders: Report of the Guideline Development Subcommittee of the American Academy of Neurology, Neurology 2014, 82: 1556-63, PMID: 24778283, PubMed
- Nugent S.M., Morasco B.J., O'Neil M.E. et al. The Effects of Cannabis Among Adults With Chronic Pain and an Overview of General Harms: A Systematic Review, Ann Intern Med 2017, 167: 319-31, PMID: 28806817, PubMed
- Allan G.M., Finley C.R., Ton J. et al. Systematic review of systematic reviews for medical cannabinoids. Pain, nausea and vomiting, spasticity, and harms, Canadian Family Physician 2018, 64 (2): 78-94, www.cfp.ca
- Barakji J., Korang S.K., Feinberg J., et al. (2023) Cannabinoids versus placebo for pain: A systematic review with meta-analysis and Trial Sequential Analysis, PLOS ONE 18(1): e0267420, journals.plos.org
- Ustawa z dnia 20 czerwca 1997 r. Prawo o ruchu drogowym. Dz.U. 1997 nr 98 poz. 602 z poźn. zm., dostęp: 06.04.2024, isap.sejm.gov.pl
- GW Pharmaceuticals: ClinicalTrials.gov, Stand Juli 2012, dostęp: 21.10.2017, clinicaltrials.gov
- Selvarajah D., Gandhi R., Emery C.J. et al. Randomized placebo-controlled double-blind clinical trial of cannabis-based medicinal product (Sativex) in painful diabetic neuropathy: depression is a major confounding factor, Diabetes Care, 2010, 33: 128-30, PMID: 19808912, PubMed
Opracowanie
- Marek Oleszczyk (recenzent)
- Adam Windak (redaktor)
- Thomas M. Heim (recenzent/redaktor)
- Marlies Karsch–Völk (recenzent/redaktor)
