Streszczenie
- Definicja: SM charakteryzuje się zmianami zapalnymi w obrębie nerwów wzrokowych, rdzenia kręgowego i mózgu, które przebiegają w postaci rzutów lub przewlekłego postępu choroby. Klinicznie występują deficyty czynnościowe nerwów ośrodkowych i obwodowych.
- Epidemiologia: Chorobowość w Europie wynosi 170–300/100 000. Pierwsze objawy pojawiają się zwykle między 20. a 45. rokiem życia. Kobiety chorują ponad 2 razy częściej niż mężczyźni.
- Objawy: Typowymi objawami są: niedowład spastyczny, ataksja, dyzartria, dysfunkcja pęcherza moczowego i odbytnicy, zaburzenia czucia oraz objawy ogólne, takie jak zmęczenie i bóle mięśni. Rzadziej występują zespoły bólu neuropatycznego, takie jak neuralgia nerwu trójdzielnego.
- Badanie fizykalne: Cechy niedowładu pochodzenia ośrodkowego to zmniejszona siła mięśni, wzmożone napięcie mięśniowe typu spastycznego i wzmożone odruchy ścięgniste. Ruchy, w tym chód, są spowolnione, koordynacja ruchowa jest zaburzona. Ubytki czucia mogą obejmować wszystkie obszary unerwienia czuciowego, często występują w obrębie rąk, stóp i podudzi. Nierzadkie są również ubytki pola widzenia z pogorszeniem wzroku i niedowładami mięśni ruchowych oka.
- Diagnostyka: Rozpoznanie opiera się na wywiadzie chorobowym, przedmiotowym badaniu neurologicznym oraz badaniu RM i analizie płynu mózgowo–rdzeniowego.
- Leczenie: W ostrym rzucie choroby leczenie ma na celu ograniczenie procesu zapalnego. W dłuższej perspektywie celem jest zapobieganie kolejnym rzutom choroby i progresji deficytów neurologicznych, łagodzenie objawów i przywrócenie zdolności do samodzielnej egzystencji pacjenta, na przykład poprzez rehabilitację.
Informacje ogólne
Definicja
- Stwardnienie rozsiane (sclerosis multiplex – SM), znane również pod nazwą encephalomyelitis disseminata jest przewlekłą, zapalną, demielinizacyjną i neurodegeneracyjną chorobą OUN.
- Klinicznie choroba charakteryzuje się występowaniem rzutów aktywnego procesu zapalnego (rzuty) w obrębie nerwów wzrokowych, rdzenia kręgowego i mózgu, po których następują fazy skąpoobjawowe (postać rzutowo–remisyjna SM).
- Kryteria diagnostyczne
- Dzięki standaryzowanym kryteriom diagnostycznym (patrz rozdział diagnostyka), choroba może być rozpoznana i leczona na wczesnym etapie.
- Podstawowym celem jest obiektywne wykrywanie zmian rozsianych zarówno w czasie, jak i pod względem ich umiejscowienia w ośrodkowym układzie nerwowym (OUN).
Klasyfikacja
- Kryteria diagnostyczne pozwalają w większości przypadków jednoznacznie potwierdzić rozpoznanie SM.
- Kategoria potencjalnego stwardnienia rozsianego obejmuje:
- Pacjentów, których obraz kliniczny wskazuje na chorobę, ale diagnostyka nie została jeszcze zakończona.
- Pacjentów, którzy spełniają niektóre, ale nie wszystkie kryteria diagnostyczne.
- Postaci choroby:
- Zespół izolowany radiologicznie (radiologically isolated syndrome – RIS).
- Zespół izolowany klinicznie (clinically isolated syndrome – CIS).
- Postać rzutowo–remisyjna (inaczej nawracająco–zwalniająca, relapsing–remitting multiple sclerosis – RRMS) – najczęstszy fenotyp choroby.
- Wtórnie postępujące stwardnienie rozsiane (secondary progressive multiple sclerosis – SPMS)
- z rzutami rzekomymi
- bez rzutów rzekomych.
- Pierwotnie postępujące stwardnienie rozsiane (primary progressive multiple sclerosis – PPMS).
Epidemiologia
- Chorobowość
- Współczynnik chorobowości różni się w zależności od szerokości geograficznej i pochodzenia etnicznego.
- Najwyższa jest wśród osób pochodzenia europejskiego zamieszkujących pomiędzy 40 a 60 równoleżnikiem.1-3
- Chorobowość w tych regionach wynosi 170–300/100 000 osób.
- W niektórych grupach etnicznych, na przykład wśród skandynawskich Saamów i rdzennych mieszkańców Ameryki Północnej, chorobowość SM jest szczególnie niska.
- Wiek
- Pierwsze objawy pojawiają się zwykle między 20. a 45. rokiem życia (w około 70% przypadków).4
- Płeć
- Kobiety chorują 2–3 x częściej niż mężczyźni.
Etiologia i patogeneza
- Przyczyny choroby nie są znane.
- Większość badaczy uważa, że stwardnienie rozsiane jest wynikiem współdziałania predyspozycji genetycznych i czynników środowiskowych.Kluczową rolę może odgrywać odpowiedź układu odpornościowego na czynniki zakaźne.5 Pojawia się wówczas proces zapalny, który prowadzi do uszkodzenia osłonek mielinowych, a w dalszym przebiegu także aksonów.
- Za najbardziej spójne czynniki ryzyka w odniesieniu do rozwoju SM uznano przebyte zakażenie wirusem Epsteina–Barr, wywołującym mononukleozę (gorączkę gruczołową Pfeiffera) – prawie 100% pacjentów z SM jest seropozytywnych pod względem EBV, oraz palenie tytoniu, które zwiększa ryzyko zachorowania o 50%.2
- Czynniki genetyczne
- Około 15% pacjentów ma krewnych chorujących na stwardnienie rozsiane.
- Ze zwiększonym ryzykiem SM wiążą się zmiany w chromosomie 6: haplotyp DRB1*1501 3–krotnie zwiększa ryzyko zachorowania na SM.6
- Niektóre z loci genów, wykazujących częste nieprawidłowości u pacjentów z SM, są znacząco związane z funkcjonowaniem układu immunologicznego, na przykład różnicowaniem limfocytów T pomocniczych.7
- Istnieją dowody na to, że światło słoneczne i witamina D mogą zmniejszać ryzyko zachorowania na SM, prawdopodobnie poprzez wpływ na ekspresję genów istotnych dla funkcjonowania układu odpornościowego.
- W dużym europejskim badaniu przesiewowym zidentyfikowano kilka genów istotnych dla SM, wśród nich 2 (CYP27B1, CYP24A1), które biorą udział w metabolizmie witaminy D.
- Choroba ma podłoże immunologiczne, ale nie udało się zidentyfikować autoantygenu.
- Zakażenie wirusowe
- Zakażenia wirusowe są rozważane jako możliwy czynnik etiologiczny, nigdy jednak nie przedstawiono odpowiednich dowodów.
- Wydaje się, że istnieje związek między zakażeniem wirusem Epsteina–Barr (mononukleozą) a stwardnieniem rozsianym.
- Witamina D
- W jednym z badań stwierdzono odwrotny związek między poziomem ekspozycji matki na słońce w I trymestrze ciąży a ryzykiem rozwoju SM u dziecka.8
- Dane z randomizowanego badania klinicznego sugerują związek między wysokim poziomem witaminy D (>50 nmol/l) a zmniejszoną aktywnością SM i wolniejszym postępem choroby u pacjentów z nowo rozpoznanym SM.9
- Wyniki fińskiego badania kohortowego wskazują na istnienie związku między niskim poziomem witaminy D a zwiększonym ryzykiem SM.10
- Autorzy metaanalizy dochodzą jednak do wniosku, że związek między stwardnieniem rozsianym a witaminą D nie jest wystarczająco udowodniony.11
- Podgrupy
- Stres a zaostrzenie choroby
- Zaostrzenia SM występują częściej po stresujących zdarzeniach życiowych.13
Powstawanie plaków (blaszek, tzn. ognisk demielinizacji) 14
- W obrazie histopatologicznym ogniska demielinizacji w SM cechuje stwardnienie, a ich rozproszony charakter występowania doprowadził do nadania chorobie nazwy: stwardnienie rozsiane. Ogniska te określane są jako plaki (blaszki).
- Zmiany pojawiają się zwykle w istocie białej, gdzie atakują przede wszystkim osłonkę mielinową i komórkę mielinującą (oligodendrocyt). Mogą jednak występować również w istocie szarej.
- Wydaje się, że do powstania plaków u osób z genetyczną predyspozycją do SM przyczynia się uszkodzenie bariery krew–mózg.
- Jedna z hipotez głosi, że zakażenie ogólnoustrojowe prowadzi do zwiększenia ekspresji cząsteczek adhezyjnych na śródbłonku naczyń zaopatrujących mózg lub rdzeń kręgowy, umożliwiając leukocytom – poprzez uszkodzoną barierę krew–mózg – przedostanie się do OUN.
- Limfocyty zdolne do rozpoznawania antygenów mieliny mogą wywołać odpowiedź immunologiczną prowadzącą do powstania ostrej zmiany zapalno–demielinizacyjnej.
- Według innej hipotezy, pierwotnym czynnikiem powodującym powstawanie plaków jest obumieranie oligodendrocytów. Zmiany molekularne w osłonce mielinowej indukują zapalne procesy immunologiczne, jak na przykład aktywację makrofagów.
- Fakt, że w mózgach pacjentów z SM znajdowane są plaki w różnych stadiach rozwoju i w różnych lokalizacjach, wydaje się wyjaśniać dużą odmienność choroby i zajętych nią dróg nerwowych.15
Czynniki predysponujące
- Czynniki genetyczne
- Czynniki genetyczne odgrywają pewną rolę, tym niemniej częste występowanie choroby w danej rodzinie jest stosunkowo rzadkie.
- Związek między SM a regionem HLA genomu został wykryty już w roku 1972.16 W dużym badaniu genetycznym wykryto również inne istotne allele, jednak ich znaczenie dla zwiększonego ryzyka SM jest znacznie mniejsze, niż w przypadku genów układu HLA.
- Klimat
- Istnieje związek między miesiącem urodzenia a ryzykiem SM, co potwierdza założenie, że wpływ czynników klimatycznych w okresie ciąży lub bezpośrednio po urodzeniu dziecka mogą odgrywać pewną rolę.17
- Zakażenia.
- Urazy.
- Stres.
- Porody
- Po porodzie matka znajduje się w grupie zwiększonego ryzyka zaostrzeń SM.18
ICD–10
- G35. –Stwardnienie rozsiane [encephalomyelitis disseminata].
- G35.0 Pierwsze objawy stwardnienia rozsianego.
- G35.1 – Stwardnienie rozsiane o przebiegu głównie nawrotowym.
- G35.2 – Stwardnienie rozsiane o przebiegu pierwotnie przewlekłym.
- G35.3 – Stwardnienie rozsiane o przebiegu wtórnie przewlekłym.
- G35.9 – Stwardnienie rozsiane, nieokreślone.
- Dla podkategorii G35.1–G35.3 należy stosować następujące piąte cyfry:
- 0 bez informacji o zaostrzeniach lub progresji.
- 1 z informacją o zaostrzeniach lub progresji.
Diagnostyka
Kryteria diagnostyczne
Kryteria McDonalda 201719
- Patrz tabela kryteria diagnostyczne w stwardnieniu rozsianym (kryteria McDonalda 2017).
- Rozpoznanie może być postawione na podstawie wywiadu lekarskiego i przedmiotowego badania neurologicznego pod warunkiem, że można wykluczyć inne przyczyny objawów. Warunkiem rozpoznania SM są:
- Deficyty neurologiczne w co najmniej 2 różnych w czasie okresach oraz objawy kliniczne z co najmniej 2 różnych w przestrzeni ognisk w OUN.
- Ewentualnie postępujący przebieg choroby, z ogniskami o różnej lokalizacji w OUN w okresie co najmniej 1 roku.
- W większości przypadków rozpoznanie opiera się na całokształcie obrazu klinicznego i badań obrazowych (RM) oraz badaniu płynu mózgowo–rdzeniowego. Obecnie rozpoznanie można postawić również u pacjentów, u których wystąpił tylko 1 rzut kliniczny, pod warunkiem, że udowodni się istnienie kilku ognisk, które występowały różnoczasowo, lub patologicznych zmian w płynie mózgowo–rdzeniowym (prążki oligoklonalne).
- Dalsze badania laboratoryjne w ramach diagnostyki różnicowej są konieczne tylko wtedy, gdy istnieje konkretne podejrzenie kliniczne.
Diagnostyka różnicowa
- Zaburzenia metaboliczne
- Zwyrodnienie powrózkowe rdzenia kręgowego (subacute combined degeneration of spinal cord – SACD) wywołana niedoborem witaminy B12.
- Zaburzenia autoimmunologiczne:
- zespół Sjögrena
- toczeń rumieniowaty układowy
- choroba Behçeta
- sarkoidoza
- przewlekła zapalna poliradikuloneuropatia demielinizacyjna z demielinizacją nerwów OUN
- zespół antyfosfolipidowy
- ostre rozsiane zapalenie mózgu i rdzenia kręgowego (acute disseminated encephalomyelitis – ADEM)
- guzkowe zapalenie tętnic (polyarteritis nodosa).
- Choroby zakaźne:
- mielopatia związana z HIV
- mielopatia związana z HTLV–I (ludzki wirus T–limfotropowy typu 1)
- borelioza
- zapalenie opon mózgowych w przebiegu kiły układu nerwowego
- postępująca wieloogniskowa leukoencefalopatia (progressive multifocal leukoencephalopathy – PML), związana z wirusem JC
- półpasiec (HZV)
- zapalenie wątroby typu C (HCV).
- Choroby naczyniowe:
- zapalenie naczyń ośrodkowego układu nerwowego
- waskulopatia siatkówkowo–ślimakowo–mózgowa (zespół Susaca)
- rodzinne naczyniaki jamiste
- oponowe przetoki tętniczo–żylne rdzenia kręgowego
- choroba Ealesa (zapalenie naczyń siatkówki z krwotokami do ciała szklistego i objawami ze strony ośrodkowego układu nerwowego)
- izolowane zapalenie naczyń OUN (isolated angiitis of the central nervous system – IACNS)
- mózgowa autosomalna dominująca arteriopatia z zawałami podkorowymi i leukoencefalopatią (Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leucoencephalopathy – CADASIL).
- Zespoły genetyczne:
- ataksje dziedziczne
- dziedziczne paraplegie
- dziedziczna neuropatia nerwów wzrokowych Lebera
- inne cytopatie mitochondrialne
- choroby lizosomalne
- leukodystrofie.
- Choroby tylnego dołu czaszki i rdzenia kręgowego (szczególnie istotne w różnicowaniu postępującej mielopatii i pierwotnie postępującego stwardnienia rozsianego):
- zespół Arnolda–Chiariego
- ataksje niedziedziczne
- spondyloza szyjna
- inne mielopatie.
- Choroby psychiczne:
- Choroby nowotworowe:
- pierwotne guzy mózgu
- guzy śródrdzeniowe
- chłoniaki ośrodkowego układu nerwowego
- zespoły paranowotworowe (paraneoplastyczne)
- liczne przerzuty do OUN.
- Klinicznie izolowane zespoły:
- zapalenie nerwu wzrokowego spowodowane innymi przyczynami
- izolowane zespoły uszkodzenia pnia mózgu.
- Poprzeczne zapalenie rdzenia (u wielu pacjentów z tą chorobą rozwija się obraz kliniczny określony jako SM lub przebieg trudny do rozróżnienia od SM).
Wywiad
- Początek
- Objawy mogą rozwinąć się w ciągu minut, godzin lub dni, ale także w ciągu tygodni lub miesięcy.
- Najczęstszy jest podostry rozwój objawów w ciągu niecałego tygodnia.
- W rzadkich przypadkach choroba może mieć również początek w postaci ostrych deficytów neurologicznych i niekiedy przypominać udar (początek apoplektyczny).
- Wczesne objawy
- W zależności od tego, które obszary OUN są dotknięte, objawy mogą być bardzo zróżnicowane.
- Częstym objawem początkowym jest podwójne widzenie (diplopia), zaburzenia widzenia jednym okiem, niedowład kończyn, zaburzenia koordynacji ruchowej, zaburzenia czucia i nagłe parcie na pęcherz.
- Często wczesnym objawem SM jest jedynie łagodny niedowład pochodzenia ośrodkowego, który w większym stopniu wpływa na szybkość wykonywania ruchów niż ich siłę, może też powodować zmniejszenie wydolności fizycznej.
- Pierwsze objawy mogą mieć łagodny charakter i szybko ustępować. Objawy trwające krócej niż 24 godziny zazwyczaj jednak nie są związane z SM.
- Dokładny wywiad medyczny często pokazuje, że SM ujawniło się u pacjenta już jakiś czas temu w postaci wczesnych objawów.
- Najczęstszym, choć niespecyficznym objawem we wczesnych stadiach SM, jest zmęczenie.
- Choroba rozwinięta:
- niedowład pochodzenia ośrodkowego z bolesnymi skurczami mięśni
- zaburzenia czucia w kończynach
- zaburzenia widzenia
- ataksja z niestabilnym chodem i niepewnym chwytem
- dyzartria
- zaburzenia czynności zwieraczy (pęcherza moczowego i odbytnicy)
- objawy psychiczne, takie jak zaburzenia lękowe i depresja
- rzadziej: zespoły bólu neuropatycznego, takie jak neuralgia nerwu trójdzielnego
- zmęczenie.
Badanie fizykalne
- Należy przeprowadzić systematyczne badanie neurologiczne, w którym można wykryć następujące objawy choroby:
- Niedowład pochodzenia ośrodkowego z obniżeniem siły mięśni, zwiększeniem napięcia mięśniowego i spowolnieniem wykonywania ruchów.
- Zaburzenia koordynacji kończyn górnych i dolnych.
- Zaburzenia czucia w określonych obszarach unerwienia.
- Wzmożenie odruchów ścięgnistych, np. odruchu rzepkowego (kolanowego) i odruchu skokowego (ze ścięgna Achillesa).
- Osłabienie lub brak odruchów polisynaptycznych, np. odruchu brzusznego lub odbytniczego.
- Dno oka:
- po zapaleniu nerwu wzrokowego: bladość tarczy nerwu wzrokowego w części skroniowej
- w wewnątrzgałkowym zapaleniu nerwu wzrokowego (papillitis): obrzęk (zastoinowy) tarczy nerwu wzrokowego.
- Dodatni objaw Lhermitta: bierne zgięcie karku wywołuje uczucie przechodzenia prądu wzdłuż kręgosłupa z promieniowaniem do przedniej części ud.
- W przypadku zmian w pniu mózgu i w móżdżku:
- oczopląs (nystagmus)
- dyzartria
- ataksja
- zaburzenia równowagi.
Badania uzupełniające w gabinecie lekarza rodzinnego
- Lekarz rodzinny nie ma do dyspozycji badań uzupełniających, które miałyby określone korzyści diagnostyczne.
- Należy wykonać badania przesiewowe w kierunku ewentualnych chorób ogólnoustrojowych:
- CRP, Hb, parametry tarczycowe (TSH), glukoza
- uwzględnić odpowiednią diagnostykę różnicową.
- CRP, Hb, parametry tarczycowe (TSH), glukoza
Diagnostyka specjalistyczna
- Rozpoznanie stwardnienia rozsianego opiera się przede wszystkim na wywiadzie i przedmiotowym badaniu neurologicznym.
- Jeśli sam obraz kliniczny nie daje pewnych podstaw do postawienia rozpoznania SM, cennych informacji mogą dostarczyć istotne diagnostycznie badania RM, płynu mózgowo–rdzeniowego i wzrokowych potencjałów wywołanych (VEP). Badania te pomagają również wykluczyć inną diagnostykę różnicową.
Badanie rezonansu magnetycznego
- Wyniki:
- W typowych przypadkach choroby, w badaniu RM mózgu i rdzenia kręgowego stwierdza się obecność typowych plak demielinizacyjnych. Typowe plaki mają początkowo kształt okrągły lub owalny, są hiperintensywne w obrazach T2–zależnych oraz izo– lub hipointensywne w obrazach T1–zależnych (black holes – czarne dziury).
- Korzyści:
- Cenne informacje dodatkowe w diagnostyce SM.
- Informacje dotyczące wieku, lokalizacji i rozsiania ognisk choroby.
- Kwalifikacja do leczenia i ocena jego skuteczności.
- Czułość
- RM jest najczulszą metodą obrazowania w diagnostyce SM. Ponieważ jednak nie zapewnia optymalnej czułości i swoistości, istnieje pewne ryzyko uzyskania wyników fałszywie dodatnich i fałszywie ujemnych.20
- W wyjątkowych przypadkach badanie RM może dawać wynik ujemny nawet w klinicznie rozpoznanym stwardnieniu rozsianym.
- Zmiany widoczne w RM i kliniczny zakres deficytów neurologicznych nie zawsze się pokrywają.
Kryteria RM do rozpoznania rzutowo–remisyjnej postaci SM19
- Rozsianie w przestrzeni (dissemination in space – DIS)
- Co najmniej 1 zmiana hyperintensywna w obrazach T2–zależnych w co najmniej 2 z 4 lokalizacji w OUN:
- okołokomorowo
- podkorowo lub okołokorowo (w istocie białej bez kontaktu z korą)
- podnamiotowo
- w rdzeniu kręgowym.
- Co najmniej 1 zmiana hyperintensywna w obrazach T2–zależnych w co najmniej 2 z 4 lokalizacji w OUN:
- Rozsianie w czasie (dissemination in time – DIT)
- Spełnione 1 z następujących kryteriów:
- Jednoczesne występowanie co najmniej 1 ogniska wzmacniającego się po gadolinie (radiologiczny wykładnik rzutów choroby, utrzymujący się zwykle 2–4 tygodni) i 1 ogniska niewzmacniającego się.
- Występowanie nowego ogniska hyperintensywnego w T2 w kolejnym badaniu RM.
- Spełnione 1 z następujących kryteriów:
Badanie płynu mózgowo–rdzeniowego (PMR)
- Analiza PMR pozwala uwidocznić immunologiczny i zapalny charakter SM. Wspiera rozpoznanie, gdy kryteria RM nie są wystarczająco swoiste lub gdy obraz kliniczny nie jest typowy.
- Za patologiczny wynik badania, mogący wskazywać na stwardnienie rozsiane, uznaje się obecność prążków oligoklonalnych IgG (będących wynikiem produkcji immunoglobulin w OUN), wyraźnie różniących się od podobnych prążków w surowicy, lub podwyższonego indeksu IgG.
- Do analizy zalecana jest metoda ogniskowania izoelektrycznego (isoelectric focusing electrophoresis).
- Pleocytoza limfocytarna w PMR nie przekracza zwykle 50 komórek/mm3, a stężenie białka całkowitego zwykle jest niższe niż 1 g/l.
Wzrokowe potencjały wywołane (visual evoked potentials – VEP)
- W pewnych sytuacjach, na przykład gdy w badaniu RM wykrywa się niewiele lub mało swoistych zmian, dodatkowych informacji może dostarczyć badanie wzrokowych potencjałów wywołanych.
- Uzyskane wyniki mogą posłużyć jako uzupełnienie badania przedmiotowego w kierunku obiektywnego potwierdzenia drugiego ogniska, pod warunkiem, że pierwsza aktywna klinicznie zmiana nie zajęła dróg wzrokowych.
- Mierzony jest czas do pojawienia się dodatniego załamka P100 po zadziałaniu bodźcem w postaci biało–czarnej szachownicy.
- Zwiększona latencja po stymulacji wzrokowej (przy prawidłowym kształcie krzywej) jest typowa dla przebytego zapalenia nerwu wzrokowego.
Specjalistyczna diagnostyka laboratoryjna
- Wywiad, badanie przedmiotowe, diagnostyka RM i badanie PMR są wystarczające do postawienia rozpoznania SM. Inne badania laboratoryjne wymagane są tylko wtedy, gdy istnieje konkretne podejrzenie innej choroby.
- W razie potrzeby należy rozważyć następujące badania:
- CRP
- morfologia krwi z rozmazem
- badania biochemiczne surowicy (np. próby nerkowe i wątrobowe, elektrolity: mocznik, kreatynina, GGTP, ALP, AST, ALT, K, Na, Ca)
- glukoza we krwi
- witamina B12
- czynnik reumatoidalny (RF)
- badanie ogólne moczu.
- Inne badania specjalistyczne:
- ANA
- przeciwciała antyfosfolipidowe (APA)
- przeciwciała anty–dsDNA
- antykoagulant toczniowy (LA)
- ACE
- diagnostyka serologiczna boreliozy
- c–ANCA/p–ANCA
- profil ENA (przeciw rozpuszczalnym antygenom jądrowym)
- przeciwciała przeciwko akwaporynie–4 (jeśli konieczne dla różnicowania zapalenia rdzenia kręgowego i nerwu wzrokowego)
- diagnostyka serologiczna HIV
- diagnostyka zakażenia HTLV–1
- odczyn biernej hemaglutynacji krętków (Treponema Pallidum Hemagglutination Assay – TPHA)
- długołańcuchowe kwasy tłuszczowe
- diagnostyka serologiczna mykoplazm
- wydzielanie kwasu metylomalonowego w moczu.
Dalsza diagnostyka
- TK głowy
- Badanie TK głowy zazwyczaj nie wykazuje żadnych zmian, duże ogniska mogą natomiast być uwidocznione jako obszary lekko hipointensywne. TK głowy może odgrywać ważną rolę w diagnostyce różnicowej w celu wykluczenia guzów śródczaszkowych.
- Drogi moczowe
- W przypadku występowania objawów ze strony układu moczowego wskazane może być również badanie urodynamiczne, cystoskopia oraz USG nerek i pęcherza.
- Do oceny ilości przyjmowanych i wydalanych płynów pomocny może być dodatkowo dzienniczek mikcji.
Wskazania do skierowania do specjalisty
- Neurolog
- W przypadku klinicznego podejrzenia choroby.
- Na okresowe badanie kontrolne (zwykle co kwartał).
- Na pograniczu medycyny rodzinnej i neurologii jak dotąd nie ma konkretnych zaleceń (np. w ramach wytycznych interdyscyplinarnych) dotyczących stałej opieki nad pacjentami ze stwardnieniem rozsianym i prowadzenia leczenia.
- Leczenie rzutów i terapia lekami DMT powinny być prowadzone w specjalistycznych ośrodkach przez lekarzy mających doświadczenie w leczeniu SM.
- Urolog
- Leczenie neurogennych dysfunkcji pęcherza moczowego w ścisłym porozumieniu z prowadzącym lekarzem neurologiem.
- Urolog/Androlog/Ginekolog
- W przypadku dysfunkcji seksualnych (kobiety, mężczyźni).
- Nefrologa
- W przypadku białkomoczu lub krwiomoczu podczas prowadzonej terapii, np. alemtuzumabem (patrz odpowiednia sekcja).
Lista kontrolna dotycząca skierowania
Stwardnienie rozsiane (sclerosis multiplex – SM)
- Cel skierowania
- Diagnostyka potwierdzająca? Leczenie? Inny?
- Wywiad lekarski
- Kiedy postawiono rozpoznanie? Przebieg i rozwój choroby: szybka progresja? Powikłania?
- Objawy: niedowłady, zaburzenia widzenia, inne? W przypadku zaawansowanej choroby: skurcze mięśniowe, ataksja, dyzartria, ból?
- Inne istotne choroby? Leki przyjmowane regularnie?
- Terapia próbna: jakim lekiem i z jakim skutkiem?
- Następstwa: Utrata sprawności? Niezdolność do pracy? Poziom aktywności?
- Badanie fizykalne
- Stan ogólny? Stan neurologiczny? Sytuacja psychosocjalna pacjenta?
- Badania uzupełniające
- Dalsza diagnostyka
- Ewentualne wyniki ostatnich badań, np. RM, TK, inne.
Leczenie
Cele leczenia
- Poprawa lub utrzymanie jakości życia.
- Skrócenie i zmniejszenie częstości rzutów choroby, a tym samym zapobieganie potencjalnie narastającemu upośledzeniu sprawności pacjenta.
Ogólne informacje o leczeniu
- Nie istnieje leczenie przyczynowe.
- Dzięki nowym kryteriom, obecnie rozpoznanie SM można postawić na wcześniejszym etapie choroby. Istnieje wiele dowodów na korzyści płynące z wcześnie rozpoczętego leczenia SM. Obecnie dostępne jest całe spektrum przeciwzapalnych i immunomodulujących terapii modyfikujących przebieg choroby (disease modifying therapies – DMT).
- Zasady leczenia
- Leczenie ma na celu zwalczanie ostrych rzutów, zapobieganie nawrotom i progresji choroby, łagodzenie objawów oraz rehabilitację pacjenta.
- Często konieczne jest równoczesne leczenie objawowe zawrotów głowy, dysfunkcji pęcherza moczowego, zaparć, bólu neurogennego i spastyczności.
- Choroba nierzadko powoduje poważne problemy psychospołeczne i u wielu pacjentów prowadzi do depresji.
- Terapia powinna być wprowadzana i kontrolowana przez neurologów doświadczonych w diagnostyce i leczeniu SM. Lekarze prowadzący powinni mieć szczególną wiedzę na temat stosowanych leków, aby móc udzielić właściwych informacji.
Ukierunkowanie na aktywność choroby
Leczenie rzutów
- Metyloprednizolon
- 500–1000 mg na dobę, dożylnie przez 3–5 dni, rzadko kontynuowany, następnie doustnie maksymalnie do 10 dni w redukowanych stopniowo dawkach.
Leki modyfikujące przebieg choroby (disease modifying therapies – DMT): wpływ na wskaźnik rzutów
- Stosowane w ramach programów terapeutycznych, zarezerwowane dla chorych z aktywnym przebiegiem SM.
- Zasady leczenia stwardnienia rozsianego w Polsce lekami modyfikującymi przebieg choroby określa program lekowy B.29 (chorzy z aktywnym przebiegiem SM).
- W zależności od wpływu na zmniejszanie częstości rzutów, immunoterapeutyki dzieli się na leki 3 linii:
- I. Leki pierwszej linii (względne zmniejszenie częstości rzutów w porównaniu z placebo o 30–50%)
- interferony beta–1b i beta–1a
- fumaran dimetylu
- octan glatirameru
- teryflunomid (uwaga: działanie teratogenne – nie stosować u kobiet w wieku rozrodczym!)
- azatiopryna tylko w wyjątkowych przypadkach
- dopuszcza się w przypadku braku możliwości zastosowania interferonu beta lub gdy podczas jej stosowania uzyskuje się stabilizację przebiegu choroby
- niska skuteczność, skąpe dane
- np. w przypadku chorób towarzyszących, takich jak choroba Leśniowskiego–Crohna lub miastenia rzekomoporaźna (myasthenia gravis), które dobrze reagują na azatioprynę.
- II. Leki drugiej linii (względne zmniejszenie częstości rzutów w porównaniu z placebo o 50–60%)
- III. Leki trzeciej linii (zmniejszenie częstości nawrotów >60% w porównaniu z placebo lub >40% w porównaniu do leków pierwszej linii)
- alemtuzumab
- przeciwciała monoklonalne przeciw limfocytom B CD20:
- I. Leki pierwszej linii (względne zmniejszenie częstości rzutów w porównaniu z placebo o 30–50%)
- W zależności od postaci choroby stosuje się różne leki. O ile wyraźnie nie stwierdzono inaczej, podana tutaj kolejność leków jest alfabetyczna i nie wskazuje na ewentualną hierarchię skuteczności poszczególnych substancji czynnych.
- CIS (zespoły klinicznie izolowane)
- W Polsce nie ma obecnie możliwości refundowania leczenia lekami modyfikującymi przebieg choroby dla pacjentów z CIS bez rozpoznania SM.
- Postać rzutowo–remisyjna (RRMS) w pierwszej linii leczenia
- Postać rzutowo–remisyjna (RRMS) w drugiej linii leczenia
- okrelizumab
- fingolimod
- natalizumab dożylnie
- natalizumab podskórnie
- alemtuzumab
- kladrybina.
- Postać wtórnie postępująca SPMS
- Postać pierwotnie postępująca PPMS
- przeciwciała monoklonalne przeciwko limfocytom B CD20
- Dowodem na skuteczność leczenia modyfikującego przebieg choroby jest osiągnięcie NEDA (no evidence of disease activity) definiowanego jako brak w określonym czasie (zwykle 2 lat):21
- rzutów choroby (NEDA–1)
- postępu niesprawności wyrażonej skalą EDSS (NEDA–2)
- nowych i/lub aktywnych zmian w badaniu RM (NEDA–3)
- narastania atrofii mózgu (NEDA–4)
- stabilne stężenie łańcuchów lekkich białka neurofilamentu (NEDA–5).22
Zalecenia dla pacjentów
- W łagodnym i umiarkowanym ograniczeniu sprawności czynnościowej, aktywność fizyczna może przyczynić się do poprawy sprawności, mobilności i jakości życia. Dzięki treningowi pacjent może poprawić długość dystansów marszowych, szybkość chodzenia i wytrzymałość.23
- Jednym z najczęstszych objawów SM jest zmęczenie w postaci wyraźnego wyczerpania. Pacjenci szybko się męczą, co może poważnie ograniczać ich wydajność zawodową i aktywność w życiu prywatnym. Kluczowe znaczenie ma wówczas dokładne zaplanowanie i właściwe dostosowanie aktywności do poziomu sprawności własnej pacjenta.
- U wielu pacjentów objawy nasilają się przy wysokich temperaturach, dlatego powinni unikać np. sauny i opalania się.
- Ważna jest zdrowa i urozmaicona dieta: zaleca się spożywanie produktów pełnoziarnistych, ryb (2 do 3 razy w tygodniu) oraz białego mięsa. Nasycone tłuszcze zwierzęce, obecne w tłustych produktach mlecznych lub mięsnych, a zwłaszcza w czerwonym mięsie, powinny być spożywane z umiarem. Zaleca się spożywanie dużej ilości owoców i warzyw (5 porcji dziennie).
Leki immunomodulacyjne
Interferon beta–1a i –1b
- Terapia interferonem może spowolnić postęp choroby u wybranych pacjentów.
- Wczesne włączenie leczenia interferonem beta po pierwszym rzucie choroby (zespoły klinicznie izolowane) wydaje się zmniejszać częstość występowania potwierdzonego klinicznie SM oraz hamować postępującą utratę tkanki nerwowej mózgu u pacjentów z zespołami klinicznie izolowanymi.
- Do leczenia takiego kwalifikują się:
- pacjenci z aktywną postacią rzutowo–remisyjną SM z co najmniej 2 rzutami w ciągu ostatnich 2–3 lat i zachowaną zdolnością chodzenia.
- Skuteczność
- Częstość rzutów choroby zmniejsza się o około 30%.
- Zmniejsza się nasilenie objawów podczas rzutów.
- W badaniu RM wykrywanych jest mniej nowych i aktywnych zmian.
- Nie wszyscy pacjenci odpowiadają na tę terapię, a u niektórych początkowy efekt stopniowo maleje.
- Tworzenie się przeciwciał neutralizujących przeciwko interferonowi beta (IFNb–NAb) wydaje się ograniczać działanie leku. W przypadku podejrzenia takiej sytuacji, przydatne może być oznaczenie poziomu tych przeciwciał.
- Przesłanki diagnostyczne i terapeutyczne
- Choroba jest w stadium aktywnym i prowadzi do rzutów klinicznych.
- Rozpoznanie można potwierdzić badaniem RM (nowe, rosnące lub wzmacniające się po podaniu środka kontrastowego zmiany) oraz badaniem płynu mózgowo–rdzeniowego (wewnątrzpłynowa synteza IgG).
- Leczenie prowadzi neurolog w specjalistycznym ośrodku.
- Nie ustalono dokładnie, kiedy najlepiej rozpocząć terapię, jak długo powinna trwać, jak postępować w przypadku niepowodzenia, w jaki sposób w razie potrzeby przerwać leczenie i jakie są jej długoterminowe efekty.
- Ogromne znaczenie ma dokładne pouczenie pacjenta i staranne zaplanowanie badań kontrolnych.
- Diagnostyka w pierwszym okresie leczenia
- Przedmiotowe badanie neurologiczne z oceną deficytów funkcjonalnych za pomocą skali EDSS (Expanded Disability Status Scale) oraz morfologia krwi.
- Morfologia z różnicowaniem leukocytów, AST, ALT, ALP, GGTP, bilirubina, T4 i TSH, elektrolity i kreatynina.
- Przedmiotowe badanie neurologiczne z oceną deficytów funkcjonalnych za pomocą skali EDSS (Expanded Disability Status Scale) oraz morfologia krwi.
- Droga podawania leków
- Poszczególne preparaty podawane są podskórnie lub domięśniowo.
- Przeciwwskazania:
- Wtórnie postępująca postać stwardnienia rozsianego
- Wyniki terapii nie są spójne. Nie ma przekonujących dowodów na jej skuteczność.
- Interferon beta–1b został zatwierdzony przez Europejską Agencję Leków (EMA) we wskazaniu do leczenia wtórnie postępującej postaci SM. Terapia wydaje się być najbardziej skuteczna u pacjentów z aktywną chorobą przebiegającą w postaci rzutów.
- Pierwotnie postępująca postać stwardnienia rozsianego
- Nie ma preparatów zatwierdzonych do leczenia pierwotnie postępującej postaci SM.
Octan glatirameru
- Wskazanie
- RRMS o przebiegu łagodnym do umiarkowanego.
- Dawkowanie
- 20 mg podskórnie 1 x na dobę.
- Skuteczność
- Skuteczność jest porównywalna z leczeniem interferonem beta–1a i –1b.
- Dostępne dane naukowe dotyczące skuteczności interferonu beta–1a i –1b oraz octanu glatirameru dotyczą jedynie pacjentów w grupie wiekowej od 18 do 45 lat z oceną EDSS do 5,0.
- Jedno z badań sugeruje, że wcześnie rozpoczęta terapia octanem glatirameru może wydłużyć czas od pierwszego objawu do potwierdzonego klinicznie SM. Stwierdzono, że czas, w którym u 1 na 4 pacjentów zostaje postawione potwierdzone rozpoznanie SM, zwiększył się o 115% (z 336 do 722 dni).24
Teryflunomid25
- Lek jest zatwierdzony do leczenia rzutowo-remisyjnej postaci SM.
- Mechanizm działania
- Teryflunomid jest aktywnym metabolitem leflunomidu, pochodnej izoksazolu, stosowanej jako podstawowy lek w terapii chorób reumatycznych.
- Teryflunomid hamuje dehydrogenazę dihydroorotanową (DHODH), która katalizuje 4. etap syntezy de novo pirymidyny w mitochondriach. Hamuje to proliferację aktywowanych limfocytów, ale nie innych limfocytów, które mogą zaspokajać swoje zapotrzebowanie na pirymidynę niezależnie od DHODH. Dzięki temu, teryflunomid działa cytostatycznie na limfocyty i ma działanie immunomodulacyjne w SM.
- Skuteczność
- W badaniach rejestracyjnych stwierdzono, że teryflunomid (14 mg) zmniejsza częstość rzutów w rzutowo–remisyjnej postaci SM (RRMS) o 31–36% i progresję choroby o 26–29% w porównaniu z placebo.
- Teryflunomid (14 mg) zmniejszał ilość zmian na obrazach T1–zależnych w RM po podaniu gadolinowego środka kontrastowego o 80% (na badanie) w porównaniu z placebo i powodował względne zmniejszenie narastania objętości zmian w obrazach T2–zależnych o 77%.
- W randomizowanym badaniu ze ślepą próbą stwierdzono również, że teryflunomid (14 mg) wykazuje skuteczność porównywalną z interferonem beta–1a pod względem rocznej częstości rzutów choroby.
- Teryflunomid (14 mg) znacząco zmniejszał odsetek pacjentów z klinicznie izolowanym rzutem choroby (CIS), u których wystąpił klinicznie nowy rzut choroby lub u których stwierdzono ponowną aktywność choroby w badaniu RM.
- Skuteczność teryflunomidu porównywalna jest z leczeniem interferonem w dużych dawkach.
- Wskazania
- Rzutowo–remisyjna postać SM (RRMS) o przebiegu łagodnym do umiarkowanego.
- Przeciwwskazania
- Teryflunomidu nie wolno stosować u pacjentów z ciężkimi zaburzeniami czynności wątroby lub nerek, ciężkim niedoborem odporności, ciężkimi aktywnymi przewlekłymi zakażeniami lub ciężką mielosupresją.
- Ryzyko teratogenne!
- Nie należy stosować w okresie ciąży ani laktacji.
- U pacjentek w wieku rozrodczym należy wybierać alternatywne leki pierwszej linii o podobnej skuteczności, ale mniejszym ryzyku.
- Dawkowanie
- Teryflunomid podaje się 1 x na dobę doustnie (tabletki 14 mg).
- Przed rozpoczęciem leczenia
- Dokładna analiza wskazań.
- Wyczerpująca ustna i pisemna informacja dla pacjentów o spodziewanej skuteczności i możliwych działaniach niepożądanych leku, a także o tym, że terapia wymaga ścisłego monitorowania parametrów krwi.
- Ocena częstości rzutów (w ciągu ostatniego roku) i zmian w zakresie deficytów funkcjonalnych w ostatnim roku za pomocą skali EDSS (Expanded Disability Status Scale), ewentualnie testu SDMT (Symbol Digit Modalities Test) i/lub MSFC (Multiple Sclerosis Functional Composite).
- Uwzględnienie wcześniejszych farmakoterapii i ocena, czy konieczny jest okres eliminacji leku z ustroju (washout).
- Badanie RM przed/po rozpoczęciu leczenia.
- Badania hematologiczne krwi, w tym rozmaz krwi obwodowej, CRP, kreatynina i próby wątrobowe (ALT).
- Pomiar ciśnienia tętniczego.
- Badania przesiewowe w kierunku gruźlicy u pacjentów z grupy ryzyka.
- Pouczenie kobiet o konieczności stosowania skutecznej metody antykoncepcji.
- W trakcie leczenia
- Po 1 miesiącu: kontrola w kierunku możliwych działań niepożądanych.
- Po 3 i 6 miesiącach, a następnie co pół roku: kontrolne badanie u neurologa.
- Po 3 i 6 miesiącach, a następnie co pół roku: badania hematologiczne krwi, w tym rozmaz krwi obwodowej oraz CRP.
- Co 2 tygodnie przez pierwsze 6 miesięcy, potem co 2 miesiące: oznaczenie we krwi ALT.
- Po 1, 3 i 6 miesiącach, potem mniej więcej co pół roku: pomiar ciśnienia tętniczego.
- Co pół roku: ocena aktywności choroby (częstości rzutów oraz ocena sprawności funkcjonalnej za pomocą testu EDSS (Expanded Disability Status Scale) i ewentualnie SDMT i MSFC.
- Raz w roku badanie RM.
- Po przerwaniu leczenia teryflunomidem wymagana jest w niektórych przypadkach przyspieszona eliminacja leku przy użyciu cholestyraminy (3 x 8 g przez okres 11 dni) lub węgla aktywowanego (2 x 50 g przez okres 11 dni). Przy zmianie leczenia na inny lek zalecany jest okres eliminacji teryflunomidu z ustroju (washout).
- Interakcje
- Teryflunomid może wchodzić w interakcje z lekami indukującymi P450 (CYP) i transporterami leków, a także inhibitorami reduktazy HMG–CoA (statynami).
- Szybkie i znaczące zmniejszenie stężenia teryflunomidu w osoczu można uzyskać po zastosowaniu cholestyraminy lub węgla aktywowanego.
- Działania niepożądane
- Terapia teryflunomidem w większości przypadków jest dobrze tolerowana i zwykle towarzyszą jej stosunkowo łagodne, przejściowe działania niepożądane.26 Według badań rejestracyjnych najczęstsze działania niepożądane to zakażenia górnych dróg oddechowych, zakażenia dróg moczowych, parestezje, biegunka, nudności, zwiększenie aktywności ALT oraz wypadanie włosów.
Fumaran dimetylu
- Mechanizm działania
- Fumaran dimetylu jest lekiem o działaniu immunomodulującym, który stosuje się doustnie.
- Działa przeciwzapalnie poprzez obniżenie stężenia cytokin prozapalnych i zwiększenie poziomu cytokin przeciwzapalnych.
- Działa również na endogenne komórkowe systemy antyoksydacyjne poprzez czynnik transkrypcyjny Nrf2 (nuclear factor erythroid 2–related factor 2). Badania in vitro sugerują, że oprócz właściwości przeciwzapalnych fumaran dimetylu chroni również komórki glejowe przed stresem oksydacyjnym.
- Łącznie działania te przyczyniają się do zmniejszenia aktywności choroby.
- Skuteczność
- Istnieją umiarkowanej jakości dowody na to, że lek zmniejsza liczbę nawrotów.27 Na podstawie dotychczasowych badań nie można również jednoznacznie ocenić skuteczności leku w zakresie narastania u pacjenta niepełnosprawności i zmian wykrywanych w RM.
- Wskazania
- Rzutowo–remisyjna postać SM.
- Przeciwwskazania
- Fumaranu dimetylu nie wolno stosować u pacjentów z ciężkim niedoborem odporności, ciężkimi aktywnymi przewlekłymi zakażeniami lub ciężką mielosupresją.
- Fumaran dimetylu jest przeciwwskazany w przypadku podejrzenia lub potwierdzenia postępującej wieloogniskowej leukoencefalopatii (PML), nie wolno go również stosować w ciężkiej limfopenii (liczba limfocytów <0,5 × 109/l).
- Dawkowanie
- W 1. tygodniu 120 mg 2 x na dobę, potem 240 mg 2 x na dobę.
- Przed rozpoczęciem leczenia
- Wyczerpująca informacja dla pacjentów o spodziewanej skuteczności i możliwych działaniach niepożądanych leku oraz o badaniach kontrolnych wymaganych podczas stosowania tej terapii.
- Ocena częstości rzutów i deficytów funkcjonalnych w ostatnim roku za pomocą skali EDSS (Expanded Disability Status Scale) i ewentualnie testów SDMT i MSFC.
- Uwzględnienie wcześniejszych farmakoterapii i ocena, czy konieczny jest okres eliminacji leku z ustroju (washout).
- Badanie RM przed/po rozpoczęciu terapii.
- Badania hematologiczne krwi, w tym rozmaz krwi obwodowej, CRP, kreatynina i próby wątrobowe (ALT).
- U kobiet w wieku rozrodczym: pouczenie o konieczności stosowania bezpiecznej metody antykoncepcji.
- W trakcie leczenia: ocena i postępowanie
- Po 1 miesiącu: kontrola w kierunku możliwych działań niepożądanych.
- Po 3 i 6 miesiącach, a następnie co pół roku: kontrolne badanie u neurologa.
- Po 3 i 6 miesiącach, a następnie co pół roku: badania hematologiczne krwi, w tym rozmaz krwi obwodowej, CRP, kreatynina i ALT).
- Co pół roku: ocena aktywności choroby (częstości rzutów oraz ocena sprawności funkcjonalnej za pomocą testu EDSS (Expanded Disability Status Scale) i ewentualnie SDMT i MSFC.
- Raz w roku badanie RM.
- Interakcje
- Nie są znane.
- Działania niepożądane
- Terapia fumaranem dimetylu jest zwykle dobrze tolerowana.
- Według badań rejestracyjnych najczęstszymi działaniami niepożądanymi są znaczne zaczerwienienie (flushing, u około 35% pacjentów) oraz dolegliwości żołądkowo–jelitowe, takie jak nudności, bóle oraz biegunka (u około 25% pacjentów). Opisane objawy niepożądane zwykle ustępowały w ciągu miesiąca.
- Terapia powoduje często niewielkie obniżenie poziomu leukocytów i limfocytów, ale tylko w rzadkich przypadkach wartości te spadają poniżej dolnej granicy normy.
- Fumaran dimetylu może powodować zwiększenie aktywności enzymów wątrobowych (ALT oraz AST), przeważnie w ciągu pierwszych 6 miesięcy.
- Zgłaszano przypadki postępującej wieloogniskowej leukoencefalopatii (PML) w związku ze stosowaniem fumaranu dimetylu nawet w przypadku łagodnej limfopenii (wcześniej za przeciwwskazanie uważano tylko umiarkowaną lub ciężką limfopenię). Jeśli liczba limfocytów jest poniżej normy, przed rozpoczęciem leczenia fumaranem dimetylu należy przeprowadzić szczegółową ocenę potencjalnych przyczyn. Fumaran dimetylu należy odstawić u pacjentów z ciężką limfopenią (liczba limfocytów <0,5 x 109/l) utrzymującą się ponad 6 miesięcy.
Natalizumab
- Wskazania
- Monoterapia nawracająco–remisyjnej postaci SM, które wykazuje wysoką aktywność pomimo stosowania leków pierwszej linii (interferonu beta i octanu glatirameru).
- Pacjenci z szybko postępującym SM z ciężkimi rzutami.
- Natalizumab jest rekombinowanym przeciwciałem monoklonalnym skierowanym przeciwko integrynie alfa–4, które hamuje przyleganie aktywowanych komórek układu odpornościowego i ich migrację przez barierę krew–mózg (antagonista integryny alfa–4).
- Skuteczność
- Natalizumab zmniejsza roczne ryzyko nawrotu o około 70% i liczbę nowych lub powiększonych zmian w mózgu w RM o ponad 80%.
- Ponadto terapia może prowadzić do remisji aktywności choroby zarówno klinicznie jak i radiologicznie.
- Lek podaje się w postaci wlewów dożylnych (300 mg) 1 x co 4 tygodnie.
- Wśród 99 571 pacjentów z SM leczonych natalizumabem odnotowano łącznie 212 przypadków postępującej wieloogniskowej leukoencefalopatii (PML).28
- Daje to częstotliwość 2,1 przypadków na 1000 pacjentów.
- W około 23% przypadków przebieg PML kończył się zgonem.
- Ryzyko wystąpienia PML zwiększa się wraz z liczbą podanych dawek leku i jest wyższe u osób z wcześniejszym zakażeniem wirusem JC (Human polyomavirus 2) oraz u osób wcześniej leczonych lekami immunosupresyjnymi.
- Natalizumab jest przeciwwskazany w PML, występującej obecnie lub w wywiadzie.
- Natalizumab jest zatwierdzony od 2006 roku jako lek drugiej linii (po leczeniu interferonem beta i octanem glatirameru).
- Stwierdzono (EMA), że korzyści ze stosowania natalizumabu przewyższają ryzyko, ale pacjenci muszą być w pełni poinformowani o możliwych działaniach niepożądanych.
- Natalizumab wymaga ścisłego monitorowania działań niepożądanych. Leczenie należy natychmiast przerwać, jeśli wystąpią objawy PML.
- Należy poinformować pacjentów – zarówno ustnie, jak i pisemnie – o ryzyku i możliwych działaniach niepożądanych podczas terapii natalizumabem.
- W trakcie leczenia mogą powstawać przeciwciała neutralizujące przeciwko natalizumabowi. Po 6 i 12 miesiącach od rozpoczęcia leczenia zaleca się kontrolne oznaczenie przeciwciał neutralizujących.
Modulatory receptorów sfingozyno–1–fosforanu (S1P)
Fingolimod
- Wskazania
- Od 2011 roku zatwierdzony jako terapia drugiej linii: monoterapia nawracająco–remisyjnej postaci SM, które wykazuje wysoką aktywność pomimo stosowania leków pierwszej linii (interferonu beta lub octanu glatirameru).
- Pacjenci w grupie wiekowej 10–17 lat z wysoce aktywną postacią RRMS (patrz punkt w wieku dziecięcym).
- Nie należy stosować w PPMS ze względu na ich niedostateczną skuteczność.
- Osoby z SPMS nie powinny rozpoczynać leczenia fingolimodem.
- Fingolimod (0,5 mg) podaje się doustnie 1 x na dobę.
- Fingolimod (modulator receptorów sfingozyno–1–fosforanu) zatrzymuje limfocyty w obwodowych węzłach chłonnych, co prowadzi do redystrybucji autoreaktywnych limfocytów T i zmniejszenia aktywności zapalnej w OUN.
- Skuteczność w RRMS (leki drugiej linii)
- Fingolimod 0,5 mg powodował względne zmniejszenie częstości nawrotów o 55% w porównaniu z placebo.
- Progresja choroby potwierdzona po 6 miesiącach zmniejszyła się o 34% po 2 latach.
- Analiza obrazów RM wykazała, że całkowita liczba nowych lub powiększonych zmian na obrazach T2–zależnych zmniejszyła się o 75%, a liczba zmian na obrazach T1–zależnych po podaniu gadolinowego środka kontrastowego zmniejszyła się o 81%.
- Skuteczność jest znacząco wyższa w porównaniu z placebo i beta–interferonem.
- Działania niepożądane
- Według badań rejestracyjnych podczas terapii fingolimodem wystąpiły 2 zgony (opryszczkowe–zapalenie mózgu i półpaścowe zapalenie mózgu).
- Ponieważ na początku leczenia istnieje ryzyko wystąpienia zaburzeń rytmu serca, po podaniu pierwszej dawki wymagane jest zwiększone monitorowanie układu sercowo–naczyniowego.
- W Stanach Zjednoczonych terapia jest przeciwwskazana w zawałach serca, udarach mózgu lub TIA przebytych w ciągu ostatnich 6 miesięcy lub gdy stosowane są leki antyarytmiczne klasy Ia lub III.
- Inne opisywane działania niepożądane to nadciśnienie tętnicze, obrzęk plamki i wzrost aktywności transaminaz wątrobowych.
- W szczególności po zmianie leczenia z natalizumabu, w pierwszych miesiącach stosowania fingolimodu obserwowano pojedyncze przypadki PML (carry–over PML).
- Stwierdzono (EMA), że korzyści ze stosowania fingolimodu przewyższają ryzyko, ale pacjenci muszą być w pełni poinformowani o możliwych działaniach niepożądanych.
- Jeśli pacjent choruje jednocześnie na cukrzycę lub jeśli występowało u niego zapalenie błony naczyniowej przed rozpoczęciem leczenia, należy rozważyć ewentualną konsultację z kardiologiem i skierowanie na badanie okulistyczne. Badanie okulistyczne powinno obejmować optyczną koherentną tomografię (OCT).
- W przypadku pacjentów, którzy nie są jeszcze odporni, przed rozpoczęciem leczenia wymagane jest zaszczepienie przeciwko ospie wietrznej (Varicella zoster).
- Fingolimod jest przeciwwskazany w ciąży oraz u kobiet w wieku rozrodczym, które nie stosują skutecznej metody antykoncepcji.
- Podczas stosowania należy monitorować czynność wątroby, wykonywać co 3 miesiące badania czynnościowe wątroby, w tym stężenia bilirubiny w surowicy. Jeśli aktywność aminotransferaz zwiększy się ponad 3–krotnie w stosunku do górnej wartości referencyjnej, należy przeprowadzać częstsze badania kontrolne, a jeśli zwiększy się ponad 5–krotnie, leczenie należy przerwać.
- Podczas stosowania fingolimodu występowały przypadki zapalenia opon mózgowo-rdzeniowych i mózgu wywołanego przez VZV. Dlatego przed rozpoczęciem leczenia należy wykonać test na obecność przeciwciał przeciwko VZV. Jeśli test jest ujemny, szczepienie należy wykonać przed rozpoczęciem leczenia. Glikokortykosteroidy stosowane w dużych dawkach mogą pogorszyć przebieg leczenia. Dlatego w przypadku pogorszenia lub nawrotu objawów neurologicznych, podczas leczenia fingolimodem należy brać pod uwagę nie tylko rzut w przebiegu SM, ale także zapalenie mózgu wywołane przez VZV.
Siponimod
- Wskazania
- Od stycznia 2020 roku zatwierdzony do leczenia dorosłych pacjentów z aktywną postacią SPMS.
- Lek drugiej linii.
- Działania niepożądane
- Brak istotnych różnic w stosunku do fingolimodu.
- Bezwzględnie przeciwwskazany w ciąży.
- Nie należy stosować w okresie laktacji.
Ozanimod
- Od maja 2020 roku zatwierdzony do leczenia pacjentów z aktywną postacią RRMS.
- Lek drugiej linii.
- Tolerancja i profil bezpieczeństwa podobne do fingolimodu
- Limfopenia, bloki AV i zaburzenia aktywności enzymów wątrobowych wydają się jednak występować rzadziej.
- Bezwzględnie przeciwwskazany w ciąży.
- Nie należy stosować w okresie laktacji.
Alemtuzumab
- Dopuszczony do obrotu od 2015 roku.
- Mechanizm działania29
- Alemtuzumab jest humanizowanym przeciwciałem monoklonalnym, które wiąże się z cząsteczkami CD52 na powierzchni limfocytów T i B powodując ich cytolizę na drodze zależnej od przeciwciał i układu dopełniacza.
- Prowadzi to do długotrwałej deplecji (niski poziom) komórek B (do 6 miesięcy) i T (ponad 1 rok) oraz późniejszej repopulacji limfocytów ze zmienionym rozkładem podgrup. W szczególności można zaobserwować nagromadzenie komórek T regulatorowych i komórek T pamięci.
- Zakłada się, że terapia usuwa „niekorzystne” populacje limfocytów, po czym następuje repopulacja limfocytów o korzystniejszym profilu w SM. Prowadzi to do zmniejszenia aktywności choroby: zmniejsza się częstość nawrotów i progresja trwałych ograniczeń sprawności.
- Skuteczność
- Według badań rejestracyjnych alemtuzumab prowadzi do względnego zmniejszenia częstości rzutów o 50–54% i zmniejszenia progresji choroby o 27–35% w porównaniu z interferonem beta–1a.
- Ponadto, w porównaniu z interferonem beta–1a, alemtuzumab powodował redukcję liczby zmian na obrazach T1–zależnych po podaniu gadolinowego środka kontrastowego w RM po 2 latach o 61–63%.30
- Wskazania ograniczone do odwołania
- Lek został pierwotnie zatwierdzony do leczenia dorosłych pacjentów z rzutowo-remisyjną postacią SM (RRMS) o wysokiej aktywności, potwierdzonej klinicznie lub w badaniach RM.
- W listopadzie 2019 roku Europejska Agencja Leków (EMA) ograniczyła to wskazanie ze względu na obawy dotyczące bezpieczeństwa, stwierdzając, że alemtuzumab powinien być stosowany wyłącznie u dorosłych z wysoce aktywnym RRMS pomimo odpowiedniego leczenia co najmniej jednym innym lekiem modyfikującym przebieg choroby oraz u pacjentów z szybko postępującym SM w postaci rzutów. Leczenie powinno odbywać się w szpitalu z szybkim dostępem do intensywnej terapii i specjalistów wykwalifikowanych w leczeniu poważnych działań niepożądanych.
- Przeciwwskazania
- Alemtuzumabu nie wolno stosować u pacjentów z zakażeniem HIV lub innymi ciężkimi zakażeniami przewlekłymi, lub w przypadku uczulenia na substancję czynną.
- Alemtuzumabu nie wolno również stosować w okresie ciąży i laktacji.
- Alemtuzumab nie powinien być stosowany u osób z niektórymi chorobami serca, krążenia i zaburzeniami krzepnięcia krwi.
- Dawkowanie
- Alemtuzumab podaje się w postaci wlewu dożylnego w dawce 12 mg przez 5 kolejnych dni na początku terapii oraz w dawce 12 mg przez 3 kolejne dni po upływie roku od pierwszego podania (cykl uzupełniający).
- W przypadku ponownej aktywności choroby można zastosować dodatkowy cykl w odstępie 1 roku.
- W każdym z pierwszych 3 dni przed podaniem alemtuzumabu należy stosować u pacjentów premedykację z użyciem 1000 mg metyloprednizolonu dożylnie.
- Należy rozważyć leczenie uzupełniające lekami przeciwhistaminowymi i (lub) przeciwgorączkowymi przed podaniem alemtuzumabu. Ponadto pacjenci powinni przyjmować acyklowir doustnie w dawce 200 mg 2 x dziennie podczas terapii infuzyjnej i przez kolejne 4 tygodnie.
- Przed rozpoczęciem leczenia
- Dokładna ocena wskazań.
- Wyczerpująca ustna i pisemna informacja dla pacjentów o spodziewanej skuteczności i możliwych działaniach niepożądanych leku, a także o konieczności comiesięcznych badań kontrolnych krwi i moczu w trakcie leczenia i przez co najmniej 48 miesięcy po podaniu ostatniej dawki.
- Ocena częstości rzutów (w ciągu ostatniego roku) i zmian w zakresie deficytów funkcjonalnych w ostatnim roku za pomocą skali EDSS (Expanded Disability Status Scale), ewentualnie testu SDMT i MSFC.
- Uwzględnienie wcześniejszych farmakoterapii i ocena, czy konieczny jest okres eliminacji leku z ustroju (washout).
- Badanie RM przed/po rozpoczęciu terapii.
- Badania przesiewowe w kierunku zakażenia (gruźlicą, wirusem zapalenia wątroby typu B i wirusem zapalenia wątroby typu C, ewentualnie HIV) u pacjentów z grupy ryzyka.
- Badania hematologiczne krwi, w tym rozmaz krwi obwodowej, CRP, kreatynina i próby wątrobowe (ALT), a także hormony tarczycy (TSH).
- Badanie moczu: testy paskowe wystarczają do badań przesiewowych.
- W razie potrzeby wykonać wszelkie planowane szczepienia co najmniej 6 tygodni przed rozpoczęciem terapii.
- Badania przesiewowe w kierunku wirusa ospy wietrznej i półpaśca (VZV) oraz szczepienie pacjentów, u których nie wykryto przeciwciał przeciw VZV, przed rozpoczęciem terapii alemtuzumabem.
- Ewentualnie badania przesiewowe w kierunku wirusa brodawczaka ludzkiego (HPV) u kobiet.
- U kobiet w wieku rozrodczym: pouczenie o konieczności stosowania skutecznej metody antykoncepcji.
- Premedykacja metyloprednizolonem, lekami przeciwhistaminowymi i (lub) przeciwgorączkowymi przed wlewem alemtuzumabu oraz acyklowirem w trakcie/po wlewie, jak wskazano powyżej w punkcie dawkowanie.
- Podczas leczenia – wytyczne dotyczące monitorowania
- Monitorowanie parametrów życiowych, w tym ciśnienia tętniczego, przed i w trakcie wlewów
- W przypadku klinicznie istotnych zmian funkcji życiowych: należy przerwać infuzję i rozważyć dodatkowe monitorowanie, w tym EKG.
- Monitorowanie parametrów czynności wątroby przed i w trakcie leczenia
- W przypadku wystąpienia objawów uszkodzenia wątroby lub pojawienia się innych poważnych reakcji immunologicznych, leczenie należy kontynuować jedynie po dokładnej ocenie stosunku ryzyka i korzyści.
- Pacjenci powinni zostać poinformowani, aby w przypadku wystąpienia objawów ogólnych lub objawów uszkodzenia wątroby kilka dni po wlewie, natychmiast zgłosili się do lekarza.
- Monitorowanie parametrów życiowych, w tym ciśnienia tętniczego, przed i w trakcie wlewów
- Inne badania kontrolne podczas leczenia
- Po 3 i 6 miesiącach, a następnie co pół roku: kontrolne badanie u neurologa.
- W trakcie leczenia i przez 48 miesięcy po podaniu ostatniej dawki alemtuzumabu: badania hematologiczne krwi, w tym rozmaz krwi obwodowej, CRP, oraz uzupełniająco kreatynina i TSH (co 3 miesiące).
- W trakcie leczenia i przez 48 miesięcy po podaniu ostatniej dawki alemtuzumabu: comiesięczne badania moczu za pomocą pasków testowych: w przypadku stwierdzenia białkomoczu i krwiomoczu lub podejrzenia choroby nerek o innej przyczynie wymagane jest skierowanie do nefrologa.
- Co pół roku: ocena aktywności choroby (częstości rzutów oraz ocena sprawności funkcjonalnej za pomocą testu EDSS (Expanded Disability Status Scale) i ewentualnie SDMT i MSFC.
- Raz do roku: badanie RM.
- Co rok: badania przesiewowe w kierunku wirusa brodawczaka ludzkiego (HPV) u kobiet.
- U kobiet w wieku rozrodczym: pouczenie o konieczności stosowania skutecznej metody antykoncepcji.
- Interakcje
- Nie są znane.
- Działania niepożądane
- Po wystąpieniu następujących poważnych zdarzeń niepożądanych, w tym związanych z nimi zgonów, EMA dokonała przeglądu alemtuzumabu w kwietniu 2019 roku i ograniczyła wskazania do odwołania (patrz wyżej).
- Autoimmunologiczne zapalenie wątroby i uszkodzenie wątroby.
- Zdarzenia sercowo–naczyniowe, takie jak zawał serca, udar mózgu, rozwarstwienia tętnic dogłowowych.
- Limfohistiocytoza hemofagocytarna (HLH, zespół hemofagocytowy).
- Reakcje na podawany w infuzji lek mogą wystąpić w trakcie wlewu lub w ciągu następnej doby. Jest to prawdopodobnie związane z uwalnianiem cytokin podczas infuzji i może prowadzić do takich objawów, jak bóle głowy, wysypka skórna (pokrzywka), świąd, nudności, gorączka i dreszcze, uderzenia gorąca, duszność, tachykardia, zawroty głowy i bóle. Premedykacja metyloprednizolonem przed podaniem alemtuzumabu oraz dodatkowo lekami przeciwhistaminowymi i przeciwgorączkowymi wydaje się łagodzić te objawy.
- Ponadto leczenie może powodować reakcje autoimmunologiczne, takie jak zapalenie tarczycy (36%), małopłytkowość immunologiczna (ITP 1%) oraz nefropatie, takie jak choroba anty–GBM (GBM: błona podstawna kłębuszków nerkowych) (0,3%).
- Opisano również przypadki z podejrzeniem cytopenii autoimmunologicznych, takich jak neutropenia, niedokrwistość hemolityczna oraz pancytopenia.
- Ponadto u pacjentów leczonych alemtuzumabem występuje zwiększone ryzyko infekcji (71% w porównaniu z 53% leczonych interferonem beta). Możliwe są ciężkie zakażenia wirusem ospy wietrznej i półpaśca (VZV), obejmujące pierwotne zakażenia wirusem ospy wietrznej i reaktywację wirusa (0,3% w porównaniu do 0% w terapii interferonem beta).
- U pacjentek leczonych alemtuzumabem zgłaszane były również zakażenia wirusem brodawczaka ludzkiego (HPV) w obrębie szyjki macicy, w tym dysplazja szyjki macicy (2%). Dlatego u kobiet zaleca się coroczne badania przesiewowe w kierunku zakażenia HPV.
- U 0,3% pacjentów leczonych alemtuzumabem zgłaszano występowanie gruźlicy. Przed rozpoczęciem leczenia należy rozważyć przeprowadzenie badań przesiewowych w kierunku gruźlicy.
- U pacjentów leczonych alemtuzumabem częściej występują powierzchowne zakażenia grzybicze skóry i błon śluzowych, zwłaszcza kandydoza jamy ustnej oraz pochwy (12% w porównaniu z 3% w terapii interferonem beta).
- Po wystąpieniu następujących poważnych zdarzeń niepożądanych, w tym związanych z nimi zgonów, EMA dokonała przeglądu alemtuzumabu w kwietniu 2019 roku i ograniczyła wskazania do odwołania (patrz wyżej).
- Przeciwciała neutralizujące
- U pacjentów leczonych alemtuzumabem wykryto przeciwciała neutralizujące (NAb).
- Odpowiednie badanie i ewentualne działania wydają się być wskazane zwłaszcza wtedy, gdy z powodu utrzymującej się wysokiej aktywności choroby konieczny jest 3., 4. lub 5. cykl leczenia.
Kladrybina
- Cytostatyczny i immunosupresyjny analog puryn, który jest również stosowany w leczeniu białaczki włochatokomórkowej.
- Dopuszczenie do obrotu
- Pd 2017 roku w UE w leczeniu wysoce aktywnej, rzutowo–remisyjnej postaci SM.
- Od marca 2019 roku w USA w leczeniu wtórnie postępującej postaci SM.
- Wskazania
- Po uwzględnieniu dostępnych badań rejestracyjnych, kladrybina może być stosowana w następujących grupach pacjentów:
- Pacjenci, u których choroba wykazuje wysoką aktywność podczas terapii lekiem modyfikującym przebieg choroby.
- Pacjenci, u których miały miejsce 2 lub więcej rzuty choroby w poprzednim roku, niezależnie od tego, czy byli leczeni DMT czy nie.
- Po uwzględnieniu dostępnych badań rejestracyjnych, kladrybina może być stosowana w następujących grupach pacjentów:
- Przeciwwskazania
- Nadwrażliwość na substancję czynną lub na którykolwiek z pozostałych składników leku.
- Ciąża i laktacja.
- Zakażenia
- Niedobór odporności.
- Umiarkowana lub ciężka niewydolność nerek (klirens kreatyniny <60 ml/min.).
- Umiarkowana lub ciężka niewydolność wątroby.
- Szczepienie żywą szczepionką w ciągu ostatnich 4–6 tygodni, np. przeciw wirusowi ospy wietrznej i półpaśca (VZV), durowi plamistemu lub żółtej gorączce.
- Aktywna złośliwa choroba nowotworowa.
- Przeciwwskazania względne:
- znaczna podatność na infekcje, np. odleżyny, skłonność do zachłystywania się, nawracające zakażenia dróg moczowych, zakażenie dróg oddechowych
- przebyte złośliwe choroby nowotworowe
- nietolerancja fruktozy (tabletki kladrybiny zawierają sorbitol)
- dzieci i młodzież: brak danych dotyczących bezpieczeństwa stosowania i skuteczności.
- Schemat leczenia
- podanie doustne, łącznie 3,5 mg/kg m.c. w 4 cyklach
- cykl leczenia to 1–2 tabletki dziennie przez 4–5 dni
- dostosowanie dawki do masy ciała.
- Przed rozpoczęciem leczenia
- Dokładny wywiad lekarski i badanie przedmiotowe w celu wykluczenia przeciwwskazań (patrz wyżej).
- W przypadku czynnego zakażenia: odroczyć cykl leczenia do czasu całkowitego ustąpienia infekcji.
- Podstawowe badania laboratoryjne
- morfologia krwi, rozmaz krwi obwodowej
- AST, ALT, GGTP, bilirubina
- kreatynina
- CRP, OB, badanie ogólne moczu.
- Przed rozpoczęciem leczenia i w razie potrzeby przed jej kontynuacją w 2. roku leczenia
- Wykluczenie czynnych zakażeń gruźlicą, HBV, HCV.
- Test w kierunku zakażenia HIV po uzyskaniu zgody od pacjenta.
- Diagnostyka serologiczna ospy wietrznej – w przypadku wyniku negatywnego – szczepienie żywą szczepionką przed rozpoczęciem leczenia. Leczenie kladrybiną należy rozpocząć dopiero po uzyskaniu odpowiednio wysokiego miana przeciwciał.
- Jeśli pacjent wcześniej otrzymywał inny lek DMT, należy przestrzegać właściwych dla danej substancji bezpiecznych odstępów czasowych i okresów eliminacji poprzedniego leku z ustroju (washout).
- U pacjentek w wieku rozrodczym: test ciążowy i pouczenie o konieczności stosowania skutecznej metody antykoncepcji.
- Ponieważ nie można wykluczyć zmniejszenia skuteczności doustnych środków antykoncepcyjnych przez kladrybinę, konieczne jest stosowanie dodatkowo metody mechanicznej podczas leczenia i przez co najmniej 4 tygodnie po podaniu ostatniej dawki kladrybiny.
- Jeśli potrzeba, podanie dawki przypominającej. Terapię kladrybiną należy rozpocząć nie wcześniej, niż 4–6 tygodni po podaniu żywej szczepionki.
- W razie potrzeby RTG klatki piersiowej.
- Wstępne badanie RM głowy z kontrastem.
- Udokumentowane poinformowanie pacjenta o terapii i ryzyku.
- Decyzja o stosowaniu kladrybiny nie może zostać cofnięta przez co najmniej 6 miesięcy od rozpoczęcia leczenia.
- W trakcie leczenia
- Podczas leczenia nie należy podawać żywych szczepionek atenuowanych. Jeśli to możliwe, należy poczekać na normalizację poziomu leukocytów (limfocytów) w przerwie pomiędzy terapiami.
- Kontrolne badanie neurologiczne przez lekarzy doświadczonych w leczeniu SM co kwartał.
- Przed każdym cyklem terapii, a następnie co 2–3 miesiące:
- Skuteczna antykoncepcja (patrz wyżej) i powtórzenie testu ciążowego przed każdym cyklem terapii.
- RM głowy raz w roku.
- Regularne badania przesiewowe w kierunku choroby nowotworowej.
- Po zakończeniu leczenia
- Kontynuowanie regularnych kontrolnych morfologii krwi przez co najmniej 5 lat.
- Regularne badania przesiewowe w kierunku choroby nowotworowej.
- Interakcje
- Preparat zawiera hydroksypropylobetadeks, co może potencjalnie prowadzić do zwiększenia biodostępności innych podawanych doustnie produktów leczniczych: zalecany odstęp 3 godzin.
- Ze względu na możliwe działanie addytywne, przeciwwskazane jest kojarzenie leczenia kladrybiną z:
- innymi lekami immunosupresyjnymi, w tym glikokortykosteroidami
- innymi lekami DMT
- innymi lekami o potencjalnym działaniu hematotoksycznym, np. karbamazepina.
- Szczepionki (patrz wyżej).
- Inhibitory BCRP, takie jak eltrombopag (agonista receptora trombopoetyny).
- Potencjalne interakcje farmakokinetyczne
- z silnymi induktorami BCRP i P-gp, np. ryfampicyną, zielem dziurawca
- z silnymi inhibitorami ENT1 i CNT1, np. antagonistami wapnia.
- Doustne środki antykoncepcyjne (patrz wyżej).
- Działania niepożądane
- Limfopenia
- stopnia 3 (<500–200 limfocytów/mcl) u 25% pacjentów poddanych leczeniu
- stopnia 4 (<200 limfocytów/mcl) u 0,7% pacjentów poddanych leczeniu.
- Zwiększona podatność na infekcje31
- W badaniu rejestracyjnym CLARITY ciężkie zakażenia wystąpiły u 2,3% pacjentów poddanych leczeniu kladrybiną.
- Odsetek zakażeń VZV, głównie opryszczki jamy ustnej lub półpaśca skórnego, w badaniach klinicznych był wyższy w przypadku kladrybiny niż placebo. Skorygowana zapadalność na 100 pacjento–lat wynosiła 0,83 w przypadku kladrybiny i 0,20 dla placebo.
- Ryzyko rozwoju nowotworów złośliwych?31
- W metaanalizie badań klinicznych z udziałem łącznie 923 pacjentów, u których kladrybina była stosowana łącznie przez 3,433 lata, ryzyko względne wystąpienia choroby nowotworowej w przypadku stosowania kladrybiny w porównaniu z placebo wynosiło 1,97 (95% CI: 0,54–7,17).
- W porównaniu z dopasowaną populacją referencyjną nie stwierdzono istotnej różnicy w ryzyku zachorowania na nowotwory złośliwe.
- Postępująca wieloogniskowa leukoencefalopatia (progressive multifocal leukoencephalopathy – PML)
- To potencjalnie zagrażające życiu działanie niepożądane, które wystąpiło w niektórych przypadkach u pacjentów otrzymujących kladrybinę drogą pozajelitową w leczeniu białaczki włochatokomórkowej, nie było dotychczas obserwowane przy stosowaniu kladrybiny drogą doustną (stan na maj 2019).32
- Limfopenia
Okrelizumab
- Przeciwciało anty–CD20, którego mechanizm działania polega głównie na deplecji limfocytów B.
- Dopuszczenie do obrotu
- Przeciwwskazania
- Nadwrażliwość na substancję czynną lub na którykolwiek z pozostałych składników leku.
- Aktywne ciężkie zakażenia.
- Przeciwwskazania względne
- przewlekłe zakażenia, np. HIV lub zapalenie wątroby
- znaczna podatność na infekcje, np. odleżyny, skłonność do zachłystywania się, nawracające zakażenia dróg moczowych, zakażenie dróg oddechowych
- niedobór odporności
- przebyte złośliwe choroby nowotworowe
- ciąża i laktacja
- dzieci i młodzież: brak danych dotyczących bezpieczeństwa stosowania i skuteczności
- pacjenci z postępującym SM i chorobą trwającą powyżej 15 lat i/lub EDSS >6,5: brak danych dotyczących bezpieczeństwa stosowania i skuteczności.
- Schemat leczenia
- Podawanie dożylne.
- 1. cykl: 2 dawki pojedyncze po 300 mg w odstępie 14 dni.
- Od 2. cyklu: 600 mg co 6 miesięcy.
- Przed rozpoczęciem leczenia
- Dokładny wywiad lekarski i badanie przedmiotowe w celu wykluczenia przeciwwskazań (patrz wyżej).
- W przypadku czynnego zakażenia: odroczyć cykl leczenia do czasu całkowitego ustąpienia infekcji.
- Podstawowe badania laboratoryjne:
- morfologia krwi, rozmaz krwi obwodowej
- zalecenie: oznaczyć liczbę limfocytów B z ekspresją antygenu CD19+– i/lub CD20+.
- całkowite IgG
- CRP, badanie ogólne moczu
- wykluczenie aktywnych zakażeń gruźlicą, HBV, HCV, VZV
- test w kierunku zakażenia HIV po uzyskaniu zgody od pacjenta.
- U pacjentek w wieku rozrodczym: test ciążowy i pouczenie o konieczności stosowania skutecznej metody antykoncepcji.
- Ocena statusu szczepień
- Jeśli potrzeba, podanie dawki przypominającej co najmniej 6 tygodni przed leczeniem.
- Diagnostyka serologiczna ospy wietrznej, w przypadku wyniku negatywnego: szczepienie żywą szczepionką przed rozpoczęciem leczenia. Terapię okrelizumabem należy rozpocząć dopiero po uzyskaniu odpowiednio wysokiego miana przeciwciał.
- Wstępne badanie RM głowy z kontrastem.
- Udokumentowane poinformowanie pacjenta o terapii i ryzyku.
- W trakcie leczenia
- Przed, w trakcie i po infuzji
- Aby uniknąć reakcji związanych z wlewem: premedykacja metyloprednizolonem 100 mg dożylnie i lekiem przeciwhistaminowym, takim jak dimetynden.
- Monitorowanie parametrów życiowych w trakcie i przez okres co najmniej 1 godziny po zakończeniu wlewu.
- Kontrolne badanie neurologiczne przez lekarzy doświadczonych w leczeniu SM co kwartał.
- Co 3 miesiące morfologia krwi i rozmaz krwi obwodowej, włącznie z oznaczeniem limfocytów B z ekspresją antygenu CD19+– i/lub CD20+, jeśli to możliwe.
- Co 6 miesięcy: oznaczenie immunoglobulin w surowicy: IgG i jeśli to możliwe również IgM i IgA.
- RM głowy raz w roku.
- Regularne badania przesiewowe w kierunku choroby nowotworowej.
- Przed, w trakcie i po infuzji
- Interakcje
- Nie przewiduje się wystąpienia żadnych interakcji farmakokinetycznych.
- Ze względu na możliwe działanie addytywne, nie zaleca się jednoczesnego podawania innych leków immunosupresyjnych, z wyjątkiem glikokortykosteroidów w leczeniu rzutów choroby.
- Działania niepożądane
- Częste działania niepożądane związane z wlewem, aż do ciężkich reakcji związanych z wlewem (IRR).
- Reakcje związane z uwalnianiem cytokin mogą wystąpić do 24 godzin po infuzji.
- Zgłoszono między innymi reakcje skórne, podrażnienie jamy ustnej i gardła, duszność, uderzenia gorąca, spadek ciśnienia tętniczego, gorączkę, zawroty głowy i tachykardię.
- Zdolność do prowadzenia pojazdów mechanicznych może być czasowo ograniczona.
- Zakażenia, np. dróg oddechowych, grypa, opryszczka pospolita i VZV.
- Pojedyncze przypadki przeniesienia PML (carry–over PML).
- Pojedyncze przypadki nowotworów złośliwych w badaniach klinicznych. Nadal nie jest jasne, czy były one związane z leczeniem okrelizumabem.
- Częste działania niepożądane związane z wlewem, aż do ciężkich reakcji związanych z wlewem (IRR).
Inne leki
- Mitoksantron
- Mitoksantron jest dopuszczony do stosowania w leczeniu osób dorosłych z wysoce aktywną, rzutowo–remisyjną postacią stwardnienia rozsianego związaną z szybko postępującą niepełnosprawnością, dla których nie istnieją alternatywne możliwości leczenia.
- Mitoksantron w badaniach klinicznych znamiennie statystycznie hamował progresję i zmniejszał częstość rzutów oraz liczbę aktywnych zmian widocznych w RM, tym niemniej wielkość efektu leczenia jest przeważnie umiarkowana. Ponieważ jednak profil ryzyka w dłuższym okresie nie jest jasny, należy go raczej traktować jako lek rezerwowy w szybko postępującym SM z częstymi rzutami. Ogólnie rzecz biorąc, istnieje niewiele dowodów na skuteczność33, a działania niepożądane są głównym argumentem przeciwko stosowaniu go jako standardowego leku.
- Mitoksantron ma działanie kardiotoksyczne. Zaburzenie czynności skurczowej serca występowało nawet u 12% osób leczonych tym lekiem.33
- Mitoksantron podawany jest dożylnie w odstępach kilkutygodniowych i często w połączeniu z metyloprednizolonem.
- Rituksymab
- Rituksymab jest przeciwciałem monoklonalnym, które podobnie jak okrelizumab, skierowane jest przeciwko antygenowi CD20 na limfocytach B.
- Stwardnienie rozsiane nie jest zatwierdzonym wskazaniem do stosowania tego leku, jednak bywa stosowany pozarejestracyjnie (off label) w rzutowej oraz pierwotnie postępującej postaci SM, przy niepowodzeniu leczenia pacjentów w wieku poniżej 50 lat z obecnymi w RM zmianami w OUN wzmacniającymi się po podaniu środka kontrastowego.
- Zgłaszano śmiertelne reakcje związane z infuzją u pacjentów z reumatoidalnym zapaleniem stawów leczonych rituksymabem. Aby zmniejszyć ryzyko wystąpienia takich zdarzeń, przed infuzją rituksymabu należy stosować premedykację 100 mg metyloprednizolonem, lekami przeciwbólowymi i przeciwgorączkowymi (np. paracetamol) oraz lekiem przeciwhistaminowym (np. difenhydramina). Należy ściśle monitorować pacjentów z istniejącą wcześniej chorobą serca oraz tych, u których w przeszłości występowały sercowo–płucne działania niepożądane. W przypadku wystąpienia anafilaksji lub innych ciężkich reakcji związanych z nadwrażliwością lub reakcji związanych z infuzją, należy natychmiast przerwać podawanie rituksymabu i wdrożyć odpowiednie leczenie.
- W związku ze stosowaniem rituksymabu w leczeniu chorób onkologicznych i reumatologicznych, wystąpiły przypadki reaktywacji zapalenia wątroby typu B. Przypadki te obejmują doniesienia o piorunującym zapaleniu wątroby, niektóre zakończone zgonem. Pacjenci z aktywnym zapaleniem wątroby typu B nie mogą być leczeni rituksymabem. Badania przesiewowe w kierunku HBV są wymagane u wszystkich pacjentów przed rozpoczęciem leczenia.
- Zgłaszano również pojedyncze przypadki PML podczas stosowania rituksymabu.
- Immunoglobuliny podawane dożylnie (IVIG)
- Nie są zatwierdzone do leczenia SM.
- Dowody na skuteczność nie są zadowalające.
- Nie powinny być już stosowane w terapii modyfikującej przebieg stwardnienia rozsianego.
- Ewentualnie w ciąży, jako alternatywa dla innych immunoterapeutyków. Jednak i tu dane nie są spójne.
Autologiczny przeszczep krwiotwórczych komórek macierzystych (hematopoietic stem–cell transplantation – HSCT)34
- HSCT oceniano u pacjentów z rzutową postacią SM, u których terapia drugiej linii nie wykazała dostatecznej skuteczności.
- Solidne dowody skuteczności z 2 dotychczas przeprowadzonych randomizowanych badań kontrolowanych (RCT) (stan na czerwiec 2021).
- W większym z 2 RCT z okresem obserwacji wynoszącym 2 lata, choroba postępowała u 3 z 52 osób leczonych HSCT, w porównaniu z 34 z 51, którzy byli leczeni immunoterapeutykiem.35
- Śmiertelność związana z leczeniem zmniejszyła się i wynosi obecnie mniej niż 1%.36
- W międzynarodowym badaniu kohortowym z udziałem 281 pacjentów z 13 krajów wykazano, że 5–letnie przeżycie bez progresji choroby wynosi 48%. Śmiertelność w ciągu pierwszych 100 dni po przeprowadzonym leczeniu HSCT wynosiła 2,8%.37
- Większe szwedzkie badanie z dłuższym okresem obserwacji wydaje się potwierdzać długoterminową skuteczność HSCT.38
- Inne badania, zwłaszcza porównujące HSCT z lekami trzeciej linii, są nadal w toku. HSCT ma szansę stać się opcją leczenia rzutowo–remisyjnej postaci SM. Na razie jednak leczenie takie powinno być prowadzony jedynie w ramach badań klinicznych.
Rzuty w SM
- Leczenie wskazane jest w przypadkach wyraźnej dysfunkcji.
- Z reguły zaleca się dożylne podawanie metyloprednizolonu w dużych dawkach przez kilka dni.
Glikokortykosteroidy
- Glikokortykosteroidy mogą skrócić czas trwania i złagodzić poszczególne rzuty choroby.
- Porównanie terapii dożylnej i doustnej
- Z metaanalizy Cochrane wynika, że terapia doustna nie jest gorsza od dożylnej.
- Doustne leczenie glikokortykosteroidami (deksametazon w dawkach malejących, zaczynając od 16 mg na dobę) można również stosować bez wcześniejszego dożylnego podawania metyloprednizolonu w dużych dawkach.
- Podawane dożylnie
- Leczenie prowadzi się przez 3 do 5 dni, podając 0,5–1 g metyloprednizolonu na dobę w 500 ml roztworu glukozy, w infuzji przez 30–60 minut.
Pierwotnie postępująca postać stwardnienia rozsianego
- Nie ma badań potwierdzających skuteczność terapii interferonem beta–1a lub –1b ani octanem glatirameru w tym wskazaniu.
Wtórnie postępująca postać stwardnienia rozsianego
- Istnieją dowody, że interferon beta w tym wskazaniu zmniejsza częstość rzutów i aktywność choroby w badaniach RM.
- Nie ma wystarczających dowodów na korzystny wpływ terapii na szybkość progresji SM w postaci wtórnie postępującej.
- Leczenie można rozważyć u pacjentów z wtórnie postępującym SM, gdy choroba jest aktywna klinicznie w postaci rzutów.
- Dawkowanie jest takie samo, jak w przypadku rzutowo–remisyjnej postaci SM.
- Simwastatyna
- W jednym z badań wykazano, że simwastatyna zmniejszyła postęp atrofii mózgu w porównaniu z placebo i była dobrze tolerowana.39
- Potrzebne są jednak dalsze badania, zanim będzie można rozważyć rutynowe stosowanie simwastatyny w leczeniu wtórnie postępującego SM.
- Wskazane może być również podawanie leku w następnym etapie leczenia doustnie przez kolejne 2–3 tygodnie.
W wieku dziecięcym
- Leczenie ostrego rzutu choroby u dzieci powinno być prowadzone w taki sam sposób, jak u dorosłych. Metyloprednizolon należy podawać dożylnie w dawce dostosowanej do masy ciała 20 mg/kg m.c. na dobę (dawka maksymalna 1000 mg/dobę).
- U dzieci i młodzieży, u których rozpoznano RRMS o przebiegu łagodnym lub umiarkowanym, należy w pierwszej kolejności rozpocząć leczenie jednym z preparatów interferonu beta lub octanem glatirameru.
- U dzieci i młodzieży w wieku 10 lat i starszych, z rozpoznaniem RRMS wskazującym na aktywny przebieg choroby (rzut lub powtarzające się aktywne ogniska w RM) w trakcie immunoterapii, należy dokonać zmiany leczenia na fingolimod.
- U dzieci i młodzieży w wieku 10 lat i starszych z szybko postępującym RRMS, z 2 lub więcej rzutami skutkującymi narastaniem niepełnosprawności w ciągu 1 roku oraz z 1 lub więcej zmianami w RM mózgu po podaniu gadolinowego środka kontrastowego lub ze znacznym zwiększeniem liczby zmian na obrazach T2–zależnych w porównaniu z ostatnim badaniem RM, w leczeniu można stosować w pierwszej linii fingolimod.
- Brak miarodajnych badań
- Istnieje tylko 1 randomizowane, kontrolowane badanie dotyczące farmakoterapii SM u dzieci (stan na czerwiec 2021).
- W badaniu wzięło udział 215 pacjentów z RRMS w wieku od 10 do 17 lat. Leczenie fingolimodem przyniosło lepsze efekty od interferonu beta–1a w odniesieniu do częstości rzutów i kumulacji zmian w RM w 2–letnim okresie obserwacji. Autorzy badania stwierdzili, że potrzebne są dłuższe badania, aby ocenić długoterminową skuteczność i bezpieczeństwo stosowania fingolimodu w SM u dzieci.40
- Od listopada 2018 roku fingolimod został zatwierdzony do leczenia pacjentów w wieku 10–17 lat z wysoce aktywną postacią RRMS.
- Leczenie SM opiera się w dużej mierze na zaleceniach dotyczących SM u dorosłych, choć u dzieci i młodzieży należy wziąć pod uwagę różne odmienności.
- Istnieje tylko 1 randomizowane, kontrolowane badanie dotyczące farmakoterapii SM u dzieci (stan na czerwiec 2021).
- Rzuty w SM
- Leczenie rzutu choroby powinno rozpocząć się możliwie wcześnie, tj. w ciągu 2–5 dni od wystąpienia objawów klinicznych.
- Podaje się metyloprednizolon 20 mg/kg m.c. (dawka maksymalna 1 g/dziennie) dożylnie, 1 x na dobę z osłoną żołądka przez 3–5 dni.
- Ponowna ocena powinna być wykonana po 7–14 dniach od zakończeniu pulsu steroidowego. W przypadku niewielkiej poprawy lub nasilenia objawów klinicznych, powtarza się leczenie steroidami.
- Jeśli objawy kliniczne są ciężkie, np. niedowład połowiczy, niedowład czterokończynowy lub ślepota i nie ulegają istotnej poprawie po leczeniu pulsami steroidów, należy możliwie szybko przeprowadzić 5 cykli plazmaferezy lub immunoadsorpcji.
- Leczenie immunomodulujące
- Ważne jest możliwie wczesne rozpoczęcie terapii i konsekwentne jej prowadzenie, ponieważ może to poprawić rokowanie.
- Wskazanie do leczenia immunomodulującego istnieje zatem już w momencie postawienia rozpoznania SM.
- Ze względu na nowe kryteria diagnostyczne, terapia ta w większości przypadków możliwa jest już przy pierwszym rzucie choroby. Jeśli nie dochodzi do rzutu, po 3 miesiącach należy wykonać drugie badanie RM w celu ewentualnego potwierdzenia rozpoznania i rozpoczęcia leczenia.
- Wybór leku i schematu dawkowania należy dokonać w specjalistycznym ośrodku, odpowiednio do postaci choroby.
Objawowe leczenie farmakologiczne
Spastyczność41
- W leczeniu spastyczności w SM dostępne są następujące leki obniżające napięcie mięśniowe:
- Baklofen
- Początkowo stosuje się dawkę 5 mg 3 x dziennie, a następnie stopniowo zwiększa się ją do maksymalnie 100 mg na dobę w dawkach podzielonych.
- Tyzanidyna 2–24 mg na dobę, maksymalnie 36 mg na dobę.
- Gabapentyna 300–2700 mg na dobę (maksymalnie 3600 mg/dobę), głównie w leczeniu spastyczności tonicznej i związanego z nią bólu. Gabapentyna nie jest zatwierdzona do leczenia w tym wskazaniu, ale jest zwykle dobrze tolerowana.
- Benzodiazepiny (np. diazepam, klonazepam) są dopuszczalne tylko w wyjątkowych przypadkach, ze względu na niedostatecznie udowodnioną skuteczność w obniżaniu spastyczności, działania niepożądane, takie jak sedacja i osłabienie mięśni oraz duży potencjał uzależniający.
- W przypadku ciężkiej spastyczności lub ciężkich ogólnoustrojowych działań niepożądanych innych leków obniżających napięcie mięśniowe, można zastosować baklofen podawany dokanałowo.
- Inną alternatywą są domięśniowe iniekcje toksyny botulinowej A. Dotychczasowe badania nie pozwalają jeszcze na jednoznaczne stwierdzenia co do skuteczności takiego postępowania. Korzyści z takiego leczenia wydają się odnosić szczególnie pacjenci z dużą spastycznością miejscową, zwłaszcza wtedy, gdy bezpośrednio po iniekcji dotknięte mięśnie poddawane są fizjoterapii.42
- Baklofen
- Kannabinoidy
- Substancje aktywne z konopi siewnych (Cannabis sativa)
- delta–9–tetrahydrokannabinol (THC)
- kannabidiol (CBD).
- Metaanaliza opublikowana w 2018 roku przez Allana i wsp. obejmowała 4 przeglądy systematyczne dotyczące kannabinoidów w leczeniu spastyczności. Większość podstawowych badań randomizowanych z grupą kontrolną (RCT) przeprowadzono u pacjentów z SM.43
- Według 2 z 3 metaanaliz, w których do pomiaru spastyczności zastosowano skalę liczbową, spastyczność zmniejszyła się znacznie bardziej w przypadku stosowania kannabinoidów niż placebo.
- Ponowna analiza największego przeglądu systematycznego wykazała, że około 35% pacjentów leczonych kannabinoidami i 25% z grupy placebo uzyskało zmniejszenie spastyczności o co najmniej 30% (współczynnik ryzyka 1,37; 95% CI: 1,07−1,76).
- Metaanaliza odpowiedzi na leczenie obejmująca wszystkie 4 przeglądy wykazała, że subiektywnej poprawy objawów doświadczyła około 50% wszystkich pacjentów stosujących kannabinoidy i 35% w grupie placebo (współczynnik ryzyka 1,45; 95% CI 1,08–1,95).
- Działania niepożądane:
- zmniejszona siła mięśni, niekiedy ze zwiększoną skłonnością do upadków
- zmęczenie
- senność
- zaburzenia pamięci i koncentracji
- możliwe zmniejszone bezpieczeństwo w ruchu drogowym i w pracy
- depresyjność
- splątanie i niepokój
- stany psychotyczne.
- Istnieją dowody, że CBD neutralizuje niepożądane efekty działania THC, takie jak:
- sedacja
- lęk
- objawy psychotyczne
- częstoskurcz
- zaburzenia równowagi podczas stania.
- Substancje aktywne z konopi siewnych (Cannabis sativa)
- Jako pierwszy gotowy produkt zawierający kannabinoidy do leczenia spastyczności u pacjentów ze stwardnieniem rozsianym został zatwierdzony w 2010 roku spray do jamy ustnej zawierający nabiksimol, etanolowy wyciąg z konopi (THC/CBD około 1/1).
- Zastrzeżono jednak, że istnieje obszerny zbiór danych klinicznych, na podstawie którego brytyjska wytyczna instytutu NICE (NG144, Cannabinoids) opublikowana w listopadzie 201944 radzi, aby kannabinoidy były początkowo stosowane w tym wskazaniu wyłącznie w ramach 4–tygodniowej próby leczenia pod nadzorem specjalisty. Jeśli podczas leczenia spastyczność nie zmniejszy się o co najmniej 20% w skali 10–punktowej, należy zakończyć tę próbę.
- Więcej szczegółów można znaleźć w artykule produkty lecznicze zawierające kannabinoidy.
Ból
- Podstawowe informacje na temat bólu, w tym rozróżnienie między bólem neuropatycznym, nocyceptywnym i somatyzacyjnym oraz między bólem ostrym i przewlekłym, można znaleźć w artykule leczenie bólu, zasady.
- U 10–15% pacjentów występuje ból ostry.
- Często: bolesna spastyczność ciągła.
- Rzadziej: ból neuropatyczny
- nerwoból nerwu trójdzielnego
- objaw Lhermitte'a (neuropatyczny ból tułowia i kończyn przy zgięciu szyi, który przypomina rażenie prądem elektrycznym)
- ból o charakterze dyzestezji i tików w obrębie kończyn
- bóle korzeniowe.
- Leczenie bólu neuropatycznego:
- trójpierścieniowe leki przeciwdepresyjne (amitryptylina, nortryptylina)
- leki przeciwpadaczkowe (gabapentyna, pregabalina, lamotrygina)
- inhibitory zwrotnego wychwytu serotoniny i noradrenaliny: duloksetyna, wenlafaksyna
- tramadol.
- Leczenie nerwobólu nerwu trójdzielnego:
- leki pierwszego rzutu: karbamazepina, okskarbazepina
- leki drugiego rzutu: gabapentyna, baklofen, lamotrygina, pregabalina
- leczenie niefarmakologiczne: dekompresja mikronaczyniowa, przezskórna rizotomia zwoju Gassera
- radiochirurgia stereotaktyczna nożem gamma.
- Objaw Lhermitte'a
- leki przeciwpadaczkowe: gabapentyna, karbamazepina.
- U ponad 30% wszystkich chorujących na SM występuje ból przewlekły.
- Przeważnie piekący ból kończyn, ewentualnie bolesne skurcze łydek lub bolesna spastyczność.
- W przypadku bólu przewlekłego wskazana jest multimodalna terapia bólu, w tym fizjoterapia, kinezyterapia, techniki relaksacyjne i w razie potrzeby psychoterapia bólu.
- Farmakologiczny komponent leczenia bólów mięśniowych w następstwie spastyczności
-
- leki zmniejszające napięcie mięśniowe: baklofen, tizanidyna
- gabapentyna, pregabalina
- kannabinoidy
- toksyna botulinowa.
- Kannabinoidy
- Istnieją dowody na umiarkowany ośrodkowy mechanizm działania przeciwbólowego i nasennego w SM.
- Znaczenie kannabinoidów w leczeniu bólu neuropatycznego jest dyskusyjne.
- W metaanalizie opisanej w części dotyczącej spastyczności (Allan 2018) nie udało się jednoznacznie udowodnić skuteczności kannabinoidów w łagodzeniu bólu. Potwierdzono jednak, że ból neuropatyczny może lepiej odpowiadać na leczenie niż inne formy bólu.43
- Więcej szczegółów można znaleźć w artykule produkty lecznicze zawierające kannabinoidy.
Objawy urologiczne
- W przypadku dysfunkcji pęcherza moczowego, objawów parcia na pęcherz i nietrzymania moczu (tzw. pęcherz neurogenny) czasami poprawa uzyskiwana jest po zastosowaniu leków antycholinergicznych.
- Nadreaktywność wypieracza
- Działania terapeutyczne zmierzają do zahamowania nadmiernej czynności skurczowej pęcherza oraz do wzmocnienia mechanizmów zamykających cewkę moczową (zwiększenie oporu podpęcherzowego).
- Metody niefarmakologiczne
- planowane częste przyjmowanie płynów w małych ilościach
- ograniczenie spożywania płynów, zależnie od sytuacji (np. przed wyjściem z domu)
- postępowanie fizjoterapeutyczne (ćwiczenia mięśni dna miednicy małej, elektrostymulacja)
- wkładki absorpcyjne.
- Postępowanie farmakologiczne
- leki cholinolityczne: skopolamina, solifenacyna, darifenacyna
- spazmolityczne: oksybutynina
- alfa–adrenomimetyczne: pseudoefedryna, midodryna, duloksetyna
- mirabegron
- trójpierścieniowe leki przeciwdepresyjne: amitryptylina, doksepina
- fezoterodyna
- desmopresyna (w celu ograniczenia nocnego oddawania moczu)
- toksyna botulinowa wstrzykiwana podśluzówkowo w ścianę pęcherza.
- Zaburzenia opróżniania pęcherza
- cewnikowanie (przerywane samocewnikowanie, założenie cewnika na stałe, cewnikowanie nadłonowe)
- leczenie operacyjne (w zaawansowanych stadiach choroby).
- Zaburzenia mieszane (dyssynergia zwieraczowo–wypieraczowa)
- leki cholinolityczne
- leki zmniejszające opór cewkowy
- toksyna botulinowa dopęcherzowo.
- Zaburzenia erekcji
- alprostadyl (analog prostaglandyny) podawany przezcewkowo lub do ciał jamistych
- inhibitory fosfodiesterazy (sildenafil, tadalafil, wardenafil lub awanafil)
- więcej informacji na temat leczenia można znaleźć w artykule zaburzenia erekcji.
- Planowanie terapii w ścisłym porozumieniu z neurologiem i urologiem.
Depresja
- Podstawowe informacje na temat diagnostyki i leczenia znajdują się w artykule depresja.
- Istnieje tylko kilka badań dotyczących farmakologicznego leczenia depresji u chorych na SM.
- Należy wybierać SSRI ze względu na ich właściwości aktywizujące. Jednak specyficzne dla danej substancji i klasy efekty uboczne mogą ograniczać ich przydatność. Do najczęstszych działań niepożądanych przy stosowaniu SSRI należą zaburzenia seksualne (u kobiet, u mężczyzn). W takim przypadku wskazana może być zmiana leku na inhibitor wychwytu zwrotnego serotoniny i noradrenaliny (SNRI, np. wenlafaksyna). W leczeniu depresji i bólu u pacjentów z ciągłym bólem neuropatycznym należy raczej rozważyć trójpierścieniowy lek przeciwdepresyjny.
Zmęczenie
- Jest jednym z najczęstszych objawów SM.
- Definiowane jako subiektywne odczucie braku energii do rozpoczynania i podtrzymywania dowolnej aktywności, pozostające bez związku z depresją lub osłabieniem siły mięśniowej. Pojawia się już po niewielkiej aktywności fizycznej czy umysłowej i trwa dłużej niż u osób zdrowych. Towarzyszy mu uczucie „wszechogarniającej niemocy".
- W przypadku rozpoznaniu u chorego na SM zespołu zmęczenia, należy zalecić eliminację lub ograniczenie wpływu czynników nasilających zmęczenie oraz dostosować postępowanie do aktualnego stanu klinicznego pacjenta.
- Leczenie niefarmakologiczne
- odpowiednia do potrzeb chorego aktywność fizyczna
- rehabilitacja
- trening oszczędzania energii.
- Leczenie farmakologiczne zespołu zmęczenia w przebiegu stwardnienia rozsianego rzadko przynosi zadowalającą poprawę. Zaleca się próbę zastosowania amantadyny, alfakalcidolu lub famprydyny.
Zdolność do chodzenia
- W randomizowanym kontrolowanym badaniu z podwójnie ślepą próbą, 4–aminopirydyna (famprydyna) prowadziła do poprawy zmniejszonej zdolności do chodzenia u około 1/3 pacjentów z SM.45
- Zmierzona poprawa korelowała z subiektywną poprawą podawaną przez pacjentów i została uznana przez autorów badania jako istotna klinicznie.
- Famprydyna w dawce 10 mg 2 x dziennie jest zatwierdzona w celu poprawy zdolności chodzenia u dorosłych pacjentów ze stwardnieniem rozsianym, którzy mają trudności z poruszaniem się (EDSS 4–7).
- Leczenie powinno być rozpoczynane przez lekarzy doświadczonych w leczeniu pacjentów z SM.
- Doświadczenia kliniczne są zróżnicowane. W okresie 2–4 tygodni przed rozpoczęciem terapii i przy ocenie po 2–4 tygodniach zaleca się wykonanie indywidualnej próby chodu (test szybkości chodu na odcinku 25 stóp (Timed 25–Foot Walk). W przypadku niewystarczającej progresji, leczenie należy przerwać.
- Możliwe działania niepożądane to: napady drgawek, zawroty głowy, bezsenność, nasilenie istniejącej neuralgii nerwu trójdzielnego, lęk i zaburzenia równowagi.
Inne metody leczenia
Informacje ogólne
- Stan psychiczny pacjenta, czyli łagodzenie lub zapobieganie objawom lękowym, depresji lub stresowi, można poprawić przez ćwiczenia uważności (mindfulness).46
Spastyczność
- Więcej informacji można znaleźć w artykule zespół spastyczny.
- Fizjoterapia stanowi ważny element terapii, dzięki któremu chory może dopasować dla siebie odpowiedni rodzaj ćwiczeń i ich częstotliwość. Wskazane jest stosowanie naprzemiennie fazy ćwiczeń i odpoczynku.
- Niepublikowane badania na niewielkiej grupie pacjentów i o krótkim czasie trwania sugerują, że intensywna kinezyterapia z dużym obciążeniem prowadzi do większej poprawy wydolności fizycznej mierzonej maksymalnym poborem tlenu w porównaniu z typowymi zajęciami fizjoterapii.
- Ortezy wspomagające zgięcie grzbietowe stawu skokowego mogą pomóc w stabilizowaniu kolana oraz poprawić koordynację i równowagę podczas chodzenia.47
Objawy urologiczne
- Cewnikowanie przerywane jest często konieczne w celu zapobiegania mimowolnemu wyciekowi moczu oraz zatrzymaniu moczu. Może być stosowane jako metoda samodzielna lub jako uzupełnienie farmakoterapii. Po odpowiednim instruktażu i przy dostatecznej sprawności ruchowej, mało skomplikowany wariant aseptycznego cewnikowania przerywanego może być wykonywany przez samych pacjentów.
- Wskazana może być operacja powiększenia pęcherza.
- Możliwą alternatywą jest urostomia z workiem urostomijnym.
- Cewnik założony na stałe i wkładki urologiczne można rozważać tylko wtedy, gdy wszystkie inne środki okażą się niedostatecznie efektywne.
Zaparcia lub nietrzymanie stolca
- Zmiana diety na dietę bogatoresztkową (zwiększenie ilości przyjmowanego błonnika do 20–30 g/dziennie).
- Przyjmowanie odpowiedniej ilości płynów (1,5–2 litry dziennie).
- Stałe pory posiłków.
- Aktywność fizyczna.
- Unikanie leków mogących nasilać zaparcia.
- Ewentualnie farmakoterapia zaparć:
- laktuloza
- makrogol
- bisakodyl
- prukalopryd.
- W nietrzymaniu stolca: loperamid.
Upośledzenie funkcji poznawczych
- Trening funkcji poznawczych, w tym ćwiczenia uwagi.
Zmęczenie
- Zmęczenie jest jednym z najczęstszych objawów w SM.
- Należy unikać zbyt dużego wysiłku fizycznego.
- Wielu pacjentów jest wrażliwych na wysokie temperatury. Próbowano stosować różne rodzaje terapii zimnem, ale nie ma dowodów na ich skuteczność.
- Lepsze planowanie codziennego życia i indywidualne dostosowanie poziomu aktywności może złagodzić dolegliwości.
- Zmiany środowiskowe i ewentualnie fizjoterapia mogą wpłynąć na poprawę subiektywnie odczuwanego zmęczenia.
- Program kontrolowania nasilenia zmęczenia w grupach (FACETS) obejmujący 6 spotkań, w tym terapię poznawczą i nauczanie metod optymalizacji energii, spowodował znaczące zmniejszenie odczuwania zmęczenia i lepsze radzenie sobie z chorobą w porównaniu z „terapią konwencjonalną“.48
- Zmęczeniu mogą również przeciwdziałać ćwiczenia fizyczne, które wydają się być bezpieczne u chorych na SM, tzn. nie powodują większej liczby rzutów w porównaniu do pacjentów niećwiczących.49
Depresja
- Może mieć przyczyny organiczne, psychiczne i społeczne.
- Leczy się ją zgodnie z odpowiednimi wytycznymi dotyczącymi depresji. Podstawowe informacje na temat diagnostyki, psycho– i farmakoterapii depresji znajdują się w artykule depresja.
- Istnieje zaledwie kilka badań dotyczących psychoterapii, jak i farmakologicznego leczenia depresji u chorych na SM.
- Istnieją dowody, że psychoterapia może zmniejszyć objawy depresji u chorych na SM i pomóc im w radzeniu sobie z chorobą. W tym kontekście najlepiej zostały zbadane metody psychoterapii poznawczo–behawioralnej.50
Zapobieganie
- Profilaktyka pierwotna
- Zapadalność na SM zmniejsza prawdopodobnie witamina D w postaci zwiększonej ekspozycji na światło słoneczne lub suplementów. Na razie nie ma jednak na to dowodów.
- Profilaktyka wtórna
- W zapobieganiu spastyczności i innym powikłaniom może pomóc fizjoterapia i terapia zajęciowa.
- Dobrze udokumentowane są korzyści wynikające z treningu wytrzymałościowego o niskiej lub umiarkowanej intensywności.51
- Trening siłowy prawdopodobnie poprawia funkcje istotne dla życia codziennego, takie jak wstawanie, chodzenie lub wchodzenie po schodach.52
- Wydaje się, że laktacja może chronić przed nawrotem choroby po ciąży, zwłaszcza w przypadku pełnego karmienia piersią do 6 miesięcy po porodzie.53
Przebieg, powikłania i rokowanie
Przebieg
- Choroba rozpoczyna się zwykle u młodych dorosłych. Średni wiek wystąpienia choroby to 30 lat.
- Przebieg może być bardzo różny.
- Rzutowo–remisyjny lub postępujący
- U 80–85% pacjentów występują powtarzające się zaostrzenia (rzuty) z całkowitą lub niepełną remisją deficytów neurologicznych w okresach wolnych od rzutów.
- W większości przypadków upośledzenie funkcji neurologicznych narasta z każdym rzutem choroby (postać rzutowo–postępująca).
- Występują warianty o łagodnym przebiegu z niewielką liczbą rzutów, bez lub z niewielkim upośledzeniem sprawności.
- Średnia liczba rzutów w ciągu roku u pacjentów z SM to 0,8.
- Pierwotnie postępujący
- U około 15% pacjentów choroba od początku ma charakter przewlekle postępujący, bez wyraźnie zaznaczonych rzutów.
- Wtórnie postępujący
- Po początkowym przebiegu rzutowo-remisyjnym choroba przechodzi w postać przewlekle postępującą.
- Po 11–15 latach występuje u 58% pacjentów z rzutowo–remisyjną postacią SM.
- Po ponad 25 latach występuje u 89% pacjentów z rzutowo–remisyjną postacią SM.54
- Rzutowo–remisyjny lub postępujący
- Deficyty neurologiczne
- Od początku choroba może powodować wszelkiego rodzaju deficyty neurologiczne w różnych kombinacjach.
- W zaawansowanej chorobie u pacjentów występują duże ograniczenia czynnościowe, a obraz kliniczny jest bardziej jednorodny.
- Ciąża
- Ciąża nie ma wpływu prognostycznego na obraz kliniczny.
- W okresie ciąży występuje jednak mniej nawrotów, a ryzyko rzutów zwiększa się 3–6 miesięcy po porodzie.18
Powikłania
- Upośledzone funkcje poznawcze, głównie zaburzenia pamięci, orientacji i percepcji przestrzennej. Zdolność mówienia zazwyczaj nie jest upośledzona.
- Powikłania mają różne nasilenie: u około 50% pacjentów w trakcie choroby dochodzi do pogorszenia funkcji poznawczych.
- Rozwój otępienia.
- Zakażenia układu moczowego
- zakażenia dolnych i górnych dróg moczowych, ryzyko uszkodzenia nerek.
- Owrzodzenia odleżynowe.
- Depresja
- Epizody depresyjne u 30–50% pacjentów.
- Zakażenia płuc.
- Posocznica.
Rokowanie
- Postać rzutowa
- U 80–85% pacjentów choroba we wczesnych stadiach charakteryzuje się występowaniem rzutów.
- U około 4 na 5 osób z początkowo rzutową postacią SM, choroba przybiera charakter wtórnie postępujący, zwykle w ciągu 20 lat od wystąpienia.
- U 1 na 5 pacjentów obserwuje się przebieg łagodny z niemal normalną długością życia i brakiem lub niewielkimi ograniczeniami sprawności funkcjonalnej.
- Postać pierwotnie postępująca
- U około 15% pacjentów choroba od początku ma charakter postępujący i jest określana jako pierwotnie postępująca postać SM.
- Po 20 latach choroby
- U 20% pacjentów występują jedynie łagodne objawy, niemal normalna długość życia oraz brak lub niewielkie ograniczenia sprawności fizycznej.
- 20% chorych umiera.
- 60% pacjentów ma ograniczenia funkcjonalne o zmiennym nasileniu.
- Norweskie badanie kontrolne55 pokazuje, że po 15 latach prawdopodobieństwo:
- poruszania się bez wózka inwalidzkiego wynosi około 75%
- chodzenia bez środków pomocniczych wynosi około 60%
- niezdolności do wykonywania zawodu wynosi około 54%.
- Rokowanie jest najlepsze w rzutowo–remisyjnej postaci SM.
- Innymi czynnikami korzystnie wpływającymi na rokowanie są: młody wiek, zaburzenia czucia i wzroku oraz długie odstępy między kolejnymi rzutami w ciągu pierwszych kilku lat po postawieniu rozpoznania.
- W dowolnym momencie może nastąpić zahamowanie postępu choroby.
- W jednym z badań stwierdzono, że średnia długość życia chorych na SM była o 7,5 roku krótsza, niż u odpowiadających osób z grupy kontrolnej.56
Dalsze postępowanie
- Regularne neurologiczne badania kontrolne, zwykle raz na kwartał, powinny być wykonywane przez lekarzy mających doświadczenie w leczeniu SM.
- Wczesne objawy nowego rzutu.
- Objawy wskazujące na powikłania (odleżyny, problemy natury psychicznej, objawy ze strony układu moczowego).
- Ewentualnie badanie RM jako uzupełniająca ocena skuteczności terapii. Korzyści nie są wystarczająco udowodnione.
- Cechy niepowodzenia leczenia.
- W przypadku ustania efektu terapeutycznego: przeciwciała neutralizujące przeciwko interferonowi beta–1a i –1b (IFNb–NAb)? Badanie rutynowe po 12 i 24 miesiącach lub w przypadku klinicznego podejrzenia niepowodzenia leczenia.
W trakcie terapii interferonem beta–1a/–1b lub octanem glatirameru
- Leczenie interferonem beta–1a/–1b lub octanem glatirameru jest rozpoczynane przez neurologów.
- Po 1, 3 i 6 miesiącach: kontrola techniki wstrzykiwania i działań niepożądanych.
- Przeprowadzenie kontroli na przemian z pielęgniarką specjalizującą się w opiece nad pacjentami z SM.
- Badania lekarskie
- Na początku co 7 miesięcy, a następnie, jeśli choroba przebiega stabilnie, raz w roku.
- Jeśli przebieg choroby jest stabilny: badania kontrolne co pół roku na zmianę na przemian lekarza rodzinnego i neurologa.
- Badanie krwi podczas każdej wizyty kontrolnej
- morfologia z różnicowaniem leukocytów
- AST, ALT, ALP, GGTP, bilirubina
- T4 i TSH
- elektrolity i kreatynina.
- Leczenie nawrotów podczas leczenia interferonem zgodnie z obowiązującymi procedurami.
- Raz w roku: oszacowanie deficytów funkcjonalnych za pomocą skali EDSS lub MSFC.
W trakcie terapii natalizumabem
- Okresowe kontrole pacjentów leczonych natalizumabem obejmują rozmowę i badanie neurologiczne podczas comiesięcznych wizyt pacjentów celem podania wlewu.
- Pielęgniarki specjalizujące się w SM oraz neurolodzy, którzy monitorują terapię, powinni zwracać szczególną uwagę na pojawianie się objawów wskazujących na PML.
- W przypadku zakażeń lub oznak niedoboru odporności: bezzwłoczne odesłanie pacjenta do kliniki neurologicznej, która prowadzi jego leczenie.
- Jeśli wskazane jest wdrożenie równoległego leczenia, należy zwracać uwagę na możliwe interakcje.
Informacje dla pacjentów
Edukacja pacjenta
- Rozważ wszystkie istotne możliwości diagnostyczne.
- Nie mów przedwcześnie o SM, jeśli rozpoznanie nie zostało jeszcze potwierdzone.
- Wyjaśnij pacjentowi chorobę i rokowania tak spokojnie, jak to możliwe.
- Podkreśl, że wielu pacjentów z SM ma normalną długość życia oraz brak lub niewielkie ograniczenia sprawności fizycznej.
- Zarówno choroba, jak i niektóre leki mogą upośledzać zdolność prowadzenia pojazdów.
Materiały edukacyjne dla pacjentów
Ilustracje
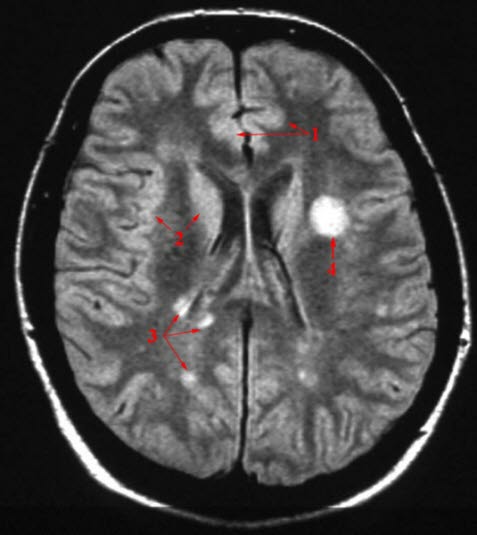
Źródła
Wytyczne
-
Leczenie modyfikujące przebieg stwardnienia rozsianego. Rekomendacje Sekcji Stwardnienia Rozsianego i Neuroimmunologii Polskiego Towarzystwa Neurologicznego. Pol. Przegl. Neurol 2023;19(3):163-189. DOI
-
Zakrzewska-Pniewska B, Adamczyk-Sowa M, Brola W, et al. Leczenie i postępowanie objawowe w stwardnieniu rozsianym. Rekomendacje Sekcji SM i Neuroimmunologii Polskiego Towarzystwa Neurologicznego. Pol. Przegl. Neurol 2019;15(4):191-217. DOI
-
Wattjes MP, Ciccarelli O, Reich DS, Banwell B, et al. 2021 MAGNIMS-CMSC-NAIMS consensus recommendations on the use of MRI in patients with multiple sclerosis. Lancet Neurol 2021 Aug;20(8):653-670. DOI
- Montalban X, Gold R, Thompson AJ, et al. 2018 ECTRIMS/EAN guideline on the pharmacological treatment of people with multiple sclerosis. Eur J Neurol, 25: 215-237. DOI
- Solari A, Giordano A, Sastre-Garriga J, et al. EAN guideline on palliative care of people with severe, progressive multiple sclerosis. Eur J Neurol 2020; 27(8) :1510-1529. DOI
Piśmiennictwo
- Compston A. Genetic epidemiology of multiple sclerosis, J Neurol Neurosurg Psychiatry 1997, 62: 553-61, PubMed
- Aschiero A., Munger K.L. Environmental risk factors for multiple sclerosis. Part II: Noninfectious factors, Ann Neurol 2007, 61: 504-13, PubMed
- Simpson S. Jr, Wang W., Otahal P., et al. Latitude continues to be significantly associated with the prevalence of multiple sclerosis: an updated meta-analysis, J Neurol Neurosurg Psychiatry 2019, 90(11): 1193-200, doi: 10.1136/jnnp-2018-320189, Epub 19.06.2019, PMID: 31217172, pubmed.ncbi.nlm.nih.gov
- Calabresi P.A. Diagnosis and management of multiple sclerosis, Am Fam Physician 2004, 70: 1935-44, PubMed
- Ascherio A., Munger K.L. Environmental risk factors for multiple sclerosis. Part I: the role of infection, Ann Neurol 2007, 61: 288-99, PubMed
- Ramogapalan S.V., Maugeri N.J., Handunnetthi L., et al. Expression of the Multiple Sclerosis-associated MHC class II allele HLA-DRB1*1501 is regulated by vitamin D, PLoS Genet 2009, 5: e1000369, www.ncbi.nlm.nih.gov
- The International Multiple Sclerosis Genetics Consortium & the Wellcome Trust Case Control Consortium. Genetic risk and primary role for cell-mediated immune mechanisms in multiple sclerosis, Nature 2011: 476: 214-9, www.ncbi.nlm.nih.gov
- Staples J., Ponsonby A-L., Lim L. Low maternal exposure to ultraviolet radiation in pregnancy, month of birth, and risk of multiple sclerosis in offspring: longitudinal analysis, BMJ 2010, 340: c1640, www.bmj.com
- Ascherio A., Munger K.L., White R., et al. Vitamin D as an early predictor of Multiple sclerosis activity and progression, JAMA Neurol 2014, doi:10.1001/jamaneurol.2013.5993, DOI
- Munger K.L., Hongell K., Åivo J., et al. 25-Hydroxyvitamin D deficiency and risk of MS among women in the Finnish Maternity Cohort, Neurology 10.10.2017, 89(15): 1578-83, pmid:28904091, PubMed
- Belbasis L., Bellou V., Evangelou E., et al. Environmental risk factors and multiple sclerosis: an umbrella review of systematic reviews and meta-analyses, Lancet Neurol. 2015, 14: 263-73, doi: 10.1016/S1474-4422(14)70267-4, DOI
- Lucchinetti C.F., Bruck W., Rodriguez M., Lassmann H. Distinct patterns of multiple sclerosis pathology indicates heterogeneity in pathogenesis, Brain Pathol 1996, 6: 259-74, PubMed
- Mohr D.C., Hart S.L., Julian L., Cox D., Pelletier D. Association between stressful life events and exacerbation in multiple sclerosis: a meta-analysis. BMJ 2004, 328: 731, PubMed
- Frohman E.M., Racke M.K., Raine C.S. Multiple sclerosis - the plaque and its pathogenesis, N Engl J Med 2006, 354: 942-55, PubMed
- Barnett M.H., Henderson A.P., Prineas J.W. The macrophage in MS: just a scavenger after all? Pathology and pathogenesis of the acute MS Lesion, Mult Scler 2006, 12: 121-32, www.ncbi.nlm.nih.gov
- Jersild C., Svejgaard A., Fog T. HL-A antigens and multiple sclerosis, Lancet 1972, 1: 1240-1, www.ncbi.nlm.nih.gov
- Willer C.J., Dyment D.A., Sadovnick A.D., Rothwell P.M., Murray T.J., Ebers GC for the Canadian Collaborative Study Group. Timing of birth and risk of multiple sclerosis: population based study, BMJ 2005, 330: 120-4, pubmed.ncbi.nlm.nih.gov
- Confavreux C., Hutchinson M., Hours M.M., Cortinovis-Tourniare P., Moreau T., and the Pregnancy in MS Group. Rate of pregnancy-related relapse in multiple sclerosis, N Engl J Med 1998, 339: 285-91, New England Journal of Medicine
- Thompson A.J., Banwell B.L., Barkhof F. et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018, 17: 162-73,PMID: 29275977, PubMed
- Whiting P., Harbord R., Main C., et al. Accuracy of magnetic resonance imaging for the diagnosis of multiple sclerosis: systematic review, BMJ 2006, 15: 875-84, www.ncbi.nlm.nih.gov
- Lu G., Beadnall H.N., Barton J., et al. The evolution of “No Evidence of Disease Activity” in multiple sclerosis, Mult Scler Relat Disord 2018, 20: 231-8, doi: 10.1016/j.msard.2017.12.016, DOI
- Benkert P., Meier S., Schaedelin S., et al. Serum neurofilament light chain for individual prognostication of disease activity in people with multiple sclerosis: A retrospective modelling and validation study, Lancet Neurol. 2022, 21(3): 246-57, doi: 10.1016/S1474-4422(22)00009-6, DOI
- Pearson M., Dieberg G., Smart N. Exercise as a Therapy for Improvement of Walking Ability in Adults With Multiple Sclerosis: A Meta-Analysis, Arch Phys Med Rehabil. 2015, 96: 1339-48, doi:10.1016/j.apmr.2015.02.011, DOI
- Comi G., Martinelli M., Rodegher M., et al. Eff ect of glatiramer acetate on conversion to clinically defi nite multiple sclerosis in patients with clinically isolated syndrome (PreCISe study): a randomised, double-blind, placebo-controlled trial, Lancet 2009, 374: 1503-11, PubMed
- Papadopoulou A., Kappos L., Sprenger T. Teriflunomide for oral therapy in multiple sclerosis, Expert Rev Clin Pharmacol. 2012, 5): 617-28, PubMed PMID: 23234322, PubMed
- Sartori A., Carle D., Freedman M.S. Teriflunomide: a novel oral treatment for relapsing multiple sclerosis, Expert Opin Pharmacother, 2014, 15(7): 1019-27. PMID: 24742277, PubMed
- Xu Z., Zhang F., Sun F., Gu K., Dong S., He D. Dimethyl fumarate for multiple sclerosis, Cochrane Database of Systematic Reviews 2015, Issue 4. Art. No.: CD011076. DOI: 10.1002/14651858.CD011076.pub2, DOI
- Bloomgren G., Richman S., Hotermans C., et al. Risk of natalizumab-associated progressive multifocal leukoencephalopathy, N Engl J Med 2012, 366: 1870-80, New England Journal of Medicine
- Brown J.W, Coles A.J. Alemtuzumab: evidence for its potential in relapsing-remitting multiple sclerosis, Drug Des Devel Ther. 2013, 7:131-8, doi: 10.2147/DDDT.S32687, DOI
- Cohen J.A., Coles A.J., Arnold D.L., et al; CARE-MS I investigators. Alemtuzumab versus interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial, Lancet. 2012, 380: 1819-28, doi: 10.1016/S0140-6736(12)61769-3, DOI
- Cook S., Leist T., Comi G. et al. Safety of cladribine tablets in the treatment of patients with multiple sclerosis: An integrated analysis, Mult Scler Relat Disord 2019, 29: 157-67, PMID: 30885374, PubMed
- EMD Serono. MAVENCLAD is the first and only short-course oral therapy for relapsing forms of MS, Rockland, MA, USA, 04.2019, www.mavenclad.com
- Martinelli Boneschi F., Vacchi L., Rovaris M., Capra R., Comi G. Mitoxantrone for multiple sclerosis, Cochrane Database of Systematic Reviews 2013, Issue 5. Art. No.: CD002127. DOI: 10.1002/14651858.CD002127.pub3, DOI
- Cohen J.A., Baldassari L.E., Atkins H.L., et al. Autologous Hematopoietic Cell Transplantation for Treatment-Refractory Relapsing Multiple Sclerosis: Position Statement from the American Society for Blood and Marrow Transplantation, Biol Blood Marrow Transplant 2019, 25(5): 845-54, PMID: 30794930, PubMed
- Burt R.K., Balabanov R., Burman J., et al. Effect of Nonmyeloablative Hematopoietic Stem Cell Transplantation vs Continued Disease-Modifying Therapy on Disease Progression in Patients With Relapsing-Remitting Multiple Sclerosis: A Randomized Clinical Trial, JAMA 2019, 321: 165-74, PMID: 30644983, PubMed
- Muraro P.A., Pasquini M., Atkins H.L., et al. Long-term Outcomes After Autologous Hematopoietic Stem Cell Transplantation for Multiple Sclerosis, JAMA Neurol 2017, 74: 459-69, PMID: 28241268, PubMed
- Muraro P.A., Pasquini M., Atkins H.L. et al. Long-term Outcomes After Autologous Hematopoietic Stem Cell Transplantation for Multiple Sclerosis, JAMA Neurol 20.02.2017, doi:10.1001/jamaneurol.2016.5867, DOI
- Burman J., Iacobaeus E., Svenningsson A., Lycke J., Gunnarsson M. et al. Autologous haematopoietic stem cell transplantation for aggressive multiple sclerosis: the Swedish experience, J Neurol Neurosurg Psychiatry 2014, 85: 1116-21, pmid:24554104, PubMed
- Chataway J., Schuerer N., Alsanousi A., Chan D., MacManus D. et al. Effect of high-dose simvastatin on brain atrophy and disability in secondary progressive multiple sclerosis (MS-STAT): a randomised, placebo-controlled, phase 2 trial, Lancet 2014, 383: 2213-21, pmid:24655729, PubMed
- Chitnis T., Arnold D.L., Banwell B. et al. Trial of Fingolimod versus Interferon Beta-1a in Pediatric Multiple Sclerosis, N Engl J Med 2018, 379: 1017-27, PMID: 30207920, PubMed
- Shakespeare D., Boggild M., Young C.A. Anti-spasticity agents for multiple sclerosis, Cochrane Database of Systematic Reviews 2003, Issue 4. Art. No.: CD001332. DOI: 10.1002/14651858.CD001332, DOI
- Giovannelli M., Borriello G., Castri P. et al. Early physiotherapy after injection of botulinum toxin increases the beneficial effects on spasticity in patients with multiple sclerosis, Clin Rehabil 2007, 21: 331-7, www.ncbi.nlm.nih.gov
- Allan G.M., Finley C.R., Ton J. et al. Systematic review of systematic reviews for medical cannabinoids. Pain, nausea and vomiting, spasticity, and harms, Canadian Family Physician 2018, 64 (2): e78-e94, www.cfp.ca
- National Institute for Health and Care Excellence. Cannabis-based medicinal products, NICE guideline. 11.11.2019, www.nice.org.uk
- Goodman A.D., Brown T.R., Krupp L.B., et al. Sustained-release oral fampridine in multiple sclerosis: a randomised, double-blind, controlled trial, Lancet 2009, 373: 732-38, PubMed
- Simpson R., Simpson S., Ramparsad N., et al. Mindfulness-based interventions for mental well-being among people with multiple sclerosis: a systematic review and meta-analysis of randomised controlled trials, J Neurol Neurosurg Psychiatry, 2019, PMID: 31196913, www.ncbi.nlm.nih.gov
- McLoughlin J.V., Lord S.R., Barr C.J., et al. Dorsiflexion assist orthosis reduces the physiological cost and mitigates deterioration in strength and balance associated with walking in people with multiple sclerosis, Arch Phys Med Rehabil 2015, 96: 226-32, doi:10.1016/j.apmr.2014.09.005, DOI
- Thomas S., Thomas P.W., Kersten P., et al. A pragmatic parallel arm multi-centre randomised controlled trial to assess the effectiveness and cost-effectiveness of a group-based fatigue management programme (FACETS) for people with multiple sclerosis, J Neurol Neurosurg Psychiatry 2013. pmid:23695501, PubMed
- Heine M., van de Port I., Rietberg M.B, et al. Exercise therapy for fatigue in multiple sclerosis. Cochrane Database Syst Rev 2015; 9: CD009956. doi:10.1002/14651858.CD009956.pub2 DOI
- Thomas PW, Thomas S, Hillier C, Galvin K, Baker R. Psychological interventions for multiple sclerosis. Cochrane Database Syst Rev 2006 25; (1):CD004431. onlinelibrary.wiley.com
- Dalgas U, Stenager E. Multipel sklerose og fysisk træning. Ugeskr Læger 2005; 167: 1495-9. PubMed
- Khan F, Turner-Stokes L, Ng L, Kilpatrick T. Multidisciplinary rehabilitation for adults with multiple sclerosis. Cochrane Database Syst Rev. 2007; (2): CD006036. onlinelibrary.wiley.com
- Krysko KM, Rutatangwa A, Graves J et al. Association Between Breastfeeding and Postpartum Multiple Sclerosis Relapses A Systematic Review and Meta-analysis. JAMA Neurol 2019. epub 4173. pmid:31816024. www.ncbi.nlm.nih.gov
- Weinshenker BG, Bass B, Rice GPA, et al. The natural history of multiple sclerosis: a geographically based study. 1. Clinical course and disability. Brain 1980; 112: 133-46. PubMed
- Myhr KM, Riise T, Vedeler C, Nortvedt MW, Grønning M, Midgard R et al. Disability and prognosis in multiple sclerosis: demographic and clinical variables important for the ability to walk and awarding of disability pension. Multiple Sclerosis 2001; 7: 59-65. PubMed
- Marrie RA, Elliott L, Marriott J, et al. Effect of comorbidity on mortality in multiple sclerosis. Neurology 2015. pmid:26019190 PubMed
- Levin L.I., Munger K.L., Rubertone M.V., et al. Multiple sclerosis and Epstein-Barr virus, JAMA 2003, 289: 1533-6, PubMed
- Ebers G.C. Environmenrtal factors and multiple sclerosis, Lancet Neurology 2008, 7: 268-77, PubMed
- DeLorenze G.N., Munger K.L., Lennette E.T., Orentreich N., Vogelman J.H., Ascherio A. Epstein-Barr Virus and Multiple Sclerosis. Evidence of Association From a Prospective Study With Long-term Follow-up, Arch Neurol 2006, 63, www.ncbi.nlm.nih.gov
- Bø L., Vedeler C.A., Nyland HI et al. Intracortical multiple sclerosis lesions are not associated with increased lymphocyte infiltration, Mult Scler 2003, 9: 323-31, PubMed
- Bø L., Vedeler C.A., Nyland H.I. et al. Subpial demyelination in the cerebral cortex of multiple sclerosis patients, J Neuropathol Exp Neurol 2003, 62: 723-32, PubMed
- Linker R.A., Gold R. Dimethyl fumarate for treatment of multiple sclerosis: mechanism of action, effectiveness, and side effects, Curr Neurol Neurosci Rep. 2013 Nov, 13(11): 394, PubMed
- Cohen J.A., Barkhof F., Comi G., et al. Oral fingolimode or intramuscular interferon for relapsing multiple sclerosis, N Engl J Med 2010, 362: 402-15, pmid: 20089954, PubMed
- Koppel, B.S., Brust J.C., Fife T. et al. Systematic review: Efficacy and safety of medical marijuana in selected neurologic disorders: Report of the Guideline Development Subcommittee of the American Academy of Neurology, Neurology 2014, 82:1556–1563. PMID: 24778283 PubMed
- Whiting PF, Wolff RF, Deshpande S et al. Cannabinoids for Medical Use: A Systematic Review and Meta-analysis. JAMA 2015; 313(24):2456-73. PMID: 26103030 PubMed
- Tremlett H, Zhao Y, Devonshire V, UBC Neurologists. Natural history comparisons of primary and secondary progressive multiple sclerosis reveals differences and similarities. J Neurol 2009; 256: 374-81. PMID: 19308306 PubMed
Opracowanie
- Grzegorz Margas (recenzent)
- Adam Windak (redaktor)
- Thomas M. Heim (recenzent/redaktor)
