informacje ogólne
Definicja
- Ubytek przegrody międzykomorowej (VSD) to wrodzona wada serca, w której występuje połączenie między lewą i prawą komorą.
- VSD występuje samodzielnie lub w połączeniu z innymi wadami serca (np. tetralogią Fallota, przełożeniem wielkich pni tętniczych, sercem jednokomorowym).
Klasyfikacja
- VSD może być zlokalizowany w różnych miejscach przegrody.1
- ubytek okołobłoniasty (ok. 80 %)
- lokalizacja w błoniastej części przegrody w pobliżu zastawki trójdzielnej i aortalnej
- ubytek mięśniowy (ok. 15 %)
- lokalizacja w mięśniowej części przegrody, często ubytki mnogie
- ubytek odpływowy (ok. 5 %)
- lokalizacja poniżej zastawek półksiężycowatych w obszarze odpływu
- ubytek napływowy
- lokalizacja bezpośrednio pod zastawkami przedsionkowo-komorowymi w obszarze napływu, zwykle w zespole Downa
- ubytek okołobłoniasty (ok. 80 %)
Częstość występowania
- Najczęstsza wrodzona wada serca
- odsetek na poziomie ok. 40% wszystkich wad wrodzonych2
- Występuje nieco częściej u płci żeńskiej3
- Systematyczne badania echokardiograficzne ujawniają małe mięśniowe VSD u 50/1000 noworodków.4
Etiologia i patogeneza
Etiologia
- Podejrzewa się wieloczynnikową etiologię opartą na interakcji między wrodzonymi predyspozycjami a czynnikami środowiskowymi.5
- Występuje często z wadami chromosomalnymi, takimi jak trisomia 13, trisomia 18, Trisomia 215
Patofizjologia
- Ubytek powoduje przepływ z lewej do prawej komory z powodu różnicy ciśnień (przeciek lewo-prawy).
- Zakres przecieku zależy przede wszystkim od
- wielkości ubytku
- stosunku oporu systemowego do oporu płucnego
- Konsekwencje hemodynamiczne są następujące:
- zwiększony płucny przepływ krwi
- podwyższone tętnicze ciśnienie płucne
- obciążenie objętościowe lewej komory
- poszerzenie i późniejszy przerost
- wzrost ciśnienia końcowo-rozkurczowego
- zmniejszony systemowy rzut serca
- Małe VSD są „restrykcyjne”.
- ze względu na mały ubytek, tylko niewielka objętość przecieku z odpowiednio niskimi efektami hemodynamicznymi
- Utrzymywana jest różnica ciśnień między lewą i prawą komorą.
- często spontaniczne zamknięcie małych, restrykcyjnych VSD w okresie poporodowym
- samoistne zamknięcie nawet u 4% dorosłych z okołobłoniastymi VSD
- Duże VSD nie są już „restrykcyjne”.
- wyrównanie ciśnienia między lewą i prawą komorą serca
- Objętość i kierunek przecieku zależą tylko od stosunku oporu między krążeniem płucnym i systemowym.
- Jeśli nadciśnienie płucne wzrasta z czasem, dochodzi do odwrócenia przecieku (przeciek prawo-lewy) z sinicą (reakcja Eisenmengera).
Czynniki predysponujące
- Ponad 95% przypadków to pojedyncze, wrodzone anomalie.
- Czynniki genetyczne5
- częste występowanie u rodziców lub rodzeństwa z wrodzonymi wadami serca
- 3-krotnie zwiększone ryzyko, jeśli rodzeństwo ma VSD
- Niektóre zespoły genetyczne są często związane z VSD, np. trisomia 13/18/21.
- Czynniki matczyne
ICD-10
- Q21 Wrodzone wady rozwojowe przegród serca
- Q21.0 Ubytek przegrody międzykomorowej
Diagnostyka
Kryteria diagnostyczne
- Wykrywanie za pomocą echokardiografii
- Cel diagnostyki:
- wykrycie ubytku
- opis lokalizacji
- ocena efektów hemodynamicznych
- oszacowanie tętniczego ciśnienia płucnego
- wykrycie lub wykluczenie współistniejących wad serca i naczyń krwionośnych
- ocena rokowania
- planowanie terapii
Diagnostyka różnicowa
- Inne wrodzone choroby serca związane z VSD
- Tetralogia Fallota
- Przełożenie wielkich pni tętniczych
- Przetrwały pień tętniczy
- Przetrwały przewód tętniczy
- Serce jednokomorowe
- Ubytek przegrody przedsionkowo-komorowej
Wywiad lekarski
- Podczas badania noworodków nawet większe wady często pozostają bezobjawowe.
- Przeciek jest nadal niewielki ze względu na początkowo wysoki opór płucny po porodzie.
- Wraz ze spadkiem oporu płucnego u małych niemowląt pojawiają się już odpowiednie do wieku objawy niewydolności serca:
- pocenie się
- tachypnoe (przyśpieszony oddech)
- wyczerpanie podczas karmienia piersią/niedostateczny wzrost i przyrost masy ciała
- zakażenia oskrzelowo-płucne
Badanie fizykalne
- Objawy kliniczne zależą od wielkości ubytku.
- Małe, restrykcyjne ubytki
- głośny lewostronny szmer skurczowy przymostkowy (patrz także artykuł Szmery w sercu u dzieci)
- ew. drżenie klatki piersiowej
- tłumienie szmery na początku samoistnego zamknięcia
- Ubytki średniej wielkości
- lewostronny szmer skurczowy przymostkowy
- początkowe zwiększenie rzutu serca (obciążenie objętościowe)
- lekka tachykardia
- Duże ubytki
- przedserce hiperdynamiczne
- objawy niewydolności serca
- Występuje u dzieci w wieku 4–8 tygodni: tachykardia, tachypnoe, pocenie się, hepatosplenomegalia.
- cichy szmer skurczowy, uwydatniony 2. ton serca
- Sinica z odwróceniem przecieku po pierwszych latach życia (reakcja Eisenmengera)
- konsekwencje wzrostu oporu i ciśnienia płucnego
Wcześniejsze występowanie w wywiadzie i obraz kliniczny w wieku dorosłym
- Wielu pacjentów z małymi, ew. też pooperacyjnymi resztkowymi VSD pozostaje bezobjawowych.
- Możliwy szmer skurczowy (patrz również artykuł Szmery w sercu u dorosłych)
- U niektórych pacjentów wraz z wiekiem mogą pojawić się następujące problemy:1
- zapalenie wsierdzia (6-krotnie zwiększone ryzyko)
- wzrost przecieku spowodowany wzrostem ciśnienia skurczowego i rozkurczowego w lewej komorze wraz z rozwojem niewydolności serca
- przy odpowiedniej lokalizacji VSD, wypadnięcie prawego płatka zastawki aortalnej z niedomykalnością zastawki aortalnej
- arytmie (rzadsze niż w przypadku innych wrodzonych wad serca)
- Wizyta u lekarza rodzinnego może mieć miejsce w różnych przypadkach:1
- VSD operowany w dzieciństwie, brak przecieku resztkowego
- VSD operowany w dzieciństwie z przeciekiem resztkowym
- mały VSD bez obciążenia objętościowego/niewydolności serca, w przypadku którego w dzieciństwie nie było wskazań do zamknięcia
- duży, prawdopodobnie nieznany wcześniej VSD z niewydolnością serca
- Zespół Eisenmengera: duży VSD z pierwotnie dużym przeciekiem lewo-prawym, późniejszy rozwój nadciśnienia płucnego z odwróceniem przecieku/ sinicą
Badanie uzupełniające w praktyce lekarza rodzinnego
- W przypadku noworodków/dzieci dalsze wyjaśnienia przez pediatrę/kardiologa dziecięcego
- W przypadku dorosłych
- EKG (patrz także artykuł Lista kontrolna EKG)
- zwykle bez zmian w przypadku małych ubytków
- w przypadku umiarkowanych i dużych ubytków z obciążeniem objętościowym, objawy przerostu lewej komory, P mitrale
- w przypadku dużych ubytków z nadciśnieniem płucnym dodatkowe objawy przerostu prawej komory serca
- RTG klatki piersiowej
- przy znacznym przecieku kardiomegalia, zwiększone unaczynienie płucne
- wykluczenie/wykrycie rozpoznań różnicowych z dusznością
- EKG (patrz także artykuł Lista kontrolna EKG)
Diagnostyka u specjalisty
- Echokardiografia
- wykrycie VSD
- lokalizacja ubytku w odniesieniu do otaczających struktur
- oznaczenie morfologii i rozmiaru
- rozległość przecieku – stosunek przepływu płucnego do systemowego (Qp:Qs)
- wielkość i czynność komór serca
- ocena zastawek, zwłaszcza zastawki aortalnej
- oznaczenie ciśnienia skurczowego w tętnicy płucnej
- wykrywanie innych wad rozwojowych
- U 22% pacjentów z wrodzonym VSD występują inne istotne wady rozwojowe.
- Badanie rezonansu magnetycznego (RM)
- alternatywa dla echokardiografii przy nieodpowiednich warunkach akustycznych
- Cewnikowanie serca (koronarografia)
- Obecnie nie jest konieczne do postawienia diagnozy.
- u pacjentów z nadciśnieniem płucnym w celu określenia tętniczego oporu płucnego
- w razie potrzeby badanie odwracalności zwiększonego oporu
Ciąża
- Niskie ryzyko u bezobjawowych pacjentów bez dysfunkcji lewej komory lub nadciśnienia płucnego1
- Przeciwwskazana w zespole Eisenmengera1
Wskazania dla skierowania do specjalisty
- W przypadku podejrzenia klinicznego/osłuchowego: skierowanie na echokardiografię
Lista kontrolna w przypadku skierowania do specjalisty
Szmery w sercu u dzieci
- Cel skierowania
- Potwierdzenie diagnostyki? Leczenie? Inne?
- Wywiad lekarski
- niedostateczny wzrost i przyrost masy ciała, zawroty głowy, omdlenia, duszność, zakażenia dróg oddechowych, kaszel, ból w klatce piersiowej, palpitacje
- wywiad rodzinny: wady serca, nagły zgon sercowy
- ciąża: alkohol, leki teratogenne, zakażenia, cukrzyca
- przebyte i współistniejące choroby związane z wadami serca
- Badanie przedmiotowe
- Ogólny stan fizyczny?
- sinica, tachypnoe (przyśpieszony oddech), obrzęki
- różnica ciśnienia tętniczego ramiona/nogi
- wyczuwalny świst w klatce piersiowej, powiększenie wątroby
- szmery w sercu: moment występowania w cyklu pracy serca, czas trwania, częstotliwość, charakter dźwięku, punctum maximum, promieniowanie
- Badanie uzupełniające
- EKG
Leczenia
Cele leczenia
- Leczenie przyczynowe: zamknięcie VSD w celu zapobiegania powikłaniom i normalizacji rokowania
Ogólne informacje o leczeniu
- Zamknięcie jest zazwyczaj wskazane w następujących przypadkach:
- echokardiograficznie wyraźne obciążenie objętościowe (stosunek przecieku Qp:Qs > 1,5:1)
- duży ubytek z rozwojem nadciśnienia płucnego (o ile nie jest jeszcze utrwalone)
- Małe ubytki
- Małe VSD zdiagnozowane w okresie noworodkowym często zamykają się samoistnie.
- wskazanie do zamknięcia w przypadku wystąpienia niedomykalności zastawki aortalnej (szczególnie w przypadku infundibularnego VSD)
- Ubytki średniej wielkości
- zamknięcie po 1. roku życia w przypadku braku redukcji i utrzymującego się obciążenia objętościowego
- Duże ubytki
- zamknięcie w ciągu pierwszych 6 miesięcy przy (jeszcze nieutrwalonym) nadciśnieniu płucnym lub objawach niewydolności serca/niedostatecznym wzroście i przyroście masy ciała
- Po 6. miesiącu życia decyzja o leczeniu jest trudniejsza, dlatego konieczne jest inwazyjne określenie oporu płucnego i badanie reaktywności.
Zamknięcie chirurgiczne
- Standardową metodą jest zamknięcie chirurgiczne.
- Zwykle zamknięcie chirurgiczne po sternotomii pośrodkowej i prawostronnej atriotomii z dostępu przezmostkowego
- w zależności od sytuacji anatomicznej, aortotomia lub wentrikulotomia (wyższe ryzyko późniejszej arytmii w przypadku wentrikulotomii) jako dostęp w indywidualnych przypadkach
- Alternatywnie procedury minimalnie inwazyjne (częściowa sternotomia dolna, torakotomia przednio-boczna lub pośrodkowa)
- Zamknięcie za pomocą łaty, w indywidualnych przypadkach również za pomocą szwu bezpośredniego
- Bardzo niskie ryzyko śmiertelności operacyjnej (jeśli nadciśnienie płucne nie jest jeszcze utrwalone)8
Interwencyjne zamknięcie za pomocą cewnika
- Interwencyjne zamknięcie za pomocą okluderów lub spiral jest zasadniczo technicznie możliwe.
- Problematyczne jest jednak zamykanie ubytków okołobłoniastych ze względu na bliskość układu przewodzącego i zastawki aortalnej.
- Szanse powodzenia wzrastają wraz ze wzrostem i odległością okluzji od zastawki aortalnej.
- Interwencyjne zamknięcie stanowi rozwiązanie szczególnie w przypadku ubytków mięśniowych.9
Leczenie farmakologiczne
- W przypadku utrwalonego nadciśnienia płucnego i wynikającego z tego wysokiego ryzyka okluzji można zastosować terapię obniżającą ciśnienie za pomocą antagonistów receptora endoteliny lub inhibitorów fosfodiesterazy.
- Objawowe leczenie farmakologiczne niewydolności serca
Profilaktyka zapalenia wsierdzia
- Profilaktykę zapalenia wsierdzia stosuje się w ciągu pierwszych 6 miesięcy po zamknięciu, a później tylko w przypadku resztkowego przecieku.
- W pozostałych przypadkach profilaktyka zapalenia wsierdzia nie jest zalecana.
Wskazania do zamknięcia ubytku przegrody międzykomorowej u dorosłych
- Wskazania u dorosłych są podobne jak u dzieci i opierają się na skuteczności hemodynamicznej VSD.
- Chirurgiczne zamknięcie jest metodą z wyboru charakteryzującą się niską śmiertelnością operacyjną i dobrymi wynikami długoterminowymi.1
- Interwencyjne zamknięcie za pomocą cewnika można rozważyć w następujących przypadkach:1
- zwiększone ryzyko operacyjne
- wcześniejsza operacja kardiochirurgiczna
- niekorzystne położenie VSD do operacji
- Interwencyjne zamknięcie za pomocą cewnika jest alternatywą dla zabiegu chirurgicznego, szczególnie w przypadku ubytków mięśniowych zlokalizowanych centralnie w przegrodzie.1
Wytyczna: wskazanie do zamknięcia VSD u dorosłych1
- U pacjentów z objawami, które można przypisać przeciekowi lewo-prawemu przez (resztkowy) ASD i u których nie występuje nadciśnienie płucne, należy wykonać chirurgiczne zamknięcie ASD.
- U bezobjawowych pacjentów z obciążeniem objętościowym lewej komory z powodu VSD należy wykonać chirurgiczne zamknięcie.
- U pacjentów z przebytym infekcyjnym zapaleniem wsierdzia należy rozważyć zamknięcie chirurgiczne.
- Operację należy rozważyć u pacjentów z wypadaniem płatka zastawki aortalnej związanym z VSD i postępującą niewydolnością zastawki aortalnej.
- Nie należy wykonywać zamknięcia w zespole Eisenmengera.
- W przypadku małego VSD bez obciążenia objętościowego/nadciśnienia płucnego/infekcyjnego zapalenia wsierdzia nie należy wykonywać zamknięcia.
Przebieg, powikłania i rokowanie
Powikłania
- Długotrwałe
- nadciśnienie płucne
- reakcja Eisenmengera
- niewydolność serca
- niewydolność zastawki aortalnej
- infekcyjne zapalenie wsierdzia
- arytmie serca
- nagły zgon sercowy rzadko10
- Krótkotrwałe po zamknięciu
Przebieg i rokowanie
- Małe, restrykcyjne VSD bez wpływu na oczekiwaną długość życia i wydolność
- Często samoistne zamknięcie małych ubytków w ciągu pierwszych 1–2 lat życia12
- Samoistne zamknięcie najczęściej występuje przy ubytkach mięśniowych.5
- Samoistne zamknięcia są rzadkie po 2. roku życia.13
- U niektórych pacjentów przeciek zwiększa się z czasem i leczenie jest konieczne w wieku dorosłym
- Znaczne ryzyko rozwoju zespołu Eisenmengera w przypadku dużych nieleczonych ubytków
- Dobre rokowanie po korekcji chirurgicznej, nawet w przypadku dużych ubytków14-15
- w przypadku terminowej, skutecznej i niepowikłanej terapii: normalna wydolność krążeniowo-oddechowa i normalna oczekiwana długość życia
Dalsze postępowanie
- Dzieci i młodzież
- po zamknięciu VSD w dzieciństwie do końca okresu wzrostu regularne pediatryczne kontrole kardiologiczne
- po okresie dojrzewania regularne badania kontrolne nie są już konieczne, o ile spełnione są następujące warunki:
- brak resztkowego przecieku
- rytm zatokowy z prawidłowym przewodzeniem przedsionkowo-komorowym
- prawidłowa wielkość i czynność serca
- prawidłowe funkcjonowanie zastawki
- w przypadku restrykcyjnego VSD bez zamknięcia dożywotnie badania kontrolne
- Dorośli
- coroczne badania kontrolne w specjalistycznych ośrodkach dla osób dorosłych z wrodzonymi wadami serca (adult congenital heart disease – ACHD) w następujących przypadkach:1
- przeciek resztkowy
- dysfunkcja lewej komory
- nadciśnienie płucne
- niewydolność zastawki aortalnej
- zawężenie drogi odpływu
- Kontrole co 3–5 lat w następujących przypadkach:
- mały VSD
- bezobjawowy
- brak dysfunkcji lewej komory, brak nadciśnienia płucnego
- coroczne badania kontrolne w specjalistycznych ośrodkach dla osób dorosłych z wrodzonymi wadami serca (adult congenital heart disease – ACHD) w następujących przypadkach:1
- Dla długoterminowego dobrostanu pacjentów ważna jest dobra współpraca między lekarzami rodzinnymi a specjalistami ACHD.
Informacje dla pacjentów
Informacje dla pacjentów w Deximed
- Ubytki przegrody u dzieci: ubytek przegrody międzyprzedsionkowej (ASD) i ubytek przegrody międzykomorowej (VSD)
- Cewnikowanie serca u dzieci
- Echokardiografia
- Profilaktyka zapalenia wsierdzia
Ilustracje


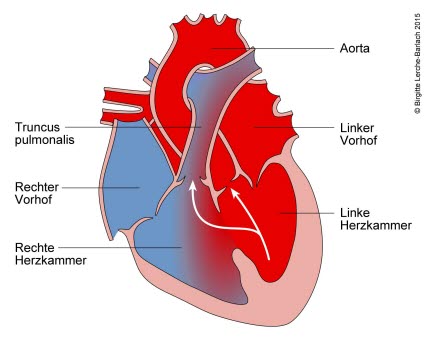
Ubytek przegrody międzykomorowej
Quellen
Leitlinien
- European Society of Cardiology. Guidelines for the management of grown-up congenital heart disease. Stand 2010. www.escardio.org
Literatur
- Baumgartner H, BonhoefferP, De Groot N, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31: 2915–2957. doi:10.1093/eurheartj/ehq249 DOI
- Penny D, Vick G. Ventricular septal defect. Lancet 2011; 377: 1103-1112. doi:10.1016/S0140-6736(10)61339-6 DOI
- Spicer D, Hsu H, Co-Vu J, et al. Ventricular septal defect. Orphanet J Rare Dis 2014; 9: 144. www.ncbi.nlm.nih.gov
- Roguin N, Du ZD, Barak M, et al. High prevalence of muscular ventricular septal defect in neonates. J Am Coll Cardiol 1995; 26: 1545-1548. doi:10.1016/0735-1097(95)00358-4 DOI
- Ramaswamy P. Ventricular septal defects. Medscape, updated Dec 10, 2015. Zugriff 21.10.18. emedicine.medscape.com
- Narchi H, Kulaylat N. Heart disease in infants of diabetic mothers. Images Paediatr Cardiol 2000; 2: 17-23. www.ncbi.nlm.nih.gov
- Yang J, Qiu H, Pengfei Q, et al. Prenatal Alcohol Exposure and Congenital Heart Defects: A Meta-Analysis. PLoS One 2015;10: e0130681. doi:10.1371/journal.pone.0130681 DOI
- Roos-Hesselink JW, Meijboom FJ, Spitaels SEC et al. Outcome of patients after surgical closure of ventricular septal defect at young age: longitudinal follow-up of 22-34 years. Eur Heart J 2004;25:1057-62. European Heart Journal
- Zartner P, Christians C, Stelter J, e al. Transvascular closure of single and multiple muscular ventricular septal defects in neonates and infants < 20 kg.. catheter cardiovasc interv 2014; 83: 564-570. pmid:23996896> PubMed
- Khairy P, Balaji S. Cardiac Arrhythmias In Congenital Heart Diseases. Indian Pacing Electrophysiol J 2009; 9: 299–317. pmid:19898654 PubMed
- Schipper M, Slieker M, Schoof P, et al. Surgical Repair of Ventricular Septal Defect; Contemporary Results and Risk Factors for a Complicated Course. Pediatr Cardiol 2017; 38: 264-270. pmid:27872996 PubMed
- Gabriel HM, Heger M, Innerhofer P, et al. Long-term outcome of patients with ventricular septal defect considered not to require surgical closure during childhood. J Am Coll Cardiol 2002;39:1066-1071. PMID: 11897452 PubMed
- Miyake T, Shinohara T, Fukuda T, Ikeoka M, Takemura T. Spontaneous closure of perimembranous ventricular septal defect after school age. Pediatr Int 2008; 50: 632-635 PMID: 19261109 PubMed
- Scully BB, Morales DL, Zafar F, et al. Current expectations for surgical repair of isolated ventricular septal defects. Ann Thorac Surg 2010; 89: 544-9. PubMed
- Moller JH, Patton C, Varco RL, Lillehei CW. Late results (30 to 35 years) after operative closure of isolated ventricular septal defect from 1954 to 1960. Am J Cardiol 1991; 68: 1491-7. PubMed
- Soufflet V, Van de BA, Troost E, et al. Behavior of unrepaired perimembranous ventricular septal defect in young adults. Am J Cardiol 2010;105:404-407. PMID: 20102957 PubMed
Autoren
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.