Informacje ogólne
Definicja
- Biegunka związana z Clostridioides difficile (ang. CDI- C. difficile infection, lub CDAD- C. difficile-assosiated diarrhea) to choroba biegunkowa wywołana przez beztlenową bakterię Clostridioides difficile (dawniej znana jako Clostridium difficile).1-2
- Manifestacja: co najmniej 3 nieuformowane stolca w ciągu 24 godzin4
- Szczególnie często występuje po antybiotykoterapii (patrz też Biegunka związana z antybiotykami).
- Wyróżnia się zakażenia nabyte w warunkach ambulatoryjnych (CDI pozaszpitalne), jak i szpitalnych.5
- Zakażenia nabyte w warunkach ambulatoryjnych są jednak znacznie rzadsze.
- Obraz kliniczny CDI obejmuje stany od łagodnej, samoograniczającej się biegunki po piorunujące zapalenie jelita grubego ze wstrząsem.
- Wydzielanie toksyn może prowadzić do rzekomobłoniastego zapalenia jelita grubego (ang. pseudomembranous colitis).
- Często CDI ma charakter nawrotowy.
Epidemiologia
- U ok. 5–25% pacjentów przyjmujących antybiotyki rozwija się biegunka, 15–20% z tych zachorowań wywołuje C. difficile.
- Clostridioides difficile jest najczęstszym patogenem wywołującym biegunkę szpitalną i choroby biegunkowe związane z antybiotykami.6
- Zakażenie C. difficile statystycznie rozwija się u około 1 na 100 pacjentów leczonych antybiotykami.
- Nosicielami tego patogenu jest około 3% zdrowej populacji, 15–35% pacjentów szpitalnych i 50–60% pensjonariuszy domów opieki.7
- W Polsce wg danych NIZP-PZH w 2022r. zapadalność na CDI wynosiła 57,0 przypadków na 100 000 mieszkańców (w porównaniu z 55,4 przypadków w 2021r.)8
- 80,3% pacjentów wymagało hospitalizacji8
- Częstość występowania CDI wzrasta na całym świecie. W ostatnich latach w Europie obserwuje się stały wzrost liczby ciężkich, zgłaszanych przypadków CDI.6
- Na CDI najczęściej zapadają pacjenci hospitalizowani, ciężko chorzy, w podeszłym wieku.9
Etiologia i patogeneza
- Clostridioides difficile
- obligatoryjnie beztlenowa, Gram-dodatnia, tworząca przetrwalniki/ zarodniki (spory) laseczka
- może wchodzić w skład flory bakteryjnej człowieka (szczepy nietoksynotwórcze)- u noworodków, osób w podeszłym wieku4
- wszechobecna w środowisku oraz w jelitach ludzi i zwierząt
- Szczególnie pacjenci objawowi wydalają duże ilości bakterii/przetrwalników z wodnistym stolcem.
- C. difficile wykazuje dużą tolerancję na ciepło i suszenie, jak również na szereg różnych substancji chemicznych, w tym wiele środków dezynfekujących.
- Bakteria może więc przetrwać na przedmiotach przez długi czas i być przeniesiona przez ręce lub stetoskop.10
- Czynnikiem odpowiedzialnym za rozprzestrzenianie się zakażeń C. difficile są spory, obecne w otoczeniu osoby chorej oraz w środowisku zewnętrznym.4
- Transmiasja drogą fekalno-oralną, poprzez wchłonięcie bakterii (przetrwalników).
- Nie wyjaśniono jeszcze, czy możliwe jest zakażenie drogą powietrzną.1
- Wzorst bakterii Clostridioides w świetle jelita jest silnie tłumiony przez prawidłową florę jelitową.4
- Aby doszło do rozwoju bakterii w jelitach człowieka, równowaga mikrobiotu musi zostać zaburzona.
- Clostridioides difficile, PCR rybotyp 027 (NAP1/BI/027)
- ang. North American Pulsed Field Type 1 (NAP1)
- szczep ten jest "hiperwirulentny"11
- produkuje więcej toksyn (16 x więcej toksyny A, 23 x więcej toksyny B niż inne szczepy)11
- wytwarza dodatkowo toksynę binarną
- ma większą zdolność do tworzenia spor
- ma wysoką oporność na fluorochinolony
- rozprzestrzenia się epidemicznie
- wywołuje zakażenia charakteryzujące się cięższym przebiegiem klinicznym i wyższą śmiertelnością w porównaniu do innych pospolitych typów C. difficile.12
- odpowiedzialny za wiele epidemii szpitalnych, również w Polsce13
- W badaniach przeprowadzonych w latach 2011-2013 w 13 szpitalach w Polsce stwierdzono, że w polskich szpitalach przeważają CDI wywołane przez PCR rybotyp 027 (62%).14
- Według danych z 2017 roku na terenie Śląska odsetek izolowanych szczepów C. difficile o PCR rybotypie 027 powodujących CDI wyniósł ponad 80%.15
- Biegunka wywołana przez Clostridioides difficile
- C. difficile uznaje się za czynnik wywołujący choroby biegunkowe związane z antybiotykoterapią.
- W przypadku następujących antybiotyków stwierdza się szczególnie częsty związek z biegunką i rzekomobłoniastym zapaleniem jelita grubego:
- cefalosporyny: znacznie większe ryzyko w przypadku cefalosporyn III generacji
- penicyliny o szerokim spektrum działania: np. pochodne ampicyliny, piperacylina (również w skojarzeniu z tazobaktamem)
- klindamycyna
- klarytromycyna: szczególnie przy dużych dawkach (3 x 500 mg)
- fluorochinolony
- W dwóch metaanalizach wykazano, że antybiotykoterapia zwiększa ryzyko zakażenia Clostridioides od 5 do 7 razy (OR 3,5–6,9).17-18
- największe ryzyko podczas przyjmowania klindamycyny (OR 16–20)= 20-krotnie zwiększa ryzyko CDI
- zwiększone ryzyko podczas przyjmowania fluorochinolonów (OR 5,5) i cefalosporyn (OR 5,5)
- zwiększone, ale nieco mniejsze ryzyko w przypadku penicylin, makrolidów i sulfonamidów (OR 2–3)
- brak zwiększonego ryzyka w przypadku przyjmowania tetracyklin (OR 0,9)
- Ponadto wykazano zwiększenie ryzyka zakażeń Clostridioides
- przy kumulatywnym dawkowaniu antybiotyków
- wraz ze wzrostem czasu trwania leczenia i
- wraz ze wzrostem liczby stosowanych antybiotyków19
- Rzekomobłoniaste zapalenie jelita grubego
- Rzekomobłoniaste zapalenie jelita grubego wykrywa się w trakcie kolonoskopii w 10–20% przypadków CDI.
- Ponad 95% przypadków rzekomobłoniastego zapalenia jelita grubego jest spowodowanych przez C. difficile.
Patofizjologia4
- Przyczyną zapalenia jelita grubego wywołanego przez C. difficile są zaburzenia normalnej flory jelitowej w okrężnicy w wyniku przyjmowania antybiotyków, co sprzyja namnażaniu się Clostridioides difficile.
- Chorobę wywołują czynniki wirulencji: enterotoksyna A i cytotoksyna B, które nie są wytwarzane przez wszystkie szczepy C. difficile (są to szczepy niepatogenne).
- Toksyny powodują cytotoksyczne uszkodzenia komórek jelitowych, prowadząc do biegunki i zapalenia jelita grubego.
- Ryzyko i nasilenie choroby zależą w dużej mierze od czynników predysponujących nosiciela.
- zaburzenia fizjologii jelit/mikrobioty jelitowej, np. w wyniku antybiotykoterapii
- podstawowe choroby przewodu pokarmowego
- zabiegi w obrębie przewodu pokarmowego
- stan immunologiczny
- Na przykład obecność swoistych przeciwciał przeciwko enterotoksynom wykazuje działanie ochronne.
Czynniki predysponujące4
- Najważniejszym czynnikiem ryzyka jest antybiotykoterapia.9
- szczególnie w ostatnich 12 tygodniach (u 64% chorych)4
- zwłaszcza dlugotrwała antybiotykoterapia i/lub stosowaniu kilku antybiotyków
- szczególnie wysokie ryzyko wywołania zakażeń C. difficile istnieje przy stosowaniu: fluorochinolonów, klindamycyny oraz cefalosporyn II i III generacji11
- Jednak każdy antybiotyk może być przyczyną biegunki o etiologii C. difficile11
- patrz Tabela Antybiotyki a ryzyko wywołania zakażeń C. difficile. [INSERT TABLE]
- Leczenie szpitalne zwiększa ryzyko.
- Ok. 82% chorych z rozpoznaniem CDI przebyło hospitalizację w ciągu ostatnich 12 tygodni.4
- Z metaanalizy wynika, że pacjenci skolonizowani w momencie przyjęcia do szpitala są 6 razy bardziej narażeni na zakażenie w trakcie hospitalizacji.20
- Starszy wiek, ≥ 65 rż21
- Wydaje się, że leki hamujące wydzielanie kwasu prowadzą do znacznie większego ryzyka zakażenia Clostridioides.22-23
- Codzienne stosowanie inhibitorów pompy protonowej (IPP) niemal podwaja to ryzyko, szczególnie u osób starszych.24-25
- Stosowanie blokerów H2
- Leczenie immunosupresyjne (np. stan po transplantacji narządu)
- Biorcy narządów oraz szpiku mają 3-krotnie wyższą zachorowalność na CDI, oraz wysokie rysyko nawrotów, ciężkiego przebiegu zakażenia i zgon.4
- Przyjmowanie niesteroidowych leków przeciwzapalnych (NLPZ)
- W tym przypadku opisano wskaźnik występowania CDI wyższy o 30%.
- Chemioterapia, szczególnie w fazie neutropenii4
- Wcześniejsze operacje w obrębie przewodu pokarmowego
- Pacjenci po usunięciu wyrostka mogą być narażeni na zwiększone ryzyko zakażenia Clostridioides.26
- Zapalne choroby jelit (Choroba Leśnioweskiego-Crohna, WZJG, zespół jelita drażliwego, choroba Hirschsprunga)11
- Żywienie przez sondę
- Niedożywienie
- Przewlekła choroby współistniejące (choroba nerek, niewydolność wątroby, cukrzyca)
- Niedobór witaminy D4
ICD-10
- A04 Inne bakteryjne zakażenia jelit
- A04.7 Zapalenie jelita cienkiego i grubego wywołane przez Clostridium difficile, w tym: Zatrucie pokarmowe wywołane przez Clostridium difficile. Rzekomobłoniaste zapalenie jelita grubego
Diagnostyka
Kryteria diagnostyczne i klasyfikacja ciężkości
- Zakażenie C. difficile (CDI- ang. C. difficile infection) może być rozpoznane, jeśli występują:11
- biegunka (w ciągu 24 godzin ≥3 luźnych stolców, dopasowujących się kształtem do pojemnika lub odpowiadających typom 5-7 w skali Bristol) LUB
- toksyczne rozdęcie okrężnicy (megacolon toxicum -okrężnica olbrzymia – patologiczne poszerzenie jelita grubego potwierdzone radiologicznie) bez innej ustalone przyczyny ORAZ
- spełnienie co przyjamniej jednego z poniższych kryteriów:
- stwierdzenie obecności toksynyC. difficile A i/lub B w stolcu lub wykazanie obecności szczepu C. difficile wytwarzającego toksyny w posiewie stolca
- rzekomobłoniaste zapalenie jelita grubego (colitis pseudomembranosa) wykryte endoskopowo lub w trakcie zabiegu
- histopatologiczne potwierdzenie zakażenia C. difficile (z biegunką lub bez biegunki) w badaniu endoskopowym, kolektomii lub sekcji zwłok
- Nawrót CDI:11
- epizod CDI rozpoznany na podstawie wyżej wymienionych kryteriów, do którego dochodzi w okresie 2-8 tygodni od poprzedniego epizodu, którego objawy ustąpiły po/lub bez leczenia
- nawroty występują głównie u osób starszych z upośledzoną odpornością4
- 3 Postacie kliniczne CDI:
- lekki/ umiarkowany przebieg
- ciężki przebieg
- piorunujący: podtyp ciężkiego CDI, przebiegający z hipotensją lub wstrząsem, niedrożnością lub jelitem olbrzymim
- Poza wynikami badań przedmiotowych za czynniki ryzyka ciężkiego przebiegu CDI uznaje się następujące parametry:4
- gorączka >38,5°C
- leukocytoza >15 000 × 109/l
- przesunięcie w lewo >20% granulocytów pałeczkowatych
- hipoalbuminemia (< 2,5 d/dl)
- wzrost kreatyniny >50% wartości wyjściowej lub > 2 mg/dl
- wzrost stężenia mleczanów ≥5 mmol/l
- wiek >65 lat
- istotne choroby współistniejące (np. niewydolność nerek, immunosupresja, itp.)
- Nawrót CDI
- Czynniki ryzyka ciężkiego przebiegu zakażenia C. difficile oraz zgonu zostały ujęte w klasyfikacji ATLAS (ATLAS score)27
- kalkulator internetowy na mdcalc.com
- Uzyskanie w tej skali 8 punktów jest związane z 56% ryzykiem zgonu w przebiegu CDI.4
Diagnostyka różnicowa
- Inne zakażenia jelitowe
- Biegunka związana z antybiotykami
- Zapalenie uchyłków
- Nieswoiste zapalenia jelit
- Niedokrwienne zapalenie jelita grubego
- Zakażenie Clostridium innocuum28
- patogeny oportunistyczne u pacjentów z upośledzeniem odporności
- objawy podobne do tych występujących przy zakażeniu C. difficile
- ale negatywny wynik oznaczenia toksyny
- bardzo częsta oporność na wankomycynę
Wywiad lekarski
- Biegunka, zwykle przez 2–4 tygodnie (zakres: 0–12 tygodni) po rozpoczęciu antybiotykoterapii
- Czynniki predysponujące?
- Zazwyczaj nagły początek z wodnistą biegunką o charakterystycznym nieprzyjemnym zapachu (co najmniej 3 wypróżnienia na dobę przez 2 lub więcej dni)
- rzadko krew w stolcu
- w rzadkich przypadkach brak biegunki przy ciężkim przebiegu z powodu porażennej niedrożności jelita
- Gorączka (w 28% przypadków)
- Ból brzucha (w 22% przypadków)
- Utrata apetytu
- Ogólne pogorszenie stanu fizycznego
Badanie przedmiotowe
- Gorączka.
- Możliwe ogólne pogorszenie stanu fizycznego
- Ewentualnie cechy odwodnienia
- W rzadkich przypadkach mogą wystąpić objawy niedrożności jelita lub zapalenia otrzewnej.29
Badania uzupełniające11
Diagnostyka stolca (poza koszykiem badań POZ)
- Materiał do badania: próbka kału biegunkowego pobrana od pacjenta z podejrzeniem CDI11
- Badana powinna być tylko płynna lub nieuformowana (przyjmująca kształt pojemnika) próbka kału, ponieważ dostępne testy nie pozwalają na odróżnienie objawowego CDI od nosicielstwa
- Metodą referencyjną w wykrywaniu zakażenia Clostridioides jest posiew beztlenowy na specjalnych podłożach w połączeniu z wykrywaniem toksyn w supernatancie.6
- jednak jest to zbyt czasochłonne (2-5 dni) do wykonywania rutynowo
- Preferowana metoda diagnostyczna: należy dążyć do wykrycia wolnych toksyn w kale11
- Obecnie w Europie rekomenduje się dwu-etapowy algorytm diagnostyczny:4
- wykrywanie antygenu GDH oraz wolnnych toksyn A i/lub B C. difficle w próbce kale pacjenta;
- w razie dodatniego wyniku GDH i braku toksyn A i/lub B w kale, należy wykonać badanie amplifikacji kwasów nukleinowych (NAAT) celem wykrycia genów toksynotwórczych
- Wykrywanie wolnych toksyn
- głównie w rutynowej diagnostyce za pomocą testów immunoenzymatycznych (EIA)
- Ze względu na mniejszą czułość należy w przypadku podejrzenia zawsze badać kilka próbek.
- Toksyny można też wykrywać przy użyciu testu cytotoksyczności, który jest wysoce czuły i swoisty, właściwie uznaje się go za złoty standard, ale jest pracochłonny i czasochłonny, jak również słabo wystandaryzowany i dlatego nie jest oferowany przez wszystkie laboratoria.
- Toksyny A i B są bardzo niestabilne, degradowane w temperaturze pokojowej, i niewykrywalne po 2 godzinach od pobraniu materiału.4
- głównie w rutynowej diagnostyce za pomocą testów immunoenzymatycznych (EIA)
- Wykrywanie wspólnego antygenu C. difficile - GDH
- za pomocą testów immunoenzymatycznych (EIA) do wykrywania enzymu dehydrogenazy glutaminianowej
- Wysoka czułość, ale niezbyt wysoka swoistość, ponieważ wykrywane są również szczepy niewytwarzające toksyn oraz inne gatunki Clostridia (metoda przesiewowa).
- Jeżeli wynik jest dodatni, należy przeprowadzić dalsze badanie (np. badanie cytotoksyczności).
- Ta dwuetapowa procedura jest zalecana diagnostycznie ze względu na wysoką czułość, jednak nie przyjęła się jeszcze w rutynowej diagnostyce.
- Posiew na selektywnym podłożu agarowym i kilkudniowa inkubacja w warunkach beztlenowych
- najbardziej czuła metoda wykrywania C. difficile
- Wykrywane są również szczepy nietoksyczne, zatem w przypadku dodatnich wyników posiewu należy również sprawdzić toksynotwórczość wyhodowanego szczepu.
- wady: długi czas do uzyskania wyniku
- niezbędny do przeprowadzania testów wrażliwości na antybiotyki, a także typowania patogenów
- Badanie lekowrażliwości/ oporności na antybiotyki
- Poza badaniami epidemiologicznymi, rutynowe testy oporności są rzadko stosowane w przypadku C. difficile, ponieważ większość patogenów reaguje na leczenie metronidazolem lub wankomycyną.
- Dotychczas szczepy oporne na metronidazol i wankomycynę wykryto w Hiszpanii oraz w Austrii u turysty z Wielkiej Brytanii.
- Poza badaniami epidemiologicznymi, rutynowe testy oporności są rzadko stosowane w przypadku C. difficile, ponieważ większość patogenów reaguje na leczenie metronidazolem lub wankomycyną.
- Typowanie patogenów
- Obecnie stosuje się przede wszystkim metodę rybotypowania PCR oraz MLVA (Multi-Locus Variable Number Tandem Repeats Analysis).30
- istotne znaczenie dla badań nad występowaniem i rozprzestrzenianiem się różnych szczepów patogenów, wyjaśniania ognisk i łańcuchów przenoszenia, jak również charakterystyki szczepów o szczególnych właściwościach wirulencji
- Postępowanie z próbkami
- Czas transportu w temperaturze pokojowej wynosi 2 godziny, w przeciwnym razie toksyna ulega rozkładowi.
- W temperaturze 4°C próbki do badania toksyn w kale mogą być przechowywane maksymalnie przez 3 dni.11
- Dłuższe przechowywanie jest możliwe w temperaturze –80°C.11
- Należy jednak unikać zamrażania próbek w temperaturze –20°C oraz wielokrotnych cykli rozmrażania i zamrażania.
Badania laboratoryjne
- Hb, CRP, OB, leukocyty (często podwyższona leukocytoza)
- Elektrolity (Na, K, Ca) oraz kreatynina
- Albumina (masywna utrata białek może wystąpić już we wczesnym okresie choroby)
Diagnostyka specjalistyczna
- Endoskopia
- Makroskopowe cechy rzekomobłoniastego zapalenia jelita grubego są w wielu przypadkach tak charakterystyczne, że rozpoznanie CDI można postawić również na podstawie endoskopii (kolonoskopia/sigmoidoskopia) i rozpocząć terapię nawet bez wcześniejszego potwierdzenia mikrobiologicznego.
- W cięższych przypadkach pojawiają się żółtoszare, plamiste błony włókniste (błona rzekoma) pokrywające ścianę jelita.
- Są one łatwe do usunięcia i powodują punktowe krwawienia.
- Badanie rentgenowskie
- Przegląd jamy brzusznej przy przyjęciu do szpitala i w trakcie przebiegu pod kątem rozwoju toksycznego rozdęcia jelita (w przypadku przebiegu piorunującego)
- TK
- Może wykazać odcinkowe zapalne pogrubienia ścian.31
Wskazanie do skierowania do hospitalizacji
- Pacjenci z ciężkimi objawami lub podejrzeniem rzekomobłoniastego zapalenia jelita grubego powinni być skierowani do szpitala celem dalszej diagnostyki i leczenia.
Lista kontrolna dotycząca skierowania
Clostridioides difficile, rzekomobłoniaste zapalenie jelita grubego
- Cel skierowania
- Diagnostyka i terapia
- Wywiad lekarski
- Początek i czas trwania? Przyczyna wyzwalająca (antybiotyki)? Ewentualne czynniki predysponujące? Rozwój?
- Objawy? Biegunka: liczba wypróżnień w ciągu dnia, krew w stolcu? Gorączka? Ból brzucha?
- Ewentualna próba leczenia; efekt?
- Skutki?
- Badanie przedmiotowe
- Ogólny stan fizyczny? Odwodnienie? Stan jamy brzusznej?
- Badania uzupełniające
- Hb, CRP, OB, elektrolity, kreatynina, albumina
- Ewentualnie zlecić posiew kału?
Leczenie
Cele terapii
- Wyleczenie zakażenia u osób dotkniętych chorobą
- Należy unikać zarażenia innych ludzi.
Ogólne informacje o terapii
- Celem ograniczenia szczerzenia się zakażenia C. difficile, jeśli pacjent jest w szpitalu11
- należy izolować pacjenta na sali jedno-osobowej z własną łazienką i toaletą
- Od pacjentów należy wymagać mycia rąk mydłem i wodą, a także kąpieli pod prysznicem w celu zredukowania liczby spor na powierzchni skóry
- perosnel medyczny powinien zakładać rękawiczki przy wejściu na salę i podczas opieki nad pacjentem; po zdjęciu rękawiczek należy wykonywać procedurę higieny rąk poprzez mycie mydłem pod bieżącą wodą lub stosując środki do higieny rąk na bazie alkoholu
- należy stosować jednorazowy sprzęt, jeśli jest to możliwe
- kontaktowe środki ostrożności należy utrzymać co najmniej przez 48 godzin po ustąpieniu biegunki
- Diagnostyka CDI nie może opóźnić wdrożenia leczenia!
- Kliniczne podejrzenie CDI u osób z grupy ryzyka oraz pacjentów z piorunującym przebiegiem jest wskazaniem do rozpoczęcia terapii empirycznej.4
- W łagodnych przypadkach i u pacjentów bez czynników ryzyka wystarczające może być odstawienie antybiotyku wyzwalającego.11 Następnie choroba ustępuje samoistnie po 2–3 dniach.
- Ważne jest nawadnianie poprzez odpowiednie podawanie płynów i elektrolitów.9
- Stosowanie leków hamujących perystaltykę (np. loperamid, opiaty lub racecadotril) jest względnie przeciwwskazane w rzekomobłoniastym zapaleniu jelita grubego, ze względu na ryzyko wystąpienia toksycznego rozdęcia okrężnicy (megacolon toxicum).1
- Wskazaniami do antybiotykoterapii są:
- ciężkie lub uporczywe objawy
- przy występowaniu czynników ryzyka ciężkiego przebiegu
- osoby starsze i/lub pacjenci z chorobami podstawowymi
- sytuacje, w których należy kontynuować dotychczasową antybiotykoterapię
- Doustna antybiotykoterapia wydaje się być znacznie bardziej skuteczna niż terapia dożylna i jest preferowana, jeśli to możliwe.32
Farmakoterapia
Leczenie pierwszego incydentu CDI4
- Wybór schematu leczenia zależy od przebiegu klinicznego choroby4
LEKKI/ UMIARKOWANY przebieg CDI
- Leki pierwszego wyboru to:
- wankomycyna 4 x 125 mg doustnie przez 10 dni
- W przypadku powolnej poprawy klinicznej lub niecałkowitego ustąpienia biegunki, leczenie można przedłużyć do 14 dni.
- wankomycyna 4 x 125 mg doustnie przez 10 dni
- Alternatywne leczenie (głównie zalecane u chorych z dużym ryzykiem nawrotu CDI)
- fidaksomycyna 2 x 200 mg doustnie przez 10 dni
- Fidaksomycyna jest istotnie lepsza od wankomycyny pod względem częstości nawrotów (ryzyko 19,7% vs 35,5%).33
- Ze względu na wysoką cenę fidaksomycyna jak dotąd znajduje jedynie ograniczone zastosowanie w praktyce.
- Zaleca się nadanie priorytetu pacjentom, u których ryzyko nawrotu choroby jest szczególnie wysokie lub którzy odniosą korzyści z utrzymania mikrobioty jelitowej w trakcie dalszego leczenia, np. osoby po allogenicznym przeszczepie komórek macierzystych.
- Obecnie nie stosuje się rutynowo metronidazolu w monoterapii w leczeniu CDI
- IDSA i SHEA zalecają zrezygnowanie z leczenia metronidazolem, z uwagi na wyższą skuteczność wankomycyny w leczeniu CDI10
- Dopuszcza się zastosowania tego leku u pacjentów z niskim ryzykiem nawrotów i ciężkiego przebiegu CDI, oraz gdy inne leki są niedostępne4
- metronidazol 3 x 500 mg doustnie/dożylnie przez 10 dni
- Należy jednak unikać powtarzania lub przedłużania kursu leczenia metronidazolem ze względu na kumulacyjny i potencjalnie nieodwracalny efekt neurotoksyczności.10
PIORUNUJĄCY przebieg CDI
- (rzekomobłoniaste zapalenie jelit, toksyczne rozdęcie okrężnicy) zaleca się stosowanie terapii skojarzonej z wankomycyną (doustnie lub przez sondę nosowo-żołądkową) i metronidazolem (dożylnie).
- wankomycyna 4 x 500 mg doustnie lub przez sondę
- metronidazol 3 x 500 mg dożylnie4,13
- Jeśli dochodzi do niedrożności przewodu pokarmowego należy rozważyć połączenie leczenia doustnego z wlewkami doodbytniczymi:
- wankomycyna 4 x 500 mg w ~100 ml soli fizjologicznej w postaci lewatywy retencyjnej10
- W przypadku perforacji jelita, koniczene jest leczenie chirurgiczne (subtotalna kolektomia lub wyłonienie stomii jelitowej)
Leczenie nawrotów CDI4
- Czynniki ryzyka nawrotu CDI: podeszły wiek, choroby współistniejące, wyczerpanie immunologiczne, kontynuacja leczenia IPP oraz antybiotyków nieaktywnych wobec CD w trakcie leczenia pierwszego incydentu CDI (np. konieczność leczenia zakażenia układu oddechowego lub moczowego)
- Leczenie podstawowe:
- wankomycyna 4 x 125 mg doustnie przez 10-14 dni, z następczą redukcją dawek
- 2 x 125 mg doustnie przez 7 dni, potem 1 x 125 mg doustnie przez 7 dni, potem 125 mg doustnie co 2-3 dni przez okres 2-8 tygodni
- Alternatywne leczenie:
- fidaksomycyna 2 x 200 mg doustnie przez 10 dni
- Alternatywnie można rozważyć transfer mikrobiomu metodą przeszczepienia kału.
Inne terapie
Leczenie chirurgiczne
- W zapaleniu otrzewnej w wyniku perforacji, ropni lub toksycznego rozdęcia okrężnicy oraz niedrożności jelita (ileus)
- Usunięcie uszkodzonych odcinków jelita (subtotalna kolektomia), w razie potrzeby wytworzenie ileostomii10
Transplantacja mikrobioty jelitowej (przeszczepienie stolca)34-41
- Transplantacja mikrobioty jelitowej (ang. fecal microbiota transplantation- FMT), również znana jako "transfer flory jelitowej," jest najbardziej efektywną terapią nawrotowego zakażenia Clostridioides difficile.
- Założeniem tej terapii jest rekonstrukcja prawidłowej flory jelitowej u osób z jatrogennymi zaburzeniami jakości i ilości tejże flory.4
- Obecnie w badaniu rejestrowym z 2020 roku z udziałem 259 uczestników dotychczas wykazano wyleczenie u 90% osób dotkniętych CDI po miesiącu, zwykle już po jednym zastosowaniu.34
- Transplantację mikrobiomu kałowego w połączeniu z antybiotykoterapią w niektórych przypadkach uznaje się za leczenie z wyboru nawracających zakażeń Clostridioides difficile.
- Warunkiem wstępnym jest intensywne badanie dawcy (wykluczenie patogenów), np. pod kątem HIV, zapalenia wątroby,enteropatogenów, pasożytów kałowych, patogenów wieloopornych.
- Istnieją różne sposoby podania (dwunastnicza, do jelita grubego, doustna w postaci kapsułek).
- Połknięcie preparatów mikrobioty w postaci kapsułek jest równie skuteczne jak aplikacja endoskopowa, ale jest bardziej przyjazna dla pacjenta lub daje możliwość dłuższego przyjmowania.
- Określenie terapeutycznie czynnych składników mikrobioty kałowej jest celem dalszych badań, aby docelowo umożliwić wytwarzanie preparatów rekombinowanych.
Terapia przeciwciałami przeciw toksynom C. difficile
- W jednym z badań wykazano, że prosty wlew przeciwciał monoklonalnych przeciwko toksynie Clostridioides w połączeniu z antybiotykoterapią zmniejsza nawroty choroby z 25% do 7% w ciągu 3 miesięcy.42
- Bezolotoxumab jest przeciwciałem wiążącym toksynę B C. difficile, a actoxumab przeciwciałem wiążącym toksynę A.4
- Bezlotoksumab jest dopuszczony do stosowania w Europie od początku 2017 roku (tylko w skojarzeniu z antybiotykoterapią) w profilaktyce nawracających zakażeń Clostridioides difficile u dorosłych z wysokim ryzykiem nawrotu. 11
- działania niepożądane
- niewydolność serca
- nudności
- gorączka
- bóle głowy
- reakcje na wlew
- działania niepożądane
- Obecnie te leki nie są dostępne w Polsce.
Zapobieganie
- Racjonalna polityka antybiotykowa: Restrykcyjne stosowanie antybiotyków43
- Jedynie uzasadnione stosowanie inhibitorów pompy protonowej13
- Uzupełnianie niedoborów witaminy D4
- Środki higieniczne zapobiegające rozprzestrzenianiu się choroby11
- Mycie rąk wodą i mydłem zmniejsza ryzyko zakażenia (środki dezynfekujące na bazie alkoholu nie pomagają).44-45
- Środki izolacyjne (izolacja w pokoju jednoosobowym/zbiorowym z własną łazienką) dla pacjentów w szpitalu/ośrodku opieki
- przy uzasadnionym podejrzeniu należy wdrożyć postępowanie nawet przed uzyskaniem wyników badań mikrobiologicznych
- ścisła higiena oraz stosowanie rękawiczek i fartuchów ochronnych
- codzienna dezynfekcja przez przecieranie i wycieranie oraz dokładne sprzątanie otoczenia pacjenta
- właściwe czyszczenie wyrobów medycznych i przedmiotów codziennego użytku oraz właściwa utylizacja odpadów
- Obecnie trwają prace nad szczepionką przeciwko C. difficile, oraz nad bioterapeutykami.11
- Rozważa się stosowanie wankomycyny w profilaktyce wtórnej CDI4
Probiotyki
- Istnieją badania, które sugerują, że leczenie probiotykami w połączeniu z antybiotykoterapią może mieć działanie profilaktyczne zarówno w przypadku biegunki związanej z antybiotykami, jak i zakażenia Clostridioides difficile.46-50
- Z kolei w innych badaniach wykazano nie tylko brak korzyści z przyjmowania probiotyków, ale także szkodliwe działanie po ich przyjmowaniu.
- Istnieją np. doniesienia o przypadkach śmierci z powodu fungemii i posocznicy w związku z podaniem Saccharomyces boulardii.44
- Jednakże wytycznych polskich z 2020r. zaleca się stosowanie preparatów Saccharmomyces boulardii w trakcie antybiotykoterapii u hospitalizowanych pacjentów.4
- Zalecenie to oparto na wyniku wieloośrodkowego, prospektywnego badania z grupą porównawczą, które wykazało, że stosowanie S. boulardii w dawce 5 x 109 2 x dziennie zmniejsza częstość (1,5% vs 3,6%) występowania CDI u chorych hospitalizowanych leczonych antybiotykami.51
- Należy przeprowadzić dalsze badania, które pozwolą ustalić dawkę i rodzaj probiotyku oraz ewentualne działania niepożądane, a także umożliwią sformułowanie ogólnych zaleceń dotyczących stosowania.
Przebieg, powikłania i rokowanie
Przebieg
- Od przypadków bezobjawowych do bardzo ciężkiego przebiegu
- Nawracające zakażenia C. difficile (nawroty) występują w 20–30% przypadków.2
- Za potwierdzone czynniki ryzyka nawrotu choroby uznaje się:4
- wiek chorego >65 lat
- choroby współistniejące
- wyczerpanie immunologiczne
- kontynuacja leczenia IPP oraz antybiotyków nieaktywnych wobec CD w trakcie leczenia pierwszego incydentu CDI (np. konieczność leczenia zakażenia układu oddechowego lub moczowego)
- nawrót choroby w wywiadzie
- ryzyko zgonu jest szczególnie wysokie podczas nawrotu choroby
- Ryzyko zgonu w ciągu 180 dni po przebyciu CDI u chorych z nawrotami biegunki jest nawet o 33% wyższe niż u chorych bez nawrotu choroby52
- Za potwierdzone czynniki ryzyka nawrotu choroby uznaje się:4
- Zakażenia C. difficile o rybotypie 027 charakteryzują się zazwyczaj cięższym przebiegiem, niższym odsetkiem wyleczeń i częstszymi nawrotami niż zakażenia bardziej powszechnymi typami bakterii.12
- Powodzenie leczenia definiuje się wyłącznie klinicznie.
- Mikrobiologiczne badania kontrolne po wyzdrowieniu nie są konieczne, ponieważ po odpowiednim leczeniu i ustąpieniu objawów toksyny wykrywa się nawet u 30% pacjentów.
- Nie można na tej podstawie wyciągać żadnych wniosków na temat zakaźności.
- Z pragmatycznego punktu widzenia środki izolacji należy zatem utrzymać przez okres 48 godzin po ustaniu biegunki.
Powikłania
- W 3-4% przypadków choroba ma przebieg piorunujący z wystąpieniem
- toksycznego rozdęcia okrężnicy (megacolon toxicum, ang. toxic megacolon)
- wymaga leczenia zachowawczego lub chirurgicznego z wykonaniem kolektomii4
- niedrożności jelita albo
- perforacji jelita z sepsą
- toksycznego rozdęcia okrężnicy (megacolon toxicum, ang. toxic megacolon)
- Grzybica przewodu pokarmowego o etiologii Candida spp (0,8%)4
- w przebiegu leczenia CDI lub w ciągu 120 dni po terapii
- głównie przy leczeniu metronidazolem
Rokowanie
- Łagodne przypadki często ustępują samoistnie lub dobrze reagują na leczenie.
- Ciężka biegunka związana z Clostridioides difficile jest chorobą potencjalnie zagrażającą życiu.
- Śmiertelność wynosi 1–2%, ale może być znacznie wyższa u starszych pacjentów z chorobami współistniejącymi, zwłaszcza w związku ze zwiększonym występowaniem szczepów hiperwirulentnych.
- Na przykład śmiertelność u starszych pacjentów z osłabieniem ogólnego stanu fizycznego może wynosić nawet 25%.53
- Śmiertelność po upływie 30 dni od kolektomii wynosi według doniesień 24–80%.6
Informacje dla pacjentów
Dieta
- Dieta w zakażeniu Cl. difficile (Wojewódzki Szpital Specjalistyczny w Legnicy)
Przeszczep mikrobioty (flory) jelitowej
- FUNDACJA INSTYTUT PROFILAKTYKI ZAKAŻEŃ- Informacja o tej metodzie leczena (Warszawa)
- Centrum Mikrobioty- Informacja o tej metodzie leczenia (Warszawa, Tychy, Szczecin)
Informacje dla pacjentów w Deximed
Ilustracje

Obraz endoskopowy rzekomobłoniastego zapalenia jelita grubego (dzięki uprzejmości endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
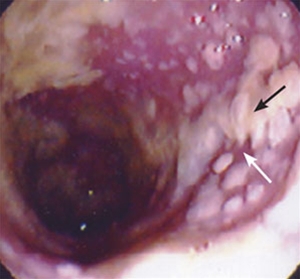
Rzekomobłoniaste zapalenie jelita grubego
Źródła
Wytyczne
- Piekarska A, Panasiuk A, Stępień P. 2020 Postępowanie w zakażeniach Clostridioides (Clostridium) difficile wraz z zasadami transferu mikrobioty jelitowej – rekomendacje Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych. Przegl Epidemiol 2020;74(1):69-87. www.pteilchz.org.pl
- Martirosian G, Hryniewicz W, Ozorowski T, et al. 2018 Zakażenia Clostridioides (Clostridium) difficile: epidemiologia, diagnostyka, terapia, profilaktyka. Narodowy Program Ochrony Antybiotyków. Narodowy Instytut Leków, Warszawa 2018. antybiotyki.edu.pl
- van Prehn J, Reigadas E, Vogelzang EH, et al. 2021 European Society of Clinical Microbiology and Infectious Diseases: 2021 update on the treatment guidance document for Clostridioides difficile infection in adults. Clin Microbiol Infect. 2021;27 Suppl 2:S1-S21. doi:10.1016/j.cmi.2021.09.038 PubMed
- Tschudin-Sutter S, Kuijper EJ, Durovic A, et al. ESCMID 2018 Guidance document for prevention of Clostridium difficile infection in acute healthcare settings. Clin Microbiol Infect. 2018;24(10):1051-1054. doi:10.1016/j.cmi.2018.02.020 PubMed
- McDonald LC, Gerding DN, Johnson S, et al. 2017 Clinical Practice Guidelines for Clostridium difficile Infection in Adults and Children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis. 2018;66(7):e1-e48. doi:10.1093/cid/cix1085 po angielsku PubMed, podsumowanie po polsku mp.pl
Piśmiennictwo
- Schroeder MS. Clostridium difficile - associated diarrhea. Am Fam Physician 2005; 71: 921-8. PubMed
- Starr J. Clostridium difficile associated diarrhoea: diagnosis and treatment. BMJ 2005; 331: 498-501. www.ncbi.nlm.nih.gov
- Lawson PA, Citron DM, Tyrrell KL, Finegold SM. Reclassification of Clostridium difficile as Clostridioides difficile (Hall and O'Toole 1935) Prévot 1938. Anaerobe. 2016;40:95-99. doi:10.1016/j.anaerobe.2016.06.008 pubmed.ncbi.nlm.nih.gov
- Piekarska A, Panasiuk A, Stępień P. Postępowanie w zakażeniach Clostridioides (Clostridium) difficile wraz z zasadami transferu mikrobioty jelitowej – rekomendacje Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych. Przegl Epidemiol 2020;74(1):69-87. www.pteilchz.org.pl
- Khanna S, Pardi DS, Aronson SL, et al. The epidemiology of community-acquired Clostridium difficile infection: a population-based study. Am J Gastroenterol 2012; 107: 89-95. PubMed
- Lübbert C, John E, von Müller L: Clostridium difficile infection— guideline-based diagnosis and treatment. Dtsch Arztebl Int 2014; 111: 723–31. www.aerzteblatt.de
- Surawicz CM, Brandt LJ, Binion DG, et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. Am J Gastroenterol. 2013;108:478-498. PubMed
- Narodowy Instytut Zdrowia Publicznego - Państwowy Zakład Higieny, Państwowy Instytut Badawczy. (2023). Choroby zakaźne i zatrucia w Polsce w 2022 roku. wwwold.pzh.gov.pl
- Winslow BT, Onysko M, Thaompson KA, et al. Common questions about Clostridium difficile infection. Am Fam Physician. 2014 Mar 15;89(6):437-442. PubMed
- Dallal RM, Harbrecht BG, Boujoukas AJ, Sirio CA, Farkas LM, Lee KK, et al. Fulminant Clostridium difficile: an underappreciated and increasing cause of death and complications. Ann Surg 2002; 235: 363-72. PubMed
- Martirosian G, Hryniewicz W, Ozorowski T, et al. 2018 Zakażenia Clostridioides (Clostridium) difficile: epidemiologia, diagnostyka, terapia, profilaktyka. Narodowy Program Ochrony Antybiotyków. Narodowy Instytut Leków, Warszawa 2018. antybiotyki.edu.pl
- Petrella LA, Sambol SP, Cheknis A, et al. Decreased cure and increased recurrence rates for Clostridium difficile infection caused by the epidemic c. difficile BI strain. Clin Infect Dis 2012; 55: 351-7. PubMed
- Jachowicz E, Pobiega M, Wójkowska-Mach J. Zakażenia Clostridium difficile - narastający problem. Przegląd Lekarski 2018; 75(12): 598-601. doi:ISSN 0033-2240
- Pituch H, Obuch-Woszczatyński P, Lachowicz D, et al. Hospital-based Clostridium difficile infection surveillance reveals high proportions of PCR ribotypes 027 and 176 in different areas of Poland, 2011 to 2013. Euro Surveill. 2015;20(38):10.2807/1560-7917.ES.2015.20.38.30025. doi:10.2807/1560-7917.ES.2015.20.38.30025 pubmed.ncbi.nlm.nih.gov
- Aptekorz M, Szczegielniak A, Wiechuła B, Harmanus C, Kuijper E, Martirosian G. Occurrence of Clostridium difficile ribotype 027 in hospitals of Silesia, Poland. Anaerobe. 2017;45:106-113. doi:10.1016/j.anaerobe.2017.02.002 pubmed.ncbi.nlm.nih.gov
- Hensgens MP, Goorhuis A, Dekkers OM, Kuijper EJ. Time interval of increased risk for Clostridium difficile infection after exposure to antibiotics. J Antimicrob Chemother 2012; 67: 742-8. PubMed
- Deshpande A, Pasupuleti V, Thota P, et al. Community-associated Clostridium difficile infection and antibiotics: a meta-analysis. J Antimicrob Chemother 2013; 68(9): 1951-1961. pmid: 23620467 PubMed
- Brown KA, Khanafer N, Daneman N, Fisman DN. Antibiotics and the risk of community-associated Clostridium difficile infection (CDI): a meta-analysis. Antimicrob Agents Chemother 2013. doi:10.1128/AAC.02176-12 DOI
- Stevens V, Dumyati G, Fine LS, et al. Cumulative antibiotic exposures over time and the risk of clostridium difficile infection. Clin Infect Dis 2011; 53: 42-8. PubMed
- Zacharioudakis IM, Zervou FN, Pliakos EE, et al. Colonization with toxinogenic C. difficile upon hospital admission, and risk of infection: A systematic review and meta-analysis. Am J Gastroenterol 2015 Mar; 110:381. PMID: 25732416 PubMed
- Miller M, Gravel D, Mulvey M, et al. Health care-associated Clostridium difficile infection in Canada: patient age and infecting strain type are highly predictive of severe outcome and mortality. Clin Infect Dis. 2010;50(2):194–201. www.ncbi.nlm.nih.gov
- Kwok CS, Arthur AK, Anibueze CI, et al. Risk of Clostridium difficile infection with acid suppressing drugs and antibiotics: Meta-analysis. Am J Gastroenterol 2012; doi: 10.1038/ajg.2012.108. DOI
- Maes ML, Fixen DR, Linnebur SA. Adverse effects of proton-pump inhibitor use in older adults: a review of the evidence. Ther Adv Drug Saf. 2017;8(9):273-297. doi:10.1177/2042098617715381 pubmed.ncbi.nlm.nih.gov
- Linsky A, Gupta K, Lawler EV, Fonda JR, Hermos JA. Proton pump inhibitors and risk for recurrent Clostridium difficile infection. Arch Intern Med 2010; 170: 772-8. PubMed
- Howell MD, Novack V, Grgurich P. Iatrogenic gastric acid suppression and the risk of nosocomial clostridium difficile infection. Arch Intern Med 2010; 170: 784-90. PubMed
- Im GY, Modayil RJ, Lin CT, et al. The appendix may protect against Clostridium difficile recurrence. Clin Gastroenterol Hepatol 2011; 9: 1072-7. PubMed
- Miller MA, Louie T, Mullane K, et al. Derivation and validation of a simple clinical bedside score (ATLAS) for Clostridium difficile infection which predicts response to therapy. BMC Infect Dis. 2013;13:148. Published 2013 Mar 25. doi:10.1186/1471-2334-13-148 pubmed.ncbi.nlm.nih.gov
- Chia J-H, Wu T-S, Wu T-S, et al. Clostridium innocuum is a vancomycin-resistant pathogen that may cause antibiotic-associated diarrhea. Clin Microbiol Infect 2018 Feb 17; pii: S1198-743X(18)30188-5: Epub ahead of print. pmid:29458157 PubMed
- Wanahita A, Goldsmith EA, Marino BJ, Musher DM. Clostridium difficile infection in patients with unexplained leukocytosis. Am J Med. 2003;115(7):543–546. www.ncbi.nlm.nih.gov
- O`Horo JC, Jones A, Sternke M, et al. Molecular Techniques for Diagnosis of Clostridium difficile Infection: Systematic Review and Meta-analysis. . Mayo Clin Proc 2012; 87: 643-51. PubMed
- Ash L, Baker ME, O'Malley CM Jr et al.: Colonic abnormalities on CT in adult hospitalized patients with Clostridium difficile colitis: prevalence and significance of findings. American Journal of Radiology 2006; 186: 1393–400. www.ncbi.nlm.nih.gov
- Wenisch JM, Schmid D, Kuo HW, et al. Prospective observational study comparing three different treatment regimes in patients with Clostridium difficile infection. Antimicrob Agents Chemother 2012; 56: 1974-8. PubMed
- Cornely OA, Crook DW, Esposito R, et al. Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada, and the USA: a double-blind, non-inferiority, randomised controlled trial. Lancet Infect Dis. 2012;12(4):281-289. doi:10.1016/S1473-3099(11)70374-7 pubmed.ncbi.nlm.nih.gov
- Kelly CR, Yen EF, Grinspan AM, et al. Fecal Microbiota Transplant is Highly Effective in Real-World Practice: Initial Results from the FMT National Registry. Gastroenerology 2020. doi:10.1053/j.gastro.2020.09.038. www.gastrojournal.org
- Drekonja D, Reich J, Gezahegn S, et al. Fecal microbiotica transplantation for Clostridium difficile infection: A systematic review. Ann Intern Med 2015; 162: 630-8. doi:10.7326/M14-2693 DOI
- Kleger A, Schnell J, Essig A, Case report: Fecal transplant in refractory clostridium difficile colitis. Dtsch Arztebl Int 2013; 110(7): 108–15. www.aerzteblatt.de
- Cammarota G, Ianiro G, Gasbarrini A. Fecal microbiota transplantation for the treatment of Clostridium difficile infection: a systematic review. J Clin Gastroenterol. 2014 ;48:693-702. doi: 10.1097/MCG.0000000000000046. journals.lww.com
- Lee CH, Steiner T, Petrof EO, et al. Frozen vs Fresh Fecal Microbiota Transplantation and clinical resolution of diarrhea in patients with recurrent clostridium difficile infection: A randomized clinical trial. JAMA 315; 142-9: 10.1001/jama.2015.18098. doi:10.1001/jama.2015.18098 DOI
- Kao D, Roach B, Solva M, et al. Effect of Oral Capsule– vs Colonoscopy-Delivered Fecal Microbiota Transplantation on Recurrent Clostridium difficile Infection A Randomized Clinical Trial. JAMA 2017 Nov 28; 318(20): 1985-1993. pmid:29183074 PubMed
- van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent clostridium difficile. N Engl J Med 2013; 368:407-15. PubMed
- Butler M, Olson A, Drekonja D, et al. Early Diagnosis, Prevention, and Treatment of Clostridium difficile: Update Internet. Rockville (MD): Agency for Healthcare Research and Quality (US); 2016 Mar. (Comparative Effectiveness Reviews, No. 172.) Available from: http://www.ncbi.nlm.nih.gov/books/NBK361173/ www.ncbi.nlm.nih.gov
- Lowy I, Molrine DC, Leav BA, et al. Treatment with monclonal antibodies against Clostridium difficile toxins. N Engl J Med 2010; 362: 197-205. New England Journal of Medicine
- Carling P, Fung T, Killion A, Terrin N, Barza M. Favorable impact of a multidisciplinary antibiotic management program conducted during 7 years. Infect Control Hosp Epidemiol 2003; 24: 699-706. PubMed
- Stone SP, Fuller C, Savage J, et al. Evaluation of the national Cleanyourhands campaign to reduce Staphylococcus aureus bacteraemia and Clostridium difficile infection in hospitals in England and Wales by improved hand hygiene: four year, prospective, ecological, interrupted time series study. BMJ 2012; 344: e3005. BMJ (DOI)
- Oughton MT, Loo VG, Dendukuri N, et al. Hand hygiene with soap and water is superior to alcohol rub and antiseptic wipes for removal of Clostridium difficile. Infect Control Hosp Epidemiol 2009; 30: 939-44. PubMed
- Gao XW, Mubasher M, Fang CY, Reifer C, Miller LE. Dose-response efficacy of a proprietary probiotic formula of Lactobacillus acidophilus CL1285 and Lactobacillus casei LBC80R for antibiotic-associated diarrhea and Clostridium difficile-associated diarrhea prophylaxis in adult patients. Am J Gastroenterol 2010; 105: 1636. PubMed
- Allen SJ, Wareham K, Wang D, et al. Lactobacilli and bifidobacteria in the prevention of antibiotic-associated diarrhoea and Clostridium difficile diarrhoea in older inpatients (PLACIDE): a randomised, double-blind, placebo-controlled, multicentre trial. Lancet 2013. doi: 10.1016/S0140-6736(13)61218-0 DOI
- Johnston BC, Goldenberg JZ, Vandvik PO, et al. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database of Systematic Reviews 2011; 11: CD004827. pubmed.ncbi.nlm.nih.gov
- Goldenberg JZ, Ma SSY, Saxton JD, et al. Probiotics for the prevention of Clostridium difficile-associated diarrhea in adults and children. Cochrane Database of Systematic Reviews 2013, Issue 5. Art. No.: CD006095. pubmed.ncbi.nlm.nih.gov
- Kujawa-Szewieczek A, Adamczak M, Kwiecień K, Dudzicz S, Gazda M, Więcek A. The Effect of Lactobacillus plantarum 299v on the Incidence of Clostridium difficile Infection in High Risk Patients Treated with Antibiotics. Nutrients. 2015;7(12):10179-10188. Published 2015 Dec 4. doi:10.3390/nu7125526 pubmed.ncbi.nlm.nih.gov
- Carstensen JW, Chehri M, Schønning K, et al. Use of prophylactic Saccharomyces boulardii to prevent Clostridium difficile infection in hospitalized patients: a controlled prospective intervention study. Eur J Clin Microbiol Infect Dis. 2018;37(8):1431-1439. doi:10.1007/s10096-018-3267-x pubmed.ncbi.nlm.nih.gov
- Olsen MA, Yan Y, Reske KA, Zilberberg MD, Dubberke ER. Recurrent Clostridium difficile infection is associated with increased mortality. Clin Microbiol Infect. 2015;21(2):164-170. doi:10.1016/j.cmi.2014.08.017 pubmed.ncbi.nlm.nih.gov
- Pepin J, Valiquette L, Alary ME, Villemure P, Pelletier A, Forget K, et al. Clostridium difficile-associated diarrhea in a region of Quebec from 1991 to 2003: a changing pattern of disease severity. CMAJ 2004; 171: 466-72. pubmed.ncbi.nlm.nih.gov
Autorzy
- Małgorzata Marczewska, lekarz, specjalista chorób wewnętrznych
- Kristine Scheibel, dr n. med., specjalista medycyny ogólnej, Norderney