Informacje ogólne
Definicja
- Wrzodziejące zapalenie jelita grubego (WZJG, colitis ulcerosa) oraz choroba Leśniowskiego–Crohna (ChLC) to dwie główne postaci nieswoistego zapalenia jelit (NZJ, inflammatory bowel disease – IBD).1 Trzecia postać to zapalenie niezdefiniowane.2
- W przeciwieństwie do ChLC, która może dotyczyć każdego odcinka przewodu pokarmowego od odbytu do jamy ustnej, proces chorobowy w WZJG obejmuje błonę śluzową odbytnicy i okrężnicy (niekiedy dalszy odcinek jelita krętego).3-4
- WZJG najczęściej przebiega w postaci ostrych rzutów i remisji.
- Leczenie oraz monitorowanie w kierunku chorób nowotworowych zależy od rozprzestrzenienia i aktywności choroby, a także ewentualnego współwystępowania pierwotnego stwardniającego zapalenia dróg żółciowych (primary sclerosing cholangitis – PSC).
- Bardzo silny związek wrzodziejącego zapalenia jelita grubego (WZJG) i PSC.
Klasyfikacja
- Klasyfikacja endoskopowa z uwzględnieniem rozprzestrzenienia (klasyfikacja montrealska)5:
- Zapalenie odbytnicy (proctitis): zajęcie wyłącznie odbytnicy (40–50%).
- Lewostronne zapalenie jelita grubego (left–sided colitis): rozprzestrzenienie choroby do lewego zgięcia okrężnicy (30–40%).
- Rozległe zapalenie jelita grubego (pancolitis): zapalenie jelita cienkiego i grubego, choroba rozprzestrzenia się poza lewe zgięcie okrężnicy (20%).
- Klasyfikacja endoskopowa z uwzględnieniem aktywności zapalnej (skala Mayo):6
- postać łagodna: zaczerwienienie błony śluzowej, skłonność do drobnych krwawień
- postać umiarkowana: nadżerki, wyraźnie wrażliwe na zranienie przy kontakcie
- postać ciężka: owrzodzenia, samoistne krwotoki.
Epidemiologia
- Zachorowalność na NZJ rośnie.2
- W 2020 roku w Polsce było 73 235 pacjentów z rozpoznanym WZJG.7
- Zapadalność:
- Współczynnik chorobowości:
- 150–250 przypadków na 100 000 osób.
- Dane polskie z 2020 roku: 191,4 przypadku na 100 000 osób.7
- Wiek:
Etiologia i patogeneza
- Obecne rozumienie patogenezy choroby zakłada, że u osób podatnych genetycznie, pod wpływem czynników środowiskowych, dochodzi do rozwoju przewlekłego NZJ z aktywacją układu immunologicznego błony śluzowej jelita.
- Koncepcja patogenetyczna odeszła od teorii klasycznej choroby autoimmunologicznej na rzecz złożonego zaburzenia funkcji barierowych.
- Jeśli bariera jelitowa zostanie uszkodzona, bakterie przedostają się do błony śluzowej jelita, czego następstwem jest reakcja zapalna.8
Czynniki genetyczne
- U krewnych pierwszego stopnia pacjentów z WZJG ryzyko wystąpienia tej choroby jest od 10 do 15 razy wyższe – ryzyko bezwzględne wynosi około 5%.
- Potwierdzono wpływ wielu genów.9
Inne czynniki
- NLPZ:
- Mogą prowadzić do wystąpienia lub nasilenia choroby.9-10
- Palenie papierosów:
- Ryzyko zachorowania na WZJG u palaczy jest o 42% niższe.11
- Palenie papierosów jednak zwiększa ryzyko wystąpienia choroby Leśniowskiego–Crohna (ChLC).12
- Karmienie piersią:
- Karmienie piersią przez co najmniej 6 miesięcy znacząco zmniejsza ryzyko rozwoju WZJG u dziecka w późniejszym okresie życia.13
- Zapalenie wyrostka robaczkowego:
- Mikrobiom:
- Zmieniony skład mikrobiomu może prowadzić do zaburzeń interakcji pomiędzy układem odpornościowym błony śluzowej jelita a mikrobiomem, skutkując uszkodzeniem funkcji barierowej jelita.8
- Zapalenie żołądka i jelit (gastroenteritis):
- Do 50% nawrotów występuje w przebiegu zapalenia żołądka i jelit potwierdzonymi patogenami jelitowymi.15
Patogeneza
- Wykazano, że w procesie zapalnym uczestniczy szereg cytokin.
- Naruszona równowaga między cytokinami pro– i przeciwzapalnymi.
- Obecne terapie nadal wpływają przede wszystkim na odpowiedź efektorową układu odpornościowego (np. przeciwciała TNF–alfa).
- Obecnie nie ma leczenia przyczynowego.
ICD–10
- K51 Wrzodziejące zapalenie jelita grubego.
- K51.0 Wrzodziejące (przewlekłe) zapalenie jelita cienkiego i grubego.
- K51.1 Wrzodziejące (przewlekłe) zapalenie jelita krętego i grubego.
- K51.2 Wrzodziejące (przewlekłe) zapalenie prostnicy.
- K51.3 Wrzodziejące (przewlekłe) zapalenie prostnicy i esicy.
- K51.8 Inne postacie wrzodziejącego zapalenia jelita grubego.
- K51.9 Wrzodziejące zapalenie jelita grubego, nieokreślone.
Diagnostyka
Kryteria diagnostyczne
- Rozpoznanie WZJG opiera się na wykazaniu charakterystycznych wyników badań klinicznych, laboratoryjnych, endoskopowych, radiologicznych i histopatologicznych.
- Nie istnieje złoty standard rozpoznania.
- Klasyczny wywiad lekarski ze stwierdzeniem biegunki i domieszki krwi w kale.
- Pełne badanie fizykalne, w tym badanie jamy ustnej i okolic odbytu.
- Typowe wyniki badań ultrasonograficznych i endoskopowych z badaniem histologicznym.
- Pomocne, ale mniej istotne, są inne badania dodatkowe (badania laboratoryjne, przede wszystkim kalprotektyna w kale).
Diagnostyka różnicowa
- Zespół jelita drażliwego (irritable bowel syndrome – IBS).
- Choroba Leśniowskiego–Crohna (ChLC)
- Uwaga: wsteczne zapalenie jelita krętego (backwash ileitis) – w WZJG jest to zapalenie końcowego odcinka jelita krętego!
- Prawdopodobną przyczyną zapalenia końcowego odcinka jelita krętego jest cofanie się kału przez zastawkę krętniczo–kątniczą.
- Utrudniona diagnostyka różnicowa ChLC i WZJG.
- Uwaga: wsteczne zapalenie jelita krętego (backwash ileitis) – w WZJG jest to zapalenie końcowego odcinka jelita krętego!
- Zakaźne choroby biegunkowe.
- Zapalenie jelita grubego wywołane przez Clostrioides difficile.
- Niedokrwienne zapalenie jelita grubego.
- Choroby nowotworowe.
Wywiad lekarski
- Wywiad lekarski:
- Charakter i początek objawów.
- Niedawna podróż w wywiadzie.
- Nietolerancje pokarmowe.
- Narażenie na kontakt z zakaźnymi chorobami biegunkowymi.
- Niemal połowa chorych wymaga leczenia immunosupresyjnego, dlatego zaleca się uzyskanie informacji o statusie immunizacji i w razie potrzeby uzupełnienie szczepień.
- Wywiad lekarski dotyczący palenia tytoniu.
- Wywiad rodzinny.
- Wywiad dotyczący przyjmowania leków.
- Szczególnie w odniesieniu do antybiotyków i niesteroidowych leków przeciwzapalnych (NLPZ).
- Pytania dotyczące objawów pozajelitowych.
- Jama ustna, skóra, oczy, stawy, ropnie okołoodbytnicze, przetoki i szczeliny odbytu.
- Status szczepień.
- Obraz kliniczny jest bardzo zróżnicowany i nie jest charakterystyczny.
- Wiodącymi objawami są:2,16
- biegunka z domieszką krwi i śluzu
- ból
- stany podgorączkowe lub gorączka
- chudnięcie
- pogorszenie wydolności fizycznej
- bolesne parcie na stolec
- ból okolicy odbytu
- nietrzymanie stolca
- nagła potrzeba wypróżnienia.
- Nasilenie objawów tylko w niewielkim stopniu koreluje z rozległością zapalenia jelita grubego.
- Zapalenie odbytnicy (proctitis) może powodować bardzo ciężkie objawy, natomiast rozległe zapalenie jelita grubego może wywoływać jedynie łagodne objawy.
Objawy pozajelitowe
- U 1/4 do 1/3 pacjentów m.in.17-18:
- Bóle stawów2
- artropatie obwodowe typu 1 (dotyczy dużych stawów obwodowych) i 2 (dotyczy głównie wielu małych stawów)
- typ 1 występuje u 4–23% chorych z NZJ2
- artropatie osiowe (spondyloartropatie oraz ZZSK).
- artropatie obwodowe typu 1 (dotyczy dużych stawów obwodowych) i 2 (dotyczy głównie wielu małych stawów)
- Zmiany skórne: rumień guzowaty (erythema nodosum), piodermia zgorzelinowa (pyoderma gangraenosum)
- Oko: zapalenie błony naczyniowej (uveitis), zapalenie tęczówki (iritis), zapalenie nadtwardówki (episcleritis).
- Pierwotne stwardniające zapalenie dróg żółciowych (primary sclerosing cholangitis – PSC)
- Przewlekła, postępująca, cholestatyczna choroba wątroby, cechująca się zapaleniem i włóknieniem wewnątrz– i zewnątrzwątrobowych dróg żółciowych, prowadzących do ich wieloogniskowych zwężeń i ostatecznie do marskości wątroby.2
- Występuje lub wystąpi u 2,5–7,5% chorych na NZJ.2
- Objawem PSC może być wzrost aktywności ALP i GGTP.
- Bóle stawów2
- Ponadto wtórne powikłania, takie jak niedobór żelaza z powodu upośledzonego wchłaniania lub osteoporoza z powodu długotrwałej terapii steroidowej.17
Badanie fizykalne
- Badanie fizykalne:
- Pełne badanie fizykalne, w tym badanie jamy ustnej i okolic odbytu.
- Badanie per rectum, najpóźniej w ramach kolonoskopii.
- W przypadku dzieci i młodzieży należy dodatkowo dokumentować zmiany masy ciała i wzrostu oraz fazę dojrzewania.
- Faza remisji:
- Zazwyczaj brak istotnych zmian.
- Ostry rzut:
- ocena ogólnego stanu fizycznego
- ciśnienie tętnicze, temperatura, tętno i stan odżywienia
- objawy uogólnionego zapalenia
- badanie jamy brzusznej
- niesłyszalna perystaltyka (niedrożność porażenna jelit)
- obrona mięśniowa
- objawy zapalenia otrzewnej.
- ocena ogólnego stanu fizycznego
Badania uzupełniające w gabinecie lekarza rodzinnego
- Badania laboratoryjne:
- Wskaźniki stanu zapalnego (CRP, leukocyty), żelazo, czynność nerek, transaminazy i parametry cholestazy (te ostatnie w kierunku PSC).
- USG jamy brzusznej:
- USG jamy brzusznej powinno być częścią diagnostyki wstępnej oraz diagnostyki kontrolnej przebiegu choroby; badanie należy też wykonywać w ciężkich ostrych rzutach w celu wykrycia powikłań.
- Np. zwężenia, ropnie, przetoki.
- Ewentualnie uwidocznienie pogrubionych ścian jelita (objaw zapalenia).
- Ogólny obraz rozprzestrzenienia choroby.
- USG jamy brzusznej powinno być częścią diagnostyki wstępnej oraz diagnostyki kontrolnej przebiegu choroby; badanie należy też wykonywać w ciężkich ostrych rzutach w celu wykrycia powikłań.
Diagnostyka specjalistyczna
Badania laboratoryjne
- Diagnostyczne badanie mikrobiologiczne stolca w kierunku bakteryjnych patogenów zakaźnych, w tym toksyny Clostrioides difficile.
- W ciężkich rzutach i przy niezadowalającej odpowiedzi na leczenie lub przed intensyfikacją leczenia immunosupresyjnego, badania w kierunku cytomegalii (CMV).
- Wykrywanie CMV metodą immunohistochemiczną z próbek uzyskanych endoskopowo i/lub metodami biologii molekularnej z próbek tkanek lub z krwi.
- Oznaczenie markerów neutrofili w stolcu (np. kalprotektyna) w celu rozróżnienia dolegliwości (czynnościowych) w zespole jelita drażliwego.
- Oznaczenie kalprotektyny służy również do monitorowania przebiegu choroby.
- Kalprotektyna w stolcu – poziom podwyższony w nieswoistym zapaleniu jelit.
- U dorosłych czułość i swoistość wynoszą odpowiednio 93% i 96%, u dzieci swoistość jest niższa (76%).19
- W podejrzeniu nieswoistego zapalenia jelit badania przesiewowe kalprotektyny w stolcu mogą ograniczyć ilość niezbędnych badań endoskopowych o 67%.19
- Badanie efektywne kosztowo zarówno u dorosłych, jak i u dzieci.20
- Poziomy poniżej 50 mcg/g wykazują negatywną wartość predykcyjną (96%) w odniesieniu do nieswoistego zapalenia jelit.21
- Zwiększone ryzyko niedożywienia i niedoborów mikroelementów.
- Zaleca się wstępne badanie pod kątem niedoborów mikroelementów:
- żelaza, witaminy D, kwasu foliowego, cynku, selenu.
- Zaleca się wstępne badanie pod kątem niedoborów mikroelementów:
Endoskopia
- Ileokolonoskopia z biopsjami (co najmniej 2 biopsje na segment) z końcowego odcinka jelita krętego i wszystkich segmentów okrężnicy, w tym odbytnicy.
- W razie wątpliwości co do rozpoznania należy powtórzyć endoskopię z pobraniem materiału do badania histopatologicznego po upływie określonego czasu (np. po 3–6 miesiącach).
- Przy zapaleniu jelita grubego, którego nie można jednoznacznie sklasyfikować, należy przeprowadzić diagnostykę górnego odcinka przewodu pokarmowego za pomocą gastroduodenoskopii (z biopsjami) oraz środkowego odcinka przewodu pokarmowego za pomocą rezonansu magnetycznego (RM) jelita cienkiego i/lub ultrasonografii (USG) jamy brzusznej.
- Diagnostyka różnicowa choroby Leśniowskiego–Crohna, która również dotyczy górnego odcinka przewodu pokarmowego i jelita cienkiego.
Histopatologia
- Typowe wyniki badania histologicznego:
- Rozlane przewlekłe zapalenie całej błony śluzowej (limfocyty i komórki plazmatyczne) w połączeniu z zaburzeniami architektury krypt/atrofią krypt.
- Zwiększona liczba plazmocytów w blaszce właściwej błony śluzowej.
- Metaplazja komórek Panetha dystalnie do prawego zgięcia okrężnicy.
- Zmniejszenie liczby komórek kubkowych lub zawartości mucyny w pojedynczych komórkach.
- Ciągłe rozmieszczenie zmian zapalnych i strukturalnych błony śluzowej, gradient malejący od strony dystalnej do proksymalnej.
- Ocena histopatologiczna jest często utrudniona.
- W 1/3 przypadków nie jest możliwe jednoznaczne odróżnienie wrzodziejącego zapalenia jelita grubego od choroby Leśniowskiego–Crohna, zwłaszcza we wczesnych stadiach.22
Wskazania do wystawienia skierowania/hospitalizacji
- Skierowanie na endoskopię w przypadku klinicznego podejrzenia WZJG.
- Pacjenci z WZJG powinni być leczeni przez gastroenterologa współpracującego z lekarzem rodzinnym.
- Przyjęcie do szpitala w przypadku wystąpienia objawów ciężkiego/piorunującego uogólnionego zapalenia jelita grubego (gorączka) i/lub z wyraźnie niedostateczną podażą płynów lub niedokrwistością z powodu częstych wypróżnień.
Lista kontrolna dotycząca skierowania
Wrzodziejące zapalenie jelita grubego
- Cel skierowania
- Potwierdzenie rozpoznania? Leczenie? Inne?
- Wywiad lekarski
- Początek i czas trwania? Przebieg? Czy postawiono diagnozę już wcześniej: kiedy, na jakiej podstawie?
- Objawy? Biegunka: liczba wypróżnień w ciągu dnia? Krwawienia z jelit? Ból? Objawy nocne? Czy mogą występować powikłania? Ogólne objawy? Apetyt? Utrata masy ciała? Dolegliwości pozajelitowe?
- Obecnie w trakcie leczenia: leki? Efekty/powodzenie leczenia?
- Choroba wpływa negatywnie na: odżywianie? Jakość życia? Zdolność do pracy? Wzrost (u dzieci)?
- Badanie fizykalne
- Ogólny stan fizyczny pacjenta? Stan odżywienia? Gorączka?
- Stan jamy brzusznej?
- Odchylenia w badaniu innych układów niż przewód pokarmowy?
- U dzieci: rozwój fizyczny, wzrost, siatka centylowa.
- Badania uzupełniające
- Hb, OB, CRP, leukocyty, parametry wątrobowe, kalprotektyna w stolcu, albuminy, krew w stolcu?
- Autoprzeciwciała przeciwko okołojądrowemu antygenowi granulocytów (perinuclear antineutrophil cytoplasmic antibodies – pANCA) – obecne u około 60% chorych, mogą mieć znaczenie w różnicowaniu z ChLC.
- Badanie bakteriologiczne stolca (badanie w kierunku C. difficile).
- Ewentualnie wyniki badań dodatkowych: endoskopia, USG, RM.
Leczenie
Cele leczenia
- Szybkie osiągnięcie i podtrzymanie remisji klinicznej bez stosowania steroidów.
Ogólne informacje o leczeniu
- Wybór leczenia zależy od stopnia zaawansowania i rozprzestrzenienia choroby.16,23
- Terapia dostosowana indywidualnie do pacjenta.
- Łagodne przypadki mogą być leczone przez lekarza rodzinnego.
- Cięższe przypadki leczą gastroenterolodzy.
- Należy rozważyć opcje i ryzyko farmakoterapii w stosunku do leczenia chirurgicznego.
- Opcją terapii jest proktokolektomia, ale mogą wystąpić powikłania pooperacyjne i mogą utrzymywać się objawy pozajelitowe choroby.
- Nie ma szczególnej diety ani terapii żywieniowej w celu wywołania lub utrzymania remisji.
- Leczenie bólu paracetamolem lub metamizolem.
- NLPZ i opioidy są względnie przeciwwskazane ze względu na działanie uszkadzające błonę śluzową oraz zaburzanie motoryki.24
Farmakoterapia
Leczenie łagodnej lub umiarkowanie aktywnej postaci zapalenia odbytnicy (proctitis ulcerosa)
- Mesalazyna ≥1000 mg dziennie w postaci czopka.2
- Mesalazyna we wlewach doodbytniczych (lewatywa) jest równoważną opcją terapeutyczną.
- W przypadku niepowodzenia monoterapii stosowanie mesalazyny doodbytniczej należy połączyć ze steroidami stosowanymi miejscowo lub mesalazyną w preparatach doustnych o przedłużonym uwalnianiu:
- Np. 2 g pianki doodbytniczej zawierającej budezonid (steroid miejscowy) lub 3–4 g mesalazyny doustnie 1 x dziennie.2
- Czas trwania terapii:
- Zwykle 2–4 tygodnie, czasem 6 lub więcej tygodni.
- Do chwili odpowiedzi na leczenie może minąć do 3–4 tygodni.
- Doustne preparaty kwasu 5–aminosalicylowego (5–ASA, 5–aminosalicylic acid): mesalazyna, sulfasalazyna, olsalazyna (niedostępna w Polsce).
- Biorąc pod uwagę profil reakcji niepożądanych przy porównywalnej skuteczności, mesalazyna powinna mieć pierwszeństwo przed sulfasalazyną.
- Rzadka, ale ciężka reakcja niepożądana: uszkodzenie nerek.
Leczenie lewostronnego zapalenia jelita grubego (left–sided colitis)
- Mesalazyna doodbytniczo w postaci lewatyw (wlewki doodbytnicze) lub pianki (≥1 g dziennie) w połączeniu z mesalazyną w preparatach doustnych o przedłużonym uwalnianiu (≥3 g dziennie).2
- Powinna być preferowana w stosunku do miejscowej steroidoterapii.
- W przypadku niewystarczającej odpowiedzi lub nietolerancji na preparaty uwalniające 5–ASA należy zastosować budezonid MMX 9 mg dziennie przez 8 tygodni.2
- Ogólnoustrojowa terapia sterydowa (0,5–1 mg/kg m.c. dziennie równoważnej dawki prednizolonu), jeśli objawy kliniczne ulegną nasileniu podczas wyżej wymienionej terapii lub jeśli krwawienie utrzymuje się ponad 14 dni.
Leczenie łagodnej do umiarkowanie ciężkiej postaci wrzodziejącego zapalenia jelita grubego z zajęciem jelita cienkiego i grubego (pancolitis)
- Mesalazyna w preparatach doustnych o przedłużonym uwalnianiu w dawce ≥3 g dziennie w połączeniu z mesalazyną w postaci lewatyw lub pianek.
- W przypadku niewystarczającej odpowiedzi lub nietolerancji na preparaty uwalniające 5–ASA należy zastosować budezonid MMX w dawce 9 mg dziennie.2
- W przypadku braku odpowiedzi na powyższą terapię lub ciężkiej postaci choroby w momencie rozpoznania należy rozpocząć ogólnoustrojową terapię sterydową (0,5–1 mg/kg m.c. dziennie równoważnej dawki prednizolonu).
Leczenie ciężkiego zapalenia jelita grubego25-26
- Kryteria ciężkiego rzutu w zaostrzeniu WZJG wg Truelove'a i Wittsa:27
- ciężka biegunka ≥6 wypróżnień na dobę, z domieszką krwi
- gorączka utrzymująca się przez co najmniej 2 z 4 dni
- tachykardia i anemia
- OB >30 mm/h.
- Pacjenci z ciężkim ostrym rzutem powinni być leczeni w szpitalu.
- Leczenie powinno być prowadzone w ścisłej współpracy z zespołem interdyscyplinarnym, w tym z doświadczonymi chirurgami specjalizującymi się w chirurgii jamy brzusznej.
- Ogólnoustrojowa terapia sterydowa (1 mg/kg m.c. równoważnej dawki prednizolonu dziennie):
- Czas trwania terapii co najmniej 3 tygodnie.
- W przypadku niewystarczającej odpowiedzi na steroidy ogólnoustrojowe (steroidooporność) lub w przypadku przeciwwskazań lub nietolerancji:
- Przeciwciała anty–TNF
- W przypadku infliksimabu najlepiej stosować terapię skojarzoną z tiopuryną (azatiopryna, 6–merkaptopuryna).
- Tofacitinib lub
- Ustekinumab lub
- Cyklosporyna A lub
- Takrolimus.
- Przeciwciała anty–TNF
- Dalsze postępowanie w trakcie hospitalizacji:
- Pozajelitowe wyrównanie zaburzeń równowagi płynów i elektrolitów.
- Odstawienie wszystkich leków hamujących motorykę i innych potencjalnie uszkadzających błonę śluzową.
- Ryzyko ostrego rozdęcia okrężnicy (megacolon toxicum).
- Sigmoidoskopia w celu potwierdzenia diagnozy przy jednoczesnym pobraniu biopsji w celu wykluczenia jelitowej reaktywacji CMV.
- Wykluczenie zakażenia C.difficile.
- Profilaktyka przeciwzakrzepowa.
- Leczenie żywieniowe pacjentów z niedożywieniem, najlepiej dojelitowo.
Leczenie piorunującego zapalenia jelita grubego (fulminant colitis)
- Pacjentów z piorunującym przebiegiem choroby, którzy są oporni na leczenie steroidami dożylnymi, należy leczyć infliksimabem (najlepiej w terapii skojarzonej z tiopuryną) lub cyklosporyną A lub takrolimusem.
- Należy rozważyć wykonanie proktokolektomii.
- Proktokolektomia może być również wskazana w przypadku braku poprawy stanu klinicznego po 4–7 dniach.
Leki immunomodulujące/immunosupresyjne
- Ze względu na brak badań porównawczych nie można wskazać żadnych ogólnych zaleceń odnośnie do wyboru terapii w przypadku przebiegu opornego na steroidy.
- Ważną rolę w indywidualnej decyzji o wyborze odpowiedniej substancji czynnej odgrywa osobiste doświadczenie w stosowaniu poszczególnych substancji.
- Przed rozpoczęciem leczenia immunosupresyjnego lub immunomodulacyjnego należy przeprowadzić ukierunkowany wywiad lekarski, wykonać badanie RTG płuc oraz oznaczyć uwalnianie interferonu–gamma (interferon gamma release assa – IGRAy) w celu wykluczenia czynnej lub utajonej gruźlicy.
- Ponadto pacjentów należy poddać badaniom przesiewowym w kierunku zapalenia wątroby typu B, gruźlicy i EBV (wirus Epsteina–Barr).
- Przed rozpoczęciem leczenia należy sprawdzić status immunizacji i w razie potrzeby uzupełnić szczepienia, ponieważ szczepionki zawierające żywe wirusy są przeciwwskazane w immunosupresji.
- Pacjenci otrzymujący trójlekową terapię immunosupresyjną powinni otrzymywać profilaktykę PJP (pneumocystis jirovecii pneumonia).
- Tiopuryny: azatiopryna lub 6–merkaptopuryna:
- Hamowanie syntezy kwasów nukleinowych.
- Prawdopodobnie porównywalna skuteczność kliniczna u pacjentów (NNT = 5), którzy nie odpowiadają na sulfasalazynę/5–ASA lub jej nie tolerują.28
- Do immunomodulacji u pacjentów z zapaleniem jelita grubego opornym na leczenie steroidami (steroidooporność).2,22
- Stosowane tylko w terapii długoterminowej, ponieważ efekty działania pojawiają się dopiero po pewnym czasie (od kilku tygodni do 6 miesięcy).28-29
- Nie są skuteczne w leczeniu ostrego rzutu WZJG.2
- W miarę możliwości nie stosować tiopuryn u dorosłych EBV-seronegatywnych pacjentów.
- Podwyższone ryzyko wystąpienia chłoniaka, przy czym ryzyko bezwzględne wynosi mniej niż 1% w okresie 10 lat.28,30
- W chorobie limfoproliferacyjnej związanej z EBV należy przerwać leczenie immunomodulacyjne tiopurynami.
- Możliwa toksyczność, np. supresja szpiku kostnego (z reguły odwracalna).
- Interakcja z allopurynolem, który hamuje metabolizm azatiopryny i tym samym zwiększa ryzyko wystąpienia supresji szpiku kostnego.
- W tym przypadku zmniejszenie dawki allopurynolu do 1/4.
- Cyklosporyna A:
- Inhibitor kalcyneuryny.
- Konieczne regularne oznaczanie stężenia.
- Stosowana w ciężkim wrzodziejącym zapaleniu jelita grubego opornym na leczenie steroidami, jeżeli jako alternatywę rozważa się radykalną proktokolektomię.
- Obniżenie częstości proktokolektomii, przynajmniej krótkookresowo.
- Inhibitor kalcyneuryny.
- Takrolimus:
- Inhibitor kalcyneuryny.
- Konieczne regularne oznaczanie stężenia.
- Skuteczność i bezpieczeństwo porównywalne do inhibitorów TNF–alfa w ciężkim zapaleniu jelita grubego.
- Inhibitor kalcyneuryny.
- Tofacytynib:
- Inhibitor kinaz janusowych (JAK).
- Wyższość nad placebo w ciężkim zapaleniu jelita grubego potwierdzona w 3 badaniach, ale jak dotąd brak badań porównawczych z lekami o ustalonej skuteczności.
- Stosowanie tofacytynibu wiąże się ze zwiększonym ryzykiem nowotworów, zdarzeń zakrzepowo–zatorowych i sercowo–naczyniowych oraz zwiększoną śmiertelnością.
- W Polsce możliwe jest leczenie refundowane przez NFZ tylko w ramach programu terapeutycznego (B.55).
- Ustekinumab:
- Ludzkie przeciwciało monoklonalne skierowane przeciwko interleukinie 12 i 23.
- 8 tygodni od rozpoczęcia terapii około 15% pacjentów (w stosunku do 5% z placebo) w remisji klinicznej.
- U pacjentów z początkową odpowiedzią na leczenie terapia podtrzymująca co 8 tygodni prowadzi do remisji klinicznej u 44% pacjentów w 44. tygodniu (w stosunku do 24% z placebo).
- Ewentualny związek z nowotworami złośliwymi (7 przypadków w stosunku do 1 w grupie placebo, z czego 3 to nieczerniakowy rak skóry).
- Wykazano skuteczność w stosunku do placebo w terapii indukcyjnej i podtrzymującej.31
- Najczęstsze reakcje niepożądane (>5%): zapalenie nosogardła i ból głowy.
- W Polsce możliwe jest leczenie refundowane przez NFZ tylko w ramach programu terapeutycznego (B.55).
- Ludzkie przeciwciało monoklonalne skierowane przeciwko interleukinie 12 i 23.
- Inhibitory TNF–alfa:
- Przeciwciała przeciwko TNF nigdy nie były przedmiotem bezpośrednich badań porównawczych.
- W dwóch metaanalizach sieciowych (network meta–analysis) najskuteczniejsza okazała się terapia infliksimabem, a następnie golimumabem i adalimumabem, przynajmniej u pacjentów wcześniej nieleczonych lekami biologicznymi.
- Infliksimab i adalimumab wykazują skuteczność zarówno w indukcji remisji, jak i w jej podtrzymaniu.2
- W Polsce możliwe jest leczenie infliksimabem i adalimumabem refundowane przez NFZ tylko w ramach programu terapeutycznego (B.55.).2
- Infliksimab działa lepiej niż placebo w umiarkowanej do ciężkiej postaci WZJG.32
- Około 2 na 3 pacjentów reaguje na leczenie infliksimabem.33
- Wysoka aktywność choroby, ujemne miano ANCA i obecność genu IL23R (związanego z wrzodziejącym zapaleniem jelita grubego) wskazują na wyższe prawdopodobieństwo odpowiedzi na infliksimab.34
- Zwiększone ryzyko wystąpienia zakażeń oportunistycznych.35
- Przeciwciała przeciwko TNF nigdy nie były przedmiotem bezpośrednich badań porównawczych.
- Inne leki biologiczne:
- Po niepowodzeniu konwencjonalnej terapii wedolizumabem (antagonista integryny) remisja u 31,3% pacjentów w 52. tygodniu w porównaniu z 22,5% w terapii adalimumabem (inhibitor TNF–alfa).36
- W Polsce możliwe jest leczenie refundowane przez NFZ adalimumabem tylko w ramach programu terapeutycznego.
- Po niepowodzeniu konwencjonalnej terapii wedolizumabem (antagonista integryny) remisja u 31,3% pacjentów w 52. tygodniu w porównaniu z 22,5% w terapii adalimumabem (inhibitor TNF–alfa).36
Inne terapie
- Całkowitą remisję uzyskano u 24% (9 z 38) pacjentów, u których zastosowano transplantację mikrobioty jelitowej („przeszczep kału”) z cotygodniową lewatywą przez 6 tygodni, w porównaniu z 5% w grupie placebo.37
- Przed włączeniem do standardowego postępowania konieczne są dalsze badania.
Leczenie chirurgiczne
- Celem leczenia chirurgicznego jest usunięcie całego jelita grubego.2
- Wskazane w przypadku opornego na leczenie WZJG, zaburzeń wzrostu w dzieciństwie lub chorób nowotworowych.
- Operacja standardowa: proktokolektomia odtwórcza z wytworzeniem zbiornika jelitowego z jelita cienkiego (ileal pouch–anal anastomosis – IPAA) i zespoleniem zbiornikowo–jelitowym.2
- Zwykle z ochronną ileostomią.
- Operacja jednoetapowa powinna być wykonywana tylko w wybranych, indywidualnych przypadkach.
- Rekonstrukcją z wyboru powinno być wytworzenie zbiornika jelitowego w kształcie litery J (J–pouch).
- Operacje z wytworzeniem J–pouch należy wykonywać tylko w wyspecjalizowanych ośrodkach.
- Operacja pozwala osiągnąć najlepszą możliwą jakość życia pacjentów przy średnio 5–6 wypróżnieniach dziennie, z zachowaniem trzymania stolca u ponad 90% chorych.
- Chorzy z piorunującym rzutem opornym na leczenie farmakologiczne powinni być operowani w trybie pilnym.
- Perforacja otwarta lub zamknięta jest wskazaniem do operacji w trybie pilnym.
- Na życzenie pacjenta można wykonać operację planową po ocenie ryzyka zachowawczych strategii leczenia względem ryzyka związanego z leczeniem chirurgicznym.
Operacja w trybie pilnym
- Zmniejsza się liczba pilnych operacji chirurgicznych w przypadku ostrego WZJG i obecnie wynosi mniej niż 10% w ciągu pierwszych 5 lat od rozpoznania.38
Operacja planowa
- Przy ciężkim niedożywieniu (BMI<19, utrata masy ciała przekraczająca 10% w ciągu ostatnich 6 miesięcy przed operacją i/lub stężenie albuminy w surowicy <30 g/l, wyraźna kacheksja) przed planową operacją należy prowadzić przedoperacyjne celowane leczenie żywieniowe przez co najmniej 7 dni.
Zespolenie jelitowo–odbytowe
- Technika chirurgiczna:
- Rozcięcie i usunięcie odbytnicy do dna miednicy.
- Wytworzenie długiego na blisko 18 cm zbiornika jelitowego w kształcie litery J (J–pouch) z jelita krętego i zespolenie z odbytem.
- Konieczne jest wykonanie odciążającej ileostomii dwulufowej (pętlowej) na jakieś 3 miesiące.
- Zabiegi laparoskopowe rzadziej powodują problemy z gojeniem rany i dają lepszy efekt estetyczny niż operacje otwarte. Ich wady to dłuższy czas operacji, wyższe koszty i konieczność specjalistycznego przeszkolenia chirurgów.39
Profilaktyka nawrotu choroby – leczenie podtrzymujące remisję
- W leczeniu podtrzymującym remisję należy stosować głównie preparaty kwasu 5–aminosalicylowego (5–ASA) w postaci doustnej i/lub w postaci wlewek.2
- Sposób podawania 5–ASA należy dostosować do postaci choroby; zapalenie odbytnicy i lewostronne zapalenie jelita grubego należy leczyć przede wszystkim doodbytniczo.
- Jako leczenie drugiego rzutu należy stosować skojarzenie doustnego i doodbytniczego 5–ASA.
- Do podtrzymywania remisji nie należy stosować glikokortykosteroidów.
- Leczenie podtrzymujące remisję 5–ASA należy kontynuować przez co najmniej 2 lata, jeśli jest skuteczne.
- Jako alternatywę do leczenie 5–ASA należy rozważyć przeszczep niepatogennego szczepu Escherichia (E.) coli Nissle 1917.
- Z punktu widzenia profilaktyki raka pacjentom należy zaproponować długotrwałą terapię 5–ASA.
- W przypadku ponownych rzutów należy zintensyfikować terapię podtrzymującą remisję, przy czym istnieją różne opcje:
- eskalacja dawki doustnej/doodbytniczej terapii skojarzonej aminosalicylanami
- terapia tiopurynami (leczenie z wyboru)2
- terapia inhibitorem TNF–alfa
- leczenie wedolizumabem.
- Jeśli w ciężkim rzucie choroby wystąpi skuteczna odpowiedź na substancję immunomodulującą, należy kontynuować leczenie odpowiednią substancją.
- Wyjątek stanowią inhibitory kalcyneuryny (cyklosporyna A, takrolimus), które ze względu na silne reakcje niepożądane należy zastąpić azatiopryną/merkaptopuryną lub wedolizumabem najpóźniej po 6 miesiącach.
- Ze względu na brak dowodów nie można sformułować zaleceń dotyczących czasu leczenia podtrzymującego remisję tiopurynami, inhibitorami TNF–alfa, ustekinumabem, tofacitinibem ani wedolizumabem.
- Często konieczne jest długotrwałe leczenie podtrzymujące remisję.
- Przy braku leczenia u 80% pacjentów nawrót choroby następuje w ciągu 1 roku od osiągnięcia remisji.
- Leczenie preparatami 5–ASA zmniejsza częstość nawrotów o 16–50%.40-41
Zapobieganie
- Należy wykonywać kontrolne kolonoskopie zgodnie ze stratyfikacją ryzyka, ponieważ nadzór endoskopowy może obniżać śmiertelność w raku jelita grubego związanym z zapaleniem jelita grubego.
- Zobacz dalsze postępowanie.
- Zwiększone ryzyko wystąpienia osteoporozy
- Możliwa skłonność do osteoporozy lub osteopenii w związku z leczeniem lekami steroidowymi.
- Zmniejszoną gęstość kości obserwuje się u 3–30% chorych na NZJ.2
- W razie potrzeby pomiar gęstości kości (densytometria).
- Zalecenia: aktywność fizyczna, niepalenie tytoniu, rezygnacja ze spożycia alkoholu albo tylko umiarkowane spożycie.
- Ewentualnie suplementacja wapnia i witaminy D.
- Jeśli chorzy są po przebytym złamaniu patologicznym, leczenie bisfosfonianami.2
5–ASA a profilaktyka nowotworów
- Przypuszczalne mechanizmy działania to zwiększona apoptoza i zmniejszona proliferacja komórek.
- Powoduje to zahamowanie wzrostu guza lub przeciwdziała rozwojowi nowotworu.42
- Farmakoterapia 5–ASA może prawdopodobnie obniżyć ryzyko wystąpienia nowotworu w jelicie grubym nawet o 80%.43-44
Zalecenia dla pacjentów
- Brak wiarygodnych dowodów na działanie profilaktyczne lub terapeutyczne konkretnej diety.
- Według metaanalizy z 2017 roku dane wskazują, że dieta o małej zawartości fermentujących oligo–, di– i monosacharydów oraz polioli (low fermentable oligo–, di–, monosaccharides and polyols – low FODMAP) może łagodzić objawy, potrzeba jednak więcej badań.45
- Zobacz szczegółowy opis diety low FODMAP według Narodowego Centrum Edukacji Żywieniowej.
- W niedoborach poszczególnych mikroelementów należy stosować odpowiednią suplementację doustną lub pozajelitową.
- Rutynowe uzupełnianie witamin lub pierwiastków śladowych nie jest wskazane.
- Konieczne może być uzupełnienie żelaza.
- Loperamid.
- Pomocny w przypadku ciężkiej biegunki po kolektomii.
- Nie stosować w ostrym rzucie choroby; zwiększa ryzyko toksycznego rozdęcia okrężnicy (megacolon toxicum).15
Środki medycyny niekonwencjonalnej
- Ponad 50% pacjentów z NZJ stosuje środki medycyny niekonwencjonalnej.46
- 30–70% pacjentów nie informuje jednak swoich lekarzy o ich stosowaniu.
- W związku z tym należy z własnej inicjatywy pytać pacjentów o stosowanie środków medycyny niekonwencjonalnej.
- Procedury medycyny naturopatycznej i komplementarnej należy oceniać według kryteriów medycyny opartej na dowodach.
- Możliwe opcje terapii komplementarnej to:
- metody redukcji stresu oparte na technikach koncentracyjnych
- joga w celu poprawy jakości życia
- akupunktura w łagodnych i umiarkowanych rzutach choroby
- kurkuma w uzupełnieniu aminosalicylanów przy indukcji i podtrzymaniu remisji
- mirra, ekstrakt z kwiatów rumianku i węgiel leczniczy (Coffeae carbo) stosowane w skojarzeniu do podtrzymania remisji
- Plantago ovata (nasiona babki jajowatej) w leczeniu podtrzymującym remisję.
- Nie należy zalecać żadnych innych metod niekonwencjonalnych ze względu na niewystarczające dane.
Przebieg, powikłania i rokowanie
Przebieg
- WZJG zwykle przebiega w sposób nawrotowy, chociaż możliwy jest przebieg przewlekły i ciągły lub piorunujący.
- Indywidualny przebieg choroby jest bardzo zróżnicowany.
- W każdym momencie może wystąpić ostry piorunujący rzut choroby.
- Po osiągnięciu remisji i zakończeniu leczenia immunomodulatorami lub lekami biologicznymi w ciągu kilku lat u co najmniej połowy pacjentów występuje nawrót choroby.47
- W przypadku nawrotów choroba zwykle ma podobny przebieg, ale może też postępować w kierunku jamy ustnej.
- Przebieg choroby w jelicie grubym może zmieniać się zarówno w pierwszych latach po rozpoznaniu, jak i w późniejszym okresie.48
- U dzieci często występuje cięższy przebieg wrzodziejącego zapalenia jelita grubego.
- U osób do 16. roku życia występuje wyższe ryzyko hospitalizacji z powodu rzutu choroby i braku odpowiedzi na początkową terapię w porównaniu z osobami dorosłymi.
Ciąża i laktacja
- Ciąża pomimo WZJG jest możliwa.
- W miarę możliwości należy ją zaplanować w nieaktywnej fazie choroby.
- Podstawowe znaczenie ma optymalna farmakoterapia.
- Należy unikać interwencji chirurgicznych.
- W przypadku leczenia inhibitorami TNF–alfa należy unikać szczepień żywymi szczepionkami (rotawirusy) u noworodków przez 9 miesięcy, ponieważ przeciwciała przenikają przez łożysko.
- W okresie laktacji przyjmowanie większości ze stosowanych leków może być kontynuowane.2
Powikłania
Piorunujące zapalenie jelita grubego (fulminant colitis)49
- Piorunujące zapalenie jelita grubego rozwija się u 5–15% chorych.
- Zazwyczaj rozwija się samoistnie, ale chorobę mogą też wywołać zakażenia, leki (NLPZ, antybiotyki), badanie RTG z kontrastem lub kolonoskopia wykonane podczas ciężkiego rzutu.
- Obawa przed ostrym rozdęciem okrężnicy (megacolon toxicum) ze względu na ryzyko perforacji.
- Ogólnoustrojowa terapia steroidowa może maskować objawy.
Osteoporoza/osteopenia
- Patrz sekcja zwiększone ryzyko wystąpienia osteoporozy.
Powikłania infekcyjne2
- U chorych z NZJ dochodzi do zaburzeń odpowiedzi immunologicznej pierwotnej (wrodzonej i nabytej) oraz wtórnej na skutek niedożywienia i stosowanych leków.
- Pacjenci mogą być narażeni na infekcje oportunistyczne (zakażenie CMV, EBV, HBV, HCV) oraz reaktywacje infekcji w razie przebycia tych zakażeń w przeszłości.
- Należy badać stan wirusologiczny chorych oraz, o ile jest to możliwe, poddać ich szczepieniom.
Powikłania pooperacyjne po proktokolektomii
- Atrezja jelita, zapalenie zbiornika jelitowego (pouchitis), zwężenia, dysfunkcja zbiornika i ewentualnie zmniejszona płodność u kobiet.23,50
Rak jelita grubego
- Podwyższone ryzyko rozwoju nowotworu jelita grubego (colorectal carcinoma – CRC).51-54
- Jeśli występuje również PSC (pierwotne stwardniające zapalenie dróg żółciowych), ryzyko wystąpienia CRC jest znacznie podwyższone.
- W profilaktyce nowotworów związanych z zapaleniem jelita grubego zalecane jest leczenie kwasem ursodeoksycholowym w dawce 13–20 mg/kg m.c. na dobę.
- Śmiertelność z powodu nowotworu prawdopodobnie nie jest wyższa niż w ogólnej populacji.49
- Negatywne czynniki prognostyczne (czynniki zwiększające ryzyko wystąpienia raka jelita grubego):2
- Czas trwania choroby powyżej 10 lat.
- Wczesny początek choroby.
- Rozległe zapalenie jelita grubego.
- Wysoki stopień aktywności choroby.
- Obecność wstecznego zapalenia jelita krętego (backwash ileitis).
- Obecność pseudopolipów.
- Zwężenia jelita grubego.
- Współwystępowanie stwardniającego zapalenia dróg żółciowych (PSC).
- Brak długotrwałego leczenia preparatami 5–ASA (działają ochronnie).
- Wywiad rodzinny nowotworów jelita grubego (rak jelita grubego u krewnych pierwszego stopnia przed 50 r.ż.).
Problemy psychiczne
- Wielu młodych pacjentów z nieswoistym zapaleniem jelit zmaga się z problemami psychicznymi.
- Problemy te dotyczą również członków rodziny.
- Zalecane skierowanie do psychologa i/lub psychiatry.
Rokowanie
- Dzięki nowym możliwościom leczenia farmakologicznego i chirurgicznego rokowanie we wrzodziejącym zapaleniu jelita grubego poprawiło się na przestrzeni ostatnich 20–30 lat.55
- 2 na 3 pacjentów osiąga remisję kliniczną dzięki farmakoterapii, a 80% pacjentów przestrzegających schematu leczenia pozostaje w remisji.56
- Śmiertelność nie jest wyższa niż w populacji ogólnej.1
- W badaniu przeglądowym ciężkich nawrotów WZJG proktokolektomia została wykonana u 27% pacjentów, a śmiertelność sięgała 1%.57
- W tym przypadku częstą przyczyną zgonu jest toksyczne rozdęcie okrężnicy (megacolon toxicum) i wynikające z niego powikłania, takie jak perforacja.
Dalsze postępowanie
- Regularne badania kontrolne – zarówno u lekarza rodzinnego, jak i gastroenterologa:
- Ocena aktywności zapalnej (częstość wypróżnień, bolesne parcia na stolec, USG jelit, kalprotektyna w stolcu), anemia, stan odżywienia i niedobory mikroelementów oraz objawy pozajelitowe.
- Odstępy czasowe zależą od aktywności choroby, jej rozległości i czasu trwania.
Nadzór endoskopowy: strategia obserwacji ukierunkowana na wczesne wykrywanie nowotworu w jelicie grubym we wrzodziejącym zapaleniu jelita grubego
- Pierwsza kolonoskopia kontrolna:
- 6–8 lat od wystąpienia objawów.
- U wszystkich pacjentów niezależnie od aktywności choroby.
- Ustalenie schematu przebiegu choroby i określenie strategii obserwacji.
- Pobrać co najmniej 2 biopsje z każdego segmentu jelita grubego, w uzupełnieniu biopsji celowanych służących ocenie schematu przebiegu choroby.
- Aktywność choroby ograniczona do odbytnicy:
- Brak włączenia do programu regularnych kontrolnych badań kolonoskopowych.
- Kontrolną kolonoskopię najlepiej przeprowadzać co 5 lat w ramach obserwacji i w kierunku progresji wrzodziejącego zapalenia jelita grubego.
- Jeżeli zmiany wykraczają poza odbytnicę, częstotliwość badań kontrolnych należy ustalić na podstawie stratyfikacji ryzyka:
- Wysokie ryzyko (PSC, zwężenie, komórki złośliwe śródnabłonkowo w ciągu ostatnich 5 lat, rozległe zapalenie jelita grubego z nasilonym stanem zapalnym lub przypadki nowotworu jelita grubego u krewnych pierwszego stopnia w wieku <50 lat).
- Raz w roku.
- Pośrednie ryzyko (zapalenie jelita grubego z łagodnym lub umiarkowanie nasilonym stanem zapalnym, liczne pseudopolipy, przypadki CRC u krewnych pierwszego stopnia w wieku ≥50 lat).
- Co 2–3 lata.
- Niskie ryzyko (nie występuje żaden z powyższych czynników).
- Co 4 lata.
- Wysokie ryzyko (PSC, zwężenie, komórki złośliwe śródnabłonkowo w ciągu ostatnich 5 lat, rozległe zapalenie jelita grubego z nasilonym stanem zapalnym lub przypadki nowotworu jelita grubego u krewnych pierwszego stopnia w wieku <50 lat).
- Stan po proktokolektomii:
- Coroczne kontrolne badanie endoskopowe, jeśli występują czynniki ryzyka.
- W przeciwnym razie endoskopowa ocena worka jelitowego w przypadku dolegliwości lub co najmniej raz na 2 lata.
Informacje dla pacjentów
Organizacje pacjenckie
- "J-elita" Polskie Towarzystwo Wspierania Osób z Nieswoistymi Zapaleniami Jelit j-elita.org.pl.
Informacja o diecie
- Narodowe Centrum Edukacji Żywieniowej – opis diety low FODMAP.
Materiały edukacyjne dla pacjentów
- Wrzodziejące zapalenie jelita grubego.
- Piorunujące zapalenie jelita grubego (fulminant colitis).
- Ileostomia.
Ilustracje
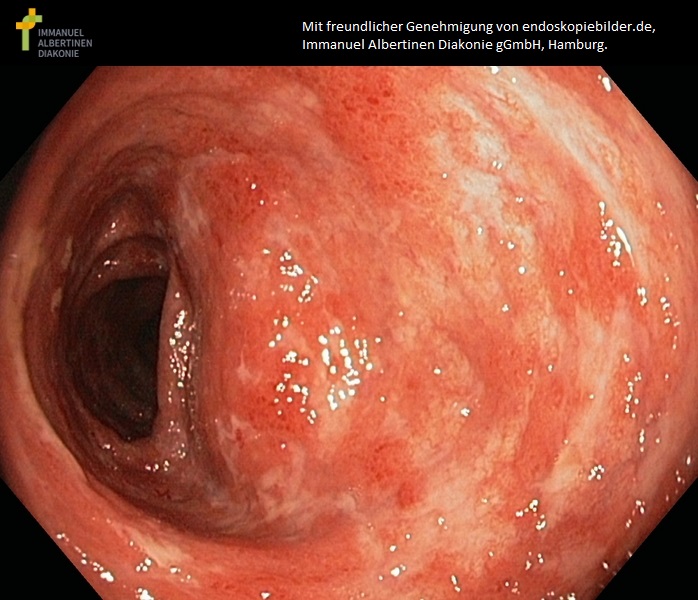
Wrzodziejące zapalenie jelita grubego o umiarkowanej aktywności (dzięki uprzejmości endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
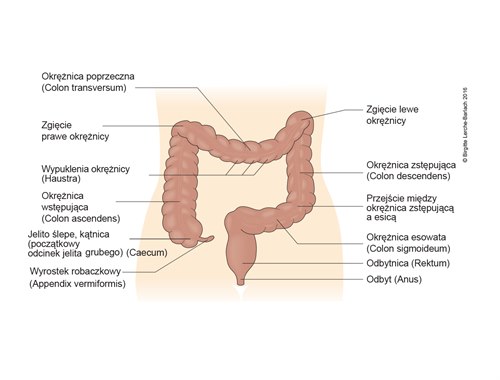
Jelito grube (okrężnica), przegląd
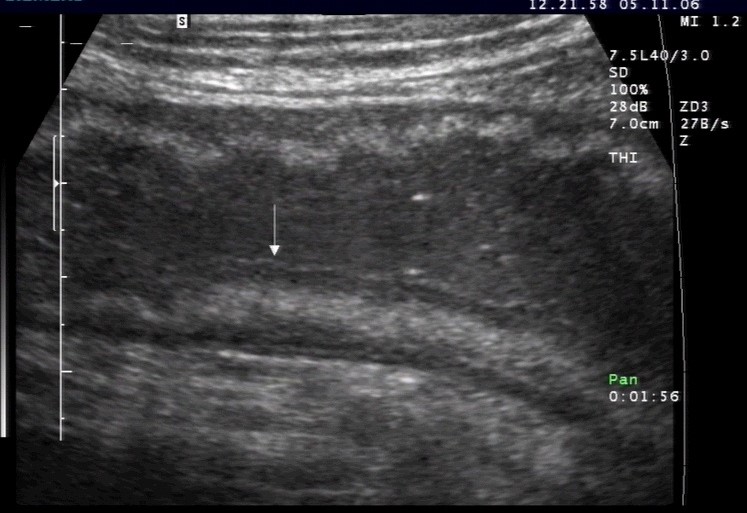
Pogrubienie ściany jelita w ostrym rzucie choroby (dzięki uprzejmości sonographiebilder.de ©Albertinen-Diakoniewerk e.V., Hamburg).
Źródła
Wytyczne
- Eder P., Łodyga M., Gawron-Kiszka M., et al. 2023 Wytyczne Polskiego Towarzystwa Gastroenterologii i konsultanta krajowego w dziedzinie gastroenterologii dotyczące postępowania z pacjentem z wrzodziejącym zapaleniem jelita grubego [published correction appears in Prz Gastroenterol. 2023; 18(2): 224], Prz Gastroenterol, 2023, 18(1): 1-42, doi:10.5114/pg.2023.125882 po angielsku PubMed, po polsku https://ptg-e.org.pl/
- Raine T., Bonovas S., Burisch J., et al. 2022 ECCO Guidelines on Therapeutics in Ulcerative Colitis: Medical Treatment, J Crohns Colitis, 2022, 16(1): 2-17, doi:10.1093/ecco-jcc/jjab178, PubMed, streszczenie po polsku mp.pl
- Spinelli A., Bonovas S., Burisch J., et al. 2022 ECCO Guidelines on Therapeutics in Ulcerative Colitis: Surgical Treatment. J Crohns Colitis. 2022; 16(2): 179-89, doi:10.1093/ecco-jcc/jjab177, PubMed
- De Simone B., Davies J., Chouillard E., et al. 2021 WSES-AAST guidelines: management of inflammatory bowel disease in the emergency setting, World J Emerg Surg. 2021, 16(1): 23, 11.05.2021, doi:10.1186/s13017-021-00362-3, po angielsku PubMed, streszczenie po polsku mp.pl
- Lamb C.A., Kennedy N.A., Raine T., et al. 2019 British Society of Gastroenterology consensus guidelines on the management of inflammatory bowel disease in adults [published correction appears in Gut. 2021 Apr; 70(4): 1]. Gut, 2019, 68(Suppl 3): 1-106, doi:10.1136/gutjnl-2019-318484, PubMed
- Gonciarz M., Szkudłapski D., Mularczyk A., et al. 2017 Wytyczne postępowania z chorymi na nieswoiste choroby zapalne jelit w praktyce lekarza rodzinnego, Lekarz POZ, 2017, 3(1): 1-11, www.termedia.pl
Piśmiennictwo
- Basson M.D. Ulcerative Colitis, Medscape, 26.07.2019, emedicine.medscape.com
- Gonciarz M., Szkudłapski D., Mularczyk A., et al. Wytyczne postępowania z chorymi na nieswoiste choroby zapalne jelit w praktyce lekarza rodzinnego, Lekarz POZ. 2017, 3(1): 1-11, www.termedia.pl
- Carter M.J., Lobo A.J., Travis S.P., for the IBD Section, British Society of Gastroenterology. Guidelines for the management of inflammatory bowel disease in adults, Gut 2004, 53 (suppl 5): 1-16, www.ncbi.nlm.nih.gov
- Langan R.C., Gotsch P.B., Krafczyk M.A. Ulcerative colitis: Diagnosis and treatment, Am Fam Physician 2007, 76: 1323-30, PubMed
- Silverberg M.S., Satsangi J., Ahmad T. et al. Toward an Integrated Clinical, Molecular and Serological Classification of Inflammatory Bowel Disease: Report of a Working Party of the 2005 Montreal World Congress of Gastroenterology, Can J Gastroenterol 2005, 19: 5-36, pubmed.ncbi.nlm.nih.gov
- Schroeder K.W., Tremaine W.J., Ilstrup D.M. Coated Oral 5-Aminosalicylic Acid Therapy for Mildly to Moderately Active Ulcerative Colitis, NEJM 1987, 317: 1625-9, www.nejm.org
- Zagórowicz E., Walkiewicz D., Kucha P., et al. Nationwide data on epidemiology of inflammatory bowel disease in Poland between 2009 and 2020, Pol Arch Intern Med, 2022, 132(5): 16194, doi:10.20452/pamw.16194, www.mp.pl
- Becker C., Neurath M.F., Wirtz S.. The Intestinal Microbiota in Inflammatory Bowel Disease, ILAR J 2015, 56(2): 192-204, pubmed.ncbi.nlm.nih.gov
- Podolsky D.K. Inflammatory bowel disease, N Engl J Med 2002, 347: 417-29, PubMed
- Forrest K., Symmons D., Foster P. Systematic review: is ingestion of paracetamol or non-steroidal anti-inflammatory drugs associated with exacerbations of inflammatory bowel disease? Aliment Pharmacol Ther 2004, 20: 1035-43, PubMed
- Mahid S.S., Minor K.S., Soto R.E. et al. Smoking and Inflammatory Bowel Disease: A Meta-Analysis. Mayo Clin Proc 2006, 81(11): 1462-71, pubmed.ncbi.nlm.nih.gov
- Rath H.C., Schultz M., Freitag R., et al. Different subsets of enteric bacteria induce and perpetuate experimental colitis in rats and mice, Infect Immun 2001, 69: 2277-85, PubMed
- Kappelman M.D., Bousvaros A. Nutritional concerns in pediatric inflammatory bowel disease patients, Mol Nutr Food Res 2008, 52: 867-74, pubmed.ncbi.nlm.nih.gov
- Frisch M., Pedersen B.V., Andersson R.E. Appendicitis, mesenteric lymphadenitis, and subsequent risk of ulcerative colitis: cohort studies in Sweden and Denmark, BMJ 2009, 338: b716, pubmed.ncbi.nlm.nih.gov
- Nayar M., Rhodes J.M. Management of inflammatory bowel disease, Postgrad Med J 2004, 80: 206-13, PubMed
- Kornbluth A., Sachar D.B., for the Practice Parameters Committee of the American College of Gastroenterology. Ulcerative colitis practice guidelines in adults (update): American College of Gastroenterology, Practice Parameters Committee, Am J Gastroenterol 2004, 99: 1371-85, PubMed
- Ott C., Schölmerich J. Extraintestinal manifestations and complications in inflammatory bowel diseases, Nat Rev Gastroenterol Hepatol 2013, 10(10): 585-95, pubmed.ncbi.nlm.nih.gov
- Rothfuss K.S., Stange E.F., Herrlinger K.R. Extraintestinal manifestations and complications in inflammatory bowel diseases, World J Gastroenterol 2006, 12: 4819-31, PubMed
- van Rheenen P.F., De Vijver E.V., Fidler F. Faecal calprotectin for screening of patients with suspected inflammatory bowel disease: diagnostic meta-analysis, BMJ 2010, 341: c3369, BMJ (DOI)
- Yang Z., Clark N., Park K.T. Effectiveness and cost-effectiveness of measuring fecal calprotectin in diagnosis of inflammatory bowel disease in adults and children, Clin Gastroenterol Hepatol 2014, 12: 253-62, pmid:23883663 PubMed
- Turvill J. High negative predictive value of a normal faecal calprotectin in patients with symptomatic intestinal disease, Frontline Gastroenterology 2012, 3: 21-8, doi:10.1136/flgastro-2013-100429, www.ncbi.nlm.nih.gov
- Collins P., Rhodes J. Ulcerative colitis: diagnosis and management, BMJ 2006, 333: 340-3, PubMed
- Cima R.R., Pemberton J.H. Medical and surgical management of chronic ulcerative colitis, Arch Surg 2005, 140: 300-10, PubMed
- Whaley K.G., Rosen M.J. Contemporary Medical Management of Acute Severe Ulcerative Colitis, Inflamm Bowel Dis 2019, 25(1): 56-66, pubmed.ncbi.nlm.nih.gov
- Kucha P., Zagórowicz E., Walkiewicz D., et al. Biologic treatment of inflammatory bowel disease in Poland, 2012-2020: nationwide data, Pol Arch Intern Med. 2022, 132(7-8): 16287, doi:10.20452/pamw.16287, pubmed.ncbi.nlm.nih.gov
- Appendix B.55. The treatment of patients with ulcerative colitis (ICD-10 K 51). [in Polish] https://www.gov.pl/web/zdrowie/choroby-nieonkologiczne. Dostęp: 31.12.2021, www.gov.pl
- Truelove S.C., Witts L.J. Cortisone in ulcerative colitis; final report on a therapeutic trial, Br Med J 1955, 4947: 141-8, pubmed.ncbi.nlm.nih.gov
- Nielsen O.H., Vainer B., Rask-Madsen J. Review article: the treatment of inflammatory bowel disease with 6-mercaptopurine or azathioprine, Aliment Pharmacol Ther 2001, 15: 1699-708, PubMed
- Fraser A.G., Orchard T.R., Jewell D.P. The efficacy of azathioprine for the treatment of inflammatory bowel disease: a 30 year review, Gut 2002, 50: 485-9, www.ncbi.nlm.nih.gov
- Beaugerie L., Brousse N., Bouvier A.M., et al. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a prospective observational cohort study, Lancet 2009, 374: 1617-25, PubMed
- Sands B.E., Sandborn W.J., Panaccione R., et al. Ustekinumab as Induction and Maintenance Therapy for Ulcerative Colitis, N Engl J Med 2019, 381(139): 1201-14, pubmed.ncbi.nlm.nih.gov
- Wang Y., MacDonald J.K., Benchimol E.I., et al. Type I interferons for induction of remission in ulcerative colitis, Cochrane Database of Systematic Reviews 2015, doi:10.1002/14651858.CD006790.pub3, DOI
- Rutgeerts P., Sandborn W.J., Feagan B.G., et al. Infliximab for induction and maintenance therapy for ulcerative colitis, N Eng J Med 2005, 353: 2462-76, New England Journal of Medicine
- Jürgens M., Laubender R.P., Hartl F. Disease activity, ANCA, and IL23R genotype status determine early response to infliximab in patients with ulcerative colitis, Am J Gastroenterol 2010, 105: 1811-9, PubMed
- Ford A.C., Peyrin-Biroulet L. Opportunistic infections with anti-tumor necrosis factor-alpha therapy in inflammatory bowel disease: meta-analysis of randomized controlled trials, Am J Gastroenterol 2013, 108 (8): 1268-76, pmid:23649185, PubMed
- Sands B.E., Peyrin-Biroulet L., Lotfus E.V., et al. Vedolizumab versus Adalimumab for Moderate-to-Severe Ulcerative Colitis, NEJM 2019, 381: 1215-26, www.nejm.org
- Moayyedi P., Surette M.G., Kim P.T., et al. Fecal microbiota transplantation induces remission in patients with active ulcerative colitis in a randomized controlled trial, Gastroenterology 2015, 149: 102-9, DOI:10.1053/j.gastro.2015.04.001, DOI
- Jahnsen J., Aadland E., Moum B., Schulz T., Sauar J., Lygren I. et al. Inflammatory bowel disease, disease course and status 5 years after diagnosis. Gastroenterology 2000, 118 (suppl 2): A118, www.gastrojournal.org
- Bach S.P., Mortensen N.J.M. Revolution and evolution: 30 years of ileoanal pouch surgery, Inflamm Bowel Dis 2006, 12: 131-45, PubMed
- Gisbert J.P., Gomollon F., Mate J., Pajares J.M. Role of 5-aminosalicylic acid (5-ASA) in treatment of inflammatory bowel disease. A systematic review. Dig Dis Sci 2002, 47: 471-88, PubMed
- Klotz U. The role of aminosalicylates at the beginning of the new millenium in the treatment of chronic inflammatory bowel disease, Eur J Clin Pharmacol 2000, 56: 353-62, PubMed
- Allgayer H., Kruis W. Aminosalicylates: potential antineoplastic actions in colon cancer prevention, Scand J Gastroenterol 2002, 38: 125-31, PubMed
- Eaden J., Abrams K., Ekbom A., Jackson E., Mayberry J. Colorectal cancer prevention in ulcerative colitis: a case-control study, Aliment Pharmacol Ther 2000, 14: 145-53, PubMed
- Bernstein C.N., Eaden J., Steinhart A.H., Munkholm P., Gordon P. Cancer prevention in inflammatory bowel diseases and the chemoprophylatic potential of 5-aminosalicylic acid, Inflamm Bowel Dis 2002, 8: 356 - 61, PubMed
- Zhan Y.L., Zhan Y.A., Dai S.X. Is a low FODMAP diet beneficial for patients with inflammatory bowel disease? A meta-analysis and systematic review, Clin Nutr. 2017, pmid:28587774, PubMed
- Langhorst J., Anthonisen I.B., Steder-Neukamm U. et al. Amount of systemic steroid medication is a strong predictor for the use of complementary and alternative medicine in patients with inflammatory bowel disease: results from a German national survey, Inflamm Bowel Dis 2005, 11: 287-95, pubmed.ncbi.nlm.nih.gov
- Torres J., Boyapati R.K., Kennedy N.A., et al. Systematic Review of Effects of Withdrawal of Immunomodulators or Biologic Agents From Patients With Inflammatory Bowel Disease, Gastroenterology 2015, 149: 1716-30, pmid:26381892, PubMed
- Moum B., Ekbom A., Vatn M., Elgjo K. Change in the extent of colonoscopic and histological involvement in ulcerative colitis over time, Am J Gastroenterol 1999, 94: 1564-9, PubMed
- Hovde Ø., Småstuen M.C., Høivik M.L., et al. Mortality and causes of death in ulcerative colitis: Results from 20 years of follow-up in the IBSEN study, Inflamm Bowel Dis 2016, 22(1): 141-5, pubmed.ncbi.nlm.nih.gov
- Olsen K.Ø., Joelsson M., Laurberg S. et al. Fertility after ileal pouch-anal anastomosis in women with ulcerative colitis, Br J Surg 1999, 86: 493-5, PubMed
- Cvancarova M., Hovde O., Wanderaas M., et al. Do patients with longstanding IBD have higher cancer risk compared to the general population? Results from the IBSEN study, J Clin Oncol 2015, 33: Abstract 1573, meetinglibrary.asco.org
- Olén O., Erichsen R., Sachs M.C., et al. Colorectal cancer in ulcerative colitis: a Scandinavian population-based cohort study, Lancet 2020, doi:10.1016/S0140-6736(19)32545-0, www.thelancet.com
- Collins P.D., Mpofu C., Watson A.J., Rhodes J.M. Strategies for detecting colon cancer and/or dysplasia in patients with inflammatory bowel disease, Cochrane Database Syst Rev, issue 2, 2006, www.ncbi.nlm.nih.gov
- Eaden J.A., Abrams K.R., Mayberry J.F. The risk of colorectal cancer in ulcerative colitis: a meta-analysis, Gut 2001, 48: 526-35, www.ncbi.nlm.nih.gov
- Sutherland L.R. Maintenance therapy for inflammatory bowel disease: what really works, Can J Gastroenterol 1997, 11: 261-4, PubMed
- Kornbluth A., Marion J.F., Salomon P., Janowitz H.D. How effective is current medical therapy for severe ulcerative and Crohn's colitis? An analytic review of selected trials, J Clin Gastroenterol 1995, 20: 280-4, PubMed
- Turner D., Walsh C.M., Steinhart A.H. et al. Response to corticosteroids in severe ulcerative colitis: a systematic review of the literature and a meta-regression, Clin Gastroenterol Hepatol 2007, 5: 103-10, pubmed.ncbi.nlm.nih.gov
Opracowanie
- Sławomir Chlabicz (recenzent/redaktor)
- Tomasz Tomasik (redaktor)
- Małgorzata Marczewska (recenzent/redaktor)
- Lino Witte (recenzent/redaktor)