Informacje ogólne
Definicja
- Poniższy artykuł zawiera ogólne informacje dla lekarzy rodzinnych na temat raka pęcherza moczowego.
- Rak pęcherza moczowego jest najczęstszym typem nowotworu urologicznego po raku prostaty.
- Zazwyczaj (>90%) wywodzi się z urotelium.1-5
- Rak płaskonabłonkowy rzadko występuje w Europie Środkowej, częściej stwierdza się go u pacjentów zamieszkujących regiony, w których występuje bilharcjoza.
- Rak urotelialny często zlokalizowany jest jednocześnie w różnych częściach pęcherza i układu moczowego.
- Rak pęcherza moczowego może mieć różny przebieg – od zmiany miejscowej o niskim wskaźniku śmiertelności do niezwykle agresywnej postaci z wysokim wskaźnikiem śmiertelności.
- Guzy pęcherza moczowego są klasyfikowane zgodnie z systemem TNM.
- Dokładne określenie stopnia zaawansowania i klasyfikacja mają kluczowe znaczenie dla wyboru optymalnego leczenia.
Klasyfikacja
Klasyfikacja TNM6
- Leczenie i dalsze postępowanie należy określić w zależności od rozprzestrzeniania się i histopatologicznych cech guza.
- TX – nie można ocenić ogniska pierwotnego.
- T0 – brak dowodów na istnienie guza pierwotnego
- Ta – nienaciekający, brodawkowaty
- Tis – in situ (śródnabłonkowy), „płaski guz”, rak in situ (CIS)
- T1 – naciekanie (blaszki właściwej) błony śluzowej
- T2 – naciekanie błony mięśniowej właściwej
- T2a – naciekanie wewnętrznej połowy błony mięśniowej
- T2b – naciekanie zewnętrznej połowy błony mięśniowej
- T3 – naciekanie poza błonę mięśniową na tkanki mięśniowe okołopęcherzowe
- T3a – naciekanie poza błonę mięśniową widoczne tylko mikroskopowo
- T3b – naciekanie poza błonę mięśniową widoczne makroskopowo
- T4 – naciekanie narządów sąsiednich
- T4a – naciekanie na prostatę, macicę, pochwę
- T4b – naciekanie na ścianę miednicy lub powłoki brzuszne (guz nieruchomy)
- NX – brak możliwości oceny regionalnych węzłów chłonnych
- N0 – brak przerzutów do regionalnych węzłów chłonnych
- N1 – przerzut do jednego węzła chłonnego miednicy mniejszej
- N2 – przerzuty do większej liczby węzłów chłonnych miednicy mniejszej
- N3 – przerzuty do węzłów chłonnych na poziomie naczyń biodrowych wspólnych
- MX – nie można ocenić przerzutów odległych
- M0 – brak przerzutów odległych
- M1 – obecność przerzutów odległych
Klasyfikacja histologiczna
- Od 2016 roku obowiązuje nowy system klasyfikacji WHO.7
- klasyfikacja guzów na inwazyjne-naciekające na błonę mięśniową pęcherza i nieinwazyjne (nienaciekające)
- bardziej precyzyjna klasyfikacja w oparciu o histopatologię, w tym stopień atypii komórek nowotworowych
Stopień złośliwości histologicznej (grading)
- Stopień zróżnicowania komórek nowotworowych, tj. odchylenie komórek nowotworowych od zdrowych komórek prawidłowej tkanki
- G1: dobrze zróżnicowany, o niskim potencjale złośliwości
- G2: średnio zróżnicowany
- G3: słabo zróżnicowany, o wysokim stopniu złośliwości
- G4: niezróżnicowane, anaplastyczne
Częstość występowania
- Zapadalność
- Rocznie około 20 nowo zdiagnozowanych przypadków inwazyjnego raka pęcherza moczowego na 100 000 osób, z czego około 1/4 stanowią kobiety.
- W Polsce nowotwory pęcherza moczowego stanowią prawie 7% przypadków nowotworów złośliwych u mężczyzn i nieco ponad 2% u kobiet.
- W 2017 roku zdiagnozowano 7293 nowych zachorowań. W tym samym roku prawie 4000 chorych zmarło z powodu raka pęcherza (3056 mężczyzn i 899 kobiet).8
- Ponadto co roku rozpoznaje się około 15/100 000 nieinwazyjnych raków brodawkowatych (Ta) i guzów in situ (Tis) pęcherza moczowego.
- Nie są one klasyfikowane jako nowotwory złośliwe zgodnie z ICD-10, ale mogą się w nie przekształcić.
- Wiek
- Mediana wieku zachorowania wynosi około 75 lat.
- Zapadalność rośnie wraz z wiekiem.
- Typy guzów6
- U około 75–85% pacjentów w momencie rozpoznania guzy są ograniczone do błony śluzowej (stadium Ta-Tis) lub podśluzowej (stadium T1).
- W tej grupie jest większość pacjentów z długim okresem przeżycia.
- U pozostałych pacjentów, guz nacieka warstwę mięśniową (muscularis propria) pęcherza moczowego (stadium T2-4) i/lub rozprzestrzenił się do regionalnych węzłów chłonnych (stadium N1-3).
- U około 75–85% pacjentów w momencie rozpoznania guzy są ograniczone do błony śluzowej (stadium Ta-Tis) lub podśluzowej (stadium T1).
Etiologia i patogeneza
- Rak pęcherza moczowego jest wyjątkowym nowotworem, dla którego znanych jest wiele czynników etiologicznych.
- Z tego powodu należy zwrócić szczególną uwagę na możliwe narażenie na znane urotelialne czynniki rakotwórcze.
Czynniki predysponujące
- Wydaje się, że istnieje genetyczna predyspozycja do zachorowania na raka pęcherza moczowego.9-10
- Częściej występuje u pacjentów z HNPCC (hereditary non-polyposis colorectal cancer, zespół Lyncha), zwłaszcza w obecności mutacji MSH2.
- Palenie tytoniu1,5,11
- Trzykrotnie zwiększa ryzyko zachorowania na raka pęcherza moczowego.
- Wśród pacjentów z nowotworami o wysokim stopniu złośliwości histologicznej występuje wyjątkowo duża liczba nałogowych palaczy.
- Palenie tytoniu zwiększa śmiertelność z powodu raka pęcherza moczowego.
- Zaprzestanie palenia zmniejsza to ryzyko, jednak dopiero po 20–30 latach.
- Zawodowe narażenie na związki chemiczne (aminy aromatyczne) stosowane w niektórych gałęziach przemysłu
- Szczególnie zagrożeni są pracownicy produkcji w przemyśle graficznym, metalowym (żelazo/aluminium), malarskim i gumowym.
- uznany za chorobę zawodową
- Inne substancje rakotwórcze to cyklofosfamid, chlornafazyna, fenacetyna i kwas arystolochowy.
- Przewlekłe zapalenie pęcherza moczowego.
- Radioterapia miednicy może prowadzić do rozwoju raka pęcherza moczowego z kilkuletnim okresem utajenia.
- Ryzyko raka płaskonabłonkowego w krajach rozwijających się zwiększa schistosomatoza.
- Nieprawidłowości genetyczne np. protoonkogenów RAS i MYC oraz TP53.
ICD-10
- C67 Nowotwór złośliwy pęcherza moczowego.
Diagnostyka
Kryteria diagnostyczne
- Choroba przez długi czas przebiega bezobjawowo.
- Objawy przedmiotowe, podmiotowe i wyniki badań dodatkowych, które nasuwają podejrzenie raka pęcherza moczowego to m.in.:
- mikrohematuria
- bezbolesna makrohematuria
- dodatni wynik badania cytologicznego moczu
- niespecyficzne objawy podrażnienia, takie jak częstomocz, objawy parcia na mocz lub dyzuria
- W takich przypadkach konieczna jest dalsza diagnostyka.
Badania przesiewowe
- Brak jednoznacznych zaleceń dotyczących markera diagnostycznego do badań przesiewowych na obecność raka pęcherza moczowego lub do systematycznego wczesnego wykrywania go w populacji ogólnej lub w populacjach wysokiego ryzyka.
- Należy unikać stosowania dostępnych na rynku testów z krwi i moczu do wczesnego wykrywania i badań przesiewowych na obecność raka pęcherza moczowego.
- Dostępne na rynku testy do badania moczu, takie jak marker nowotworowy NMP22 (białko macierzy jądrowej uwalniane z komórek guza urotelialnego), mają zbyt niską swoistość (poniżej 90%).12
- Badania przesiewowe w kierunku bezobjawowego krwiomoczu nie są również zalecane w USA (przez U.S. Preventive Services Task Force), ponieważ dodatnia wartość predykcyjna dla raka pęcherza moczowego z mikroskopowym krwiomoczem wynosi <10%.13
- W grupach wysokiego ryzyka (palacze, grupy ryzyka zawodowego) badania moczu pod kątem mikrohematurii mogą wykryć raka pęcherza moczowego wcześniej niż u pacjentów, u których występują już objawy.
- Powtarzająca się potwierdzona bezobjawowa mikrohematuria powinna być wskazaniem do oceny urologicznej.
Diagnostyka różnicowa
- Inne przyczyny hematurii
- zakażenie układu moczowego
- nowotwory nerek i drog moczowych
- stosunek płciowy
- sztuczny krwiomocz, np. zanieczyszczenie krwią menstruacyjną
- kamica moczowa
- zapalenie, rak gruczołu krokowego
- uraz
- choroby nerek, w tym zapalenie nerek
- hematuria wysiłkowa
- skaza krwotoczna
- przedawkowanie leków przeciwzakrzepowych.
Wywiad lekarski
- U wielu pacjentów przez długi czas nie występują żadne objawy, dopóki choroba nie stanie się zaawansowana.
Hematuria
- Najważniejszym objawem jest bezbolesny przerywany lub ciągły krwiomocz, makroskopowy lub mikroskopowy (85–90% pacjentów).1,14
- Stopień krwiomoczu nie odpowiada rozprzestrzenianiu się i nasileniu choroby.
- Bezbolesny krwiomocz makroskopowy jest uważany za objaw raka urotelialnego, dopóki to rozpoznanie nie zostanie wykluczone.
Zaburzenia w oddawaniu moczu
- Objawy podrażnienia pęcherza moczowego (dyzuria, nagłe parcie na mocz, częstomocz) mogą być związane z rakiem pęcherza moczowego.
- W przypadku opornego na leczenie zapalenia pęcherza moczowego, należy wykluczyć raka pęcherza moczowego.
- Objawy te powinny wzbudzić podejrzenia, zwłaszcza u mężczyzn.
- Występują zwłaszcza w przypadku raka inwazyjnego naciekającego błonę mięśniową i rozległego raka in situ.
- Rzadko występują samodzielnie w guzach Ta/T1.
- Problemy z oddawaniem moczu mogą się pojawić, jeśli guz znajduje się w pobliżu cewki moczowej lub szyi pęcherza moczowego.
Objawy przerzutów
- U niektórych pacjentów przerzuty dają objawy, takie jak np.:
- powiększenie wątroby
- powiększenie nadobojczykowych węzłów chłonnych
- obrzęk limfatyczny kończyn dolnych.
Inne badania
- Badanie moczu na obecność krwiomoczu.
- Badanie ultrasonograficzne w celu wykluczenia zatrzymania moczu lub kamicy moczowej jako przyczyny krwiomoczu
- Badania laboratoryjne mogą wskazywać na zajęcie narządów przez przerzuty:
- Hb, OB, leukocyty, kreatynina, fosfataza alkaliczna, GGTP, AST, ALT.
Podstawowa diagnostyka
- U pacjentów z klinicznym podejrzeniem raka pęcherza moczowego należy przede wszystkim wykonać badanie ultrasonograficzne w celu wykluczenia zatrzymania moczu.
- U pacjentów z podejrzeniem raka pęcherza moczowego, w ramach podstawowej diagnostyki należy standardowo wykonać cystoskopię w świetle białym (w Polsce badanie niedostępne w POZ).
- W porównaniu ze sztywną cystoskopią, elastyczna cystoskopia przyczynia się do zmniejszenia zachorowalności i poprawy komfortu pacjenta przy tej samej skuteczności.
- W podstawowej diagnostyce raka pęcherza moczowego można stosować cystoskopię fluorescencyjną.
- Jeśli zachodzi podejrzenie raka pęcherza moczowego na podstawie cystoskopii, należy potwierdzić to badaniem histologicznym.
- Po wykluczeniu guza pęcherza moczowego za pomocą cystoskopii jako przyczyny mikro- lub makrohematurii lub dodatniej cytologii, należy przeprowadzić diagnostykę górnych dróg moczowych.
Dalsza diagnostyka specjalistyczna
Cystoskopia
- Rozpoznanie potwierdza cystoskopia z biopsją.
- Wizualizację zmian nowotworowych w cystoskopii można poprawić za pomocą specjalnych źródeł światła:
- światło białe:
- wieloletni standard
- jasne, białe źródło światła
- światło fluorescencyjne:
- przed cystoskopią podanie przez cewnik do pęcherza moczowego roztworu aminolewulinianu heksylu
- akumulacja w tkance nowotworowej i prekursorach, ale także w tkance objętej stanem zapalnym (UWAGA: wyniki fałszywie dodatnie!)
- W niebieskim świetle podejrzane obszary świecą na różowo.
- światło białe:
Resekcja przezcewkowa (transurethral resection -TUR)
- Resekcja przezcewkowa guza aż do powięzi mięśniowej ma dwa cele:
- diagnostyczny
- lokalizacja, ocena wielkości i biopsja w celu określenia stopnia zaawansowania choroby
- Stanowi podstawę wyboru dalszego leczenia.
- terapeutyczny
- całkowite usunięcie guzów nienaciekających błonę mięśniową
- paliatywna resekcja guzów naciekających błonę mięśniową
- diagnostyczny
- W zależności od wyników badania cystoskopowego i histopatologicznego guza, wykonuje się diagnostykę obrazową w celu określenia stopnia zaawansowania.
Diagnostyka obrazowa15-16
- Rak pęcherza moczowego nienaciekający błonę mięśniową
- We wstępnej diagnostyce raka pęcherza moczowego nienaciekającego błonę mięśniową, nie należy rutynowo wykonywać badań obrazowych górnych dróg moczowych innych niż USG.
- Należy je wykonać wtedy, gdy guz zlokalizowany jest w trójkącie pęcherza i/lub w przypadku guzów mnogich i/lub guzów o wysokim stopniu złośliwości.
- W przypadku obecności raka pęcherza moczowego nienaciekającego błonę mięśniową (pierwotne znalezisko lub nawrót), jeśli wskazane jest obrazowanie górnych dróg moczowych, należy wykonać urografię TK.
- Jako alternatywę dla urografii TK, można wykonać badanie RM z kilkoma czasami badania przed i po podaniu środka kontrastowego lub urografię wydzielniczą.
- Nie należy przeprowadzać diagnostyki medycyny nuklearnej (PET lub PET/TK) w celu wykrycia wtórnych guzów górnych dróg moczowych przy wstępnym rozpoznaniu raka pęcherza moczowego nienaciekającego błonę mięśniową.
- We wstępnej diagnostyce raka pęcherza moczowego nienaciekającego błonę mięśniową, nie należy rutynowo wykonywać badań obrazowych górnych dróg moczowych innych niż USG.
- Rak pęcherza moczowego naciekający błonę mięśniową
- U pacjentów z rakiem pęcherza moczowego naciekającym błonę mięśniową, należy wykonać tomografię komputerową (TK) jamy brzusznej (z urografią TK), miednicy i klatki piersiowej z podaniem środka kontrastowego. Zamiast tomografii komputerowej miednicy, można wykonać rezonans magnetyczny miednicy.
- Tomografię komputerową czaszki lub scyntygrafię kości należy wykonać wyłącznie w przypadku wystąpienia objawów klinicznych i/lub nieprawidłowych wyników badań diagnostycznych.
- Urografia TK (TK z kontrastem i bez kontrastu)
- Rak urotelialny pęcherza moczowego jest chorobą wieloogniskową. Guzy urotelialne mogą występować jednocześnie w górnych drogach moczowych. W urografii TK są one widoczne jako wady wypełnienia.
- Umożliwia wykrycie poszerzenia moczowodu/wodonercza świadczącego o naciekającym guzie, który objął śródścienną część moczowodu.
- Rezonans magnetyczny (RM)
- Umożliwia ocenę stanu węzłów chłonnych w miednicy i przestrzeni zaotrzewnowej, a także możliwych odległych przerzutów oraz ocenę miejscowego zasięgu guza.
- USG
- Może pomóc w uwidocznieniu guzów pęcherza moczowego.
- badanie jamy brzusznej z dobrze wypełnionym pęcherzem moczowym
- wewnątrzpęcherzowo z sondą ultrasonograficzną przez cystoskopię
- Może pomóc w uwidocznieniu guzów pęcherza moczowego.
Cytologia moczu
- W diagnostyce urologicznej zwykle wykonywana rutynowo podczas cystoskopii.
Wskazania do skierowania do specjalisty
- Jeśli podejrzewa się raka pęcherza moczowego, należy skierować do urologa w celu wykonania cystoskopii i, w razie potrzeby, biopsji.
Leczenie
Cele leczenia
- Wyleczenie
- Zapobieganie progresji choroby
- W razie potrzeby opieka paliatywna
Ogólne informacje o leczeniu1,4
- Leczenie raka pęcherza moczowego obejmuje resekcję przezcewkową (transurethral resection of bladder tumor - TUR-B), wlewki dopęcherzowe, cystektomię, radioterapię, chemioterapię lub ich połączenie. Od niedawna immunoterapia inhibitorami punktów kontrolnych (checkpoint inhibitor - CPI,) stała się również możliwa w stadium z przerzutami.
- TUR-B jest początkową metodą leczenia wszystkich pacjentów z rakiem pęcherza moczowego.
- Oprócz resekcji guza, wykonuje się biopsję w podejrzanych endoskopowo obszarach.
- TUR-B wspomagana fluorescencją ma wyższy wskaźnik wykrywalności guzów i raków in situ w porównaniu do zwykłej TUR-B w świetle białym.
- W związku z tym jest ona również zalecana w wytycznych jako możliwa alternatywa w diagnostyce podstawowej.
- Dalsze leczenie zależy przede wszystkim od tego, czy guz pęcherza nacieka tylko na błonę podśluzową (T1), czy też na błonę mięśniową (T2-4) i do której grupy ryzyka należy.
Stratyfikacja ryzyka
- W przypadku raka pęcherza moczowego nienaciekającego błonę mięśniową, ryzyko nawrotu i progresji jest obliczane zgodnie ze skalą ryzyka EORTC (European Organisation for Research and Treatment of Cancer). 17
- Klasyfikacja do grupy niskiego, pośredniego lub wysokiego ryzyka i odpowiedni dobór terapii
Niskie ryzyko
- Pojedynczy guz pTa G1 (oznaczenia: p - rozpoznanie hist-pat; T - tumor; G - stopień złośliwości histologicznej)
- Pojedynczy guz pTa G2 (o niskim stopniu złośliwości)
- PUNLMP (brodawkowaty nowotwór urotelialny o niskim potencjale złośliwości)
Pośrednie ryzyko
- Pojedynczy guz pTaG1 ≥3 cm
- Guzy wieloogniskowe pTaG1
- Pojedynczy guz pTaG2 (o niskim stopniu złośliwości) ≥3cm
- Guzy wieloogniskowe pTaG2 (o niskim stopniu złośliwości)
- Dowolny guz pTa G2 (o wysokim stopniu złośliwości)
- Dowolny guz pTaG2 (jeśli nie jest znana dokładniejsza ocena stopnia złośliwości histologicznej)
- Każdy rak z grupy niskiego ryzyka, który nawraca w ciągu 12 miesięcy.
Wysokie ryzyko
- Wszystkie guzy T1
- Wszystkie guzy G3 (o wysokim stopniu złośliwości)
- Dowolny rak in situ
- Liczne nawracające i duże guzy (>3 cm) Ta G1/G2 (jeśli powyższe warunki występują jednocześnie)
- Agresywne warianty histologiczne raka urotelialnego z komponentami limfoepitelialnymi, plazmacytoidalnymi, płaskonabłonkowymi, mikropapilarnymi i/lub drobnokomórkowymi, a także warianty „zagnieżdżone"
Leczenie raka pęcherza moczowego nienaciekającego błonę mięśniową
Przezcewkowa resekcja guza pęcherza moczowego (transurethral resection of bladder tumour - TUR-B)
- Jeśli jest to technicznie możliwe, resekcję małych guzów pęcherza moczowego należy wykonywać w całości.
- Jeśli nie jest planowana cystektomia, u pacjentów z rakiem urotelialnym pęcherza moczowego nienaciekającym błonę mięśniową, powtórną resekcję należy wykonać w następujących sytuacjach:
- W przypadku guzów, w których pierwotna TUR była niecałkowita.
- Jeśli w próbce histopatologicznej z pierwotnej TUR nie wykryto obecności błony mięśniowej, z wyjątkiem pTa o niskim stopniu złośliwości.
- w przypadku guzów pT1
- we wszystkich guzach o wysokim stopniu złośliwości, z wyjątkiem pacjentów z pierwotnym rakiem in situ (pTis)
- Powtórną resekcję należy wykonać w ciągu 6 tygodni od pierwszej resekcji.
Wlewki dopęcherzowe
- U pacjentów z guzem pęcherza moczowego klinicznie nienaciekającym błonę mięśniową, można zastosować wczesne (natychmiastowe, pooperacyjne) dopęcherzowe wlewki chemioterapeutyku, pod warunkiem, że nie występuje znaczące krwawienie lub perforacja pęcherza moczowego.
- jednorazowo w przypadku TUR-B z użyciem mitomycyny C, alternatywnie także z zastosowaniem doksorubicyny
- Pacjenci z rakiem urotelialnym pęcherza moczowego o charakterze pierwotnym, jednoogniskowym lub niskiego ryzyka, odnoszą największe korzyści z wczesnego zastosowania wlewek dopęcherzowych.
- Pacjenci z rakiem urotelialnym pęcherza moczowego w stadium niskiego ryzyka, nie powinni być poddawani dodatkowym adjuwantowym dopęcherzowym wlewkom chemioterapeutyku po TUR i wczesnych wlewkach dopęcherzowych.
- Pacjenci ze wstępnie zdiagnozowanym rakiem urotelialnym pęcherza moczowego w stadium pośredniego ryzyka, powinni otrzymać, po szczegółowej konsultacji, dopęcherzowe wlewki chemioterapeutyku (mitomycyny C) lub dopęcherzowe wlewki BCG (Bacille-Calmette-Gueri).
- Jeśli u pacjentów z rakiem urotelialnym pęcherza moczowego w stadium wysokiego ryzyka nie jest wskazana wczesna cystektomia, należy zastosować dopęcherzowe wlewki BCG. W przypadku całkowitej remisji po fazie indukcji, należy zastosować dodatkową terapię podtrzymującą przez co najmniej 1 rok do maksymalnie 3 lat.
- Odpowiedź na leczenie indukcyjne i podtrzymujące BCG u pacjentów z rakiem urotelialnym pęcherza moczowego wysokiego ryzyka, można monitorować poprzez wykonywanie cystoskopii kontrolnych i cytologii moczu.
Cystektomia
- Cystektomia jest metodą leczenia raka pęcherza moczowego obarczoną wysokim ryzykiem.
- W przypadku wczesnego nawrotu lub utrzymywania się guza z czynnikami wysokiego ryzyka raka pęcherza moczowego nienaciekającego błonę mięśniową po leczeniu indukcyjnym BCG, należy wykonać cystektomię.
Szczególny przypadek izolowanego raka in situ
- W przypadku raka in situ, terapia BCG powinna być prowadzona zgodnie ze schematem indukcji i podtrzymywania.
- Alternatywą dla terapii BCG może być radykalna cystektomia po uzyskaniu wyczerpujących informacji na temat jej zalet i wad.
- Terapia BCG powinna być prowadzona zgodnie z następującym schematem:
- cykl indukcyjny: 6 dopęcherzowych wlewek BCG w odstępach tygodniowych
- terapia podtrzymująca: 3 dopęcherzowe wlewki BCG w odstępach tygodniowych, w 3., 6. i 12. miesiącu po rozpoczęciu cyklu indukcyjnego
- w przypadku guzów wysokiego ryzyka, kolejne 3 dopęcherzowe wlewki BCG w odstępach tygodniowych w 18., 24., 30. i 36. miesiącu po rozpoczęciu cyklu indukcyjnego i po rozważeniu korzyści i ryzyka lub działań niepożądanych
- Podczas pełnego cyklu leczenia, przez 3 lata podaje się 27 dawek.18
- Terapia BCG (terapia indukcyjna i podtrzymująca) znacząco zmniejsza wskaźnik nawrotów w nowotworach średniego i wysokiego ryzyka w porównaniu do dopęcherzowych wlewek chemioterapeutyku. Wpływ na wskaźnik progresji nie został potwierdzony.
- Terapia BCG powinna być stosowana w pełnej dawce i bez jednoczesnego profilaktycznego podawania antybiotyków.
- Obecnie nie ma dowodów na różnice między dostępnymi szczepami BCG pod względem skuteczności i częstości występowania działań niepożądanych.
Leczenie miejscowego raka pęcherza moczowego naciekającego błonę mięśniową
- Po rozpoznaniu raka pęcherza moczowego naciekającego błonę mięśniową, koncepcję leczenia należy omówić interdyscyplinarnie z udziałem urologa, onkologa, radioterapeuty i innych specjalistów.
Cystektomia radykalna
- Standardowym sposobem leczenia miejscowego raka pęcherza moczowego naciekającego błonę mięśniową, jest cystektomia radykalna w połączeniu z obustronną limfadenektomią w obrębie miednicy.
- Podczas radykalnej cystektomii zwykle usuwany jest cały pęcherz moczowy i sąsiednie narządy – prostata i pęcherzyki nasienne u mężczyzn oraz macica, przydatki i części przedniej ściany pochwy u kobiet.
- Pacjenci z rakiem pęcherza moczowego naciekającym błonę mięśniową, którzy nie otrzymali leczenia neoadjuwantowego (przedoperacyjnego), powinni zostać poddani radykalnej cystektomii w ciągu 3 miesięcy od rozpoznania, jeśli jest to możliwe.
- Nie zaleca się wykonywania częściowej cystektomii jako standardowego leczenia, ponieważ nie udowodniono jej równorzednej skuteczności.
Chemioterapia
- Pacjenci z rakiem pęcherza moczowego naciekającym błonę mięśniową (≥T2) powinni zostać poinformowani o możliwościach zastosowania chemioterapii neoadjuwantowej lub adjuwantowej, z uwzględnieniem ich indywidualnej sytuacji.
- Chemioterapia neoadjuwantowa powinna obejmować 3–4 cykle chemioterapii skojarzonej zawierającej cisplatynę.
- Adjuwantowa chemioterapia skojarzona (3–4 cykle) po cystektomii powinna być oparta na cisplatynie.
Radioterapia
- Nie ma wskazań do adjuwantowej radioterapii/radiochemioterapii po radykalnej cystektomii z resekcją R0 (mikroskopowo wolne marginesy resekcji, tj. całkowite usunięcie tkanki nowotworowej).
Terapia multimodalna oszczędzająca narządy
- Multimodalna terapia oszczędzająca narządy (TUR-B, a następnie radiochemioterapia, cystektomia ratunkowa w przypadku inwazyjnego guza resztkowego lub nawrotowego) jest alternatywą dla radykalnej cystektomii z celem leczniczym u pacjentów z rakiem urotelialnym naciekającym błonę mięśniową.
- cystektomia ratunkowa: lecznicza cystektomia u pacjentów z resztkową tkanką nowotworową w pęcherzu moczowym po wcześniejszej próbie leczenia za pomocą TUR-B i radiochemioterapii
- Pacjentom z miejscowym rakiem urotelialnym naciekającym błonę mięśniową (cT2–4 cN0/Nx M0), którzy nie kwalifikują się do radykalnej cystektomii lub którzy szukają alternatywy dla radykalnej operacji, należy zaoferować multimodalne leczenie oszczędzające narządy. Szczególnie odpowiednimi pacjentami są ci z wczesnymi guzami (cT2N0) bez wodonercza lub towarzyszącego raka in situ, u których początkowa resekcja przezcewkowa prowadzi do możliwie najpełniejszego usunięcia guza.
- Radiosensybilizację, jako część jednoczesnej radiochemioterapii (RCT), należy prowadzić z chemioterapią opartą na cisplatynie lub w połączeniu z 5-fluorouracylem i mitomycyną C.
Odprowadzenie moczu po cystektomii
- Po radykalnej cystektomii stosowane są następujące metody:
- odprowadzenie moczu przy nietrzymaniu moczu
- przetoka moczowodowo-skórna
- wstawka z jelita krętego lub okrężnicy
- odprowadzenie moczu z zachowaniem trzymania moczu
- woreczki z możliwością cewnikowania
- ortotopowe zastąpienie pęcherza moczowego (pęcherz zastępczy)
- przezodbytnicze odprowadzenie moczu (formy ureterosigmoideostomii)
- odprowadzenie moczu przy nietrzymaniu moczu
- Nie ma wiarygodnych danych z randomizowanych badań kontrolowanych porównujących różne techniki tworzenia odprowadzenia moczu po radykalnej cystektomii.
- Pacjenci powinni zostać szczegółowo poinformowani o wszystkich formach odprowadzenia moczu oraz ich zaletach i wadach.
Chemioterapia
- W przypadku miejscowego raka pęcherza moczowego naciekającego błonę mięśniową, rokowanie poprawia dodatkowa chemioterapia neoadjuwantowa lub adjuwantowa. Opcje leczenia należy omówić ze wszystkimi pacjentami w stadium zaawansowania nowotworu ≥cT2.
- Argumentami przemawiającymi za leczeniem neoadjuwantowym są wyniki badań przeprowadzonych na dużych grupach pacjentów oraz lepszy stan ogólny chorych przed cystektomią.
- Argumenty przemawiające za chemioterapią adjuwantową obejmują bardziej precyzyjne określenie stopnia zaawansowania w badaniu histopatologicznym materiału po cystektomii.
- Okołooperacyjna chemioterapia prowadzi do poprawy całkowitego wskaźnika przeżycia o 5–10% w wartościach bezwzględnych po 10 latach.19
Leczenie raka pęcherza moczowego z przerzutami
- Pacjentom z rakiem urotelialnym pęcherza moczowego z przerzutami, należy zaproponować chemioterapię zawierającą cisplatynę, jeśli pozwala na to ich stan ogólny i choroby współistniejące. Jednak znaczna część pacjentów, którzy są na ogół starsi, nie kwalifikuje się do leczenia cisplatyną.
- Pacjenci z co najmniej jednym z poniżej wymienionych parametrów, nie powinni być leczeni chemioterapią opartą na cisplatynie:
- stan sprawności wg WHO lub ECOG (PS) ≥2 lub Karnofsky PS ≤70%
- klirens kreatyniny (obliczony lub zmierzony) ≤60 ml/min
- Wybrani pacjenci z EGOC (0–1), umiarkowanie upośledzoną czynnością nerek (GFR 40–60 ml/min) i bez innych chorób współistniejących, mogą być leczeni cisplatyną w dawkach podzielonych.
- utrata słuchu w audiometrii (≥ stopień 2 wg CTCAE wersja 4)
- neuropatia obwodowa (≥stopień 2 wg CTCAE wersja 4)
- niewydolność serca klasy NYHA >III
- Pacjenci, którzy nie kwalifikują się do chemioterapii opartej na cisplatynie i mają dobry stan sprawności EGOC (0–1), powinni być leczeni gemcytabiną/karboplatyną.
- Pacjenci, którzy nie kwalifikują się do chemioterapii opartej na cisplatynie, mogą być leczeni inhibitorami punktów kontrolnych - atezolizumabem lub pembrolizumabem, jeśli mają dodatni status PD-L1 (białko powierzchniowe, które hamuje odpowiedź immunologiczną i może być w coraz większym stopniu wydzielane przez komórki nowotworowe; więcej informacji można znaleźć w artykule Terapie onkologiczne, leki).
- Pacjenci otrzymujący immunoterapię inhibitorami punktów kontrolnych, powinni uzyskać szczegółowe informacje na temat możliwych działań niepożądanych przed rozpoczęciem leczenia. W szczególności należy podkreślić, że działania niepożądane mogą wystąpić nawet kilka miesięcy po zakończeniu leczenia.
Leczenie drugiego rzutu
- W przypadku progresji po pierwotnej chemioterapii lub chemioterapii okołooperacyjnej bądź immunoterapii przerzutowego raka urotelialnego, wszystkich pacjentów należy ocenić pod kątem możliwości poddania się leczeniu drugiego rzutu. W szczególności należy wskazać możliwość udziału w badaniach klinicznych.
- Pacjenci z przerzutowym rakiem urotelialnym, u których wystąpiła progresja w trakcie lub po terapii zawierającej platynę, powinni otrzymać leczenie drugiego rzutu inhibitorem immunologicznego punktu kontrolnego pembrolizumabem.
- Pacjenci z przerzutowym rakiem urotelialnym, u których wystąpiła progresja w trakcie lub po terapii zawierającej platynę i którzy mają przeciwwskazania do stosowania inhibitorów immunologicznego punktu kontrolnego, powinni otrzymać leczenie drugiego rzutu winfluniną.
- Pacjenci z przerzutowym rakiem urotelialnym, którzy wykazali co najmniej 6-miesięczny okres wolny od leczenia po terapii podstawowej zawierającej platynę i dobrą tolerancję, ale którzy mają przeciwwskazania do stosowania inhibitorów immunologicznego punktu kontrolnego, mogą alternatywnie otrzymać ponowną terapię skojarzoną zawierającą platynę.
- Pacjenci z przerzutowym rakiem urotelialnym, u których wystąpiła progresja w trakcie lub po leczeniu pierwszego rzutu inhibitorami punktu kontrolnego atezolizumabem lub pembrolizumabem, mogą otrzymać leczenie skojarzone lub monochemioterapię jako leczenie drugiego rzutu.
Resekcja przerzutów po chemioterapii
- Jako opcję leczenia, można wykonać radykalną resekcję przerzutów u odpowiednich pacjentów z pierwotnym rakiem urotelialnym pęcherza moczowego, po konsultacji multidyscyplinarnej. Z reguły są to pacjenci z dobrym stanem sprawności (PS 0-1), którzy dobrze zareagowali na chemioterapię i mają jedynie przerzuty do węzłów chłonnych lub oligometastazę w innych miejscach.
- Resekcja przerzutów u pacjentów, którzy nie odpowiedzieli na chemioterapię, nie ma uzasadnienia z terapeutycznego punktu widzenia. U pacjentów z objawowymi przerzutami można rozważyć resekcję przerzutów z zamiarem paliatywnym.
Leczenie przerzutów do kości
- Pacjentom z objawowymi przerzutami do kości, należy zaoferować jedną lub więcej z poniższych opcji leczenia:
- farmakologiczne leczenie bólu
- radioterapia
- interwencja chirurgiczna (zwykle w połączeniu z radioterapią)
- bisfosfonian lub denosumab
- Aby zapobiec martwicy kości żuchwy, przed podaniem bisfosfonianów lub denosumabu należy przeprowadzić badanie stomatologiczne i ewentualne konieczne leczenie, przy jednoczesnym pouczeniu i zmotywowaniu pacjenta do zachowania szczególnie starannej higieny jamy ustnej.
Cystektomia paliatywna
- Jeśli objawy (krwawienie, zatrzymanie moczu, ból) nie są kontrolowane mniej inwazyjnymi metodami, można również wykonać cystektomię ze wskazań paliatywnych (cystektomia paliatywna) u pacjentów w stadium miejscowo zaawansowanym (pT4b) i/lub przerzutowym (M1).
Stan sprawności
- Do oceny stanu fizycznego pacjentów z chorobą nowotworową stosuje się zwykle 2 następujące skale:
- skala WHO-ECOG (Eastern Cooperative Oncology Group)
- skala Karnofsky’ego
- Poniżej podano skalę ECOG, a w nawiasach odpowiadającą jej skalę Karnofsky'ego.
- Stopień 0: sprawność prawidłowa, zdolność do samodzielnego wykonywania codziennych czynności (90–100%)
- Stopień 1: obecność objawów choroby, możliwość chodzenia i samodzielnego dbania o siebie, ograniczenia dotyczące forsownych aktywności fizycznych, możliwe lekkie prace domowe lub biurowe (70–80%)
- Stopień 2: zdolność wykonywania czynności osobistych, dbania o siebie, niezdolność do pracy, konieczność spędzania w łóżku mniej niż połowy czasu w ciągu dnia (50–60%)
- Stopień 3: ograniczona zdolność wykonywania czynności osobistych, konieczność spędzania w łóżku >50% czasu, pacjent wymagający opieki (30–40%)
- Stopień 4: konieczność spędzania w łóżku całego dnia, konieczność stałej opieki z powodu choroby, wymagane leczenie szpitalne (10–20%)
- Stopień 5: Zgon (0%)
Klasyfikacja działań niepożądanych (CTCAE)
- Klasyfikacja CTCAE (Common Terminology Criteria for Adverse Events) służy do klasyfikowania skutków ubocznych leczenia onkologicznego.
- Istnieje 6 stopni nasilenia działań niepożądanych (np. nudności, małopłytkowość, neuropatia) w zakresie od 0 (brak działań niepożądanych) do 5 (zgon pacjenta).
- Anglojęzyczną bazę danych umożliwiającą wyszukiwanie kryteriów i stopni ciężkości można znaleźć tutaj.
Leczenie paliatywne
- Ból..
- Nudności i wymioty.
- Zaparcia.
- Niedrożność przewodu pokarmowego o charakterze złośliwym.
- Suchość w jamie ustnej.
- Niedożywienie i odwodnienie.
- Dolegliwości ze strony układu oddechowego.
- Depresja.
- Lęk.
- Majaczenie.
Przebieg, powikłania i rokowanie
Przebieg
- Często bezobjawowy przebieg do momentu wystąpienia mikro-/makrohematurii.
- 75% wszystkich raków pęcherza moczowego to raki pęcherza moczowego nienaciekające błonę mięśniową, ograniczone do błony śluzowej lub podśluzowej w momencie rozpoznania i charakteryzujące się niskim wskaźnikiem śmiertelności.
- Pozostałe 25% to guzy początkowo naciekające błonę mięśniową, charakteryzujące się znacznie gorszym rokowaniem.
- Istnieje zwiększone ryzyko progresji i nawrotu, szczególnie w przypadku słabo zróżnicowanych guzów Ta i Tis.
Powikłania
- Hematuria.
- Tamponada pęcherza moczowego, zatrzymanie moczu z powodu wypełnienie skrzepami.
- Dyzuria (kobiety, mężczyźni).
- Nietrzymanie moczu (kobiety, mężczyźni).
- Bóle w obrębie miednicy.
- Powikłania okołooperacyjne związane z cystektomią.
- Skutki uboczne chemioterapii i/lub immunoterapii i/lub radioterapii.
Rokowanie
- Większość pacjentów ma typ guza z dużą szansą na wyleczenie, jednak nierzadko dochodzi u nich do nawrotu choroby i dlatego powinni być monitorowani w poradni specjalistycznej do końca życia.
- U pacjentów z nienaciekającym rakiem pęcherza moczowego, wskaźnik 5-letniego przeżycia wynosi >80%.20
- W przypadku raka pęcherza moczowego z przerzutami, tylko 5–10% pacjentów nadal żyje po 2 latach.20
Wskaźniki przeżywalności
- Względny wskaźnik 5-letniego przeżycia w przypadku raka pęcherza moczowego
- kobiety: około 45%
- mężczyźni: około 55%
- Wyższe względne wskaźniki 5-letniego przeżycia mężczyzn w porównaniu z kobietami, odpowiadają korzystniejszemu rozkładowi stadiów zaawansowania guza (36% w porównaniu z 24% UICC I).
- Względny wskaźnik 10-letniego przeżycia
- kobiety: około 40%
- mężczyźni: około 50%
Dalsze postępowanie
- Badania kontrolne powinni przeprowadzać specjaliści w dziedzinie urologii/onkologii.
- Celem opieki kontrolnej jest wczesne rozpoznanie nawrotu choroby, aby wydłużyć czas przeżycia/zwiększyć szansę na wyzdrowienie, rozpoznać objawy uboczne terapii i wdrożyć profilaktykę.
Opieka po zakończeniu leczenia raka pęcherza moczowego nienaciekającego błonę mięśniową
- Opieka kontrolna jest stratyfikowana zgodnie z podziałem na grupy niskiego, pośredniego i wysokiego ryzyka raka pęcherza moczowego nienaciekającego błonę mięśniową.
- W zależności od ryzyka obejmuje ona cystoskopię, cytologię moczu i badania obrazowe.
Opieka po zakończeniu leczenia raka pęcherza moczowego naciekającego błonę mięśniową
- Programy dalszej opieki pooperacyjnej nad pacjentami z rakiem pęcherza moczowego naciekającym błonę mięśniową są początkowo zależne od wyboru metody leczenia.
- Schemat opieki nad pacjentami po radykalnej cystektomii i odprowadzeniu moczu, różni się znacząco od opieki nad pacjentami po radio-/chemioterapii pęcherza moczowego.
- Ponadto program opieki pooperacyjnej dla pacjentów z rakiem pęcherza moczowego naciekającym błonę mięśniową musi obejmować kilka obszarów medycznych. Należą do nich:
- wczesne wykrywanie nawrotów guza – nawrotów miejscowych, nawrotów w cewce moczowej po cystektomii, nawrotów w górnych drogach moczowych i przerzutów odległych
- zmiany metaboliczne
- zaburzenia czynnościowe
- stan psychoonkologiczno-społeczny.
Informacje dla pacjentów
Informacje dla pacjentów w Medibas
- Rak pęcherza moczowego.
TerapieLekiprzeciwnowotworowe,stosowanelekiw terapii nowotorów.- Ból i jego leczenie.
- Jedzenie przy
utraciebraku apetytu.
Ilustracje
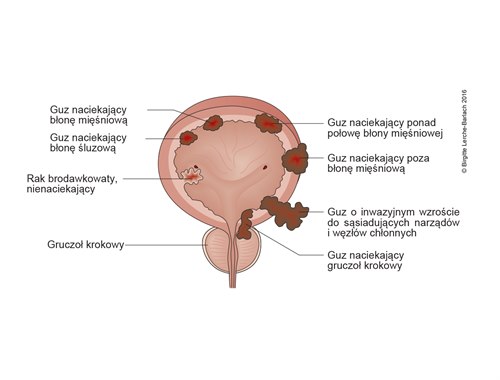
Guzy pęcherza moczowego
USG Color Doppler: guzy pęcherza moczowego (dzięki uprzejmości sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg)
Źródła
Wytyczne
- 2024 European Association of Urology Guidelines on Non–muscle-invasive Bladder Cancer. PubMed
- Bladder cancer: ESMO Practice Guidelines for diagnosis, treatment and follow-up, 2022. esmo.org
Piśmiennictwo
- European Association of Urology. Guidelines on Non–muscle-invasive Bladder Cancer, 2024. pubmed.ncbi.nlm.nih.gov
- Gakis G, Efstathiou J, Lerner SP, et al. ICUD-EAU International Consultation on Bladder Cancer 2012: radical cystectomy and bladder preservation for muscle-invasive urothelial carcinoma of the bladder. Eur Urol 2013; 63: 45-57. PubMed
- Stenzl A, Cowan NC, De Santis M, et al. Treatment of muscle-invasive and metastatic bladder cancer: update of the EAU guidelines. Eur Urol 2011; 59: 1009-18. PubMed
- Babjuk M, Oosterlinck W, Sylvester R, et al. EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder, the 2011 update. Eur Urol 2011; 59: 997-1008. PubMed
- European Society for Medical Oncology. Bladder cancer: ESMO Practice Guidelines for diagnosis, treatment and follow-up, Stand 2014. www.esmo.org
- The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part B: Prostate and Bladder Tumours. www.europeanurology.com
- Humphrey PA, Moch H, Cubilla AL, et al. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part B: Prostate and Bladder Tumours . Eur Urol 2016; 70(1): 106-119. pubmed.ncbi.nlm.nih.gov
- Wojciechowska U, Barańska K, Miklewska M, Didkowska JA. Cancer incidence and mortality in Poland in 2020. Nowotwory. Journal of Oncology 2023;73(3):129-145. journals.viamedica.pl
- García-Closas M, Malats N, Silverman D, et al. NAT2 slow acetylation, GSTM1 null genotype, and risk of bladder cancer: results from the Spanish Bladder Cancer Study and meta-analyses. Lancet 2005; 366: 649-59. PubMed
- Engel LS, Taioli E, Pfeiffer R, et al. Pooled analysis and meta-analysis of glutathione S-transferase M1 and bladder cancer: a HuGE review. Am J Epidemiol 2002; 156: 95-109. pubmed.ncbi.nlm.nih.gov
- Janković S, Radosavljević V. Risk factors for bladder cancer. Tumori 2007; 93: 4-12. PubMed
- Grossman HB, Messing E, Soloway M, et al. Detection of bladder cancer using a point-of-care proteomic assay. JAMA 2005; 293(7): 810-6. pubmed.ncbi.nlm.nih.gov
- Chou R, Dana T. Screening adults for bladder cancer: a review of the evidence for the U.S. preventive services task force. Ann Intern Med 2010; 153: 461-8. pubmed.ncbi.nlm.nih.gov
- Pashos CL, Botteman MF, Laskin BL, Redaelli A. Bladder cancer: epidemiology, diagnosis, and management. Cancer Pract 2002; 10: 311-22. PubMed
- Turney BW, Willatt JM, Nixon D, et al. Computed tomography urography for diagnosing bladder cancer. BJU Int 2006; 98: 345-8. PubMed
- Kundra V, Silverman PM. Imaging in oncology from the University of Texas M. D. Anderson Cancer Center. Imaging in the diagnosis, staging, and follow-up of cancer of the urinary bladder. AJR Am J Roentgenol 2003; 180: 1045-54. PubMed
- Sylvester RJ, van der Meijden AP, Oosterlinck W et al. Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol 2006; 49: 466-75. pubmed.ncbi.nlm.nih.gov
- www.Indeks24.pl; Bonnier Healthcare Polska Sp. z o.o. indeks24.pl
- Advanced Bladder Cancer Metaanalysis Collaboration: Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data advanced bladder cancer (ABC) meta-analysis collaboration. Eur Urology 48:202-205, 2005. pubmed.ncbi.nlm.nih.gov
- Steinberg GD. Bladder Cancer. Medscape, last updated May 06, 2020. emedicine.medscape.com
Autorzy
- Katarzyna Kosiek, Dr n. med., specjalista medycyny rodzinnej, Poradnia Lekarzy Rodzinnych w Łodzi (recenzent)
- Tomasz Tomasik, Dr hab. n. med., Prof. UJ, specjalista medycyny rodzinnej, Uniwersytet Jagielloński Collegium Medicum w Krakowie (redaktor)
- Lino Witte, Dr med., Arzt in Weiterbildung, Innere Medizin, Frankfurt
- Klaus Gebhardt, Facharzt für Allgemeinmedizin, Bremen (Review)